tinjauan pustaka
advertisement

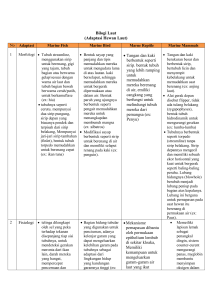
TINJAUAN PUSTAKA Kryptopterus spp. dan Ompok spp. Kryptopterus spp. dan Ompok spp. merupakan kelompok ikan air tawar yang termasuk dalam ordo Siluriformes, famili Siluridae. Famili Siluridae dikenal sebagai ikan bersungut (catfish) yang mengalami penciutan sirip punggung. Famili Siluridae memiliki satu atau dua pasang sungut pada rahang bawah dan rahang atas, dan sungut pada rahang atas biasanya lebih panjang (Nelson 2006). Famili Siluridae dibedakan dari famili lain dalam ordo Siluriformes berdasarkan ciri kepala dan badannya yang lebih pipih (Diogo 2005). Famili ini memiliki sirip anal sangat panjang terdiri dari 41-110 jari-jari lunak, dengan sirip perut kecil atau tidak ada, dan tidak memiliki sirip lemak (Nelson 2006). Sirip punggung tidak dilengkapi dengan jari-jari keras, dan jumlah jari-jari sirip kurang dari tujuh. Jarijari keras pada sirip dada biasanya tidak kuat. Beberapa genera dalam famili Siluridae tidak memiliki sirip punggung (Diogo 2005). Paling kurang ada 11 genera dan 97 spesies dalam famili Siluridae. Genera yang termasuk famili Siluridae antara lain Belodontichthys, Ceratoglanis, Hemisilurus, Hito, Kryptopterus, Micronema, Ompok, Pterocryptis, Silurichthys, Silurus (Parasilurus), dan Wallago (Nelson 2006). Genus Kryptoterus dan Ompok memiliki warna dan bentuk tubuh yang mirip. Kedua genus ini secara umum disebut ikan lais (Elvyra 2009) dan hanya dibedakan dari penampakan sirip punggung (Kottelat et al. 2003). Kelompok ikan ini tersebar di perairan tawar Indochina, Thailand, Borneo dan Sumatera. Penciri jenis (spesies) dalam genus Kryptopterus dan Ompok dapat didasarkan pada berbagai karakter. Weber dan de Beaufort (1965) mengutamakan jumlah jari-jari sirip sebagai kunci identifikasi jenis Kryptopterus. Kottelat et al. (1993), menggunakan jumlah dan panjang sungut, dan jumlah jari-jari sirip anal untuk kunci identifikasi Kryptopterus dan Ompok. Ng (2004) menggunakan indeks perbandingan morfometrik untuk karakterisasi jenis Kryptopterus. Beberapa indeks morfometrik yang digunakan tersebut antara lain: perbandingan panjang, tinggi dan lebar kepala terhadap panjang baku, perbandingan panjang 6 sirip terhadap panjang baku, perbandingan panjang hidung terhadap panjang kepala dan perbandingan diameter mata terhadap panjang kepala. Paling kurang 14 spesies Kryptopterus dan 7 spesies Ompok telah dideterminasi. Pembeda utama antar spesies dalam kedua genus ini didasarkan pada jumlah dan jarak terjauh sungut, dan jumlah sirip anal. Akan tetapi ada beberapa kelompok spesies yang memiliki sungut dan jumlah sirip anal yang mirip, sehingga diperlukan karakter lain untuk pembeda antar spesies. Karakter lain yang digunakan sebagai penciri spesies antara lain: pola warna badan, bentuk cuping sirip ekor, bentuk gigi vomer, dan beberapa indeks morfometrik. Indeks morfometrik yang digunakan adalah perbandingan kepala terhadap panjang baku, perbandingan diameter mata terhadap panjang kepala dan perbandingan panjang sirip dada terhadap panjang kepala (Kottelat et al. 1993). Meristik dan Morfometrik Karakter struktur morfologis telah umum digunakan dalam biologi ikan untuk mengukur tingkat perbedaan dan hubungan antar takson pada berbagai tingkatan (Turan 1999). Karakter struktur morfologis dapat dibagi atas karakter meristik dan morfometrik. Karakter meristik adalah struktur yang dapat dihitung seperti jumlah sisik, jumlah insang, pori-pori pada kepala dan sebagainya. Karakter morfometrik adalah karakter yang dapat diukur seperti panjang sirip, panjang kepala, diameter mata, atau perbandingan antar beberapa karakter yang dapat diukur (Helfman et al. 1997). Pengukuran karakter morfometrik dapat digunakan untuk memperkirakan persediaan (ukuran populasi) ikan pada suatu lokasi (Misra & Easton 1999). Selain itu karakter morfometrik dapat digunakan untuk interpretasi habitat dan tingkah laku makan suatu spesies (Calvanti et al. 1999). Ketepatan analisis morfometrik dengan perkiraan ukuran populasi ikan dipengaruhi oleh jumlah karakter morfometrik yang dianalisis (Misra & Easton 1999). Penggunaan karakter-karakter tradisisonal banyak dikritik karena memiliki banyak bias dan kelemahan. Sebagai alternatif, perlu suatu sistem pengukuran morfometrik baru (truss system) sehingga analisis ukuran populasi ikan lebih tepat (Turan 1999). 7 Karakter meristik dan morfometrik dapat dianalisis dengan metode analisis komponen utama (PCA). PCA merupakan teknik analisis multivarian yang mampu mebedakan kelompok sama atau berbeda berdasarkan dua atau lebih karakter yang terukur (Quicke 1997). Konsep dasar PCA adalah analisis kelompok, karakter yang sama akan dikelompokkan pada satu kelompok dan karakter yang berbeda dipisahkan menjadi kelompok yang berbeda. Hasil dari PCA adalah pengelompokan fenetik atau yang sering disebut dengan fenogram (Ubaidillah & Sutrisno 2009). Reproduksi dan Status Populasi Usia matang gonad pada ikan lais berbeda antara jantan dan betina. Menurut Simanjuntak (2007), ikan lais betina mulai matang gonad saat panjang tubuh mencapai 115 mm, sedangkan lais jantan mulai matang gonad saat panjang tubuh mencapai 214 mm. Penelitian terbaru Elvyra (2010), menyatakan bahwa ikan lais betina baru mulai matang gonad saat mencapai ukuran 229 mm dengan berat 53.66 gram, sedangkan lais jantan mulai matang gonad saat berukuran panjang 226 mm dengan berat 48.04 gram. Ciri morfologis betina matang gonad ditandai dengan ovari dan telur berwarna kuning, mengisi hingga 2/3 rongga perut. Telur tersusun rapat dan butir telur mudah dipisahkan. Sedangkan jantan matang gonad ditandai dengan testis mengisi hingga ¼ rongga perut, gerigi testis lebar dan tebal, dan struktur testis menjadi lebih pejal (Elvyra 2009). Pemijahan ikan lais hanya berlangsung satu musim dalam setahun (total spawner). Pemijahan mulai berlangsung pada awal musim penghujan dan mencapai puncaknya pada bulan Oktober (Simanjuntak 2007; Elvyra 2010). Namun hasil penelitian Simanjuntak (2007), dan Elvyra (2010) pada sungai yang sama menunjukkan sedikit perbedaan pada lama waktu pemijahan. Simanjuntak (2007), menyatakan bahwa pemijahan ikan lais berlangsung dari bulan Juni hingga Desember. Sedangkan Elvyra (2010), menyatakan waktu pemijahan ikan lais berlangsung lebih pendek yaitu hanya terjadi pada bulan September hingga November. Pemijahan ikan lais dominan dilakukan di daerah rawa banjiran, sehingga ekosistem rawa banjiran memegang peranan penting dalam siklus reproduksi ikan 8 lais. Pemijahan ikan lais berlangsung sebelum terjadinya banjir maksimum. Hal ini merupakan strategi adaptasi ikan lais untuk mendapatkan keuntungan dari sumberdaya makanan alami yang tersedia bagi juwana ikan. Beberapa bulan kemudian ketika musim banjir besar tiba, anak-anak ikan lais sudah dapat mengkonsumsi anak-anak spesies ikan yang lain yang baru menetas (Simanjuntak 2007). Nilai fekunditas rata-rata pada ikan lais adalah sebesar 6635 dengan diameter telur 0.77 mm. Nilai fekunditas adalah banyaknya jumlah telur yang ada dalam ovari sesaat sebelum ikan melakukan pemijahan. Tidak ada perbedaan yang signifikan pada diameter telur di ovari bagian anterior, tengah dan posterior. Hal ini memperkuat bukti bahwa ikan lais memiliki pola pemijahan serentak (total spawner). Fekunditas ikan lais hanya tergantung pada indeks kematangan gonad, dan tidak terpengaruh dengan bertambahnya ukuran panjang. Ikan lais yang telah mengalami pematangan gonad tidak akan memiliki fekunditas yang lebih tinggi walaupun memiliki ukuran tubuh yang lebih panjang (Elvyra 2010). Belum ada usaha konservasi yang signifikan untuk melindungi ikan lais. Data IUCN (2010), menunjukkan hanya empat jenis ikan lais yang termasuk dalam daftar IUCN. Diantara keempat jenis tersebut hanya Ompok fumidus yang dikategorikan sebagai ikan lais terancam punah (vulnerable) dengan perkembangan populasi yang terus menurun. Sedangkan tiga jenis lainnya (O. leiachantus, K. lumholtzi dan K. micronema) dikategorikan sebagai tidak cukup data (data deficient). Elvyra (2009), menyarankan penangkapan ikan lais hanya dilakukan pada ikan yang telah melewati tahapan matang gonad, yaitu 229 mm pada betina dan 226 mm pada jantan. Berdasarkan waktu pemijahan, sebaiknya penangkapan hanya dilakukan setelah ikan melakukan pemijahan yaitu pada akhir bulan November dan harus dihindari penangkapan sebelum ikan melakukan pemijahan. DNA Mitokondria DNA mitokondria (mtDNA) merupakan DNA utas ganda yang pada umumnya berbentuk sirkuler. DNA mitokondria terdiri atas DNA utas berat (heavy strand) dan DNA utas ringan (light strand). Utas berat terdiri atas 2 gen 9 penyandi rRNA (16 S dan 12 S), 12 gen penyandi protein (NADH dehydrogenase (ND)1, ND2, ND3, ND4, ND5, ND 4L, COI, COII, COIII, Cythochrome-b, ATPase 6 dan ATPase 8), 14 gen penyandi tRNA dan daerah bukan penyandi (dloop). Utas ringan terdiri dari 1 gen penyandi protein (ND 6) dan 8 gen penyandi tRNA (glutamic acid, proline, serine, tyrosine, cystein, asparagine, alanine dan glutaminaae). Berdasarkan fungsinya, genom mitokondria dibagi menjadi daerah penyandi (coding region) dan daerah bukan penyandi (non coding region). Daerah penyandi terdiri dari 13 gen penyandi protein, 2 gen penyandi rRNA dan 22 gen penyandi tRNA. Daerah bukan penyandi hanya ada pada daerah kontrol (control region). Daerah control region berperan dalam proses transkripsi dan replikasi genom mitokondria (Anderson et al. 1981). Rekonstruksi pohon filogenetik dan sistematika pada berbagai kelompok hewan termasuk ikan lebih sering menggunakan analisis mtDNA dibanding DNA inti. DNA mitokondria berevolusi lebih cepat dibanding DNA inti, sehingga proses evolusi antar takson lebih mudah dideteksi (Kocher et al. 1989). Menurut Solihin (1994), mtDNA memiliki keunggulan sebagai penanda dalam keragaman genetik dan studi biologi populasi pada hewan karena: (i) mt DNA terdapat dalam jumlah kopi yang tinggi, sehingga lebih mudah diisolasi dan dipurifikasi; (ii) mtDNA berukuran relatif kecil sehingga dapat dipelajari sebagai kesatuan yang utuh; (iii) bagian-bagian mtDNA berevolusi dengan kecepatan yang berbeda sehingga dapat digunakan untuk studi sistematika dan zoogeografi; (iv) mtDNA diturunkan melalui jalur induk betina tanpa rekombinasi sehingga afinitas genetik yang diatur mtDNA merupakan refleksi dari filogeni matriarcale (garis induk betina); (v) mtDNA sangat polimorf, baik untuk intrapopulasi maupun untuk interspesies. Cytochrome b Gen cytochrome b (cyt b) mtDNA merupakan salah satu gen yang paling banyak dipelajari pada ikan. Ukuran gen cytochrome b pada ikan berkisar 1140 bp (Ketmaier et al. 2004; Doadrio & Perdices 2005) hingga 1143 bp (Perez et al. 2007). Seperti halnya sebagian besar gen pengkode protein, gen cyt b mtDNA 10 merupakan transmembran protein yang penting dalam rantai respirasi seluler organisme (Kocher et al. 1989). Gen cyt b mtDNA dapat digunakan sebagai parameter klasifikasi pada berbagai tingkatan taksa, karena nilai mutasi pada gen ini berbeda berdasarkan posisi kodonnya (Irwin et al. 1991). Namun demikian, masih ada beberapa keraguan tentang kemampuan gen cyt b menghasilkan pohon filogeni yang akurat, apabila fragmen yang digunakan berukuran pendek (Kocher et al. 1989). Pada ikan, gen cyt b telah digunakan untuk menganalisis filogeni (Sullivan et al. 2004), sejarah dan struktur genetik antar populasi yang berbeda (Aboim et al. 2005), struktur genetik populasi yang terisolasi (Russel 2003) maupun sejarah biogeografi (Mateos et al. 2002). Kodon (basa nitrogen) pertama dan kedua pada gen cyt b mtDNA memiliki nilai gamma yang rendah. Hal ini berarti bahwa kodon pertama dan kedua pada gen cyt b memiliki nilai substitusi yang rendah atau tidak bervariasi antar individu. Sebaliknya, kodon ketiga memiliki nilai gamma yang tinggi. Hal ini berarti bahwa kodon ketiga memiliki nilai substitusi yang tinggi, atau bervariasi antar individu (Farias et al. 2001). Akan tetapi, walaupun memiliki nilai substitusi yang tinggi, sebagian besar substitusi pada kodon ketiga bersifat saturation effect. Saturation effect adalah perubahan basa nukleotida yang tidak diikuti dengan perubahan asam amino yang ditranslasikan (Kocher et al. 1989). Substitusi nukleotida terdiri atas substitusi transisi dan transversi. Substitusi transisi adalah substitusi basa nitrogen sejenis, purin menjadi purin atau pirimidin menjadi pirimidin. Substitusi transversi adalah perubahan nukleotida dari basa purin menjadi pirimidin atau sebaliknya. Pada gen penyandi protein, substitusi nukleotida dapat menghasilkan asam amino yang sama (substitusi silent/sinonim), maupun asam amino yang berbeda (substitusi non sinonim). Sebagian besar substitusi sinonim ditemukan akibat substitusi nukleotida pada kodon ketiga, walaupun dapat terjadi akibat substitusi nukleotida pada kodon pertama. Substitusi non sinonim dominan ditemukan akibat substitusi nukleotida pada kodon kedua dan pertama, walaupun dapat terjadi akibat substitusi nukleotida pada kodon ketiga (Nei & Kumar 2000).