Kimia Unsur
advertisement
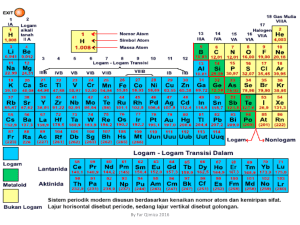
KIM 4 materi78.co.nr Kimia Unsur A. B. Non-logam lain PENDAHULUAN Kimia unsur adalah cabang ilmu kimia yang mempelajari sifat fisis dan sifat kimia unsur. H H2(g) C C(s), alotrop: grafit, intan, amorf Sistem periodik unsur modern sampai tahun 2011 terdiri atas 118 unsur, 98 di antaranya ditemukan secara alami, dan 20 lainnya disintesis di laboratorium. N N2(g) O O2(g), alotrop: oksigen atomik, oksigen triatomik, ozon P P4(s), alotrop: fosfor merah, fosfor putih S S8(s), alotrop: belerang α, belerang β KELIMPAHAN UNSUR DI ALAM Kelimpahan unsur-unsur di kulit bumi: Unsur Kelimpahan Unsur Kelimpahan O 49,20% Ca 3,39% Si 25,67% Na 2,63% Al 7,50% K 2,40% Fe 4,71% Mg 1,93% Kelimpahan senyawa di udara kering di bumi: Rumus Kelimpahan Rumus Kelimpahan N2 78,09% Ne 0,0018% O2 20,94% He 0,00052% Ar 0,934% CH4 0,00012% CO2 0,0315% Kr 0,00010% Unsur logam kebanyakan ditemukan dalam bentuk senyawa/mineral, namun dapat juga ditemukan unsur bebasnya (kecuali logam alkali dan alkali tanah). Unsur Mineral/bijih Logam alkali & alkali tanah Na sendawa Chili (NaNO3) air laut/halit (NaCl) K air laut/silvit (KCl) ortoklas/kalium feldspar (KAlSi3O8) Mg Ca kalsit/batu kapur/pualam (CaCO3) gipsum/batu tahu (CaSO4.2H2O) kaporit (Ca(OCl)2) Kelimpahan unsur di perairan bumi: C. Unsur Kelimpahan Unsur Kelimpahan O 85,84% Mg 0,13% H 10,82% S 0,09% Cl 1,94% Ca 0,04% Na 1,08% K 0,04% SUMBER UNSUR DI ALAM Unsur di bumi secara alami dapat ditemukan dalam bentuk unsur bebas atau mineral. Mineral atau bijih (ore) adalah zat yang terbentuk secara alami yang mengandung bermacam-macam unsur dengan kadar tinggi, dan dapat dituliskan dalam suatu rumus mineral. Unsur non-logam kebanyakan ditemukan dalam bentuk bebasnya (tidak membentuk senyawa). Unsur Sumber murni Senyawa/mineral Gas mulia Hanya ditemukan dalam bentuk gas monoatomik di alam. Halogen F F2(g) fluorspaar/fluorit (CaF2) kriolit (Na3AlF6) Cl Cl2(g) air laut/halit (NaCl) Br Br2(l) air laut/bromargirit (AgBr) I I2(s) air laut (NaIO3) air laut (MgCl2) magnesit (MgCO3) dolomit (MgCO3.CaCO3) epsomit/garam inggris (MgSO4.7H2O) karnalit (KCl.MgCl2.6H2O) Sr selestit (SrSO4) stronsianit (SrCO3) Logam transisi Ti rutil (TiO2) Cr kromit (FeCr2O4) Mn pirolusit (MnO2) Fe hematit (Fe2O3) siderit (FeCO3) magnetit (Fe3O4) kromit (FeO3) pirit (FeS2) limonit (Fe2O3.H2O) Ni pentlandit (FeNiS) millerit (NiS) Cu kalkopirit (CuFeS2) kuprit (Cu2O) kalkosit (Cu2S) malasit (Cu2(OH)2CO3) Zn sfalerit (ZnS) smithsonit (ZnCO3) Logam golongan utama & metaloid Al bauksit (Al2O3) kriolit (Na3AlF6) Si pasir/kuarsa (SiO2) tanah liat (Al2O3.2SiO2.2H2O) KIMIA UNSUR 1 KIM 4 materi78.co.nr Proses Deacon Sn kasiterit (SnO2) Pb galena (PbS) anglesit (PbSO4) C intan (C) grafit (C) 4HCl(g) + O2(g) d 2Cl2(g) + 2H2O(g) Pembuatan bromin: Pendesakan Br2NaBr(aq) + Cl2(g) d 2NaCl(aq) + Br2(l) Berdasarkan kandungan mineralnya, secara umum mineral dibagi menjadi: 1) Unsur bebas, contohnya belerang, intan. Pendesakan I2KI(aq) + Br2(g) d 2KBr(aq) + I2(s) 2) Sulfida (S2-), contohnya pirit, kalkopirit. 3) Oksida (O2-), contohnya hematit, bauksit. Proses Weldon 4) Halida (X-), contohnya kriolit, halit. Dilakukan dengan mencampurkan KI dengan batu kawi dan asam sulfat pekat. 5) Karbonat (CO32-), contohnya dolomit, pualam. 2KI(aq) + MnO2(s) + 2H2SO4(aq) 6) Sulfat (SO42-), contohnya garam inggris. 7) Fosfat (PO43-), d MnSO4(aq) + K2SO4(aq) + H2O(l) + I2(s) contohnya fluorapatit. 8) Silikat (Si), contohnya feldspar, kuarsa. D. Pembuatan iodin: Pembuatan hidrogen: PEMBUATAN UNSUR NON-LOGAM Unsur Elektrolisis air Cara Pembuatan/Proses 2H2O(l) + 2e d 2OH-(aq) + H2(g) Halogen Reaksi metana F Elektrolisis leburan KF Cl Elektrolisis lelehan NaCl Proses Weldon Br Pendesakan Br I Pendesakan I- Reaksi metana dengan uap air menghasilkan suatu campuran CO dan H2 yang disebut sin-gas. Proses Deacon CH4(g) + H2O(g) d CO(g) + H2(g) - Pembuatan nitrogen dan oksigen: Proses Weldon Distilasi bertingkat udara cair Non-logam lain H Elektrolisis air N Distilasi bertingkat udara cair O Distilasi bertingkat udara cair P Proses Wohler S Proses Frasch 1) Penyaringan Reaksi metana Udara disaring dari pengotor padat. 2) Pencairan udara Udara dikompresi lalu didinginkan, sehingga air dan CO2 membeku dan dapat dipisahkan. Proses Sisilia Jadi, udara cair hanya mengandung N2, O2 dan Ar. Pembuatan fluorin: 3) Distilasi bertingkat Elektrolisis leburan KF E + 2KF d 2K + 2F : K (-) : A (+) : Udara diekspansi kembali dan didistilasi bertingkat dengan menurunkan tekanan. - + 2K + 2e d 2K 2F- d F2 + 2e + 2KF d 2K + F2 Pembuatan klorin: Elektrolisis lelehan NaCl E : K (-) : A (+) : Gas-gas dalam udara cair tersebut menguap pada tekanan yang berbeda, urutannya adalah N2, Ar lalu O2. Pembuatan fosfor: + 2NaCl d 2Na + 2Cl Proses Wohler (fosfor putih) - 1) Reaksi dalam tanur listrik 2Na+ + 2e d 2Na 2Cl- d Cl2 + 2e + 2NaCl d 2Na + Cl2 Proses Weldon Dilakukan dengan mencampurkan NaCl dengan batu kawi dan asam sulfat pekat. 2Ca3(PO4)2(l) + 6SiO2(l) d 6CaSiO3(l) + P4O10(g) 2) Reduksi P4O10(g) + 5C(s) d P4(s) + 5CO2(g) Fosfor putih lalu disimpan dalam CS2 atau H2O agar tidak teroksidasi. 2NaCl(aq) + MnO2(s) + 2H2SO4(aq) d MnSO4(aq) + Na2SO4(aq) + H2O(l) + Cl2(g) KIMIA UNSUR 2 KIM 4 materi78.co.nr Pembuatan belerang: Proses Frasch Adalah proses pengambilan belerang dari bawah permukaan tanah. 1) Belerang dicairkan dengan dialiri air bersuhu 1600oC dan bertekanan 16 atm. 2) Belerang cair dikeluarkan dengan pompa udara panas bertekanan 20-25 atm. 3) Belerang cair kemudian dibiarkan membeku menjadi belerang padat. Proses Sisilia Adalah proses pengambilan permukaan tanah. E. belerang di Selanjutnya proses elektrolisis lelehan NaCl yang dicampur dengan CaCl2 untuk menurunkan titik leleh NaCl. E 2NaCl d 2Na+ + 2Cl- : K (-) : 2Na+ + 2e d 2Na 2Cl- d Cl2 + 2e A (+) : 2NaCl d 2Na + Cl2 Pembuatan magnesium: Proses Dow Magnesium berasal dari air laut yang diproses sehingga menghasilkan MgCl2, melalui tahap: 1) Pelarutan CaO dalam air CaO(s) + H2O(l) d 2Ca2+(aq) + 2OH-(aq) 1) Mineral yang mengandung belerang dipanaskan hingga belerang terpisah. 2) Pengendapan Mg2+ 2) Belerang kemudian dimurnikan dengan cara sublimasi. 3) Reaksi dengan HCl pekat PEMBUATAN UNSUR LOGAM Mg2+(aq) + 2OH-(aq) d Mg(OH)2(s) Mg(OH)2(s) + 2HCl(aq) d MgCl2(aq) + 2H2O(l) 4) Pencairan MgCl2 Unsur Cara Pembuatan/Proses Logam alkali & alkali tanah Li, Na, K, Mg, Ca, Sr, Ba Elektrolisis cairan/lelehan garam halidanya Proses Down (Na) Proses Dow (Mg) Logam transisi Cr Proses Goldschmidt E Mn Proses aluminotermi Fe Tanur tiup/tanur tinggi Pembuatan kromium: MgCl2(aq) d MgCl2(s) MgCl2(s) d MgCl2(l) Selanjutnya proses elektrolisis lelehan MgCl2. : K (-) : A (+) : MgCl2 d Mg2+ + 2ClMg2+ + 2e d Mg 2Cl- d Cl2 + 2e Proses Goldschmidt Reduksi kalkopirit Logam golongan utama & metaloid Al Proses Hall-Heroult Cr2O3(s) + 2Al(s) d Al2O3(s) + 2Cr(s) Pembuatan mangan: Proses aluminotermi Reduksi kuarsa 3MnO2(s) d Mn3O4(s) + O2(g) Pembuatan logam alkali dan alkali tanah: Elektrolisis cairan/lelehan garam halidanya 3Mn3O4(s) + 8Al(s) d 9Mn(s) + 4Al2O3(s) Contoh: Pembuatan besi: Pembuatan kalium dari elektrolisis cairan KCl. Proses tanur tiup E K (-) : Menghasilkan besi gubal (pig iron). 2KCl d 2K+ + 2Cl- : 2K+ + 2e d 2K A (+) : 2Cl- d Cl2 + 2e + MgCl2 d Mg + Cl2 Cu Si + + 2KCl d 2K + Cl2 Pembuatan natrium: Proses Down 1) Hematit, kokas dan batu kapur diletakkan pada puncak tanur yang ditiup udara panas. 2) Pembakaran kokas a. Menaikkan suhu sampai 2000oC C(s) + O2(g) d CO2(g) (eksoterm) b. Menghasilkan CO untuk reduksi hematit Natrium berasal dari air laut yang diuapkan sehingga menghasilkan NaCl. NaCl(aq) d NaCl(s) NaCl(s) d NaCl(l) CO2(g) + C(s) d 2CO(g) 3) Reduksi hematit Fe2O3(s) + 3CO(g) d 2Fe(l) + 3CO2(g) 4) Pembentukan terak (cairan kental) dari pengotor bijih besi oleh batu kapur KIMIA UNSUR 3 KIM 4 materi78.co.nr CaCO3(s) d CaO(s) + CO2(g) Pembuatan silikon: CaO(s) + SiO2(s) d CaSiO3(l) Reduksi kuarsa 1) Reduksi kuarsa 3CaO(s) + P2O5(g) d Ca3(PO4)2(l) SiO2(l) + C(s) d Si(l) + 2CO(g) Pembuatan tembaga: 2) Pemurnian Reduksi kalkopirit Si(l) d Si(s) 1) Flotasi Si(s) + 2Cl2(g) d SiCl4(g) Serbuk kalkopirit diberi air dan minyak, sehingga tembaga berminyak dan mengapung. 3) Pengendapan SiCl4(g) + 2H2(g) d Si(s) + 4HCl(g) 2) Pemanggangan F. 4CuFeS2(s) + 9O2(g) d 2Cu2S(s) + 2Fe2O3(s) + 6SO2(g) 3) Peleburan Peleburan menghasilkan lapisan Cu2S dan Fe cair, dan lapisan FeSiO3 cair (terak). 4) Reduksi Menghasilkan tembaga kotor yang disebut tembaga lepuh. 2Cu2S(l) + 3O2(g) d 2Cu2O(s) + 2SO2(g) Cu2S(l) + Cu2O(s) d 2Cu(s) + SO2(g) 5) Elektrolisis (pemurnian logam) Cu murni dijadikan katoda, Cu kotor dijadikan anoda, dan larutan CuSO4 dijadikan elektrolitnya. Pengotor-pengotor Cu biasanya adalah Ag, Au, Pt, Fe dan Zn. Selama elektrolisis, logam pengotor tidak akan larut, tetapi membentuk lumpur anoda, sehingga tembaga menjadi murni. PEMBUATAN SENYAWA Senyawa H2SO4 Proses klor-alkali NaHCO3 Proses Solvay Na2CO3 Proses Solvay NH3 Proses Haber-Bosch HNO3 Proses Ostwald baja Proses tungku oksigen Proses kontak pada pembuatan H2SO4: 1) Pembakaran belerang S(s) + O2(g) → SO2(g) 2) Oksidasi belerang dioksida 2SO2(g) + O2(g) qe 2SO3(g) Reaksi ini dilakukan pada suhu sekitar 500°C dan tekanan 1 atm, dan dengan katalis V2O5. 3) Pelarutan belerang trioksida SO3(s) + H2SO4(aq) → H2S2O7(l) 4) Asam pirosulfat direaksikan dengan air Proses Hall-Heroult H2S2O7(l) + H2O(l) → H2SO4(aq) 1) Pelarutan bauksit Al2O3(s) + 2NaOH(aq) + 3H2O(l) d 2NaAl(OH)4(aq) 2) Pengendapan d 2Al(OH)3(s) + Na2CO3(aq) + H2O(l) 3) Pemanasan 2NaCl d 2Na+ + 2Cl- K (-) : 2H2O + 2e d 2OH- + 2H2 A (+) : 2Cl- d Cl2 + 2e + - 2NaCl + 2H2O d 2Na + 2OH + 2H2 + Cl2 Selanjutnya proses elektrolisis bauksit yang dicampur dengan lelehan kriolit agar titik didihnya turun. 2NaCl + 2H2O d 2NaOH + 2H2 + Cl2 Proses Sovlay pada pembuatan NaHCO3 dan Na2CO3: 1) Pemanasan batu kapur 2Al2O3 d 4Al3+ + 6O2- CaCO3(s) → CaO(s) + CO2(g) K (-) : 4Al3+ + 12e d 4Al 6O2- d 3O2 + 12e : + 2Al(OH)3(s) d Al2O3(s) + 3H2O(g) A (+) : Proses klor-alkali adalah elektrolisis larutan NaCl pada pembuatan NaOH: E 2NaAl(OH)4(aq) + CO2(g) : Proses kontak Bilik timbal NaOH Pembuatan aluminium: E Cara Pembuatan/Proses + 2Al2O3 d 4Al + 3O2 Elektroda yang digunakan adalah grafit. Oksigen yang dihasilkan bereaksi dengan grafit, sehingga anoda harus diganti ketika telah habis. 2) Pembentukan asam karbonat CO2(g) + H2O(l) → H2CO3(aq) 3) Penambahan amonia H2CO3(aq) + NH3(g) → NH4HCO3(aq) KIMIA UNSUR 4 KIM 4 materi78.co.nr 4) Pembentukan NaHCO3 NH4HCO3(aq) + NaCl(aq) → NaHCO3(s) + NH4Cl(aq) Endapan NaHCO3 kemudian dipisahkan melalui penyaringan, dan dapat diolah kembali menjadi Na2CO3. 5) Pemanasan NaHCO3 menghasilkan Na2CO3 2NaHCO3(s) → Na2CO3(s) + H2O(g) + CO2(g) Proses Haber-Bosch pada pembuatan NH3: N2(g) + 3H2(g) qe 2NH3(g) Reaksi ini dilakukan pada suhu tinggi dan tekanan tinggi, dan dengan katalis serbuk Fe. Untuk mengurangi reaksi balik, amonia yang terbentuk segera dipisahkan. Proses Ostwald pada pembuatan HNO3: 1) Pembentukan nitrogen oksida 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g) 2) Pembentukan nitrogen dioksida 2NO(g) + O2(g) → 2NO2(g) 3) Pembentukan asam nitrat 3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g) Baja adalah aliasi logam yang dibentuk dari logam utama besi, sedikit karbon dan logam lain. Berdasarkan menjadi: kadar baja terbagi Beda Rendah Menengah Tinggi Kadar C 0,05-0,3% 0,3-0,6% 0,6-1,5% Sifat mudah ditempa sukar ditempa sangat keras dan kuat poros as, rel, palu, obeng bor, pemotong logam, palu pandai besi Sifat Contoh badan mobil, pipa, Contoh rantai, corong, baut Contoh-contoh baja: Nama Aliasi Stainless steel Cr, Ni tahan karat perkakas dapur, alat pemotong Baja kromiumvanadium Cr, V kuat poros as, roda gigi Baja mangan Mn keras dan kuat per, mesin penghancur Baja silikon Si keras dan kuat magnet Baja invar Ni sukar memuai alat ukur Proses tungku oksigen pada pembuatan baja: 1) Besi gubal dari proses tanur tiup dimasukkan ke dalam tungku oksigen. karbon, 2) Tungku oksigen lalu ditiupkan oksigen, sehingga kadar karbon turun karena teroksidasi menjadi CO, dan pengotor diikat CaO menjadi terak. KIMIA UNSUR 5