PROFIL SEL GOBLET ITIK CIHATEUP
advertisement

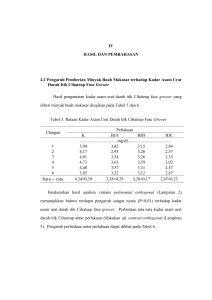
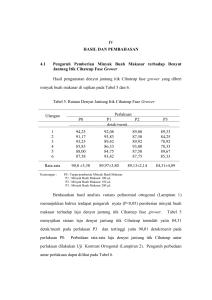
Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana PROFIL SEL GOBLET ITIK CIHATEUP (Anas platyrhynchos javanica) YANG DIBERI FRUKTOOLIGOSAKARIDA (FOS) DALAM KONDISI PEMELIHARAAN MINIM AIR GOBLET CELLS PROFILE OF CIHATEUP DUCK (Anas platyrhynchos javanica) WHICH GIVEN FRUCTOOLIGOSACCHARIDES (FOS) IN KEEP OF MINIMUM WATER CONDITION Indra Permana*, Andi Mushawwir**, Diding Latipudin** Universitas Padjadjaran *Alumni Fakultas Peternakan Unpad Tahun 2016 **Staf Pengajar Fakultas Peternakan Unpad e-mail : [email protected] ABSTRAK Penelitian ini dilaksanakan pada bulan Oktober – Desember 2015, di kandang percobaan Produksi Ternak Unggas, Fakultas Peternakan Universitas Padjadjaran dan dianalisis di Laboratorium Mikroteknik Hewan, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Padjadjaran. Penelitian bertujuan untuk mengetahui pengaruh pemberian Fruktooligosakarida (FOS) terhadap jumlah sel goblet dan luas sekret mucus sel goblet ileum itik Cihateup (Anas platyrhynchos javanica). Penelitian ini menggunakan metode eksperimental dengan Rancangan Acak Lengkap (RAL). Terdapat empat perlakuan (P0 = tanpa pemberian FOS, P1 = 50 µL FOS, P2 = 75 µL FOS, dan P3 = 100 µL FOS) dengan enam ulangan. Pengaruh perlakuan diuji menggunakan analisis ragam (Anova) polynomial orthogonal dan dilanjutkan dengan uji contrast orthogonal. Hasil analisis menunjukkan bahwa pemberian FOS (50 µl-100 µL) berpengaruh sangat nyata (P<0,01) terhadap jumlah sel goblet ileum itik Cihateup, dan berpengaruh nyata (P<0,05) terhadap luas sekret mucus sel goblet ileum itik Cihateup. Pemberian terbaik terhadap jumlah sel goblet ileum dan mucus sel goblet ileum itik Cihateup adalah 100 µl FOS. Kata Kunci : Fruktooligosakarida (FOS), Itik Cihateup, Sel goblet, Sekret mucus. ABSTRACT This research was conducted from October to Desember, 2015 at the Faculty of Animal Husbandry Poultry Testing Cage, Padjadjaran University, and was analyzed at Laboratory Animal Microtech, Biology, Faculty of Mathematic and Sciences, Padjadjaran University. The aim of this research was to determine the effect of Fructooligosaccharides (FOS) on the amount of goblet cells and mucus area secretion of goblet cells ileum in Cihateup duck (Anas platyrhynchos javanica). The research was used experiment method with a completely randomized design (CRD). There were four treatments (P0 = no given FOS, P1 = 50 µL FOS, P2 = 75 µL FOS, dan P3 = 100 µL FOS) with six replications. The data were analyzed with Analysis of Variance (Anova) polynomial orthogonal and contrast orthogonal test to know differents significantly. Based on the results showed that administration of FOS (50 µl-100 µL) increasing the amount goblet cells ileum of Cihateup duck, highly significant (P<0,01) and significant effect (P<0,05) shows on mucus area secretion goblet cells ileum of Cihateup Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana duck. The best level to increase amount goblet cells ileum and mucus area secretion goblet cells ileum of Cihateup duck is 100 µL FOS. Keywords : Fructooligosaccharides (FOS), Cihateup duck, Goblet cells, Mucus area secretion. PENDAHULUAN Itik Cihateup adalah bangsa itik yang berasal dari Desa Cihateup, Kecamatan Rajapolah, Kabupaten Tasikmalaya, Provinsi Jawa Barat. Itik ini sering disebut sebagai itik pegunungan karena adaptif dengan daerah yang bersuhu dingin, dengan tempat diketinggian 378 m diatas permukaan laut. Itik Cihateup ini terbiasa dengan kolam air untuk menjaga kondisi tubuhnya agar tetap stabil dan normal. Hal tersebut menyebabkan bahwa kemampuan thermoregulasi itik Cihateup rendah dibandingkan dengan unggas-unggas lainnya seperti ayam-ayam lokal. Kondisi minim air adalah suatu keadaan dimana ternak tidak menerima air dalam kondisi optimal, misalnya pada ternak itik kondisi optimal dalam mempergunakan air adalah untuk kebutuhan minum dan berenang. Apabila ternak tidak mempergunakan air secara optimal, maka kondisi tubuh ternak dapat mengalami stres atau dibawah kondisi Thermoneutral Zone (TNZ). Kondisi Thermoneutral Zone (TNZ) yang sesuai dengan kondisi tubuh itik adalah dibawah 250C (≤ 25). Ternak akan mampu melakukan metabolisme secara optimal jika lingkungan hidup ternak tersebut berada pada kondisi Thermoneutral Zone (TNZ). Proses metabolisme pada sistem pencernaan membutuhkan kondisi yang sesuai agar enzim dan sel bisa bekerja dengan baik. Proses pencernaan dan penyerapan zat-zat makanan dalam usus halus membutuhkan cairan yang disebut dengan mucus. Mucus merupakan cairan hasil sekresi sel goblet untuk membantu sel-sel dalam mengabsorpsi zat-zat makanan pada vili-vili usus, sehingga akan terjadi peningkatan konversi ransum. Proses pencernaan dalam tubuh ternak membutuhkan bantuan mikroorganisme hidup (probiotik) untuk menjaga kestabilan sistem penyerapan nutrisi zat makanan. Menurut FAO/WHO (2006), probiotik adalah mikroorganisme hidup yang jika diberikan dalam jumlah memadai akan memberikan manfaat kesehatan bagi inangnya, sedangkan prebiotik sebagai sumber energi untuk hidup probiotik. Prebiotik merupakan pati yang tidak dapat dicerna langsung tubuh melainkan harus dicerna dahulu oleh mikroba probiotik. Contoh prebiotik yaitu fruktooligosakarida (FOS), galaktooligosakarida (GOS), dan laktosa. Fruktooligosakarida memiliki efek untuk menstimulasi mikrobiota usus yang menghasilkan peningkatan berat vili-vili usus pada babi (Spencer dkk., 1997). Fruktooligosakarida juga merangsang aktivitas enzim pencernaan (protease, tripsin, dan amilase) dalam usus kecil pada Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana babi (Xu dkk., 2002), yang menguntungkan bagi penyerapan nutrisi di usus, sehingga meningkatkan efisiensi pakan. Oleh karena itu, daya cerna meningkat ketika babi diberi Fructan pada level 0,10%. Pertumbuhan bakteri probiotik (seperti Bifidobacteria dan Lactobacilli) dirangsang oleh suplementasi FOS menghasilkan asam lemak rantai pendek (SCFA), mengakibatkan pengasaman saluran pencernaan (Yu Wang dkk., 2010). Asam lemak rantai pendek berperan dalam stimulan pembentuk sel-sel usus contohnya sel goblet, karena asam lemak merupakan komponen fosfolipid membran sel. pH asam di saluran pencernaan, seperti pada ventriculus, duodenum, jejunum, dan ileum, memberikan efek menguntungkan untuk kelarutan mineral serta aktivitas fitase (Selle dkk., 2009). Oleh karena itu, FOS berpotensi meningkatkan fitase dan menghidrolisis fitat, dengan demikian dapat meningkatkan pemanfaatan mineral pada tubuh. Kondisi asam pada sistem pencernaan tersebut juga membunuh sebagian bakteri patogen dan menggesernya keluar dari usus halus, karena bakteri patogen dapat merusak dinding-dinding usus seperti vili, sehingga bakteri non patogen dapat hidup pada kondisi baik dan peningkatan vili usus dapat terjadi. Stres dapat relatif cepat menyebabkan perubahan mukosa usus pada permukaan dan isi usus. Perubahan morfologi usus seperti memendeknya vili dan dampak lebihnya meningkatkan radikal bebas (Yason dkk., 1987). Ketika vili usus memendek maka luas permukaan akan berkurang, begitu juga dengan sel-sel goblet yang terdapat pada permukaan tersebut. Hasil-hasil penelitian sebelumnya menunjukkan perbaikan jaringan usus dan perbaikan efisiensi ransum pada ternak yang diberi FOS, antara lain dapat meningkatkan berat vili-vili pada pakan babi (Z.R.Xu dkk., 2002) dan pada ayam (K.S.Shim dkk., 2006) dan meningkatkan konversi ransum pada broiler (Fesler dan Peterson, 2013) dan pada layer (Suksombat dkk., 2006). Perbaikan ini karena kemampuan FOS sebagai prebiotik dan media untuk meningkatkan kestabilan mikroflora usus. Hasil penelitian F.Y.Long dkk. (2012) juga menunjukkan peningkatan bakteri non patogen terutama dari kelompok bacillus dengan pemberian FOS. Hal ini berdampak terhadap perbaikan ekosistem usus yang dapat memacu pertumbuhan vili dalam periode pertumbuhan ternak. Hasil penelitian K.S.Shim dkk. (2006) menunjukkan pertambahan dimensi vili dan usus secara keseluruhan dengan penambahan FOS. Lebih lanjut dilaporkan bahwa FOS menyebabkan peningkatan keasaman usus dalam kisaran normal pH usus menyebabkan peningkatan absorpsi mineral mikro dan makro serta kinetika enzim, yang mampu menyebabkan pertumbuhan sel-sel (penambahan ukuran sel) vili. Hasil penelitian F.Y.Long dkk. (2012) menunjukkan peningkatan kadar insulin dengan pemberian FOS, ini Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana menunjukkan indikasi laju pertumbuhan jaringan meningkat karena diketahui bahwa insulin merupakan kelompok hormon anabolisme. Terlihat beberapa perbaikan menjelaskan pada kenaikan berat badan dan konversi pakan dengan FOS. FOS menunjukkan dapat membantu proses pencernaan dalam usus halus, dengan membantu jalur metabolisme dengan peningkatan vili-vili dan mikroflora usus, sehingga bertambahnya sel-sel goblet dan pengeluaran mucus. METODE 1. Fruktooligosakarida (FOS) Fruktooligosakarida (FOS) adalah hasil dari ekstraksi dan isolasi kulit buah pisang batu dengan konsentrasi yang telah ditetapkan. Tahap pertama dilakukan proses ekstraksi fruktooligosakarida. Sebanyak 10 kg bahan direndam dalam 30 L larutan etanol 70% selama 14 hari. Selama perendaman setiap hari dilakukan pengadukan kurang lebih 10 menit. Selanjutnya filtrat disaring dengan menggunakan kain saring dan diuapkan dengan evaporator vakum hingga menjadi 1 L. Filtrat pekat tersebut kemudian diekstrak dengan etil asetat (EtOAc) sehingga diperoleh fraksi air. Selanjutnya fraksi air tersebut diuapkan hingga kering kemudian dimasukkan dalam Diaion LH-20 kolom kromatografi. Fraksi yang mengandung FOS kemudian dilakukan pemurnian lebih lanjut dengan menggunakan teknik pemurnian seperti kolom kromatografi, Preparative Thin Layer Chromatography (PTLC), atau kristalisasi. Senyawa FOS yang diperoleh selanjutnya dianalisis dengan spektoskopi. Masing–masing fraksi yang diperoleh diuji dengan metode TLC dengan cara meneteskan pada plate. Selanjutnya plate dikembangkan dengan kombinasi pelarut metanolair untuk mendapatkan spot. Pengujian juga dilakukan dengan membandingkan retention time standar senyawa FOS dengan menggunakan metoda kromatografi cair kinerja tinggi (HPLC). 2. Peubah yang Diamati Peubah yang diamati dalam penelitian ini adalah jumlah sel goblet dan luas sekret mucus. Analisis sekret mucus dan sel goblet ileum itik menggunakan metode paraffin dan pewarnaan MA (Mallory-Azan). 3. Rancangan Percobaan Penelitian menggunakan metode eksperimental Rancangan Acak Lengkap (RAL) dan diuji menggunakan analisis ragam (Anova) polynomial orthogonal dan dilanjutkan dengan uji contrast orthogonal. Terdapat 4 macam perlakuan konsentrasi Fruktooligosakarida (FOS), Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana setiap perlakuan diulang sebanyak 6 kali dengan masing-masing unit percobaan 2 ekor itik Cihateup, sehingga ada 24 unit percobaan (48 ekor). Perlakuan terdiri dari P 0 = tanpa pemberian FOS, P1 = 50 µL FOS; P2 = 75 µL FOS; dan P3 = 100 µL FOS. Ransum yang digunakan berbentuk mash dengan kandungan energi metabolis sebesar 3.004 Kkal/kg dan protein kasar 16,06%. Pengaruh perlakuan akan diuji menggunakan SPSS. Peubah yang diamati adalah jumlah sel goblet dan luas sekret mucus sel goblet ileum itik Cihateup. HASIL DAN PEMBAHASAN Pengaruh Perlakuan terhadap Jumlah Sel Goblet Ileum Itik Cihateup Rataan jumlah sel goblet ileum itik cihateup yang dianalisis dengan metode Paraffin dan pewarnaan Mallory-Azan disajikan pada Tabel 1. Tabel 1. Rataan Jumlah Sel Goblet Ileum Itik Cihateup Ulangan 1 2 3 4 5 6 Rata-rata Keterangan: Perlakuan P0 P1 P2 P3 ….………………Σ sel per lp 10x10 …………………… 20 51 52 65 19 52 53 65 20 53 51 67 20 52 51 66 19 51 52 67 20 52 51 66 19,67 ± 0,52 51,83 ± 0,75 51,67 ± 0,82 66,00 ± 0,89 lp 10x10 : lapang pandang okuler perbesaran 10 x objek perbesaran 10 P0 : kontrol (tanpa pemberian) P1 : total konsentrasi Fruktooligosakarida (FOS) 50 µL P2 : total konsentrasi Fruktooligosakarida (FOS) 75 µL P3 : total konsentrasi Fruktooligosakarida (FOS) 100 µL Hasil analisis ragam menunjukkan bahwa pemberian fruktooligosakarida (FOS) pada itik Cihateup dengan konsentrasi berbeda, berpengaruh sangat nyata (P<0,01) terhadap jumlah sel goblet ileum. Selanjutnya dilakukan uji contrast orthogonal untuk mengetahui perlakuan yang paling optimal terhadap jumlah sel goblet ileum itik Cihateup. Hasil dari uji contrast orthogonal disajikan pada Tabel 2. Berdasarkan Tabel 2 tampak bahwa pemberian fruktooligosakarida (FOS) terhadap jumlah sel goblet ileum itik Cihateup per lp 10x10 dari mulai terbesar ke terendah yaitu P3 (66,00); P1 (51,83); P2 (51,67); dan P0 (19,67). Rataan jumlah sel goblet ileum itik Cihateup Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana terbesar diperoleh pada perlakuan P3 sebesar 66,00, sedangkan yang paling rendah diperoleh pada perlakuan P0 sebesar 19,67. 70 66 60 51.83 50 51.67 40 Rataan Jumlah Sel Goblet 30 20 19.67 10 0 P0 P1 P2 P3 Ilustrasi 1. Grafik Rataan Jumlah Sel Goblet Ileum Itik Cihateup Hal tersebut menunjukkan bahwa terjadinya peningkatan jumlah sel goblet ileum itik Cihateup yang telah diberi fruktooligosakarida dengan konsentrasi 50 µL, 75 µL, dan 100 µL (Ilustrasi 1). Tabel 2. Uji Contrast Orthogonal Jumlah Sel Goblet Ileum Itik Cihateup Perlakuan Rata-rata Jumlah Sel Goblet Signifikansi* P0 19,67 ± 0,52 a P2 51,67 ± 0,82 b P1 51,83 ± 0,75 c P3 66,00 ± 0,89 d *Keterangan: Huruf yang berbeda dalam kolom signifikansi menunjukkan pengaruh masing-masing perlakuan berbeda sangat nyata (P<0,01) Berdasarkan data Tabel 2, bahwa tiap perlakuan P0 (tanpa pemberian), P1 (50 µL), P2 (75 µL), dan P3 (100 µL) masing-masing semua perlakuan berbeda nyata atau signifikan (P<0,05). Hal ini disebabkan bahwa fruktooligosakarida mampu menjadi stimulan, sehingga jumlah sel goblet ileum itik Cihateup meningkat. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana Sel Goblet (a) (b) (c) (d) Ilustrasi 2. Hasil Analisis Sel goblet dan sekret mucus (a) kontrol (tanpa pemberian); (b) FOS 50 µl; (c) FOS 75 µl; (d) FOS 100 µl Fruktooligosakarida (FOS) merupakan senyawa prebiotik yang tidak bisa langsung dihidrolisa oleh enzim-enzim dalam sistem pencernaan yang di sekresikan oleh pankreas, maka dari itu perlu bantuan mikroba agar dapat dicerna oleh usus halus. FOS akan dimanfaatkan oleh bakteri probiotik sebagai sumber energi. Pertumbuhan bakteri probiotik (seperti Bifidobacteria dan Lactobacilli) dirangsang oleh suplementasi FOS menghasilkan asam lemak rantai pendek (SCFA), mengakibatkan pengasaman saluran pencernaan (Yu Wang dkk., 2010). Asam lemak rantai pendek yaitu fosfolipid berperan dalam stimulan pembentuk sel-sel usus yaitu sel goblet, sehingga meningkatnya metabolisme sel dan perbanyakan sel. Pengasaman saluran pencernaan menyebabkan peningkatan kinetika enzim dalam saluran pencernaan, sehingga menurut K.S.Shim dkk. (2006) menunjukkan pertambahan dimensi vili dan usus secara keseluruhan dengan penambahan FOS. Pertumbuhan jaringan usus karena unit terkecil yakni sel mengalami pertumbuhan dan penambahan ukuran sehingga vili-vili usus semakin melebar. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana Peningkatan absorpsi mineral mikro dan makro yang signifikan membuat fungsifungsi metabolisme tubuh semakin baik. Fungsi mineral makro yaitu Mg2+ berperan sangat penting untuk sintesis protein dalam inti sel. Menurut Mushawwir dan Latipudin (2013) menerangkan bahwa ketika penyerapan mineral makro Mg2+ (magnesium) dalam bahan pakan baik, maka sintesis protein dalam inti sel akan optimal karena Mg2+ sebagai kofaktor dalam penyusunan mRNA. Mg2+ dan enzim polymerase memutus double helix RNA menjadi mRNA untuk membentuk asam-asam amino. Ketika metabolisme sel baik maka pertumbuhan dan perkembangan sel akan baik pula, dan fungsi-fungsi yang ada dalam sistem pencernaaan seperti penyerapan zat-zat nutrisi oleh vili usus semakin bagus, sehingga pakan menjadi efisien. Pemberian FOS sampai 100 µL berdampak baik terhadap pertambahan jumlah sel goblet di ileum. Pengaruh Perlakuan terhadap Luas Sekret Mucus Sel Goblet Ileum Itik Cihateup Rataan luas sekret mucus sel goblet ileum itik cihateup yang dianalisis dengan metode Paraffin dan pewarnaan Mallory-Azan disajikan pada Tabel 3. Tabel 3. Rataan Luas Sekret Mucus Sel Goblet Ileum Itik Cihateup Ulangan 1 2 3 4 5 6 Rata-rata Keterangan: Perlakuan P0 P1 P2 P3 2 ………...……………….. µm …………………………….. 4,43 7,09 8,52 7,15 6,85 8,45 8,46 5,94 6,93 8,89 6,19 7,89 5,49 8,23 5,84 4,65 6,98 8,26 8,35 8,00 5,43 8,84 6,58 8,63 6,02 ± 1,06 8,29 ± 0,65 7,32 ± 1,25 7,04 ± 1,49 P0 : kontrol (tanpa pemberian) P1 : total konsentrasi Fruktooligosakarida (FOS) 50 µL P2 : total konsentrasi Fruktooligosakarida (FOS) 75 µL P3 : total konsentrasi Fruktooligosakarida (FOS) 100 µL Hasil analisis ragam menunjukkan bahwa pemberian fruktooligosakarida (FOS) pada itik Cihateup dengan konsentrasi berbeda, berpengaruh nyata (P<0,05) terhadap luas sekret mucus sel goblet ileum. Selanjutnya dilakukan uji contrast orthogonal untuk mengetahui perlakuan yang paling optimal terhadap luas sekret mucus sel goblet ileum itik Cihateup. Hasil dari uji contrast orthogonal disajikan pada Tabel 4. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana Berdasarkan Tabel 3 tampak bahwa pemberian fruktooligosakarida (FOS) terhadap luas sekret mucus sel goblet ileum itik cihateup (µm2) dari mulai terbesar ke terendah yaitu P1 (8,29); P2 (7,32); P3 (7,04); dan P0 (6,02). Rataan luas sekret mucus sel goblet ileum itik Cihateup terbesar diperoleh pada perlakuan P1 sebesar 8,29, sedangkan yang paling rendah diperoleh pada perlakuan P0 sebesar 6,02. 9 8 7 6 5 4 3 2 1 0 8.29 7.32 7.04 6.02 Rataan Luas Sekret Mucus Sel Goblet P0 P1 P2 P3 Ilustrasi 3. Grafik Rataan Luas Sekret Mucus Sel Goblet Ileum Itik Cihateup Hal tersebut menunjukkan bahwa terjadinya peningkatan luas sekret mucus sel goblet ileum itik Cihateup yang telah diberi fruktooligosakarida pada konsentrasi 50 µL, dan terjadi penurunan pada konsentrasi 75 µL dan 100 µL (Ilustrasi 3). Tabel 4. Uji Contrast Orthogonal Luas Sekret Mucus Sel Goblet Ileum Itik Cihateup Perlakuan Rata-rata Luas Sekret Mucus Signifikansi* P0 6,02 ± 1,06 a P3 7,04 ± 1,49 b P2 7,32 ± 1,25 b P1 8,29 ± 0,65 b *Keterangan: Huruf yang berbeda dalam kolom signifikansi menunjukkan pengaruh masing-masing perlakuan berbeda nyata (P<0,05) Berdasarkan data Tabel 4, bahwa perlakuan P0 (tanpa perlakuan) berbeda nyata atau signifikan terhadap perlakuan P1 (50 µL), P2 (75 µL), dan P3 (100 µL), tetapi masing-masing perlakuan P1 (50 µL) terhadap P2 (75 µL) dan P3 (100 µL) tidak berbeda nyata atau masingmasing perlakuan berpengaruh sama. Hal ini disebabkan bahwa fruktooligosakarida mampu menjadi stimulan, sehingga luas sekret mucus sel goblet ileum itik Cihateup meningkat meskipun dengan konsentrasi yang sama. Sel goblet melepaskan musin, musin tersebut mengalami proses hidrasi dan membentuk suatu gel elastik kental yang disebut mukus (mucus), sebagai alat untuk Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana pertahanan dan membantu penyerapan makanan di usus sehingga lebih maksimal (Junquiera dkk., 1997). Mucus tersebut mengandung glikoprotein, selain untuk membantu penyerapan zat-zat makanan juga sebagai pertahanan terhadap mikroba patogen. Mucus yang disekresikan oleh sel goblet merupakan campuran antara air, glikoprotein, glikolipid, elektrolit-elektrolit, enzim, garam, dan sekresi kelenjar (Utama, 2014; Castagliuolo, 1998). Menurut Harnett dkk. (1997) bahwa mucus dari hasil sekret sel goblet dapat menjadi barrier penting dalam mempertahankan mikroflora dan ekologi usus halus, sebagai cairan untuk menstabilkan dan menghilangkan ancaman penyakit. Keadaan tersebut membuat absorpsi mineral mikro dan makro semakin baik. Glikoprotein merupakan hasil dari metabolisme didalam sel. Didalam transpor sel mineral adalah komponen penting yang berfungsi membantu metabolisme sel. Ca2+ (kalsium) merupakan komponen mineral yang berfungsi sebagai komunikasi (penyinalan) antar aktivitas didalam sel. Ca2+ menjadi salah satu mineral transduksi atau penyinalan di dalam sel, dan berkontribusi baik terhadap sintesis glikoprotein (Mushawwir, 2014). Luas oval mucus yang disekresikan sangat penting untuk membantu epitel-epitel usus dalam absorpsi zat-zat makanan. Semakin luas sekret mucus yang dihasilkan maka semakin banyak pula cairan untuk membantu penyerapan di usus. FOS memperluas sekret mucus sel goblet yang membuat sekresi cairan semakin banyak, sehingga absorpsi semakin baik. Akan tetapi masing-masing konsentrasi FOS pada perlakuan P1 (50 µL); P2 (75 µL); dan P3 (100 µL) tidak memberikan efek yang berbeda. KESIMPULAN Berdasarkan hasil penelitian menunjukkan bahwa pemberian fruktooligosakarida berpengaruh sangat nyata (P<0,01) terhadap jumlah sel goblet dan berpengaruh nyata (P<0,05) terhadap luas sekret mucus sel goblet ileum itik Cihateup dalam kondisi pemeliharaan minim air. Pemberian fruktooligosakarida terbaik adalah pada P3 (100 µL) karena dapat meningkatkan jumlah sel goblet ileum, akan tetapi pada luas sekret mucus sel goblet ileum masing-masing perlakuan P1, P2, dan P3 tidak berbeda nyata atau sama. UCAPAN TERIMA KASIH Ucapan terima kasih disampaikan kepada projek Penelitian Unggulan Perguruan Tinggi (PUPT) Strategi Three in One dalam produksi Itik Lokal Jawa Barat pada Kondisi Minim Air dengan nomor kontrak 393/UN6.R/PL/2015 pada tanggal 16 Februari 2015 yang didanai Dikti sehingga penelitian ini dapat berjalan dengan baik. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana DAFTAR PUSTAKA A.Muzani., B.Brahmantiyo., C.Sumantri., dan A.Tapyadi. 2005. Pendugaan Jarak Genetik pada Itik Cihateup, Cirebon dan Mojosari. Media Peternakan, Desember 2005, hlm. 109-116 ISSN 0126-0472 Vol. 28 No.3. Castagliuolo. 1998. Colonic Mucin Release in Response to Immobilization Stress is Mast Cell Dependent. Am. J. Physiol. Soc. 274: G1094-G1100. Dudi. 2007. Identifikasi Sifat Kuantitatif Itik Cihateup sebagai Sumberdaya Genetik Unggas Lokal (Identification of Quantitative of Cihateup ducks as local genetic resources). Fakultas Peternakan Universitas Padjadjaran. Jurnal Ilmu Ternak Juni, 2007, Vol.7 No.1. Eroschenko, Victor P. 2010. Atlas Histologi diFiore: Dengan Kolerasi Fungsional Edisi 11. Buku Kedokteran EGC: Jakarta. F.Y.Long., Y.M.Guo., Z.Wang., D.Liu., B.K.Zang., dan X.Yang. 2011. Conjugated Linoleic Acids Alleviate Infectious Bursal Disease Virus-Induced Immunosuppression in Broiler Chickens. 2011 Poultry Science 90:1926-1933. _____________. 2012. Immunology, Health, and Disease: Conjugated Linoleic Acids Alleviate the Immunosuppression of Peripheral Blood T Lymphocytes in Broiler Chickens Exposed to Cyclosporin A. 2012 Poultry Science 91:2431-2437. Fesler dan Peterson. 2013. Conjugated Linoleic Acids Alter Body Composition Differently According to Physiological Age in Mourlard Ducks. 2013 Poultry Science 92:26972704. Food and Agriculture Organization [FAO]. 2006. Probiotics in Food Health and Nutritional Properties and Guidelines for Evaluation. FAO Food and Nutrition Paper. Roma: World Health Organization and Food and Agriculture Organization of The United Nations. Gomperts, B. D., I. M. Kramer and P. E. R.Tatham. 2009. Signal Transductions. Elsevier San Diego, USA. Harnett, W., M. McDonald, G. Preece, M. Patterson and M.E. Parkhouse. 1997. Production of Monoclonal Antibodies Against Excretory-Secretory Products of Adult Male Onchocerca gibsoni. J. of Parasitol. 83 (2): 316-319. J. Li dan I. H. Kim. 2013. Effects of Levan-Type Fructan Supplementation on Growth Performance, Digestibility, Blood Profile, Fecal Microbiota, and Immune Responses after Lipopolysaccharide Challenge in Growing Pigs. J. Anim. Sci. 2013.91:5336– 5343. J.H.Kim,. dkk. 2007. Physiology, Endocrinology, and Reproducion: Effect of Dietary Supplementation with Conjugated Linoleic Acid, with Oleic, Linoleic, or Linolenic Acid, on Egg Quality Characteristics and Fat Accumulation in the Egg Yolk. 2007 Poultry Science 86:1180-1186. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana Junquiera, L.Carlos., Cameiro, Jose., Robert O. Kelly. 1997. Histologi Dasar Edisi ke 8. Buku Kedokteran EGC: Jakarta. K.S.Shim., K.T.Hwang., M.W.Son., dan G.H.Park. 2006. Lipid Metabolism and Peroxidation in Broiler Chicks under Chronic Heat Stress. Asians-Aust. J. Anim. Sci. Vol. 19, No.8:1206-1211. Kaffi S., Hertini Rani, Zulfahmi., A. Mushawwir. 2010. Penggunaan Fruktooligosakarida (FOS) Hasil Isolasi dari Kulit Pisang sebagai Prebiotik pada Ternak Ruminansia. Politeknik Negeri Lampung. Bandar Lampung. Mushawwir dan Latipudin. 2013. Biologi Sintesis Telur: Perspektif Fisiologi, Biokimia dan Molekular Produksi Telur. Fakultas Peternakan Universitas Padjadjaran: Bandung. Mushawwir, A. 2014. Transpor Sel: Paper Ilmiah. Fakultas Peternakan Universitas Padjadjaran: Bandung. Selle, P. H., A. J. Cowieson, dan V. Ravindran. 2009. Consequences of Calcium Interactions with Phytate and Phytase for Poultry and Pigs. Livest. Sci. 124:126–141. Sinurat, A.P. 2000. Penyusunan Ransum Ayam Buras dan Itik. Pelatihan Proyek Pengembangan Agribisnis Peternakan, Dinas Peternakan DKI Jakarta, 20 Juni 2000. Spencer, J. D., K. J. Touchette, H. Liu, G. L. Allee, M. D. Newcomb, M. S. Kerley, dan L. W. Pace. 1997. Effect of spray-dried plasma and fructooligosaccharide on nursery performance and small intestinal morphology of weaned pigs. J. Anim. Sci. 75:1999. Suksombat, W., S.Samitayotin., dan P.Lounglawan. 2006. Effects of Conjugated Linoleic Acid Supplementation in Layer Diet on Fatty Acid Compositions of Egg Yolk and Layer Performances. 2006 Poultry Science 85:1603-1609. Utama, Fajar Hudaya. 2014. Sekret Mucus Sel Goblet Ileum dan Ukuran Usus Halus Puyuh (Coturnix coturnix japonica) yang diberi Bawang Putih (Allium sativum). Fakultas Peternakan. Universitas Padjadjaran, Bandung. Wulandari WA., Hardjasworo., dan Gunawan. 2005. Kajian karakteristik biologis itik Cihateup dari Kabupaten Tasikmalaya dan Garut. Dalam: Mathius IW, Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor, 12-13 September 2005. Bogor (Indonesia): Puslitbangnak. p. 795-803. Xu, Chuanlai., Xudong Chenl., Cheng Ji1., Qiugang Ma1 dan Kai Hao. 2005. Study of the Application of Fructooligosaccharides in Piglets. J. Anim. Sci. 2005. Vol 18, No. 7 : 1011-1016. Xu, Z. R, X. T. Zou, C. H. Hu, M. S. Xia, X. A. Zhan and M. Q. Wang. 2002. Effects of Dietary Fructooligosaccharide on Digestive Enzyme Activities, Intestinal Microflora and Morphology of Growing Pigs. Asian-Aust. J. Anim. Sci. 2002. Vol 15, No. 12 : 1784-1789. Yason, C. V., B. A. Summers dan K. A. Schat. 1987. Pathogenesis of rotavirus infection in various age groups of chickens and turkeys: pathology. Am. J. Vet. Res. 6:927-938. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana Yu Wang, M. A., Tao Zeng, M. D., Shu-eWang, M. A.,Wei Wang, M. A., Qian Wang, M. A., & Hong-Xia Yu, M. A. 2010. Fructooligosaccharides Enhance The Mineral Absorption and Counteract The Adverse Effects of Phytic Acid in Mice. Nutrition, 26, 305–311. Profil Sel Goblet Itik Cihateup ………………………………………………… Indra Permana