Kimia Unsur oleh Sartika Apriani File - e
advertisement

BAB 3
KIMIA UNSUR
3.1 Kelimpahan Unsur-unsur di Alam
3.2 Sifat-sifat Unsur
3.3 Pembuatan dan Manfaat
Beberapa Unsur Logam dan
Senyawanya
3.4 Pembuatan dan Manfaat
Beberapa Unsur Nonlogam dan
Senyawanya
3.5 Unsur Radioaktif
3.6 Penggunaan Radioisotop
STANDAR KOMPETENSI DAN
KOMPETENSI DASAR
STANDAR KOMPETENSI
Memahami karakteristik unsur-unsur penting,
kegunaan dan bahayanya, serta terdapatnya di
alam.
KOMPETENSI DASAR
Mendeskripsikan kecenderungan sifat fisik dan kimia unsur
transisi (titik didih, titik leleh, kekerasan, warna, kelarutan,
kereaktifan, dan sifat khusus lain.
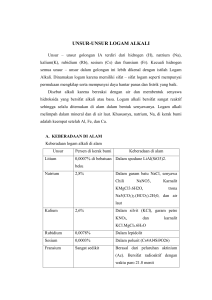
Keberadaan Unsur-unsur di Kulit Bumi
a. Sekitar 90 jenis unsur terdapat di alam, sisanya merupakan
unsur buatan. Sebagian dari unsur tersebut terdapat sebagai
unsur bebas, tetapi lebih banyak yang berupa senyawa.
b. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon,
dan radon) terdapat sebagai unsur bebas.
c. Beberapa unsur logam, yaitu emas, platina, perak, dan
tembaga, juga ditemukan dalam bentuk bebas dan senyawa.
d. Beberapa unsur nonlogam, yaitu oksigen, nitrogen,
belerang, dan karbon.
e. Bahan-bahan alam yang mengandung unsur atau senyawa
tertentu dalam kadar yang relatif besar disebut mineral.
f. Mineral yang secara komersial digunakan sebagai sumber
logam disebut bijih.
Sifat-sifat Kimia Gas Mulia
a. Radon ternyata dapat bereaksi spontan dengan fluorin,
sedangkan xenon memerlukan pemanasan atau
penyinaran untuk memulai reaksi.
b. Kripton lebih sukar, hanya bereaksi dengan fluorin jika
disinari atau jika diberi loncatan muatan listrik.
c. Sementara itu helium, neon, dan argon, ternyata lebih
sukar lagi bereaksi dan belum berhasil dibuat suatu
senyawa dari ketiga unsur itu.
d. Kereaktifan gas mulia bertambah besar sesuai dengan
pertambahan jari-jari atomnya, yaitu dari atas ke bawah.
Sifat-sifat Fisis Halogen
Struktur Halogen
a. Dalam bentuk unsur, halogen (X) terdapat sebagai
molekul diatomik (X2).
b. Molekul X2 dapat mengalami disosiasi menjadi atomatomnya.
X2(g) → 2X(g)
c. Kestabilan molekul halogen (X2) berkurang dari Cl2 ke I2.
d. Hal itu sesuai dengan pertambahan jari-jari atomnya,
sehingga energi ikatan dari Cl–Cl ke I–I berkurang.
e. Akan tetapi, energi ikatan F–F ternyata lebih kecil
daripada ikatan Cl–Cl karena kecilnya jari-jari atom
fluorin.
Wujud Halogen
Pada suhu kamar, fluorin dan klorin berupa gas,
bromin berupa zat cair yang mudah menguap,
sedangkan iodin berupa zat padat yang mudah
menyublim.
Pemanasan iodin padat pada tekanan atmosfir tidak
membuat unsur itu meleleh, tetapi langsung
menguap (menyublim).
Warna dan Aroma Halogen
a. Fluorin berwarna kuning muda, klorin berwarna hijau
muda (“kloros” berarti hijau), bromin berwarna merah
tua, iodin padat berwarna hitam, sedangkan uap iodin
berwarna ungu.
b. Semua halogen berbau rangsang dan menusuk, serta
bersifat racun.
Kelarutan Halogen
Kelarutan dalam air berkurang dari fluorin ke iodin.
Sifat-sifat Kimia
Halogen merupakan kelompok
unsur nonlogam yang paling reaktif.
Namun demikian, kereaktifannya
menurun dari fluorin ke iodin.
Reaksi-reaksi Halogen
a. Reaksi dengan logam
Halogen bereaksi dengan sebagian besar logam
menghasilkan halida logam dengan bilangan
oksidasi tertinggi.
b. Reaksi dengan hidrogen
Semua halogen bereaksi dengan hidrogen
membentuk hidrogen halida (HX).
c. Reaksi dengan nonlogam dan metaloid tertentu
Halogen bereaksi dengan sejumlah nonlogam
dan metaloid.
d. Reaksi dengan air
Fluorin bereaksi hebat dengan air
membentuk HF dan membebaskan
oksigen.
e. Reaksi dengan basa
Klorin, bromin, dan iodin mengalami
reaksi disproporsionasi dalam basa.
f. Reaksi antarhalogen
Antarhalogen dapat bereaksi membentuk
senyawa antarhalogen.
Daya Oksidasi Halogen
Halogen merupakan pengoksidasi kuat. Daya pengoksidasi
halogen menurun dari atas ke bawah. Sebaliknya, daya reduksi ion
halida (X–) bertambah dari atas ke bawah. Jadi, I– merupakan
reduktor terkuat, sedangkan F– merupakan reduktor terlemah.
Daya oksidasi halogen atau daya pereduksi ion halida dicerminkan
oleh potensial elektrodenya.
Semakin positif harga potensial elektrode, semakin mudah
mengalami reduksi, berarti merupakan pengoksidasi kuat.
Reaksi Pendesakan Antarhalogen
Halogen yang bagian atas dapat mengoksidasi halida
yang bagian bawahnya, tetapi tidak sebaliknya.
Contoh:
Klorin dapat mendesak bromin, tetapi sebaliknya
bromin tidak dapat mendesak klorin.
Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(l)
Br2(l) + 2NaCl(aq) → (tidak ada reaksi)
Reaksi-reaksi Logam Alkali
1. Reaksi dengan Air
Semua logam alkali bereaksi dengan air
membentuk basa dan gas hidrogen.
2L(s) + 2H2O(l) 2LOH(aq) + H2(g)
2. Reaksi dengan Hidrogen
Jika dipanaskan, logam alkali dapat bereaksi dengan
gas hidrogen membentuk hidrida, suatu senyawa ion
yang hidrogennya mempunyai bilangan oksidasi –1.
2L(s) + H2(g) 2LH(s)
3. Reaksi dengan Oksigen
Logam alkali terbakar dalam oksigen membentuk oksida,
peroksida atau superoksida.
4L(s) + O2(g) 2L2O(s) L
Jika oksigen berlebihan, natrium dapat membentuk peroksida.
2Na(s) + O2(g) Na2O2(s)
Kalium, rubidium, dan sesium dapat membentuk superoksida
dalam oksigen berlebihan.
L(s) + O2(g) LO2(s) (L = K, Rb, Cs)
Reaksi dengan
Halogen
Logam alkali bereaksi hebat dengan
halogen membentuk garam halida.
2L(s) + X2 → 2LX(s)
Beberapa Reaksi Logam Alkali Tanah
1. Reaksi dengan Air
Kalsium, strontium, dan barium bereaksi baik
dengan air membentuk basa dan gas hidrogen.
Magnesium bereaksi sangat lambat dengan air
dingin dan sedikit lebih baik dengan air panas,
sedangkan berilium tidak bereaksi.
M(s) + 2H2O(l) → M(OH)2(aq) + H2(g)
2. Reaksi dengan Udara
Semua logam alkali tanah terkorosi terus-menerus
di udara membentuk oksida, hidroksida atau
karbonat, kecuali berilium dan magnesium.
2M(s) + O2(g) → 2MO(s)
3M(s) + N2(g) → M3N2(s)
3. Reaksi dengan Halogen (X2)
Semua logam alkali tanah bereaksi dengan halogen
membentuk garam halida.
M(s) + X2(g) → MX2(s)
4. Reaksi dengan asam dan basa
Semua logam alkali tanah bereaksi dengan asam
kuat (seperti HCl) membentuk garam dan gas
hidrogen. Reaksi makin hebat dari Be ke Ba.
Be juga bereaksi dengan basa kuat, membentuk
Be(OH)4 2 – dan gas H2.
Reaksi Nyala Logam Alkali dan Alkali Tanah
Kelarutan Senyawa Logam Alkali Tanah
Salah satu perbedaan logam alkali dari alkali tanah adalah dalam hal
kelarutan senyawanya. Senyawa logam alkali pada umumnya mudah larut
dalam air, sedangkan senyawa logam alkali tanah banyak yang sukar larut.
Grafik Titik Leleh Unsur-unsur Periode Ketiga
Grafik Energi ionisasi Unsur-unsur Periode Ketiga
Sifat Logam dan Nonlogam
a. Natrium, magnesium, dan aluminium merupakan logam
sejati.
b. Ketiga unsur itu merupakan konduktor listrik dan panas
yang baik, serta menunjukkan kilap logam yang khas.
c. Silikon tergolong metaloid dan bersifat semikonduktor.
Fosforus, belerang, dan klorin merupakan nonlogam.
Padatan ketiga unsur itu tidak menghantar listrik.
d. Secara kimia, sifat nonlogam dari fosforus, belerang, dan
klorin tercermin dari kemampuannya membentuk ion
negatif.
Sifat Pereduksi dan Pengoksidasi Unsur
Periode Ketiga
a. Daya pereduksi unsur-unsur periode ketiga
berkurang dari kiri ke kanan, sebaliknya daya
pengoksidasinya bertambah.
b. Jadi, pereduksi terkuat adalah natrium,
sedangkan pengoksidasi terkuat adalah klorin.
c. Kecenderungan tersebut sesuai dengan energi
ionisasi yang cenderung bertambah dari kiri ke
kanan.
Sifat-sifat Umum Unsur Transisi
Unsur transisi mempunyai sifat-sifat khas yang
membedakannya dari unsur golongan utama, antara lain:
1. Sifat logam, semua unsur transisi tergolong logam dengan
titik cair dan titik didih yang relatif tinggi.
2. Bersifat paramagnetik (sedikit tertarik ke dalam medan
magnet).
3. Membentuk senyawa-senyawa yang berwarna.
4. Mempunyai beberapa tingkat oksidasi.
5. Membentuk berbagai macam ion kompleks.
6. Berdaya katalitik, banyak unsur transisi atau senyawanya
yang berfungsi sebagai katalis, baik dalam proses industri
maupun dalam metabolisme.
Sifat-sifat Unsur Transisi Periode Keempat
Tingkat Oksidasi Unsur Transisi Periode Keempat
Sifat Magnet
a. Unsur transisi periode keempat dan senyawa-senyawanya
umumnya bersifat paramagnetik.
b. Feromagnetisme hanya diperlihatkan oleh beberapa
logam, yaitu besi, kobal, dan nikel.
c. Sifat magnet zat berkaitan dengan konfigurasi
elektronnya.
d. Zat yang bersifat paramanetik mempunyai setidaknya
satu elektron tak berpasangan. Semakin banyak elektron
tak berpasangan, semakin bersifat paramagnetik.
Warna Senyawa Unsur Transisi
Periode Keempat
a. Pada umumnya unsur-unsur transisi periode keempat
membentuk senyawa berwarna, baik dalam bentuk padat
maupun dalam larutan.
b. Warna senyawa dari unsur transisi juga berkaitan dengan
adanya subkulit d yang terisi tidak penuh.
Senyawa dari Sc3+ dan Ti3+ tidak berwarna karena subkulit
3d-nya kosong.
d. Senyawa dari Zn2+ juga tidak berwarna karena subkulit
3d-nya terisi penuh.
c.
Struktur Ion Kompleks
Ion kompleks adalah ion yang terbentuk dari suatu kation tunggal (biasanya ion
logam transisi) yang terikat langsung pada beberapa anion atau molekul netral.
Ion kompleks terdiri dari ion atau atom pusat dan ligan-ligan.
Ligan-ligan terikat pada ion pusat melalui ikatan kovalen koordinat.
Beberapa Contoh Ligan
Bilangan Koordinasi
Jumlah ligan sederhana atau jumlah ikatan koordinasi yang
dibentuk oleh satu ion pusat disebut bilangan koordinasi ion
pusat itu.
Muatan Ion Kompleks
Muatan ion kompleks sama dengan jumlah muatan ion
pusat dengan ligan-ligannya.
• Latihan Soal
• Tulislah rumus ion kompleks dg data sbb:
• A. Ion pusat Al3+, ligan molekul air dan OH-,
bilangan koordinasi 6 dan muatan ion
kompleks -1
• B. Ion pusat Cr3+, ligan molekul NH3 dan anion
Cl-, bil.koord 6, muatan ion kompleks +1
• C. Ion pusat Fe2+, ligan CN-, muatan ion
kompleks -4
• D. Ion pusat Ag+, ligan S2O32- , bil.koord 2
Tata Nama Ion Kompleks
a. Nama ion kompleks, baik kation ataupun anion,
terdiri atas dua bagian yang ditulis dalam satu
kata. Bagian pertama menyatakan jumlah dan
nama ligan, bagian kedua menyatakan nama ion
pusat dan bilangan oksidasinya. Bilangan oksidasi
ion pusat ditulis dengan angka Romawi dalam
tanda kurung.
b. Bila terdapat lebih dari sejenis ligan, maka urutan
penulisannya adalah berdasarkan urutan abjad dari
nama ligan tersebut (ligan Cl– dianggap bermula
dengan huruf c bukan k).
Tata Nama Ion Kompleks
Pembuatan Natrium
Sel Downs
untuk
elektrolisisi
leburan NaCl
Katode :
Anode :
NaCl(l) Na+(l) + Cl–(l)
Na+(l) + e Na(l)
2Cl–(l) Cl2(g) + 2e
Penggunaan Natrium dan
Senyawa Natrium
1. Natrium
Penggunaan yang semakin penting dari natrium
adalah sebagai cairan pendingin (coolant) pada
reaktor nuklir.
Selain itu, karena merupakan reduktor kuat,
natrium digunakan pada pengolahan logam-logam
tertentu seperti litium, kalium, zirkonium dan
logam alkali yang lebih berat.
2. Natrium Klorida (NaCl)
a. Natrium Klorida sebagai bahan baku untuk
membuat natrium, klorin, dan senyawasenyawa natrium seperti NaOH dan natrium
karbonat (Na2CO3);
b. dalam industri susu; mengawetkan ikan dan
daging;
c. mencairkan salju di jalan raya di negara yang
bermusim dingin;
d. regenerasi alat pelunak air;
e. pengolahan kulit;
f. sebagai bumbu masak.
3. Natrium Hidroksida
Natrium hidroksida digunakan terutama dalam industri
sabun, detergen, pulp, dan kertas, pengolahan bauksit
untuk pembuatan aluminium, tekstil, plastik, pemurnian
minyak bumi, serta untuk membuat senyawa natrium
lainnya seperti natrium hipoklorit.
4. Natrium Karbonat
Natrium karbonat digunakan untuk pembuatan kaca.
5. Natrium Bikarbonat
Natrium bikarbonat disebut soda kue untuk memekarkan
adonan kue sehingga menjadi empuk karena adanya
rongga-rongga gas di dalamnya.
Penggunaan Magnesium
a. Kegunaan utama magnesium adalah untuk membuat
logam-campur.
b. Paduan magnesium dengan aluminium, yang disebut
magnalium, merupakan logam yang kuat tetapi ringan,
resisten terhadap asam maupun basa, serta tahan
korosi.
c. Paduan itu digunakan untuk membuat komponen
pesawat terbang, rudal, bak truk, serta berbagai
peralatan lainnya.
d. Magnesium digunakan untuk membuat kembang api.
Pembuatan Magnesium
Pengolahan magnesium dari air laut
Pembuatan Alumunium
Sel Hall-Heroult untuk pembuatan aluminium dari
elektrolisis lelehan Al2O3 (larutan Al2O3 dalam kriolit)
Penggunaan Aluminium dan Senyawanya
1.
2.
3.
4.
5.
6.
Sektor industri otomotif: untuk membuat bak truk dan komponen
kendaraan bermotor lainnya, untuk membuat badan pesawat terbang.
Sektor pembangunan perumahan: untuk kusen pintu dan jendela.
Sektor industri makanan: aluminium foil dan kaleng aluminium untuk
kemasan berbagai jenis produk makanan/minuman.
Sektor lainnya: untuk kabel listrik, perabotan rumah tangga, dan barang
kerajinan.
Membuat termit, yaitu campuran serbuk aluminium dengan serbuk
besi(III) oksida.
Termit digunakan untuk mengelas baja di tempat, misalnya untuk
menyambung rel kereta api.
Penggunaan Aluminium Sulfat
[Al2(SO4)3]
Pembuatan Besi
Gambar di samping merupakan
tanur tiup.
a. Bijih besi, kokas, dan batu kapur
dimasukkan dari bagian atas
tungku, dan udara panas
dihembuskan dari bagian
bawah.
b. Suhu maksimum terjadi di
bagian bawah tempat besi cair
dan terak dikumpulkan.
Penggunaan Besi
a. Besi adalah logam yang paling luas dan paling banyak
penggunaannya karena:
1. bijih besi relatif melimpah dan tersebar di berbagai
penjuru dunia;
2. pengolahan besi relatif mudah dan murah;
3. sifat-sifat besi mudah dimodifikasi.
b. Kegunaan utama dari besi adalah untuk membuat baja.
c. Baja adalah istilah yang digunakan untuk semua logam
campur (aliase) dari besi.
d. Salah satu contoh baja yang paling terkenal adalah baja
tahan karat (stainless steels), yang merupakan paduan besi
dengan kromium (14 –18%) dan nikel (7 – 9%).
Pembuatan Baja
Logam-logam campur dari besi disebut baja.
Perubahan yang harus dilakukan pada
pembuatan baja dari besi gubal, yaitu:
1. menurunkan kadar karbon dari 3 – 4%
menjadi 0 – 1,5%,
2. menghilangkan pengotor seperti Si, Mn,
dan P,
3. menambahkan logam-logam campur
seperti Ni dan Cr, sesuai dengan jenis
baja yang akan dibuat.
Besi gubal cair dari tanur
tiup dituangkan ke dalam
tungku oksigen untuk
diubah menjadi baja.
Beberapa Jenis Baja
Pembuatan Tembaga
a. Pengolahan tembaga melalui beberapa tahap, yaitu flotasi,
pemanggangan, peleburan, pengubahan, dan elektrolisis.
b. Pada umumnya, bijih tembaga hanya mengandung 0,5% Cu.
c. Melalui pengapungan dapat diperoleh bijih pekat yang
mengandung 20 – 40% Cu.
d. Bijih pekat itu kemudian dipanggang untuk mengubah besi
sulfida menjadi besi oksida, sedangkan tembaga tetap
berupa sulfida.
4CuFeS2 + 9O2 → 2Cu2S + 2Fe2O3 + 6SO2
e. Bijih yang sudah melalui pemanggangan kemudian
dilebur sehingga bahan tersebut mencair dan
terpisah menjadi dua lapisan.
f. Lapisan bawah disebut ”copper matte” yang
mengandung Cu2S dan besi cair, sedangkan lapisan
atas merupakan terak silikat yang antara lain
mengandung FeSiO3.
g. Selanjutnya, ”copper matte” dipindahkan ke dalam
tungku lain dan ditiupkan udara sehingga terjadi
reaksi redoks yang menghasilkan tembaga lepuh.
h. Tembaga lepuh adalah tembaga yang mengandung
gelembung gas SO2 beku.
i. Tembaga lepuh mengandung 98 – 99% Cu dengan
berbagai jenis pengotor.
j. Pemurnian tembaga dilakukan dengan elektrolisis.
k. Tembaga lepuh digunakan sebagai anode,
sedangkan tembaga murni digunakan sebagai
katodenya.
l. Elektrolit yang digunakan adalah larutan CuSO4.
m. Selama elektrolisis, Cu dipindahkan dari anode ke
katode.
n. Dengan menggunakan potensial tertentu, bahan
pengotor dapat terpisah.
Penggunaan Tembaga
a. Tembaga adalah logam yang berwarna kuning merah dan
tergolong logam yang kurang aktif.
b. Dalam udara lembab, tembaga terkorosi secara perlahanlahan.
c. Mula-mula warnanya menjadi coklat karena terbentuknya
lapisan tipis CuO atau CuS.
d. Lama-kelamaan menjadi berwarna hijau karena
terbentuknya tembaga karbonat basa, Cu2(OH)2CO3.
e. Hal seperti itu sering terlihat pada patung atau barang
kerajinan yang terbuat dari tembaga atau perunggu.
Timah
a. Timah adalah logam yang relatif lunak, berwarna
putih perak dan tahan karat.
b. Timah terutama digunakan untuk membuat kaleng
kemasan, seperti untuk roti, susu, cat, dan buah.
c. Kegunaan lain dari timah adalah untuk membuat
logam campur, misalnya perunggu (paduan timah,
tembaga, dan zink) dan solder.
Kromium
a. Kromium adalah logam yang sangat mengkilap, keras, dan
tahan karat.
b. Lebih dari separo produksi kromium digunakan dalam
industri logam dan sekitar sepertiga lainnya dalam refraktori
(pelapis tahan panas bagi tanur bersuhu tinggi).
Emas
Emas tergolong logam mulia, berwarna kuning mengkilap,
tahan karat, mudah ditempa dan dapat diukur.
Karbon dan Senyawa Karbon
Intan
a. Sebagian besar intan alam digunakan untuk
perhiasan.
b. Intan alam yang tidak cukup baik untuk
perhiasan dan intan buatan digunakan untuk
membuat alat pemotong kaca, gerinda, dan
mata bor.
Grafit
1. Sebagai anode dalam batu baterai dan dalam
berbagai proses industri yang menggunakan
elektrolisis, misalnya pada peleburan aluminium.
2. Grafit dicampur dengan tanah liat untuk
membuat pensil dan bahan kosmetik.
3. Bahan pelumas.
4. Sebagai komponen dalam pembuatan komposit.
Karbon Monoksida (CO)
1. Sebagai reduktor pada pengolahan
berbagai jenis logam, misalnya besi.
2. Sebagai bahan baku untuk membuat
metanol.
3. Merupakan komponen dari berbagai jenis
bahan bakar gas, seperti gas air dan gas
kokas.
Karbon Dioksida (CO2)
1. Karbon dioksida padat yang disebut
es kering (dry ice) digunakan sebagai
pendingin.
2. Untuk memadamkan kebakaran.
3. Untuk membuat minuman ringan
(soft drink).
Silikon
1. Silikon dibuat dari silika dengan kokas sebagai reduktor.
2. Penggunaan penting dari silikon adalah untuk membuat
transistor, chips komputer, dan sel surya.
3. Untuk tujuan itu diperlukan silikon ultra murni. Silikon
juga digunakan dalam berbagai jenis aliase dengan besi
(baja).
4. Baja biasa mengandung sekitar 0,03% silikon, baja silikon
mengandung sekitar 2,5 - 4% silikon, sedangkan durion
mengandung 15% silikon.
5. Durion bersifat keras tetapi rapuh dan sangat tahan karat.
6. Durion digunakan untuk membuat peralatan industri
yang berkontak dengan asam.
Nitrogen dan
Senyawa Nitrogen
Dalam industri, nitrogen diperoleh dari udara.
Prosesnya berlangsung dalam dua tahap, yaitu:
1. pencairan udara, dan
2. distilasi bertingkat udara cair.
Penggunaan Nitrogen
1. Sebagian besar produksi nitrogen digunakan untuk
membuat amonia (NH3).
2. Oleh karena sifatnya yang kurang reaktif, nitrogen
digunakan untuk membuat atmosfer inert dalam
berbagai proses yang terganggu oleh oksigen, misalnya
dalam industri elektronika.
3. Nitrogen juga digunakan sebagai atmosfer inert dalam
makanan kemasan untuk memperpanjang masa
penggunaannya.
4. Nitrogen cair digunakan sebagai pendingin untuk
menciptakan suhu sangat rendah.
Penggunaan Amonia
1. Membuat pupuk, misalnya urea {CO(NH2)2}, dan ZA
{(NH4)2SO4}.
2. Untuk membuat senyawa nitrogen yang lain, seperti
asam nitrat (HNO3), amonium klorida (NH4Cl), dan
amonium nitrat.
3. Dalam pabrik es, digunakan sebagai pendingin
(refrigerant) karena amonia cair mudah menguap dan
mempunyai kalor penguapan yang cukup besar.
4. Untuk membuat hidrazin, N2H4.
Penggunaan Asam Nitrat
1. untuk membuat amonium nitrat, NH4NO3,
dan digunakan sebagai pupuk.
2. digunakan dalam percobaan di
laboratorium
3. digunakan dalam industri kimia seperti
industri bahan peledak, plastik, dan obat.
Fosforus dan
Senyawa Fosforus
Fosforus mempunyai dua bentuk alotropi,
yaitu fosforus putih dan fosforus merah.
Pembuatan Fosforus
1. Sumber fosforus terpenting yaitu batuan fosfat,
suatu bahan kompleks yang mengandung
flourapatit (Ca3(PO4)2.CaF2).
2. Senyawa Ca3(PO4)2 dipisahkan dari batuan fosfat
kemudian dipanaskan dengan pasir (SiO2) dan
kokas (C).
3. Uap fosforus yang terbentuk ditampung dalam
air.
Penggunaan Fosforus
1. Sebagian besar produksi fosforus digunakan
untuk membuat asam fosfat.
2. Penggunaan akhir yang utama dari senyawa
fosforus adalah pupuk dan detergen.
3. Fosforus merah dan senyawa fosforus tertentu
digunakan pada pembuatan korek api.
4. Berbagai senyawa organofosfat digunakan
sebagai pestisida.
Penggunaan Asam Fosfat
Asam fosfat digunakan untuk membuat
pupuk superfosfat juga untuk membuat
detergen, bahan pembersih lantai,
insektisida, dan makanan hewan.
Penggunaan Oksigen
1. Untuk pernapasan para penyelam, angkasawan, atau
penderita penyakit tertentu.
2. Sebagian besar dari produksi oksigen digunakan dalam
industri baja, yaitu mengurangi kadar karbon dalam besi
gubal.
3. Bersama-sama dengan gas asetilena digunakan untuk
mengelas baja.
4. Oksigen cair bersama dengan hidrogen cair digunakan
sebagai bahan bakar roket untuk mendorong pesawat
ruang angkasa. Oksigen juga digunakan dalam berbagai
industri kimia untuk mengoksidasikan berbagai zat.
Belerang dan Senyawa Belerang
Belerang padat mempunyai dua bentuk alotropi, yaitu belerang
rombik dan belerang monoklinik.
Deposit belerang yang terdapat di bawah permukaan
ditambang menurut cara Frasch.
Penggunaan Belerang
Penggunaan utama dari belerang adalah untuk
pembuatan asam sulfat.
Asam sulfat digunakan untuk:
1. industri pupuk
2. industri cat/zat warna
3. detergen
4. industri logam
Flourin dan Senyawa Flourin
Fluorin digunakan untuk membuat senyawa
klorofluorokarbon (CFC) yang dikenal dengan
nama dagang freon.
Freon digunakan sebagai cairan pendingin pada
mesin-mesin pendingin seperti AC dan lemari es.
Bromin dan Senyawa Bromin
1. Bromin digunakan terutama untuk membuat
etilenbromida, C2H4Br2, suatu aditif yang
dicampurkan ke dalam bensin bertimbel untuk
mengikat timbel sehingga tidak melekat pada
silinder atau piston.
2. Bromin juga digunakan untuk membuat AgBr.
Iodin dan Senyawa Iodin
1. Iodin digunakan dalam obat-obatan.
2. Iodoform digunakan sebagai antiseptik.
3. Iodin juga digunakan untuk membuat perak
iodida yang digunakan bersama-sama dengan
AgBr dalam film fotografi.
4. Natrium iodat atau natrium iodida
dicampurkan ke dalam garam dapur.
Sinar-sinar Radioaktif
Sinar-sinar radioaktif. Zat radioaktif alami dapat memancarkan tiga jenis sinar, yaitu sinar α,
β, γ. Sinar α dan β terdiri atas partikel bermuatan listrik, sedangkan sinar γ merupakan
gelombang elektromagnet. Sinar β bermuatan positif sehingga dibelokkan ke kutup negatif;
sinar bermuatan negatif sehingga dibelokkan ke kutup positif. Sinar γ tidak bermuatan,
sehingga tidak dipengaruhi medan magnet atau medan listrik. Partikel sinar β lebih ringan
daripada partikel sinar α, oleh karena itu sinar β mengalami pembelokan yang lebih besar.
Daya tembus sinar alfa, beta, dan gamma.
Sinar alfa dapat ditahan oleh selembar kertas, sedangkan sinar
gamma dapat menembus pelat timbel yang cukup tebal.
Persamaan Inti
Misalnya, peluruhan uranium yang disertai pemancaran partikel
alfa dipaparkan dengan persamaan inti sebagai berikut.
Persamaan inti juga mengikuti azas kesetaraan.
Suatu persamaan inti dikatakan setara jika muatan (nomor atom)
dan massa di ruas kiri sama dengan di ruas kanan.
Untuk contoh di atas:
Jumlah muatan di ruas kiri = 92; di ruas kanan = 90 + 2 = 92.
Nomor massa di ruas kiri = 238; di ruas kanan = 234 + 4 = 238.
Transmutasi Buatan
Reaksi transmutasi biasanya diringkaskan dengan
notasi sebagai berikut.
dengan, T = inti sasaran (target)
x = partikel yang ditembakkan
y = partikel hasil
P = inti baru (produk)
Laju Peluruhan
Secara matematis, laju peluruhan dinyatakan dengan
persamaan sebagai berikut.
dengan, v = laju peluruhan (keaktifan), yaitu banyaknya
peluruhan dalam satu satuan waktu.
λ = tetapan peluruhan (serupa dengan k dalam
persamaan laju reaksi), nilainya bergantung pada
jenis radioisotop.
N = jumlah nuklida radioaktif dalam contoh.
Hubungan antara fraksi zat yang tersisa dengan waktu
paro dari rumus sebagai berikut.
Oleh karena keaktifan sebanding dengan
jumlah atom radioaktif, maka:
At = keaktifan pada waktu t
A0 = keaktifan awal
Radioisotop Sebagai Perunut
a. Bidang Kedokteran
Berbagai jenis radioisotop digunakan sebagai perunut
untuk mendeteksi (diagnosis) berbagai jenis penyakit
antara lain teknesium-99, talium-201, iodin-131, natrium24, xenon-133, fosforus-32, dan besi-59.
b. Bidang Kimia dan Biologi
Dalam ilmu kimia, perunut radioaktif digunakan untuk
mempelajari mekanisme reaksi dan proses biologis.
1. Mempelajari Kesetimbangan Dinamis
2. Mempelajari Reaksi Pengesteran
3. Mempelajari Mekanisme Reaksi Fotosintesis
Radioisotop Sebagai Sumber Radiasi
a. Bidang Kedokteran
1. Steriliasasi radiasi
2. Terapi tumor atau kanker
b. Bidang Pertanian
1. Pemulihan tanaman
2. Penyimpanan makanan
c. Bidang Pertanian
1. Pemeriksaan tanpa merusak
2. Pengawetan bahan