unsur-unsur logam alkali
advertisement
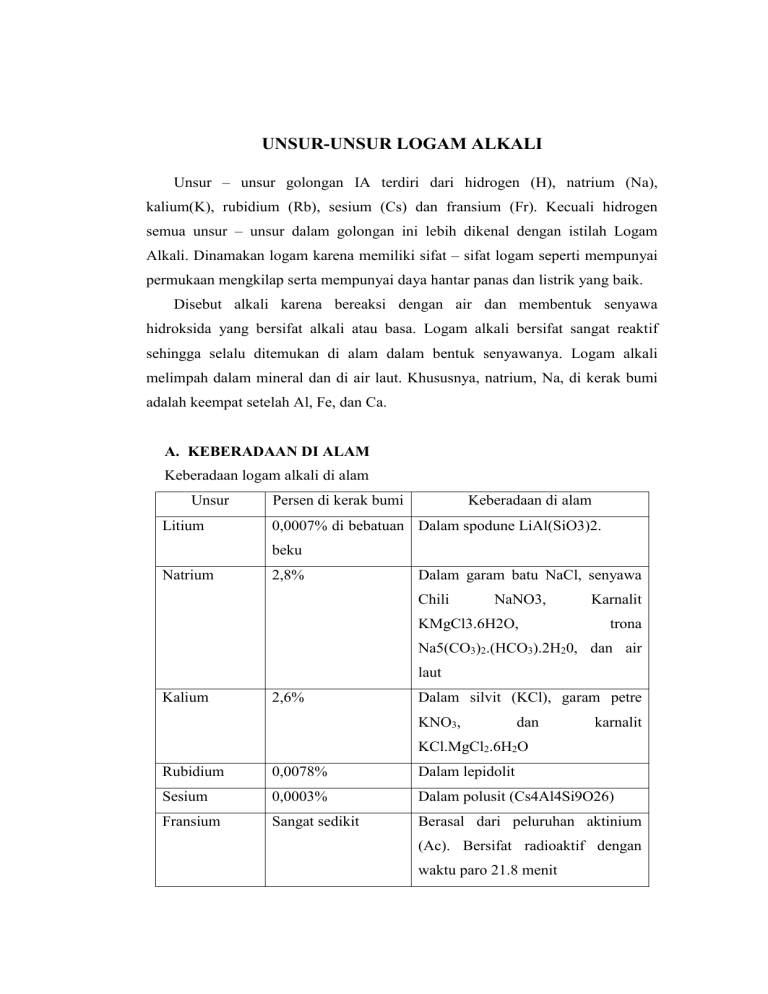
UNSUR-UNSUR LOGAM ALKALI Unsur – unsur golongan IA terdiri dari hidrogen (H), natrium (Na), kalium(K), rubidium (Rb), sesium (Cs) dan fransium (Fr). Kecuali hidrogen semua unsur – unsur dalam golongan ini lebih dikenal dengan istilah Logam Alkali. Dinamakan logam karena memiliki sifat – sifat logam seperti mempunyai permukaan mengkilap serta mempunyai daya hantar panas dan listrik yang baik. Disebut alkali karena bereaksi dengan air dan membentuk senyawa hidroksida yang bersifat alkali atau basa. Logam alkali bersifat sangat reaktif sehingga selalu ditemukan di alam dalam bentuk senyawanya. Logam alkali melimpah dalam mineral dan di air laut. Khususnya, natrium, Na, di kerak bumi adalah keempat setelah Al, Fe, dan Ca. A. KEBERADAAN DI ALAM Keberadaan logam alkali di alam Unsur Litium Persen di kerak bumi Keberadaan di alam 0,0007% di bebatuan Dalam spodune LiAl(SiO3)2. beku Natrium 2,8% Dalam garam batu NaCl, senyawa Chili NaNO3, KMgCl3.6H2O, Karnalit trona Na5(CO3)2.(HCO3).2H20, dan air laut Kalium 2,6% Dalam silvit (KCl), garam petre KNO3, dan karnalit KCl.MgCl2.6H2O Rubidium 0,0078% Dalam lepidolit Sesium 0,0003% Dalam polusit (Cs4Al4Si9O26) Fransium Sangat sedikit Berasal dari peluruhan aktinium (Ac). Bersifat radioaktif dengan waktu paro 21.8 menit Garam batu (NaCl), silvit (KCl), dan karnalit (KMgCl3.6H2O) berasal dari endapan yang terbentuk akibat penguapan laut dahuu kala. Karena perbedaan kelarutan, garam – garam mengendap tidak bersamaan, tetapi satu persatu sehingga terbentuk lapisan – lapisan garam yang relatif murni. Garam di tambang dengan cara menyemprotkan air untuk melarutan garam, kemudian memompa larutan garam tersebut kepermukaan. Berikut ini tabel kadar unsur-unsur alkali di kerak bumi dalam satuan bpj (bagian per sejuta). UNSUR KADAR (bpj) Li 65 Na 28.300 K 25.900 Rb 310 Cs 7 Unsur yang paling banyak adalah Na dan K. Kedua unsur ini banyak terdapat dalam air laut dalam bentuk senyawa NaCl dan KCl. Natrium di alam dijumpai sebagai NaCl dalam air laut dan mineral halit, kalium sebagai KCl dalam bijih silvit, karnalit (KCl.MgCl2.6H2O), dan feldspaat (K2O.Al2O3.3SiO2). Unsur alkali lain sedikit sekali dijumpai, sedangkan fransium bersifat radioaktif.Adapun logam Li, Cs, Rb terdapat dalam mineral fosfat trifilit dan mineral silikat lepidolit dapat ditemukan litium yang bercampur alumunium. Li kelimpahan 6Li kemungkinan hanya 3,75% di alam oleh karena itu 7Li memiliki kelimpahan sampai 96,25%. Rb ( rubidium ) paling banyak ditemukan di kerak bumi. Rb ada di polucite luecite dan zinnwaldite yang terkandung sekitar 1% dan dalam bentuk oksida. Rb ditemukan di lepidolite sebanyak 15%. a. Litium Litium tidak ditemukan sebagai unsur tersendiri di alam; ia selalu terkombinasi dalam unit-unit kecil pada batu-batuan berapi dan pada sumber-sumber mata air. Mineral-mineral yang mengandung litium contohnya: lepidolite, spodumeme, petalite, dan amblygonite. Di Amerika Serikat, litium diambil dari air asin di danau Searles Lake, di negara bagian California dan Nevada. Deposit quadramene dalam jumlah besar ditemukan di California Utara. Logam ini diproduksi secara elektrolisis dari fusi klorida. Secara fisik, litium tampak keperak-perakan, mirip natrium (Na) dan kalium (K), anggota seri logam alkali. Litium bereaksi dengan air, tetapi tidak seperti natrium. Litium memberikan nuansa warna pelangi yang indah jika terjilat lidah api, tetapi ketika logam ini terbakar benar-benar, lidah apinya berubah menjadi putih.Di alam terdapat secara bebas, tetapi dalam bentuk senyawa seperti spodomene [LiAl(SiO3)2] dan senyawa pollucit [H2Cs4Al4(SiO3)9]. b. Natrium Natrium banyak ditemukan di bintang-bintang. Garis D pada spektrum matahari sangat jelas. Natrium juga merupakan elemen terbanyak keempat di bumi, terkandung sebanyak 2.6% di kerak bumi. Unsur ini merupakan unsur terbanyak dalam grup logam alkali.Unsure natrium dialam juga ditemukan dalam bentuk garam-garam mineral seperti natrium klorida (NaCl), natrium karbonat (Na2CO3), dan Natrium Sulfat (Na2SO4). c. Kalium Logam ini merupakan logam ketujuh paling banyak dan terkandung sebanyak 2.4% (berat) di dalam kerak bumi. Kebanyakan mineral kalium tidak terlarut dalam air dan unsur kalium sangat sulit diambil dari mineral-mineral tersebut. Mineral-mineral tertentu, seperti sylvite, carnalite, langbeinite, dan polyhalite ditemukan di danau purba dan dasar laut yang membentuk deposit dimana kalium dan garamgaramnya dengan mudah dapat diambil. Kalium ditambang di Jerman, negara bagian-negara bagian New Mexico, California, dan Utah. Deposit besar yang ditemukan pada kedalaman 3000 kaki di Saskatchewan, Kanada diharapkan menjadi tambang penting di tahun-tahun depan. Kalium juga ditemukan di samudra, tetapi dalam jumlah yang lebih sedikit ketimbang natrium. d. Rubidium Unsur ini ternyata ditemukan lebih banyak dari yang diperkirakan beberapa tahun lalu. Sekarang ini, rubidium dianggap sebagai elemen ke-16 yang paling banyak ditemukan di kerak bumi. Rubidium ada di pollucite, leucite dan zinnwaldite, yang terkandung sekitar 1% dan dalam bentuk oksida. Ia ditemukan di lepidolite sebanyak 1.5% dan diproduksi secara komersil dari bahan ini. Mineral-mineral kalium, seperti yang ditemukan pada danau Searles, California, dan kalium klorida yang diambil dari air asin di Michigan juga mengandung rubidium dan sukses diproduksi secara komersil. Elemen ini juga ditemukan bersamaan dengan cesium di dalam depositpollucite di danau Bernic, Manitoba. e. Sesium Sesium merupakan logam alkali yang terdapat di lepidolite, pollucte (silikat aluminum dan Sesium basah) dan di sumber-sumber lainnya. Salah satu sumber terkaya yang mengandung Sesium terdapat di danau Bernic di Manitoba, Kanada. Deposit di danau tersebut diperkirakan mengandung 300.000 ton pollucite yang mengandung 20% Sesium. Unsur ini juga dapat diisolasi dengan cara elektrolisis fusi sianida dan dengan beberapa metoda lainnya. Sesium murni yang bebas gas dapat dipersiapkan dengan cara dekomposisi panas Sesium azida. f. Fransium Elemen ini ditemukan pada tahun 1993 oleh Marguerite Perey, ilmuwan Curie Institute di Paris. Fransium yang merupakan unsur terberat seri logam-logam alkali, muncul sebagai hasil disintegrasi unsur actinium. Ia juga bisa dibuat secara buatan dengan membombardir thorium dengan proton-proton. Walau fransium secara alami dapat ditemukan di mineralmineral uranium, kandungan elemen ini di kerak bumi mungkin hanya kurang dari satu ons. Fransium juga merupakan elemen yang paling tidak stabil di antara 101 unsur pertama di tabel periodik. Ada 33 isotop fransium yang dikenal. Yang paling lama hidup 223Fr (Ac, K), anak 227Ac, memiliki paruh waktu selama 22 menit. Ini satu-satunya isotop fransium yang muncul secara alami. Karena isotop-isotop fransium lainnya sangat labil, sifat-sifat fisik mereka diketahui dengan cara teknik radiokimia. Sampai saat ini unsur belum pernah dipersiapkan dengan berat yang memadai atau diisolasi. Sifat-sifat kimia fransium sangat mirip dengan Sesium. B. SIFAT-SIFAT LOGAM ALKALI 1.Sifat-sifat logam alkali secara umum Unsur- unsur alkali disebut juga logam alkali. Kecuali litium atom unsurunsur ini mempunyai konfigurasi electron np6 (n+1) s1. Diantara unsure-unsur dalam satu periode unsure alkali adalah unsure dengan ukuran terbesar. Unsurunsur ini mempunyai energi ionisasi kecil. Makin besar nomor atom, energi ionisasinya berkurang. Unsure- unsure ini dapat memancarkan elektron jika disinari dengan cahaya. Oleh karena itu cesium dan kalium biasanya di gunakan dalam sel fotolistrik. Unsur- unsure ini mempunyai keelektronegatifan kecil oleh sebab itu membentuk senyawa ion (menghasilkan senyawa dengan perbedaan kelektronegatifan besar). Titik leleh, titik didih dan kerapatan logam alkali rendah dan logam-logam itu sangat lunak. Karena kulit elektron terluarnya hanya mengandung satu elektron s,. energi ionisasi logam-logam ini sangat rendah, dan kation mono logam alkali terbentuk dengan mudah. Analisis kualitatif logam alkali dapat dilakukan dengan uji nyala dengan menggunakan garis luminisensinya yang khas. Khususnya garisD oranye dari Natrium digunakan dalam lampu natrium. Logam alkali dioksidasi oleh air dan akan melepaskan gas hidrogen karena rendahnya potensial reduksilogam-logam tersebut. Kereaktifan litium terendah, natrium bereaksi dengan hebat, kalium, rubidium, dan cesium bereaksi disertai ledakan.Oleh karena itu harus ditangani dengan sangat hati-hati dan disimpan dalam minyak tanah atau hidrokarbon yang inert. Unsur-unsur alkali adalah reduktor kuat. Karena logam alkali adalah reduktor kuat, logam-logam ini juga digunakan untuk sebagai reduktor. Kekuatan reduktor dapat dilihat dari potensial elektroda. Diantara unsur-unsur alkali litium adalah reduktor terkuat dengan potensial elektroda sebesar -3,05volt sedangkan natrium adalah unsure alkali yang paling rendah yaitu -2,71 volt. Karena keaktifannya yang tinggi pada halogen, logam alkali penting dalam sintesis organik dan anorganik yang menghasilkan halida logam alkali sebagai hasil reaksi kondensasi dan metatesis. dari elektron yang terlarut. Jadi, proses pelarutan disertai dengan pemisahan atom logam menjadi ion logam alkali dan elektron yang tersolvasi dalam amonia, menurut persamaan : Larutan logam alkali dalam amonia bersifat konduktif dan paramagnetik. Larutan yang sangat kuat daya reduksinya ini digunakan untuk reaksi reduksi khusus atau sintesis kompleks logam dan polihalida. Larutan ini adalah penghantar listrik yang baik dibandingkan dengan larutan garam. Daya hantarnya hampir sama dengan daya hantar logam murni. Secara umum, logam alkali ditemukan dalam bentuk padat. Kecuali Cs (cesium) yang berbentuk cair jika suhu lingkungan pada saat pengukuran melebihi 28OC. Meskipun mereka adalah logam paling kuat, tetapi secara fisik mereka lunak bahkan bisa diiris menggunakan pisau. Hal ini karena mereka hanya memiliki satu elektron valensi pada kulit terluarnya. Sedangkan jumlah kulitnya makin bertambah dari atas ke bawah dalam tabel unsur periodik. Sehingga ikatan antar logamnya lemah. Titik didih adalah titik suhu perubahan wujud dari cair menjadi gas. Dan titik leleh adalah titik suhu perubahan wujud dari padat ke cair. Dalam golongan IA, dari Li ke Cs kecenderungan titik didih dan titik lelehnya turun. Salah satu ciri khas dari logam alkali adalah memiliki sprektum emisi. Sprektum ini dihasilkan bila larutan garamnya dipanaskan dalam nyala bunsen, atau dengan mengalirkan muatan listrik pada uapnya. Ketika atom diberi energi (dipanaskan) elektronnya akan tereksitasi ke tingkat yang lebih tinggi. Ketika energi itu dihentikan, maka elektronnya akan kembali lagi ke tingkat dasar sehingga memancarkan energi radiasi elektromagnetik. Menurut Neils Bohr, besarnya energi yang dipancarkan oleh setiap atom jumlahnya tertentu (terkuantitas) dalam bentuk spektrum emisi. Sebagian anggota spectrum terletak di daerah sinar tampak sehingga akan memberikan warna-warna yang jelas dan khas untuk setiap atom. Energi ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan satu elektron yang terikat paling lemah dari satu mol atom dalam keadaan gas. Energi ionisasi dalam satu golongan berhubungan erat dengan jari-jari atom. Jarijari atom pada golongan alkali dari Li ke Cs jari-jarinya semakin besar, sesuai dengan pertambahan jumlah kulitnya. Semakin banyak jumlah kulitnya, maka semakin besar jari-jari atomnya. Semakin besar jari-jari atom, maka daya tarik antara proton dan elektron terluarnya semakin kecil. Sehingga energy ionisasinya pun semakin kecil. Pada logam alkali yang memiliki satu elektron valensi ia akan lebih mudah membentuk ion positif agar stabil dengan melepas satu elektron tersebut. Li menjadi Li+, Na menjadi Na+, K manjadi K+ dan yang lainnya. Jari-jari ionnya mempunyai ukuran yang lebih kecil dibandingkan jari-jari atomnya, karena ion logam alkali membentuk ion positif. Ion positif mempunyai jumlah elektron yang lebih sedikit dibandingkan atomnya.Logam alkali sangat reaktif dibandingkan logam golongan lain. Selain disebabkan oleh jumlah elektron valensi yang hanya satu dan ukuran jari-jari atom yang besar, sifat ini juga disebabkan oleh harga energi ionisaisnya yang lebih kecil dibandingkan logam golongan lain. Dari Li sampai Cs harga energi ionisai semakin kecil sehingga logamnya semakin reaktif. Kereaktifan logam alkali dibuktikan dengan kemudahannya bereaksi dengan air, oksigen, unsur-unsur halogen, dan hidrogen. a. Litium Litium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Li dan nomor atom 3. Unsur ini termasuk dalam logam alkali dengan warna putih perak, sangat reaktif dan merupakan logam yang lunak. Dalam keadaan standar, litium adalah logam paling ringan sekaligus unsur dengan densitas paling kecil. Seperti logam-logam alkali lainnya, litium sangat reaktif dan terkorosi dengan cepat dan menjadi hitam di udara lembab Menurut teorinya, litium (kebanyakan 7Li) adalah salah satu dari sedikit unsur yang disintesis dalam kejadian Dentuman Besar walaupun kelimpahannya sudah jauh berkurang. Sebab-sebab menghilangnya litium dan proses pembentukan litium yang baru menjadi topik penting dalam astronomi. Litium adalah unsur ke-33 paling melimpah di bumi, namun oleh karenareaktivitasnya yang sangat tinggi membuat unsur ini hanya bisa ditemukan di alam dalam keadaan bersenyawa dengan unsur lain. Litium ditemukan di beberapa mineral pegmatit, asin dan lempung. Pada dengan elektrolisis dari namun skala juga komersial, campuran litium bisa logam didapatkan litium klorida dan kalium dari air didapatkan klorida. Sekelumit litium terdapat dalam samudera dan pada beberapa organisme walaupun unsur ini tidak berguna pada fungsi biologis manusia. Walaupun demikian, efek neurologi dari ion litium Li+ membuat garam litium sangat berguna sebagai obat penstabilan suasana hati. Litium dan senyawa-senyawanya mempunyai beberapa aplikasi komersial, meliputi keramikdan gelas tahan panas, aloi dengan rasio kekuatan berbanding berat yang tinggi untukpesawat terbang, dan baterai litium. Litium juga memiliki tempat yang penting dalam fisika nuklir. b. Natrium Natrium, seperti unsur radioaktif lainnya, tidak pernah ditemukan tersendiri di alam. Natrium adalah logam keperak-perakan yang lembut dan mengapung di atas air. Tergantung pada jumlah oksida dan logam yang terkekspos pada air, natrium dapat terbakar secara spontanitas. Lazimnya unsur ini tidak terbakar pada suhu dibawah 115 derajat Celcius. c. Kalium Unsur ini sangat reaktif dan yang paling elektropositif di antara logam-logam. Kecuali litium, kalium juga logam yang sangat ringan. Kalium sangat lunak, dan mudah dipotong dengan pisau dan tampak keperak-perakan pada permukaan barunya. Elemen ini cepat sekali teroksida dengan udara dan harus disimpan dalam kerosene (minyak tanah). Seperti halnya dengan logam-logam lain dalam grup alkali, kalium mendekomposisi air dan menghasilkan gas hidrogen. Unsur ini juga mudah terbakar pada air. Kalium dan garam-garamnya memberikan warna ungu pada lidah api. d. Rubidium Rubidium dapat menjelma dalam bentuk cair pada suhu ruangan. Ia merupakan logam akali yang lembut, keperak-perakan dan unsur akali kedua yang paling elektropositif. Ia terbakar secara spontan di udara dan bereaksi keras di dalam air, membakar hidrogen yang terlepaskan. Dengan logam-logam alkali yang lain, rubidium membentuk amalgam dengan raksa dan campuran logam dengan emas, cesium dan kalium. Ia membuat lidah api bewarna ungu kekuning-kuningan. Logam rubidium juga dapat dibuat dengan cara mereduksi rubidium klorida dengan kalsium dan dengan beberapa metoda lainnya. e. Sesium Karakteristik metal ini dapat dilihat pada spektrum yang memiliki dua garis biru yang terang dan beberapa di bagian merah, kuning dan hijau. Elemen ini putih keperak-perakan, lunak dan mudah dibentuk. Sesium merupakan elemen akalin yang paling elektropositif. Sesium, galium dan raksa adalah tiga logam yang berbentuk cair pada suhu ruangan. Sesium bereaksi meletup-letup dengan air dingin, dan bereaksi dengan es pada suhu di atas 116 derajat Celsius. Sesium hidroksida, basa paling keras yang diketahui, bereaksi keras dengan kaca. f. Fransium Fransium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Fr dan nomor atom 87. Fransium merupakan unsur logam alkali yang bersifat radioaktif dan sifat-sifat kimianya sangat mirip dengan cesium. Selain itu fransium merupakan unsur logam berat yang angat elektropositif dan merupakan unsur radioaktif alami yang isotopisotopnya mempunyai massa atom dalam rentang 204 sampai 224. C. PEMBUATAN LOGAM-LOGAM ALKALI Tingkat oksidasi logam selalu +1. Oleh karena itu , semua reaksi pembuatan logam alkali dari senyawanya tergolong reaksi reduksi. a. Litium Sumber logam Li adalah spodumene [LiAl(SO)3]. Spodumene dipanaskan pada suhu 100oC, lalu dicampur dengan H2SO4 panas, dan dilarutkan ke air untuk memperoleh larutan Li2SO4. kemudian, Li2SO4 direksikan dengan Na2CO3 membentuk Li2CO3 yang sukar larut. Li2SO4 + Na2CO3 → Li2CO3 + Na2SO4 Setelah itu, Li2CO3 direaksikan dengan HCl untuk membentuk LiCl. Li2CO3 + 2HCl → 2LiCl + H2O + CO2 Li dapat diperoleh dari elektrolisis lelehan LiCl. Katoda : Li+ + e- → Li Anoda : 2Cl- → Cl2 + 2eKarena titik leleh LiCl tinggi (>600oC), biaya elektrolisis menjadi mahal. Namun, biaya dapat ditekan dengan cara menambahkan KCl (55% LiCl dan 45% KCl) yang dapat menurunkan titik leleh menjadi 430oC. b. Natrium Na diperoleh dari elektrolisis leburan garam kloridanya yang dilakukan dengan menggunakan ”downs cell” . Elektrolisis lelehan NaCl dilakukan didalam sel silinder dengan menambahkan CaCl2 untuk menurunkan titih leleh dari NaCl dari 8010C menjadi 5800C. Akan tetapi dari elektrolisis tidak diperoleh Ca. Hal ini disebabkan karena Ca lebih sulit tereduksi dibanding Na karena potensial reduksi Ca lebih rendah dibanding Na. Sumber utama logam natrium adalah garam batu dan air laut. Na hanya dapat diperoleh dari elektrolisis lelehan NaCl. Katoda : Na+ + e- → Na Anoda : 2Cl- → Cl2 + 2e- c. Kalium,Rubidium,dan sesium Untuk mendapatkan logam K, Rb, dan Cs dilakukan metode reduksi sebab jika dengan metode elektrolisis logam ini cenderung larut dalam larutan garamnya. Reduksi K Sumber utama logam K adalah silvit (KCl). Logam ini didapatkan dengan mereduksi lelehan KCl. Na + KCl ↔ K + NaCl Reaksi ini berada dalam kesetimbangan karena K mudah menguap maka K dapat dikeluarkan dari sistem. Dan kesetimbangan akan tergeser ke kanan untuk memproduksi K. Suhu optimum beroperasinya downs cell 7720C, sementara titik leleh KCl 8500C dan pada suhu tersebut K akan berwujud gas sehingga K tidak mungkin dipisahkan atau diisolasi dengan menggunakan downs cell. Oleh karena itu logam K, Rb, Cs diisolasi dengan mereaksikan garam kloridanya dengan Na. D. PERSENYAWAAN LOGAM ALKALI Reaksi-reaksi logam alkali dan senyawnya Reaksi-reaksi logam alkali: 1. Reaksi logam alkali dengan air Logam alkali bereaksi dengan air membentuk senyawa hidroksida dan gas H2. Jika M adalah logam alkali, maka reaksinya dapat dituliskan sebagai berikut: 2M(s) + H2O(l) 2MOH(aq) + H2(g) Reaksi berlangsung semakin hebat dengan pertambahan nomor atom dari Li ke Cs. Hal ini disebabkan dalam satu golongan dari atas ke bawah jumlah kulit semakin banyak sehingga semakin mudah melepaskan elektron terluar yang nantinya digunakan untuk berikatan dengan unsur atau senyawa lain. 2. Reaksi logam alkali dengan oksigen Logam alkali bereaksi dengan oksigen membentuk senyawa oksida, senyawa peroksida, dan senyawa superoksida. Persamaan umumnya adalah sebagai berikut: Senyawa oksida (O2-) 4M(s) + O2(g) 2M2O(s) Contoh reaksi logam alkali dengan oksigen menghasilkan oksida 4Na(s) + O2(g) 2NaO(s) Senyawa peroksida (O22-) 2M(s) + O2(g) M2O2(s) Contoh reaksi logam alkali dengan oksigen menghasilkan peroksida 2K(s) + O2(g) K2O2(s) Senyawa superoksida (O2-) M(s) + O2(g) MO2(s) Contoh reaksi logam alkali dengan oksigen menghasilkan oksida Rb(s) + O2(g) RbO2(s) Senyawa oksida dihasilkan apabila reaksi melibatkan jumlah oksigen terbatas; sedangkan senyawa peroksida dan superoksida diperoleh dari reaksi dengan jumlah oksigen berlebih. 3. Reaksi logam alkali dengan halogen Logam alkali bereaksi dengan halogen membentuk senyawa halida. Persamaan umum reaksi antara logam alkali (M) dengan halogen (X) sebagai berikut: 2M(s) + X2(g) 2MX(s) Contoh reaksi logam alkali dengan halogen: 2Li(s) + Cl2(g) 4. 2LiCl(s) (Litium klorida) Reaksi logam alkali dengan hidrogen Logam alkali bereaksi dengan hidrogen membentuk senyawa hidrida. Senyawa hidrida merupakan senyawa ionik kristal yang berwarna putih. Reaksi umumnya adalah sebagai berikut: 2M(s) + H2(g) 2MH(s) Contoh reaksi logam alkali dengan hydrogen: 2Na(s) + H2(g) 2NaH(s) Senyawa-senyawa logam alkali: 1.Litium Dari kelompok logam alkali,hanya ion litium mempunyai densitas muatan yang paling besar,dan membentuk senyawa nitrida dengan energi kisi yang cukup tinggi.Dan litium mampu bergabung dengan molekul dihidrogen membentuk senyawa hidrida. 2. Natrium Senyawa yang paling banyak ditemukan adalah natrium klorida (garam dapur), tapi juga terkandung di dalam mineral-mineral lainnya seperti soda niter, amphibole, zeolite, dsb. Senyawa natrium juga penting untuk industri-industri kertas, kaca, sabun, tekstil, minyak, kimia dan logam. Sabun biasanya merupakan garam natrium yang mengandung asam lemak tertentu. Pentingnya garam sebagai nutrisi bagi binatang telah diketahui sejak zaman purbakala. Di antara banyak senyawa-senyawa natrium yang memiliki kepentingan industrial adalah garam dapur (NaCl), soda abu (Na2CO3), baking soda (NaHCO3), caustic soda (NaOH), Chile salpeter (NaNO3), di- dan tri-natrium fosfat, natrium tiosulfat (hypo, Na2S2O3 . 5H20) and borax (Na2B4O7 . 10H2O). 3. Kalium Kalium tidak ditemukan tersendiri di alam, tetapi diambil melalui proses elektrolisis hidroksida. Metoda panas juga lazim digunakan untuk memproduksi kalium dari senyawa-senyawa kalium dengan CaC2, C, Si, atau Na. 4.Sesium dan rubidium Terdapat dalam mineral fosfat trifilit. E. KEGUNAAN LOGAM ALKALI a) Litium Digunakan pada proses yang terjadi pada tungku peleburan logam (misalnya baja). Digunakan untuk mengikat karbondioksida dalam sistem ventilasi pesawat dan kapal selam. Digunakan pada pembuatan bom hydrogen. Litium karbonat digunakan pada proses perawatan penyakit atau gangguan sejenis depresi. Digunakan sebagai katalisator dalam reaksi organik. Logam Li yang tidak terlalu reaktif, digunakan dalam baterai untuk kalkulator, jam, kamera, dan alat pacu jantung. Paduan logam Li dengan magnalium digunakan pada komponen pesawat terbang , karena paduan logam ini sangat ringan tetapi kuat. b) Natrium Logam natrium sangat penting dalam fabrikasi senyawa ester dan dalam persiapan senyawa-senyawa organik. Logam di gunakan untuk memperbaiki struktur beberapa campuran logam, dan untuk memurnikan logam cair. Sebagai pendingin pada reaktor nuklir. Natrium digunakan pada pengolahan logam-logam tertentu. Natrium digunakan pada industri pembuatan bahan anti ketukan pada bensin yaitu TEL (tetraetillead). Uap natrium digunakan untuk lampu natrium yang dapat menembus kabut. Untuk membuat senyawa natrium seperti Na2O2 (natrium peroksida) dan NaCN (natrium sianida). Natrium juga digunakan untuk foto sel dalam alat-alat elektronik. c) Kalium Unsur kalium sangat penting bagi pertumbuhan. Tumbuhan membutuhkan garam-garam kalium, tidak sebagai ion K+ sendiri, tetapi bersama-sama dengan ion Ca2+ dalam perbandingan tertentu. Unsur kalium digunakan untuk pembuatan kalium superoksida (KO2) yang dapat bereaksi dengan air membentuk oksigen. Persamaan reaksinya: 4KO2(S) + H2O(l) → 4KOH(aq) + 3O2(g) senyawa KO2 digunakan sebagai bahan cadangan oksigen dalam tambang (bawah tanah), kapal selam, dan digunakan untuk memulihkan seseorang yang keracunan gas. d) Rubidium Digunakan sebagai katalis pada beberapa reaksi kimia Digunakan sebagai sel fotolistrik Sifat radioaktif rubidium -87 digunakan dalam bidang geologi (untuk menentukan unsure batuan atau benda-benda lainnya) e) Sesium Digunakan dalam sel-sel fotoelektrik, dan sebagai katalis di hydrogenasi senyawa-senyawa tertentu. Logam ini baru-baru saja ditemukan aplikasinya pada sistim propulsi. Sesium digunakan pada jam atom dengan akurasi sebesar 5 detik dalam 300 tahun. Senyawa-senyawanya yang penting adalah klorida dan nitrat. Digunakan untuk menghilangkan sisa oksigen dalam tabung hampa Karena mudah memancarkan electron ketika disinari cahaya, maka cesium digunakan sebagai keping katoda photosensitive pada sel fotolistrik. f) Fransium fransium digunakan untuk mengukur kadar aktinum(ac) dalam materi alami (fr adalah produk peluruhan ac) dan dalam penelitin biologi untuk mempelajari organ tubuh tikus.











