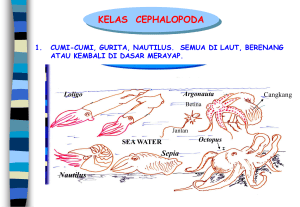
UJI TRANSPORTASI IKAN MASKOKI
advertisement

UJI TRANSPORTASI IKAN MASKOKI (Carassius auratus Linnaeus) HIDUP SISTEM KERING DENGAN PERLAKUAN SUHU DAN PENURUNAN KONSENTRASI OKSIGEN BHAYU SUFIANTO SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2008 x PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa tesis yang berjudul: “Uji Transportasi Ikan Maskoki (Carassius auratus Linnaeus) Hidup Sistem Kering dengan Perlakuan Suhu dan Penurunan Konsentrasi Oksigen” adalah karya saya sendiri dengan pengarahan dari komisi pembimbing dan belum pernah dipublikasikan kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Hasil penelitian atau gambar boleh dikutip untuk kepentingan non komersial dengan menyebutkan sumbernya. Bogor, Mei 2008 Bhayu Sufianto F051040121 ix RINGKASAN BHAYU SUFIANTO. Uji Transportasi Ikan Maskoki (Carassius auratus Linnaeus) Hidup Sistem Kering dengan Perlakuan Suhu dan Penurunan Konsentrasi Oksigen. Dibimbing oleh SAM HERODIAN dan RIDWAN AFFANDI. Ikan hias merupakan komoditas perikanan yang juga ikut menyumbang banyak devisa, nilai ekspornya sangat besar dan cenderung meningkat dari tahun ke tahun. Ikan maskoki (Carassius auratus) termasuk salah satu jenis ikan hias yang non-temporer, peluang pasarnya selalu stabil bahkan menunjukkan peningkatan. Pada pengangkutan ikan hias dengan media air untuk tujuan ekspor dinilai kurang effisien, karena berat air yang yang digunakan sebagai media juga ikut membebani biaya pengangkutan. Sistem pengangkutan ikan hidup tanpa media air dapat menjadi salah satu alternatif untuk mengurangi biaya angkut dan memungkinkan jumlah ikan yang diangkut lebih besar. Penelitian ini bertujuan untuk menentukan berbagai faktor (waktu pemingsanan, suhu pemingsanan, suhu penyimpanan, penurunan konsentrasi O2, dan lama transportasi) yang optimum terhadap kelulusan hidup (survival rate) ikan selama transportasi (statis) sistem kering. Pada penelitian ini juga dilakukan uji toksisitas, pengukuran densitas kamba dan daya serap air terhadap media pengisi; pengukuran efisiensi kemasan; serta pengamatan terhadap kondisi ikan maskoki selama proses pemingsanan, pengemasan, pembongkaran, dan penyadaran. Setelah dilakukan uji toksisitas selama 24 jam, dinyatakan bahwa busa yang digunakan sebagai media pengisi pada penelitian ini aman bagi ikan maskoki. Busa tersebut mempunyai daya serap air yang baik, yaitu sebesar 57.32% berat basah atau 135.23% berat kering. Busa tersebut juga mempunyai densitas kamba yang rendah, yaitu 0.074 gram/cm3, sehingga busa lebih ringan jika digunakan sebagai media pengisi, kapasitas angkutnya lebih besar, dan kandungan udara di dalam rongga busa tersebut lebih besar. Jenis kemasan rak biasa yang dapat memuat 30 ekor ikan dengan busa lembab sebagai media pengisi mempunyai efisiensi kemasan sebesar 56%. Sedangkan pada jenis kemasan rak berisi udara yang dapat memuat 60 ekor ikan dengan busa lembab sebagai media pengisi, mempunyai efisiensi kemasan sebesar 46%. Dari hasil penelitian ini diketahui bahwa waktu pemingsanan selama 8 jam, suhu pemingsanan pada 60C, suhu simpan pada 180C, dengan penurunan konsentrasi O2 sebesar 0% di dalam kemasan (konsentrasi O2 di dalam kemasan ±21%) dapat mempertahankan hidup ikan maskoki dengan nilai SR 100% selama 24 jam waktu transportasi (statis) sistem kering. Semakin lama waktu pemingsanan yang dilakukan sebelum pengemasan, dapat memperbesar kelulusan hidup (SR) ikan maskoki selama transportasi sistem kering. Dengan diturunkannya konsentrasi O2 di dalam kemasan, tidak dapat memperbesar kelulusan hidup (SR) ikan maskoki selama transportasi sistem kering. xii ABSTRACT BHAYU SUFIANTO. Examination of Dry System Transportation of Live Goldfish (Carassius auratus Linnaeus) with temperature and reduced oxygen concentration Treatments. Under Supervision of SAM HERODIAN and RIDWAN AFFANDI. This research aimed to discover the optimum factors (sedation rate, sedation temperature, storage temperature, reduced O2 concentration, and period of transportation) influenced to survival rate during dry system transportation (static) of live goldfish. Observation on fish condition during sedation, packaging, unpacking, and refreshing process; toxicity test on filler; bulk density measurement on filler; water absorption of filler; and container efficiency were also performed. The results showed that the optimum sedation temperature is at 60C, the optimum storage temperature is at 180C, the best sedation rate is eight hours from normal temperature (± 270C) down to 60C, the best reduced O2 concentration is 0 % reduction in O2 concentration (package which was contained ±21% O2 concentration), and the longest period of transportation (static) is 24 hours by normal atmosphere packaging. The filler was known harmless for live goldfish after 24 hours of toxicity test. The bulk density of filler is 0.074 gram/cm3 and the capacity of water absorption of filler is 57.32% wet weight or 135.23% dry weight. Keywords: Dry system transportation, goldfish, sedation, temperature, reduced O2 concentration ix © Hak Cipta milik IPB, tahun 2008 Hak Cipta dilindungi Undang – undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB. xiv UJI TRANSPORTASI IKAN MASKOKI (Carassius auratus Linnaeus) HIDUP SISTEM KERING DENGAN PERLAKUAN SUHU DAN PENURUNAN KONSENTRASI OKSIGEN BHAYU SUFIANTO Testis Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Pascapanen SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2008 ix Penguji Luar Komisi pada Ujian Tesis: Dr. Ir. Usman Ahmad, M.Agr xvi Judul Tesis : Uji Transportasi Ikan Maskoki (Carassius auratus Linnaeus) Hidup Sistem Kering dengan Perlakuan Suhu dan Penurunan Konsentrasi Oksigen Nama : Bhayu Sufianto NRP : F051040121 Disetujui, Komisi Pembimbing Dr. Ir. Ridwan Affandi, DEA. Anggota Dr. Ir. Sam Herodian, MS. Ketua Diketahui, Ketua Program Studi Teknologi Pascapanen Dr. Ir. Wayan Budiastra, MAgr. Tanggal Ujian : 18 April 2008 Dekan Sekolah Pascasarjana Prof. Dr. Ir. Khairil Anwar Notodiputro, MS. Tanggal Lulus : ix PRAKATA Puji sukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan kuliah dan karya ilimiah ini. Karya ilmiah ini merupakan sebagian kecil dari nikmat dan kasih sayang-Nya yang diberikan kepada penulis. Judul yang dipilih pada karya ilimiah ini adalah “Uji Transportasi Ikan Maskoki (Carassius auratus Linnaeus) Hidup Sistem Kering dengan Perlakuan Suhu dan Penurunan Konsentrasi Oksigen”. Terima kasih penulis sampaikan kepada Ayahanda R. A Sofyan, MPH. Mkes yang telah banyak berkorban dan bersabar dalam mendukung kemajuan studi penulis, Ibunda Dra. Suwarni (Alm.), Utari, dan Dhanu yang selalu memberikan kasih sayang, dukungan, dan do’a yang membuat penulis ter-support untuk menyelesaikan kuliah dan karya ilmiah ini dengan sebaik-baiknya. Terima kasih penulis sampaikan kepada Dr. Ir. Sam Herodian, MS dan Dr. Ir. Ridwan Affandi, DEA yang telah bersedia memberikan bimbingan dan arahan yang sangat bermanfaat untuk pengembangan wawasan penulis, juga kepada Dr. Ir. Usman Ahmad, MAgr selaku dosen penguji yang telah memberikan masukkan demi kesempurnaan tesis ini. Terima kasih juga penulis sampaikan kepada Pak Suyaden dan Udin Reza, Spi yang telah banyak memberi bantuan dan berkenan meminjamkan kepada penulis peralatan – peralatan yang sangat dibutuhkan, Pak Parma dan Mas Andri atas segala bantuannya. Terima kasih kepada teman – teman: Riksan THH’36 dan Fajar BDP’37 atas pinjaman motornya, Yandra dan Cha2 TEP’40 atas bantuan serta ide – idenya, Agung ‘Jagung’ BDP’38 atas resep treatment on freshwater fish parasite, Asep Horti’40 atas pinjaman printernya, Ubay TPP’05, Rahman STP’38, Hendro MSP’38, teman – teman TPP’04 atas segala dukungan dan bantuannya. Dengan kerendahan hati, semoga karya ilmiah ini memberi manfaat bagi yang membutuhkan. Bogor, Mei 2008 Bhayu Sufianto xviii RIWAYAT HIDUP Penulis dilahirkan di Jakarta pada Tanggal 14 Februari 1981. Anak pertama dari tiga bersudara dari Ayahanda R. A. Sofyan MPH. Mkes dan ibunda Dra. Suwarni (Alm.). Penulis menamatkan pendidikan S1 pada Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut pertanian Bogor pada Tahun 2004. Pada Tahun yang sama, penulis melanjutkan studinya pada Program Studi Teknologi Pascapanen, Sekolah Pascasarjana, Institut Pertanian Bogor dan lulus pada Tahun 2008. ix DAFTAR ISI Halaman RINGKASAN ............................................................................................ iii ABSTRACT ............................................................................................... iv PRAKATA ................................................................................................. vii RIWAYAT HIDUP ................................................................................... viii DAFTAR ISI .............................................................................................. ix DAFTAR TABEL ...................................................................................... xi DAFTAR GAMBAR ................................................................................. xii DAFTAR LAMPIRAN ............................................................................. xiii I. PENDAHULUAN ................................................................................. 1 1.1. Latar Belakang.................................................................................. 1 1.2. Tujuan .............................................................................................. 3 II. TINJAUAN PUSTAKA ...................................................................... 4 2.1. Ikan Maskoki (Carassius auratus Linnaeus).................................. 4 2.1.1. Biologi ikan maskoki ........................................................... 2.1.2. Morfologi ikan maskoki ...................................................... 4 6 22. Metabolisme Ikan ........................................................................... 9 23. Respirasi Ikan ................................................................................. 10 2.4. Transportasi Ikan Hidup ............................................................... 23 2.4.1. Sistem basah ....................................................................... 2.4.2. Sistem kering ...................................................................... 24 27 2.5. Kemasan Transportasi ................................................................... 33 2.6. Media Pengisi Kemasan ................................................................ 35 x III. METODE PENELITIAN ................................................................. 37 3.1. Tempat dan Waktu Penelitian ...................................................... 37 3.2. Bahan dan Alat ............................................................................. 37 3.2.1. Bahan ................................................................................. 3.2.2. Alat ..................................................................................... 37 43 3.3. Tahapan dan Prosedur Penelitian ................................................. 47 3.3.1. Pengujian toksisitas media pengisi .................................. 3.3.2. Daya serap air media pengisi ........................................... 3.3.3. Densitas kamba media pengisi ......................................... 3.3.4. Efisiensi kemasan ............................................................ 3.3.5. Pemingsanan ikan ............................................................ 3.3.6. Menentukan suhu pemingsanan optimum ....................... 3.3.7. Menentukan suhu penyimpanan optimum ....................... 3.3.8. Pengaruh waktu pemingsanan terhadap SR ..................... 3.3.9. Pengaruh penurunan konsentrasi O2 terhadap SR ........... 3.3.10. Menentukan waktu transportas (statis) optimum ............. 50 50 51 51 52 54 54 55 56 58 IV. HASIL DAN PEMBAHASAN ......................................................... 59 4.1. Pengujian Toksisitas Media Pengisi ............................................ 59 4.2. Daya Serap Air Media Pengisi ..................................................... 60 4.3. Densitas Kamba Media Pengis .................................................... 66 4.4. Efisiensi Kemasan ........................................................................ 68 4.5. Pemingsanan Ikan Maskoki ......................................................... 70 4.6. Suhu Pemingsanan Optimum ....................................................... 73 4.7. Suhu Penyimpanan Optimum ...................................................... 77 4.8. Pengaruh Waktu Pemingsanan terhadap SR ................................ 79 4.9. Pengaruh Penurunan Konsentrasi O2 terhadap SR ...................... 82 V. KESIMPULAN DAN SARAN .......................................................... 87 5. 1. Kesimpulan .................................................................................. 87 5. 2. Saran ............................................................................................ 88 DAFTAR PUSTAKA ............................................................................... 89 LAMPIRAN .............................................................................................. 94 xi DAFTAR TABEL No. Halaman 1. Sifat – sifat styrofoam sebagai bahan insulasi .................................... 34 2. Kondisi ikan maskoki pada pengujian toksisitas media pengisi ......... 59 3. Daya serap air media pengisi busa ...................................................... 60 4. Daya serap air beberapa media pengisi (Prasetyo, 1993) ................... 61 5. Daya serap air beberapa media pengisi (Muslih, 1996) ..................... 62 6. Daya serap air media pengisi rumput laut (Muslih, 1996) ................. 62 7. Hasil pengamatan terhadap bau media pengisi (Prsetyo, 1993) ......... 64 8. Hasil pengamatan terhadap bau media pengisi (Muslih, 1996) .......... 65 9. Densitas kamba media pengisi busa ................................................... 66 10. Kondisi ikan maskoki selama proses pemingsanan ............................ 72 11. Kondisi ikan maskoki pada proses penyadaran .................................. 73 12. Penentuan suhu pemingsanan optimum .............................................. 74 13. Penentuan suhu penyimpanan optimum ............................................. 77 14. Hasil pengaturan volume air terhadap waktu pemingsanan ............... 80 15. Pengaruh lama waktu pemingsanan terhadap SR ............................... 80 16. Pengaruh penurunan konsentrasi O2 terhadap SR .............................. 83 xii DAFTAR GAMBAR No. Halaman 1. Morfologi ikan maskoki (Liviawaty dan Afrianto, 1999) .................. 8 2. Proses pertukaran gas (Affandi dan Tang, 2002) ............................... 12 3. Hubungan antara temperatur dengan laju konsumsi O2 aktif dan standar pada ikan maskoki (Fry dan Hart, 1948) ................. 16 4. Kecepatan renang ikan Perca flavescens yang berhubungan dengan temperatur dan kandungan O2 di dalam air (Fry, 1957) ......... 17 5. Efek dari kandungan O2 dan temperatur terhadap tingkat konsumsi O2 pada ikan Perca flavescens (Fry, 1957) ............ 18 6. Perbedaan tipe kecepatan konsumsi O2 pada tiga spesies ikan yang berbeda pada suhu 200C (Fry, 1957) .............. 20 7. Pengaruh kandungan O2 terlarut di media terhadap tingkat konsumsi O2 oleh ikan (Affandi dan Tang, 2002) .................. 21 8. Kurva hubungan antara kadar CO2 dan tingkat konsumsi O2 oleh ikan (Affandi dan Tang, 2002) .............................. 23 9. Ikan maskoki (carassius auratus Linnaeus) ....................................... 37 10. Rak pada jenis kemasan rak biasa ...................................................... 38 11. Rak pada jenis kemasan rak berisi udara............................................. 39 12. Kemasan rak biasa .............................................................................. 40 13. Kemasan rak berisi udara..................................................................... 40 14. Busa tempat diletakkannya ikan ......................................................... 41 15. Busa untuk menutupi ikan .................................................................. 42 16. Tabung – tabung gas O2, CO2, dan N2 ................................................ 42 17. Water chiller ....................................................................................... 43 18. Bak pemingsanan ikan ........................................................................ 44 19. Peti kemas ........................................................................................... 44 20. Gases mixer ........................................................................................ 45 21. Chinorecorder ..................................................................................... 46 22. Akuarium, aerator 180 Watt, dan aerator 60 Watt .............................. 46 23. Proses aklimatisasi pada ikan ............................................................. 48 xiii DAFTAR LAMPIRAN No. Halaman 1. Bagan alir tahapan – tahapan penelitian ............................................. 94 2. Proses pengujian toksisitas media pengisi .......................................... 95 3. Sketsa jenis kemasan rak biasa ........................................................... 96 4. Sketsa jenis kemasan rak berisi udara ................................................. 98 5. Pola lapisan busa-ikan-busa pada setiap rak di dalam kemasan rak biasa .......................................................... 100 6. Pengemasan ikan di dalam kemasan rak biasa ................................... 101 7. Pola lapisan busa-ikan-busa pada setiap rak di dalam kemasan rak berisi udara ..................................................... 103 8. Pengemasan ikan di dalam kemasan rak berisi udara ................................................................................... 104 9. Ikan yang mati dengan insang berdarah dan bercak darah pada busa ................................................................ 108 10. Ikan yang mati dalam keadaan kaku dengan mulut terbuka ......................................................................... 109 11. Pola kenaikan suhu media pengisi dari suhu 30C, 40C, 50C, dan 60C mencapai suhu simpan (salah satu contoh: 100C) ............................................... 110 12. Data hasil pada tahap menentukan suhu pemingsanan optimum ............................................................... 111 13. Data hasil pada tahap menentukan suhu penyimpanan optimum .............................................................. 113 14. Data hasil pengaruh waktu pemingsanan terhadap SR ...................... 115 15. Data hasil pengaruh penurunan konsentrasi O2 terhadap SR ............ 117 1 I. PENDAHULUAN 1. 1. Latar Belakang Ikan hias merupakan komoditas perikanan air tawar yang juga ikut menyumbangkan banyak devisa, nilai ekspornya sangat besar dan cenderung meningkat dari tahun ke tahun. Sebagai contoh, jumlah ikan hias yang diekspor dari Bogor pada tahun 2003 mencapai 6.4 juta ekor dengan nilai nominal kira – kira Rp. 3 milyar lebih. Sedangkan pada tahun 2004, tercatat sebanyak 6.8 juta ekor ikan hias yang diekspor dari Bogor, dengan nilai nominal Rp. 4.25 milyar (Pikiran Rakyat, 2004). Pada tahun 2000, 2001, dan 2003 nilai ekspor ikan hias nasional masing – masing adalah US$ 3.917; 4.623; dan 5.835 juta atau setara dengan Rp. 35.253; 41.607; dan 52.515 milyar (Kompas, 2003). Sedangkan menurut Sekda Jabar, Lex Laksamana, pada tahun 2004 nilai ekspor ikan hias nasional mencapai US$ 7,3 juta dan 60% dari jumlah tersebut dikontribusi oleh Jawa Barat (Pemda Jabar, 2006). Ikan maskoki (Carassius auratus) termasuk salah satu jenis ikan hias yang non-temporer, peluang pasarnya selalu stabil bahkan menunjukkan peningkatan. Sebagai contoh, produksi ikan maskoki di Jakarta Selatan mengalami peningkatan dari tahun 2000 sampai 2004, yaitu dari 512.365 ekor meningkat hingga 798.428 ekor (Pemkot Jaksel, 2005). Ikan hias yang siap untuk dijual biasanya diangkut dengan wadah yang berisikan air. Ada dua model pengangkutan ikan hias yang biasanya dilakukan, yaitu pengangkutan sistem terbuka dan sistem tertutup. Pada sistem terbuka memungkinkan tetap terjadinya kontak antara udara luar dan media pengangkut (air). Pada sistem tertutup tidak memungkinkan terjadinya kontak antara udara luar dan media pengangkut (air), sehingga perlu diberi tambahan gas O2. Sistem pengangkutan terbuka biasanya dilakukan jika jumlah ikan yang diangkut relatif sedikit, jarak tempuhnya dekat, serta dalam waktu yang relatif singkat. Sistem pengangkutan tertutup biasa dilakukan untuk mengirim ikan dalam jumlah yang relatif banyak, pada jarak yang jauh, dan waktu yang relatif lama, misalnya pada waktu pengiriman ikan hias untuk ekspor (Daelami, 2001). 2 Ikan yang diangkut dengan media air sistem tertutup biasanya menggunakan kantung plastik sebagai alat angkut. Menurut Liviawaty dan Afrianto (1999), kantung plastik yang baik untuk digunakan dalam pengangkutan ikan mempunyai ukuran lebar 50 cm dan ketebalan 0.03 mm. Kantung plastik yang biasa digunakan untuk pengangkutan ikan maskoki mempunyai panjang 1 meter. Pada 1/3 bagian dari volume kantung plastik tersebut diisi dengan air bersih, kemudian ikan – ikan yang akan diangkut dimasukkan ke dalamnya. Sisa volume yang kira – kira 2/3 bagian dari volume kantung plastik tersebut, kemudian diisi dengan gas O2. Jumlah ikan maskoki, dengan ukuran panjang baku (kepala sampai pangkal ekor) ± 5 cm, yang diangkut dengan cara ini dapat mencapai 100 ekor. Sistem pengangkutan ikan hias dengan media air untuk tujuan ekspor dinilai kurang effisien, karena berat air yang digunakan sebagai media juga ikut membebani biaya pengangkutan. Katung plastik dengan panjang 1 meter dan lebar 50 cm, yang kemudian diisi dengan air hingga 1/3 bagian dari volume kantung plastik tersebut, maka jika ditimbang bobotnya akan mencapai berat ± 5 kg (berat ikan 100 ekor dan udara 2/3 bagian dari volume kantung diabaikan). Ikan maskoki dengan ukuran panjang baku ± 5 cm yang berjumlah 100 ekor, mempunyai bobot total ± 1150 gram. Sehingga Ikan maskoki dengan jumlah 100 ekor (bobot total ± 1150 gram) yang dikemas di dalam kantung plasik yang berisi air hingga 1/3 bagian dari volume kantung plastik tersebut, jika diukur hanya mempunyai efisiensi kemasan sebesar 23%. Sistem pengangkutan ikan hias tanpa media air dapat menjadi salah satu alternatif untuk mengurangi biaya pengangkutan dan memungkinkan jumlah ikan yang dapat diangkut lebih besar. Pada sistem pengangkutan ini, ikan diangkut pada media pengangkut yang bukan air. Ikan yang diangkut dengan sistem ini harus dalam keadaan pingsan atau imotil. Ikan dapat dipingsankan dengan senyawa – senyawa kimia, suhu rendah, dan arus listrik. Media pengangkut ikan harus lembab dan dapat mempertahankan dingin sesuai suhu penyimpanan masing – masing ikan. 3 Media pengangkut yang biasa digunakan pada sistem pengangkutan ini adalah serbuk gergaji, serutan kayu, kertas koran, atau bahan karung goni (Wibowo, 1993). Udang windu tambak (Paneus monodon Fab.) dengan bobot 2000 gram (2 kg), setelah dipingsankan dan dikemas ke dalam boks styrofoam bermedia pengisi/pengangkut serbuk gergaji lembab (sistem pengangkutan tanpa media air/sistem kering), mempunyai efisiensi kemasan sebesar 50% (Karnila, 1998). 1. 2. Tujuan Penelitian Penelitan ini bertujuan untuk menentukan berbagai faktor (waktu pemingsanan, suhu pemingsanan, suhu penyimpanan, penurunan konsentrasi O2, dan lama waktu transportasi) yang optimum terhadap kelulusan hidup (survival rate) ikan maskoki selama transportasi (statis) sistem kering. Pada penelitian ini juga dilakukan uji toksisitas terhadap media pengisi; pengukuran densitas kamba dan daya serap air media pengisi; serta pengamatan terhadap kondisi ikan maskoki selama penyadaran. proses pemingsanan, pengemasan, pembongkaran, dan 4 II. TINJAUAN PUSTAKA 2. 1. Ikan Maskoki (Carassius auratus Linnaeus) 2. 1. 1. Biologi ikan maskoki Ikan maskoki yang terdapat di seluruh panjuru dunia ini dapat dipastikan berasal dari negeri Cina dan disebut goldfish dalam bahasa Inggris. Nenek moyang ikan maskoki adalah ikan Crucian carp, sejenis ikan karper yang tidak bermisai/berkumis. Ikan Crucian carp ini sangat mirip dengan ikan karper/ikan mas yang ada di Indonesia, tetapi ukurannya lebih kecil dan warnanya menarik. Perbedaan yang mencolok antara ikan Crucian carp dengan ikan karper (Cyprinus carpio) adalah pada ikan karper terdapat sepasang kumis pada mulutnya, sedangkan pada ikan Crucian carp tidak terdapat kumis sama sekali (Lingga dan Susanto, 1999). Secara genetik atau berdasarkan kromosomnya, ikan maskoki berhubungan dekat dengan Crucian carp yang tersebar luas di seluruh penjuru Jepang dan Cina (Kafuku dan Ikenoue, 1983). Namun demikian, secara fenotip keduanya dapat dibedakan karena ikan maskoki memiliki sisik yang lebih sedikit (29 – 30) dibandingkan ikan Crucian carp (32 – 33) (Huet, 1994). Pada awalnya ikan maskoki diberi nama Cyprinus auratus, yang artinya “ikan dengan warna emas dengan tiga lapis ekor”. Tetapi rupanya perkembangan ilmu pengetahuan dalam taksonomi ikan yang pesat, menghasilkan nama biologi yang baru untuk ikan maskoki, yaitu Carrasius auratus. Sedangkan sekelompok ahli dari lembaga internasional yang mengatur tentang penamaan zoologi, memberikan nama untuk ikan Crucian carp yaitu Carrasius carrasius (Budhiman dan Lingga, 1999). Dal Vesco et al. (1975) menyatakan bahwa ikan maskoki jarang mencapai panjang 30 cm, sedangkan di aquarium ikan maskoki jarang mencapai ukuran 10 cm. Secara alami, ikan maskoki menyukai habitat kolam berlumpur, bendungan, sungai, atau danau dengan pakan alami berupa zooplankton dan serangga air (Stickney, 1979). 5 Ikan maskoki betina dapat matang telur pada umur satu tahun, sedangkan yang jantan telah matang gonad pada usia yang lebih muda lagi. Telur ikan maskoki memiliki diameter berukuran 0.7 – 0.5 mm dan dapat melekat pada benda – benda di dalam air, misalnya rumput atau tanaman air. Makanan ikan maskoki bermacam – macam dan tidak pilih – memilih makanan. Selain suka dengan makanan alami seperti plankton dan organisme dasar perairan, ikan maskoki juga suka dengan pelet buatan manusia. Para ahli biologi ikan menggolongkan ikan maskoki termasuk ke dalam ikan omnivora (Budhiman dan Lingga, 1999). Taksonomi/klasifikasi ikan maskoki menurut Axelrod dan Schultz (1983) adalah sebagai berikut : Filum : Chordata Subfilum : Craniata Superkelas : Gnathostomata Kelas : Ostheichthyes Subkelas : Actinopterygii Superordo : Teleostei Ordo : Ostariophysoidei Subordo : Cyprinoidea Famili : Cyprinidae Genus : Carassius Spesies : Carassius auratus Linnaeus 6 2. 1. 2. Morfologi ikan maskoki Berbeda dengan ikan karper, ikan maskoki tidak dimakan sebagai hidangan yang lezat. Ikan maskoki ini dimanfaatkan seratus persen sebagai ikan hias yang disukai di berbagai penjuru dunia, karena mempunyai bentuk dan warna yang unik dan menarik, serta menciptakan pesona yang indah bagi penggemarnya. Bentuk luar tubuh ikan maskoki hampir menyerupai ikan karper, yaitu sama – sama mempunyai sirip yang lengkap seperti sirip punggung, sirip dada, sirip perut, sirip anal/dubur, dan sirip ekor. Selain itu juga ikan maskoki mempunyai sisik yang berderet rapih. Walau pun ikan maskoki hampir menyerupai ikan karper, terdapat banyak pula perbedaannya. Perbedaan tersebut terletak pada bentuk badan, bentuk kepala, bentuk sisik, bentuk sirip, dan bentuk mata. Bentuk badan ikan maskoki pendek dan gemuk, sehingga gerakan tubuhnya sangat menarik saat berenang. Sirip ikan maskoki berfungsi sebagai alat gerak. Sirip perut dan sirip dada yang bekerja sama dengan gelembung udara, berfungsi sebagai kontrol terhadap gerakan ke atas dan ke bawah. Jika di dalam gelembung udara penuh berisi udara, maka sirip dada akan bergerak dan secara otomatis ikan maskoki akan muncul ke permukaan air. Tetapi sebaliknya jika gelembung udara kosong dan mengecil, maka sirip perut yang akan bergerak dan ikan maskoki akan menyelam ke bagian dalam air. Selain oleh bentuk sirip yang menarik, keelokan ikan maskoki banyak dipengaruhi oleh deretan – deretan sisik yang rapih seperti genteng yang menutupi atap rumah. Di bawah deretan – deretan sisik ini terdapat kelenjar lendir yang berfungsi sebagai pelindung tubuh dari gesekan dan mencegah infeksi karena luka. Sisik – sisik ini mempunyai warna yang gelap karena mengandung bahan guanine yang membentuk kristal (C5H5N5O) di dalam sisik, misalnya warna merah pada ikan maskoki varietas Wakin dan Ryukin. Jika di dalam sisik ikan tersebut tidak terdapat guanine, maka sisik ikan tidak akan bewarna alias transparan. Sisik yang di dalamnya tidak terdapat guanine, dapat ditemui seperti pada ikan maskoki varietas Calico dan Shubunkin. Pada umumnya sisik ikan maskoki mempunyai warna dasar hitam, merah, kuning, dan putih. Warna sisik 7 tersebut tergantung pada pigmen pembawa warna yang terdapat pada masing – masing varietas/ras ikan maskoki. Keindahan warna dari ikan maskoki juga tergantung kepada tersedianya bahan pemantul cahaya yang terdapat di dalam lapisan sisik. Sering dijumpai ikan maskoki yang berwarna kuning pucat, tetapi juga sering bewarna merah, karena tergantung kepada bahan pemantul cahaya tersebut. Selain dipengaruhi oleh guanine dan ada atau tidaknya bahan pemantul cahaya, keindahan ikan maskoki juga sangat dipengaruhi oleh kadar bahan kimia di dalam air, cahaya, suhu air, makanan, dan tentu saja faktor genetiknya. Bentuk kepala ikan makoki juga tidak kalah menariknya, karena bentuknya yang indah seperti pada varietas ikan maskoki Ranchu, Oranda, dan Pompon. Kepala ikan makoki pada varietas Ranchu dan Oranda/Spenser ditutupi oleh jaringan daging yang menebal, yaitu pada bagian atas kepala dan pipinya. Pada varietas Ranchu, penebalan jaringan ini hampir menutupi seluruh bagian kepala yang tampak seperti singa, karena itu varietas ikan maskoki ini sering pula disebut “si kepala singa”. Lain halnya pada varietas Oranda, pada ikan ini mempunyai kepala yang berjambul, sedangkan pada varietas Pompon mempunyai tambahan hidung yang menyembul keluar, yang sewaktu – waktu hidung tersebut dapat bergerak bila terhembus udara saat mengeluarkan nafas. Bentuk mata ikan maskoki pada umumnya sama dengan sebagian besar hewan vertebrata lainnya, yaitu iris matanya tidak dapat membuka dan menutup. Lensa mata ikan maskoki tidak dapat berkontraksi luas, oleh karena itu ikan maskoki mempunyai pandangan mata yang dekat dan terbatas. Dalam mencari makanan, ikan maskoki lebih tergantung kepada penciumannya dari pada penglihatannya. Walau bagaimana pun juga, bentuk mata pada ikan maskoki menandakan varietas – varietas tertentu. Ada empat tipe bentuk mata pada varietas ikan maskoki, yaitu mata yang normal seperti lazimnya bentuk mata ikan karper, mata teleskop, mata teleskop yang mengarah ke atas seperti pada ikan celestial, dan mata yang berbentuk balon (Budhiman dan Lingga, 1999). Bentuk tubuh luar (morfologi) ikan maskoki, untuk lebih jelasnya dapat dilihat pada Gambar 1 di bawah ini. 8 Gambar 1. Morfologi ikan maskoki (Liviawaty dan Afrianto, 1999) Ikan maskoki memiliki bentuk yang beragam terutama pada bagian mata dan sirip (Huet, 1994). Ikan ini juga memiliki variasi warna seperti merah, kuning, putih – jingga dengan atau tanpa bintik hitam (Dal vesco et al., 1975). Hingga saat ini, varietas ikan maskoki sudah cukup banyak jumlahnya (Axelrod dan Vorderwinkler, 1986). Varietas/jenis yang terkenal antara lain adalah Wakin (common goldfish), Ryukin (fantail), Rancha (lionhead), Oranda, Jikin (peacocktail), Demekin (telescop-eye), Kaliko, Kaliko oranda, Shubunkin, Komet (Kafuku dan Ikenoue, 1983). Budhiman dan Lingga (1999) menambahkan terdapat vaeritas yang lainnya, yang juga sangat digemari, seperti Kokitosa (veiltail), Sisik mutiara (pearlscale), Mata balon (bubble-eye), Nirwana (celestial), Pompon, dan Blackmoor. Ikan maskoki varietas Tosa atau Kokitosa (veiltail) marupakan varietas yang paling sering dijumpai pada setiap pedagang dan peternak ikan maskoki. Tidak jelas dari mana asal – muasal nama Tosa atau Kokitosa ini. Sementara nama veiltail jelas muncul dari bentuk ekor yang panjang dan kembar (twintail) sehingga tampak seperti menjuntai (merumbai). Ikan maskoki varietas Tosa memiliki sirip sebanyak 6 buah, yaitu dua buah sirip dada, dua buah sirip anus, sebuah sirip ekor, dan sebuah lagi sirip punggung. Ukuran sirip ini umumnya cukup panjang. Karena bentuk tubuhnya yang bulat dan gemuk, gerakan ikan maskoki varietas Tosa ini umumnya sangat lamban. 9 Karena siripnya yang panjang dan lemah gemulai, maka setiap kali ikan tersebut berenang, sirip – siripnya akan ikut bergerak sehingga menyuguhkan pemandangan yang menarik seperti layaknya gerakan seorang penari balet. Keindahan ikan maskoki varietas Tosa dikatakan sempurna manakala ikan tersebut memiliki tubuh yang bulat dan gemuk, sirip ekornya menjuntai melebihi panjang tubuhnya, sirip punggung tinggi (setinggi tubuhnya atau lebih) dan berdiri tegak, kondisi tubuhnya mulus, serta warnanya merah metalik atau kuning (Budhiman dan Lingga, 1999). 2. 2. Metabolisme Ikan Metabolisme adalah semua reaksi kimia yang terjadi di dalam tubuh mahluk hidup, yang terdiri atas anabolisme (proses sintesis senyawa kimia kecil menjadi molekul yang lebih besar) dan katabolisme (proses penguraian molekul besar menjadi molekul kecil). Laju/kecepatan metabolisme cenderung dihubungkan dengan jumlah kalori yang dapat dihasilkan, sehingga pengukuran laju metabolisme secara tidak langsung dapat dengan mudah diukur menggunakan kalorimetri. Akan tetapi untuk pengukuran laju metabolisme yang secara lengkap dari suatu mahluk hidup, membutuhkan juga pengukuran terhadap besarnya konsumsi O2, besarnya CO2 yang dihasilkan, dan besarnya jumlah nitrogen yang diekskresikan (dibuang) bersamaan dengan pendugaan besarnya nilai kalori dari sisa hasil buangan (kotoran). Sesungguhnya laju konsumsi O2 sendiri dapat digunakan untuk mengetahui secara umum intensitas dari metabolisme pada mahluk hidup aerobik. Pengukuran terhadap laju konsumsi O2 juga digunakan untuk mengetahui kemampuan dari suatu mahluk hidup aerobik untuk mengambil O2 ketika berada dalam berbagai kondisi lingkungan, termasuk berbagai perubahan tekanan parsial O2 itu sendiri, yang merupakan salah satu dari indikasi - indikasi paling penting untuk mengetahui perubahan – perubahan yang terjadi di dalam suatu perairan. Pengukuran laju metabolisme berdasarkan pengukuran laju konsumsi O2 dapat dibagi berdasarkan dua katagori, yaitu laju konsumsi O2 minimum yang merupakan laju konsumsi O2 terendah yang dibutuhkan suatu mahluk hidup hanya untuk mempertahankan kelangsungan hidupnya saja, dan laju konsumsi O2 10 maksimum yang merupakan laju konsumsi O2 tertinggi yang dapat dicapai suatu mahluk hidup untuk beraktifitas secara maksimum. Laju konsumsi O2 minimum dan laju konsumsi O2 maksimum masing – masing biasa disebut dengan laju konsumsi O2 standar (laju metabolisme standar) dan laju konsumsi O2 aktif (laju metabolisme aktif). Sesuatu hal yang menarik dari pola konsumsi O2 pada ikan yaitu adalah laju konsumsi O2 aktif pada ikan biasanya hanya beberapa kali lipat dari pada laju konsumsi O2 standarnya. Pada manusia diketahui laju konsumsi O2 aktifnya adalah sebesar 20 kali lipat dari pada laju konsumsi O2 standarnya, ketika sedang bekerja keras. Sedangkan laju konsumsi O2 aktif pada serangga dapat terjadi sebesar seratus kali lipat dari pada laju konsumsi O2 standarnya (Fry, 1957). 2. 3. Respirasi Ikan Respirasi atau pernafasan adalah proses pengikatan O2 dan pengeluaran CO2 oleh darah melalui permukaan alat pernafasan. Proses pengikatan O2 tersebut selain dipengaruhi oleh struktur alat pernafasan, juga dipengaruhi oleh perbedaan tekanan parsial O2 di dalam perairan dengan di dalam darah. Perbedaan tekanan tersebut menyebabkan gas – gas berdifusi ke dalam darah atau ke luar darah. Oksigen sebagai bahan pernafasan dibutuhkan oleh sel untuk berbagai reaksi metabolisme. Oleh sebab itu, kelangsungan hidup ikan sangat ditentukan oleh kemampuannya memperoleh O2 yang cukup dari lingkungannya. Berkurangnya O2 terlarut di dalam perairan akan mempengaruhi fisiologi respirasi dan metabolisme ikan tersebut. Pengertian mengenai tekanan parsial merupakan suatu langkah penting menuju pemahaman difusi O2 dari perairan ke dalam darah melalui insang. Tekanan parsial gas – gas dalam suatu campuran ditunjukkan dengan istilah yang sama seperti yang digunakan untuk menunjukkan tekanan di dalam cairan, yaitu P O2, P CO2, P N2, P He, dan sebagainya. Dari teori kinetik gas kita dapat mengetaui bahwa tekanan pada membran apa pun atau pada permukaan lain apa pun ditentukan oleh jumlah molekul yang membentur suatu satuan luas membran pada saat tertentu dikalikan dengan energi kinetik rata – rata dari molekul tersebut. Oleh karena itu, tekanan parsial suatu gas dalam suatu campuran 11 sebenarnya merupakan jumlah kekuatan tubrukan molekul seketika itu juga dari gas tertentu pada permukaan tersebut. Kerena setiap gas di dalam suatu campuran gas menimbulkan tekanan parsialnya sendiri yang sebanding dengan konsentrasi molekulnya. Bila gas dari suatu campuran larut di dalam suatu cairan dan berada dalam keadaan seimbang dengan fase gas dari campuran itu., maka tekanan tiap gas terlarut sama dengan tekanan parsial gas yang sama di dalam campuran gas tersebut. Dengan perkataan lain, tiap – tiap gas tidak bergantung kepada gas lain dalam kemampuannya untuk melarut di dalam suatu cairan. Prinsip ini juga berlaku untuk larutan gas di dalam darah. Jadi peningkatan jumlah CO2 yang terlarut di dalam cairan tubuh tidak mempengaruhi secara berarti jumlah O2 yang dapat dilarutkan di dalam cairan yang sama, akan tetapi berbagai gas yang terlarut sering saling menggangu reaksi kimianya, misalnya reaksi O2 dan CO2 dengan hemoglobin dalam darah (Fujaya, 2004). Pada ikan proses pernafasan terjadi karena adanya pertukaran gas pada insang secara difusi. Pada proses difusi terjadi suatu aliran molekul gas dari lingkungan/ruang yang konsentrasi gasnya tinggi ke lingkungan/ruang yang konsentrasi gasnya rendah. Persyaratan untuk dapat terjadinya pertukaran gas pada proses pernafasan ikan yaitu: 1) dinding membran dalam insang harus tipis dan lembab; 2) harus terdapat perbedaan tekanan parsial gas antara lingkungan luar dengan lingkungan dalam pada tubuh ikan (Affandi dan Tang, 2002). Untuk lebih jelasnya, proses pertukaran gas yang terjadi pada membran sel di dalam insang ikan, dapat dilihat pada Gambar 2 di bawah ini. 12 Membran sel Lingkungan luar (perairan bebas) O2 tinggi CO2 rendah Lingkungan dalam (kapiler darah) O2 rendah CO2 tinggi Gambar 2. Proses pertukaran gas (Affandi dan Tang, 2002) Banyak peneliti yang telah membuktikan bahwa kecepatan pengambilan atau konsumsi O2 oleh ikan dan kebanyakan mahluk hidup yang bernafas di dalam air akan menurun seiring dengan menurunnya kandungan O2 di dalam air. Oleh karena itu, fenomena tersebut secara umum dijuluki “pernafasan yang tergantung (respiratory dependence)”. Ada pun secara teknis dapat dipahami, tetapi masih banyak terjadi kebingungan yang berhubungan dengan istilah tersebut. Penurunan pengambilan O2 tersebut tidak dapat diinterpretasikan sebagai indikasi dari penurunan proses – proses tubuh yang bersifat fital. Hal tersebut telah diketahui dengan jelas bahwa fenomena “respiratory dependence” berhubungan erat dengan kecepatan metabolisme aktif Ketika ikan berada pada lingkungan perairan dengan kandungan O2 yang terbatas, penurunan kecepatan respirasi yang terjadi seiring dengan penurunan kandungan O2 di lingkungan perairan tersebut, disebabkan karena penurunan dari aktifitas ikan tersebut dan bukan disebabkan karena penurunan metabolisme dasar (standar) pada ikan tersebut (Fry, 1957). 13 Kondisi kandungan O2 yang rendah bagi kehidupan suatu organisme pada suatu lingkungan tertentu disebut hypoxia. Pengaruh dari hypoxia terhadap kecepatan pengambilan O2 dan pelepasan CO2 telah dipelajari pada ikan trout dan ikan mas. Pengaruh penurunan kandungan O2 di dalam suatu perairan pada temperatur yang tetap/sama pada ikan trout mengakibatkan laju pernafasan serta amplitudonya meningkat, laju detak jantungnya menurun, akan tetapi terdapat peningkatan pada volume darah yang dipompa oleh jantungnya. Kerja jantung sedikit bervariasi, akan tetapi perbandingan antara tingkat ventilasi dan perfusi terhadap air (ventilation – perfusion ratio ) meningkat, yang dikarenakan oleh meningkatnya aliran air yang melewati insang. Peningkatan kerja komponen – komponen yang berpengaruh terhadap pertukaran gas (transfer factor) pada insang menyebabkan penurunan pada rata – rata gradien tekanan gas O2 yang terdapat di antara darah dan air yang melewati insang. Tekanan parsial O2 yang terdapat di dalam pembuluh darah menurun seiring dengan penggunaan oleh ikan terhadap cadangan O2 yang terdapat pada pembuluh darah tersebut. Akibat terakhir dari meningkatnya kerja transfer factor dan ventilation – perfusion ratio, dan disertai dengan penurunan kandungan O2 di dalam pembuluh darah adalah suatu usaha pengambilan O2 yang cukup oleh ikan pada awal menurunnya kandungan O2 pada suatu perairan. Pengambilan/konsumsi O2 oleh ikan akan menurun seiring dengan menurunnya tingkat kandungan O2 pada suatu perairan, dan bersamaan dengan hal tersebut pula akan terjadi peningkatan asam laktat pada tubuh ikan. Tingkatan yang tepat kandungan O2 yang rendah di suatu perairan ketika terjadi penurunan pengambilan oksigen oleh ikan, bervariasi tergantung pada setiap jenis ikan. Jenis ikan teleostei diketahui lebih dapat mengatur pengambilan O2 pada suatu perairan dengan berbagai tingkatan kandungan O2 yang lebih luas. Sedangkan jenis ikan elasmobranchi diketahui lebih tidak dapat mengatur pengambilan O2 pada suatu perairan dengan berbagai tingkatan kandungan O2. Akan tetapi kedua jenis ikan tersebut akan menjadi lebih aktif pada kondisi perairan yang rendah O2 dan kemudian segera berusaha untuk keluar dari lingkungan perairan yang rendah O2 tersebut. 14 Peningkatan pada volume ventilasi yang berhubungan dengan penurunan laju detak jantung, diketahui merupakan suatu dampak (response) yang umum pada ikan ketika berada pada kondisi lingkungan yang rendah O2 (hypoxia). Peningkatan pada volume ventilasi memberikan distribusi O2 yang cukup kepada permukaan lapisan alat pernafasan ketika tingkat kandungan O2 di dalam perairan menurun. Laju detak jantung (dalam mengambil O2) yang menurun dapat di atasi dengan peningkatan volume darah yang dipompa oleh jantung pada ikan trout, sehingga hal tersebut hanya mengakibatkan perubahan yang kecil pada kerja jantung. Selama ikan berada dalam pada kondisi lingkungan yang rendah O2 (hypoxia) mengakibatkan pola aliran darah pada ikan tersebut berubah, dibandingkan dengan kerja dari jantung ikan tersebut. Perubahan pola aliran darah yang mengalir melewati insang selama kondisi hypoxia mungkin terjadi untuk memperbesar terjadinya pertukaran gas (gas exchange). Pengaruh yang utama dari temperatur terhadap respirasi ikan adalah merubah pola kebutuhan O2 pada ikan. Perubahan temperatur air dari suhu 100C menjadi 200C dapat meningkatkan konsumsi O2 standar pada ikan maskoki hingga 254%. Akan tetapi tingkat kandungan O2 di dalam air tersebut hanya menurun 18%, hal tersebut disebabkan karena tingkat viskositas (kekentalan) pada air tersebut menurun sehingga laju difusi gas –gas akan terjadi lebih cepat. Koefisien pada persamaan Krogh akan meningkat 1% setiap kenaikan 10C. Sistem pernafasan pada ikan harus dapat beradaptasi untuk memenuhi kebutuhan O2 yang meningkat seiring dengan meningkatnya suhu. Telah terdapat banyak hasil penelitian yang menunjukkan pengaruh dari temperatur terhadap konsumsi O2 oleh ikan pada saat sedang aktif dan beristirahat. Peningkatan konsumsi O2 seiring dengan meningkatnya temperatur berkenaan dengan meningkatnya kerja jantung dan volume ventilasi. Segala sesuatu yang menghambat aliran darah akan berkurang/menurun seiring dengan meningkatnya temperatur, penurunan jumlah beban kerja jantung sangat diperlukan untuk mendukung kerja jantung seiring dengan meningkatnya suhu. 15 Kecepatan penyerapan O2 melalui insang dipengaruhi baik dari kelancaran aliran darah dan air yang mengalir melewati permukaan dari sistem pernafasan, mau pun dari besarnya kinerja komponen – komponen yang berpengaruh terhadap pertukaran gas (transfer factor) pada insang untuk menyerap O2. Tingkat maksimum yang terlihat pada aktifitas dari ikan salmon pada temperatur di atas 150C, ternyata masih dapat ditingkatkan lagi dengan cara menjenuhkan kandungan O2 terlarut pada perairan tersebut. Hal tersebut menunjukkan bahwa selain dipengaruhi oleh kelancaran aliran darah dan air yang mengalir melewati permukaan sistem pernafasan, mau pun oleh besarnya kinerja komponen – komponen pada insang yang berpengaruh terhadap pertukaran gas (transfer factor), kecepatan penyerapan O2 oleh ikan juga dipengaruhi oleh kandungan O2 yang terlarut pada perairan tersebut (Randall, 1970). Tingkat metabolisme standar/basal (tingkat konsumsi O2 standar) merupakan tingkat di mana energi yang dihasilkan hanya untuk dapat mempertahankan kelangsungan hidup ikan saja, sedangakan tingkat metabolisme yang dapat menghasilkan energi yang memungkinkan ikan dapat beraktifitas secara maksimum disebut tingkat metabolisme aktif (tingkat konsumsi O2 aktif). Hubungan antara temperatur dengan tingkat metabolisme standar dan tingkat metabolisme aktif pada ikan maskoki (Carassius auratus) dapat dilihat pada Gambar 3 di bawah ini. 16 Gambar 3. Hubungan antara temperatur dengan laju konsumsi O2 aktif dan standar pada ikan maskoki (Fry dan Hart, 1948) Pada Gambar 3 di atas memperlihatkan bahwa laju konsumsi O2 standar (laju metabolisme standar) ikan maskoki meningkat seiring dengan kenaikan suhu perairan hingga tercapainya suhu tertinggi di mana ikan maskoki akan memasuki suhu letalnya. Hal tersebut menunjukkan dengan jelas bahwa tidak terjadi kerusakan atau melemahnya fungsi enzim pernafasan yang berkenaan dengan laju metabolisme standar hingga pada suhu 350C. Tetapi sebaliknya, laju metabolisme aktif terlihat tidak mengalami perubahan kecepatan (kecepatannya stabil) setelah melewati suhu 300C. Kecepatan yang tetap pada laju metabolisme aktif setelah melewati suhu 300C tersebut mungkin disebabkan karena terjadinya kerusakan enzim pada suhu yang tinggi, sehingga menyebabkan keseimbangan antara efek 17 dari peningkatan tenperatur dengan kemampuan organisme tersebut untuk memberikan respon (Fry dan Hart, 1948).. Telah diketahui bahwa meningkatnya aktifitas ikan berkorelasi kuat dengan temperatur dan tingkat kandungan O2 pada perairan tempat ikan tersebut berada. Temperatur perairan yang tinggi menyebabkan aktifitas ikan yang tinggi pula, sehingga tingkat konsumsi O2 oleh ikan menjadi tinggi akibat tingginya aktifitas ikan (Fry, 1957). Pada Gambar 4 di bawah ini menunjukkan suatu hasil penelitian yang menggambarkan tingkat aktifitas ikan yang berhubungan dengan temperatur dan tingkat kandungan O2 di dalam suatu perairan. Gambar 4. Kecepatan renang ikan Perca flavescens yang berhubungan dengan temperatur dan kandungan O2 di dalam air (Fry, 1957) 18 Efek yang disebabkan dari kombinasi antara kandungan O2 dan temperatur, yang berkenaan dengan laju konsumsi O2 dan kecepatan metabolisme ikan, dapat dilihat pada Gambar 5 di bawah ini. Pada gambar tersebut, gambar bagian sebelah kiri menunjukkan kecepatan standar konsumsi O2, kecepatan maksimum konsumsi O2 pada kondisi udara jenuh, serta kecepatan konsumsi O2 pada kondisi ketika kandungan O2 terlarut terbatas pada beberapa konsentrasi. Sedangkan pada gambar bagian sebelah kanan, garis vertikal paling kanan merupakan kecepatan metabolisme standar pada beberapa temperatur dan menunjukkan seberapa jauh kecepatan konsumsi O2 secara aktif meningkat pada berbagai temperatur dan pada beberapa konsentrasi kandungan O2 terlarut. Gambar 5. Efek dari kandungan O2 dan temperatur terhadap tingkat konsumsi O2 pada ikan Perca flavescens (Fry, 1957) 19 Pada bagian sebelah kiri Gambar 5 di atas menunjukkan bahwa pada ikan P. Flavescens, penurunan kandungan O2 di dalam air hingga mencapai 4 mg/l, dapat mengurangi kecepatan metabolisme aktif dan kemudian dapat mengurangi tingkat aktifitas ikan tersebut pada beberapa temperatur yang diujikan. Penurunan lebih lanjut terhadap kandungan O2 hingga di bawah 4 mg/l, tentunya mengakibatkan penurunan yang lebih jauh pada kecepatan metabolisme aktif pada ikan tersebut. Penurunan kandungan O2 hingga mencapai 1 mg/l pada temperatur yang lebih tinggi, dapat mengakibatkan penurunan kecepatan metabolisme aktif hingga tingkat yang tidak dapat memenuhi kebutuhan metabolisme standar (metabolisme basal). Penurunan kandungan O2 seperti itu dapat mengakibatkan kondisi yang fatal bagi kehidupan ikan tersebut. Ketika kondisi penurunan tingkat aktifitas ikan terus berlanjut dan juga ikut disertai dengan meningkatnya temperatur, maka pada temperatur yang lebih tinggi tingkat aktifitas ikan tersebut juga menjadi sangat tertekan, seperti yang telah ditunjukan pada bagian sebelah kanan Gambar 5 di atas. Dari hal tersebut dapat disimpulkan bahwa ketika kandungan O2 di dalam air rendah, maka kondisi yang optimum bagi ikan adalah pada kondisi temperatur air tersebut yang juga rendah (Fry, 1957). Pada temperatur yang tetap, peningkatan kecepatan konsumsi O2 seiring dengan meningkatnya kandungan O2 terlarut di dalam air akan terhenti dan kecepatan konsumsi O2 tersebut oleh ikan akan stabil pada kecepatan tertentu, walau pun kandungan O2 di dalam air terus bertambah (Fry, 1957). Perbedaan tipe peningkatan kecepatan konsumsi O2 yang terjadi pada tiga spesies ikan yang berbeda, dapat dilihat pada Gambar 6 di bawah ini. 20 Gambar 6. Perbedaan tipe kecepatan konsumsi O2 pada tiga spesies ikan yang berbeda pada suhu 200C (Fry, 1957) Pada Gambar 6 di atas ditunjukkan bahwa dengan meningkatnya kandungan O2 di dalam air pada suhu yang tetap, peningkatan kecepatan konsumsi O2 pada ikan Carassius auratus (ikan maskoki) lebih cepat terhenti dan stabil pada kecepatan tertentu dibandingkan dengan dua jenis ikan lainnya. Pada ikan Perca flavescens, peningkatan kecepatan konsumsi O2 seiring meningkatnya kandungan O2 di dalam air terjadi lebih lama dibandingkan pada ikan Carassius auratus, tetapi lebih cepat terhenti dan stabil pada kecepatan tertentu dibandingkan dengan ikan Salvelinus fantinalis. Pada ikan Salvelinus fantinalis, peningkatan kecepatan konsumsi O2 seiring meningkatnya kandungan O2 di dalam air terjadi lebih lama dan stabil pada kecepatan tertentu setelah kandungan O2 di dalam air jauh lebih tinggi dari pada kandungan O2 ketika kecepatan komsumsi O2 pada ikan Carassius auratus dan Perca flavescens mengalami kestabilan pada kecepatan tertentu. 21 Affandi dan Tang (2002) juga menyatakan bahwa kandungan O2 terlarut di perairan akan mempengaruhi tingkat konsumsi O2 oleh ikan. Pada kisaran toleransi, tingkat (kecepatan) konsumsi O2 meningkat dengan meningkatnya kandungan O2 di perairan dan mencapai nilai maksimum ketika dicapai konsentrasi optimum. Di atas konsentrasi optimum tersebut, tingkat konsumsi O2 oleh ikan relatif konstan. Sebelum tercapainya konsentrasi O2 optimum tersebut, di mana tingkat konsumsi O2 meningkat dengan meningkatnya kandungan O2 di perairan, di sebut zona dependence atau “pernafasan yang tergantung” menurut Fry (1957). Setelah tercapainya konsentrasi O2 optimum, di mana tingkat konsumsi O2 oleh ikan relatif konstan, disebut zona independence. Untuk lebih jelasnya, pengaruh O2 terlarut di dalam air terhadap tingkat konsumsi O2 oleh ikan, dapat dilihat pada Gambar 7 di bawah ini. K O2 Zona dependence Zona independence (mg O2/kg/jam) Maksimum Optimum Gambar 7. Pengaruh kandungan O2 terlarut di media terhadap tingkat konsumsi O2 oleh ikan (Affandi dan Tang, 2002) 22 Peningkatan tekanan parsial gas CO2 di dalam perairan telah diketahui dapat mengakibatkan penurunan kecepatan konsumsi O2 oleh ikan. Ikan rainbow trout memberikan reaksi/respon yang nyata kira – kira pada tekanan parsial CO2 10 mm.Hg, sedangkan kecepatan konsumsi O2 oleh belut tidak terpengaruh meski pun tekanan parsial CO2 mencapai kira – kira 40 mm.Hg. Terdapat suatu penelitian kecil yang mengujikan efek dari CO2 bebas terhadap kecepatan konsumsi O2 secara aktif oleh ikan. Data awal yang diperoleh pada penelitian terhadap ikan Salvelinus fantinalis yang diujikan pada suhu 100C, menunjukkan bahwa semua tekanan pasial CO2 bebas dapat mengakibatkan penurunan pada kecepatan konsumsi O2 secara aktif tergantung pada besarnya tekanan parsial CO2 bebas itu sendiri, serta kecepatan konsumsi O2 secara aktif dapat mengalami penurunan sampai batas yang dibutuhkan untuk terjadinya proses metabolisme basal pada tekanan parsial CO2 kira – kira sebesar 25 mm.Hg (Fry, 1957). Data hasil pengujian terhadap ikan umbra limi menunjukkan bahwa kecepatan konsumsi O2 secara aktif tidak menunjukkan adanya tanda – tanda mengalami penurunan hingga tercapai tekanan parsial CO2 yang telah melebihi 100 mm.Hg. Pada kebanyakan karakteristik dari spesies ikan, memberikan respon yang sangat kecil terhadap CO2. Data hasil pengujian kecepatan konsumsi O2 pada tiga jenis ikan Indian carp, Catla catla, Labeo rohita, dan Cirrhina mrigala, bersamaan dengan ikan maskoki, menunjukkan bahwa ikan – ikan tersebut tidak mengalami akibat yang fatal terhadap tekanan parsial CO2 hingga mencapai 100 mm.Hg. Pada kondisi lingkungan yang sesungguhnya yang terjadi di alam, berbagai tingkat tekanan parsial dari CO2 mempunyai dampak yang kecil terhadap kecepatan konsumsi O2 oleh ikan (Fry, 1957). Affandi dan Tang (2002) juga menyatakan bahwa kadar CO2 di perairan akan mempengaruhi laju konsumsi oksigen oleh ikan. Hubungan antara kadar CO2 di perairan dengan tingkat/kecepatan/laju konsumsi O2 pada ikan dapat dilihat pada Gambar 8 di bawah ini. 23 K. O2 (mgO2/kg/jam) [ CO2 ] Gambar 8. Kurva hubungan antara kadar CO2 dan tingkat konsumsi O2 oleh ikan (Affandi dan Tang, 2002) Semakin tinggi kadar CO2 di perairan, maka akan semakin rendah tingkat konsumsi O2 oleh ikan. Hal tersebut terjadi karena pada saat kadar CO2 di perairan tinggi maka CO2 yang diikat oleh Hb (butir darah merah) sulit dilepaskan ke luar tubuh melalui insang. Seperti yang telah dipaparkan di awal, syarat terjadinya pelepasan CO2 dari tubuh (insang) ikan ke media lingkungan (ke perairan) adalah jika tekanan parsial (konsentrasi) CO2 di perairan lebih rendah dari pada tekanan CO2 yang terdapat di dalam kapiler darah pada lamela sekunder insang. Akibat dari minimumnya CO2 yang dilepaskan oleh Hb, maka O2 yang dapat diikat oleh Hb pun menjadi sedikit pula, hal tersebut ditunjukkan oleh rendahnya tingkat konsumsi O2 oleh ikan tersebut (Affandi dan Tang, 2002). 2. 4. Transportasi Ikan Hidup Transportasi ikan hidup merupakan tindakan memindahkan ikan dalam keadaan hidup yang di dalamnya diberikan tindakan – tindakan untuk menjaga agar derajat kelulusan hidup (survival rate) ikan tinggi atau ikan tetap berada dalam kondisi hidup setelah sampai di tempat tujuan. Pengangkutan ikan hidup pada dasarnya adalah memaksa ikan untuk ditempatkan di dalam suatu lingkungan yang berlainan dengan lingkungan asalnya dan disertai dengan perubahan – perubahan sifat lingkungan yang mendadak (Wibowo et al., 1994). Menurut Wibowo (1993), transportasi ikan hidup dapat dilakukan dengan dua 24 cara, yaitu pengangkutan ikan dengan media air (sistem basah) dan tanpa media air (sistem kering). 2. 4. 1. Sistem basah Transportasi ikan hidup dengan media air dapat dilakukan dengan dua cara yaitu sistem terbuka dengan pemberian aerasi terus – menerus dan sistem tertutup dengan aerasi yang terbatas. Pada transportasi dengan media air sistem terbuka, ikan diangkut dalam wadah terbuka yang kedap panas yang biasanya dipasang pada kendaraan roda empat. Pada transportasi dengan media air sistem terbuka, suplai O2 diberikan secara terus – menerus dengan pemberian aerasi selama perjalanan. Transportasi dengan media air sistem terbuka biasanya dilakukan jika jumlah ikan yang diangkut relatif sedikit, jarak tempuhnya dekat, serta dalam waktu yang relatif singkat (Daelami, 2001). Wadah terbuka yang paling umum digunakan untuk pengangkutan ikan maskoki adalah keramba. Keramba merupakan wadah yang terbuat dari bambu yang dianyam membentuk keranjang. Pada seluruh lapisan bagian dalam dan luar keramba dilapisi dengan ter untuk mencegah kebocoran air. Umunya keramba mempunyai ukuran 80 x 70 cm di bagian dasarmya dan tinggi 22 cm. Tinggi air yang digunakan dalam pengangkutan ikan maskoki dengan keramba adalah 10 cm. Jumlah ikan maskoki yang dapat diangkut dengan keramba relatif sedikit. Dua buah keramba hanya mampu mengangkut 100 – 150 ekor ikan maskoki yang mempunyai ukuran 5 cm. Bila untuk mengangkut induk maskoki, dua buah keramba hanya mampu menampung 20 – 30 ekor saja. Keramba hanya dapat digunakan untuk pengangkutan ikan maskoki dalam jarak dekat atau waktu tempuh yang relatif singkat. Sebagai sumber O2 bagi ikan yang diangkut dengan keramba adalah berasal dari kontak yang terjadi antara permukaan air dan udara di sekeliling keramba saja. Oleh karena itu, supaya kandungan O2 yang terlarut di dalam air selalu memadai, selama dalam pengangkutan petani sering menggerak – gerakkan air di dalam keramba atau memanfaatkan getaran yang berasal dari kendaraan bermotor yang mengangkut keramba tersebut (Liviawaty dan Afrianto, 1999). 25 Pada transportasi dengan media air sistem tertutup, ikan diangkut dalam wadah yang tertutup dengan pemberian gas O2 dalam jumlah terbatas yang telah diperhitungkan sesuai dengan kebutuhan selama pengangkutan. Transportasi dengan media air sistem tertutup biasanya dilakukan untuk mengirim ikan dalam jumlah yang relatif banyak, pada jarak yang jauh, dan waktu yang relatif lama, misalnya pada waktu pengiriman ikan hias untuk ekspor (Daelami, 2001). Wadah yang digunakan pada transportasi dengan media air sistem tertutup dapat berupa kantung plastik atau kemasan lain yang ditutup rapat. Kepadatan ikan yang diangkut tergantung volume air, bobot dan ukuran ikan, jarak dan lama pengangkutan, suplai O2, dan temperatur (Sunyoto, 1993). Pada transportasi dengan media air sistem terutup, wadah yang biasa atau paling sering digunakan untuk mengangkut ikan maskoki adalah kantung plastik. Kantung plastik yang baik digunakan untuk pengangkutan ikan mempunyai ukuran lebar 50 cm dan ketebalan 0.03 mm. Ada pun cara membuat kantung plastik tersebut sangat mudah. Lembaran plastik dipotong hingga sepanjang 2 m, kemudian dilipat menjadi dua bagian yang sama. Bagian lipatan ini selanjutnya dibuat ikatan (dibundel). Salah satu bagian plastik kemudian dibalik, sehingga membentuk sebuah kantung rangkap dua. Pada 1/3 bagian dari volume kantung plastik tersebut diisi dengan air bersih dan disusul dengan memasukkan ikan – ikan yang akan ditransportasi. Sebelum diisi gas O2, sebaiknya udara yang terdapat di dalam kantung plastik tersebut dikeluarkan terlebih dahulu. Volume gas O2 yang diisikan harus mencapai 2/3 bagian dari volume kantung palstik tersebut atau 2 kali volume air. Jumlah ikan maskoki yang dapat diangkut dengan cara ini jauh lebih banyak. Untuk ikan maskoki yang berukuran 5 cm dapat diangkut hingga sebanyak 100 ekor. Tetapi bila untuk mengangkut induk ikan maskoki, jumlahnya tidak boleh melebihi 50 ekor. Penggunaan kotak karton pada pengangkutan ikan dengan kantung plastik, sebaiknya pada lapisan dalam karton diberi lapisan atau kemasan dalam (inner packaging) berupa styrofoam yang agak tebal. Hal tersebut dimaksudkan untuk mengurangi kontak yang terjadi antara air di dalam kantung dengan temperatur lingkungannya yang relatif lebih panas. Untuk pengangkutan pada jarak yang 26 lebih jauh, sebaiknya di dalam kemasan styrofoam tersebut diberi potongan – potongan es batu yang dibungkus dalam kantung plastik kecil. Hal tersebut bertujuan untuk mencegah peningkatan temperatur air di dalam kantung yang terlalu cepat. Penggunaan kantung plastik kecil untuk membungkus es bertujuan agar es yang mencair tidak membasahi kemasan. Jumlah es yang digunakan sebaiknya tidak melebihi 10% dari berat air dalam kantung plastik tempat ikan. Untuk meningkatkan daya tahan ikan dan agar kondisi ikan setelah ditransportasi masih tetap bugar dan sehat, maka sebelum dilakukannya transportasi dilakukan pemberokan terhadap ikan tersebut. Pemberokan adalah membiarkan ikan selama beberapa waktu di suatu kolam tanpa diberi pakan. Tujuan pemberokan adalah untuk mengosongkan makanan yang ada di dalam lambung dan usus ikan. Dengan demikian, selama dalam pengangkutan, aktivitas metabolisme ikan akan tetap rendah dan efek keracunan yang disebabkan karena penimbunan kotoran hasil metabolisme makanan menjadi berkurang. Penimbunan kotoran hasil metabolisme makanan dapat mengalami proses pembusukan oleh organisme pengurai. Proses ini selain dapat meracuni ikan itu sendiri, juga banyak membutuhkan O2, sehingga kandungan O2 di dalam wadah pengangkutan akan cepat berkurang. Keadaan ini akan sangat membahayakan, sebab ikan dapat menjadi lemas karena keracunan atau kekurangan O2 sehingga akhirnya dapat menyebabkan kematian. Untuk pengangkutan jarak jauh, biasanya ikan diberok terlebih dahulu di dalam kolam khusus selama 1 – 2 hari (Liviawaty dan Afrianto, 1999). Salah satu faktor yang banyak mengakibatkan kematian ikan selama pengangkutan yaitu stres yang umumnya ditimbulkan oleh kepanikkan. Untuk mengurangi stres, selama dalam wadah pengangkutan sebaiknya ikan dibuat pasif (Jangkaru, 2003). Masalah yang dihadapi dalam transportasi ikan hidup adalah bagaimana menekan aktifitas metabolisme ikan agar kebutuhan O2 maupun hasil metabolismenya sekecil mungkin. Dengan menekan aktifitas metabolisme serendah mungkin, maka ikan dapat mempertahankan hidupnya lebih lama (Tseng, 1987). 27 Kandungan O2 terlarut sangat dipengaruhi sekali oleh stres, suhu air, pH, konsentrasi CO2, dan metabolisme lain. Kadungan O2 terlarut di atas 5 mg/l dapat menjamin ikan tidak akan mengalami stres dan kandungan O2 terlarut dalam media pengangkut harus lebih besar dari 7 mg/l dan lebih kecil dari tingkat jenuh (Piper et al., 1982). Amoniak dan hasil metabolisme ikan lainnya dapat mengubah nilai pH air media pengangkutan. Nilai pH air yang ideal bagi kehidupan ikan adalah 6.5 sampai 8.5, namun pH optimal untuk pengangkutan ikan hidup adalah 6 – 7, sedangkan pH yang lebih kecil dari 4 dan lebih besar dari 9 akan membunuh ikan. Tetapi dalam kondisi pengangkutan, pH air dapat mencapai antara 5.5 – 6.5 tanpa ada kematian (Wardoyo dan Jokosetyani, 1988). Kadar CO2 terlarut lebih dapat ditoleransi oleh ikan dibandingkan dengan amoniak. Kadar CO2 sebesar 50 – 100 mg/l dapat membunuh ikan dalam waktu relatif lama dan kadar CO2 antara 300 – 600 mg/l akan membahayakan ikan dalam transportasi (Fry dan Norris, 1962). 2. 4. 2. Sistem kering Transportasi ikan hidup tanpa media air merupakan sistem pengangkutan ikan hidup dengan media pengangkutan bukan air. Karena tidak menggunakan air, ikan dibuat dalam kondisi tenang atau akifitas respirasi dan metabolismenya rendah. Kondisi tersebut dapat dicapai apa bila ikan dalam kondisi pingsan (imotil) (Wibowo, 1993). Pemingsanan ikan merupakan suatu tindakan yang membuat kondisi dimana tubuh ikan kehilangan kemampuan untuk merasa (insensibility). Pada proses pemingsanan, ikan akan mengalami perubahan fisiologis dari keadaan hidup aktif menjadi dorman/pingsan. Ketika ikan dalam keadaan pingsan, metabolismenya berada pada tingkat yang paling rendah dari metabolisme basal, sehingga kelulusan hidup di luar media air tinggi (Setiabudi et al., 1995). Pemingsanan ikan dapat dilakukan dengan menggunakan senyawa – senyawa kimia, suhu dingin, arus listrik, dan penyakit (Anonim, 1980). Pemingsanan ikan untuk pengangkutan dapat menurunkan laju konsumsi O2, tingkat laju eksresi karbondioksida, amoniak, dan sisa buangan lainnya (Jhingran dan Pulin, 1985). Pada pemingsanan udang dengan suhu rendah, udang telah 28 berada pada keadaan pingsan pada suhu 150C. Pada kondisi pingsan tersebut, laju respirasi udang adalah sebesar 0.02 mg O2/kg/menit. Sedangkan ketika berada pada kondisi normal atau pada kondisi udang masih dapat bergerak aktif pada suhu 270C, laju respirasi udang sebesar 0.45 mg O2/kg/menit (Nitibaskara et al. 1997). Pemingsanan dengan suhu rendah dapat dibagi menjadi dua katagori, yaitu pemingsanan dengan penurunan suhu secara bertahap dan pemingsanan dengan suhu rendah secara langsung. Pemingsanan udang dengan penurunan suhu secara bertahap dilakukan dengan cara menurunkan suhu dengan kecepatan 50C/jam higga mencapai suhu 150C, dan pada suhu ini udang dipertahankan selama 15 menit. Pemingsanan udang dengan penurunan suhu secara bertahap ini menghasilkan tingkat kelulusan hidup sebesar 90% setelah udang tersebut ditransportasi kering di dalam media serbuk gergaji lembab dingin (140C) selama 22 jam. Pada pemingsanan udang dengan suhu rendah secara langsung dilakukan dengan cara memasukkan udang secara langsung ke dalam air dingin bersuhu 180C selama 15 menit. Pemingsanan udang dengan suhu rendah secara langsung ini menghasilkan tingkat kelulusan hidup sebesar 40% setelah udang tersebut ditransportasi kering di dalam media serbuk gergaji lembab dingin (140C) selama 22 jam . Dari hasil penelitian tersebut dapat diketahui bahwa pemingsanan udang dengan penurunan suhu secara bertahap menghasilkan tingkat kelulusan hidup lebih baik dari pada pemingsanan udang dengan suhu rendah secara langsung untuk transportasi udang hidup tanpa media air (sistem kering) (Nitibaskara et al. 1997). Kelebihan dalam transportasi ikan hidup tanpa media air antara lain adalah: 1) tidak diperlukan wadah transportasi yang besar, karena ikan yang pingsan tidak bergerak atau berenang, 2) tidak terjadi kematian akibat kelelahan atau stres karena getaran dan kebisingan, 3) tidak terjadi kehilangan berat, dan 4) tidak membuang kotoran dan melakukan aktivitas makan selama pingsan (Ditjen Perikanan, 1993 dalam Jailani, 2000). Ikan hidup yang akan ditransportasi dipersyaratkan dalam kondisi sehat atau tidak cacat. Ikan yang kurang sehat atau lemah mempunyai daya tahan hidup yang rendah dan peluang untuk mati selama pemingsanan dan pengangkutan lebih besar. Karena itu pemeriksaan kondisi 29 kesehatan ikan selalu dilakukan untuk mengurangi kemungkinan mortalitas yang tinggi. Sedangkan adanya cacat seperti cacat sirip, mata, kulit rusak, dan sebagainya dapat menurunkan harga jual. Pada pengangkutan sistem kering diperlukan media pengisi sebagai pengganti air. Bahan pengisi tersebut harus dapat ditempatkan di antara ikan hidup dalam kemasan untuk menahan ikan dalam posisinya. Bahan pengisi tersebut juga harus mampu menjaga suhu ruang penyimpanan agar tetap rendah sehingga ikan tetap immotil serta memberi kelembaban yang memadai untuk kelangsungan hidupnya (Wibowo, 1993). Proses pertukaran gas secara difusi oleh ikan juga dapat terjadi di dalam media lingkungan dingin dan lembab yang bukan air. Hal tersebut memungkinkan karena media bukan air yang lembab memberikan suasana lembab dan basah di daerah sekitar insang, sehingga titik – titik air yang menempel pada insang menjadi media pertukaran gas secara difusi dengan lingkungan sekitar. Pada penelitian Irania (2003), dilakukan pengukuran laju penurunan konsentrasi O2 pada media serbuk gergaji dingin dan lembab yang mengemas ikan mas, ikan patin, ikan lele, dan udang windu di dalam beberapa kotak styrofoam yang berbeda. Ikan mas, ikan patin, ikan lele, dan udang windu yang dikemas di dalam kotak styrofoam bermedia pengisi serbuk gergaji dingin dan lembab tersebut, telah berada dalam keadaan pingsan. Suhu media serbuk gergaji dingin merupakan suhu yang terbaik untuk penyimpanan dari masing – masing jenis ikan yang diperoleh dari hasil pengujian sebelumnya. Ikan mas yang telah berada dalam kondisi pingsan, di kemas di dalam kemasan boks styrofoam berisi media serbuk gergaji dingin (140C) dan lembab, kemudian boks styrofoam tersebut didiamkan pada suhu kamar selama 5 jam. Hasil pengukuran menunjukkan laju penurunan konsentrasi O2 yang terjadi di dalam kemasan boks styrofoam adalah sebesar 0.082% per jam. Pada kondisi tersebut, setelah penyimpanan selama 5 jam, tingkat kelulusan hidup ikan mas hanya 59.83%. Sedangkan bila kemasan boks styrofoam berisi ikan mas tersebut disimpan di dalam peti kemas yang suhu ruangnya relatif stabil pada 140C, maka laju penurunan konsentrasi O2 di dalam kemasan boks styrofoam hanya sebesar 30 0.022% per jam, dan kelulusan hidup ikan yang dihasilkannya cukup tinggi yaitu sebesar 93.3%. Ikan patin yang telah berada dalam kondisi pingsan, di kemas di dalam kemasan boks styrofoam berisi media serbuk gergaji dingin (170C) dan lembab, kemudian boks styrofoam tersebut didiamkan pada suhu kamar selama 3 jam. Hasil pengukuran menunjukkan laju penurunan konsentrasi O2 yang terjadi di dalam kemasan boks styrofoam adalah sebesar 0.1% per jam. Pada kondisi tersebut, setelah penyimpanan selama 3 jam, tingkat kelulusan hidup ikan patin hanya sebesar 33.3%. Sedangkan bila kemasan boks styrofoam berisi ikan patin tersebut disimpan di dalam peti kemas yang suhu ruangnya relatif stabil pada 170C, maka laju penurunan konsentrasi O2 di dalam kemasan boks styrofoam hanya sebesar 0.036% per jam, dan kelulusan hidup ikan yang dihasilkannya lebih tinggi yaitu sebesar 90.6%. Ikan lele yang telah berada dalam kondisi pingsan, di kemas di dalam kemasan boks styrofoam berisi media serbuk gergaji dingin (140C) dan lembab, kemudian boks styrofoam tersebut didiamkan pada suhu kamar selama 15 jam. Hasil pengukuran menunjukkan laju penurunan konsentrasi O2 yang terjadi di dalam kemasan boks styrofoam adalah sebesar 0.2% per jam. Pada kondisi tersebut, setelah penyimpanan selama 15 jam, tingkat kelulusan hidup ikan lele sebesar 87.5%. Sedangkan bila kemasan boks styrofoam berisi ikan lele tersebut disimpan di dalam peti kemas yang suhu ruangnya relatif stabil pada 140C, maka laju penurunan konsentrasi O2 di dalam kemasan boks styrofoam hanya sebesar 0.015% per jam, dan kelulusan hidup ikan yang dihasilkannya juga lebih tinggi yaitu sebesar 93.33%. Udang windu yang telah berada dalam kondisi pingsan, di kemas di dalam kemasan boks styrofoam berisi media serbuk gergaji dingin (170C) dan lembab, kemudian boks styrofoam tersebut didiamkan pada suhu kamar selama 15 jam. Hasil pengukuran menunjukkan laju penurunan konsentrasi O2 yang terjadi di dalam kemasan boks styrofoam adalah sebesar 0.15% per jam. Pada kondisi tersebut, setelah penyimpanan selama 15 jam, tingkat kelulusan hidup udang windu hanya sebesar 60%. Sedangkan bila kemasan boks styrofoam berisi udang windu tersebut disimpan di dalam peti kemas yang suhu ruangnya relatif stabil 31 pada 170C, maka laju penurunan konsentrasi O2 di dalam kemasan boks styrofoam hanya sebesar 0.012% per jam, dan kelulusan hidup ikan yang dihasilkannya juga lebih tinggi yaitu sebesar 84.17%. Pola suhu kemasan sangat dipengaruhi oleh suhu awal bahan pengisi dan suhu lingkungan. Menurut Setyowati (1995), jika perbedaan antara suhu kemasan dan suhu lingkungan terlalu besar, maka kenaikan suhu kemasan lebih cepat terjadi. Kelulusan hidup ikan selama transportasi sistem kering sangat dipengaruhi oleh suhu ruang penyimpanan, termasuk suhu media pengisi. Irania (2003) melaporkan bahwa ikan lele dengan berukuran 6 ekor/kg yang dipingsankan secara bertahap hingga suhu 100C, lalu diteletakkan dalam kemasan styrofoam tipe rak bermedia pengisi serbuk gergaji dan ditransportasi (statis) selama 10 jam dalam peti kemas bersuhu ruang 120C, menghasilkan tingkat kematian sebesar 86% dan hampir semua ikan lele yang mati menunjukkan kulit yang pucat dan tubuh berwarna merah karena pecahnya pembuluh darah. Sedangkan pada suhu ruang penyimpanan 140C dan 150C menghasilkan tingkat kelulusan hidup 100%. Pada ikan patin dengan ukuran 5 ekor/kg yang dipingsankan secara bertahap hingga suhu 130C, lalu diletakkan dalam kemasan styrofoam tipe rak bermedia pengisi serbuk gergaji dan ditransportasi (statis) selama 3 jam, menghasilkan kelulusan hidup sebesar 30% di dalam peti kemas bersuhu ruang 140C. Pada peti kemas bersuhu ruang 170C, menghasilkan kelulusan hidup sebesar 92.3%. Sedangkan Pada peti kemas bersuhu ruang 180C menghasilkan kelulusan hidup sebesar 48.2%. Pada ikan mas dengan ukuran 5 ekor/kg yang dipingsankan secara bertahap hingga suhu 7.70C, lalu diletakkan dalam kemasan styrofoam tipe rak bermedia pengisi serbuk gergaji dan ditransportasi (statis) selama 5 jam, menghasilkan kelulusan hidup sebesar 25% dalam peti kemas bersuhu ruang 130C. Pada peti kemas bersuhu ruang 140C menghasilkan kelulusan hidup sebesar 92.3%. Sedangkan pada peti kemas bersuhu ruang 150C menghasilkan kelulusan hidup sebesar 50%. 32 Dari hasil penelitian Syuaib (2002) didapatkan bahwa ikan lele berukuran 3 ekor/kg yang dipingsankan secara bertahap hingga suhu 100C, lalu diteletakkan dalam kemasan styrofoam tipe rak bermedia pengisi serbuk gergaji dan ditransportasi (statis) selama 2 jam dalam peti kemas bersuhu ruang 170C menghasilkan tingkat kelulusan 80%. Sedangkan untuk transportasi (statis) pada suhu ruang 150C selama 10 jam menghasilkan tingkat kelulusan 100%. Ikan patin dengan ukuran 3 ekor/kg yang dipingsankan secara bertahap hingga suhu 130C, lalu diteletakkan dalam kemasan styrofoam tipe rak bermedia pengisi serbuk gergaji lembab dan dingin (130C), kemudian ditransportasi (statis) selama 16 jam dalam peti kemas bersuhu ruang 150C, menyebabkan seluruh ikan (7 ekor) mati dalam keadaan kulit pucat, kaku, dan sirip berwarna merah. Pada transportasi selama 3 jam dengan suhu ruang 170C dan suhu serbuk gergaji 150C menghasilkan tingkat kelulusan hidup sebesar 77.78% dari 9 ekor yang digunakan, tetapi dalam kondisi yang sangat lemah. Prasetyawati (1994) juga melaporkan bahwa ikan gurame dengan ukuran 500 – 600 gram/ekor yang telah ditenangkan pada suhu 200C selama 6 jam, lalu dipingsankan dengan penurunan suhu secara bertahap sampai suhu 120C, mempunyai tingkat kelulusan hidup 100% setelah ditransportasi selama 2 jam, 58.34% setelah ditransportasi selama 4 jam, dan 33.33% setelah ditransportasi selama 6 jam. Ikan gurame tersebut dikemas dalam kotak styrofoam yang terdiri dari kotak inner dan outer. Ikan gurame yang pingsan diletakkan berlapis – lapis dengan media serutan kayu lembab bersuhu 120C, lalu diantara kotak inner dan outer diisi serutan kayu dan hancuran es batu. Dari hasil penelitian Jailani (2000) dilaporkan bahwa ikan mas berukuran 125 – 200 gram/ekor yang dipingsankan dengan suhu rendah secara bertahap sampai 80C, lalu ikan tersebut dibungkus dengan pelepah pisang dan dikemas dalam kotak styrofoam yang terlebih dulu alasnya diberi lapisan es dan pelepah pisang, menghasilkan kelulusan hidup 100% setelah ditransportasi (statis) selama 6 jam. Suhu ruang yang terukur dalam kemasan tersebut adalah ±140C. 33 2. 5. Kemasan Transportasi Para petani ikan di Indonesia mengawetkan ikan dengan es di dalam kotak pendingin (cool box). Pengawetan dengan cool box ini menggunakan insulator dari bahan plastik busa putih atau styrofoam setebal 2.5 cm (sigit, 1986). Sifat insulator dari styrofoam ini terjadi karena konduktifitas dari styrofoam yang relatif rendah jika dibandingkan dengan bahan – bahan yang lain, yaitu sebesar 0.433 W/moK (Geankoplis, 1987). Faktor yang memegang peranan penting dalam mempertahankan mutu ikan adalah konstruksi peti kemas dan bahan isolasi yang dipakai untuk menyimpan dan mengangkut ikan. Masing – masing sisi peti terdiri atas tiga lapis bahan yang berbeda – beda. Lapisan luar dapat terbuat dari lembaran plastik, papan kayu, plat logam (seng atau alumunium), atau kombinasi dari bahan – bahan tersebut. Lapisan isolasi tengah berupa isolator seperti polystyrena atau styrofoam. Lapisan dalam atau lining terbuat dari lembaran plastik, pelat logam, seng, atau alumunium. Untuk tujuan pengangkutan, wadah berisolasi ini dapat dibuat berbentuk peti (cool box) yang tidak terlalu berat dan terlalu besar. Tinggi peti dibuat sedemikian rupa sehingga tinggi tumpukan ikan dan es di dalamnya tidak melebihi 50 cm. Sedangkan untuk tujuan penyimpanan, cool box, dapat dibuat dari peti kayu berisolasi yang lebih besar karena peti ini biasanya tidak dipindah – pindahkan. Selain itu lapisan isolasinya harus lebih tebal, yaitu kurang lebih 10 cm (soeseno, 1983). Pada pengangkutan ikan hidup sistem kering digunakan kotak styrofoam sebagai kemasan dalam (inner packaging), kemudian kotak styrofoam tersebut dilapisi kotak karton sebagai kemasan luarnya (outter packaging). Lapisan paling bawah diisi serbuk gergaji yang telah didinginkan, lalu ikan yang telah dipingsankan disusun di atasnya, dan kemudian ikan tersebut ditutupi dengan serbuk gergaji yang sama. Hal tersebut terus dilakukan sampai kotak styrofoam penuh (Tseng, 1987). 34 Tipe kemasan dengan rak merupakan tipe yang bagus untuk kemasan dingin ikan hidup yang terdiri atas dinding kemasan dari kotak styrofoam dan kotak karton berukuran 30 x 30 x 50 cm3. Isi kotak terdiri atas ikan, bahan pengisi, dan rak plastik. Efisiensi kemasan tersebut 70% dan biaya materi kemasan 5% dari harga ikan hidup yang dikemas (Soekarto dan Wibowo, 1993). Dari seleksi susunan dan kontruksi kemasan terhadap kemasan bertingkat, kemasan berlapis, dan kemasan rak, ternyata kemasan yang paling optimum untuk pengemasan ikan hidup adalah kemasan rak, dengan efisiensi kemasan sebesar 44.25% dan kapasitas panasnya sebesar 122.6 KJ. Kemasan bertingkat meski pun memiliki kapasitas panas yang tinggi (150.8 KJ), tetapi mempunyai efisiensi paling rendah (31.19%), sedangkan kemasan berlapis mempunyai nilai efisiensi kemasan paling tinggi (50%), tetapi nilai kapasitas panasnya paling rendah (103.9 KJ), sehingga kedua konstruksi kemasan ini kurang efektif digunakan sebagai pengemas (Prasetyo, 1993). Kotak styrofoam dapat digunakan sebagai kemasan primer (kemasan dalam) dalam pengangkutan ikan hidup, untuk menghindari penetrasi panas yang dapat merubah suhu di dalam kotak pengemas (Prasetyo, 1993). Istilah teknis styrofoam adalah foamed polystyrene (FPS) atau expanded polystyren. Sifat insulator dari styrofoam ini terjadi karena konduktifitas dari styrofoam tersebut yang relatif rendah jika dibandingkan dengan bahan – bahan yang lain (Ilyas, 1983). Sifat – sifat penting dari styrofoam sebagai bahan insulasi dapat dilihat pada Tabel 1 di bawah ini. Tabel 1. Sifat – sifat styrofoam sebagai bahan insulasi Sifat styrofoam Nilai 3 Densitas (Kg/m ) 15 – 30 0 Konduktifitas panas (kkal/m jam C) 0.030 Ketahanan terhadap masuknya air Baik Ketahanan terhadap api Jelek 3 Kekuatan kompresi (Kg/m ) Sumber: Ilyas (1983) 2000 35 2. 6. Media Pengisi Kemasan Media pengisi kemasan adalah bahan yang dapat ditempatkan di antara ikan hidup dalam kemasan untuk menahan atau mencekal ikan dalam posisinya. Media pengisi kemasan berfungsi untuk menahan ikan agar tidak bergeser di dalam kemasan, menjaga suhu lingkungan di dalam kemasan tetap rendah agar ikan tetap berada dalam kondisi pingsan, serta memberi lingkungan udara dan RH yang memadai untuk kelangsungan hidupnya. Media pengisi kemasan atau bahan pengisi yang biasa digunakan dalam pengemasan adalah serbuk gergaji, serutan kayu, kertas koran, sekam padi, rumput laut Gracilaria tambak, Gracilaria laut, rumput laut Euchema, atau bahkan karung goni. Namum penggunaan karung goni sudah ditinggalkan karena hasilnya kurang bagus. Jenis serbuk gergaji atau serutan kayu yang digunakan tidak spesifik, tergantung bahan yang tersedia. Dari berbagai jenis bahan pengisi tersebut, ternyata sekam padi dan serutan kayu merupakan media kemasan yang terbaik untuk ikan yang dikemas hidup karena memiliki karakteristik berongga, kuat mencekal ikan dalam kemasan, mempunyai kapasitas panas yang memadai, tidak beracun, dan memberi lingkungan RH tinggi. Stabilitas suhu isi kemasan dengan bahan pengisi sekam padi dapat mencapai 16 jam. Sekam padi dan serbuk gergaji adalah media pengisi kemasan yang paling efektif dan efisien untuk pengemasan ikan hidup. Hal tersebut disebabkan karena teksturnya yang baik (seragam) dan nilai ekonomisnya yang rendah. Bahan pengisi kemasan serutan kayu kurang efektif, karena dapat menimbulkan kerusakan fisik pada ikan selama pengemasan, sedangkan rumput laut Gracilaria dan Euchema kurang efektif digunakan sebagai bahan pengisi karena dapat menimbulkan lendir dan bau basi setelah 46 jam digunakan (Soekarto dan Wibowo, 1993). Menurut Prasetyo (1993), bahan pengisi yang paling baik adalah sekam padi dan serbuk gergaji karena teksturnya seragam dan nilai ekonomisnya rendah. Serutan kayu dinilai kurang efektif karena dapat menimbulkan kerusakan fisik, sedangkan rumput laut dapat menimbulkan lendir atau bau basi setelah 48 jam digunakan. Keunggulan media serbuk gergaji terutama terlihat pada performa mempertahankan suhu. Serbuk gergaji mampu mempertahankan suhu rendah 36 sampai 9 jam tanpa bantuan es dan tanpa beban di dalamnya. Kondisi ini ditampilkan oleh serbuk gergaji yang dilembabkan dengan air laut dengan perbandingan 4 : 3 (serbuk gergaji : air) (Utomo et al., 1998). Dari hasil pengukuran yang dilakukan oleh Prasetyo (1993), diketahui bahwa nilai panas jenis dan nilai kapasitas panas terbesar dimiliki oleh kemasan dengan bahan pengisi serbuk gergaji, yaitu 2942.6 J/Kg 0C untuk panas jenis dan 3156.6 KJ untuk nilai kapasitas panas. Hal tersebut terjadi karena kadar air serbuk gergaji yang tinggi. Kecilnya partikel – partikel serbuk gergaji menyebabkan molekul air yang terikat pada permukaan partikel serbuk gergaji semakin besar. Pada sekam padi, jika dibandingkan dengan serutan kayu, meski pun nilai panas jenisnya lebih rendah (2313.1 J/Kg 0C) jika dibandingkan dengan panas jenis dari serutan kayu (2670.7 J/Kg 0C), tetapi karena densitas kamba dari sekam padi lebih besar dari serutan kayu, maka berat sekam padi yang dikemas pun menjadi lebih besar dari pada berat berat serutan kayu yang dikemas. Hal tersebut mempengaruhi nilai kapasitas panas yang dihasilkan, sehingga kemasan dengan bahan pengisi sekam padi mempunyai nilai kapasitas panas yang lebih besar yaitu 1134.6 KJ, jika dibandingkan dengan serutan kayu yang mempunyai nilai sebesar 949.7 KJ. Pada pengukuran yang dilakukan oleh Prasetyo (1993) tersebut, panas jenis dari masing – masing bahan pengisi yang diukur, diperbesar oleh panas jenis air yang terserap selama perendaman. Mohsein (1980) menyatakan bahwa nilai dari panas jenis bahan hasil pertanian lebih banyak dipengaruhi oleh kadar air dan struktur fisik dari bahan tersebut, dari pada pengaruh yang ditimbulkan oleh suhu. 37 III. METODE PENELITIAN 3. 1. Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Laboratorium Ergonomika dan Elektronik, Departemen Teknik Pertanian, Institut Pertanian Bogor, Darmaga Bogor. Penelitian ini dilaksanakan mulai pada bulan Januari 2007 sampai pada bulan Januari 2008. 3. 2. Bahan dan Alat 3. 2. 1. Bahan 3. 2. 1. 1. Ikan maskoki Pada penelitian ini digunakan ikan maskoki yang merupakan varietas Tosa atau Kokitosa (veiltail). Ikan maskoki ini diperoleh dari pedagang ikan hias di kawasan pasar Parung, Kabupaten Bogor. Ikan yang digunakan dipilih yang kondisinya sehat dan tidak cacat. Ukuran ikan yang digunakan mempunyai pajang baku ± 5 cm (panjang dari kepala hingga pangkal ekor) dengan berat 11 – 12 gram per ekornya. Gambar 9. Ikan maskoki (carassius auratus Linnaeus) 38 3. 2. 1. 2. Kemasan dan media pengisi Bahan yang digunakan untuk membuat kemasan adalah busa styrofoam. Terdapat dua jenis kemasan styrofoam yang dibuat untuk digunakan pada penelitian ini, yaitu kemasan rak biasa dan kemasan rak berisi udara. Pada kedua jenis kemasan tersebut terdapat sirip – sirip dengan tebal 3 cm pada setiap sisi – sisinya. Sirip – sirip tersebut berfungsi untuk memberi ruang di antara tumpukan tumpukan/susunan – susunanan kemasan di dalam peti kemas, agar udara dingin dari sistem refrigrasi peti kemas dapat menjangkau setiap sisi tumpukan tumpukan/susunan – susunanan kemasan tersebut. Di dalam kedua jenis kemasan tersebut terdapat susunan rak – rak styrofoam yang dapat memuat busa (media pengisi) dan ikan. Pada bagian alas setiap rak tersebut terdapat lubang – lubang kecil yang berfungsi untuk mengeluarkan tetesan – tetesan air dari busa yang lembab. Tetesan – tetesan air yang keluar dari busa lembab pada setiap rak tersebut, ditampung pada ruang yang disebut “drip space” yang terdapat pada bagian paling bawah pada kedua jenis kemasan tersebut. Rak – rak yang terdapat pada jenis kemasan rak biasa, mempunyai ukuran dimensi ( p x l x t) dalam: 26 x 20 x 6.5 (cm3) dan ukuran dimensi luar: 30 x 20 x 8.5 (cm3). Bentuk rak tersebut dapat dilihat pada Gambar 10 di bawah ini. Gambar 10. Rak pada jenis kemasan rak biasa 39 Rak – rak yang digunakan pada kemasan rak berisi udara, pada kedua sisinya terdapat penyanggah dari styrofoam yang memiliki lubang – lubang kecil. Sisi penyanggah ini berfungsi untuk mencegah jatuhnya ikan dan busa keluar dari rak, karena di dalam kemasan rak berisi udaraterdapat celah yang berisi udara dengan komposisi O2 yang telah diatur. Sedangkan lubang – lubang kecil pada penyanggah tersebut berfungsi sebagai celah/tempat untuk keluar – masuknya aliran gas yang terdapat di dalam kemasan ke dalam rak Rak – rak yang terdapat pada jenis kemasan rak berisi udaramempunyai ukuran dimensi ( p x l x t) dalam: 26 x 20 x 6.5 (cm3) dan ukuran dimensi luar: 30 x 24 x 8.5 (cm3). Bentuk rak tersebut dapat dilihat pada Gambar 11 di bawah ini. Gambar 11. Rak pada jenis kemasan rak berisi udara Kemasan rak biasa mempunyai ukuran dimensi luar: 36 x 25.5 x 28 (cm3) dan ukuran dimensi dalam: 30 x 20 x 21 (cm3). Kemasan ini dapat memuat dua susun rak, yang mana masing – masing rak dapat memuat 10 ekor ikan. Sehingga sebuah kemasan rak biasa dapat memuat 20 ekor ikan. Pada penelitian ini digunakan tiga buah kemasan rak biasa untuk sekali ulangan. Bentuk luar kemasan rak biasa tersebut dapat dilihat pada Gambar 12 di bawah ini. 40 Gambar 12. Kemasan rak biasa Kemasan rak berisi udara mempunyai ukuran dimensi luar: 36 x 35 x 68 (cm 3) dan ukuran dimensi dalam: 30 x 30 x 65 (cm3). Kemasan ini dapat memuat enam susun rak, masing – masing rak memuat 10 ekor ikan. Sehingga sebuah kemasan rak berisi udara dapat memuat 60 ekor ikan. Lain halnya dengan jenis kemasan rak biasa, jenis kemasan rak berisi udara mempunyai ruang kosong atau celah pada bagian dalamnya setelah diisi penuh dengan rak. Ruang kosong ini berfungsi sebagai tempat untuk udara yang sengaja dimasukkan ke dalam kemasan, yang mana komposisi O2 pada udara tersebut telah diatur sebelumnya. Pada penelitian ini digunakan satu buah kemasan rak berisi udara untuk sekali ulangan. Bentuk luar kemasan rak berisi udara dapat dilihat pada Gambar 13 di bawah ini. Sketsa jenis kemasan rak biasa dan kemasan rak berisi udara dapat dilihat pada Lampiran 3 dan Lampiran 4. Gambar 13. Kemasan rak berisi udara 41 Media pengisi yang digunakan adalah busa dengan berat ± 0.031 gram per cm3. Busa yang digunakan sebagai media pengisi mempunyai dimensi 25 x 19 x 1 cm3. Terdapat dua jenis busa yang digunakan sebagai media pengisi pada setiap susunan rak di dalam setiap kemasan. Dua jenis busa tersebut mempunyai ukuran dimensi yang sama. Jenis busa yang pertama berfungsi sebagai alas tempat di mana ikan yang telah pingsan diletakkan dan jenis busa yang kedua berfungsi untuk menutupi ikan yang terdapat pada setiap rak di dalam kemasan. Busa yang digunakan sebagai alas tempat diletakkannya ikan mempunyai sekat – sekat dengan tinggi 1 cm. Sekat – sekat ini berfungsi untuk mencegah menumpuknya ikan di dalam kemasan. Busa merupakan media pengisi yang dapat mempertahankan dingin dan kelembaban dengan baik, karena mempunyai daya serap air yang baik. Selain itu busa tersebut mempunyai bobot yang ringan sehingga akan memperbesar nilai efisiensi kemasan. Sebelum digunakan, busa tersebut dicuci sampai bersih lalu dikeringkan. Kemudian busa tersebut didinginkan dan dilembabkan sesuai dengan suhu penyimpanan, sebelum digunakan sebagai media pengisi. Busa yang digunakan pada penelitian ini, diperoleh dari penjual busa jok di daerah Empang, Sukasari, Bogor. Bentuk busa yang digunakan sebagai tempat diletakkannya ikan dapat dlihat pada gambar 14 dan bentuk busa yang digunakan sebagai penutup di mana ikan diletakkan, dapat dilihat pada Gambar 15 di bawah ini. Gambar 14. Busa tempat diletakkannya ikan 42 Gambar 15. Busa untuk menutupi ikan 3. 2. 1. 3. Gas O2, CO2, N2 murni Pada jenis kemasan rak berisi udara, di dalam kemasannya diisikan dengan udara yang mana komposisi gas O2, CO2, dan N2 pada udara tersebut telah diatur sebelumnya. Sebelum udara dengan komposisi gas O2, CO2, dan N2 tertentu tersebut dimasukkan, udara awal yang terdapat di dalam kemasan dikeluarkan (divakumkan) terlebih dulu. Gas N2 merupakan gas inert yang berfungsi untuk mengatur konsentrasi gas O2 dan CO2 yang dimasukkan ke dalam kemasan rak berisi udara. Gas – gas O2, CO2, dan N2 tersebut diperoleh dari tabung – tabung seperti pada Gambar 16 di bawah ini. Gambar 16. Tabung – tabung gas O2, CO2, dan N2 43 3. 2. 2. Alat 3. 2. 2. 1. Water chiller Water chiller berfungsi sebagai alat untuk memingsankan ikan dengan shok suhu rendah. Pada water chiller ini terdapat pompa untuk menghisap air melalui selang dari bak pemingsanan berisi ikan menuju ke dalam evaporator di dalam water chiller tersebut, lalu air yang telah didinginkan dikeluarkan lagi melalui selang lainnya menuju ke dalam bak berisi ikan. Pada water chiller juga terdapat thermostat yang dapat mengatur pada suhu berapa kerja kompresor harus berhenti sehingga penurunan suhu dapat dikontrol. Bentuk dari pada Water chiller dapat dilihat pada Gambar 17 di bawah ini. Gambar 17. Water chiller 3. 2. 2. 2. Bak pemingsanan ikan Bak pemingsanan berfungsi sebagai tempat menampung ikan ketika ikan tersebut dipingsankan. Bak ini terbuat dari bahan stainless steel untuk mencegah terjadinya karat pada bak tersebut. Bahan stainless steel tersebut juga dapat meratakan suhu dingin di bagian dalam bak. Pada bagian luar bak tersebut dilapisi oleh lembaran styrofoam yang berfungsi untuk mencegah penetrasi panas dari lingkungan di sekeliling bagian luar bak ke dalam bagian bak, karena stainless steel merupakan bahan konduktor yang baik. Bentuk dari pada bak pemingsanan ikan dapat dilihat pada Gambar 18 di bawah ini. 44 Gambar 18. Bak pemingsanan ikan 3. 2. 2. 3. Peti kemas Peti kemas berfungsi untuk memuat kemasan – kemasan styrofoam berisi ikan yang telah dipingsankan. Selama dilakukannya transportasi (statis) pada selang waktu tertentu, kemasan – kemasan styrofoam berisi ikan tersebut disimpan di dalam peti kemas ini. Peti kemas ini terbuat dari alumunium dengan lapisan styrofoam di antara lapisan alumunium tersebut. Peti kemas ini mempunyai dimensi dalam berukuran: 130 x 90 x 90 (cm3). Peti kemas ini dilengkapi oleh sistem refrigrasi yang dapat menjaga suhu di dalam peti kemas tersebut tetap rendah. Kestabilan suhu di dalam peti kemas ini diatur oleh alat yang disebut thermostat. Bentuk dari pada peti kemas dapat dilihat pada Gambar 19 di bawah ini. Gambar 19. Peti kemas 45 3. 2. 2. 4. Gases mixer Gases mixer berfungsi untuk mengatur konsentrasi gas O2 yang masuk ke dalam kemasan rak berisi udara, setelah udara awal yang terdapat dalam kemasan tersebut dikeluarkan (divakumkan). Konsentrasi gas O2 diatur dengan cara mengatur konsentrasi gas CO2 dan N2 yang ikut masuk ke dalam kemasan tersebut. Bentuk dari pada gases mixer dapat dilihat pada Gambar 20 di bawah ini. Gambar 20. Gases mixer 3. 2. 2. 5. Chinorecorder Chinorecorder berfungsi untuk mencatat data suhu di dalam kemasan selama ikan ditransportasi (statis). Pada chinorecorder ini terdapat kabel – kabel yang dihubungkan ke beberapa titik di dalam kemasan dan satu titik di dalam peti kemas. Kabel – kabel tersebut merupakan sensor suhu yang disebut thermocopel. Thermocopel tersebut mengambil data suhu dari titik tengah media pengisi busa yang merupakan alas tempat peletakan ikan di dalam rak – rak pada setiap kemasan. Thermocopel tersebut juga mengambil data suhu ruang di dalam peti kemas selama waktu transportasi. Data – data suhu yang diambil thermocopel tersebut kemudian diterima dan dicatat oleh chinorecorder dalam bentuk plot titik – titik suhu dengan jedah waktu pencatatan 25 mm per detik. Setiap data suhu yang dicatat dari titik – titik thermocopel yang berbeda, ditandai dengan warna plot titik – titik yang berbeda pula pada chart pada chinorecorder. Bentuk dari pada chinorecorder dapat dilihat pada Gambar 21 di bawah ini. 46 Gambar 21. Chinorecorder 3. 2. 2. 6. Akuarium dan aerator Akuarium digunakan sebagai tempat pemeliharaan ikan selama penelitian berlangsung. Pada penelitian ini juga dibutuhkan dua buah aerator, masing – masing aerator 180 Watt dan 60 Watt. Aerator 180 Watt digunakan untuk menggerakkan sistem filtrasi air secara sirkulasi dan berfungsi sebagai penyedia O2 terlarut pada air di tempat pemeliharaan ikan. Sedangkan aerator 60 Watt digunakan sebagai perata suhu dan penyedia O2 terlarut pada air di dalam bak pemingsanan ikan. Bentuk dari pada akuarium dan kedua buah aerator tersebut dapat dilihat pada Gambar 22 di bawah ini. Gambar 22. Akuarium, aerator 180 Watt, dan aerator 60 Watt 47 3. 3. Tahapan dan Prosedur Penelitian Sebelum penelitian dilaksanakan, persiapan terhadap ikan maskoki terlebih dulu dilakukan. Ikan maskoki yang terdapat pada pedagang ikan, telah ditempatkan di dalam kantung – kantung plastik yang berisi O2. Pengangkutan ikan maskoki ke laboratorium dilakukan dengan cara membawa katung – katung plastik tersebut. Sesampainya di laboratorium, ikan diaklimatisasi dan ditampung di akuarium untuk penyesuaian dan pemulihan kondisi. Aklimatisasi merupakan proses pengadaptasian oleh ikan terhadap beberapa variabel di lingkungan yang berbeda atau baru, misalnya suhu, salinitas, kekeruhan, kandungan O2, kandungan amoniak, dan sebagainya. Respon fisiologis suatu organisme untuk menyesuaikan diri terhadap perubahan beberapa faktor lingkungan disebut dengan istilah aklimatisasi, sedangkan respon fisiologis suatu organisme untuk menyesuaikan diri terhadap perubahan satu faktor lingkungan disebut dengan istilah aklimasi (Rankin dan Jensen, 1993). Aklimatisasi diawali dengan cara menaruh kantung plastik yang masih berisi ikan di atas air yang terdapat di akuarium. Setelah 6 jam, kantung tersebut dibuka dan digulung. Kemudian biarkan air dari akuarium sedikit demi sedikit bercampur dengan air yang ada di dalam kantung, hingga ikan yang terdapat di dalam kantung tersebut keluar dengan sendirinya ke dalam akuarium. Air yang terdapat di dalam akuarium tersebut diberikan aerasi yang cukup selama dilakukannya proses aklimatisasi. Aerasi tersebut selain berfungsi untuk mencukupi pasokan O2 pada air di dalam akuarium, juga berfungsi untuk mencampurkan sedikit – demi sedikit air yang terdapat di dalam akuarium dengan air yang terdapat di dalam kantung plastik ikan. Bercampurnya air yang terdapat di dalam akuarium dengan air yang terdapat di dalam kantung plastik ikan sedikit – demi sedikit, membuat ikan dapat beradaptasi secara perlahan - lahan dengan kondisi air yang terdapat di dalam akuarium, sehingga tidak menimbulkan shok dan stres pada ikan tersebut. Untuk lebih jelasnya, proses aklimatisasi ini dapat dilihat pada Gambar 23 di bawah ini. 48 Gambar 23. Proses aklimatisasi pada ikan Air yang digunakan pada penelitian ini, baik untuk menampung ikan atau pun yang digunakan pada setiap tahapan perlakuan, diperoleh dari air sumur yang ditampung di dalam tandon – tandon yang terdapat pada gedung Fateta. Air yang terdapat pada tandon tersebut diambil pada saat malam hari atau pagi hari. Hal tersebut dilakukan untuk mencegah terbawanya partikel – partikel terlarut yang dapat menyebabkan kekeruhan, saat pengambilan air. Karena pada saat malam hari atau pagi hari, pompa yang menghisap air dari sumur tidak sedang bekerja, sehingga pada saat tersebut partikel – partikel yang terlarut di dalam air sumur mengendap di dalam tandon dan air yang diambil pada saat tersebut pun bersih dan jernih. Air tesebut kemudan ditampung di dalam bak – bak alumunium. 49 Air yang telah ditampung di dalam bak – bak alumunium tersebut belum dapat langsung digunakan. Air tersebut terlebih dahulu harus diberi obat (malachyte green – formaline) sebanyak 5 ppm. Malachyte green – formaline tersebut digunakan untuk membunuh bakteri, parasit, virus, bahkan spora bakteri dan spora parasit. Setelah diberi malachyte green – formaline, air tampungan tersebut harus diaerasi kuat minimal selama 1 x 24 jam sebelum digunakan. Pemberian aerasi tersebut dilakukan untuk mendapatkan oksigen terlarut yang cukup sebelum digunakan. Daelami (2002) menyatakan bahwa formaline (formaldehid murni/pro analisis) sebanyak 25 mg/l atau 2.5 ml formaline dicampur dengan 100 l air bersih sangat ampuh untuk membunuh parasit lerneae pada stadia nauplius mau pun lerneae dewasa. Sedangkan malachyte green pada konsentrasi sebesar 0.15 ppm atau 150 mg malachyte green yang dicampurkan ke dalam 1000 l air bersih, sangat ampuh untuk membunuh parasit jamur. Terdapat dua genus jamur yang paling dikenal sebagai parasit ikan, yaitu jamur Achlya dan Saprolegnia. Akuarium yang digunakan untuk penampungan ikan dilengkapi dengan sistem filtrasi, sehingga air pada akuarium tersebut selalu terjaga kebersihannya. Air yang terdapat di dalam akuarium tersebut juga selalu diberikan airasi yang cukup. Selama di penampungan, ikan diberi pakan pelet dua kali dalam sehari. Sebelum digunakan dalam penelitian, ikan dipuasakan terlebih dulu selama 24 jam agar metabolismenya rendah ketika dipingsankan dan ditransportasi. Penelitian ini terdiri dari beberapa tahap yang dilakukan untuk: 1) menentukan suhu pemingsanan optimum, 2) menentukan suhu penyimpanan optimum, 3) mengetahui pengaruh waktu pemingsanan terhadap nilai SR, 4) mengetahui pengaruh penurunan konsentrasi O2 terhadap nilai SR, dan 5) menentukan waktu transportasi (statis) optimum. Setiap perlakuan pada tahapan – tahapan penelitian tersebut terdiri dari tiga kali ulangan, dan setiap ulangannya digunakan 60 ekor ikan. Sebelum tahapan – tahapan penelitian tersebut dilakukan, terlebih dulu dilakukan pengujian toksisitas terhadap media pengisi, perhitungan terhadap daya serap air oleh media pengisi, perhitungan terhadap densitas kamba media pengisi, dan perhitungan terhadap efisiensi kemasan. Bagan alir (flow chart) tahapan – tahapan dari penelitian ini dapat dilihat pada Lampiran 1. 50 3. 3. 1. Pengujian toksisitas media pengisi Pengujian toksisitas media pengisi terhadap kelangsungan hidup ikan sangat penting dilakukan, mengingat bahan busa belum pernah digunakan sebagai media pengisi pada penelitian – penelitian sebelumnya. Metode pengujian ini cukup sederhana, yaitu dengan prosedur sebagai berikut: 1) Ikan maskoki sebanyak 20 ekor dimasukkan ke dalam bak yang berisi 20 l air. 2) Kemudian potongan – potongan busa bersih berukuran 2 x 2 x 1.5 (cm3) dimasukkan ke dalam bak yang telah berisi ikan. Media pengisi busa tersebut sengaja dibuat potongan – potongan yang berukuran kecil untuk memperbesar luas permukaan busa tersebut. Dengan semakin luas permukaan busa yang dapat kontak dengan air bak yang berisi ikan tersebut, maka diharapkan proses pengujian toksisitas busa terhadap kehidupan ikan maskoki dapat berjalan dengan efektif. 3) Setelah potongan – potongan busa dimasukkan ke dalam bak, kemudian dilakukan pengamatan terhadap tingkah – laku atau kondisi ikan setiap 8 jam selama 1 x 24 jam. Jika dalam 1 x 24 jam terdapat ikan dengan tingkah – laku seperti keracunan (berenang limbung, tidak seimbang, atau terlihat mabok), tubuh ikan berlendir, atau terdapat ikan yang mati, maka busa tersebut tidak dapat digunakan sebagai media pengisi. Proses pengujian toksisitas terhadap busa sebagai media pengisi, dapat dilihat pada Lampiran 2. 3. 3. 2. Daya serap air media pengisi Daya serap air oleh media pengisi merupakan kemampuan untuk mengikat kolom air di dalam matriks serat media pengisi (busa). Daya serap air merupakan persentase dari ratio antara selisih berat basah dan berat kering media pengisi dengan berat basah atau berat kering suatu media pengisi tersebut. Berat basah ini merupakan berat basah media pengisi yang telah diperas atau ditiriskan terlebih dulu sebelum ditimbang. Semakin tinggi daya serap air oleh suatu media pengisi maka semakin tinggi kapasitas panas (Cp) media pengisi tersebut. Perhitungan daya serap air dirumuskan sebagai berkut: 51 Daya serap air (%Berat basah) = Berat basah - Berat kering × 100 Berat basah Daya serap air (%Berat kering) = Berat basah - Berat kering × 100 Berat kering 3. 3. 3. Densitas kamba media pengisi Desitas kamba media pengisi merupakan perbandingan antara berat media pengisi (basah) dengan volumenya. Densitas kamba menunjukkan sifat berongga bahan pengisi. Jika densitas kamba suatu bahan rendah, bahan tersebut bersifat voluminuous sehingga jika digunakan sebagai media transportasi akan lebih ringan, kapasitas angkut lebih besar, dan kandungan udara di dalam rongga media pengisi lebih besar (Utomo et al., 1998). Densitas kamba diukur pada busa berdimensi 18.5 x 12 x 1.8 cm3 (p x l x t) dengan tiga kali ulangan. Persamaan perhitungan densitas kamba suatu bahan adalah sebagai berikut: Densitas kamba = Berat bahan (gram) Volume Bahan (cm3 ) 3. 3. 4. Efisiensi kemasan Efisiensi kemasan dilihat dari rasio antara bobot total ikan yang dapat dimuat dengan bobot total kemasan yang sudah berisi. Semakin besar nilai rasio, menunjukkan semakin tinggi efisiensi isi dari kemasan tersebut (Karnila, 1998). Persamaan perhitungan dari efisiensi kemasan adalah sebagai berikut: Efisiensi kemasan = Bobot total ikan × 100 Bobot total kemasan 52 3. 3. 5. Pemingsanan ikan Pemingsanan ikan dilakukan dengan metode pemingsanan secara bertahap, yaitu dengan cara menurunkan suhu air media ikan dengan kecepatan tertentu (bertahap/gradually) hingga tercapai suhu yang dapat membuat ikan berada dalam keasaan pingsan. Pada beberapa titik – titik suhu tertentu dalam proses pemingsanan, secara umum ikan mengalami beberapa fase sebelum ikan tersebut pingsan. Pada awal penurunan suhu, kondisi ikan masih terlihat normal dan beberapa saat kemudian ikan terlihat lebih tenang, tidak banyak berenang, dan respon menurun. Semakin menurunnya suhu air, pada beberapa titik suhu tertentu ikan bergerak tidak tentu arah, terkejut – kejut, dan terlihat kehilangan keseimbangan (limbung). Ikan yang berada dalam kondisi tersebut menunjukkan ikan telah memasuki fase panik. Menurut Nitibaskara et al. (1997) kepanikan tersebut terjadi karena adanya gangguan pada saat dalam kondisi yang tertekan. Apabila kepanikan tersebut reda, maka ikan akan menjadi tenang kembali. Pada beberapa titik suhu di bawahnya, ikan kembali tenang, berenang pasif, dan respon sangat berkurang atau sangat lemah. Pada saat ini ikan lebih sering berdiam diri di dasar atau di tengah ketinggian air. Kerena responnya yang sangat lemah, maka jika ada rangsangan fisik dari luar ikan hanya bergerak sedikit dengan hanya menggoyangkan bagian ekor dan kepalanya saja. Pada kondisi seperti ini ikan sudah tidak mampu untuk berenang atau bergerak dengan mengatur gerakan sirip – siripnya. Pada kondisi tersebut, ikan dinyatakan telah melewati fase panik dan berada dalam fase pingsan ringan (light sedation). Pada beberapa titik suhu di bawahnya setelah ikan mengalami fase pingsan ringan, ikan berada dalam keadaan tergeletak di dasar air dan reaktifitas terhadap rangsangan fisik dari luar tidak ada, sehingga bila disentuh dan diangkat dari dalam air ikan hanya diam. Pada kondisi tersebut, ikan telah berada dalam fase pingsan berat (deep sedation). Fase pingsan berat merupakan kondisi yang tepat untuk pengangkutan ikan, karena pada kondisi ini aktifitas ikan relatif terhenti. Hal tersebut ditunjukkan dengan tidak adanya respon terhadap rangsangan dari luar. Pada kondisi ini konsumsi O2 dari tiap – tiap ikan hanya berada pada kadar 53 yang terendah dari metabolisme basal, yang dibutuhkan ikan hanya untuk kelangsungan hidupnya saja (bukan untuk beraktifitas) (Mc Farland, 1959). Dalam kondisi pingsan, laju konsumsi O2 pada ikan berada dalam keadaan yang terendah dari laju konsumsi O2 standar atau laju metabolisme basal. Ketika dalam keadaan laju metabolisme basal, dihasilkan sejumlah energi yang hanya cukup untuk menggerakkan fungsi organ – organ fital seperti pada jantung, alat pernafasan, otak dan sistem syaraf yang berelaksasi, hati, dan ginjal. Laju metabolisme basal terjadi ketika suatu mahluk hidup sedang beristirahat dan alat pencernaan dalam keadaan kosong (sistem pencernaan sedang tidak aktif bekerja), tetapi dalam keadaan sadar (Winkipedia, 2008). Laju metabolisme basal (BMR) atau energi metabolime basal (EMB) merupakan jumlah energi minimum yang dibutuhkan untuk melakukan prosesproses tubuh vital, di mana tanpa berlangsungnya kegiatan tersebut tidak mungkin terjadi kehidupan, karena metabolisme itu sendiri merupakan kehidupan. Pengeluaran energi basal termasuk pengeluaran untuk pernafasan, sirkulasi, kegiatan kelenjar (thyroid, adrenal, pancreas dan pituitary), dan tonus otot. Laju metabolisme basal dapat diukur ketika sistem pencernaan tidak sedang bekerja (keadaan post-absorpsi), istirahat mental dan fisik, dan dalam keadaan sadar (tidak tidur). Pada manusia (umumnya pada orang dewasa) laju metabolisme basal pada waktu tidur 10% lebih rendah dibandingkan dengan laju metabolisme basal pada waktu istirahat dengan posisi berbaring (Williams, 1988). Pada penelitian ini, ikan yang telah dipingsankan kemudian ditempatkan di rak – rak styrofoam yang tersusun di dalam kotak styrofoam. Pada setiap rak – rak styrofoam tersebut, ikan dialasi dan ditutupi oleh busa yang lembab dan dingin. Sehingga di dalam kotak styrofoam terdapat susunan rak dan di setiap rak tersusun lapisan busa – ikan – busa. Setiap rak tersebut terdapat 10 ekor ikan. Pola penempatan dan penyusanan ikan di dalam kemasan kotak styrofoam, dapat dilihat pada Lampiran 5 hingga Lampiran 8. 54 3. 3. 6. Menentukan suhu pemingsanan optimum Suhu pemingsanan optimum adalah suhu yang dapat menyebabkan ikan berada dalam kondisi pingsan, tetapi tidak menyebabkan kematian ketika ditransportasi menggunakan kontainer pendingin. Kemasan yang digunakan pada tahap ini adalah kemasan rak biasa. Untuk menentukan suhu pemingsanan optimum, maka ditentukan beberapa titik suhu setelah ikan diperkirakan telah memasuki fase pingsan ringan. Pada tahap ini dilakukan prosedur sebagai berikut: 1) Ikan dipingsankan dengan penurunan suhu secara bertahap selama 1 jam dari suhu normal hingga tercapai suatu titik suhu pemingsanan ikan (3, 4, 5, dan 6). 2) Setelah tercapai suhu pemingsanan, ikan ditahan selama 5 menit pada suhu pemingsanan tersebut. 3) Pada kondisi pingsan, ikan dengan cepat dikemas ke dalam kemasan rak biasa bermedia pengisi busa lembab dan dingin, lalu kemasan tersebut dimasukkan ke dalam peti kemas. Suhu di dalam kemasan dipertahankan pada suhu 100C. 4) Ikan kemudian ditransportasi (statis) selama 1 jam. Suhu pemingsanan yang menghasilkan nilai SR paling tinggi setelah ikan disadarkan, maka suhu tersebut ditetapkan sebagai suhu pemingsanan optimum. 5) Jika dari perlakuan diatas dapat dihasilkan nilai SR 100%, maka lama waktu transportasinya dinaikkan mulai dari 3 jam. Hal ini dimaksudkan untuk mengetahui seberapa lama nilai SR 100% dapat dipertahankan pada saat ikan ditranportasi. 3. 3. 7. Menentukan suhu penyimpanan optimum Suhu penyimpanan merupakan suhu dalam kemasan yang tetap dipertahankan stabil selama dilakukannya transportasi. Suhu penyimpanan optimum adalah suhu yang dapat mempertahankan ikan tetap dalam kondisi pingsan, namun tidak menyebabkan kematian pada ikan tersebut. Kemasan yang digunakan pada tahap ini adalah kemasan rak biasa. Untuk menentukan suhu ruang penyimpanan optimum, maka akan dilakukan prosedur sebagai berikut: 55 1) Ikan dipingsankan dengan penurunan suhu secara bertahap selama 1 jam dari suhu normal hingga tercapai suhu pemingsanan optimum. 2) Setelah tercapai suhu pemingsanan, ikan ditahan selama 5 menit pada suhu pemingsanan tersebut. 3) Pada kondisi pingsan, ikan dengan cepat dikemas ke dalam kemasan rak biasa bermedia pengisi busa lembab dan dingin, lalu kemasan tersebut dimasukkan ke dalam peti kemas. Jika suhu penyimpanan 100C dengan lama traportasi 3 jam (tahap sebelumnya) tidak menghasilkan nilai SR 100%, maka suhu penyimpanannya dinaikkan menjadi 120C, 140C, 160C, 180C, dan 200C. 4) Jika terdapat nilai SR 100% setelah suhu penyimpanannya dinaikkan, maka lama waktu transportasinya dinaikkan mulai dari 6 jam. Suhu penyimpanan yang menghasilkan nilai SR paling tinggi merupakan suhu penyimpanan optimum. 3. 3. 8. Pengaruh waktu pemingsanan terhadap nilai SR Waktu pemingsanan merupakan waktu yang dibutuhkan untuk menurunkan suhu air dari suhu normal (± 270C) sampai pada suhu pemingsanan ikan. Tahap ini dilakukan untuk mengetahui pengaruh berbagai waktu pemingsanan (2, 4, 6, dan 8 jam) terhadap tingkat kelulusan hidup (Survival Rate/SR) ikan maskoki selama transportasi (statis) sistem kering. Lama waktu pemingsanan yang berbeda – beda tersebut diatur dengan cara mengatur volume media air yang terdapat di dalam bak pemingsanan ikan. Dengan volume air yang berbeda – beda, maka beban panas pada air yang terdapat di dalam bak pemingsanan ikan juga berbeda – beda pula. Dengan beban panas yang berbeda – beda tersebut, maka lama waktu yang dibutuhkan alat water chiller untuk mencapai suhu pingsan ikan akan berbeda – beda pula. Sehingga dengan mengatur volume air yang terdapat di dalam bak pemingsanan ikan, lamanya waktu pemingsanan ikan dapat dikontrol sesuai dengan waktu yang dibutuhkan. 56 Kemasan yang digunakan pada tahap ini adalah kemasan rak biasa. Untuk megetahui pengaruh berbagai waktu pemingsanan terhadap nilai SR, maka dilakukan prosedur sebagai barikut: 1) Ikan dipingsankan dengan penurunan suhu secara bertahap dengan berbagai waktu pemingsanan (2, 4, 6, dan 8 jam) hingga tercapai suhu pemingsanan optimum. 2) Setelah tercapai suhu pemingsanan, ikan ditahan selama 5 menit pada suhu pemingsanan tersebut. 3) Pada kondisi pingsan, ikan dengan cepat dikemas ke dalam kemasan rak biasa bermedia pengisi busa lembab dan dingin, lalu kemasan tersebut dimasukkan ke dalam peti kemas. Suhu di dalam kemasan merupakan suhu penyimpanan optimum. 4) Pengaruh berbagai waktu pemingsanan terhadap nilai SR dapat diketahui setelah ikan ditransportasi (statis) selama 6 jam. Waktu pemingsanan yang menghasilkan nilai SR tertinggi merupakan waktu pemingsanan optimum. 3. 3. 9. Pengaruh penurunan konsentrasi O2 terhadap SR Laju konsumsi O2 oleh ikan akan menurun seiring dengan menurunnya kandungan O2 terlarut di dalam air, sehingga akan menurunkan laju metabolismenya (Fry, 1957). Penurunan konsentrasi O2 di dalam kemasan diharapkan dapat mengurangi laju metabolisme ikan yang dikemas di dalamnya. Tahap ini dilakukan untuk mengetahui pengaruh berbagai penurunan konsentrasi O2 (menjadi 21% (kontrol), 15%, 10%, dan 5%) di dalam kemasan terhadap tingkat kelulusan hidup (nilai SR) ikan maskoki selama transportasi (statis) sistem kering. Kemasan yang digunakan pada tahap ini adalah jenis kemasan rak berisi udara. Konsentrasi O2 dapat diatur dengan mengatur konsentrasi CO2 dan N2 dalam volume suatu ruang. Pada penelitian ini penurunan konsentrasi O2 di dalam kemasan dilakukan dengan cara menaikkan konsentrasi N2 di dalam kemasan, sedangkan konsentrasi CO2 dibiarkan tetap pada kisaran 0.03% (konsentrasi normal). Sehingga bila konsentrasi O2 di dalam kemasan diturunkan menjadi 15%, maka konsentrasi N2 di dalam kemasan naik menjadi 84.97% dan 57 konsentrasi CO2 tetap pada kisaran 0.03%. Begitu pula bila konsentrasi O2 di dalam kemasan turun menjadi 10%, maka konsentrasi N2 naik menjadi 89.97% dan konsentrasi CO2 tetap pada kisaran 0.03%. Pada penurunan konsentrasi O2 di dalam kemasan menjadi 5%, maka konsentrasi N2 naik menjadi 94.97% dan konsentrasi CO2 tetap pada kisaran 0.03%. Sedangkan untuk kontrol, konsentrasi O2 di dalam kemasan tidak diturunkan atau tetap pada kisaran 21%, sehingga konsentrasi N2 dan CO2 di dalam kemasan tersebut pun tidak berubah atau tetap pada konsentrasi 78% dan 0.03% (konsentrasi normal). Pengaturan konsentrasi O2 di dalam kemasan dilakukan dengan cara memasukkan udara dengan konsentrasi O2 yang telah diatur sebelumnya, setelah udara awal di dalam kemasan disedot keluar (divakumkan terlebih dahulu). Pengaturan konsentrasi O2 pada udara yang akan dimasukkan ke dalam kemasan dilakukan dengan menggunakan gases mixer. Udara dengan konsentrasi O2 yang telah diatur tersebut, dimasukkan ke dalam kemasan sebanyak ±10 l. Kemasan yang digunakan pada tahap ini adalah kemasan rak berisi udara. Untuk mengetahui pengaruh berbagai penurunan konsentrasi O2 di dalam kemasan, maka dilakukan prosedur sebagai berikut: 1) Ikan dipingsankan dengan penurunan suhu secara bertahap dengan lama waktu pemingsanan optimum. 2) Setelah tercapai suhu pemingsanan, ikan ditahan selama 5 menit pada suhu pemingsanan tersebut. 3) Pada kondisi pingsan, ikan dengan cepat dikemas ke dalam kemasan rak berisi udara bermedia pengisi busa lembab dan dingin. Setelah udara awal di dalam kemasan disedot keluar, udara dengan konsentrasi O2 yang telah diatur dimasukkan ke dalam kemasan sebanyak ±10 l. Kemasan yang telah diisi udara tersebut lalu dimasukkan ke dalam peti kemas. Suhu di dalam kemasan merupakan suhu penyimpanan optimum. 4) Pengaruh berbagai berbagai penurunan konsentrasi O2 di dalam kemasan terhadap nilai SR dapat diketahui setelah ikan ditransportasi (statis) selama 6 jam. Tingkat penurunan konsentrasi O2 yang menghasilkan nilai SR tertinggi merupakan tingkat penurunan konsentrasi O2 optimum. 58 3. 3. 10. Menentukan waktu transportasi (statis) optimum Pada tahap - tahap sebelumnya diperoleh perlakuan – perlakuan optimum, seperti: suhu pemingsanan optimum, suhu penyimpanan optimum, waktu pemingsanan optimum, serta tingkat penurunan konsentrasi O2 optimum. Tahap ini dilakukan untuk mengetahui seberapa lama ikan dapat ditransportasikan dengan tingkat kelulusan hidup (nilai SR) tertinggi, setelah diberi perlakuan – perlakuan optimum tersebut. Untuk mengetahui waktu transportasi optimum, maka dilakukan prosedur sebagai berikut: 1) Ikan dipingsankan dengan penurunan suhu secara bertahap dengan lama waktu pemingsanan optimum. 2) Setelah tercapai suhu pemingsanan, ikan ditahan selama 5 menit pada suhu pemingsanan tersebut. 3) Pada kondisi pingsan, ikan dengan cepat dikemas ke dalam kemasan rak berisi udara bermedia pengisi busa lembab dan dingin. Kemasan tersebut kemudian diisi udara sebanyak ±10 l dengan tingkat penurunan konsentrasi O2 optimum. Gas tersebut diisi setelah udara awal pada kemasan tersebut dikeluarkan (divakumkan). Kemasan yang telah diisi gas tersebut lalu dimasukkan ke dalam peti kemas. Suhu di dalam kemasan merupakan suhu penyimpanan optimum. 4) Ikan kemudian ditransportasikan (statis) selama beberapa selang waktu tertentu (6, 12, 18, 24, 28 jam). Selang waktu transportasi yang dapat menghasilkan nilai SR paling tinggi, merupakan waktu transportasi optimum pada transportasi ikan maskoki hidup sistem kering. 59 IV. HASIL DAN PEMBAHASAN 4. 1. Pengujian Toksisitas Media Pengisi Hasil pengamatan terhadap kondisi ikan pada pengujian toksisitas media pengisi selama 1 x 24 jam disajikan pada Tabel 2 di bawah ini. Tabel 2. Kondisi ikan maskoki pada pengujian toksisitas media pengisi Jam ke- Kondisi ikan 0 Lincah, berenang aktif, responsif, dan tubuh tidak berlendir 8 Lincah, berenang aktif, responsif, dan tubuh tidak berlendir 16 Lincah, berenang aktif, responsif, dan tubuh tidak berlendir 24 Lincah, berenang aktif, responsif, dan tubuh tidak berlendir Berdasarkan hasil pengamatan yang disajikan pada Tabel 2, menunjukkan bahwa tidak ada ikan yang berlendir, sekarat, atau mati selama waktu pengamatan. Hal tersebut menunjukkan pula bahwa busa tersebut tidak bersifat toksik bagi ikan ketika digunakan sebagai media pengisi. Menurut Berka (1986), ikan yang dalam keadaan sehat dan baik mempunyai tanda – tanda diantaranya yaitu ikan dapat berenang normal, bergerak aktif terhadap ransangan fisik dari luar, dan tidak terdapat luka pada tubuhnya. Menurut Affandi dan Tang (2002), ketika suatu bahan pencemar (polutan) baik yang berupa senyawa organik atau pun senyawa anorganik dalam bentuk padat atau cair, yang masuk ke dalam suatu perairan dalam jumlah tertentu, maka akan mempengaruhi kondisi kualitas air. Kondisi kualitas air tersebut akan mempengaruhi kehidupan biota yang hidup di perairan tersebut, yang direfleksikan oleh adanya perubahan baik pada tingkat sel maupun pada tingkat organisme. Jika suatu bahan pencemar terdeteksi oleh sistem sensori (reseptor) dari ikan yang berada pada perairan yang tercemar, dan bahan pencemar tersebut dikenal ikan sebagai hal yang berbahaya, maka ikan tersebut akan segera keluar dari kawasan tersebut dan melarikan diri menuju perairan yang bebas dari bahan pencemar tersebut. Namun apabila ikan tersebut tidak memungkinkan untuk keluar dari kawasan tersebut, maka ikan tersebut akan berupaya memperkecil 60 kontak permukaan luar tubuhnya dengan cara memproduksi mukus (lendir) yang banyak dan berusaha menyelimuti tubuhnya termasuk bagian insangnya. Adanya bahan toksik di media hidup ikan dalam waktu yang singkat (dalam hitungan menit hingga beberapa hari) dapat menyebabkan terjadinya perubahan – perubahan biokimia di dalam tubuhnya (misalnya: aktivitas enzim, sintesis protein, sistem lemak, dan lain – lain). Jika penurunan kualitas air tersebut berjalan terus dan berada pada kondisi kronis, maka akan menyebabkan gangguan fisiologis yang berujung pada penurunan laju pertumbuhan dan keberhasilan reproduksi pada tingkat individu. Penurunan kualitas air yang berujung pada perubahan kondisi ekologis dapat menyebabkan penurunan populasi, komposisi komunitas, dan bahkan mungkin dapat menyebabkan perubahan fungsi ekosistem perairan. 4. 2. Daya Serap Air Media Pengisi Hasil pengukuran terhadap daya serap oleh air busa sebagai media pengisi, dapat dilihat pada Tabel 3 di bawah ini. Tabel 3. Daya serap air media pengisi busa Ulangan ke- Berat kering (gram) Berat basah (gram) 1 12.46 2 3 Daya serap air % Berat kering (Bk) % Berat basah (Bb) 25.7 106.3 51.5 12.55 32.6 159.8 61.5 12.52 30.5 139.6 58.95 135.23 57.32 Rata - rata Berdasarkan hasil pengukuran yang disajikan pada Tabel 3 di atas, diketahui daya serap air oleh busa sebagai media pengisi adalah rata – rata 135.23% berat kering dan 57.32% berat basah. Dari hasil pengukuran Prasetiyo (1993) diketahui bahwa daya serap air oleh sekam padi adalah 75% berat kering dan 42.9% berat basah, serbuk gergaji adalah 113% berat kering dan 53.1% berat basah, 61 serutan kayu adalah 75% berat kering dan 42.9% berat basah, sedangkan Gracilaria laut adalah 290% berat kering dan 74.4% berat basah. Untuk lebih jelasnya, hasil pengukuran Prasetiyo (1993) terhadap daya serap air pada beberapa media pengisi tersebut, dapat dilihat pada Tabel 4 di bawah ini. Tabel 4. Daya serap air beberapa media pengisi (Prasetiyo, 1993) No. Jenis bahan pengisi Daya serap air % Bk % Bb 1 Sekam padi 75 42.9 2 3 4 Serbuk gergaji Serutan kayu Gracilaria laut 113 75 290 53.1 42.9 74.4 Pada penelitian yang dilakukan oleh Muslih (1996), pengukuran daya serap air terhadap sekam padi, serbuk gergaji, dan serutan kayu sebagai bahan pengisi, dilakukan dengan cara menambahkan/memberikan air laut sebanyak 100% dari bobot kering sekam padi, serbuk gergaji, dan serutan kayu tersebut. Dari hasil pengukuran tersebut diketahui bahwa daya serap air oleh sekam padi sebesar 49.44% berat basah, serbuk gergaji sebesar 50.60% berat basah, dan serutan kayu sebesar 42.22% berat basah. Sedangkan pengukuran daya serap air terhadap rumput laut Gracilaria sp. dan Gelidium sp. dilakukan dengan cara merendam rumput laut tersebut hingga beberapa jam. Dari hasil pengukuran tersebut didapatkan bahwa rumput laut Gracilaria sp yang direndam selama 12 jam dan kemudian dilakukan penirisan selama 1 jam, memiliki kadar air yang paling tinggi dari pada perlakuan waktu perendaman dan waktu penirisan yang lainnya. Sedangkan rumput laut Gelidium sp yang direndam selama 4 jam dan kemudian dilakukan penirisan selama 1 jam, memiliki kadar air yang paling tinggi dari pada perlakuan waktu perendaman dan waktu penirisan yang lainnya. Kadar air paling tinggi pada rumput laut Gracilaria sp. adalah sebesar 85.06% berat basah, sedangkan kadar air paling tinggi pada rumput laut Gelidium sp. adalah sebesar 70.43% berat basah. 62 Untuk lebih jelasnya, hasil pengkuran Muslih (1996) terhadap daya serap air sekam padi, serbuk gergaji, dan serutan kayu dapat dilihat pada Tabel 5. Sedangkan hasil pengukuran terhadap daya serap air rumput laut Gracilariasp. dan Gelidium sp. dapat dilihat pada Tabel 6 di bawah ini. Tabel 5. Daya serap air beberapa media pengisi (Muslih, 1996) Kadar air media pengisi (% Bb) Penambahan air laut (%)* Sekam padi Serbuk gergaji Serutan kayu 100 49.44 50.60 42.22 * Persentase dari bobot kering Tabel 6. Daya serap air media pengisi rumput laut (Muslih, 1996) Kadar air (% Bb) Lama perendaman (jam) Lama penirisan (jam) Gracilaria sp. Gelidium sp. 0 0 13.45 11.22 4 1 2 3 4 83.57 82.79 84.22 83.01 70.76 68.96 67.53 64.95 8 1 2 3 4 83.35 84.11 83.17 82.15 70.35 67.94 66.96 62.87 12 1 2 3 4 85.06 84.46 83.73 83.06 70.43 69.00 66.17 65.85 16 1 2 3 4 84.27 84.12 83.28 83.92 69.93 39.38 66.89 63.99 20 1 2 3 4 84.46 83.69 83.48 83.35 70.01 69.87 66.56 66.73 63 Dari data – data yang diperoleh pada Tabel 5 dan 6 di atas, ditunjukkan bahwa busa yang merupakan media pengisi yang digunakan pada penelitian ini, memiliki daya serap air yang lebih tinggi dari pada sekam padi, serbuk gergaji, dan serutan kayu seperti yang terlihat pada data – data hasil pengukuran oleh Prasetiyo (1993) dan Muslih (1996). Sehingga berdasarkan daya serap airnya, busa memiliki kapasitas panas yang lebih besar dari pada sekam padi, serbuk gergaji, dan serutan kayu. Busa yang telah dilembabkan dan didinginkan tersebut akan mampu mempertahankan suasana lembab dan dingin lebih lama dari pada bahan pengisi sekam padi, serbuk gergaji, dan serutan kayu yang telah dilembabkan dan didinginkan. Daya serap air oleh media pengisi berhubungan erat dengan karakteristik fisik media pengisi tersebut. Karakteristik fisik busa yang memiliki pori – pori kecil yang sangat banyak, sangat halus, dan homogen di seluruh lapisan pada setiap satuan dimensinya, memungkinkan menyerap air lebih banyak dan menahannya lebih baik. Air yang terserap pada busa dapat tertahan di dalam busa tersebut karena adanya tegangan permukaan dari setiap butiran – butiran air yang terperangkap pada setiap pori – pori kecil yang terdapat pada busa tersebut. Serbuk gergaji juga mempunyai daya serap air yang baik karena bentuknya yang berupa partikel – partikel kecil yang relatif halus sehingga memiliki permukaan yang luas untuk menyerap dan menahan air. Serutan kayu memiliki karakteristik fisik berupa lembaran – lembaran yang menyebabkan penyerapan dan pengikatan air kurang sempurna. Luas permukaan serutan kayu lebih kecil dibandingkan dengan serbuk gergaji, sehingga menyebabkan kemampuannya untuk menyerap dan menahan air lebih kecil dari pada serbuk gergaji. Sedangkan karakteristik fisik pada sekam padi yang berbentuk menyerupai kantong dapat berfungsi untuk menyimpan air, meski pun hanya sementara. Sekam padi mempunyai luas permukaan yang lebih besar dibandingkan dengan serutan kayu, tetapi lebih kecil dibandingkan dengan serbuk gergaji, sehingga air yang dapat diserap dan ditahan oleh sekap padi tersebut lebih besar dari pada serutan kayu dan lebih kecil dari pada serbuk gergaji. 64 Akan tetapi data – data di atas juga menunjukkan bahwa daya serap air oleh rumput lebih besar dari pada daya serap air oleh busa. Sehingga rumput laut yang telah dilembabkan dan didinginkan tersebut memiliki kapasitas panas yang lebih besar dan mampu mempertahankan suasana lembab dan dingin lebih lama dari pada bahan pengisi busa. Daya serap air rumput laut yang besar tersebut dipengaruhi oleh komponen kimiawi penyusunnya. Komponen penyusun utama rumput laut adalah polisakarida yang mempunyai banyak sekali gugus hidroksil yang bertanggung jawab atas afinitas air dan berpotensi tinggi membentuk ikatan hidrogen (Angka dan Suhartono, 2000). Hal tersebut yang menyebabkan rumput laut dapat bersifat higrokopis, sehingga dapat menyerap dan menahan air lebih banyak dari pada busa. Pada penelitian yang dilakukan Prasetiyo (1993), pengamatan terhadap media pengisi menunjukkan bahwa setelah pengemasan, Gracilaria sp. mulai menimbulkan bau basi dan berlendir setelah 48 jam digunakan. Sedangkan bau khas ketiga media pengisi lainnya telah berkurang setelah dilakukan pengemasan. Seperti pada sekam padi, bau khas sekam berkurang setelah dilakukan pengemasan. Begitu pula pada serbuk gergaji dan serutan kayu, bau khas damarnya telah berkurang setelah dilakukan pengemasan. Hasil pengamatan Prasetiyo (1993) terhadap bau yang ditimbulkan oleh media pengisi setelah pengemasan, lebih jelas dilihat pada Tabel 7 di bawah ini. Tabel 7. Hasil pengamatan terhadap bau media pengisi (Prasetiyo, 1993) Bau No. Jenis bahan pengisi Sebelum direndam Setelah direndam Setelah dikemas kerusakan 1. Sekam padi Bau khas sekam Bau sekam kurang Bau sekam kurang - 2. Serbuk gergaji Bau khas damar Bau damar kurang Bau damar kurang - 3. Serutan kayu Bau khas damar Bau damar kurang Bau damar kurang - 4. Gracilaria sp. Bau khas rumput laut Bau khas rumput laut Bau basi Berlendir 65 Pada penelitian yang dilakukan Muslih (1996), pengamatan terhadap media pengisi menunjukkan bahwa setelah pengemasan selama 15 jam, media pengisi Gracilaria sp. mengeluarkan/tercium bau asam (basi) dan pada media pengisi Gelidium sp. mengeluarkan/tercium aroma golongan senyawa alkohol. Sedangkan pada media pengisi sekam padi, setelah pengemasan selama 15 jam, masih terdapat bau khas sekam dengan intensitas yang sama seperti sebelum dilakukan pengemasan. Begitu pula dengan media pengisi serbuk gergaji dan serutan kayu, masih terdapat bau khas terpentin dengan intensitas yang sama seperti sebelum dilakukan pengemasan. Hasil pengamatan Muslih (1996) terhadap bau yang ditimbulkan oleh media pengisi, lebih jelas dilihat pada Tabel 8 di bawah ini. Tabel 8. Hasil pengamatan terhadap bau media pengisi (Muslih, 1996) Bau media pengisi Jenis media pengisi Sebelum dikemas Setelah dikemas (15 jam) Sekam padi Bau khas sekam Bau khas sekam Serbuk gergaji Bau khas terpentin Bau khas terpentin Serutan kayu Bau khas terpentin Bau khas terpentin Gracilaria sp. Bau khas rumput laut Bau asam/basi Gelidium sp. Bau khas rumput laut Aroma alkohol Menurut pengamatan Prsetiyo (1993), timbulnya bau basi dan lendir pada media pengisi Gracilaria sp. setelah pengemasan disebabkan karena kondisi lingkungan dalam kemasan yang lembab (basah) dan suhu yang terus meningkat sehingga mikroorganisme yang semula inaktif menjadi aktif kembali dan menyebabkan Gracilaria sp. menjadi basi. Selain itu komponen terbesar dari Gracilaria sp. adalah karbohidrat seperti agar – agar, alginat, dan karagenan yang merupakan media yang baik untuk pertumbuhan bakteri. Sedangkan menurut pengamatan Muslih (1996), timbulnya aroma golongan senyawa alkohol pada media pengisi Gelidium sp. setelah pengemasan, diakibatkan karena terjadinya proses fermentasi selama media pengisi Gelidium sp. tersebut dikemas. Asam – asam organik dan senyawaan alkohol umunya merupakan produk – produk fermentasi anaerob atau anaerob fakutatif (Prave et al., 1987). 66 Media pengisi busa yang digunakan pada penelitian ini, setelah dicuci, direndam, dan ditiriskan, tidak mempunyai bau seperti apa pun (bau netral). Begitu pula setelah media pengisi busa lembab tersebut dikemas dan disimpan selama 8 jam, tidak terdapat bau apa pun yang muncul dari busa tersebut. Hal tersebut mungkin disebabkan karena busa yang digunakan sebagai media pengisi tersebut terbuat dari serat sintetis yang merupakan senyawa anorganik. Sehingga bahan pada busa tersebut tidak dapat diuraikan oleh mikroorganisme yang menghasilkan senyawa volatil penyebab timbulnya bau, sekali pun bahan busa tersebut dalam keadaan lembab dan berada pada suhu ruang. Meski pun rumput laut memiliki daya serap air yang lebih baik dari pada busa, tetapi jika digunakan sebagai media pengisi, lendir yang dihasilkan oleh rumput laut tersebut dapat menghalangi difusi O2 dari lingkungan dalam kemasan ke dalam insang ikan, sehingga daya tahan ikan selama dilakukannya transportasi sistem kering akan menurun. 4. 3. Densitas Kamba Media Pengisi Hasil pengukuran terhadap densitas kamba media pengisi (busa) lembab, disajikan pada Tabel 9 di bawah ini. Tabel 9. Densitas kamba media pengisi (busa) Ulangan ke- Volume (cm3) Berat basah (gram) Densitas kamba (gram/cm3) 1 399.6 25.7 0.064 2 3 399.6 399.6 Rata – rata 32.6 30.5 0.082 0.076 0.074 67 Berdasarkan hasil pengukuran yang disajikan pada Tabel 9 di atas, dapat diketahui bahwa media pengisi busa lembab memiliki nilai rata – rata densitas kamba sebesar 0.074 gram/cm3. Pada penelitian yang dilakukan oleh Prasetiyo (1993), hasil pengukuran terhadap densitas kamba media pengisi sekam padi lembab adalah sebesar 0.19 gram/cm3, serbuk gergaji lembab sebesar 0.44 gram/cm3, serutan kayu lembab sebesar 0.12 gram/cm3, dan Gracilaria sp. lembab sebesar 0.32 gram/cm3. Sedangkan pada penelitian yang dilakukan oleh Muslih (1996), hasil pengukuran terhadap densitas kamba media pengisi sekam padi lembab adalah sebesar 178.23 Kg/m3 (0.18 gram/cm3), serbuk gergaji lembab sebesar 346.75 Kg/m3 (0.35 gram/cm3), serutan kayu lembab sebesar 85 Kg/m3 (0.085 gram/cm3), Gracilaria sp. lembab sebesar 444.64 Kg/m3 (0.44 gram/cm3), dan Gelidium sp. lembab sebesar 217.29 Kg/m3 (0.22 gram/cm3). Dari data – data tersebut di atas dapat diketahui bahwa media pengisi busa memiliki densitas kamba paling kecil dibandingkan dengan media pengisi lainnya yang telah diukur oleh Prasetiyo (1993) dan Muslih (1996). Berdasarkan data – data yang diperoleh dari hasil pengukuran Prasetiyo (1993), densitas kamba media pengisi yang lebih besar dari densitas kamba busa lembab adalah serutan kayu lembab, kemudian diikuti dengan sekam padi lembab, Gracilaria sp. lembab, dan serbuk gergaji lembab. Sedangkan berdasarkan data – data yang diperoleh dari hasil pengukuran Muslih (1996), densitas kamba media pengisi yang lebih besar dari densitas kamba busa adalah serutan kayu lembab, kemudian diikuti dengan sekam padi lembab, Gelidium sp. lembab, serbuk gergaji lembab, dan Gracilaria sp. lembab. Menurut Soekarto dan Wibowo (1993), densitas kamba menunjukkan sifat berongga dari suatu bahan (media pengisi). Semakin kecil densitas kamba suatu media pengisi, maka akan semakin besar rongga atau ruang kosong yang terdapat pada media pengisi tersebut, sehingga kemampuan media pengisi tersebut untuk memasok udara (O2) bebas juga akan semakin besar. Utomo et al. (1998) juga menyatakan bahwa jika densitas kamba suatu bahan rendah, bahan tersebut bersifat voluminuous sehingga jika digunakan sebagai media transportasi akan lebih ringan, kapasitas angkut lebih besar, dan kandungan udara di dalam rongga media pengisi lebih besar. 68 Hal tersebut di atas menunjukkan bahwa media pengisi busa lembab memiliki rongga udara atau ruang kosong yang lebih banyak, sehingga kemampuan media pengisi tersebut untuk memasok udara (O2) bebas juga lebih besar dibandingkan dengan media pengisi lembab lainnya yang telah diukur oleh Prasetiyo (1993) dan Muslih (1996). Berdasarkan pernyataan Utomo et al. (1998), media pengisi busa lembab tersebut bersifat voluminuous sehingga jika digunakan sebagai media transportasi akan lebih ringan dan kapasitas angkutnya lebih besar. Sedangkan media pengisi yang memiliki rongga udara paling buruk (paling sedikit) adalah media pengisi yang memiliki densitas kamba paling besar. Berdasarkan hasil pengukuran Prasetiyo (1993), media pengisi yang memiliki rongga udara paling baik adalah serutan kayu dan yang paling buruk adalah serbuk gergaji. Sedangkan hasil pengukuran Muslih (1996), media pengisi yang memiliki rongga udara paling baik adalah serutan kayu dan yang paling buruk adalah Gracilaria sp. 4. 4. Efisiensi Kemasan Efisiensi kemasan dapat diketahui dari rasio antara bobot total ikan yang dapat dimuat di dalam kemasan dengan bobot total kemasan yang telah berisikan ikan. Semakin besar nilai rasio yang dihasilkan, maka semakin tinggi efisiensi kemasan tersebut. Semakin tingginya efisiensi suatu kemasan, maka jumlah ikan yang dapat dimuat di dalam kemasan juga semakin banyak. Semakin banyaknya ikan yang dapat dimuat di dalam suatu kemasan, maka akan semakin ekonomis nilai kemasan tersebut, sehingga jika digunakan dalam pengangkutan ikan akan sangat menguntungkan. Pada kemasan rak biasa, bobot total ikan (20 ekor) yang dapat dimuat di dalam kemasan tesebut adalah sebesar 234 gram. Sedangkan bobot total kemasan rak biasa yang telah berisi 20 ekor ikan adalah sebesar 415 gram. Sehingga efisiensi kemasannya adalah: Efisiensi kemasan = 234 gram x 100 = 56% 415 gram 69 Pada kemasan rak berisi udara, bobot total ikan (60 ekor) yang dapat dimuat di dalam kemasan tesebut adalah sebesar 690 gram. Sedangkan bobot total kemasan rak berisi udarayang telah berisi 60 ekor ikan adalah sebesar 1500 gram. Sehingga efisiensi kemasannya adalah: Efisiensi kemasan = 690 gram x 100 = 46% 1500 gram Pada penelitian Prasetiyo (1993), dilakukan pengukuran nilai efisiensi terhadap beberapa jenis rancangan kemasan yang digunakan untuk pengangkutan ikan lele. Pada jenis rancangan kemasan bertingkat memiliki nilai efisiesi sebesar 31.19%, jenis rancangan berlapis memiliki nilai efisiesi sebesar 50%, dan jenis rancangan kemasan berrak memiliki nilai efisiesi sebesar 44.25%. Sedangkan pada penelitian Karnila (1998), hanya dilakukan pengukuran nilai efisiensi terhadap jenis rancangan kemasan berrak dan tanpa rak yang digunakan untuk pengangkutan udang windu. Jenis rancangan kemasan tanpa rak merupakan kemasan di mana udang disusun berlapis dengan media pengisi (serbuk gergaji) tanpa menggunakan sekat – sekat penyangga/rak. Hasil pengukuran terhadap dua jenis kemasan tersebut menunjukkan nilai efisiensi pada kemasan berrak adalah sebesar 50%, sedangkan nilai efisiensi pada kemasan tanpa rak adalah sebesar 21.05%. Berdasarkan dari data – data yang tertera di atas, kemasan yang digunakan dalam penelitian ini, yaitu kemasan rak biasa dan kemasan rak berisi udara, termasuk memiliki nilai efisiensi yang tinggi, yaitu kurang – lebih sekitar 50%. Oleh karena itu, kedua jenis kemasan rak yang digunakan dalam penelitian ini tergolong ekonomis untuk digunakan sebagai kemasan pengangkut ikan hidup sistem kering, jika dilihat dari segi efisiensi kemasan. 70 4. 5. Pemingsanan Ikan Maskoki Ketika dalam proses pemingsanan, ikan maskoki menunjukkan pola tingkah laku yang berbeda – beda secara jelas seiring dengan semakin turunnya suhu. Pola tingkah laku ikan maskoki selama proses pemingsanan tesebut dapat dibagi ke dalam beberapa kelompok, yaitu kelompok yang berada dalam kisaran suhu 27 – 210C, 20 – 180C, 17 – 140C, 13 – 100C, 9 - 70C, 60C, 5 – 40C, dan 30C. Pada kisaran suhu 27 - 210C, akitifitas dan kondisi ikan relatif tidak berubah. Ikan masih berenang normal dan sangat lincah, sangat responsif terhadap rangsangan dari luar, terutama bila didekatkan dengan suatu benda. Gerakan – gerakan anggota badan (insang, sirip dorsal, ventral, dan sirip ekor) bergerak dengan aktif. Bila diangkat dari dalam air, ikan meronta dengan kuat dan operkulumnya bergerak dengan cepat. Bila dilepaskan kembali ke dalam air, ikan langsung berenang dengan gesit. Pada kisaran suhu 20 – 180C, aktivitas ikan mulai menurun. Hal ini ditunjukkan dengan sebagian besar ikan sudah mulai tenang, kurang aktif berenang, tetapi masih responsif terhadap rangsangan fisik dari luar. Bila diangkat dari dalam air, ikan meronta dengan kuat dan operkulumnya bergerak dengan cepat. Bila dilepaskan kembali ke dalam air, ikan langsung berenang dengan gesit dan tidak lama kemudian ikan kembali berenang dengan tenang. Pada kisaran suhu 17 – 140C, ikan mulai berenang dengan lemah (lamban), kurang aktif berenang, dan kurang responsif terhadap rangsangan fisik dari luar. Beberapa ikan diam dan kurang aktif berenang di dasar bak pemingsanan. Pada kisaran suhu ini, ikan mulai mudah ditangkap Bila diangkat dari dalam air, ikan masih meronta dan operkulumnya bergerak agak cepat. Bila dilepaskan kembali ke dalam air, ikan langsung berenang, tetapi tidak segesit pada kisaran suhu sebelumnya, dan tidak lama kemudian ikan kembali berenang dengan tenang. Pada kisaran suhu 13 – 100C, ikan berenang dengan sangat lamban, tidak aktif berenang, dan kurang responsif terhadap rangsangan fisik dari luar. Sebagian ikan diam dan kurang aktif berenang di dasar bak pemingsanan. Pada kisaran suhu ini, ikan mudah ditangkap. Bila diangkat, ikan meronta dengan lemah dan operkulumnya bergerak dengan lambat. Bila dilepaskan kembali ke dalam air, ikan langsung berenang, tetapi tidak gesit dan terlihat lemah untuk berenang. 71 Pada kisaran suhu 9 - 70C, ikan mulai terlihat berenang dengan limbung, hilang keseimbangan, dan beberapa saat bergerak panik. Ikan yang terlihat limbung dan hilang keseimbangan mulai sulit untuk mempertahankan posisi tegak dan berenang dengan posisi miring dan terbalik – balik. Pada kisaran suhu ini, ikan sangat lemah untuk berenang, sehingga ikan terombang – ambing oleh arus dari pompa water chiller. Sesekali ikan terlihat panik, kondisi ini ditandai dengan gerakan ikan yang terkejut - kejut dengan tiba – tiba untuk beberapa saat. Sebagian ikan juga terlihat diam dengan posisi tegak dan tidak aktif berenang di bagian dasar bak pemingsanan. Respon ikan sangat lemah terhadap rangsangan fisik dari luar, hal tersebut ditunjukkan pula dengan sangat mudahnya ikan untuk ditangkap. Bila diangkat dari dalam air, ikan meronta dengan lemah dan operkulumnya bergerak dengan lambat. Bila dilepaskan kembali ke dalam air, ikan berenang dengan limbung dan terlihat sangat lemah. Pada kisaran suhu ini, ikan maskoki diperkirakan telah memasuki fase panik. Pada suhu 60C, hampir semua ikan mulai berada dalam keadaan diam dengan posisi tegak dan bergerombol di dasar bak. Beberapa ikan masih terlihat limbung dan terbawa arus. Pada suhu ini, ikan tidak merespon terhadap rangsangan fisik dari luar, sehingga pada kondisi ini ikan dapat dengan mudah diambil dari dalam air. Bila diangkat dari dalam air, ikan hanya sedikit bergerak dengan lemah dan operkulumnya pun bergerak dengan lambat. Bila dilepaskan kembali ke dalam air, ikan berenang dengan limbung, lalu kembali diam di dasar bak atau berenang terbawa arus. Pada suhu ini, ikan maskoki diperkirakan telah berada dalam fase pingsan ringan (light sedation). Pada suhu 5 – 40C, sebagian besar ikan dalam keadaan diam dengan posisi tegak dan bergerombol di dasar bak. Beberapa ikan mulai berada dalam kondisi tergeletak miring di dasar bak. Respon ikan terhadap rangsangan fisik dari luar pada kisaran suhu ini juga tidak ada, sehingga ikan dapat dengan mudah diambil dari dalam air. Bila diangkat dari dalam air, ikan juga sedikit bergerak dengan lemah dan operkulumnya pun bergerak dengan lambat. Bila dilepaskan kembali ke dalam air, ikan berenang dengan limbung lalu diam atau tergeletak kembali di dasar bak. 72 Pada suhu 30C, hampir semua ikan berada dalam keadaan tegeletak miring dan bergerombol di dasar bak. Pada suhu ini, ikan tidak merespon terhadap rangsangan fisik dari luar, sehingga ikan juga dapat dengan mudah diambil dari dalam air. Bila diangkat dari dalam air, tubuh ikan tidak bergerak sama sekali dan operkulumnya pun tidak terlihat bergerak. Bila dilepaskan kembali ke dalam air, ikan langsung jatuh ke dasar bak lalu berada dalam posisi tergeletak. Pada suhu ini, ikan maskoki diperkirakan telah berada dalam fase pingsan berat (deep sedation). Ikan maskoki yang berada dalam fase pingsan berat ini, telah siap untuk dikemas.Untuk lebih jelasnya, kondisi ikan maskoki selama proses pemingsanan yang terbagi dalam beberapa kelompok kisaran suhu, dapat dilihat pada Tabel 10 di bawah ini. Tabel 10. Kondisi ikan maskoki selama proses pemingsanan Suhu (0C) 27 - 21 20 – 18 17 – 14 Kondisi Ikan Maskoki Ikan aktif berenang (normal) dan responsif Ikan mulai tenang (kurang aktif) dan masih responsif Ikan lamban, kurang aktif, dan kurang responsif 13 – 10 Ikan sangat lamban, tidak aktif berenang, dan kurang responsif. Diangkat meronta lemah 9-7 Ikan mulai limbung, hilang keseinbangan, dan panik. Respon lemah. 6 Ikan diam dan bergerombol di dasar. Beberapa limbung dan terbawa arus. Diangkat hampir tidak meronta 5–4 Ikan diam dan bergerombol di dasar. Beberapa dalam posisi tergeletak miring. Diangkat bergerak dengan sangat lemah. 3 Hampir semua ikan dalam posisi tegeletak miring dan bergerombol di dasar. Diangkat tidak bergerak sama sekali. Dari data – data pada proses pemingsanan di atas, ikan maskoki diperkirakan telah berada dalam keadaan pingsan berat pada suhu 30C. Untuk mengetahui pada suhu 30C ikan tersebut masih dalam keadaan pingsan dan tidak mati, maka dilakukan proses penyadaran. Proses penyadaran dilakukan dengan cara memasukkan ikan yang telah berada dalam keadaan pingsan berat tersebut ke 73 dalam air yang bersuhu normal (± 270C) dengan aerasi yang cukup. Kondisi ikan selama proses penyadaran tersebut dapat dilihat pada Tabel 11 di bawah ini. Tabel 11. Kondisi ikan maskoki pada proses penyadaran Menit ke- Kondisi Ikan 1 Beberapa ikan langsung panik dan limbung, lainnya masih tergeletak di dasar 3 Beberapa ikan baru mulai panik dan limbung, sebagian besar baru menggerakkan operkulum, sedikit sudah tenang 5 Sebagian besar ikan masih berenang limbung, beberapa panik 8 Semua ikan sudah tenang, tetapi belum aktif berenang 10 Beberapa ikan mulai aktif berenang 15 Semua ikan sudah aktif berenang (normal) Dari Tabel 11 di atas dapat diketahui bahwa ikan maskoki yang telah berada dalam keadaan pingsan berat dapat kembali berenang dengan normal setelah proses penyadaran selama 15 menit. Ikan yang telah disadarkan tersebut dapat berenang dengan lincah dan sangat responsif terhadap rangsangan fisik dari luar. Gerakan – gerakan anggota badan (insang, sirip dorsal, sirip ventral, dan sirip ekor) ikan juga sudah kembali bergerak dengan aktif. Hal tersebut ditunjukkan pula dengan sulitnya menangkap kembali ikan – ikan yang telah disadarkan tersebut. 4. 6. Suhu Pemingsanan Optimum Dari hasil pengamatan selama proses pemingsanan telah diketahui bahwa ikan maskoki berada dalam keadaan pingsan berat setelah tercapai suhu 30C. Ikan maskoki yang berada dalam keadaan pingsan berat tersebut telah siap untuk dikemas. Untuk mengetahui apakah suhu 30C merupakan suhu pemingsanan optimum, maka dilakukan percobaan dengan hasil seperti yang disajikan pada Tabel 12 di bawah ini. 74 Tabel 12. Penentuan suhu pemingsanan optimum No. Tp (0C) Ts (0C) ∆tp (Jam) ∆ts (Jam) SR* (%) DC 1 3 10 1 1 14.5 68% Insang berdarah** 2 4 10 1 1 47.2 49% Insang berdarah** 3 5 10 1 1 86.7 42% Insang berdarah** 4 6 10 1 1 100 - 5 6 10 1 3 86.7 46% Insang berdarah** * Rataan dari 3 kali ulangan ** Persentase dari total ikan yang mati Keterangan : Tp = Suhu pingsan Ts = Suhu simpan ∆ts = Lama waktu penyimpanan/waktu tranportasi ∆tp = Lama waktu pemingsanan/waktu pemingsanan DC = Dead Condition (Kondisi ikan yang mati) SR = Survival Rate (Tingkat kelulusan hidup/ikan yang dapat bertahan hidup setelah diberikan perlakuan) Berdasarkan hasil percobaan yang disajikan pada Tabel 12 di atas, dapat diketahui bahwa ikan yang dipingsankan hingga tercapai suhu pingsan 30C atau yang dikemas dalam keadaan pingsan berat, hanya mempunyai nilai SR 14.5% setelah dilakukan transportasi (statis). Dari jumlah total ikan yang mati, 68% di antaranya mengalami pendarahan pada insang. Hal tesebut dapat diketahui dari keluarnya darah ketika bagian luar operkulum sedikit ditekan dan terdapatnya bercak darah pada busa media pengisi yang berasal dari insang yang berdarah. Hal tersebut menunjukkan bahwa suhu pingsan 30C bukan merupakan suhu pemingsanan optimum, karena menyebabkan kematian selama dilakukannya transportasi. Sehingga ikan tidak ideal atau tidak tepat untuk dikemas ketika berada dalam keadaan pingsan berat. 75 Pendarahan pada insang tersebut terjadi karena pecahnya pembuluh darah kapiler pada insang. Di dalam operkulum insang terdapat beberapa filamen, yang mana tiap – tiap filamen tersebut terdiri atas banyak lamela. Lamela tersebut merupakan tempat pertukaran gas, tugas ini ditunjang oleh struktur lamela yang tersusun atas sel – sel epitel yang tipis pada bagian luar, membran dasar, dan sel – sel tiang sebagai penyangga pada bagian dalam. Pinggiran lamela yang tidak menempel pada lengkung insang sangat tipis, ditutupi oleh epitelium. Pada lamela tersebut banyak mengandung jaringan pembuluh darah kapiler. Pada proses respirasi, air akan dilewatkan melalui permukaan yang tipis dari lamela tersebut untuk memungkinkan terjadinya pertukaran gas secara difusi. (Fujaya, 2004). Pada saat dilakukannya proses pemingsanan ikan dengan suhu rendah, suhu air yang melewati permukaan lamela juga ikut mempengaruhi suhu cairan yang ada di dalam sel – sel epitel lamela dan pembuluh darah kapiler. Semakin rendah suhu air akan mengakibatkan densitas cairan pada sel – sel epitel lamela dan pembuluh darah kapiler insang semakin rendah, sehingga akan mengakibatkan volume cairan pada sel – sel epitel lamela dan pembuluh darah kapiler insang tersebut akan semakin besar. Bertambah besarnya volume cairan tersebut hingga dapat melampaui batas daya elastisitas dari sel – sel epitel lamela dan pembuluh darah kapiler insang, akan menyebabkan pecahnya struktur lamela hingga merusak filamen – filamen pada insang. Rusaknya filamen – filamen pada insang tersebut dapat memungkinkan darah keluar dari insang. Ikan mas koki yang dipingsankan dengan penurunan suhu secara bertahap hingga mengalami pingsan berat pada suhu 30C dan dipertahankan pada suhu tersebut selama 5 menit, ketika langsung disadarkan di dalam air yang bersuhu normal (± 270C) dengan aerasi yang cukup, tidak ada satu pun ikan yang mengalami pendarahan pada insangnya. Pendarahan pada insang terjadi setelah ikan disimpan di dalam kemasan pada suhu yang dipertahankan 100C selama 1 jam. Ketika ikan langsung disadarkan di dalam air yang bersuhu normal (± 270C) setelah mengalami pingsan berat pada suhu 30C dan dipertahankan pada suhu tersebut selama 5 menit, air yang bersuhu normal (± 270C) tersebut dapat dengan cepat menaikkan densitas cairan yang ada di dalam sel – sel epitel lamela dan 76 pembuluh darah kapiler, sehingga volume cairan tersebut tidak mengakibatkan pecahnya struktur lamela yang mengakibatkan pendarahan pada insang. Suhu awal media pengisi (busa) sama dengan suhu pemingsanan ikan. Ketika ikan maskoki dipingsankan hingga suhu 30C, maka suhu awal dari media pengisi tersebut juga 30C. Pola kenaikan suhu media pengisi di dalam kemasan ketika suhu penyimpanan dipertahankan 100C selama waktu transportasi, dapat dilihat pada Lampiran 11. Dari Lampiran 11 dapat diketahui bahwa kenaikan suhu media pengisi hingga stabil pada 100C membutuhkan waktu hampir 11 menit. Suhu pemingsanan dan suhu awal media pengisi pada 30C, serta kenaikan hingga suhu 100C selama 11 menit, kemudian dipertahankan pada suhu 100C hingga 1 jam dari awal penyimpanan (transportasi), mungkin masih menyebabkan cairan yang ada di dalam sel – sel epitel lamela dan pembuluh darah kapiler mempunyai densitas yang rendah, sehingga volume cairan tersebut mengakibatkan pecahnya struktur lamela dan menyebabkan pendarahan pada insang pada saat ikan ditransportasi (statis). Pada Tabel 12 di atas dapat terlihat bahwa ketika ikan dikemas pada suhu pingsan yang lebih tinggi, maka jumlah ikan yang mengalami pendarahan semakin berkurang. Hingga pada ikan dikemas pada suhu pingsan 60C, tidak terdapat lagi ikan yang mati (SR 100%) dan mengalami pendarahan pada insang, setelah dilakukan transportasi pada suhu penyimpanan dan dengan lama waktu transportasi yang sama. Kondisi ikan tersebut kembali normal setelah dilakukan proses penyadaran selama 15 menit. Hal tersebut menunjukkan bahwa setelah tercapainya suhu pingsan 60C merupakan saat yang ideal atau tepat bagi ikan untuk dilakukan pengemasan setelah proses pemingsanan. Suhu 60C merupakan suhu di mana ikan mengalami pingsan ringan pada proses pemingsanan dengan penurunan suhu secara bertahap. Sehingga saat yang ideal atau tepat bagi ikan untuk dilakukan pengemasan setelah proses pemingsanan adalah pada saat ikan berada dalam keadaan pingsan ringan. Untuk mengetahui apakah dengan suhu pingsan 60C dapat mempertahankan nilai SR 100% lebih dari 1 jam waktu transportasi, maka lama waktu transportasinya diperpanjang hingga 3 jam. Dari hasil percobaan pada Tabel 12 di atas menunjukkan bahwa jika lama waktu tranportasinya diperpanjang hingga 77 3 jam menyebabkan nilai SR ikan turun menjadi 86.7% dan terdapat kembali 46% ikan yang berdarah insangnya dari jumlah total ikan yang mati. Persentasi ikan yang berdarah ini bahkan lebih besar dari ikan yang dikemas pada suhu pingsan 50C. Hal tersebut diperkirakan terjadi karena volume cairan yang ada di dalam sel – sel epitel lamela dan pembuluh darah kapiler mengembang hingga merusak struktur lamela yang mengakibatkan pendarahan pada insang selama waktu penyimpanan 3 jam pada suhu simpan 100C. Dari hal tersebut dapat diketahui bahwa suhu simpan 100C masih terlalu dingin untuk penyimpanan ikan maskoki selama 3 jam. Oleh kerena itu pada tahap selanjutnya, dilakukan percobaan untuk menetapkan suhu penyimpanan optimum. Ikan yang mengalami pendarahan pada insang serta bercak darah yang terdapat pada busa media pengisi, dapat dilihat pada Lampiran 9. 4. 7. Suhu Penyimpanan Optimum Dari tahap sebelumnya diketahui bahwa suhu simpan 100C diperkirakan masih terlalu rendah untuk waktu transportasi selama 3 jam. Oleh kerena itu pada tahap ini digunakan suhu simpan yang lebih tinggi. Hasil percobaan pada tahap ini yang dilakukan untuk memperoleh suhu penyimpanan optimum, disajikan pada Tabel 13 di bawah ini. Tabel 13. Penentuan suhu penyimpanan optimum ∆tp ∆ts (Jam) (Jam) 1 3 SR* (%) 100 1 Tp (0C) 6 Ts (0C) 12 2 6 12 1 6 28.9 67% Insang berdarah** 3 6 14 1 6 55.6 75% Insang berdarah** 4 6 16 1 6 82.8 Insang tidak berdarah, tidak kaku 5 6 18 1 6 82.8 Insang tidak berdarah, tidak kaku 6 6 20 1 6 76.1 Insang tidak berdarah, 40% kaku** No. * Rataan dari 3 kali ulangan ** Persentase dari total ikan yang mati DC - 78 Berdasarkan hasil percobaan yang disajikan pada Tabel 13 di atas dapat diketahui bahwa suhu simpan yang dinaikkan menjadi 120C dapat meningkatkan nilai SR hingga menjadi 100% untuk waktu transportasi selama 3 jam. Untuk mengetahui apakah dengan naiknya suhu simpan menjadi 120C dapat mempertahankan nilai SR 100% lebih dari 3 jam waktu transportasi, maka lama waktu transportasinya diperpanjang hingga menjadi 6 jam. Dari hasil percobaan yang disajikan pada Tabel 13 di atas, terlihat bahwa dengan diperpanjangnya waktu transportasi menjadi 6 jam, menyebabkan turunnya nilai SR hingga menjadi 28.9% pada ikan yang ditranportasi dengan suhu simpan 120C. Waktu transportasi selama 6 jam juga menyebabkan 67% dari jumlah total ikan yang mati mengalami pendarahan pada insangnya. Hal tersebut diduga karena suhu simpan 120C masih terlalu rendah untuk waktu transportasi selama 6 jam, oleh kerena itu pada proses transportasi selanjutnya dicobakan dengan mengunakan suhu simpan yang lebih tinggi. Dari hasil pada Tabel 13 di atas ditunjukkan bahwa kenaikan suhu simpan hingga 200C tidak dapat meningkatkan nilai SR hingga menjadi 100% pada waktu transportasi selama 6 jam. Pada suhu simpan 160C dan 180C terjadi kenaikan nilai SR hingga 82.8%, akan tetapi nilai SR menurun hingga menjadi 76.1% pada suhu simpan 200C. Terlihat pula pada Tabel 13 di atas, masih terdapat insang yang berdarah sebanyak 75% dari jumlah total ikan yang mati pada suhu simpan 140C. Hal tersebut diduga karena suhu simpan 140C juga masih terlalu rendah untuk waktu transportasi selama 6 jam. Pada suhu simpan 160C dan 180C, kondisi ikan yang mati tidak menunjukkan perubahan apa pun (tidak berdarah dengan kondisi tubuh yang lentur) setelah dilakukannya transportasi. Sedangkan pada suhu simpan 200C, 40 % dari jumlah total ikan yang mati menunjukkan kondisi tubuh yang kaku, seperti mulut terbuka dan tubuh mengeras. Hal tersebut diperkirakan karena suhu simpan 200C dapat menaikkan metabolisme basal dari ikan yang berada dalam keadaan pingsan, sehingga ikan yang terdapat di dalam kemasan tersebut terbangun/tersadar. Ikan yang tersadarkan tersebut dapat menyebabkan kandungan O2 di dalam kemasan habis dengan cepat, sehingga dapat menyebabkan ikan mati dalam keadaan kaku.Ikan yang mati dalam keadaan kaku dengan mulut terbuka dapat dilihat pada Lampiran 10. 79 Dari hasil percobaan pada tahap ini, tidak tercapainya nilai SR 100% (nilai SR optimum) pada waktu transportasi selama 6 jam diperkirakan disebabkan oleh terlalu singkatnya lama waktu pemingsanan yang dilakukan sebelum ikan ditransportasi, yang pada tahap ini hanya dilakukan selama 1 jam. Dari hal tersebut dapat disimpulkan bahwa waktu pemingsanan selama 1 jam dapat menghasilkan nilai SR 100% hanya dalam waktu transportasi selama 3 jam, dengan suhu simpan 120C. Sehingga pada tahap selanjutnya, sebelum dilakukan transportasi, terlebih dulu dilakukan pemingsanan ikan dengan waktu pemingsanan yang lebih lama (lebih dari 1 jam). 4. 8. Pengaruh Waktu Pemingsanan terhadap SR Dari tahap sebelumnya diketahui bahwa untuk waktu transportasi selama 6 jam, peningkatan suhu simpan sampai dengan pada suhu 200C, tidak dapat mencapai nilai SR 100% (nilai SR optimum). Bahkan pada suhu simpan 200C tersebut, nilai SR yang dihasilkan lebih kecil dari pada nilai SR yang dihasilkan pada suhu simpan 160C dan 180C. Hal tersebut diperkirakan disebabkan karena waktu pemingsanan yang hanya selama 1 jam. Pada tahap ini dilakukan percobaan untuk mengetahui pengaruh lama waktu pemingsanan terhadap nilai SR yang dihasilkan setelah ikan ditransportasi. Sebelum dipaparkannya hasil dari percobaan yang menunjukkan pengaruh lama waktu pemingsanan terhadap nilai SR, maka pada tabel 14 di bawah ini ditunjukkan hasil dari pengaturan berbagai volume air yang terdapat di dalam bak pemingsanan ikan untuk mendapatkan lama waktu pemingsanan yang telah ditetapkan sebagai perlakuan, yaitu: 2, 4, 6, dan 8 jam. Debit air yang masuk dan keluar (bersirkulasi) dari mesin water chiller ke bak pemingsanan ikan adalah 0.038 liter/detik. 80 Tabel 14. Hasil pengaturan volume air terhadap waktu pemingsanan Q = 0.038 liter/detik Volume air (liter) Waktu pemingsanan (jam) 100 2 200 300 4 6 400 8 Pada tabel 14 di atas ditunjukkan bahwa dengan debit air 0.038 liter/detik yang bersirkulasi dari bak pemingsanan masuk ke water chiller, perbedaan volume air yang terdapat di dalam bak pemingsanan dapat menghasilkan waktu pemingsanan yang berbeda pula. Tabel 8 di atas menunjukkan bahwa setiap kenaikan 100 liter air yang terdapat di dalam bak pemingsanan mengakibatkan waktu pemingsanan yang dihasilkan lebih lama 2 jam dari pada volume air sebelumnya. Hasil percobaan yang menunjukkan pengaruh lama waktu pemingsanan terhadap nilai SR yang dihasilkan setelah ikan ditransportasi, disajikan pada Tabel 15 di bawah ini. Tabel 15. Pengaruh lama waktu pemingsanan terhadap SR SR* (%) DC 6 37.2 65% Insang berdarah** 4 6 64.4 72% Insang berdarah** 12 6 6 84.4 Insang tidak berdarah, tidak kaku 6 12 8 6 100 - 5 6 12 8 12 76.7 33% Insang berdarah** 6 6 14 8 12 76.1 Insang tidak berdarah, tidak kaku 7 6 16 8 12 83.9 Insang tidak berdarah, tidak kaku 8 6 18 8 12 88.3 Insang tidak berdarah, tidak kaku 9 6 20 8 12 83,9 Insang tidak berdarah, 52% kaku** No. Tp (0C) Ts ( C) 1 6 12 2 2 6 12 3 6 4 0 ∆tp ∆ts (Jam) (Jam) * Rataan dari 3 kali ulangan ** Persentase dari total ikan yang mati 81 Berdasarkan hasil percobaan yang disajikan pada Tabel 15 di atas dapat diketahui bahwa dengan lama waktu pemingsanan yang semakin panjang dapat meningkatkan nilai SR dalam waktu transportasi selama 6 jam. Pada Tabel 15 di atas terlihat bahwa waktu pemingsanan selama 8 jam dengan suhu simpan 120C dapat menghasilkan nilai SR 100% dalam waktu transportasi selama 6 jam. Pada waktu pemingsanan selama 2 jam dan 4 jam, terdapat ikan mati yang insangnya berdarah. Sedangkan pada waktu pemingsanan selama 6 jam tidak terdapat insang yang berdarah pada ikan yang mati, padahal masing – masing dari perlakuan tersebut ikan ditransportasi pada suhu simpan yang sama, yaitu pada suhu 120C. Hal tersebut diperkirakan karena ikan yang dipingsankan dengan waktu pemingsanan selama 2 jam dan 4 jam, secara fisiologi, masih terlalu cepat untuk teradaptasi dengan suhu simpan 120C selama 6 jam waktu transportasi, sehingga masih terjadi pendarahan pada insang. Sedangkan ikan yang dipingsankan dengan waktu pemingsanan selama 6 jam, secara fisiologi masih belum teradaptasi dengan benar dan masih lemah untuk ditransportasi selama 6 jam, sehingga tidak tercapai nilai SR 100%. Untuk mengetahui apakah waktu pemingsanan selama 8 jam dengan suhu simpan 120C dapat mempertahankan nilai SR 100% lebih dari 6 jam waktu transportasi, maka lama waktu transportasinya diperpanjang hingga menjadi 12 jam. Dari hasil percobaan yang disajikan pada Tabel 15 di atas, terlihat bahwa dengan diperpanjangnya waktu transportasi menjadi selama 12 jam, menyebabkan turunnya nilai SR hingga menjadi 76.7% pada ikan yang ditranportasi dengan suhu simpan 120C. Perpanjangan waktu transportasi tersebut menyebabkan pula 33% dari ikan yang mati mengalami pendarahan. Hal tersebut diperkirakan karena suhu 120C masih terlalu rendah untuk waktu transportasi selama 12 jam. Pada Tabel 8 di atas juga ditunjukkan bahwa dengan ditingkatkannya suhu simpan hingga 200C tidak dapat meningkatkan nilai SR hingga menjadi 100% pada waktu transportasi selama 12 jam. Hal ini diperkirakan karena pada waktu pemingsanan selama 8 jam, secara fisiologi, ikan masih belum teradaptasi dengan benar, sehingga kondisinya masih lemah untuk ditransportasi selama 12 jam. Bahkan pada suhu simpan 200C terdapat ikan yang mati kaku sebanyak 52% dari total ikan yang mati. Sama dengan perlakuan pada tahap sebelumnya, suhu 82 simpan 200C dapat menyababkan ikan yang terdapat di dalam kemasan terbangun/tersadar, sehingga dapat menyebabkan ikan mati dalam keadaan kaku karena kekurangan O2. Dari hal tersebut dapat disimpulkan bahwa kenaikan waktu pemingsanan menjadi selama 8 jam dapat menghasilkan nilai SR 100% hanya dalam waktu transportasi selama 6 jam, dengan suhu simpan 120C. Sehingga untuk mendapatkan nilai SR 100% pada waktu transportasi selama 12 jam, maka diperkirakan lama waktu pemingsanan ikan harus lebih dari 8 jam. Akan tetapi pada penelitian ini, variabel waktu pemingsanan yang diujikan untuk mengetahui pengaruh lama waktu pemingsanan terhadap nilai SR yang dihasilkan setelah ikan ditransportasi, adalah selama 2, 4, 6, dan 8 jam. Pada waktu transportasi selama 12 jam, nilai SR yang dihasilkan pada suhu simpan 140C lebih rendah dari pada nilai SR yang dihasilkan pada suhu simpan 120C. Akan tetapi nilai SR yang dihasilkan pada suhu simpan 160C dan 180C lebih tinggi dari pada nilai SR yang dihasilkan pada suhu simpan 120C, dan nilai SR yang dihasilkan pada suhu simpan 180C lebih tinggi dari pada nilai SR yang dihasilkan pada suhu simpan 160C. Pada suhu simpan 200C nilai SR kembali menurun dan nilainya sama dengan nilai SR yang dihasilkan pada suhu simpan 120C. 4. 9. Pengaruh Penurunan Konsentrasi O2 terhadap SR Percobaan pada tahap ini didasarkan pada hasil penelitian yang menyimpulkan bahwa laju konsumsi O2 oleh ikan menurun seiring dengan menurunnya kandungan O2 terlarut di dalam air, sehingga akan menurunkan laju metabolismenya (Fry, 1957). Penurunan konsentrasi O2 di dalam kemasan diharapkan dapat mengurangi laju metabolisme ikan yang dikemas di dalamnya, sehingga ikan dapat ditransportasikan lebih lama. Hasil percobaan untuk mengetahui pengaruh berbagai konsentrasi O2 terhadap tingkat SR selama transportasi sistem kering, disajikan pada Tabel 16 di bawah ini. 83 Tabel 16. Pengaruh penurunan konsentrasi O2 terhadap SR No. Tp (0C) Ts (0C) ∆tp (jam) ∆ts (jam) [O2] (%) SR* (%) DC 1 6 12 8 6 15 100 - 2 6 12 8 6 10 100 - 3 6 12 8 6 5 100 - 4 6 12 8 12 15 96.1 Insang tidak berdarah, tidak kaku 5 6 14 8 12 15 100 - 6 6 14 8 18 15 94.4 Insang tidak berdarah, tidak kaku 7 6 16 8 18 15 100 - 8 6 16 8 24 15 90 Insang tidak berdarah, tidak kaku 9 6 18 8 24 15 93.3 Insang tidak berdarah, tidak kaku 10 6 20 8 24 15 80 Insang tidak berdarah, 42% kaku** 11 6 18 8 20 15 100 - 12 6 18 8 20 10 90 Insang tidak berdarah, tidak kaku 13 6 18 8 20 5 75.6 Insang tidak berdarah, 43% kaku** 14 6 18 8 24 21 100 - 15 6 18 8 28 21 88.9 Insang tidak berdarah, tidak kaku 16 6 20 8 28 21 73.3 Insang tidak berdarah, 52% kaku** * Rataan dari 3 kali ulangan ** Persentase dari total ikan yang mati 84 Berdasarkan hasil percobaan yang disajikan pada Tabel 16 di atas dapat diketahui bahwa ketiga konsentrasi O2 yang berbeda yaitu sebesar 15%, 10%, dan 5% yang terdapat di dalam kemasan, dapat menghasilkan nilai SR 100% pada waktu transportasi selama 6 jam dengan suhu simpan 120C. Waktu transportasi selama 6 jam dengan suhu simpan 120C ini digunakan karena pada tahap sebelumnya dapat menghasilkan nilai SR 100% untuk lama waktu pemingsanan ikan 8 jam. Untuk mengetahui apakah ketiga konsentrasi O2 tersebut dapat mempertahankan nilai SR 100% lebih dari 6 jam waktu transportasi, maka lama waktu transportasinya diperpanjang lebih dari 6 jam. Pada Tabel 16 di atas menunjukkan bahwa, pada kemasan yang mengandung konsentrasi O2 15% mengalami penurunan nilai SR ketika lama waktu transportasinya terus diperpanjang. Akan tetapi ketika suhu simpannya ikut dinaikkan, maka nilai SRnya kembali meningkat. Kondisi tersebut berlanjut sampai pada suhu simpan 160C dengan waktu transportasi selama 18 jam. Waktu transportasi selama 24 jam tidak dapat menghasilkan nilai SR hingga menjadi 100%, meski pun suhu simpannya terus dinaikkan. Bahkan ketika suhu simpannya dinaikkan menjadi 200C, nilai SRnya lebih kecil dari pada nilai SR yang dihasilkan pada suhu simpan 180C. Oleh karena pada kemasan dengan konsentrasi O2 15% tidak dapat menghasilkan nilai SR 100% pada waktu transportasi selama 24 jam, meski pun suhu simpannya telah terus dinaikkan, maka waktu transportasinya diperpendek hingga menjadi 20 jam. Tabel 16 di atas menunjukkan bahwa kemasan dengan konsentrasi O2 15% pada suhu simpan 180C dapat menghasilkan nilai SR 100% setelah ditransportasi selama 20 jam. Suhu simpan 180C yang digunakan tersebut diacukan dari suhu simpan yang menghasilkan nilai SR tertinggi pada waktu transportasi selama 24 jam. Setelah kemasan dengan konsentrasi O2 15% pada suhu simpan 180C dapat menghasilkan nilai SR 100% setelah ditransportasi selama 20 jam, maka selanjutnya kemasan dengan konsentrasi O2 10% dan 5% pada suhu simpan 180C, juga ditransportasi selama 20 jam untuk membandingkan nilai SR yang dihasilkannya. Hasil pada Tabel 16 di atas menunjukkan bahwa kemasan dengan 85 konsentrasi O2 10% dan 5% pada suhu simpan 180C, masing – masing hanya menghasilkan nilai SR 90% dan 75.6% setelah ditransportasi selama 20 jam. Kemasan dengan konsentrasi O2 normal yaitu sebesar ± 21%, diujikan sebagai kontrol untuk membandingkan nilai SR yang dihasilkannya dengan nilai SR kemasan dengan konsentrasi O2 15%, 10%, dan 5%. Hasil pada Tabel 16 di atas menunjukkan bahwa kemasan dengan konsentrasi O2 normal (21%) pada suhu simpan 180C dapat menghasilkan nilai SR 100% setelah ditransportasi selama 24 jam. Akan tetapi ketika waktu transportasinya diperpanjang hingga menjadi 28 jam, nilai SRnya mengalami penurunan, meski pun suhu simpannya telah ikut dinaikkan. Bahkan ketika suhu simpannya dinaikkan menjadi 200C, nilai SRnya lebih kecil dari pada nilai SR yang dihasilkan pada suhu simpan 180C. Sehingga untuk kemasan dengan konsentrasi normal, ikan tidak dapat ditransportasi lebih dari 24 jam, karena nilai SRnya akan terus menurun. Dari data – data tersebut di atas menunjukkan bahwa penurunan konsentrasi O2 yang terdapat di dalam kemasan dapat mengakibatkan penurunan nilai SR setelah ikan ditransportasi dalam jangka waktu yang sama. Sebaliknya, jika konsentrasi O2 yang terdapat di dalam kemasan berada pada konsentrasi normal (±21%), maka dapat menghasilkan kenaikkan nilai SR setelah ikan ditransportasi dalam jangka waktu sama pula. Hal tersebut diperkirakan disebabkan karena pada keadaan pingsan, laju metabolisme ikan berada pada keadaan basal, sehingga laju konsumsi O2 oleh ikan tersebut telah berada pada tingkat yang paling rendah. Oleh karena ikan yang pingsan tersebut telah berada pada tingkat laju konsumsi O2 yang paling rendah, penurunan konsentrasi O2 di dalam kemasan tidak akan berpengaruh untuk menurunkan lagi laju konsumsi O2 seperti yang terjadi pada ikan yang masih sadar/tidak pingsan. Oleh karena ikan yang pingsan laju konsumsi O2-nya berada pada kecepatan yang stabil, yaitu pada tingkat kecepatan yang paling rendah, maka ikan (dalam keadaan pingsan) yang berada di dalam kemasan yang mengandung konsentrasi O2 paling tinggi (yang pada penelitian ini pada konsentrasi O2 normal) yang dapat bertahan hidup lebih lama. 86 Pada awal dari hasil tahap ini telah diketahui bahwa pada ketiga konsentrasi O2 yang berbeda yaitu sebesar 15%, 10%, dan 5% yang terdapat di dalam kemasan, dapat menghasilkan nilai SR 100% pada waktu transportasi selama 6 jam dengan suhu simpan 120C. Hal tersebut diperkirakan dapat terjadi karena kebutuhan konsumsi O2 oleh ikan mas koki yang berada pada tingkat laju konsumsi O2 paling rendah tersebut (dalam keadaan pingsan), masih dapat dipenuhi di dalam kemasan yang mengandung konsentrasi O2 5% selama 6 jam waktu transportasi pada suhu simpan 120C, hingga menghasilkan nilai SR 100%. Oleh karena itu, sudah pasti bahwa kemasan yang mengandung konsentrasi O2 15% dan 10% juga dapat mempertahankan kehidupan ikan maskoki hingga menghasilkan nilai SR 100% dalam waktu transportasi selama 6 jam dengan suhu simpan 120C. Pada waktu transportasi selama 20 jam dengan suhu simpan 180C, telah diketahui bahwa hanya kemasan yang mengandung konsentrasi O2 15% saja yang dapat mempertahankan kehidupan ikan hingga menghasilkan nilai SR 100%. Sedangkan kemasan yang mengandung konsentrasi O2 10% dan 5% masing – masing hanya menghasilkan nilai SR 90% dan 75.6%. Hal tersebut diperkirakan dapat terjadi karena kebutuhan konsumsi O2 oleh ikan mas koki yang berada pada tingkat laju konsumsi O2 paling rendah tersebut (dalam keadaan pingsan), sudah tidak dapat dipenuhi di dalam kemasan yang mengandung konsentrasi O2 10% dan 5% selama 20 jam waktu transportasi pada suhu simpan 180C, sehingga tidak lagi dapat mempertahankan kehidupan ikan maskoki hingga menghasilkan nilai SR 100%. Ketika konsentrasi O2 di dalam kemasan tersebut tidak dikurangi sedikit pun (berada pada konsentrasi normal), ternyata dapat memepertahankan kehidupan ikan maskoki hingga menghasilkan nilai SR 100% selama 24 jam waktu transportasi pada suhu simpan 180C. 87 V. KESIMPULAN DAN SARAN 5. 1. Kesimpulan a. Busa yang digunakan sebagai media pengisi dalam pengemasan ikan maskoki hidup, terbukti tidak berbahaya bagi kelangsungan hidup ikan maskoki. Busa tersebut diketahui memiliki daya serap air yang baik dan juga memiliki densitas kamba yang kecil. Selain itu busa yang lembab tidak mengeluarkan bau apa pun. b. Efisiensi kemasan pada jenis kemasan rak biasa dan jenis kemasan rak berisi udara, termasuk memiliki nilai efisiensi yang tinggi, yaitu kurang – lebih sekitar 50%. c. Suhu pingsan optimum untuk pemingsanan ikan maskoki dengan penurunan suhu secara bertahap adalah pada suhu 60C. d. Waktu pemingsanan optimum untuk pemingsanan ikan maskoki dengan penurunan suhu secara bertahap adalah selama 8 jam. e. Suhu penyimpanan optimum dalam transportasi ikan maskoki hidup sistem kering adalah pada suhu 180C. f. Penurunan konsentrasi O2 optimum di dalam kemasan adalah konsentrasi O2 yang diturunkan 0% (kemasan dengan konsentrasi O2 21% (kontrol)). g. Waktu transportasi (statis) optimum pada transportasi ikan maskoki hidup sistem kering adalah selama 24 jam dengan kondisi sebagai berikut: suhu pingsan ikan 60C, waktu pemingsanan secara bertahap selama 8 jam, suhu penyimpanan 180C, dan konsentrasi O2 di dalam kemasan 21%. 5. 2. Saran a. Perlu dilakukan pengkajian lebih lanjut tetang rancangan kemasan yang murah dan dapat mempertahankan sendiri suhu di dalamnya, sehingga tidak memerlukan peti kemas (container) dengan mesin pendingin. 88 b. Perlu dilakukan pengkajian lebih lanjut tetang pengaruh penggunaan kemasan yang berisi udara dengan konsentrasi O2 di atas konsentrasi O2 normal terhadap tingkat kelulusan hidup (nilai SR) ikan maskoki pada transportasi sistem kering. c. Perlu dilakukan pengkajian lebih lanjut tetang pola selisih antara suhu pingsan optimum dengan suhu penyimpanan optimum pada setiap jenis ikan yang berbeda. d. Perlu dilakukan pengkajian secara mendetail terhadap perubahan fisiologi yang terjadi pada ikan maskoki selama proses pemingsanan, transportasi (penyimpanan), serta penyadaran kembali. 89 DAFTAR PUSTAKA Affandi, R. dan Tang, U. M. 2002. Fisiologi Hewan Air. Badan Penerbit Universitas Riau. Pekanbaru. Riau. Angka, S. L. Dan M. T. Maggy. 2000. Bioteknologi Hasil Laut. Penerbit Pusat Kajian Sumberdaya Pesisir dan Lautan IPB. Bogor. Anonim. 1980. Encyclopedia Americana. Volume ke-1. USA: Americana Corporation. International Headquaters. Denbury, Connecticut. 06816. Anonim. 2003. Ekspor Ikan Hias RI tergantung Singapura. http: // www. kompas. Com / kompas-cetak / 0308 / 14 / ekonom / 491804.htm. Edisi tanggal 14/08/2003. Anonim. 2004. Terminal Ikan Hias Pertama di Indonesia. http: // www.pikiranrakyat.com / cetak / 0103 / 07 / 0606.htm. Edisi tanggal 07/01/2004. Anonim. 2005. Produksi Ikan Hias di Kotamadya Jakarta Selatan. Suku Dinas Peternakan dan Perikanan Kotamadya Jakarta Selatan. Anonim. 2006. Ikan Hias Andalan Perekonomian Jabar. http: // www. jabar. go. Id / lang / user / berita.jsp?id=1813&type=C. Edisi tanggal 30/10/2006. Anonim. 2008. Basal Metabolic Rate. Wikipedia. http: // en. wikipedia. org / wiki / Basal_Metabolic_Rate. Edisi tanggal 26/04/2008. Axelrod, H. R. dan W. Vorderwinkler. 1986. Encyclopedia of Tropical Aquarium Fishes. T. F. H. Publications, Inc. Neptune, New Jersey. Berka, R. 1986. The Transport of Live Fish. EIFAC Tech. Pap., FAO, (48): 52. Budhiman, A. A. dan P. Lingga. 1999. Maskoki. Penerbit Penebar Swadaya. Jakarta. Daelami, D. A. S. 2001. Usaha Pembenihan Ikan Hias Air Tawar. Penerbit Penebar Swadaya . Jakarta. Daelami, D. A. S. 2002. Agar Ikan Sehat. Penerbit Penebar Swadaya . Jakarta. 90 Dal vesco, V., W. Klausewitz, B. Peyronel, dan E. Tortonese. 1975. Aquarium Life. Chartwell Books, Inc. Secaucos, New Jersey. Fry, F. E. J. and Hart, J. S. 1948. The relation of temperature to oxygen consumption in the goldfish. Bio/. Bull., Woods Hole, 94, 66. Fry, F. E. J. 1957. The Aquatic Respiration of Fish. In: The Physiology of Fishes Vol. I. M. E. Brown (ed). Academic Press Inc. Publisher. New York Fry, F. E. J. and K. S. Norris. 1962. The Transportation of Live Fish. In: Fish as Food Vol. II. G. Borgstrom (ed). Academic Press Inc. Publisher. New York. Fujaya, Y. 2004. Fisiologi Ikan, Dasar Pengembangan Teknik Perikanan. Penerbit Rineka Cipta. Jakarta. Geankoplis, C. J. 1987. Transport Processes and Unit Operation. Allyn and Bacon Inc. Landon. Huet, M. 1994. Textbook of Fish Culture: Breeding and Cultivation of Fish. 2nd Edition. Fishing News Books, Ltd. England. Ilyas, S. 1983. Teknologi Refrigrasi hasil Perikanan Jilid I: Teknik Pendinginan Ikan. Penerbit CV. Paripurna. Jakarta. Inaba, A., Y. Kubo, and R. Nakamura. 1989. Automated Microcomputer System for Measurment of O2 Uptake, CO2 Output, and C2H4 Evolution by Fruit and Vegetable. J. Jspan. Soc. Hort. Sci. 58(2). Okayama. Irania, Y. 2003. Mempelajari Suhu Optimal dan Pola Penurunan Kadar O2 Ruang Kemasan pada Transportasi Udang dan Ikan Sistem Kering. Skripsi. Jurusan Teknik Pertanian. Institut Pertanian Bogor. Bogor. Jailani. 2000. Mempelajari Pengaruh Penggunaan Pelepah Pisang sebagai Bahan Pengisi terhadap Tingkat Kelulusan Hidup Ikan Mas (Cyprinus carpio). Skripsi. Jurusan Teknologi Hasil Perikanan. Institut Pertanian Bogor. Bogor. Jangkaru, Z. 2003. Memelihara Ikan di Kolam Tadah Hujan. Penerbit Penebar Swadaya. Jakarta. 91 Jhingran, V. G. and R. S. V. Pulin. 1985. A Hatchery Manual for The Common Carp, Chinese, and Indian Major. ICLARM Studies and Reviews II. Asian Development Bank. Kafuku, T. Dan H. Ikenoue. 1983. Modern Method of Aquaculture in Japan. Kodansha, Ltd. Tokyo. Karnila, R. 1998. Penenganan dan Transportasi Udang Windu Tambak (Peneus monodon Fab.) Hidup dengan Sistem Kering. Thesis. Program Studi Teknik Pertanian. Institut Pertanian Bogor. Bogor. Lingga, P. dan H. Susanto. 1999. Ikan Hias Air Tawar. Penerbit Penebar Swadaya. Jakarta. Liviawaty, E. dan E. Afrianto. 1999. Maskoki, Budidaya dan Pemasarannya. Penerbit Kanisius. Jakarta. Mc Farland. 1959. A Study of The Effects of Anasthetic on Behavior and Physiology of Fishes. Publ. Inst. Mar. Univ. Texas. Mohsein, N. W. 1980. Thermal Properties of Food and Agricultural Material. Gordon and Breach Science Publishing. New York. Muslih, I. 1996. Rancangan Media Pengisi Kemasan untuk Transportasi Udang Windu Tambak (Penaeus monodon FAB.) Hidup dalam Media Bukan Air. Skripsi. Fakultas Teknologi Pertanian IPB. Bogor. Nitibaskara, R. R., S. Wibowo, dan R. Affandi. 1997. Pengembangan Teknologi Penanganan dan Transportasi Udang Hidup untuk Peningkatan Ekspor. Laporan Penelitian. Fakultas Perikanan. Institut Pertanian Bogor. Piper, R. G., Ivan, B., Mc Elwain, Leo, and E. Orme. 1982. Fish Hatchery Management. United States Department of Interior Fish and Wild Life Service. Washington D. C. Prasetiyo. 1993. kajian Kemasan Dingin untuk transportasi Udang Hidup secara Kering. Skripsi. Jurusan Teknik Pertanian. Fateta IPB. Bogor. Prasetyawati, R. 1994. Studi Penenangan dan Pemingsanan Ikan Gurame (Osphronemus gouramy Lac.) untuk Transportasi Hidup dalam Media tanpa Air. Skripsi. Jurusan Teknologi Hasil Perikanan. Institut Pertanian Bogor. Bogor. 92 Prave, P., Faust, W. Sitting, and D. A. Sukatch. 1987. Fudamental of Biotechnology. UCH Verlagsgesellschaft mbH, D – 6940 Weinheim. Randall, D. J. 1970. Gas Exchange in Fish. In: Fish Physiology Vol. IV. W. S. Hoar and D. J. Randall (ed). Academic Press Inc. Publisher. New York. Rankin, J. B. and Jensen, F. B. 1993. Fish Ecophysiology. 1st ed. Chapman and Hall Publisher. London. Soekarto, S. T. dan S. Wibowo. 1993. Cara Penangaan Udang Hidup di luar Air untuk Transportasi Tujuan Export. Makalah Seminar Hasil – hasil Penelitian IPB. Bogor, 9 Februari 1993. Soeseno, S. 1983. Budidaya Ikan dan Udang dalam Tambak. Kerjasama antara Pemerintah Daerah DKI Jakarta dengan Gramedia. Jakarta. Setyowati, U. 1995. Mempelajari Tingkat Mortalitas Lobster Hijau (Panelirus homarus) dalam Kemasan Dingin Bahan Pengisi Serbuk Gergaji dan Koran sebagai Pembungkus. Skripsi. Jurusan Teknologi Hasil Perikanan. Institut Pertanian Bogor. Bogor. Stickney R. R. 1979. Principles of Warmwater Aquaculture. John Wiley and Son, Inc. New York. Sunyoto, P. 1993. Pembesaran Kerapu dengan Keramba Jaring Apung. Penerbit Penebar Swadaya. Jakarta. Syuaib, L. R. 2002. Penentuan Suhu Pemingsanan Beberapa Jenis Ikan dan Uji Performasi Peti Kemas Transportasi Sistem Kering. Skripsi. Jurusan Teknik Pertanian. Institut Pertanian Bogor. Bogor. Tseng, W. Y. 1987. Shrimp Mariculture A Practical Manual. Port Moresby. Departement of Papua Nuguinea. Utomo, B. S. B., Suryaningrum, T. D., Sari A., dan Wibowo, S. 1998. Intisari Penelitian Perikanan Laut. Balai Penelitian Perikanan Laut. Slipi. Jakarta. Wardoyo, S. T. H. dan D. Jokosetyani. 1988. Pengelolaan Kualitas Air Tambak Udang. Prosiding Seminar Memacu Keberhasilan dan Pengembangan Usaha Pertambakan. Bogor, 16 – 17 September 1988. 93 Wibowo, S. 1993. Penerapan Teknologi Penanganan dan Transportasi Ikan Hidup di Indonesia. Sub Balai Penelitian Perikanan Laut Slipi. Jakarta. Wibowo, S., E. Setiabudi, D. Suryaningrum, dan Y. Sudradjat. 1994. Pengaruh Penurunan Suhu terhadap Aktifitas Lobster Hijau (Panulirus hamarus). Balai Penelitian Perikanan Laut.. Balai penelitian dan Pengembangan Pertanian. Jakarta. 94 Lampiran 1. Bagan alir tahapan – tahapan penelitian Pengujian toksisitas media pengisi (busa) 20 l air + 20 ikan + busa 24 jam Daya serap air oleh media pengisi (% berat basah dan % berat kering) Densitas kamba media pengisi Efisien kemasan Menentukan suhu pemingsanan optimum (3, 4, 5, dan 60C) Menentukan suhu penyimpanan optimum (10, 12, 14, 16, 18, dan 200C) Pengruh waktu pemingsanan terhadap nilai SR (2, 4, 6, dan 8 jam) Pengaruh penurunan konsentrasi O2 terhadap SR (21 (kontrol), 15, 10, dan 5%) Menentukan waktu transportasi (statis) optimum (6, 12, 18, 24, dan 28 jam) 95 Lampiran 2. Proses pengujian toksisitas media pengisi Potongan busa (2 x 2 x 1.5 cm3) + 20 L air + 20 ekor ikan 96 Lampiran 3. Sketsa jenis kemasan rak biasa 1 2 3 5 4 6 8 7 Kemasan rak biasa tampak samping 1 2 3 4 5 Kemasan rak biasa tampak depan 97 Keterangan : 1 = Tutup kemasan 2 = Lembaran styrofoam 3 = Penyanggah rak 4 = Alas rak berpori 5 = Kotak styrofoam 6 = Ruang tempat peletakan lapisan busa dan ikan 7 = Drip space 8 = Kaki penyanggah rak bawah 98 Lampiran 4. Sketsa jenis kemasan rak berisi udara 1 2 3 4 5 6 9 7 8 10 Kemasan rak berisi udaratampak samping 1 2 3 4 5 6 7 11 8 Kemasan rak berisi udaratampak depan 99 Keterangan : 1 = Tutup kemasan 2 = Kantung udara 3 = Udara dengan komposisi O2, CO2, dan N2 yang telah diatur 4 = Lembaran styrofoam berpori 5 = Penyanggah rak 6 = Alas rak berpori 7 = Kemasan styrofoam 8 = Kaki penyanggah rak bawah 9 = Ruang tempat peletakan lapisan busa dan ikan 10 = Drip space 11 = Sekat berpori pada sisi rak 100 Lampiran 5. Pola lapisan busa-ikan-busa pada setiap rak di dalam kemasan rak biasa Kemasan rak biasa tampak samping 101 Lampiran 6. Pengemasan ikan di dalam kemasan rak biasa Ikan yang telah pingsan diletakkan di atas alas busa yang dingin dan lembab pada setiap rak dalam kemasan Ikan yang telah disusun pada setiap rak dalam kemasan, kemudian ditutupi dengan busa penutup yang dingin dan lembab 102 Lapisan rak paling atas di dalam kemasan ditutupi dengan lembaran styrofoam Kemasan kemudian ditutup dengan penutup styrofoam dan siap untuk dimasukkan ke dalam kontainer 103 Lampiran 7. Pola lapisan busa-ikan-busa pada setiap rak di dalam kemasan rak berisi udara Kemasan rak berisi udaratampak samping 104 Lampiran 8. Pengemasan ikan di dalam kemasan rak berisi udara Ikan yang telah pingsan diletakkan di atas alas busa yang dingin dan lembab pada setiap rak dalam kemasan Ikan yang telah disusun pada setiap rak dalam kemasan, kemudian ditutupi dengan busa penutup yang dingin dan lembab 105 Lapisan rak paling atas di dalam kemasan ditutupi dengan lembaran styrofoam Udara yang terdapat di dalam kemasan disedot keluar (divakumkan) 106 Setelah kemasan divakumkan, kemudian kemasan diisi dengan udara yang komposisi O2, CO2, dan N2 nya telah diatur Setelah terisi udara kira – kira 10 l, kantung udara dalam kemasan kemudian diikat dengan karet 107 Kemasan kemudian ditutup dengan penutup styrofoam dan siap untuk dimasukkan ke dalam kontainer 108 Lampiran 9. Ikan yang mati dengan insang berdarah dan bercak darah pada busa 109 Lampiran 10. Ikan yang mati dalam keadaan kaku dengan mulut terbuka 110 Lampiran 11. Pola kenaikan suhu media pengisi dari suhu 30C, 40C, 50C, dan 60C mencapai suhu simpan (salah satu contoh: 100C) 11 10 9 8 7 6 5 4 3 2 1 0 suhu 3 suhu 4 suhu 5 suhu 6 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Suhu (Celcius) Kenaikan Suhu dalam Kemasan Waktu (menit) 111 Lampiran 12. Data hasil pada tahap menentukan suhu pemingsanan optimum No. 1 2 3 4 5 Σ Tp Ts ∆tp ∆ts Ulangan ikan (0C) (0C) (Jam) (Jam) kemati 3 4 5 6 6 10 10 10 10 10 1 1 1 1 1 1 1 1 1 3 1 50 2 56 3 48 1 41 2 32 3 22 1 10 2 5 3 9 1 2 3 0 0 0 1 9 2 7 3 8 DC 35 ikan insang berdarah 44 ikan insang berdarah 27 ikan insang berdarah 19 ikan insang berdarah 17 ikan insang berdarah 11 ikan insang berdarah 4 ikan insang berdarah 3 ikan insang berdarah 3 ikan insang berdarah 5 ikan insang berdarah 3 ikan insang berdarah 4 ikan insang berdarah Σ ikan hidup SR 10 16.7 4 6.7 12 20 19 31.7 28 46.7 38 63.3 50 83.3 55 92 51 85 60 60 60 100 100 100 51 85 53 88.3 52 87 112 Ketetarangan : Tp = Suhu pingsan ∆ts = Lama waktu penyimpanan/waktu tranportasi Ts = Suhu simpan ∆tp = Lama waktu pemingsanan/waktu pemingsanan DC = Dead Condition (Kondisi ikan yang mati) SR = Survival Rate (Tingkat kelulusan hidup/ikan yang dapat bertahan hidup setelah diberikan perlakuan) 113 Lampiran 13. Data hasil pada tahap menentukan suhu penyimpanan optimum No. 1 2 3 4 1 2 3 Σ ikan mati - 1 47 2 42 3 39 1 25 2 37 3 18 1 13 2 10 3 8 Tp Ts ∆tp ∆ts Ulangan (0C) (0C) (Jam) (Jam) ke6 6 6 6 12 12 14 16 1 1 1 1 3 6 6 6 DC Σ ikan hidup SR (%) - 60 60 60 100 100 100 13 22 18 30 21 35 35 58 23 38.3 42 70 47 78.3 50 83.3 52 87 32 ikan insang berdarah 28 ikan insang berdarah 26 ikan insang berdarah 19 ikan insang berdarah 26 ikan insang berdarah 15 ikan insang berdarah Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku 114 No. 5 6 Tp Ts ∆tp ∆ts Ulangan 0 0 ( C) ( C) (Jam) (Jam) ke- 6 6 18 20 1 1 6 6 Σ ikan mati 1 10 2 12 3 9 1 15 2 11 3 17 DC Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, 6 ikan kaku Insang tidak berdarah, 4 ikan kaku Insang tidak berdarah, 7 ikan kaku Σ ikan hidup SR (%) 50 83.3 48 80 51 85 45 75 49 82 43 72 115 Lampiran 14. Data hasil pengaruh waktu pemingsanan terhadap SR No. 1 2 3 4 5 Tp Ts ∆tp ∆ts Ulangan (0C) (0C) (Jam) (Jam) ke- 6 6 6 6 6 12 12 12 12 12 2 4 6 8 8 6 6 6 6 12 Σ ikan mati 1 38 2 40 3 35 1 30 2 18 3 16 1 10 2 10 3 8 1 2 3 - 1 15 2 13 3 14 DC 25 ikan insang berdarah 27 ikan insang berdarah 21 ikan insang berdarah 23 ikan insang berdarah 13 ikan insang berdarah 10 ikan insang berdarah Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku 6 ikan insang berdarah 3 ikan insang berdarah 5 ikan insang berdarah Σ ikan hidup SR (%) 22 37 20 33.3 25 42 30 50 42 70 44 73.3 50 83.3 50 83.3 52 87 60 60 60 100 100 100 45 75 47 78.3 46 77 116 No. 6 7 8 9 Tp Ts ∆tp ∆ts Ulangan 0 0 ( C) ( C) (Jam) (Jam) ke- 6 6 6 6 14 16 18 20 8 8 8 8 12 12 12 12 Σ ikan mati 1 14 2 16 3 13 1 10 2 11 3 8 1 9 2 5 3 7 1 9 2 12 3 8 DC Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, 5 ikan kaku Insang tidak berdarah, 6 ikan kaku Insang tidak berdarah, 4 ikan kaku Σ ikan hidup SR (%) 46 77 44 73.3 47 78.3 50 83.3 49 82 52 87 51 85 55 92 53 88.3 51 85 48 80 52 87 117 Lampiran 15. Data hasil pengaruh penurunan konsentrasi O2 terhadap SR No. 1 Tp Ts ∆tp ∆ts [O2] Ulangan Σ ikan kemati (0C) (0C) (jam) (jam) (%) 1 6 12 8 6 15 2 3 - - Σ ikan hidup 60 60 60 SR (%) 100 100 100 DC 2 6 12 8 6 10 1 2 3 3 6 12 8 6 5 1 2 3 - - 60 60 60 100 100 100 1 2 Insang tidak berdarah, tidak kaku 58 97 2 3 Insang tidak berdarah, tidak kaku 57 95 3 2 Insang tidak berdarah, tidak kaku 58 97 1 2 3 - - 60 60 60 100 100 100 1 4 56 93.3 2 4 56 93.3 3 2 58 97 1 2 3 - 60 60 60 100 100 100 4 5 6 7 6 6 6 6 12 14 14 16 8 8 8 8 12 12 18 18 15 15 15 15 - - 60 60 60 100 100 100 Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku - 118 No. 8 9 10 11 12 Tp Ts ∆tp ∆ts [O2] Ulangan Σ ikan 0 0 kemati ( C) ( C) (jam) (jam) (%) 6 6 6 6 6 16 18 20 18 18 8 8 8 8 8 24 24 24 20 20 15 15 15 15 10 1 6 2 5 3 7 1 4 2 3 3 5 1 9 2 15 3 12 1 2 3 - 1 8 2 6 3 4 DC Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, 4 ikan kaku Insang tidak berdarah, 6 ikan kaku Insang tidak berdarah, 5 ikan kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Σ ikan hidup SR (%) 54 90 55 92 53 88.3 56 93.3 57 95 55 92 51 85 45 75 48 80 60 60 60 100 100 100 52 87 54 90 56 93.3 119 Tp Ts ∆tp ∆ts [O2] Ulangan Σ ikan 0 0 kemati No. ( C) ( C) (jam) (jam) (%) 13 14 15 16 6 6 6 6 18 18 18 20 8 8 8 8 20 24 28 28 5 21 21 21 1 16 2 13 3 15 1 2 3 - 1 6 2 5 3 9 1 16 2 18 3 14 DC Insang tidak berdarah, 9 ikan kaku Insang tidak berdarah, 4 ikan kaku Insang tidak berdarah, 6 ikan kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, tidak kaku Insang tidak berdarah, 8 ikan kaku Insang tidak berdarah, 11 ikan kaku Insang tidak berdarah, 6 ikan kaku Σ ikan hidup SR (%) 44 73.3 47 78.3 45 75 60 60 60 100 100 100 54 90 55 92 51 85 44 73.3 42 70 46 77