RPP Model Atom 2 - Blog Grup AGKI (Asosiasi Guru Kimia Indonesia)
advertisement

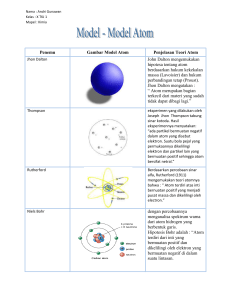
LEMBAR KERJA 2 ANALISIS PERANCANGAN RENCANA PELAKSANAAN PEMBELAJARAN RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Sekolah Mata pelajaran Kelas/Semester Alokasi Waktu : : : : SMA N 5 BOGOR Kimia X / Genap 1 x pertemuan ( 3 JP ) A. Kompetensi Inti ( KI ) KI- 3 : Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerap-kan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah. KI-4 : Mengolah, menalar, dan menyaji dalam ranah konkrit dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metode sesuai kaidah keilmuan. B. Kompetensi Dasar dan Indikator Kompetensi Dasar KD-3.2 : Memahami model atom Dalton, Thomson, Rutherfod, Bohr, dan Mekanika Gelombang Indikator 3.2.1 Mendefinisikan model atom Dalton, Thomson, Rutherfod, Bohr, dan mekanika gelombang. 3.2.2 Menggambarkan model atom Dalton, Thomson, Rutherfod, Bohr, dan mekanika gelombang. 3.2.3 Membedakan kan model atom Dalton, Thomson, Rutherfod, Bohr, dan mekanika gelombang. KD-4.2 : Menggunakan model atom untuk menjelaskan fenomena alam atau hasil percobaan 4.2.1 Membuat gambar model atom Dalton, Thomson, Rutherfod, Bohr, dan Mekanika Gelombang C. Materi Pembelajaran “ Perkembangan Model Atom “ Pengetahuan Faktual Konseptual Prosedural Metakogntif Materi Pelajaran Setiap materi mengandung atom Di dalam atom ada partikel-partikel subatom Inti atom Kulit atom Nomor atom Nomor massa Perkembangan teori atom Menerapkan model-model atom dalam kehidupan sehari-hari D. Kegiatan Pembelajaran 1). Kegiatan Pendahuluan Guru mengucapkan salam dan memimpin doa Guru mengabsen peserta didik Apersepsi : Guru memberikan pertanyaan tentang istilah “ atom “ Guru menyampaikan judul materi dan kompetensi dasar yang harus dicapai Guru menyampaikan teknik penlaian yang akan digunakan. 2). Kegiatan inti Guru menampilkan gambar model-model atom Guru menyampaikan pertanyaan : a). Apa perbedaan dari gambar model-model atom ? b). Apakah ada kelemahan dari masing-masing model atom? Peserta didik mengumpulkan data/informasi untuk menemukan jawaban dari masalah/pertanyaan yang sudah diidentifikasi melalui langkah-langkah : - Membentuk kelompok kerja - Membagikan lembar kerja yang harus diisi sebagai panduan memahami materi. - Peserta didik mengisi lembar kerja untuk menguraikan tentang perkembangan model dan teori atom. Berdasarkan informasi yang didapat peserta didik mengolahnya untuk menjawab pertanyaan : a). Apa perbedaan dari gambar model-model atom ? b). Apa kelemahan dari masing-masing model model atom tersebut ? Hasil diskusi dipresentasikan oleh masing-masing kelompok, sehingga diperoleh kesimpulan. 3). Penutup Membuat kesimpulan Melakukan refleksi : menanyakan kepada siswa bagian materi mana yang mudah dan sulit dipahami. Melakukan umpan balik : guru menugaskan peserta didik untuk menerapkan modelmodel atom dengan benda-benda atau peristiwa yang ada dalam kehidupan seharihari. Guru menyampaikan rencana pembelajaran pada pertemuan berikutnya. E. Teknik Penilaian dan Bentuk instrumen Penilaian Kognitip ( pengetahuan ) Soal Uraian : 1. Apa kelemahan model atom Dalton? 2. Apa yang dimaksud atom seperti roti kismis yang dikemukan oleh Thomson? 3. Bagaimana percobaan Rutherford menemukan inti atom? 4. Bagaimana model atom yang dikemukan oleh Erwin Schrodinger? 5. Jelaskan apa yang dimaksud bilangan kuantum? Pedoman Penilaian : Nomor 1 Nomor 2 Nomor 3 Nomor 4 Nomor 5 Jumlah skor maksimal Nilai = = 5 = 5 = 5 = 5 = 5 = 25 Jumlah skor yang diperoleh x 100 25 Penilaian Kompetensi Sikap Nama Rasa ingin tahu Berpikir kriris Berpikiran Ketekunan Penemuan terbuka dan dan kreativitas kerjasama Ratarata Skor penilaian: 1 = kurang baik, 2 = cukup baik, 3 = baik, 4 = sangat baik. Persentase penskoran penilaian sikap ilmiah siswa: No Nama Penilaian Kompetensi Keterampilan (penilaian kinerja) Mengam ati Aspek yang dinilai Mengajukan Merumusk pertanyaan an hipotesis Mengkomu nikasikan Jumlah Skor Skor penilaian: 1 = kurang baik, 2 = cukup baik, 3 = baik, 4 = sangat baik. Persentase penskoran penilaian kinerja (tes praktik): Rubrik aspek-aspek penilaian kinerja Kriteria No Skor Mengamati 1 Mengumpulkan fakta yang relevan, mengamati dengan penglihatan, perasa, dan pendengaran 4 Hanya melakukan tiga variabel diatas. 3 Hanya melakukan dua variabel di atas. 2 Hanya melakukan satu variabel diatas. 1 Mengajukan pertanyaan 2 Mengemukakan kemungkinan apa yang terjadi pada kegiatan apa yang diamati, bertanya apa, mengapa, dan bagaimana 4 Hanya melakukan tiga variabel diatas. 3 Nilai Kriteria No Skor Hanya melakukan dua variabel di atas. 2 Hanya melakukan satu variabel diatas. 1 Merumuskan hipotesis 3 Mengetahui bahwa ada lebih dari satu kemungkinan penjelasan dari suatu kejadian, menyadari bahwa suatu penjelasan perlu diuji kebenarannya dengan memperoleh bukti lebih banyak, melakukan cara pemecahan masalah, menyimpulkan sementara 4 Hanya melakukan tiga variabel diatas. 3 Hanya melakukan dua variabel di atas. 2 Hanya melakukan satu variabel diatas. 1 Mengkomunikasikan 4 Mengubah bentuk penyajian, menjelaskan hasil percobaan, membaca grafik, tabel, atau gambar, mendiskusikan hasil kegiatan, menyusun dan menyampaikan laporan secara sistematis 4 Hanya melakukan tiga variabel diatas. 3 Hanya melakukan dua variabel di atas. 2 Hanya melakukan satu variabel diatas. 1 F. Media dan Sumber Belajar - Laptop dan LCD - Lembar Kerja - Buku Kimia 1 G. Lampiran-Lampiran Ringkasan Materi Pelajaran ( FILE POWER POINT ) URAIAN MATERI SEBAGAI BERIKUT : PERKEMBANGAN MODEL ATOM 1.Model Atom Dalton John Dalton John Dalton mengemukakan hipotesa tentang atom berdasarkan hukum kekekalan massa (Lavoisier) dan hukum perbandingan tetap (Proust). Teori yang diusulkan Dalton: a. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi. b. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atomatom yang identik dan berbeda untuk unsur yang berbeda. c. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen. d. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan. Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti ada tolak peluru. Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan listrik. Bagaimana mungkin suatu bola pejal dapat menghantarkan listrik, padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menyebabkan terjadinya daya hantar listrik. 2. Model Atom Thomson JJ. Thomson Kelemahan dari Dalton diperbaiki oleh JJ. Thomson, eksperimen yang dilakukannya tabung sinar kotoda. Hasil eksperimennya menyatakan ada partikel bermuatan negatif dalam atom yang disebut elektron. Thomson mengusulkan model atom seperti roti kismis atau kue onde-onde. Suatu bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif sehingga atom bersifat netral. Model atom Thomson Kelemahan model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut. 3. Model Atom Rutherford Rutherford Eksperimen yang dilakukan Rutherford adalah penembakan lempeng tipis dengan partikel alpha. Ternyata partikel itu ada yang diteruskan, dibelokkan atau dipantulkan. Berarti di dalam atom terdapat susunan-susunan partikel bermuatan positif dan negatif. Hipotesa dari Rutherford adalah atom yang tersusun dari inti atom dan elektron yang mengelilinginya. Inti atom bermuatan positif dan massa atom terpusat pada inti atom. Model atom Rutherford Kelemahan dari Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit. 4. Model Atom Niels Bohr Kelemahan dari Rutherford diperbaiki oleh Niels Bohr dengan percobaannya menganalisa spektrum warna dari atom hidrogen yang berbentuk garis . Hipotesis Bohr adalah : Kelemahan dari Rutherford diperbaiki oleh Niels Bohr dengan percobaannya menganalisa spektrum warna dari atom hidrogen yang berbentuk garis. Hipotesis Bohr adalah : a. Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan. b. Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah lintasan ke lintasan yang lebih tinggi maka elektron akan menyerap energi. Jika beralih ke lintasan yang lebih rendah maka akan memancarkan energi. Model atom Bohr digambarkan sebagai berikut Model atom Bohr Kelebihan atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron. Kelemahan model atom ini adalah: tidak dapat menjelaskan spekrum warna dari atom berelektron banyak. Sehingga diperlukan model atom yang lebih sempurna dari model atom Bohr.