ii. bahan dan metode
advertisement

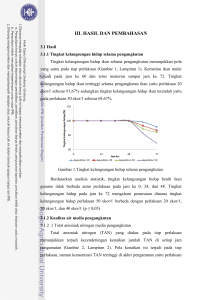
II. BAHAN DAN METODE Kegiatan penelitian ini terbagi dalam dua tahap yaitu tahap penelitian pendahuluan dan tahap utama. Penelitian pendahuluan meliputi hasil uji kapasitas serap zeolit, kapasitas serap karbon aktif, kemampuan puasa ikan, laju ekskresi total amoniak nitrogen (TAN) benih ikan gurame, dan tingkat konsumsi oksigen. Tahap penelitian utama yaitu penentuan kepadatan optimum benih ikan gurame pada transportasi tertutup, kualitas air, gambaran darah, kelangsungan hidup ikan pemeliharaan, dan laju pertumbuhan harian. 2.1 Prosedur kerja. 2.1.1 Kemampuan puasa ikan Ikan dipuasakan dalam akuarium ukuran 0,6x0,5x0,5 m3 selama lima hari. Ikan uji dimasukkan ke dalam akuarium sebanyak 30 ekor dengan diaklimatisasi selama 15 menit. Pergantian air dilakukan sebanyak 20% setiap hari kemudian tingkah laku ikan uji diamati dan dicatat. Pengujian dilakukan dengan tiga ulangan. Selama pemuasaan ikan dilakukan pengukuran kualitas air yaitu suhu, nilai pH, dan oksigen terlarut. 2.1.2 Tingkat konsumsi oksigen Pengukuran tingkat konsumsi oksigen (TKO) dilakukan dengan pengukuran bobot dan panjang benih ikan gurame. Benih ikan gurame dimasukkan ke dalam toples volume 3,5 ℓ yang telah diisi air. Jumlah benih ikan gurame yang dimasukkan sebanyak lima ekor. Pengujian dilakukan dengan tiga ulangan. Jumlah oksigen terlarut dalam toples diukur setiap jam selama 6 jam. 2.1.3 Laju ekskresi amoniak Pengukuran laju ekskresi amoniak ikan terlebih dahulu dilakukan dengan pengukuran bobot dan panjang total tubuh benih ikan gurame, kemudian benih tersebut dimasukkan ke dalam toples kaca yang tertutup steroform sebanyak sepuluh ekor. Setelah melakukan hal tersebut dilakukan pengambilan air sampel. Air sampel diambil sebanyak 30 mℓ setiap 12 jam selama 48 jam untuk pengukuran kualitas air. Parameter yang diukur adalah suhu, nilai pH, oksigen terlarut, dan konsentrasi TAN. Pengujian ini dilakukan dengan tiga ulangan. 2.1.4 Kapasitas zeolit dan karbon aktif Pengukuran kemampuan serap zeolit dan karbon aktif terhadap NH3 dapat dilakukan dengan mengukur tingkat serap bahan aktif tersebut dalam larutan TAN. Tahapan dalam proses ini diawali dengan penyiapan dua botol plastik yang salah satu bagian tutup botol dilubangi dengan jarum. Bagian leher botol diisi dengan zeolit dan karbon aktif masing-masing sebanyak 20 gram. Larutan TAN dengan konsentrasi 0,766 mg/ℓ dialirkan ke dalam botol yang berisi karbon aktif dan zeolit. Pengambilan sampel air dilakukan pada setiap menit selama proses tersebut sebanyak 30 mℓ, kemudian dilakukan pengukuran TAN, nilai pH, dan suhu. Pengujian ini dilakukan dengan tiga ulangan. 2.1.5 Penentuan kepadatan optimum benih ikan gurame pada pengangkutan tertutup Kegiatan packing diawali dengan pemuasaan benih ikan gurame selama dua hari untuk mengosongkan lambung pada ikan. Zeolit (20 gram) dan karbon aktif (10 gram) diikatkan pada bagian ujung plastik kemudian ujung plastik yang lainnya diikat dengan kran yang berfungsi untuk pengambilan sampel air media pengangkutan. Kantong plastik diisi air sebanyak 1,2 ℓ dan ikan dengan kepadatan berbeda yaitu 20 ekor, 30 ekor, 40 ekor, dan 50 ekor. Kantong plastik diberi oksigen murni dengan perbandingan 1:3 kemudian diikat dengan karet. Pengujian pada setiap perlakuan dilakukan dengan tiga ulangan. Wadah packing (steroform) diberi es batu pada bagian ujung yang berfungsi untuk menurunkan suhu udara. Kantong packing diletakkan dalam wadah dan dilakukan simulasi pengangkutan dengan perlakuan goncangan. Selama simulasi, dilakukan pengukuran kualitas air setiap 24 jam sekali. Parameter yang diukur adalah oksigen terlarut, TAN, suhu, dan nilai pH. Selain itu juga dilakukan evaluasi tingkat kelangsungan hidup ikan setiap 12 jam. Rangkaian penelitian tahap ini dilakukan selama 72 jam. 2.1.6 Gambaran darah Gambaran darah dilakukan sebanyak dua kali yaitu pascapengangkutan dan pemeliharaan pascapengangkutan (7 hari setelah pengangkutan). Darah diambil menggunakan syringe yang telah dibasahi dengan antikoagulan (Na-sitrat) yang bertujuan untuk mencegah terjadinya pembekuan darah. Darah ditampung ke dalam tabung Eppendorf yang telah dibasahi dengan antikoagulan. Jumlah darah yang diambil sebanyak ± 0,4 ml. Darah yang telah didapatkan dilakukan pengukuran gambaran darah meliputi difirensiasi leukosit, jumlah sel darah merah, jumlah sel darah putih, hemoglobin, dan hematokrit. 2.1.6.1 Jumlah sel darah merah dan sel darah putih Perhitungan sel darah merah dilakukan dengan pengenceran darah sampel terhadap larutan Hayem dengan perbandingan 1:200 (Svobodova dan Vykusova, 1991). Perhitungan sel dilakukan dibawah mikroskop dengan menggunakan haemositometer dengan jumlah lapang pandang 10 kotak kecil. Pengujian ini dilakukan dengan tiga ulangan. Perhitungan jumlah sel darah putih dilakukan dengan cara pengenceran darah pada larutan Turk’s dengan perbandingan 1:20 (Svobodova dan Vykusova, 1991). Perhitungan haemositometer sel dilakukan dibawah mikroskop menggunakan dengan jumlah lapang pandang lima kotak besar. Pengujian dilakukan dengan tiga ulangan. 2.1.6.2 Hematokrit Darah dihisap dengan menggunakan tabung mikrohematokrit berlapis heparin pada bagian dalam (sebagai antikoagulan) dengan sistem kapiler. Setelah darah terhisap sebanyak 4/5 dari volume tabung maka bagian ujung tabung ditutup dengan menggunakan bahan penutup (critoseal) (Svobodova dan Vykusova, 1991). Tabung yang telah berisi darah di sentrifuge dengan kecepatan 3000 rpm selama 5 menit. Pengukuran dilakukan dengan membandingkan bagian darah yang mengendap dengan seluruh bagian darah yang ada dalam tabung mikrohematokrit dan dinyatakan dalam persen. Pengujian dilakukan dengan tiga ulangan. 2.1.6.3 Hemoglobin Pengukuran kadar hemoglobin darah dilakukan dengan metode Sahli (Wedemeyer dan Yasutake, 1977). Metode ini mengonversi hemoglobin darah dalam bentuk asam hematin oleh asam klorida. Darah dihisap sampai skala 20 mm3 dengan pipet Sahli. Ujung pipet yang digunakan dibersihkan dari sisa-sisa darah dengan menggunakan tisu, kemudian darah dipindahkan dalam tabung Sahlinometer yang telah berisi HCl 0,1 N sampai batas tera 10. Kedua bahan diaduk dan dibiarkan selama 3-5 menit agar hemoglobin bereaksi dengan HCl dan membentuk asam hematin (kuning kecoklatan), kemudian ditambahkan akuades sehingga warna sampel sama dengan warna standar. Pembacaan skala dilakukan dengan melihat permukaan cairan dan dicocokkan dengan skala tabung Sahlinometer yang dilihat pada lajur g%, yang berarti banyaknya hemoglobin dalam gram per 100 mℓ darah. Pengujian dilakukan dengan tiga ulangan. 2.1.6.4 Diferensiasi leukosit Darah diambil sebanyak 0,05 mℓ yang diletakkan diatas gelas objek, kemudian diratakan dengan gelas objek yang lain dengan cara sekali ulas baik dari arah depan maupun dari arah belakang, setelah itu difiksasi udara sampai kering. Setelah kering, preparat difiksasi dengan metanol selama 10 menit, kemudian dikeringkan dan direndam dengan larutan Giemsa selama 15-30 menit setelah itu dicuci dengan akuades. Preparat kemudian dikeringkan dan diamati dengan cara menghitung jumlah neutrofil dan limfosit dalam darah tersebut dengan pengamatan dilakukan sebanyak lima lapang pandang kemudian perhitungan dalam bentuk persentase. Pengujian dilakukan dengan tiga ulangan. 2.1.7 Pemeliharaan ikan Pemeliharaan ikan dilakukan selama 21 hari setelah ikan dibongkar. Ikan dipelihara sebanyak 15 ekor di akuarium dengan dimensi 60x50x50 cm3 yang telah dicuci dan dikeringkan selama tiga hari. Sumber air yang digunakan yaitu berasal dari tandon laboratorium lingkungan dan ditreatment dengan menggunakan filter fisik melalui sistem pengendapan. Akuarium diisi air dengan ketinggian 25 cm dan diaerasi selama tiga hari. Ikan dipelihara dengan pemberian pakan berupa cacing dan pellet secara at satiation. Penyiponan dilakukan setiap pagi dan sore dengan pergantian air sebanyak 20% setiap hari. Pengukuran laju pertumbuhan harian dilakukan dengan mengukur bobot ikan awal dan ikan akhir sedangkan kelangsungan hidup ikan selama pemeliharaan yaitu setiap hari dengan mengamati ada atau tidaknya ikan yang mati. Pengukuran kualitas air selama pemeliharaan ikan pascapengangkutan yaitu dilakukan satu minggu sekali dengan parameter yang diukur yaitu nilai pH, oksigen terlarut, suhu, dan TAN. Suhu optimal dalam pemeliharaan ikan gurame yaitu 28-30 0C sehingga media pemeliharaan menggunakan heater di setiap akuarium. 2.2 Rancangan percobaan Rancangan yang dilakukan dalam penelitian ini adalah rancangan acak lengkap (RAL) dengan empat perlakuan yaitu: A = 20 g zeolit + 10 g karbon aktif + kepadatan 20 ekor/ℓ B = 20 g zeolit + 10 g karbon aktif + kepadatan 30 ekor/ℓ C = 20 g zeolit + 10 g karbon aktif + kepadatan 40 ekor/ℓ D = 20 g zeolit + 10 g karbon aktif + kepadatan 50 ekor/ℓ Masing-masing perlakuan terdiri dari 3 ulangan. Model rancangan yang digunakan yaitu: yij = µ + τi + έij (Steel dan Torrie, 1982) Keterangan: yij = data pada perlakuan kepadatan ke-i dan ulangan ke-j µ = nilai tengah data τi = pengaruh perlakuan ke-i έij = kesalahan percobaan pada perlakuan kepadatan ke-j dan ulangan ke-i Data yang diperoleh dianalisa secara statistik menggunakan analisis ragam (anova) dengan uji F pada selang kepercayaan 95% menggunakan progam MS.exel 2007 dan SPSS 16.0 untuk menentukan apakah perlakuan berpengaruh terhadap parameter yang diamati. Apabila berpengaruh nyata, untuk melihat perbedaan antara perlakuan akan diuji lanjut dengan menggunakan uji Tukey. 2.3 Pengumpulan data Adapun data yang dikumpulkan dalam penelitian ini adalah data tingkat kematian ikan, data kualitas air (oksigen terlarut, nilai pH, suhu dan total amoniak nitrogen), bobot ikan, jumlah sel darah merah, jumlah sel darah putih, hematokrit, hemoglobin, dan diferensiasi leukosit. Data tersebut akan digunakan untuk menghitung parameter yang diamati meliputi derajat kelangsungan hidup, pertumbuhan bobot harian, NH3, dan gambaran darah ikan. 2.3.1 Derajat kelangsungan hidup Derajat kelangsungan hidup (SR) adalah perbandingan jumlah ikan yang hidup sampai akhir pemeliharaan dengan jumlah ikan awal pemeliharaan. Perhitungan SR digunakan rumus dari Goddart (1996): % % Keterangan : SR = Kelangsungan Hidup Nt = Jumlah ikan akhir (ekor) No = Jumlah ikan awal (ekor) 2.3.2 Total Amoniak Nitrogen (TAN) dan Amoniak Nilai TAN didapatkan dari perbandingan nilai absorban sampel dan standar kemudian dilakukan konsentrasi larutan standar yang digunakan NH3 = nilai TAN dikalikan dengan persentase amoniak yang tidak terionisasi berdasarkan nilai pH dan suhu. Tabel 1. Persentase amoniak tidak terionisasi (NH3) pada pH dan suhu yang berbeda (Boyd, 1990) pH Suhu (0C) 18 20 22 24 26 6,5 0,1 0,1 0,1 0,2 0,2 7 0,3 0,3 0,4 0,5 0,5 7,5 0,9 1,1 1,2 1,4 1,7 8 2,9 3,3 3,8 4,4 5 8,5 8,5 9,8 11,2 12,7 14,4 2.3.3 Laju pertumbuhan bobot harian Laju pertumbuhan bobot harian (α) ditentukan berdasarkan selisih bobot rata-rata akhir (Wt) dengan bobot rata-rata awal (Wo) pemeliharaan kemudian dibandingkan dengan waktu pemeliharaan (t) dengan rumus dari Huisman (1989): % 2.3.4 Tingkat konsumsi oksigen Tingkat konsumsi oksigen ditentukan berdasarkan selisih oksigen terlarut akhir (DOt) dengan oksigen terlarut awal (DOo) kemudian dibagi selisih waktu pengamatan akhir (t1) dengan waktu pengamatan awal (t0) dan dibagi banyaknya biomas (W) kemudian dikalikan volume air (V) dengan rumus dari Pavlovskii (1964): 2.3.4 Jumlah sel darah merah Perhitungan sel darah merah dilakukan dengan menghitung sel darah merah pada haemasitometer dengan jumlah lapang pandang sepuluh kotak kecil dan jumlahnya dihitung dengan rumus (Nabib dan Pasaribu, 1989): SDM = (A/N) x (1/V) x Fp SDM = Jumlah sel darah merah A = Jumlah sel darah merah N = Jumlah kotak haemasitometer yang diamati V = Volume haemasitometer Fp = Faktor pengenceran 2.3.5 Jumlah sel darah putih Perhitungan sel darah putih dilakukan dengan menghitung sel darah putih pada haemasitometer dengan jumlah lapang pandang lima kotak besar dan jumlahnya dihitung dengan rumus (Nabib dan Pasaribu, 1989): SDP = (A/N) x (1/V) x Fp SDP = Jumlah sel darah putih A = Jumlah sel darah putih N = Jumlah kotak haemasitometer yang diamati V = Volume haemasitometer Fp = Faktor pengenceran