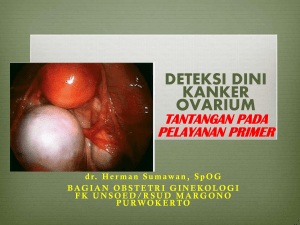
modifikasi indeks risiko keganasan sebagai modalitas diagnostik
advertisement

MODIFIKASI INDEKS RISIKO KEGANASAN SEBAGAI MODALITAS DIAGNOSTIK PREOPERATIF UNTUK MEMPREDIKSI KEGANASAN TUMOR OVARIUM : SUATU UJI DIAGNOSTIK dr. I Nyoman Gede Budiana, Sp.OG(K) BAGIAN / SMF OBSTETRI DAN GINEKOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA / RSUP SANGLAH DENPASAR 2011 ABSTRAK Latar belakang : Kanker ovarium merupakan salah satu penyakit kanker yang banyak dijumpai pada wanita dan sering disebut sebagai “Silent Killer” karena diagnosa baru diketahui setelah penderita sudah memasuki stadium lanjut. Oleh karena itu, deteksi dini untuk mengetahui sejak dini adanya kanker ovarium sangat diperlukan. Kebanyakan mereka yang diketahui kanker ovarium pada stadium awal akan mempunyai harapan hidup yang lebih baik. Akan tetapi pemeriksaan skrining untuk mendeteksi adanya kanker ovarium sejak dini sangat sulit. Bila dilakukan pemeriksaan USG atau tumor marker saja, akurasi untuk memprediksi keganasan tumor ovarium kurang akurat. Diperlukan beberapa kombinasi pemeriksaan untuk bisa mendiagnosa keganasan ovarium. Risk of malignancy Index (RMI) adalah integrasi dari pemeriksaan kadar serum CA125, status menopause penderita, dan temuan ultrasonografi. Dengan cut off value 200, digunakan untuk membedakan antara tumor ovarium yang jinak dan ganas, dengan sensitivitas 87% dan spesifisitas 97%. Dengan melakukan modifikasi dari RMI ini, diharapkan pemeriksaan lebih mudah dan akurasinya sama. Tujuan: untuk mengetahui akurasi Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif dalam memprediksi keganasan tumor ovarium. Bahan dan cara : Penelitian ini merupakan suatu studi prospektif uji diagnostik. Uji diagnostik yang diuji adalah Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium yang dibandingkan dengan hasil pemeriksaan histopatologis sebagai gold standard. Populasi penelitian adalah semua penderita dengan diagnosis tumor ovarium yang datang ke Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar. Setelah didapatkan sampel sesuai dengan kriteria inklusi dan eklusi, dilakukan penghitungan nilai Modifikasi Indeks Risiko Keganasan yaitu dengan formula U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). Kemudian dibandingkan dengan hasil pemeriksaan histopatologis tumor ovarium Hasil : batas (Cut-Off) nilai Modifikasi Indeks Risiko Keganasan sebagai petanda tumor ganas atau jinak adalah 119. Bila >119 dinyatakan ganas, bila <119 dinyatakan jinak. Berdasarkan hasil analisis, didapatkan bahwa Sensitivitas = 93,33%; Spesifisitas = 95%; Nilai duga positif = 93,33%); Nilai duga negatif = 95%; Rasio Kemungkinan positif = 18,67; Rasio Kemungkinan negatif = 0,07. Kesimpulan : Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium mempunyai nilai Sensitivitas sebesar 93,33% dan Spesifisitas sebesar 95%. Bila dibandingkan dengan RMI, nilai sensitivitas lebih tinggi dan nilai spesifisitas hampir sama. Kata kunci : Keganasan tumor ovarium, Modifikasi Indeks Risiko Keganasan, Pemeriksaan histopatologis. ABSTRACT Background : Ovarian cancer is one of the most cancer that is often found in women and is often referred to as the “Silent Killer” because of the diagnosis became known only after the patient has entered an advanced stage. Therefore, early detection to determine the presence of early ovarian cancer are needed. Most of them are known in early-stage ovarian cancer will have a better life expectancy. However, screening examination or tumor markers alone, the accuracy for predicting malignant ovarian tumors that are less accurate. Required some combination of the examination to be able to diagnose ovarian malignancy. The Risk of Malignancy Index (RMI) is the integration of the examination of serum CA 125 levels, menopausal status of patients, and ultrasound findings. With the cut-off value of 200, is used to differentiate between ovarian tumors are benign and malignant, with sensitivity of 87% and a specificity of 97%. By performing a modification of the RMI, is expected to be much easier and accuracy checks together. Purpose : To determine the accuracy of the Modified Risk Malignancy Index as preoperative diagnostic modality to predict malignancy of ovarian tumors compared with histologic examination as the gold standard. The study population was all patient with a diagnosis of ovarian tumors who came to the outpatient Obstetric and Gynecology Sanglah Denpasar Hospital. Once the sample is obtained in accordance with inclusion and exclusion criteria, the Modified Risk Malignancy calculated with formula U (ultrasound score) x M (menopausal status) x serum CA 125 (U/ml). Then compared with the results of histopathological examination of ovarian tumors. Result : Limit (cut-off) Modified Risk Malignancy Index as malignant or benign tumors marker was 119. When >119 declared vicious, when <119 otherwise benign. Based on the analysis, it was found that the sensitivity=93,33%, specificity=95%, positive expected value=93,33%, negative expected value=95%. Reason for positive probability=18,67;reason for negative probability=0,07. Conclusion : The modification of the rate of risk of malignancy as a modality of preoperative diagnosis to predict malignancy of ovary tumors has a value of 93,33% of sensitivity and specificity of 95%. In comparison with the RMI, the values of higher sensitivity and specificity are almost identical. Keyword : Malignant Tumors of Ovary, Modified of Risk Malignancy Index, Histopathological examination. ix 1 BAB I PENDAHULUAN 1.1. Latar Belakang Kanker ovarium merupakan salah satu penyakit kanker yang banyak dijumpai pada wanita dan sering menyebabkan kematian. Kanker ovarium sering disebut dengan “Silent Killer” karena gejala kanker ovarium sangat sulit diketahui hingga akhirnya saat terdiagnosa penderita sudah memasuki stadium lanjut. Kanker ovarium tidak memiliki gejala yang spesifik. Sebagian gejala pertumbuhan kanker ovarium mungkin sama dengan pertumbuhan non kanker atau gejala penyakit lainnya. Deteksi dini terhadap kanker ovarium ini sangatlah penting untuk keselamatan penderita. Kebanyakan mereka yang diketahui kanker ovarium pada stadium awal akan mempunyai harapan hidup yang lebih baik. Akan tetapi pemeriksaan skrining untuk mendeteksi adanya kanker ovarium sejak dini sangat sulit. Prevalensi kanker ovarium telah meningkat sejak 30 – 40 tahun terakhir. Terdapat 20.000 kasus baru didiagnosa setiap tahun, dan 12.500 dari penderita ini akan meninggal dalam perjalanan penyakit mereka. Fakta berdasarkan penelitian yang dilakukan oleh Cancer Research UK, terdapat sekitar 6.800 wanita Inggris telah didiagnose menderita kanker ovarium. Di Amerika Serikat, 23.000 wanita terserang kanker ovarium tiap tahunnya dan 14.000 meninggal karena penyakit ini. Di negaranegara berkembang kanker ovarium merupakan kanker nomor lima terbesar setelah kanker payudara, kanker usus, kanker paru-paru, dan kanker rahim. Kanker ovarium merupakan penyebab kematian keempat diantara semua kematian karena kanker dan 2 sebagai penyebab kematian pertama karena kanker ginekologi (National Guideline Clearinghouse, 2009). Di Indonesia tumor ganas ovarium banyak dijumpai, setelah tumor ganas serviks dan tumor ganas payudara, dengan five years survival rate dalam 50 tahun terakhir tidak banyak mengalami kemajuan, yakni berkisar antara 20 – 37%. Hampir 75% karsinoma ovarium tidak terdiagnosa sampai akhirnya sudah berkembang menjadi stadium III atau IV, dengan five years survival rate hanya 20%. Bila penderita karsinoma ovarium bisa didiagnosa saat stadium I, maka five years survival rate setinggi 80 – 90% dan angka kematian akan menurun setengahnya (Chrisdiono, 1996). Sebagai akibat hasil tersebut diatas, metode skrining untuk deteksi awal kanker ovarium sangat diperlukan. Tetapi bukti klinis menunjukkan bahwa fase preklinis untuk kanker ovarium kurang dari dua tahun, sehingga cepatnya pola perjalanan penyakit mengakibatkan kesulitan untuk deteksi awal. Saat ini tes skrining yang digunakan untuk deteksi dini yaitu pemeriksaan fisik, tumor marker seperti CA125, USG termasuk transabdominal, transvaginal dengan color dopler dan power dopler, CT scan, dan MRI. Tetapi hampir sebagian besar pemeriksaan penunjang untuk melakukan tes skrining tersebut mahal, dan memberikan hasil false positif sehingga menyebabkan pemeriksaan tersebut menjadi tidak efektif (Ian J and Usha M, 2004). Karena keterbatasan skrining tumor ovarium maka diagnosis yang akurat massa di adneksa merupakan tantangan bagi dokter ginekologi. Tumor ovarium terlihat sebagai massa di adneksa yang bisa dibedakan menjadi jinak dan ganas. Prosedur diagnosis preoperatif yang dapat membedakan antara tumor ovarian yang curiga ganas dan jinak, diharapkan dapat bermanfaat untuk merencanakan secara optimal penanganan yang diperlukan. Diagnosis preoperatif sangat penting, 3 karena bisa mencegah pembedahan yang tidak perlu, misalnya pada kista fungsional. Sedangkan penderita dengan kecurigaan ganas preoperatif tidak saja memerlukan tindakan pembedahan yang optimal tetapi juga memerlukan penanganan pre, peri, dan postoperatif yang tepat. Kecurigaan keganasan preoperatif menentukan apakah penderita memerlukan rujukan ke spesialis onkologi untuk mendapatkan penanganan yang optimal, sehingga memberikan hasil prognostik penyakit menjadi lebih baik. Ketepatan dan kecepatan mereferal penderita ke onkologi ginekologi dapat meningkatkan harapan hidup penderita kanker ovarium. Metode yang sudah terstandarisasi untuk identifikasi kemungkinan keganasan pada tumor ovarium preoperatif, optimis akan merupakan langkah pertama yang tepat bagi penderita dengan kanker ovarium. Untuk bisa diterima secara klinis, suatu modalitas diagnotik preoperatif untuk memprediksi keganasan tumor ovarium harus mempunyai sensitifitas dan spesifisitas yang tinggi, yaitu 90% dan 75%, bisa diinterpretasikan, dan menggunakan beberapa tehnik diagnostik/parameter (Viktoriya S., Emmanuel C,2006). Ada beberapa modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium yaitu pemeriksaan fisik pelvis, tumor marker seperti CA125, USG termasuk transabdominal, transvaginal dengan color dopler dan power dopler, sitologi aspirasi kista ovarium, sitologi aspirasi cairan ascites dan efusi pleura, biopsi kelenjar limfe yang membesar, CT-scan, MRI, PET, Foto thoraks, Rektosigmoideskopi, dan Barium enema. Adapula variasi metode identifikasi preoperatif yang telah dikembangkan dan digunakan untuk mengetahui kemungkinan adanya keganasan dari tumor ovarium yaitu dengan suatu algoritma yang disebut Risk of malignancy Index (RMI). Risk of 4 malignancy Index (RMI) adalah integrasi dari pemeriksaan kadar serum CA125, status menopause penderita, dan temuan ultrasonografi (Ian J.,et.al, 2005). Begitu banyak modalitas diagnostik preoperatif bisa digunakan, masalahnya adalah memilih prosedur yang mempunyai nilai diagnostik yang tinggi, efektif,tidak invasif, dan applicable/mudah dikerjakan (Viktoriya S., Emmanuel C,2006). Tidak ada metode diagnostik preoperatif yang sangat adekuat yang bisa membedakan tumor ovarium jinak atau ganas. Tetapi dengan kombinasi pemeriksaan kadar serum CA-125, temuan USG dan status menopause penderita, diharapkan dapat memberikan hasil diagnostik yang lebih baik. Algoritme RMI diperkenalkan pertama kali oleh Jacobs tahun 1990. RMI dihitung dengan formula (RMI = U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). Temuan ultrasonografi diklasifikasikan berdasarkan atas ada atau tidaknya lesi kistik multilokular, bagian padat, lesi bilateral, ascites dan metastasis intraabdominal. Bila tidak terdapat gambaran USG di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Menopause status diberikan nilai 1 untuk premenopause dan nilai 3 bila postmenopause. Postmenopause ditetapkan apabila wanita riwayat amenore lebih dari satu tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Kadar CA125 dinyatakan sesuai dengan nilai absolut yang didapatkan dalam satuan U/ml. Dengan cut off value 200, digunakan untuk membedakan antara tumor ovarium yang curiga jinak dan ganas. Penderita dengan skor RMI >200 diprediksi ganas dan skor RMI <200 diprediksi jinak. Hasil dari suatu review menyatakan 5 bahwa Risk of Malignancy Index (RMI) adalah prediktor yang paling baik digunakan sebagai modalitas diagnostik preoperatif untuk memprediksi tumor ovarium jinak atau ganas pra bedah (Geomini, et al., 2009). Namun hal ini sulit dikerjakan, terutama dalam menilai metastasis intraabdominal. Akan lebih mudah apabila temuan USG yang dicari adalah ada atau tidaknya gambaran papil dan tebal dinding kista. Maka dari itu peneliti ingin melakukan modifikasi RMI menjadi suatu indeks yang dinamakan Modifikasi Indeks Risiko Keganasan, yang lebih mudah dikerjakan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium preoperatif, sehingga bisa merencanakan tindakan atau penanganan yang tepat bagi pasien. Diharapkan Modifikasi Indeks Risiko Keganasan ini, mempunyai nilai sensitivitas dan spesifisitas yang sama atau lebih baik dari RMI. Peneliti ingin mengetahui apakah Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium mempunyai akurasi yang sama atau bahkan lebih baik daripada RMI? 1.2. Rumusan Masalah Apakah Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium mempunyai akurasi yang sama atau bahkan lebih baik daripada RMI? 1.3. Tujuan Penelitian 1.3.1. Tujuan umum : Untuk mengetahui akurasi Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif dalam memprediksi keganasan tumor ovarium. 6 1.3.2. Tujuan khusus : 1. Untuk mengetahui sensitifitas dan spesifisitas CA 125, USG, dan Modifikasi Indeks Risiko Keganasan dalam memprediksi keganasan tumor ovarium preoperatif. 2. Untuk mengetahui nilai duga positif dan nilai duga negatif CA 125, USG, dan Modifikasi Indeks Risiko Keganasan dalam memprediksi keganasan tumor ovarium preoperatif. 3. Untuk mengetahui Rasio Kemungkinan CA 125, USG, dan Modifikasi Indeks Risiko Keganasan dalam memprediksi keganasan tumor ovarium preoperatif. 1.4. Manfaat Penelitian 1.4.1. Manfaat bagi Pengetahuan Memberikan sumbangsih suatu modalitas diagnostik yang berguna untuk memprediksi keganasan tumor ovarium preoperatif. 1.4.2. Manfaat bagi Pelayanan 1. Untuk meningkatkan five years survival rate tumor ganas ovarium. 2. Sebagai sistem rujukan pasien lebih awal, sehingga pasien mendapatkan tindakan operasi yang tepat. 3.Mengurangi re-operasi 7 BAB II TINJAUAN PUSTAKA 2.1. Definisi Tumor ganas ovarium merupakan kumpulan tumor dengan histiogenesis yang beraneka ragam, dapat berasal dari ketiga dermoblast (ektodermal, endodermal, dan mesodermal) dengan sifat-sifat histiologis maupun biologis yang beraneka ragam (Mardjikoen P., 2005). 2.2. Epidemiologi Tumor ganas ovarium merupakan 20% dari semua keganasan alat reproduksi wanita. Insidensi rata-rata dari semua jenis diperkirakan 15 kasus baru per 100.000 populasi wanita setahunnya (Mardjikoen P., 2005). 2.3. Faktor predisposisi keganasan pada ovarium Sampai saat ini ada beberapa hal yang diketahui berhubungan dengan kejadian karsinoma ovarium yaitu : 1.Riwayat kanker ovarium dalam keluarga Dari hasil penelitian diketahui bahwa risiko akan meningkat sampai 50 % bila ada riwayat karsinoma ovarium dalam keluarga dari garis keturunan pertama maupun kedua. Risiko ini akan lebih tinggi apabila dalam keluarga juga terdapat riwayat kanker payudara, kanker endometrium dan kanker kolon (Lynch syndrome) (Berek J.S., 2002). 8 2.Umur Terdapat perbedaan insiden karsinoma ovarium berdasarkan golongan umur. Umumnya insiden kanker ovarium meningkat setelah menopause atau sekitar umur 51 tahun keatas. Lebih dari 50 % kanker ovarium terjadi pada wanita berumur lebih dari 65 tahun (Busmar B., 2006) 3.Riwayat menstruasi, kahamilan dan infertilitas Banyak peneliti yakin bahwa ada hubungan antara kanker ovarium dengan riwayat menstruasi. Risiko karsinoma ovarium meningkat pada wanita yang haid pertamanya dibawah umur 12 tahun atau menopause diatas umur 50 tahun. Demikian juga wanita yang tidak pernah hamil, tidak pernah mengalami proses kehamilan secara lengkap atau mempunyai anak pertama pada umur diatas 30 tahun. Risiko karsinoma ovarium menurun sampai 40-50% pada wanita yang memakai kontrasepsi hormonal jenis pil squensial demikian juga pada wanita yang menyusui anaknya setelah melahirkan (Busmar B., 2006) 4.Pengobatan infertitilas Suatu penelitian retrospektif menyatakan pemakaian klomifen sitrat pada perempuan infertil lebih dari 12 siklus akan meningkatkan resiko relatif menjadi 11. Sedangkan penelitian kohort lainnya menyatakan bahwa sampai saat ini tidak ada hubungan antara penggunaan obat-obat fertilitas terhadap peningkatan resiko untuk terjadinya karsinoma ovarium. Tetapi penelitian ini masih perlu dilanjutkan karena banyak perempuan dalam penelitian ini belum mencapai umur puncak terjadinya kanker ovarium. Beberapa data menyatakan bahwa infertilitas yang menyebabkan wanita infertil yang mendapatkan terapi klomifen sitrat mempunyai resiko karsinoma 9 ovarium, atau faktor-faktor predisposisi lain yang dimiliki sebelumnya (Jensen A., et.al, 2009) 5.Diet tinggi lemak Diet banyak daging dan lemak binatang berhubungan dengan peningkatan risiko untuk terjadinya karsinoma ovarium (Berek J.S., 2002). 6.Talcum Powder Kebiasaan menggunakan bedak pada daerah genital dapat meningkatkan risiko kanker ovarium. Umumnya bedak mengandung asbestos, senyawa yang diketahui memiliki sifat karsinogenik (Berek J.S., 2002). 7.Mutasi genetik yang didapat Seperti kanker pada umumnya, karsinoma ovarium dapat disebabkan oleh mutasi DNA yang sebabkan rangsangan bahan onkogenik. Terjadinya mutasi pada HER2 onkogen atau gen tumor supresor p53 berhubungan dengan tingginya risiko terjadinya karsinoma ovarium (Berek J.S., 2002). 2.4. Klasifikasi Tumor Ovarium Pelbagai kesulitan dijumpai ketika menyusun klasifikasi tumor ovarium dengan menggunakan kriteria histologik, sehingga WHO pada tahun 1973 mengajukan klasifikasi sebagai berikut (Chrisdiono A., 1996) : I. Neoplasia epitel 1) Jenis serosum : jinak, borderline, ganas 2) Jenis musinosum : jinak, borderline, ganas 3) Endometrioid : jinak, borderline, ganas 4) Mesonefroid : jinak, borderline, ganas 10 5) Tumor Brenner : jinak, borderline, ganas 6) Kombinasi jenis epitelial : jinak, borderline, ganas 7) Tidak terdiferensiasi 8) Tidak terklasifikasi II. Neoplasma stroma gonad 1) Tumor sel granulosa/tekofibroma 2) Tumor sel Sertoli-Leydig 3) Gonadoblastoma III. Tumor sel lipoid IV. Neoplasma germinal 1) Disgerminoma 2) Tumor sinus endodermal 3) Karsinoma embrional 4) Khoriokarsinoma 5) Teratoma V. Tumor jaringan lain yang tidak khas ovarium VI. Limfomamaligna VII.Tumor primer unclassified VIII.Tumor Metastatik 90% kanker ovarium berasal dari epithelial, 75% dari kanker ovarium epithelial adalah tipe histologis serosum, 20% musinosum, 2% endometrioid, dan kurang dari 1% adalah mesonefroid, Brenner, dan karsinoma yang tidak terdiferensiasi. 11 2.5. Kriteria Diagnostik (Busmar B., 2006) 1) Gejala Klinis. a. Dicurigai kanker ovarium usia kurang dari 20 tahun atau lebih dari 60 tahun /menopause dengan: • Tumor kistik atau solid. • Mobile atau terfiksir. b. Sangat dicurigai kanker ovarium: • Tumor cepat membesar, padat berdungkul, dan terfiksir. • Dapat disertai keadaan umum yang menurun sampai kacheksia, asites, efusi pleura, gangguan pasase usus, pembesaran kelenjar limfe supra klavikula dan lain-lain sesuai dengan luas penyebaran penyakit ke organ lainnya. 2) Pemeriksaan Penunjang (Andrijono, 2009) a. USG (dikerjakan pada setiap kasus tumor ovarium). b. Tumor marker. c. Sitologi aspirasi kista ovarium. d. Sitologi cairan ascites dan pleura. e. Biopsi kelenjar limfe yang membesar. f. CT-scan, MRI, PET, Foto toraks, Rektosigmoidoskopi, dan Barium enema. 12 3) Stadium klinis kanker ovarium (FIGO) (Berek J.S., 2002) Stadium Deskripsi Stadium I Tumor tumbuh terbatas pada ovarium Stadium Ia Terbatas pada satu ovarium, kapsul intak, tidak ada tumor pada permukaan dan sel ganas (-) pada cairan ascites. Stadium Ib Terbatas pada kedua ovarium, kapsul intak, tidak ada tumor pada permukaan dan sel ganas negatif pada cairan ascites atau cucian peritoneum Stadium Ic Adalah stadium Ia dan Ib dengan tumor pada permukaan ovarium atau ruptur kapsul atau ascites dengan sel ganas (+) atau cucian peritoneum sel ganas (+) Stadium II Pertumbuhan tumor pada satu atau kedua ovarium dengan penyebaran pada pelvis Stadium IIa Penyebaran ke uterus atau tuba Stadium IIb Penyebaran ke organ pelvis lainnya Stadium IIc Stadium IIa/IIb dengan tumor pada permukaan ovarium atau ruptur kapsul, atau asites dengan sel ganas (+) atau cucian peritoneum sel ganas (+) Stadium III Tumor pada satu/kedua ovarium dengan implantasi tumor pada peritoneum diluar kavum pelvis dan/atau pembesaran kelenjar limfe retroperitoneal/inguinal (+), Metastasis ke bagian superfisial hati atau tumor terbatas pada rongga pelvis tetapi pemeriksaan histopatologi terhadap perluasan pada usus halus atau omentum. StadiumIIIa Tumor secara makros terbatas pada true pelvis dengan pembesaran kelenjar limfe (-) tetapi secara histologi ada perluasan pada peritoneum abdomen. Stadium IIIb Stadium IIIa dan perluasan tumor pada peritoneum abdomen kurang dari 2 cm, pembesaran kelenjar limfe (-). Stadium IIIc Stadium IIIa + pertumbuhan tumor pada peritoneum abdomen lebih dari 2 cm dan atau pembesaran kel limfe retroperitoneal/inguinal (+). Stadium IV Tumor pada satu atau kedua ovarium dengan metastase jauh berupa pleural efusion dengan sitologi (+) atau penyebaran pada parenkim hati. Catatan :Stadium lc apabila stadium Ia terjadi: a. Kapsul ruptur spontan atau dipecahkan oleh operator b. Sitologi (+) dari cairan peritoneum atau ascites. 13 2.6.Skema Evaluasi Preoperatif Tumor di Ovarium Tumor di Ovarium Premenopause ≤ 8 cm Pasca Menopause peningkatan CA125 dan/massa kompleks pada pemeriksaan USG ≥ 8 cm Pemeriksaan USG Tumor Kistik Tumor Padat Operasi Observasi selama 2 bulan Tumor tumbuh Progresi Gambar 2.1. Skema Evaluasi Preoperatif Tumor di Ovarium (Dikutif dari Berek J.S., editors. Ovarian Cancer. Novak’s Gynecology. 13th ed.) 14 2.7.Modalitas Diagnostik Preoperatif untuk memprediksi keganasan tumor ovarium preoperatif Problem diagnosis preoperatif untuk membedakan tumor curiga jinak atau ganas ovarium masih belum terselesaikan dengan baik, padahal pembedahan akan bisa direncanakan seoptimal mungkin apabila telah diketahui sebelum operasi apakah tumor ovarium tersebut curiga jinak atau ganas. Macam pembedahan dan pengalaman dokter bedah merupakan faktor penting untuk prognosis tumor ganas ovarium. Adapun beberapa pemeriksaan bisa dijadikan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium. A.Pemeriksaan pelvis Pada pemeriksaan pelvis hal-hal yang memerlukan perhatian khusus, bila dalam pemeriksaan fisik pelvis dijumpai hal-hal sebagai berikut (Chrisdiono A.,1996): 1) Adanya massa tumor di daerah ovarium 2) Gerakan tumor terbatas 3) Permukaan tumor irreguler 4) Adanya tumor di daerah cul de sac 5) Massa tumor bilateral 6) Tumor daerah panggul yang membesar dalam observasi 7) Adanya asites 8) Adanya omental cake atau hepatomegali 9) Tumor di daerah panggul setelah menopause. 15 Mengamati perbedaan-perbedaan antara tumor jinak dan ganas ovarium, pada pemeriksaan panggul sangat diperlukan, untuk meningkatkan kewaspadaan terhadap adanya keganasan dapat lebih terarah lagi (Padilla LA.,et.al, 2000). Penemuan pada pemeriksaan panggul bisa membedakan tumor jinak dan ganas. Adapun membedakan tumor jinak dan ganas dari pemeriksaan panggul, seperti terlihat pada tabel 2.1. Tabel 2.1. Penemuan pada pemeriksaan paggul Kriteria Jinak Ganas Unilateral Bilateral 2. Konsistensi Kistik Padat 3. Gerakan Bebas Terbatas 4. Permukaan Licin Tidak licin Sedikit/tidak ada Banyak Tidak ada Ada Lambat Cepat 1. Sifat 5. Ascites 6. Benjolan di daerah cul-de-sac 7. Pertumbuhan Dikutip dari : Chrisdiono A.,1996. Berdasarkan penelitian didapatkan bahwa keakuratan pemeriksaan pelvis untuk menentukan jinak atau ganasnya suatu tumor ovarium sangat terbatas. Sekitar 10% massa pelvis yang berukuran kurang dari 10 cm tidak terdeteksi dengan pemeriksaan pelvis secara manual. Akurasi pemeriksaan pelvis untuk mengevaluasi massa pelvis sebesar 70,2% (Padilla LA., et.al, 2000). 16 Soedaryanto juga mengembangkan suatu Indeks yang dapat menemukan adanya kecurigaan keganasan prabedah yang bisa diketahui dengan pemeriksaan fisik, yaitu dengan menggunakan Indeks Keganasan Ovarium Prabedah. Tabel 2.2. Indeks Keganasan Ovarium Variasi petunjuk diagnosis 1. Lama pembesaran perut atau tumor Kelas variable Score a. Lambat (lebih dari 16 bulan atau tak ada pembesaran) 0 1 b. Cepat (16 bulan atau kurang) 2. Keadaan umum 3. Tingkat kekurusan 4. Konsistensi tumor 5. Permukaan tumor 6. Gerakan tumor 7. Ascites 8. Laju endap darah a. Baik 0 b. Kurang / tak baik 1 a. Normal / gemuk 0 b. Kurus 1 a. Kistik homogeny 0 b. Solid homogen 1 c. Macam-macam 2 a. Rata/licin 0 b. Benjol tak teratur 1 a. Bebas 0 b. Terbatas 1 a. Tak ada 0 b. Ada 1 a. Rendah (60 mm atau kurang) 0 b. Tinggi (lebih dari 60 mm) 1 Dikutip dari : Chrisdiono A., 1996. Skor 3 – 5 menunjukkan kecurigaan keganasan, sedangkan skor 6 atau lebih dapat dikatakan ganas. 17 B. Ultrasonografi. Pemeriksaan ultrasonografi saat ini merupakan hal yang umum untuk mengevaluasi hasil temuan abnormal pada pemeriksaan ginekologi. Dibandingkan dengan pemeriksaan pelvis secara manual, ultrasonografi memiliki keunggulan terutama untuk mengevaluasi kondisi ovarium. Ovarium bisa tervisualisasi lebih dari 95% pada wanita premenopause dan lebih dari 85% pada wanita post menopause. Dahulu, penggunaan transabdominal ultrasound (TAS) sering digunakan. Pada tabel 2.3 di bawah ini disajikan beberapa variasi hasil penelitian menggunakan TAS untuk mendiagnosa keganasan massa adneksa (Uma S., et.al, 2006). Tabel 2.3. Nilai TAS untuk mendiagnosa keganasan pada massa adneksa Peneliti Pasien Tumor Specificity Sensitivity (n) Malignan (%) (%) (n) Herman et al 304 50 94 82 Finkler et al 106 37 95 62 Benacerraf et al 100 30 87 80 Jacobs et al 139 41 83 71 Buy et al 108 43 92 60 Luxman et al 102 29 42 93 Total 859 230 78 74 Spesifisitas bervariasi antara 42 – 95% dan sensitivitas antara 60 – 93%, hal ini membuktikan bahwa sulit untuk membedakan antara tumor jinak dan ganas ovarium dengan menggunakan TAS. 18 Penggunan transvaginal sonografi (TVS) memiliki tiga keunggulan dibandingkan dengan transabdominal sonografi dalam hal tidak membutuhkan kandung kencing yang penuh, pada pasien yang gemuk pemeriksaan akan lebih mudah, dan tranduser probe dapat ditempatkan sedekat mungkin dengan organ pelvik, sehingga dapat dipergunakan frekuensi yang lebih tinggi dengan demikian kualitas gambar yang dihasilkan lebih jernih dan tajam. Sistem skoring morfologi telah dikembangkan untuk menambah akurasi TVS. Kriteria evaluasi meliputi ukuran atau volume, penampakan formasi papilari pada dinding kista, dan kompleksitas dari kista (Busmar B., 2006). Tabel 2.4. Indeks Morfologi Tumor Ovarium Catagory Volume (cm3) Tebal dinding (mm) Septum (mm) 0 < 10 tipis < 3 mm 1 10 – 50 tipis > 3 mm Tidak ada Tebal < 3 mm Morphology Index 2 > 50 – 200 Papiler < 3 mm Septa 3 mm – 1 Cm 3 > 200 – 500 Papiler > 3 mm 4 > 500 Dominan Padat Padat, > 1 Cm Dominan Padat Dengan menggunakan TVS saja, beberapa penelitian telah dilakukan untuk mendiagnosa keganasan pada massa adneksa. Dalam beberapa hasil penelitian ini didapatkan variasi spesifisitas berkisar antara 65 – 98% dan sensitifitas berkisar 48 – 100%. Adapun hasil beberapa penelitian tersebut ditampilkan dalam tabel 2.5 berikut ini (Mettler L.,t.al, 2008). 19 Tabel 2.5. Nilai TVS untuk mendiagnosa keganasan pada massa adneksa Peneliti Pasien Tumor Malignan Specificity Sensitivity (n) (n) (%) (%) Granberg et al 50 16 82 100 Sassone et al 143 13 83 100 Kurjak et al 83 29 98 48 Hata et al 63 27 69 85 Weiner et al 53 17 69 94 Kawai et al 109 40 65 90 Total 501 142 79 83 Walaupun gambaran morfologi untuk mengukur indek morfologi bisa rutin dilakukan dan dijadikan standar pemeriksaan ultrasonografi, banyak variabel yang tidak dicatat atau terukur, sehingga hal ini menyebabkan terbatasnya penggunaan index morfologi dalam praktek sehari-hari. Karena alasan ini, index morfologi tidak selalu bisa digunakan untuk menghitung kemungkinan keganasan (Uma S., et.al,2006). Transvaginal color doppler imaging (CDI), dapat meningkatkan sensitifitas dan nilai prediksi positif ultrasogografi untuk mengevaluasi massa pada daerah pelvis. Telah diketahui bahwa pertumbuhan pembuluh darah adalah memegang peranan penting untuk menunjang pertumbuhan tumor, terutama pada tumor ganas dimana pertumbuhan dan perkembangan jaringannya sangat cepat dan tidak terkendali. Dinding pembuluh darah pada tumor tersebut memiliki otot polos yang lebih sedikit bila dibandingkan dengan pembuluh darah normal, sehingga tahanannya (resitance index/RI) lebih kecil terutama pada arteriola. Penurunan tahanan ini dapat 20 diketahui dengan memakai CDI. Kurjak dkk, dalam penelitiannya melakukan pemeriksaan dengan mempergunakan CDI pada 14.317 wanita tanpa keluhan atau dengan keluhan minimal. Ditemukan 624 tumor jinak adneksa dengan RI normal, dan 56 penderita keganasan ovarium dimana sebanyak 54 penderita menunjukkan RI yang rendah. Sensitifitas CDI dalam penelitian ini adalah 96,4% dengan spesifisitas 99,8% (Uma S., et.al,2006). Aplikasi gambaran aliran pembuluh darah sangat membantu dalam mendeteksi keganasan ovarium karena adanya neovaskularisasi menandakan keganasan. Ketika ultrasonografi gray-scale mendeteksi adanya septum dan papil atau komponen solid pada ovarium, adanya gambaran aliran pembuluh darah seringkali menunjukkan adanya keganasan. Tetapi, deteksi vaskularisasi pada tumor ganas yang terdapat papil terkadang tidak terlihat terutama pada tumor yang masih kecil. Penggunaan color doppler ultrasonografi menunjukkan sensitivitas dan spesifisitas yang tinggi dalam mendeteksi keganasan ovarium bila level Resistensi Indeks (RI) < 0,4 dan PI < 1. Ada beberapa studi menunjukkan kemungkinan tumpang tindihnya nilai PI dan RI antara tumor yang jinak dengan tumor yang ganas. Parameter dan cut-off level untuk pulsatility dan resistensi indeks yang mana bisa memprediksi keganasan sangat sulit untuk ditentukan. Selain itu pula, biaya pemeriksaan yang mahal dan memerlukan pengalaman pemeriksa yang tinggi mengakibatkan keterbatasan penggunaan alat ini. Hal ini menunjukkan bahwa penggunaan color doppler saja tidak cukup sebagai indikator keganasan ovarium (University General Hospital “Attikon”, Athens, Greece. 2004). 21 C. Tumor marker. CA125 adalah suatu glikoprotein dengan berat molekul tinggi dan bisa dikenali oleh monoclonal antibody (OC-125). CA125 terdapat pada cairan amnion dan embrionik coelomic epithelium. Antigen juga bisa terdapat pada jaringan lain seperti epithel tuba fallopii, endometrium, endoserviks, dan ovarium. CA125 juga terdapat di sel mesothelial pleura, pericardium, dan peritoneum. CA125 disebutkan sebagai salah satu tumor marker yang bisa membedakan dan paling dipercaya untuk mendiagnosis kanker ovarium. Data menyebutkan bahwa CA125 secara signifikan meningkat pada 90% pasien dengan tumor ganas ovarium epithelial, dan 40% pada seluruh kasus keganasan intra-abdominal (Rasjidi I., 2009). Kadar CA125 bisa mengestimasi diagnosis preoperatif, monitoring keganasan ovarium yang sudah didapatkan dan monitoring respon terapi dengan kemotherapi dan prognosis penyakit. Penelitian besar yang sudah pernah dilakukan cut off nilai CA125 >35 U/mL di curigai keganasan. Beberapa pusat laboratorium menetapkan nilai normal serum CA125 berkisar 0 – 35 U/mL. Literature menunjukkan nilai diagnostik serum CA125 untuk membedakan tumor jinak dan ganas ovarium mempunyai sensitifitas berkisar antara 56% - 100% dan spesifisitas sebesar 60% - 92% pada pre atau post menopause. Peningkatan serum CA125 > 35 U/mL bisa terdeteksi pada 50% pasien dengan stadium 1 dan lebih dari 90% pada stadium lanjut. Kadar serum CA125 lebih jarang meningkat pada tumor mucinous dibandingkan dengan tumor non-mucinous. Keterbatasan nilai serum CA125 adalah kadarnya juga bisa meningkat selama menstruasi dan kehamilan dan pada beberapa kondisi jinak terutama pada masa 22 reproduksi seperti endometriosis, peritonitis, dan cirrhosis yang disertai ascites. Untuk meningkatkan nilai diagnostik preoperatif resiko keganasan pada wanita dengan massa di ovarium CA125 dikombinasikan dengan pemeriksaan ultrasonografi, status menopause, dan serum tumor marker lainnya (Mongkol B., Neungton C. 2007). D.Sitologi aspirasi dan biopsi kista ovarium Kista ovarium bisa di evaluasi dengan cara aspirasi sitologi dinding kista yang masih intak dan dilanjutkan dengan eksisi dinding kista dengan bantuan laparoskopi. Kemudian hasil aspirasi dan eksisi dinding kista dilakukan pemeriksaan histologi. Tetapi indikasi untuk melakukan aspirasi sitologi ini masih kontroversi. Beberapa penulis menyatakan bahwa prosedur aspirasi sitologi ini tidak lagi dibenarkan sejak rembesan komponen kista yang malignan bisa meningkatkan stadium tumor ovarium. Penulis lain menyatakan bahwa aspirasi kista ovarium mempunyai peranan yang penting untuk evaluasi tumor ovarium yang kecil pada wanita premenopause yang masih ingin mempertahankan fertilitas. Berdasarkan dari beberapa studi, akurasi aspirasi sitologi tumor ovarium adalah 90%, tetapi seleksi pasien yang akan menjalankan prosedur ini sangat penting, disarankan pada wanita muda, masih reproduktif, dan tidak dilakukan pada wanita peri atau post menopause. Reliability dan akurasi diagnostik aspirasi bisa sampai 91% pada tumor jinak dan 84% pada tumor ganas. Beberapa studi juga menyatakan bahwa kegagalan diagnostik dari sitologi kista ovarium sebesar 15%. Kegagalan diagnostik hasil sitologi bisa disebabkan karena cairan aspirasi bercampur darah atau mucus, cairan kista ovarium mempunyai jumlah sel yang sedikit untuk bisa membuat kesimpulan yang akurat, 23 atau sel malignan tidak menyebar secara merata di ovarium (Salehpour S., et.al, 2002). E.Sitologi cairan ascites dan pleura Dinyatakan bahwa 4 diantara 5 penderita dengan ascites yang malignan paling sering disebabkan oleh karsinoma ovarium, tumor saluran pencernaan, payudara, paru, uterus dan tumor serviks. Penyebaran sel tumor ke dalam rongga abdomen menyebabkan gangguan regulasi aliran cairan peritoneum dengan berbagai cara. Pemeriksaan pelvis tidak cukup kuat untuk menyimpulkan penyebab ascites adalah karena keganasan atau penyakit lainnya. Diperlukan beberapa pemeriksaan seperti pemeriksaan darah, tumor marker CA-125, dan imaging (CT-scan, MRI, USG) untuk mengidentifikasi adanya keganasan. Mendeteksi adanya sel tumor dalam cairan ascites adalah indikator yang sangat spesifik untuk membuktikan adanya keganasan. Tetapi hanya 60% hasil aspirasi menunjukkan hasil sitologi yang positif, sehingga perlu dilakukan pengulangan pemeriksaan apabila dicurigai adanya keganasan. Apabila hasil sitologi cairan adalah negatif (tidak ditemukan sel ganas), biochemical marker pada cairan ascites bisa mengindikasikan adanya penyakit keganasan. Selain adanya tumor marker, peningkatan kadar protein atau laktat dehidrogenase sebesar kadar serum albumin ascites bisa digunakan untuk membedakan penyebab penyakit. Tetapi, tumor marker dan serum lainnya tidak terlalu spesifik untuk satu jenis tumor, dan hasil sensitivitas yang diberikan tidak konsisten tergantung dari asal tumor primer. Sedangkan aspirasi Cairan pleura untuk menentukan etiologi effusi pleura, dilihat dari penampakan cairan pleura pada saat thoracosintesis. Penampakan cairan pleura yang berdarah dihubungkan dengan keganasan. Tetapi dari hasil penelitian 24 hanya 11% pleura effusi yang berdarah menunjukkan keganasan dan banyak faktor yang bisa mempengaruhi hasil aspirasi yaitu trauma (Villena V., et al, 2004). F.Biopsi kelenjar limfe yang membesar Peranan biopsi kelenjar limfe yang membesar adalah bisa membedakan antara metastase keganasan, penyakit infeksi, reaksi hiperplasia, dan limfoma. Dengan biopsi diagnosis penyakit penderita dengan pembesaran kelenjar limfe bisa cepat diketahui mudah dikerjakan, tidak menyakitkan, murah, tidak memerlukan rawat inap atau anestesi, dan tidak menimbulkan scar. Nilai diagnostik biopsi kelenjar limfe yang membesar dalam mendiagnosa metastase kelenjar limfe, metastase tumor primer yang tidak diketahui atau monitoring penanganan pasien dengan kanker telah diterima secara luas. Dalam mendiagnosa metastase suatu keganasan biopsi kelenjar limfe mempunyai sensitivitas dan spesifisitas >98%, sehingga hal ini menghindarkan dilakukannya eksisional biopsi pada kebanyakan pasien. Tetapi akurasi diagnostik tergantung dari pengalaman dalam mengidentifikasi sel ganas dan ketepatan mengaspirasi kelenjar limfe (Buley I.D., 1998). G.CT-scan, MRI, PET, Foto thoraks, Rektosigmoidoskopi, dan Barium enema. Peran tehnik radiologi lainnya seperti computed tomography (CT), magnenitic resonance imaging (MRI), positron emission tomografi (PET), dalam mendeteksi awal diagnosis kanker ovarium tidak bisa dipungkiri lagi. Pemeriksaan radiologi ini dapat membantu mengidentifikasi atau memonitoring massa karsinoma ovarium dengan metastase atau asites. Dalam suatu studi, dinyatakan bahwa MRI lebih superior dibandingkan dengan CT-scan dan USG dalam mendiagnosa suatu massa ovarium, tetapi kemampuan dalam membedakan jinak atau ganas tumor ovarium 25 tidak terdapat perbedaan. Beberapa studi menunjukkan pemeriksaan 3D power doppler lebih akurat. Kurangnya bukti, pemeriksaan yang mahal dan kemampuan yang terbatas, prosedur ini bukan merupakan hal rutin dilakukan. Pemeriksaan foto thoraks dikerjakan untuk menemukan penyebaran ke paru-paru, penyebaran bisa menyebabkan adanya tumor di paru-paru dan biasanya menimbulkan effusi pleura yang bisa terlihat melalui foto thoraks. Pemeriksaan rektosigmoideskopi dan barium enema dilakukan untuk menemukan penyebaran kanker ovarium ke kolon atau rektum. Tetapi pemeriksaan ini sudah jarang dilakukan, biasanya lebih sering digunakan untuk menemukan kanker kolorektal (Moore R.G., et.al, 2007). H.Risk of Malignancy Index (RMI) Apabila pemeriksaan dilakukan sendiri-sendiri tidak satupun modalitas diagnostik preoperatif tersebut diatas akurat. Diperlukan beberapa kombinasi pemeriksaan untuk bisa mendiagnosa keganasan ovarium. Jacobs et al mengkombinasikan ultrasonografi, CA-125, dan status menopause untuk membuat indeks resiko keganasan (Risk of Malignancy Index/RMI) agar bisa memprediksi keganasan tumor ovarium preoperatif, didapatkan sesnsitifitas sebesar 85% dan spesifisitas 97%. Salah satu keuntungan RMI adalah sangat simpel, sehingga penggunaannya mudah diaplikasikan dalam klinis sehari-hari. Adapun criteria yang dinilai ditampilkan dalam table 2.6 berikut ini. 26 Tabel 2.6. Risk of Malignancy Index Kriteria Sistem Skor Skor Gambaran USG Multilokular Tidak tampak gambaran=0 Bagian padat 1 gambaran = 1 Bilateral >1 gambaran = 3 U (0,1,3) Ascites Metastasis Status Menopause Premenopause 1 Postmenopause 3 Serum Ca 125 Nilai Absolut (U/ml) Risk of Malignancy M (1 atau 3) Nilai CA125 U x M x CA125 Risk of malignancy Index (RMI) adalah integrasi dari pemeriksaan kadar serum CA125, status menopause penderita, dan temuan ultrasonografi. Algoritme RMI diperkenalkan pertama kali oleh Jacobs tahun 1990. RMI dihitung dengan formula (RMI = U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). Temuan ultrasonografi diklasifikasikan berdasar atas ada atau tidaknya lesi kistik multilokular, bagian padat, lesi bilateral, ascites dan metastasis intraabdominal. Bila tidak terdapat gambaran USG di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Menopause status diberikan nilai 1 untuk premenopause dan nilai 3 bila postmenopause. Postmenopause ditetapkan apabila wanita riwayat amenore lebih dari satu tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Kadar 27 CA125 dinyatakan sesuai dengan nilai absolut yang didapatkan dalam satuan U/ml (Ian J., et.al, 2005). Dengan cut off value 200, digunakan untuk membedakan antara tumor ovarium yang jinak dan ganas, dengan sensitivitas 87% dan spesifisitas 97%. Penderita dengan skor RMI >200 mempunyai kemungkinan 42 kali mengarah kanker ovarium dan skor RMI <200 0,15 kali. Diagnosis histopatologik dipergunakan sebagai gold standard untuk menentukan hasil dan jenis tumor jinak atau ganas (Clarke S.E., et.al, 2009). Seperti telah dijelaskan di atas bahwa penggunaan salah satu pemeriksaan saja tidak akan memberikan hasil yang sensitif dan spesifik tinggi, tetapi dengan penggunaan RMI memberikan hasil sensitivitas dan positive predictive value (PPV) yang lebih tinggi dibandingkan dengan hanya pemeriksaan CA125 atau USG saja. Selain itu keuntungan-keuntungan yang didapatkan dengan menggunakan RMI : 1.Sistem referal pasien lebih awal RMI direkomendasikan penggunaannya untuk menyeleksi pasien yang memerlukan tindakan pembedahan di rumah sakit pusat kanker oleh dokter onkologis ginekologis. RMI merupakan cara efektif untuk menyeleksi pasien yang beresiko rendah, sedang atau tinggi untuk mengalami keganasan atau mungkin masih bisa ditangani oleh dokter ginekologis umum. Hasil validasi RMI oleh Prys Davies et al, yang menggunakan RMI sebagai protocol untuk menyeleksi pasien yang beresiko kanker didapatkan bahwa semakin rendah nilai RMI atau <25 resiko kanker hanya 3%, RMI 25 – 250 resiko kanker 20, dan RMI>250 resiko kanker 75%. Seperti tampak pada tabel 2.7 (Saleh A., Shorbagy M.S.) 28 Tabel 2.7. Korelasi hasil RMI dengan resiko kanker Risk Low Moderate RMI Women Risk of cancer (%) <25 40 <3 25 – 250 30 20 >250 30 75 High 2.Tindakan operasi lebih tepat dan mengurangi re-operasi RMI direkomendasikan untuk menyeleksi tindakan pembedahan yang akan dilakukan. Pasien dengan resiko tinggi untuk kanker , didapatkan dari penghitungan RMI memerlukan laparotomi dan full staging prosedur saat pembedahan primer (Toress J.C., et.al, 2002). I.Modifikasi Indeks Risiko Keganasan Modifikasi Indeks Risiko Keganasan dibuat berdasarkan RMI yang telah dimodifikasi. Adapun modifikasi yang dilakukan adalah modifikasi nilai temuan pemeriksaan USG. Temuan USG yang dinilai pada RMI adalah ada tidaknya gambaran multilokular, bagian padat, bilateral, ascites, dan metastasis intraabdominal. Sedangkan dalam penilaian Modifikasi Indeks Risiko Keganasan, temuan USG yang dinilai adalah ada tidaknya gambaran multilokular, bagian padat, papil, ascites, dan septa. Ada tidaknya gambaran bilateral dan metastasis intraabdominal tidak dinilai untuk mempermudah melakukan pemeriksaan. Modifikasi Indeks Risiko Keganasan dihitung sama dengan formula RMI yaitu U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). 29 Tabel 2.8. Modifikasi Indeks Risiko Keganasan Kriteria Sistem Skor Skor Gambaran USG Multilokular Tidak tampak gambaran=0 Bagian padat 1 gambaran = 1 Ascites >1 gambaran = 3 U (0,1,3) Papil Septa Status Menopause Premenopause 1 Postmenopause 3 Serum Ca 125 Nilai Absolut (U/ml) Risk of Malignancy M (1 atau 3) Nilai CA125 U x M x CA125 Temuan ultrasonografi diklasifikasikan berdasar atas ada atau tidaknya lesi kistik multilokular, bagian padat, papil, septa dan ascites. Bila tidak terdapat gambaran USG di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Menopause status diberikan nilai 1 untuk premenopause dan nilai 3 bila postmenopause. Postmenopause ditetapkan apabila wanita riwayat amenore lebih dari satu tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Kadar CA125 dinyatakan sesuai dengan nilai absolut yang didapatkan dalam satuan U/ml. Diharapkan dengan tingkat pemeriksaan yang lebih mudah, Modifikasi Indeks Risiko Keganasan ini mempunyai akurasi yang sama dengan RMI untuk memprediksi keganasan tumor ovarium preoperatif. 30 BAB III KERANGKA KONSEP DAN HIPOTESIS PENELITIAN 3.1. Kerangka Konsep Begitu banyak modalitas diagnostik preoperatif bisa digunakan, masalahnya adalah memilih prosedur yang mempunyai nilai diagnostik yang tinggi, efektif,tidak invasif, dan applicable/mudah dikerjakan. Tidak ada metode diagnostik preoperatif yang sangat adekuat yang bisa membedakan tumor ovarium jinak atau ganas. Tetapi dengan kombinasi pemeriksaan kadar serum CA-125, temuan USG dan status menopause penderita, diharapkan dapat memberikan hasil diagnostik yang lebih baik. Tumor Ovarium USG: Status - Multilocular TumorMarker Menopause (CA 125) - Area Solid - Ascites - Papil - Sept Pre Menopause Post Menopause Modifikasi Indeks Risiko Keganasan Curiga Ganas Curiga Jinak PA GANAS Gambar 3.1. Kerangka Konsep Penelitian JINAK 31 3.2. Hipotesis Penelitian Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium mempunyai akurasi yang sama atau bahkan lebih baik dari RMI. 32 BAB IV METODOLOGI PENELITIAN 4.1. Rancangan Penelitian Rancangan penelitian ini adalah studi prospektif uji diagnostik dengan gold standard adalah pemeriksaan Histopatologis. JINAK Curiga Jinak Histopatologis GANAS Tumor Ovarium Nilai Modifikasi Indeks Risiko Keganasan JINAK Curiga Ganas Histopatologis GANAS Gambar 4.1. Rancangan Penelitian 4.2. Tempat dan Waktu Penelitian 4.2.1.Tempat Penelitian Penelitian dilaksanakan di Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar. 4.2.2. Waktu Penelitian Penelitian akan dilaksanakan sejak bulan Februari 2010 sampai jumlah sampel terpenuhi. 4.3. Populasi dan Sampel Penelitian 4.3.1. Populasi Penelitian 33 Populasi penelitian adalah semua penderita dengan diagnosis tumor ovarium yang datang Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar. 4.3.2. Sampel Penelitian Sampel penelitian adalah semua penderita tumor ovarium yang datang ke Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar yang memenuhi kriteria inklusi dan kriteria eklusi. Kriteria Inklusi : 1. Penderita dengan diagnosis tumor ovarium ukuran ≥ 8 cm atau tumor ovarium dengan bagian padat. 2. Bersedia ikut penelitian setelah mendapatkan informed consent. Kriteria Eklusi: 1. Penderita tumor ovarium disertai dengan kehamilan dan keganasan ditempat lain. 2. Penderita dengan tumor ovarium yang sudah mendapatkan terapi pembedahan dan sudah dinyatakan karsinoma ovarium dari hasil histopatologi. 3. Tidak bersedia ikut penelitian 4.4. Cara Pemilihan Sampel Sampel ditentukan dengan cara consecutive sampling dari semua penderita dengan diagnosis tumor ovarium yang memenuhi kriteria inklusi yang datang ke Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar mulai Februari 2010. 34 4.5. Penghitungan besar sampel Besar sampel atau jumlah subyek minimal ditentukan berdasarkan asumsi : Bila diperkirakan sensitivitas uji diagnostik adalah 90% (P = 0,90), penyimpangan (d) untuk sensitivitas sebesar ± 10%, dan interval kepercayaan = 95% (α = 0,05 ; Zα = 1,96), maka dengan rumus (Sastroasmoro S., 2002): 2 Zα PQ n= 2 d 2 2 = (1,96 x 0,90 x 0,10) / 0,1 = 34,5 dibulatkan 35 Besar sampel yang diperlukan adalah 35 sampel. 4.6. Variabel Penelitian 1. Variabel bebas : Nilai Modifikasi Indeks Risiko Keganasan 2. Variabel tergantung : Hasil pemeriksaan gold standard histopatologis 4.7. Definisi Operasional Variabel a. Modifikasi Indeks Risiko Keganasan adalah suatu indeks yang merupakan integrasi dari pemeriksaan kadar serum CA-125, status menopause penderita, dan temuan ultrasonografi untuk memprediksi keganasan tumor ovarium preoperatif, yang merupakan modifikasi dari Risk of Malignancy Index (RMI) yang diperkenalkan pertama kali oleh Jacob et al. b. Kadar serum CA-125 adalah kadar petanda tumor CA-125 dalam darah yang dilakukan dengan cara mengambil 5 ml darah vena dan dikirim ke 35 laboratorium Prodia untuk dilakukan pemeriksaan dengan menggunakan Reagen Abbott/ Axsym metode MEIA Prodia. c. Temuan ultrasonografi berdasarkan atas ada atau tidaknya lesi kistik multilokular, bagian padat, papil, septa dan ascites. Bila tidak ditemukan gambaran di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Kistik multilokular : suatu struktur yang bervariasi dalam ukuran di ovarium karena terisi oleh cairan, tampak sebagai gambaran hipoechoic pada pemeriksaan ultrasonografi dan berlokul-lokul ; Bagian padat : tampak gambaran hiperoechoic diantara lesi kistik di ovarium; Ascites : tampak gambaran cairan bebas (hipoechoic) di cavum abdomen dan atau di cavum douglas papil : tonjolan hiperechoic pada dinding bagian dalam; Septa : ketebalan septa dengan ukuran ≥ 3mm. d. Status menopause dibedakan menjadi postmenopause dan premenopause. Postmenopause adalah wanita yang sudah amenore lebih dari 1 tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Postmenopause diberi nilai 3, premenopause diberi nilai1. 4.8. Alat pengumpul data Alat-alat pengumpul data meliputi : 1. Lembar status pasien 2. Spuite disposible 5 cc 36 3. Reagen untuk pemeriksaan CA-125 4. Alat USG 5. Lembar pengumpul data 4.9. AlurPenelitian Penderita Tumor Ovarium (memenuhi kriteria inklusi) Nilai Modifikasi Indeks Risiko Keganasan Curiga Ganas Curiga Jinak Histopatologis JINAK Histopatologis GANAS JINAK ANALISIS PELAPORAN Gambar 4.2. Bagan Alur Penelitian GANAS 37 5.0.Teknik Analisa Data Analisa data berupa skala nominal dimana sampel disebut Jinak apabila hasil pemeriksaan gold standard histopatologis tumor ovarium dinyatakan tidak terdapat sel-sel ganas. Sampel dinyatakan ganas apabila hasil pemeriksaan gold standard histopatologis tumor ovarium dinyatakan terdapat sel-sel ganas. Sensitivitas, spesifisitas, nilai duga positif, nilai duga negatif, akurasi dan rasio kemungkinan CA 125, USG, dan Modifikasi Indeks Risiko Keganasan dihitung dengan cut off value yang berbeda-beda. Data yang telah terbagi ditampilkan dalam tabulasi silang tabel 2x2. Untuk menentukan kemampuan diagnostik dari CA 125, USG, dan Modifikasi Indeks Risiko Keganasan digunakan kurve Receiver operating characteristic (ROC). Pada grafik ROC sensitivitas digambarkan pada ordinat Y sedangkan (1-spesifisitas) digambarkan pada absis X atau diolah dengan program komputer. Tabulasi silang uji CA 125, USG, dan Modifikasi Indeks Risiko Keganasan dengan pemeriksaan gold standard histopatologis, tampak pada tabel 4.1, 4.2, 4.3 berikut ini. Tabel 4.1. Tabulasi silang uji CA 25 dengan gold standard histopatologis Pasien No Uji CA 125 1 Ganas Ganas A 2 Jinak Jinak d 3 Jinak Ganas c 4 Ganas Jinak b 5 Ganas Ganas a 6 Jinak Jinak d 7 Jinak Jinak d 8 Ganas Jinak b Dst Histopatologis Tempatkan dalam tabel 2x2 pada sel 38 GOLD STANDARD (Histopatologis) UJI CA 125 Ganas Jinak Jumlah Ganas A B a+b Jinak C D c+d a+c b+d a+b+c+d Dari tabel dihitung : Sensitivitas = a : (a+c) Spesifisitas = d : (b+d) Nilai duga positif = a : (a+b) Nilai duga negatif = d : (c+d) Rasio Kemungkinan positif = sensitivitas : (1-spesifisitas) Rasio Kemungkinan negatif = (1-sensitivitas) : spesifisitas Tabel 4.2. Tabulasi silang uji USG dengan gold standard histopatologis Pasien Uji USG Histopatologis No Tempatkan dalam tabel 2x2 pada sel 1 Ganas Ganas a 2 Jinak Jinak d 3 Jinak Ganas c 4 Ganas Jinak b 5 Ganas Ganas a 6 Jinak Jinak d 7 Jinak Jinak d 8 Ganas Jinak b Dst 39 GOLD STANDARD (Histopatologis) UJI USG Ganas Jinak Jumlah Ganas A B a+b Jinak C D c+d a+c b+d a+b+c+d Dari tabel dihitung : Sensitivitas = a : (a+c) Spesifisitas = d : (b+d) Nilai duga positif = a : (a+b) Nilai duga negatif = d : (c+d) Rasio Kemungkinan positif = sensitivitas : (1-spesifisitas) Rasio Kemungkinan negatif = (1-sensitivitas) : spesifisitas Tabel 4.3. Tabulasi silang uji Modifikasi Indeks Risiko Keganasan dengan gold standard histopatologis Pasien Uji Modifikasi Indeks No Risiko Keganasan 1 Ganas Ganas A 2 Jinak Jinak d 3 Jinak Ganas c 4 Ganas Jinak b 5 Ganas Ganas a 6 Jinak Jinak d 7 Jinak Jinak d 8 Ganas Jinak b Dst Histopatologis Tempatkan dalam tabel 2x2 pada sel 40 GOLD STANDARD (Histopatologis) UJI ModifikasiIndeks Risiko Keganasan Ganas Jinak Jumlah Ganas A b a+b Jinak C d c+d a+c b+d a+b+c+d Dari tabel dihitung : Sensitivitas = a : (a+c) Spesifisitas = d : (b+d) Nilai duga positif = a : (a+b) Nilai duga negatif = d : (c+d) Rasio Kemungkinan positif = sensitivitas : (1-spesifisitas) Rasio Kemungkinan negatif = (1-sensitivitas) : spesifisitas 41 BAB V HASIL PENELITIAN Penelitian ini suatu penelitian Cross Sectional dengan consecutive sampling di Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar. Sampel yang digunakan adalah 35 sampel yang ditentukan dengan cara consecutive dari semua penderita dengan diagnosis tumor ovarium yang memenuhi kriteria inklusi yang datang ke Poliklinik Kebidanan dan Penyakit Kandungan RSUP Sanglah Denpasar mulai Februari 2010 – yang terkumpul sampai bulan November 2010. Karakteristik subyek pada 35 orang pasien penderita tumor ovarium disajikan dalam tabel 5.1 berikut ini. Tabel 5.1. Karakteristik subyek berdasarkan Histopatologis Histopatologi Karakteristik Ganas P Jinak 2 18 Umur ≥50 th + - 8 7 Paritas 0 + - 9 6 3 17 Post Menopause + 11 4 1 19 13 2 2 18 0,001 12 3 6 14 0,003 Ca 125 >41,3 + - USG Ganas + - Sumber : Data Primer 0,008 0,006 0,001 42 Dari data tabel 5.1 di atas, didapatkan bahwa kejadian keganasan ovarium pada penelitian ini sebanyak 15 dari 35 sampel atau sebesar 42,9%. Dari semua yang ganas, didapatkan jenis epitelial sebesar 93,3% dan 6,7% jenis non epitelial. Sedangkan dari 35 sampel didapatkan 20 dengan tumor ovarium jinak atau sebesar 57,1%. Kejadian keganasan pada umur lebih dari 50 tahun didapatkan 53,3%, sedangkan pada umur kurang dari 50 tahun didapatkan 47,3%, perbedaan kejadian keganasan berdasarkan umur perbedaannya bermakna. Berdasarkan paritas, kejadian keganasan pada paritas 0 didapatkan sebesar 60% sedangkan pada paritas 1 atau multiparitas sebesar 40%, perbedaan persentase keganasan antara paritas 0 dengan paritas 1 atau multiparitas mempunyai perbedaan yang bermakna. Berdasarkan status menopause, kejadian keganasan pada post menopause sebesar 73,3% dan pada premenopause sebesar 26,7%, bila dibedakan kejadian keganasan berdasarkan status menopause ini, didapatkan perbedaan bermakna kejadian keganasan pada post menopause dengan pre menopause dengan kejadian keganasan lebih tinggi terjadi pada post menopause dibandingkan dengan pre menopause. Dengan menggunakan Cut-Off Values yang didapatkan dari penghitungan Receiver Operator Curve (ROC), didapatkan bahwa batas (Cut-Off) kadar Ca 125 sebagai petanda tumor ganas atau jinak adalah 41,3 (U/mL). Bila >41,3 (U/mL) dinyatakan ganas, bila <41,3 (U/mL) dinyatakan jinak. Berdasarkan hasil analisis pada tabel 5.1 di atas, didapatkan bahwa kejadian keganasan pada nilai Ca 125 >41,3 sebesar 86,7%, sedangkan pada nilai Ca 125 < 41,3 sebesar 13,3%. Perbedaan persentase ini bermakna. Bila dihitung nilai Sensitivitas = 86,67%; Spesifisitas = 43 90%; Nilai duga positif = 86,67%); Nilai duga negatif = 90%; Rasio Kemungkinan positif = 8,67; Rasio Kemungkinan negatif = 0,15. Gambaran ganas atau jinak suatu tumor ovarium dari pemeriksaan USG dalam penelitian ini, dinilai dari tampak atau tidaknya gambaran Multilokular, Bagian padat, Ascites, Papil, dan Tebal septa. Bila tidak tampak salah satu atau hanya tampak satu gambaran saja dinyatakan dengan jinak, sedangkan apabila tampak lebih dari satu gambaran dinyatakan ganas. Berdasarkan hasil analisis pada tabel 5.1 di atas, didapatkan bahwa kejadian keganasan dengan gambaran USG ganas didapatkan sebesar 80%, sedangkan pada gambaran USG jinak dari hasil histopatologis dinyatakan ganas sebesar 20%. Perbedaan persentase ini bermakna. Bila dihitung nilai Sensitivitas = 80%; Spesifisitas = 70%; Nilai duga positif = 66,67%; Nilai duga negatif = 82,35%; Rasio Kemungkinan positif = 2,67; Rasio Kemungkinan negatif = 0,29. Dari hasil analisa faktor, didapatkan bahwa adanya gambaran USG yang menunjukkan gambaran bagian padat, ascites, dan multilocular kemungkinan ganas sebesar 52%. Uji Diagnostik Modifikasi Indeks Risiko Keganasan dan Histopatologi Tabel 5.2. Uji Diagnostik Modifikasi Indeks Risiko Keganasan dan Histopatologi Kelompok Modifikasi RMI Ganas Jinak Histopatologi Ganas Jinak 14 P 1 0,001 1 19 44 Dengan menggunakan Cut-Off Values yang didapatkan dari penghitungan ROC Curve, didapatkan bahwa batas (Cut-Off) nilai Modifikasi Indeks Risiko Keganasan sebagai petanda tumor ganas atau jinak adalah 119. Bila >119 dinyatakan ganas, bila <119 dinyatakan jinak. Berdasarkan hasil analisis tabel 5.2 di atas, didapatkan bahwa Sensitivitas = 93,33%; Spesifisitas = 95%; Nilai duga positif = 93,33%); Nilai duga negatif = 95%; Rasio Kemungkinan positif = 18,67; Rasio Kemungkinan negatif = 0,07. 45 BAB VI PEMBAHASAN Dalam penelitian ini didapatkan bahwa dari 35 sampel, 15 sampel menunjukkan tumor ganas ovarium yaitu sebesar 42,9%, dan 20 menunjukkan tumor jinak ovarium yaitu sebesar 57,1%. Dari semua yang ditemukan ganas, 93,3% jenis epitelial dan 6,7% jenis non epitelial. Tumor ganas ovarium merupakan tumor dengan histiogenesis yang beraneka ragam, dapat berasal dari ketiga dermoblast (ektodermal, endodermal, dan mesodermal) dengan sifat-sifat histiologis maupun biologis yang beraneka ragam (Mardjikoen P., 2005). Kanker ovarium terbanyak adalah jenis epithel, 90% kanker ovarium berasal dari epithelial, 75% kanker ovarium yang berasal dari epithelial mempunyai tipe histologis serous, 20% mucinous, 2% endometrioid, sedangkan clear cell, brenner, dan undifferentiated karsinoma kurang dari 1%. Dibandingkan dengan kanker ovarium epithelial, kanker ovarium non epithelial berkisar antara 10% dari seluruh kanker ovarium (Berek J.S., 2002). Kejadian kanker ovarium meningkat pada usia setelah 45 tahun. Kanker ovarium jarang ditemukan pada usia di bawah 40 tahun. Angka kejadian meningkat dengan makin tuanya usia; dari 15-16 per 100.000 pada usia 40-44 tahun, menjadi paling tinggi dengan angka 57 per 100.000 pada usia 70-74 tahun. Usia median saat diagnosis adalah 63 tahun dan 48% penderita berusia di atas 65 tahun (Busmar B., 2006). Borderline tumor lebih banyak muncul pada perempuan premenopause berkisar pada umur 30 – 50 tahun. Pada invasive karsinoma muncul pada wanita umur 50 – 70 tahun. Sedangkan pada usia anak atau remaja yang terbanyak adalah 46 jenis germinal. Dysgerminoma jenis tumor ganas sel germinal yang paling sering ditemukan 75% muncul antara 10 – 30 tahun, 5% muncul < 10 tahun, dan jarang sekali ditemukan pada umur setelah 50 tahun (Berek J.S., 2002). Dari data tabel 5.1 di atas, didapatkan bahwa kejadian keganasan ovarium pada penelitian ini terdapat paling banyak pada paritas 0 (nullipara) yaitu sebanyak 60% dari semua keganasan. Sedangkan pada paritas 1 atau lebih didapatkan 40%. Risiko terhadap tumor ovarium jinak, boderline dan tumor ovarium ganas tidak dipengaruhi oleh paritas. Peningkatan paritas tidak menurunkan risiko menderita ketiga tumor ovarium tersebut (Andrijono, 2009). Riwayat reproduksi terdahulu serta durasi dan jarak reproduksi memiliki dampak terbesar pada penyakit ini, paritas yang rendah dan infertilitas, menarche dini dan menopause yang terlambat meningkatkan risiko untuk berkembang menjadi kanker ovarium. Peningkatan insiden kanker ovarium pada wanita lajang, biarawati, dan wanita nulipara menunjukkan ovulasi yang teratur yang tidak diselingi dengan kehamilan, meningkatkan predisposisi wanita dapat mengidap keganasan. Kehamilan yang multipel dapat meningkatakan efek protektif untuk berkembang menjadi suatu kanker ovarium. Apabila dibandingkan dengan wanita nulipara, satu sampai dua kehamilan menghasilkan risiko relatif (RR) 0,49-0,97. Wanita dengan jumlah kehamilan lebih dari tiga memiliki penurunan risiko sebanyak 0,35-0,76 apabila dibandingkan dengan populasi kontrol (Rasjidi I., 2009). Penelitian menunjukkan bahwa wanita dengan paritas yang tinggi memiliki risiko terjadinya kanker ovarium yang lebih rendah daripada nulipara, yaitu dengan risiko relatif 0,7. Pada wanita yang mengalami 4 atau lebih kehamilan aterm, risiko terjadinya kanker ovarium berkurang sebesar 40% jika dibandingkan dengan wanita nulipara (Busmar B., 2006). Kanker 47 ovarium berhubungan dengan paritas yang rendah dan infertility sesuai dengan teori insecant ovulasi (Berek J.S., 2002). Dari data tabel 5.1 di atas, didapatkan bahwa kejadian keganasan ovarium pada penelitian ini terdapat paling banyak pada post menopause yaitu sebanyak 73,3% dari semua keganasan. Sedangkan pada pre menopause didapatkan 26,7%. Lebih dari 80% kanker ovarium epitel ditemukan pada wanita pascamenopause. Usia 62 tahun adalah usia dimana kanker ovarium epitelial paling sering ditemui. Kanker ovarium epitelial ini jarang ditemukan pada usia kurang dari 45 tahun. Pada usia kurang dari 21 tahun kanker ovarium epitelial ini sangat jarang ditemukan,sedangkan kanker ovarium jenis sel germinal lebih sering ditemukan, yaitu pada lebih dari dua pertiga kasus. Pada wanita pramenopause hanya 7% tumor epitelial yang ganas (Busmar B.,2006). Beberapa modalitas pemeriksaan penunjang digunakan untuk mendiagnosa suatu keganasan tumor ovarium, bisa dilakukan dengan pemeriksaan USG (dikerjakan pada setiap kasus tumor ovarium), pemeriksaan tumor marker, sitologi aspirasi kista ovarium, sitologi cairan ascites dan pleura, biopsi kelenjar limfe yang membesar, CT-Scan, MRI, PET, Foto toraks, Rektosigmoideskopi, dan Barium enema. Pada penelitian ini, dilakukan uji diagnostik tumor marker dalam hal ini Ca 125, USG, dan Modifikasi Indeks Risiko Keganasan (kombinasi pemeriksaan Ca 125, USG, dan status menopause pasien) untuk mendiagnosa keganasan tumor ovarium preoperatif dengan membandingkan hasil pemeriksaan Ca 125, USG dan Modifikasi Indeks Risiko Keganasan dengan gold standard yaitu pemeriksaan histopatologis. 48 Dengan menggunakan Cut-Off Values yang didapatkan dari penghitungan Receiver Operator Curve (ROC), didapatkan bahwa batas (Cut-Off) kadar Ca 125 sebagai petanda tumor ganas atau jinak pada penelitian ini adalah 41,3 (U/mL). Bila >41,3 (U/mL) dinyatakan ganas, bila <41,3 (U/mL) dinyatakan jinak. Berdasarkan hasil analisis pada tabel 5.1 di atas, didapatkan bahwa Sensitivitas = 86,67%; Spesifisitas = 90%; Nilai duga positif = 86,67%); Nilai duga negatif = 90%; Rasio Kemungkinan positif = 8,67; Rasio Kemungkinan negatif = 0,15. Beberapa penelitian telah menunjukkan bahwa kadar Ca 125 preoperatif dapat membantu membedakan massa pelvik jinak atau ganas. Secara keseluruhan lebih dari 80% wanita dengan kanker ovarium mempunyai kadar Ca 125 meningkat, kira-kira setengah wanita dengan kanker ovarium stadium I dan II mempunyai kadar Ca 125 lebih dari 65U/ml dan dalam persentase yang lebih besar akan didapatkan lebih dari 35 U/ml. Terdapat beberapa penelitian yang menegaskan bahwa wanita postmenopause dengan massa pelvic dan kadar serum Ca 125 antara lebih dari 65 – 95 U/ml yang melakukan pembedahan dimana oncologist dapat melakukan operasi definitif pada awal operasi. Walaupun negative predictive value hanya 72 – 82%, kadar Ca 125 normal tidaklah mengecilkan hati pembedah untuk eksplorasi pada pasien postmenopause. Ca 125 mempunyai sensitivitas diagnostik yang tinggi pada karsinoma epitel ovarium dan dapat dipakai untuk diagnosis, pemantauan terapi, prognosis maupun deteksi dini adanya kekambuhan. Dengan nilai batas 35 U/ml, akan didapatkan sensitivitas dan spesifisitas sebesar 79% dan 89%. Carbohydrate Antigen 125 (Ca 125) merupakan senyawa glikoprotein (mucinlike) dengan berat molekul yang cukup tinggi (200.000 dalton). Ditemukan oleh Bast 49 dkk pada tahun 1983. Ca 125 diproduksi oleh sel epitel “coelomic” (rongga badan embrio) pada masa perkembangan embrio. Ca 125 adalah determinan antigenik untuk kanker ovarium, kanker terdapat pada sel adenokarsinoma ovarium dalam jumlah besar dan tidak ditemukan pada ovarium normal. Peningkatan kadar Ca 125 dalam serum terdapat pada karsinoma ovarium primer, karsinoma pancreas, pada beberapa penyakit bukan keganasan, seperti penyakit hati kronis, pancreatitis, peritonitis, kadar Ca 125 dapat juga meningkat, tetapi umumnya dibawah 100 U/ml. Pemeriksaan Ca 125 kurang diandalkan pada penderita premenopause dimana kadar Ca 125 dapat meningkat karena kehamilan, endometriosis, adenomiosis, fibroid, penyakit radang pelvic dan secara individual tetapi jarang pada menstruasi (Rasjidi I., 2009). Adanya keterbatasan nilai serum Ca 125 untuk membantu membedakan massa pelvik jinak atau ganas preoperatif, dan untuk meningkatkan nilai diagnostik preoperatif risiko keganasan pada wanita dengan massa di ovarium Ca 125 dikombinasikan dengan pemeriksaan ultrasonografi, status menopause, dan serum tumor marker lainnya (Mongkol B., Neungton C., 2007). Penggunaan ultrasonografi dikerjakan pada setiap kasus tumor ovarium. Dibandingkan dengan pemeriksaan pelvis secara manual, ultrasonografi memiliki keunggulan terutama untuk mengevaluasi kondisi ovarium. Ovarium bisa tervisualisasi lebih dari 95% pada wanita premenopause dan lebih dari 85% pada wanita post menopause (Uma S.,et.al, 2006). Dahulu, penggunaan transabdominal ultrasound (TAS) sering digunakan dan ketika dievaluasi secara prospektif pada 5540 wanita didapatkan angka false positif sebesar 5,4%. Dari angka ini, 25,7% tidak didapatkan kelainan pada ovarium saat operasi. Spesifisitas bervariasi antara 42 – 50 95% dan sensitivitas antara 60 – 93%, hal ini membuktikan bahwa sulit untuk membedakan antara tumor jinak dan ganas ovarium dengan menggunakan TAS. Penggunan transvaginal sonografi (TVS) memiliki tiga keunggulan dibandingkan dengan transabdominal sonografi dalam hal tidak membutuhkan kandung kencing yang penuh, pada pasien yang gemuk pemeriksaan akan lebih mudah, dan tranduser probe dapat ditempatkan sedekat mungkin dengan organ pelvik, sehingga dapat dipergunakan frekuensi yang lebih tinggi dengan demikian kualitas gambar yang dihasilkan lebih jernih dan tajam. Sistem skoring morfologi telah dikembangkan untuk menambah akurasi TVS. Kriteria evaluasi meliputi ukuran atau volume, penampakan formasi papilari pada dinding kista, dan kompleksitas dari kista (Busmar B., 2006). Dengan menggunakan TVS saja, beberapa penelitian telah dilakukan untuk mendiagnosa keganasan pada massa adneksa. Dalam beberapa hasil penelitian ini didapatkan variasi spesifisitas berkisar antara 65 – 98% dan sensitifitas berkisar 48 – 100%. Walaupun gambaran morfologi untuk mengukur indek morfologi bisa rutin dilakukan dan dijadikan standar pemeriksaan ultrasonografi, banyak variabel yang tidak dicatat atau terukur, sehingga hal ini menyebabkan terbatasnya penggunaan index morfologi dalam praktek sehari-hari. Karena alasan ini, index morfologi tidak selalu bisa digunakan untuk menghitung kemungkinan keganasan (Uma S.,et.al, 2006). Gambaran ganas atau jinak suatu tumor ovarium dari pemeriksaan USG dalam penelitian ini, dinilai dari tampak atau tidaknya gambaran Multilokular, Bagian padat, Ascites, Papil, dan Tebal septa. Kista ovarium ganas dapat memiliki dinding tumor atau septa dengan tebal lebih dari 3 mm, mempunyai pertumbuhan menyerupai 51 papil di dinding dalam, multilocular, dan memiliki struktur yang kompleks dengan bagian kistik dan padat. Dengan gambaran tersebut kemungkinan ganas lebih dari 60%. Kista ovarium unilokuler dengan diameter < 10 cm ditemukan pada 18% wanita pascamenopause asimtomatik berusia > 50 tahun dan diasosiasikan dengan resiko yang sangat rendah akan keganasan (Rasjidi I., et.al, 2009). Pada tumor dengan bagian-bagian padat (echogenik) persentase keganasan makin meningkat. Sebaliknya, pada tumor kistik tanpa ekointernal (anechogenic) kemungkinan keganasan menurun (Busmar B.,2006). Kista ovarium kompleks dengan abnormalitas dinding atau area solid dikaitkan dengan risiko keganasan yang signifikan (Rasjidi I., et.al, 2009). Asites merupakan suatu keadaan terdapatnya kelebihan cairan di dalam rongga peritoneal. Ini adalah temuan klinis akumulasi cairan patologis dalam rongga perut dengan berbagai penyebab, tetapi berkembang lebih sering sebagai bagian dari kompensasi penyakit liver kronis asimptomatik sebelumnya. Selain itu, asites juga berhubungan dengan keganasan yang sudah parah dan menandakan prognosis yang kurang baik. Cairan asites dapat pula dijumpai pada tumor ovarium yang normal walaupun kejadiannya relatif kecil (9%), dan kejadian asites pada tumor ovarium borderline kurang lebih sebesar 58%. Kanker ovarium dengan asites ternyata sebanyak 69% berada pada stadium III-IV, hanya 31% stadium I-II. Keberadaan asites merupakan indikator kuat untuk mendiagnosis tumor ovarium ganas karena nilai duga positif dapat mencapai 95%. Dengan demikian, adanya massa di pelvis dan asites menunjukkan besar kemungkinan massa tersebut adalah tumor ganas ovarium. Berdasarkan perubahan anatomik gross pada saat pembedahan, proyeksi papilar mempunyai korelasi paling tinggi dengan diagnosis keganasan ovarium. dimana kista 52 sederhana dan penebalan septa memiliki asosiasi paling rendah dengan diagnosis keganasan ovarium. Kista sederhana dan penebalan septa memiliki asosiasi paling rendah dengan diagnosis keganasan ovarium (Rasjidi I., et.al, 2009). Penilaian hasil USG pada penelitian ini, dinilai dengan tampak atau tidaknya gambaran Multilokular, Bagian padat, Ascites, Papil, dan Tebal septa. Bila tidak tampak salah satu atau hanya tampak satu gambaran saja dinyatakan dengan jinak, sedangkan apabila tampak lebih dari satu gambaran dinyatakan ganas. Berdasarkan hasil analisis dengan menggunakan tabel 5.1 di atas, didapatkan bahwa Sensitivitas = 80%; Spesifisitas = 70%; Nilai duga positif = 66,67%; Nilai duga negatif = 82,35%; Rasio Kemungkinan positif = 2,67; Rasio Kemungkinan negatif = 0,29. Seperti telah dijelaskan di atas, bahwa spesifisitas dan sensitivitas transabdominal ultrasound (TAS) untuk membedakan antara tumor jinak dan ganas ovarium preoperatif bervariasi antara 42 – 95% dan 60 – 93%. Transvaginal color doppler imaging (CDI), dapat meningkatkan sensitifitas dan nilai prediksi positif ultrasogografi untuk mengevaluasi massa pada daerah pelvis. Telah diketahui bahwa pertumbuhan pembuluh darah adalah memegang peranan penting untuk menunjang pertumbuhan tumor, terutama pada tumor ganas dimana pertumbuhan dan perkembangan jaringannya sangat cepat dan tidak terkendali. Dinding pembuluh darah pada tumor tersebut memiliki otot polos yang lebih sedikit bila dibandingkan dengan pembuluh darah normal, sehingga tahanannya (resitance index/RI) lebih kecil terutama pada arteriola. Penurunan tahanan ini dapat diketahui dengan memakai CDI. Kurjak dkk, dalam penelitiannya melakukan pemeriksaan dengan mempergunakan CDI pada 14.317 wanita tanpa keluhan atau dengan keluhan minimal. Ditemukan 624 53 tumor jinak adneksa dengan RI normal, dan 56 penderita keganasan ovarium dimana sebanyak 54 penderita menunjukkan RI yang rendah. Sensitifitas CDI dalam penelitian ini adalah 96,4% dengan spesifisitas 99,8% (Uma S., et.al, 2006). Aplikasi gambaran aliran pembuluh darah sangat membantu dalam mendeteksi keganasan ovarium karena adanya neovaskularisasi menandakan keganasan. Ketika ultrasonografi gray-scale mendeteksi adanya septum dan papil atau komponen solid pada ovarium, adanya gambaran aliran pembuluh darah seringkali menunjukkan adanya keganasan. Tetapi, deteksi vaskularisasi pada tumor ganas yang terdapat papil terkadang tidak terlihat terutama pada tumor yang masih kecil. Penggunaan color doppler ultrasonografi menunjukkan sensitivitas dan spesifisitas yang tinggi dalam mendeteksi keganasan ovarium bila level Resistensi Indeks (RI) < 0,4 dan PI < 1. Ada beberapa studi menunjukkan kemungkinan tumpang tindihnya nilai PI dan RI antara tumor yang jinak dengan tumor yang ganas. Parameter dan cut-off level untuk pulsatility dan resistensi indeks yang mana bisa memprediksi keganasan sangat sulit untuk ditentukan. Selain itu pula, biaya pemeriksaan yang mahal dan memerlukan pengalaman pemeriksa yang tinggi mengakibatkan keterbatasan penggunaan alat ini. Hal ini menunjukkan bahwa penggunaan color doppler saja tidak cukup sebagai indikator keganasan ovarium (University General Hospital “Attikon”, Athens, Greece. 2004). Apabila pemeriksaan dilakukan sendiri-sendiri tidak satupun modalitas diagnostik preoperatif tersebut diatas akurat. Diperlukan beberapa kombinasi pemeriksaan untuk bisa mendiagnosa keganasan ovarium. Jacobs et mengkombinasikan ultrasonografi, CA-125, dan status menopause untuk membuat al 54 indeks resiko keganasan (Risk of Malignancy Index/RMI). Risk of malignancy Index (RMI) adalah integrasi dari pemeriksaan kadar serum CA125, status menopause penderita, dan temuan ultrasonografi. Algoritme RMI diperkenalkan pertama kali oleh Jacobs tahun 1990. RMI dihitung dengan formula (RMI = U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). Temuan ultrasonografi diklasifikasikan berdasar atas ada atau tidaknya lesi kistik multilokular, bagian padat, lesi bilateral, ascites dan metastasis intraabdominal. Bila tidak terdapat gambaran USG di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Menopause status diberikan nilai 1 untuk premenopause dan nilai 3 bila postmenopause. Postmenopause ditetapkan apabila wanita riwayat amenore lebih dari satu tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Kadar CA125 dinyatakan sesuai dengan nilai absolut yang didapatkan dalam satuan U/ml (Ian J., et.al, 2005). Dengan cut off value 200, digunakan untuk membedakan antara tumor ovarium yang jinak dan ganas, dengan sensitivitas 87% dan spesifisitas 97%. Penderita dengan skor RMI >200 mempunyai kemungkinan 42 kali mengarah kanker ovarium dan skor RMI <200 0,15 kali. Modifikasi Indeks Risiko Keganasan dibuat berdasarkan RMI yang telah dimodifikasi. Adapun modifikasi yang dilakukan adalah modifikasi nilai temuan pemeriksaan USG. Temuan USG yang dinilai pada RMI adalah ada tidaknya gambaran multilokular, bagian padat, bilateral, ascites, dan metastasis intraabdominal. Sedangkan dalam penilaian Modifikasi Indeks Risiko Keganasan, 55 temuan USG yang dinilai adalah ada tidaknya gambaran multilokular, bagian padat, papil, ascites, dan septa. Ada tidaknya gambaran bilateral dan metastasis intraabdominal tidak dinilai untuk mempermudah melakukan pemeriksaan. Modifikasi Indeks Risiko Keganasan dihitung sama dengan formula RMI yaitu U (ultrasonografi skor) x M (menopause status) x serum CA125 (U/ml). Temuan ultrasonografi diklasifikasikan berdasar atas ada atau tidaknya lesi kistik multilokular, bagian padat, papil, septa dan ascites. Bila tidak terdapat gambaran USG di atas maka diberi nilai 0, bila hanya tampak satu gambaran saja diberi nilai 1, apabila tampak lebih dari satu diberi nilai 3. Menopause status diberikan nilai 1 untuk premenopause dan nilai 3 bila postmenopause. Postmenopause ditetapkan apabila wanita riwayat amenore lebih dari satu tahun atau wanita umur lebih dari limapuluh tahun bila sudah dilakukan operasi histerektomi. Premenopause adalah wanita selain yang disebutkan sebagai postmenopause. Kadar CA125 dinyatakan sesuai dengan nilai absolut yang didapatkan dalam satuan U/ml. Dengan menggunakan Cut-Off Values yang didapatkan dari penghitungan ROC Curve, didapatkan bahwa batas (CutOff) nilai Modifikasi Indeks Risiko Keganasan sebagai petanda tumor ganas atau jinak adalah 119. Bila >119 dinyatakan ganas, bila <119 dinyatakan jinak. Berdasarkan hasil analisis pada tabel 5.2 di atas, didapatkan bahwa Sensitivitas = 93,33%; Spesifisitas = 95%; Nilai duga positif = 93,33%); Nilai duga negatif = 95%; Rasio Kemungkinan positif = 18,67; Rasio Kemungkinan negatif = 0,07. Seperti telah dijelaskan di atas bahwa penggunaan salah satu pemeriksaan saja tidak akan memberikan hasil yang sensitif dan spesifik tinggi, tetapi dengan penggunaan RMI memberikan hasil sensitivitas dan positive predictive value (PPV) yang lebih tinggi 56 dibandingkan dengan hanya pemeriksaan CA125 atau USG saja. Hasil validasi RMI oleh Prys Davies et al, yang menggunakan RMI sebagai protocol untuk menyeleksi pasien yang beresiko kanker didapatkan bahwa semakin rendah nilai RMI atau <25 resiko kanker hanya 3%, RMI 25 – 250 resiko kanker 20, dan RMI>250 resiko kanker 75%. Sedangkan pada penelitian ini, dengan nilai cut-off value 119 didapatkan nilai Modifikasi Indeks Risiko Keganasan <75 tidak mempunyai resiko kanker, 75 – 119 resiko kanker 6,7%, dan >119 resiko kanker 93,3%. 57 BAB VII SIMPULAN DAN SARAN 7.1. Simpulan Dari hasil penelitian ini, disimpulkan bahwa : 1. Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium mempunyai nilai Sensitivitas sebesar 93,33% dan Spesifisitas sebesar 95%. Bila dibandingkan dengan RMI, nilai sensitivitas Modifikasi Indeks Risiko Keganasan lebih tinggi, sedangkan nilai spesifisitas hampir sama. 2. Modifikasi Indeks Risiko Keganasan mempunyai akurasi lebih tinggi dibandingkan pemeriksaan USG dan tumor marker saja. 3. Semakin rendah nilai Modifikasi Indeks Risiko Keganasan, semakin kecil kemungkinan risiko keganasan. Semakin tinggi nilai Modifikasi Indeks Risiko Keganasan, semakin besar kemungkinan risiko keganasan. 4. Dengan penggunaan Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif, akan mengurangi kemungkinan relaparotomi. 58 7.2. Saran 1. Menggunakan Modifikasi Indeks Risiko Keganasan sebagai modalitas diagnostik preoperatif untuk memprediksi keganasan tumor ovarium pada pasien dengan diagnosa tumor ovarium. 2. Apabila dari hasil pemeriksaan Modifikasi Indeks Risiko Keganasan didapatkan kecurigaan keganasan terutama pada penderita Pre Menopause, disarankan merujuk ke RS dengan fasilitas Frozen Section untuk menghindari re-laparotomi. DAFTAR PUSTAKA Andrijono, 2009. Kanker Ovarium. Sinopsis Kanker Ginekologi. Fakultas Kedokteran Universitas Indonesia RS. Dr. Cipto Mangunkusumo. Pustaka Spirit. Jakarta.p. 167 – 168. Berek J.S., editors. 2002. Ovarian Cancer. Novak’s Gynecology. 13 Lippincott Williams & Wilkins. p.1245-1262. th ed. Buley I.D., 1998. Fine needle aspiration of lymph nodes. Clin Pathol. 51: 881 – 885. Busmar B. 2006. Kanker Ovarium. Buku Acuan Nasional Onkologi Ginekologi. Yayasan Bina Pustaka Sarwono Prawirohardjo. Jakarta. p.468-494. Chrisdiono A. 1996. Tumor-tumor Ovarium Borderline. Dokter Spesialis dan Ginekologi RSUP Tegalyoso, Klaten, Jawa Tengah. Cermin Dunia Kedokteran No.112. p. 21. Clarke S.E., Grimshaw R., Rittenberg P., Kieser K., Bentley J. 2009. Risk of Malignancy Index in the Evaluation of Patients with Adnexal Masses. JOGC. Geomini, Peggy, Kruitwagen, Roy, Bremer, Gerard L, et al. 2009. The Accuracy of Risk Scores in Predicting Ovarian Malignancy : A Systematic Review. AOG,Vol.113, Issue 2 Part I.p.1. Ian J and Usha M. 2004. Progress and Challenges in Screening for early Detection of Ovarian Cancer. Molecular & Cellular Proteomics. p. 355 – 366. Ian J., Oram D., Fairbanks J., Turner J., Frost C., Grudzinskas J.G. 2005. A risk of Malignancy Index incorporating CA 125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer, BJOG: An International Journal of Obstetrics and Gynaecology,Vol.97,Issue 10.p.922-929. Jensen A., Sharif H., Frederiksen K., Kruger SK,. 2009. Use of fertility drugs and risk of ovarian cancer : Danish population based cohort study. BMJ;338:b249 Mardjikoen P., 2005. Tumor Ganas Ovarium. Ilmu Kandungan. Yayasan Bina Pustaka Sarwono Prawirohardjo. Jakarta.p.400-408. Mettler L, Patvekar M, Soyinka A.S., Meinhold I, Schollmeyer T, Schmutzler A. 2008. Value of Malignancy Exclusion of Ovarian Cysts Prior to Laparoscopy. J. Reproduktionsmed. Endokrinol; 5(2).p. 93 – 100. Moore R.G., Robert C. Bast JR. 2007. How Do You Distinguish a Malignant Pelvic Mass From a Benign Pelvic Mass? Imaging, Biomarkers, or None of the Above. Editorial. Journal of Clinical Oncology, Vol 25, No 27 (September 20).p. 4259 – 4161. Mongkol B., Neungton C. 2007. Pre-operative Prediction of Serum CA 125 Level in Women with Ovarian Masses. J Med Asocc Thai;90(10): 1986-91. National Guideline Clearinghouse. 2009. Approriateness Criteria ovarian cancer screening .p. 7. Available at : www.guideline.gov. Padilla LA., Radosevich, Milad M.P. 2000. Accuracy of the pelvic examination in detecting adnexal masses. Internal J Gynaecol Obstet; 96(4): 593-8. Padilla LA, Radosevich, Milad M.P. 2005. Limitations of the pelvic examination for evaluation of the female pelvic organs. Internal J Gynaecol Obstet; 88(1): 84-8. Rasjidi I., Kusumo L., Yudasmara., 2009. Deteksi Dini Pencegahan Kanker Pada Wanita. CV Sagung Seto. Jakarta. p. 193 – 195. Salehpour S., H. Zhaam, Panah T. 2002. Laparoscopic Aspiration of Ovarian Cysts. Med J Iran Hosp, Vol 4 No 2. Saleh A., Shorbagy M.S. Preoperative Diagnosis of Ovarian Cancer in Patients Presented with Adnexal Mass using the Risk of Malignancy Index.OBGYN.net Advertisement. Sastroasmoro S., 2002. Dasar-Dasar Metodologi Penelitian Klinis. Sagung Seto. Jakarta.p.270. Toress J.C., Mauricette S.F., Derchain, Faunders A., Gontijo R.C., Martinez E.Z., Andrade L.A. 2002. Risk of Malignancy Index in preoperative evaluation of clinically restricted ovarian cancer. San Paulo Medical Journal;12(3):72-6. Uma S., Neera K., Nisha, Ekta. 2006. Evaluation of new scoring system to differentiate between benign and malignant adnexal mass. The Journal of Obstetrics and Gynaecology of India, Vol.56,No2. University General Hospital “Attikon”, Athens, Greece. 2004. Benefits and limitations of ultrasonographic evaluation of uterine adnexal lesions in early detection of ovarian cancer. Clin Exp Obstet Gynecol; 31(2) : 85 – 98. Viktoriya S., Emmanuel C. 2006. A new method for modeling preoperative diagnosis of ovarian tumors. Villena V,. Encuentra A.L., Lujan R.G, Sustaeta J.E., and Alvarez C.J. 2004. Clinical Implications of Appearance of Pleural Fluid at Thoracocentesis. American College of Chest Physicians. Lampiran Data Umur * Histopatologi Crosstab Histopatologi Ganas Umur > = 50 tahun 8 2 Total 10 4.3 5.7 10.0 53.3% 10.0% 28.6% 7 18 25 10.7 14.3 25.0 46.7% 15 90.0% 20 71.4% 35 15.0 20.0 35.0 100.0% 100.0% 100.0% Count Expected Count % within Histopatologi < 50 tahun Count Expected Count % within Histopatologi Count Total Expected Count % within Histopatologi Jinak Chi-Square Tests Value a 7.887 Pearson Chi-Square b Continuity Correction Likelihood Ratio Fisher's Exact Test Linear-by-Linear Association 5.906 8.148 7.661 df Asymp. Sig. (2- Exact Sig. (2- Exact Sig. (1sided) sided) sided) 1 .005 1 .015 1 .004 .008 .007 1 .006 b N of Valid Cases 35 a. 1 cells (25.0%) have expected count less than 5. The minimum expected count is 4.29. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Odds Ratio for Umur (> = 50 tahun / < 50 tahun) For cohort Histopatologi = Ganas For cohort Histopatologi = Jinak N of Valid Cases Lower Upper 10.286 1.737 60.902 2.857 1.418 5.758 .278 .079 .983 35 Paritas * Histopatologi Crosstab Histopatologi Ganas Paritas 0 9 3 Total 12 5.1 6.9 12.0 60.0% 15.0% 34.3% 6 17 23 9.9 13.1 23.0 % within Histopatologi Count Expected Count 40.0% 15 15.0 85.0% 20 20.0 65.7% 35 35.0 % within Histopatologi 100.0% 100.0% 100.0% Count Expected Count % within Histopatologi >=1 Count Expected Count Total Jinak Chi-Square Tests Value a 7.704 Asymp. Sig. (2- Exact Sig. (2- Exact Sig. (1df sided) sided) sided) 1 .006 1 .016 1 .005 .011 .008 Pearson Chi-Square b Continuity Correction 5.836 Likelihood Ratio 7.905 Fisher's Exact Test Linear-by-Linear 7.484 1 .006 Association b N of Valid Cases 35 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 5.14. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Odds Ratio for Paritas (0 / > = 1) For cohort Histopatologi = Ganas For cohort Histopatologi = Jinak N of Valid Cases Lower Upper 8.500 1.709 42.279 2.875 1.342 6.157 .338 .123 .928 35 Menopause * Histopatologi Crosstab Histopatologi Menopause Ya Ganas 11 1 Total 12 5.1 6.9 12.0 73.3% 5.0% 34.3% 4 19 23 9.9 13.1 23.0 % within Histopatologi Count Expected Count 26.7% 15 15.0 95.0% 20 20.0 65.7% 35 35.0 % within Histopatologi 100.0% 100.0% 100.0% Count Expected Count % within Histopatologi Tidak Count Expected Count Total Jinak Chi-Square Tests Value a 17.764 Pearson Chi-Square b Continuity Correction Likelihood Ratio Fisher's Exact Test Linear-by-Linear Association 14.861 19.666 17.257 Asymp. Sig. (2- Exact Sig. (2- Exact Sig. (1df sided) sided) sided) 1 .000 1 .000 1 .000 .000 .000 1 .000 b N of Valid Cases 35 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 5.14. b. Computed only for a 2x2 table Risk Estimate 95% Confidence Interval Value Odds Ratio for Menopause (Ya / Tidak) For cohort Histopatologi = Ganas For cohort Histopatologi = Jinak N of Valid Cases Lower Upper 52.250 5.167 528.342 5.271 2.128 13.054 .101 .015 .665 35 Ca_125 * Histopatologi Crosstab Histopatologi Ca_125 Positif Ganas 13 2 Total 15 6.4 8.6 15.0 86.7% 10.0% 42.9% 2 18 20 8.6 11.4 20.0 % within Histopatologi Count Expected Count 13.3% 15 15.0 90.0% 20 20.0 57.1% 35 35.0 % within Histopatologi 100.0% 100.0% 100.0% Count Expected Count % within Histopatologi Negatif Count Expected Count Total Jinak Chi-Square Tests Value a 20.572 Pearson Chi-Square b Continuity Correction Likelihood Ratio Fisher's Exact Test Linear-by-Linear Association b McNemar Test 17.561 23.020 Asymp. Sig. (2df sided) 1 .000 1 .000 1 .000 Exact Sig. (2- Exact Sig. (1sided) sided) .000 19.984 1 .000 1.000 c N of Valid Cases 35 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 6.43. b. Computed only for a 2x2 table c. Binomial distribution used. Risk Estimate 95% Confidence Interval Value Odds Ratio for Ca_125 (Positif / Negatif) For cohort Histopatologi = Positif For cohort Histopatologi = Negatif N of Valid Cases Lower Upper 58.500 7.266 470.964 8.667 2.293 32.759 .148 .040 .543 35 .000 USG * Histopatologi Crosstab Histopatologi USG Positif Ganas 12 6 Total 18 7.7 10.3 18.0 80.0% 30.0% 51.4% 3 14 17 7.3 9.7 17.0 % within Histopatologi Count Expected Count 20.0% 15 15.0 70.0% 20 20.0 48.6% 35 35.0 % within Histopatologi 100.0% 100.0% 100.0% Count Expected Count % within Histopatologi Negatif Count Expected Count Total Jinak Chi-Square Tests Value a 8.578 Pearson Chi-Square b Continuity Correction Likelihood Ratio Fisher's Exact Test Linear-by-Linear Association b McNemar Test 6.694 9.045 Asymp. Sig. (2- Exact Sig. (2sided) sided) df 1 1 1 Exact Sig. (1sided) .003 .010 .003 .006 8.333 1 .004 .508 c N of Valid Cases 35 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 7.29. b. Computed only for a 2x2 table c. Binomial distribution used. Risk Estimate 95% Confidence Interval Value Odds Ratio for USG (Positif/Negatif) For cohort Histopatologi = Positif For cohort Histopatologi = Negatif N of Valid Cases Lower Upper 9.333 1.911 45.583 3.778 1.286 11.098 .405 .203 .806 35 .004 Modifikasi Indeks Risiko Keganasan * Histopatologi Crosstab Histologi Modifikasi RMI Ganas Ganas 14 1 Total 15 40.0% 2.9% 42.9% 1 19 20 % of Total Count 2.9% 15 54.3% 20 57.1% 35 % of Total 42.9% 57.1% 100.0% Count % of Total Jinak Total Count Jinak Chi-Square Tests Value a 27.310 23.822 32.515 Pearson Chi-Square b Continuity Correction Likelihood Ratio Fisher's Exact Test Linear-by-Linear Association b McNemar Test df Asymp. Sig. (2sided) 1 .000 1 .000 1 .000 Exact Sig. (2sided) .000 26.529 1 .000 1.000 N of Valid Cases 35 a. 0 cells (.0%) have expected count less than 5. The minimum expected count is 6.43. b. Computed only for a 2x2 table c. Binomial distribution used. Risk Estimate 95% Confidence Interval Value Odds Ratio for Kat_periksa (Ganas / Jinak) For cohort Histologi = Ganas For cohort Histologi = Jinak N of Valid Cases Exact Sig. (1sided) Lower Upper 266.000 15.287 4628.455 18.667 2.750 126.705 .070 .011 .467 35 c .000 ROC Curve Case Processing Summary Histologi Positive b a Valid N (listwise) 20 15 Negative Smaller values of the test result variable(s) indicate stronger evidence for a positive actual state. a. The test result variable(s): Ca_125 has at least one tie between the positive actual state group and the negative actual state group. b. The positive actual state is Jinak. Area Under the Curve Test Result Variable(s):Ca_125 Asymptotic 95% Confidence Interval Area Std. Error a Asymptotic Sig. b Lower Bound .897 .068 .000 a. Under the nonparametric assumption b. Null hypothesis: true area = 0.5 Coordinates of the Curve Test Result Variable(s):Ca_125 Positive if Less Than or Equal a To 3.0400 4.1200 5.7500 7.7500 8.5000 8.9150 9.3650 9.7500 9.9100 10.2450 11.4850 13.0000 13.7150 14.1650 15.5500 20.3500 26.0700 29.6200 35.8500 41.3000 49.5000 59.0000 61.4850 66.1350 76.8500 86.0000 89.6500 91.7500 Sensitivity 1 – Specificity .000 .000 .000 .067 .050 .067 .100 .067 .150 .067 .200 .067 .250 .067 .300 .067 .350 .067 .400 .067 .450 .067 .500 .067 .550 .067 .600 .067 .650 .067 .700 .067 .750 .067 .800 .067 .850 .067 .900 .067 .900 .133 .900 .200 .900 .267 .900 .333 .900 .400 .950 .400 .950 .467 1.000 .467 .763 Upper Bound 1.030 102.7500 125.4500 164.1000 208.1850 251.3650 289.6000 424.4200 1.000 1.000 1.000 1.000 1.000 1.000 1.000 .533 .600 .667 .733 .800 .867 .933 547.0000 1.000 1.000 a. The smallest cutoff value is the minimum observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered observed test values. ROC Curve Case Processing Summary Histologi Positive a Valid N (listwise) 20 15 Negative Smaller values of the test result variable(s) indicate stronger evidence for a positive actual state. a. The positive actual state is 2. Area Under the Curve Test Result Variable(s):Pemeriksaan Asymptotic 95% Confidence Interval Area Std. Error a Asymptotic Sig. b Lower Bound .970 .028 .000 a. Under the nonparametric assumption b. Null hypothesis: true area = 0.5 Coordinates of the Curve Test Result Variable(s):Pemeriksaan Positive if Less Than or Equal a To -1.0000 5.2350 11.9850 17.7000 24.5000 27.6200 28.6200 32.7500 54.2000 75.6000 81.3000 85.8000 89.1900 90.4400 101.6000 112.6000 119.0350 125.6850 148.5000 177.0000 184.4550 198.4050 218.6350 320.4850 480.3000 558.0000 683.7000 Sensitivity 1 – Specificity .000 .000 .300 .000 .350 .000 .400 .000 .450 .000 .500 .000 .550 .000 .600 .000 .600 .067 .650 .067 .700 .067 .750 .067 .800 .067 .850 .067 .900 .067 .950 .067 .950 .133 1.000 .133 1.000 .200 1.000 .267 1.000 .333 1.000 .400 1.000 .467 1.000 .533 1.000 .600 1.000 .667 1.000 .733 .915 Upper Bound 1.025 813.2400 832.1400 871.8600 1.000 1.000 1.000 .800 .867 .933 909.5200 1.000 1.000 a. The smallest cutoff value is the minimum observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered observed test values