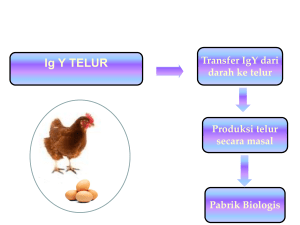
karakteristik imunoglobulin y antitetanus diisolasi
advertisement

KARAKTERISTIK IMUNOGLOBULIN Y ANTITETANUS DIISOLASI DARI TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS SERUM KUDA I NYOMAN SUARTHA SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2006 IPB 2006 I NYOMAN SUARTHA B161030021 PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa disertasi Karakteristik Imunoglo bulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antite tanus Serum Kuda adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutif dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini. Bogor, September 2006 I Nyoman Suartha NRP. B161030021 ABSTRAK I NYOMAN SUARTHA. Karakteristik Imunoglobulin Y Antitetanus Diisolasi dari Telur Ayam sebagai Pengganti Antitetanus Serum Kuda. Dibawah bimbingan I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, dan BIBIANA W. LAY. Produksi antibodi poliklonal pada ayam lebih menguntungkan dibandingkan dengan produksi pada mamalia. Pemeliharaan ayam lebih sederhana dan murah, ekstraksi dan purifikasi imunoglobulin Y (IgY) dari telur lebih sederhana, cepat dan biayanya murah. Penggunaan ayam juga dapat mengurangi pemakaian hewan mamalia dan menjadikan kondisi hewan coba lebih baik. Selain itu IgY di dalam telur memberikan prospek yang sangat berarti, untuk mengatasi masalah produksi antitetanus serum pada kuda. Telur dikoleksi dari ayam betina jenis Isa Brown yang telah diimunisasi dengan toksoid tetanus dosis bertingkat. Toksoid tetanus dicampur dengan Freund adjuvant complete dan Freund adjuvant incomplete . Ekstraksi IgY antitetanus dari kuning telur dilakukan dengan metode PEG–Kloroform selanjutnya dipurifikasi dengan fast protein liquid chromatography. Identifikasi IgY antitetanus ditentukan secara fotometris dengan metode Bradford (λ = 595 nM), uji Agar Gel Presipitation. Berat molekul IgY antitetanus dideteksi dengan Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. IgY antitetanus diber ikan perlakuan pH, panas , dan enzim. Aktivitas biologis IgY antitetanus setelah perlakuan diamati dengan metode enzyme linked imunosorbent assay. Uji Potensi IgY anti tetanus ditentukan dengan metode Spearman-Karber. Titer IgY antitetanus mencapai punca k pada telur minggu ke tujuh dari awal imunisasi. Rataan titer tertinggi pada telur 80.16 ± 33.55 IU/ml dan terendah 1.69 ± 0.63 IU/ml. Konsentrasi protein (IgY) setelah ekstraksi diperoleh sebesar 0.652 ± 0.041 mg/ml. Sedangkan setelah purifikasi konsentrasi protein sebesar 1.644 ± 0.424 mg/ml. Aktivitas biologis IgY anti tetanus menurun sangat nyata (p<0.01) pada pH 2 dan pH 3, suhu 72.5 oC, dan hilang pada perlakuan suhu 90 o C. Larutan sukrosa konsentrasi 25% mampu mempertahankan aktivitas IgY antitetanus sampai 50 % pada suhu 75 oC selama 5 menit, sedangkan larutan glukosa konsentrasi 50% mampu meningkatkan aktivitas IgY antitetanus pada suhu 75 o C dan suhu 80 o C selama 5 menit. Aktivitas IgY antitetanus menurun setelah perlakuan enzim pepsin, tripsin dan protease. Berdasarkan perhitungan Spearman-Karber diperoleh nilai potensi IgY antitetanus sebesar 35 IU/ml. Pemberian IgY antitetanus 0.2 dan 0.4 IU/ekor mampu melindungi mencit dari dosis letal toksin tetanus . Pada pemberian dosis IgY lebih tinggi (0.8 IU/ekor dan 1 IU/ekor) mampu melindungi mencit dari peningkatan dua kali dosis letal toksin. Pemberian IgY antitetanus secara oral pada hewan dewasa tidak efektif untuk tujuan imunoterapi pasif dalam usaha pencegahan penyakit secara sistemik . Kesimpulan dari penelitian ini yaitu ayam mampu memproduksi IgY antitetanus pada kuning telur dan dapat digunakan sebagai sumber antitetanus serum untuk menggantikan produksi antitetanus serum di kuda. Key words : imunoglobulin Y, Ayam, antitetanus serum, kuda ABSTRACT I NYOMAN SUARTHA. The Characteristic of Antitetanus Immunoglobulin Y Isolated from Eggs to substitute Horse Antitetanus Serum. Under advisory of I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, and BIBIANA W. LAY. Laying hens are highly profitable producers of polyclonal antibodies in comparison with mammals as antibodies can be purified from egg yolks. The cost for producing IgY is lower than for mammalian antibodies since chicken housing is cheap and isolation process is economical, high yielding, uncomplicated and fast. The purpose of the study was to explore the opportunity of using antitetanus IgY from egg yolks to substitute the production of antitetanus serum from horses. The eggs were collected from adult Isa brown hens which have been immunized by tetanus toxoid. The immunization was applied intra venously with an initial dose of 15 Lf. The immunization was repeated three times with gradual dose of 100, 200, and 300 Lf with an interval of one week intra muscularly. The first immunization was tetanus toxoid mixed with Freund adjuvant complete and subsequently mixed with Freund adjuvant incomplete. Antitetanus IgY was extracted from egg yolks by means of PEG–Chloroform and purified using fast protein liquid chromatography. The purity of antitetanus IgY was determined by Bradford method (λ = 595 nm) and Agar Gel Precipitation test. The molecular weight of purified antitetanus IgY was determined with Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. The antitetanus IgY were treated by pH, heat, and enzyme. The biological activities of treated antitetanus IgY was determined by enzyme linked immunosorbent assay. Neutralization potency test of antitetanus IgY was determined by Spearman-Karber method. The antitetanus IgY highest titer of egg yolks was 80.16 ± 33.55 IU/ml reached at seven weeks after starting immunization schedule and the lowest was 1.69 ± 0.63 IU/ml. Protein concentration (IgY) after extraction and purification were 0.652 ± 0.041 mg/ml and 1.644 ± 0.424 mg/ml respectively . Biological activity of antitetanus IgY decreased significantly (p<0.01) at of pH 2, pH 3, and at 72.5 o C, and lost its activity at 90 o C after 20 minutes. Addition of 25% sucrose solution was able to maintain antitetanus IgY activity until 50 % at 75 o C for 5 minutes, while addition of 50% glucose solution increase antitetanus IgY activity at 75 oC and 80 o C for 5 minutes. The effect of pepsin, trypsin, and protease enzyme s decreased the activities of antitetanus IgY. Spearman-Karber value of potency of antitetanus IgY was 35 IU/ml. The injection of 0.2 and 0.4 IU antitetanus IgY per mice respectively, protect all mice from the letal dose tetanus toxin. The doses of 0.8 IU and 1 IU anti tetanus IgY per mice protected twice dose of letal tetanus toxin. Antitetanus IgY given orally on adult animal was ineffective as passive immunotherapy. This research concluded that the hens were capable of produc ing antitetanus in egg yolks and can be used as a resource of antitetanus serum to substitute horse antitetanus serum. Key Words : imunoglobulin Y, Chicken’s egg, antitetanus serum, horse. Hak cipta milik I nstitut Pertanian Bogor , tahun 2006 Hak cipta dilindungi Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apa pun, baik cetak, fotokopi, mikrofilm, dan sebagainya KARAKTERISTIK IMUNOGLOBULIN Y ANTITETANUS DIISOLASI DARI TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS SERUM KUDA I NYOMAN SUARTHA Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Sains Veteiner SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2006 Judul Disertasi : KARAKTERISTIK IMUNOGLOBULIN Y ANTITETANUS DIISOLASI DARI TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS SERUM KUDA Nama Mahasiswa Nomor pokok Program Studi : I NYOMAN SUARTHA : B161030021 : SAINS VETERINER Disetujui Komisi Pembimbing Dr. drh. I Wayan Teguh Wibawan, MS. Ketua Dr. Retno Damayanti Soejoedono, MS. Anggota Prof. Dr. Bibiana W. Lay, M.Sc. Anggota Diketahui Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana drh. Bambang P. Priosoeryanto, MS, PhD. Dr.Ir.Khairil Anwar Notodiputro,MS. Tanggal Ujian : 30 Agustus 2006 Tanggal Lulus : PRAKATA Puji syukur penulis panjatkan kehadapan Ida Sang Hyang Widi Wasa, Tuhan Yang Maha Esa atas segala rahmatNya, sehingga penulisan disertasi ini dapat diselesaikan. Karya ilmiah ini berjudul : Karakteristik Imunoglobulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antitetanus Serum Kuda . Ucapan terimakasih dan penghargaan penulis sampaikan kepada Yang terhormat: Dr. drh. I Wayan Teguh Wibawan MS selaku ketua komisi pembimbing, Dr. Retno Damayanti Soejoedono, MS, dan Prof. Dr. Bibiana W. Lay, MSc. Sebagai anggota komisi pembimbing yang telah memberikan semangat, bimbingan, saran, petunjuk dan tuntunan yang tulus selama mengikuti pendidikan, persiapan dan perencanaan penelitian, pencarian dana penelitian sampai pada penyusunan disertasi ini. Terima kasih penulis sampaikan kepada DIRJEN DIKTI atas beasiswa BPPS yang telah diberikan, Direktur P3M DIKTI atas sebagian dana penelitian yang diberikan melalui proyek Hibah bersaing XII/tahun ke-1 dan ke-2, Dr. drh Risa Tiuria, MS atas masukannya saat ujian tertutup. Prof. Dr. Fachriyan H. Pasaribu, dan Dr. drh. A.E.T.H. Wahyuni, MSi atas masukannya saat sidang terbuka untuk memperluas kasanah tulisan ini. Ibu drh Lia Siti Halimah, MSi dan staf di laboratorium uji hewan PT Bio Farma Bandung atas segala bantuan yang telah diberikan, Dr Ita Djuwitha, MPhil dan staf di laboratorium Embriologi FKH IPB atas bantuannya. Ucapan terima kasih juga penulis sampaikan kepada drh Okti Nadia putri, drh Putu Ika Mayangsari, drh Candramaya Siska Damayanti, Dra Elisabeth Maria, MSi, saudara Imam Bayu serta tema n–teman Punhawacana Bali atas bantuannya. Kepada ayahanda I Wayan Budiasa, BA, Ibunda Ni Ketut Sangi, AMAPd, Ayah mertua I Nyoman Padet dan Ibunda Ni Wayan Rambu (Alm) , Kakak, Adik serta seluruh keluarga, penulis mengucapkan terima kasih dan penghargaan atas segala doa, bimbingan dan dorongan semangat yang telah diberikan selama ini. Terima kasih, penghargaan dan hormat yang tulus penulis sampaikan kepada istri tercinta drh Ni Made Sri Widiyani, yang penuh rasa kasih dan pengertian, sabar, selalu mendoakan, memberikan dorongan, semangat, dan banyak berkorban selama penulis mengikuti pendidikan sampai selesainya disertasi ini. Terima kasih pula untuk anak-anak tercinta dan tersayang Ni Luh Vigyan Witharni, Ni Made Praba Viswandari, dan I Nyoman Gede Prajnam Magha Vadantha yang senantiasa memberikan semangat dan dorongan dalam kehidupan penulis. Penulis dengan rendah hati mohon maaf atas segala kekurangan dalam disertasi ini dan semoga karya ini bermanfaat. Bogor, September 2006 I Nyoman Suartha RIWAYAT HIDUP Penulis dilahirkan di Badung Bali pada tanggal 1 Maret 1968, sebagai anak kedua dari empat saudara dari pasangan ayah I Wayan Budiasa BA, dan Ibu Ni Ketut Sangi, AMAPd. Pendidikan sarjana dan profesi dokter hewan di tempuh di Fakultas Kedokteran Hewan Universitas Udayana, lulus tahun 1993. Pada tahun 1997 penulis mendapat kesempatan mengikuti pendidikan program Magister di Program Studi Sains Veteriner Program Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 1999. Kesempatan untuk melanjutkan ke program doktor pada program studi dan pada perguruan tinggi yang sama di peroleh pada tahun 2003. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia melalui Biaya Pendidikan Program Pascasarjana (BPPS). Sejak tahun 1994, penulis mengabdikan diri sebagai staf pengajar pada Fakultas Kedokteran Hewan Universitas Udayana , Denpasar Bali sampai sekarang. PENDAHULUAN Latar Belakang Kejadian penyakit tetanus dilaporkan masih tetap tinggi, setiap tahun dilaporkan terjadi 350 000 sampai 400 000 kasus tetanus di seluruh dunia. Kejadian kasus lebih tinggi di negara berkembang terutama negara yang program imunisasinya tidak teratur dan tingkat kesadaran masyarakat tentang kesehatan rendah (Bruggemann et al. 2003; Kiefer 2004). Pada negara industri dilaporkan kasus tetanus terjadi secara sporadik. Penyakit tetanus dilaporkan bersifat endemis pada 90 negara berkembang (Bruggemann et al. 2003). Strategi pencegahan penyakit tetanus dengan meningkatkan kebersihan dan imunisasi. Imunisasi dapat dilakukan secara aktif dengan toksoid tetanus dan pasif dengan antitetanus serum. Pada daerah yang beresiko tinggi, imunisasi aktif minimal dilakukan sebanyak tiga kali (Vandelaer et al. 2003). Antibodi yang terbentuk akan berikatan dan menginaktivasi toksin sebelum toksin itu menyerang otot dan saraf. Clostridium tetani dapat dibunuh dengan antibiotik penicilin, tetapi antibiotik tidak mampu menetralisasi toksin (Kiefer 2004). Pencegahan dengan antitetanus serum dan pengobatan dengan antibiotik merupakan pendekatan yang masih relevan untuk mengurangi penyakit tetanus (Covarelli dan Marconi 1980; Bleck 1991; Forrat et al. 1998; Bruggemann et al. 2003). Pencegahan tetanus difokuskan pada imunisasi awal. Imunisasi diulang setiap 10 tahun atau pada saat berumur 40 sampai 50 tahun untuk menghindari terinfeksi tetanus saat umur tua (Schatz et al. 1998; Cavuslu et al. 2003). Maral et al. (2001) melaporkan kejadian tetanus menyerang lebih dari satu juta orang di seluruh dunia, dengan 80% kejadian terjadi pada masa neonatal. Imunisasi pada setiap wanita hamil sangat protektif untuk mencegah tetanus neonatal dan imunisasi mampu menekan morbiditas dan mortalitas penyakit tetanus (Maral et al. 2001). Akan tetapi sampai saat ini tetanus masih merupakan masalah utama pada kesehatan masyarakat pada kebanyakan negara berkembang. Pada negara yang standar kesehatannya tinggi dilaporkan case fatality rate tetanus tetap tinggi (7% sampai 58%) terutama pada pasien umur tua (Forrat et al. 1998; Maral et al. 2001). 2 Kekhawatiran akan kejadian tetanus sampai saat ini pada manusia masih mendapat perhatian yang serius, khususnya aplikasi antitetanus ser um (ATS) tetap dilakukan pada saat terjadi perlukaan. Hal yang sama juga terjadi pada kesehatan hewan, terutama pada kawasan kebun binatang atau kawasan wisata dengan obyek binatang. Penggunaan kandang yang sempit, daya dukung kawasan yang terbatas akan mempermudah kejadian luka, seperti halnya pada daerah kawasan wisata monkey forest Ubud Bali yang dihuni oleh monyet ekor panjang, kejadian luka berkisar sampai 10%. Tipe luka yang banyak diderita adalah kulit robek, luka tusuk, dan kulit robek sampai otot rusak. Kondisi luka ini akan mempermudah kejadian tetanus terutama luka yang terjadi di daerah badan yang sulit dibersihkan. Kesembuhan luka yang diderita oleh monyet itu berkisar antara satu minggu sampai 3 minggu (Suartha et al. 2002). Waktu itu merupakan periode masa inkubasi dari kuman tetanus (Lewis 1998). Hal yang sama juga sangat rentan dialami oleh praktisi kesehatan hewan di lapangan, terutama yang bertugas di wilayah terpencil. Seorang praktisi kesehatan hewan dilaporkan tewas akibat tetanus sete lah terinjak sapi, begitu juga halnya di daerah bekas bencana (Soeharsono 2005). Produksi ATS saat ini umumnya dilakukan pada kuda, yakni dengan menyuntikkan toksoid tetanus pada kuda yang terpilih. Masalah sering muncul karena penggunaan serum spesifik sering menyebabkan reaksi silang seperti reaksi anafilaktik atau serum sickness. Hal itu telah mendorong penggunaan imunoglobulin antitetanus dari sumber lain seperti serum manusia, tetapi kesulitan menyedia kan donor (Forrat et al. 1998). Penggunaan telur (Imunoglobulin Y) diharapkan dapat mengurangi resiko itu dan digunakan sebagai sumber antitetanus . Sampai saat ini imunoglobulin Y (IgY) ayam belum dimanfaatkan secara maksimal untuk tujuan terapi atau pencegahan, khususnya untuk pemberian kekebalan secara pasif. Perkembangan industri perunggasan terfokus membuat ayam sebagai sumber nutrisi. Hanya sedikit ahli yang mengetahui ayam merupakan sumber produksi antibodi yang sangat baik. Penerimaan atau dukungan ahli terhambat karena sikap tradisional dan terba tas atau tidak ada informasi secara luas (Schade dan Hlinak 1996). Para peneliti masih 3 menggunakan imunoglobulin dari mamalia seperti kelinci, tikus, quinea pig, dan hewan mamalia besar seperti kuda, kambing, domba, dan sapi (Svendsen et al. 1995). Beberapa peneliti melaporkan keuntungan penggunaan telur sebagai pabrik bahan biologi adalah : kandungan IgY tinggi dalam telur, mudah diproduksi dalam jumlah besar, tidak menimbulkan efek samping karena tidak bereaksi silang dengan faktor rheumatoid dan komponen jaringan mamalia, tidak bereaksi dengan reseptor Fc yang dimiliki oleh mikrob sehingga bereaksi lebih spesifik terhadap antigen yang dikehendaki, memiliki aktivitas dan daya netralisasi lebih tinggi dibandingkan IgG mamalia, biaya produksi secara masal lebih murah dibandingkan menggunakan mamalia, dan dari segi Animal welfare lebih dapat diterima dibandingkan dengan menggunakan mamalia (Davis dan Reeves 2002). Pemanfaatan IgY untuk pengobatan dan pencegahan penyakit masih sedikit dan terbatas pada skala laboratorium. Perkembangan dan penelitian ke arah pemanfaatan telur unggas baru berkembang dalam satu setengah dekade terakhir. Antibodi spesifik di dalam kuning telur dapat ditimbulkan dari berbagai macam patogen. Kermani-Arab e t al. (2001) melaporkan IgY spesifik terhadap penyakit Marek yang diaplikasi secara pasif mampu menahan infeksi virus Marek. Efek yang sama diamati terhadap berbagai penyakit misalnya influenza (Bogoyavlensky et al. 1999), EPEC K11 (Rawendra 2005) , Salmonella enteridis dan typhimurium (Lee et al. 2002; Babu et al. 2003) , Helicobacter pylori (Shin et al. 2002; Shin et al. 2004). IgY juga digunakan untuk deteksi antigen pe rmukaan penderita hepatitis B (Makvandi dan Fiuzi 2002), caries gigi (Hamada et al.1991), pembentukan plaque gigi karena Streptokokus mutans (Hatta et al. 1997), diare pada pedet (Erhard et al. 1997), deteksi kanker (Yang et al. 1997; Fortgens et al. 1997; Sasse et al. 1998; Sriram et al. 1999), Virus horsesickness (Plessis et al. 1999) , Bovine coronavirus (Ikemori et al. 1997) , dan deteksi insulin (Song et al. 1985). Teknologi IgY sangat baik digunakan untuk produksi antibodi dari antigen conserved mamalia (Gassmann et al. 1990; Murata et al. 1996), modifikasi metode diagnosis suatu penyakit seperti modifikasi dalam uji ELISA (Marti et 4 al.1997; Losonczy et al.1999; Coillie et al. 2004; Ester 2004), dan diagnostik yang lain (Katz et al.1985). Pemberian secara oral sebagai food suplemen untuk pencegahan kuman (Shimizu et al. 1988; Yokohama et al. 1998; Carlander et al. 2000; Hedlund dan Hau 2001, Sunwoo et al. 2002). IgY dapat di absor psi dan ditransfer secara efisien sebagai antibodi kolustrum (Yokohama et al. 1993). Adanya IgY dalam telur memberikan prospek untuk pemberian kekebalan pasif pada kasus penya kit (Polson et al. 1980). Prinsip pengebalan adalah pasif, artinya transfer kekebalan terhadap beberapa penyakit dilakukan dengan mengkonsumsi telur yang mengandung zat kebal dan dipreparasi secara khusus. IgY unggas mengenal lebih banyak epitop protein mamalia dibandingkan dengan imunoglobulin kelinci, sehingga cocok untuk percobaan imunologi protein mamalia (Schade et al.1996). IgY unggas dapat diproduksi apabila antigen dalam jumlah sedikit atau memerlukan pengawetan tinggi seperti hormon. Dalam pemerik saan imunologi, IgY memberikan hasil lebih akurat karena dapat mengurangi ikatan dengan antigen non spesifik, yang menyebabkan hasil negatif palsu atau positif palsu (Schade et al. 1996; Warr dan Higgins 1995). Laporan penelitian di atas memberikan inspirasi untuk mempelajari karakteristik dan efikasi atau daya netralisasi IgY spesifik terhadap toksin tetanus. Sampai saat ini keperluan akan antitetanus serum (ATS) untuk pencegahan infeksi tetanus, khususnya pada kasus perlukaan masih sangat dibutuhkan. Pe rumusan masalah Pengebalan pasif terhadap penyakit tetanus di dunia kedokteran telah lama dikenal penggunaan “Anti Tetanus Serum” (ATS). Produksi ATS umumnya dilakukan pada kuda, yakni dengan menyuntikkan toksoid tetanus pada kuda terpilih. Prosedur produksi antibodi tersebut menyebabkan cekaman (stress). Cekaman terjadi saat melakukan imunisasi dan saat pengambilan darah untuk preparasi antibodi. Masalah yang sering muncul saat produksi ATS pada kuda adalah : Penyuntikan toksoid yang berulang dan terus menerus menyebabkan respon pembentukan antibodi spesifik terhadap toksoid kurang baik. Titer antibodinya sering rendah dan tidak konsisten. Penyuntikan toksoid yang terus menerus menyebabkan terjadinya amiloidosis pada kuda -kuda yang digunakan. 5 Hal ini menyebabkan penderitaan kronis pada kuda. Endapan amiloid sering dijumpai pada organ limpa, limfoglandula dan organ limfoid lainnya. Produksi ATS pada kuda sangat mahal. Adanya masalah-masalah di atas maka terpikirkan untuk memproduksi ATS pada telur ayam. Hal ini sangat mungkin dilakukan karena antibodi dalam darah induk ayam dapat ditransfer ke dalam telur dalam jumlah yang cukup banyak. Schade et al. (1996) melaporkan imunisasi pada ayam menghasilkan konsentrasi antibodi spesifik yang sama antara serum da n kuning telur. Konsentrasi IgY pada kuning telur konstan sampai oosit matang (maturasi), dengan kandungan 10 sampai 20 mg/ml (Carlander 2002). Biaya produksi imunoglobulin pada telur unggas sangat murah (Warr dan Higgins 1995; Makvandi dan Fiuzi 2002) Penggunaan ayam untuk produksi antibodi menghilangkan dan mengurangi penggunaan mamalia sebagai hewan laboratorium. Menghilangkan yang di maksud adalah menghilangkan langkah yang menyakitkan saat koleksi darah, yang digantikan dengan ekstraksi antibodi dari kuning telur. Pengurangan yang di maksud adalah mengurangi jumlah hewan yang digunakan, sebab ayam menghasilkan antibodi yang lebih efisien dibandingkan hewan mamalia seperti kelinci maupun mamalia besar lainnya (Karlsson et al. 2004). Berkenaan dengan animal welfare dan efisiensi biaya, penggunaan antibodi dalam telur lebih bisa diterima dibandingkan dengan penggunakan hewan percobaan mamalia (Svendsen et al. 1995). Tujuan Penelitian Tujuan penelitian ini adalah mengetahui sifat karakteristik IgY spesifik terhadap toksin tetanus yang diisolasi dari telur, untuk menggantikan produksi antitetanus serum pada kuda. Manfaat Penelitian Hasil penelitian ini diharapkan dapat dipakai untuk memproduksi IgY yang lebih spesifik terhadap antigen toksoid tetanus, sehingga dapat digunakan untuk imunodiagnostik dan imunoterapi secara masal. IgY antitetanus ini biaya 6 produksinya lebih murah, aman, mudah, dan kualitas yang lebih baik daripada ATS konvensional yang diproduksi dari kuda. Hipotesis Berdasarkan atas latar belakang dan permasalahan yang diajukan di atas, maka disusun suatu hipotesis sebagai berikut : 1 Ayam mampu memproduksi IgY spesifik terhadap toksin tetanus yang tersimpan pada telur, 2 IgY yang terbentuk mempunyai daya tahan terhadap pengaruh suhu, pH, dan enzim pencernaan, 3 IgY yang terbentuk mampu menetralisasi toksin tetanus dan berpotensi tinggi. DAFTAR ISI Halaman DAFTAR TABEL ................................................................................... DAFTAR GAMBAR ................................................................................... x xi DAFTAR LAMPIRAN ................................................................................. PENDAHULUAN ......................................................................................... xiii 1 Latar Belakang ................................................................................. Perumusan masalah ......................................................................... 1 4 Tujuan Penelitian ............................................................................. Manfaat Penelitian .......................................................................... 5 5 Hipotesis ......................................................................................... TINJAUAN PUSTAKA ............................................................................... 6 7 Sistem Imun ..................................................................................... Imunoglobulin ................................................................................ 7 9 Imunoglobulin Y ............................................................................ Keuntungan Penggunaan Imunoglobulin Y .................................... 10 14 Penggunaan Teknologi IgY ............................................................ Stabilitas IgY .................................................................................. 17 18 Tetanus ........................................................................................... Toksin Tetanus ............................................................................... 19 22 Mekanisme Kerja Toksin Tetanus .................................................... Imunitas Terhadap Toksin Tetanus ................................................. Pencegahan dengan Antitoksin ....................................................... 25 34 35 MATERI DAN METODE ........................................................................... Lokasi dan Waktu Penelitian ............................................................ 36 36 Materi .............................................................................................. Hewan Percobaan ........................................................................ 36 36 Toksoid Tetanus .......................................................................... Bahan ........................................................................................... 36 37 Peralatan ...................................................................................... Metode ............................................................................................. 37 38 Produksi IgY pada Telur Ayam .................................................. Ekstraksi IgY dari Kuning Telur .............................................. Purifikasi IgY .............................................................................. Identifikasi Kemurnian IgY ...................................................... 38 38 39 39 Metode Bradford .................................................................... 40 viii Uji Imunodifusi ..................................................................... Sodium Dodecyl Sulphate Polyacrylamide Gel 40 Electrophoresis ....................................................................... Teknik ELISA ........................................................................ 41 42 Aktivitas Biologis IgY.......................................... .......................... Uji Aktivitas IgY Setelah Perlakuan pH ........... ......................... 43 43 Uji Aktivitas IgY Setelah Perlakuan Suhu ............................... Uji Aktivitas IgY Setelah Perlakuan Enzim Pepsin, Tripsin, dan Protease ...................................................................................... 43 Uji Potensi IgY ................................................................................ 44 44 Uji Tantang pada Hewan Coba ....................................................... HASIL DAN PEMBAHASAN ..................................................................... 45 47 Produksi IgY antitetanus pada Telur Ayam ..................................... 47 Ekstraksi, Purifikasi dan Karakterisasi IgY Antitetanus dari Kuning Telur .................................................................................... Aktivitas Biologis IgY antitetanus .................................................. Titrasi Toksoid, Sampel IgY Ayam, dan Konjugate Enzim .... 52 59 59 Aktivitas IgY Antitetanus Setelah Perlakuan pH ...................... Aktivitas IgY Antitetanus Setelah Perlakuan Suhu .................. 59 62 Aktivitas IgY Antitetanus Setelah Perlakuan Enzim Pepsin, Tripsin, dan Protease .................................................................. 67 Hasil SDS-PAGE IgY Antitetanus Setelah Perlakuan Fisik dan Kimia .............................................................................................. Potensi IgY Antitetanus .................................................................. Uji Tantang Pada Hewan Coba ....................................................... 69 70 72 Berat Badan ............................................................................... Feed Intake ................................................................................ 75 78 Laju Respirasi ........................................................................... Refleksitas ................................................................................ 80 82 Pemberian IgY Antitetanus Secara Oral ................................... KESIMPULAN DAN SARAN ...................................................................... 83 86 Kesimpulan ....................................................................................... Saran ................................................................................................. 86 86 DAFTAR PUSTAKA .................................................................................... 87 ix DAFTAR TABEL Halaman 1. Karakter imunoglobulin itik .................................................................. 12 2. Kelebihan IgY dibandingkan dengan IgG mamalia ........................... 16 3. Hasil uji AGP IgY antitetanus pada serum dan telur ayam ................. 47 4. Hasil pengukuran titer IgY antitetanus (IU/ml) .................................. 51 5. Konsentrasi protein hasil ekstraksi dan purifikasi IgY antitetanus ...... 54 6. Uji potensi IgY antitetanus .................................................................... 71 7. Protective dose-50 ATS standar ……………………………………… 71 8. Protective dose-50 ATS uji ………………………………………… 71 9. Persentase mencit yang bertahan hidup pada setiap kelompok perlakuan ............................................................................. 10. Persentase mencit yang hidup setelah diberi IgY antitetanus secara oral .............................................................................................. 73 84 x DAFTAR GAMBAR Halaman 1 2 Perbedaan struktur IgY dan IgG. .............................................................. 12 Fragmen Hc toksin tetanus ........................................................................ 25 3 4 Proses perlekatan toksin bakteri pada sel .................................................. 27 Interaksi ganggliosida pada dua permukaan binding site fragmen Hc....... 28 5 6 Patogenesis penyakit tetanus ..................................................................... 31 7. 8. 9. Proses penghambatan toksin tetanus terhadap reseptor transmiter inhibitor .................................................................................................... 32 Rataan konsentrasi IgY antitetanus pada serum dan telur ..................... 48 Hasil uji imunodifusi IgY antitetanus Ayam ......................................... 48 Penambahan kloroform pada laruta n kuning telur. B. Pemisahan supernatan yang mengandung IgY antitetanus dari lemak telur yang telah mengendap ...................................................................................... 52 10 A. Penambahan PEG 6000 pada supernatan. B. Pemisahan pelet dari supernatan setelah disentrifuse .................................................................. . 53 11 Profil pita protein dari IgY antitetanus hasil ekstraksi dengan metode PEG – kloroform ...................................................................................... . 55 12 Kromatogram hasil FPLC IgY antitetanus .............................................. 13 Hasil uji agar gel presipitasi IgY antitetanus setelah pemurnian dengan FPLC. ... .................................................................................................. 56 57 14 Hasil SDS-PAGE IgY antitetanus setelah pemurnian FPLC. ................. 58 15 Pola aktifitas IgY antitetanus setelah perlakuan pH ................................. 60 16 Penurunan aktivitas IgY antitetanus setelah perlakuan pH ...................... 61 17 Pola aktifitas IgY antitetanus setelah perlakuan suhu ............................. 62 18 Penurunan aktivitas IgY antitetanus setelah perlakuan suhu dengan waktu inkubasi berbeda ........................................................................... 63 19 Penambahan larutan sukrosa pada larutan IgY antitetanus ...................... 64 20 Penambahan larutan glukosa ke dalam larutan IgY antitetanus ............... 21 Pola aktifitas IgY antitetanus setelah perlakuan enzim pepsin, tripsin, dan protease .............................................................................................. 65 22 Hasil SDS-PAGE IgY antitetanus setelah perlakua n fisik dan kimia . . 68 69 23 Frekuensi pemunculan kasus dengan gejala klinis khas tetanus .......... 24 Jumlah gejala klinis yang muncul harian. .............................................. 73 74 25 Gejala klinis yang muncul pada dosis IgY berbeda. .............................. 26 Pola kecenderungan garis regresi berat badan mencit ………………… 74 76 xi 27 Pola pertambahan berat badan mencit ..................................................... 28 Pola kecenderungan garis regresi feed intake mencit ………………… 77 79 29 Pola kecenderungan garis regresi laju respirasi mencit ............................ 30 Konsumsi oksigen mencit ....................................................................... 80 81 31 Kemampuan lama berenang mencit ...................................................... 83 xii DAFTAR LAMPIRAN Halaman 1. Reagensia untuk Fast Protein Liquid Chromatography (FPLC) .......... 99 2. Reagensia untuk ELISA ........................................................................ 100 3. Perhitungan berat molekul protein ....................................................... 101 4. Prosedur pengenceran serum antitetanus standar dan toksin tetanus .................................................................................................. 102 5. Bagan pengamatan uji tantang........................................................ 103 6. Kurva standar BSA untuk pengukuran konsentrasi protein .............. 103 7. Analisis ANOVA perlakuan suhu terhadap IgY antitetanus ….……... 104 8. Analisis ANOVA perlakuan pH terhadap IgY antitetanus …………... 105 9. Analisis ANOVA perlakuan enzim terhadap IgY antitetanus ............... 109 10. Persamaan garis regresi berat badan .................................................. 111 11 Persamaan garis regresi feed intake ……………………………….. 111 12 Persamaan garis regresi laju respirasi ………………………………. 112 xiii TINJAUAN PUSTAKA Sistem Imun Sistem imun dimiliki oleh semua spesies, digunakan untuk mempertahankan diri melawan benda asing yang masuk ke dalam tubuh. Keberadaan protein asing dan patogen dimonitor secara rutin oleh tubuh melalui pelepasan imunoglobulin. Sistem kekebalan akan mampu mengenali spesifik zat kimia yang membedakan sebuah patogen asing dari yang lainnya, serta mampu mengenali molekul asing dengan sel-sel tubuh beserta protein -proteinnya (Kuby 1997). Antibodi mampu mengenali dan berikatan dengan antigen spesifik sampai ribuan atau jutaan antigen. Interaksi antigen-antibodi merupakan interaksi biologi yang sangat spesifik. Sifat khusus itu yang dimanfaatkan dalam teknik imunologi (Abbas et al. 1997). Pertahanan tubuh melawan infeksi dapat diba gi atas dua yaitu : kekebalan alamiah (non spesifik) dan kekebalan spesifik (adaptive). Kekebalan non spesifik meliputi empat tipe pertahanan yaitu : pertahanan secara anatomi, fisiologi, fagositik, dan peradangan. Pertahanan secara anatomi merupakan pertahanan tubuh yang pertama mencegah masuknya mikrob patogen ke dalam tubuh. Pertahanan secara anatomi terdiri atas barier fisik kulit, selaput lendir, silia, proses batuk, dan bersin. Barier fisik berperan mencegah penetrasi patogen ke dalam tubuh dengan cara melisiskan dan menghambat kolonisasi kuman. Sebagian besar bakteri gagal untuk hidup lebih lama pada kulit karena pengaruh hambatan langsung dari asam laktat dan asam lemak yang disekresikan kelenjar keringat dan sekresi glandula sebaseus (Roitt 1988) . Pertahanan secara fisiologi akan menghambat perlekatan patogen yang masuk ke dalam tubuh melalui mekanisme fisiologi seperti pengaturan temperatur, pH, sekresi mucus, dan pelepasan mediator kimia (lisozim, sekresi sebaseus, asam lambung, laktoferin, dan asam neuramik), dan faktor humoral (komplemen, dan interferon). Pertahanan fagositik diperankan oleh sel hetrofil, basofil, eosinofil, sel natural killer, dan sel mast. Sel itu akan mencerna dan menghancurkan mikrob asing, serta membunuh sel tubuh yang ter infeksi kuman. Jaringan yang telah rusak dan infeksi menyebabkan reaksi peradangan (Halliwell dan Gorman 1989; Kuby 1997). 8 Respon imun spesifik terbentuk dari kemampuan tubuh menghasilkan respon yang spesifik untuk melawan patogen yang masuk ke dalam tubuh. Secara klasik respon imun spesifik dikelompokkan menjadi kekebalan humoral dan kekebalan berperantara sel (Roitt 1988). Dua tipe sel yang berperan secara aktif yaitu makrofag dan limfosit. Makrofag menguraikan antigen untuk disajikan pada sistem imum, dan limfosit mengenali fragmen antigen yang disajikan untuk produksi antibodi (Halliwell dan Gorman 1989). Imunitas spesifik selama merespon substansia asing juga membentuk sel memori sehingga mudah mengenali antigen jika terjadi paparan yang berulang (Roitt 1988). Respon humoral meliputi interaksi sel B (sel plasma) dengan antigen dan selanjutnya proliferasi dan diferensiasi membentuk antibodi dengan atau tanpa bantuan sel T. Limfosit B mengekspresikan imunoglobulin permukaan yang spesifik terhadap epitop dari antigen, dan limfosit T mengenali antigen yang telah diproses pada sel presenting antigen. Antibodi yang disekresikan oleh sel plasma menghasilkan antibodi soluble (terlarut). Respon imun selular meliputi interaksi reseptor sel T dan antigen yang telah diproses. Respon itu melalui dua jalur. Pertama , interaksi sel T dengan antigen dan sekresi limfokin untuk menarik makrofag yang akan memfagositosis antigen. Kedua, interaksi sel T sitotoksik dengan antigen yang dipresentasikan oleh MHC II yang akan menyebabkan lisis sel (Roitt 1988). Berdasarkan proses terbentuknya kekebalan dalam tubuh, kekebalan dibedakan atas dua tipe, yaitu kekebalan aktif dan kekebalan pasif. Pada proses imunisasi aktif tubuh akan memproduksi antibodi dan memberi kekebalan yang lama. Pada imunisasi pasif antibodi terbentuk segera tetapi memberikan perlindungan dalam waktu singkat (Abbas et al. 1997). Neonatus mendapatkan kekebalan dari induk melalui kolustrum selama laktasi pada mamalia dan kuning telur pada reptil dan burung (Anonim 2002). Kuning telur ayam telah diteliti dan mengandung lebih dari 200 antibodi berbeda. Setiap protein asing atau mikrob yang memapar ayam baik dengan cara imunisasi atau terpapar secara alami akan diproses dan menimbulkan antibodi untuk melawan bahan asing itu. Antibodi akan berkumpul di kuning telur dengan titer yang berbeda tergantung derajat paparan. Ayam adalah hewan yang paling 9 optimal memproduksi antibodi, dibandingkan dengan mamalia yang hanya memproduksi kolustrum saat partus (Da vis and Reeves 2002). Produk imun itu memberikan perlindungan secara alami terhadap infeksi selama perkembangan sistem imun anak belum berfungsi optimal (Anonim 2002). Imunoglobulin Imunoglobulin atau antibodi adalah kelompok protein yang mempunyai kema mpuan berikatan secara spesifik pada antigen dan mengeluarkan antigen itu dari tubuh. Antibodi adalah molekul protein yang dihasilkan oleh sel plasma sebagai akibat interaksi antara limfosit B peka antigen dengan antigen khusus (Kuby 1997). Struktur dasar dari antibodi tersusun atas empat rantai polipeptida yaitu dua rantai berat dan dua rantai ringan yang identik (Male et al. 1987). Rantai berat (H) dan rantai ringan (L) disatukan oleh ikatan kovalen disulfida. Posisi ikatan sulfida bervariasi tergantung dari kelas dan subkelas antibodi. Setiap molekul antibodi terbagi atas bagian yang dapat berubah (variable) dan bagian yang tetap (konstan). Bagian variable merupakan tempat pertautan antigen, sedangkan bagian konstan tempat sifat biologi antibodi. Bagian variabel dihubungkan dengan bagian konstan oleh bagian engsel. Pada bagian variabel terdapat bagian hipervariabel untuk mengenali berbagai variasi antigen. Bagian variabel dan konstan terdapat pada rantai berat dan rantai ringan antibodi (Kuby 1997). Secara umum imunoglobulin pada mamalia dibagi ke dalam lima kelas berdasarkan struktur regio konstan rantai berat, yaitu Ig G (γ), IgA (α ), Ig M (µ), Ig D (δ), dan Ig E (ε) dan dua tipe rantai ringan kaffa (κ) dan lamda (λ). Pada setiap molekul antibodi terdapat hanya satu tipe rantai ringan (Roitt 1988). Sedangkan pada sistem pertahanan unggas (ayam) ada tiga kelas imunoglobulin (Ig), yaitu IgA, IgY, dan IgM (Shimizu et al. 1992; Hatta et al. 1993; Sharma 1997). Di antara spesies avian, sistem imun aya m telah dipelajari de ngan intensif (Davis and Reeves 2002). Struktur imunoglobulin M dan A ayam mirip dengan yang ditemukan pada mamalia sedangkan struktur IgG mamalia berbeda dengan IgY ayam (Sharma 1997). Selain imunoglobulin, perlindungan terhadap patogen pada unggas juga diperankan oleh organ pertahanan yang terdiri atas bursa 10 fabricius, bone marrow, limpa, timus, glandula harderian, limponodus, limfosit yang bersirkulasi, dan jaringan limfoid pada saluran cerna (Shimizu et al. 1992; Hatta et al. 1993; Sharma 1997). Imunoglobulin Y Terminologi (istilah) IgY telah diperkenalkan sejak tahun 1969 dalam literatur yang diistilahkan dengan 7-S Ig terutama yang terdapat di serum, tetapi juga ditemukan dalam isi duodenum, bilasan trakea, dan plas ma seminal (Hadge dan Ambrosius 1984). Imunoglobulin Y telah diisolasi dari unggas (kalkun, ayam, itik, angsa) , ampibi, reptil (Hadge 1985), dan kura-kura darat (Hadge dan Ambrosius 1986). Pada awalnya, beberapa peneliti menduga bahwa IgY yang dihasilkan bangsa unggas sama dengan IgG mamalia, sedangkan kenyataannya berbeda (Szabo et al. 1998). Transpor IgY dari serum induk ke anak meliputi dua proses. Pertama , IgY ditransfer melewati epitel folikular dari ovari dan berakumulasi dalam kuning telur selama masa oogenesis, yang mirip dengan proses transfer IgG melalui plasenta pada mamalia. Kedua, pemindahan IgY dari kuning telur ke embrio yang sedang berkembang. Isotipe antibodi yang lain seperti IgA dan IgM ditransfer dalam jumlah terbatas ke putih telur (Sharma 1997). Konsentrasi IgY dalam kuning telur konstan sampai oosit matang. IgY tidak terdapat dalam putih telur, sedangkan IgA dan IgM hanya terdapat dalam putih telur. Tidak terjadi seleksi atau destruksi IgY selama proses transfer itu (Davis and Reeves 2002). IgY dalam kuning telur dipersiapkan untuk memberikan kekebalan pasif pada anak ayam. Kuning telur mengandung 8 sampai 20 mg IgY per ml atau 136 sampai 340 mg per kuning telur. Dalam setahun dapat diisolasi 30 g sampai 40 g IgY (Shimizu et al. 1992), sedangkan pada mamalia hanya 1.3 g (Davis and Reeves 2002). Hal itu menyebabkan ayam sebagai sumber IgY mendapat perhatian serius (Shimizu et al. 1992). Penelitian dan penggunaan Ig dari ayam, terutama IgY untuk terapi, pencegahan, dan diagnostik dalam satu setengah dekade terakhir berkembang dengan pesat. Secara alami IgY ayam berbeda dengan IgG mamalia dalam hal berat molekul, titik isoelektrik, berikatan dengan komplemen, dan spesifisitas terhadap 11 antigen yang diberikan (protein, bakteri, virus dan parasit ) (Hatta et al. 1993). Sedangkan berat molekul, morfologi, dan mobilitas imunoelektroforetik dari IgA dan IgM ayam mirip dengan IgA dan IgM mamalia (Davis and Reeves 2002). IgY tidak bereaksi silang dengan komponen struktural jaringan mamalia (Larsson et al. 1993). Hal ini me mberikan indikasi penggunaan IgY dalam diagnostik imunologis akan menghasilkan reaksi yang lebih spesifik. Hassl et al. (1987) melaporkan spesifisitas antibodi serum IgY ayam yang di imunisasi dengan antigen toxoplasma gondii lebih tinggi dibandingkan dengan serum antibodi IgG kelinci. Lebih lanjut, antibodi spesifik (IgY) yang ada dalam darah induk ayam, secara baik dapat ditransfer ke dalam telur. Titer IgY dalam darah dan dalam telur tidak berbeda secara signifikan (Larsson et al. 1993), dan tidak ada perbedaan kandungan IgY pada dua spesies ayam berbeda (Li et al. 1998). Sehingga telur dapat digunakan sebagai sumber protein hewani dan sebagai pabrik produksi antibodi (Regenmortel 1993; Losch et al. 1986). Imunoglobulin Y secara struktural berbeda dengan IgG pada mamalia. Rantai berat IgG dengan berat molekul (BM) 50 kDa terdiri atas empat domain yaitu : domain variabel (VH) dan tiga domain konstan (Cã1, Cã2, dan Cã3). Domain Cã1 terpisahkan dari Cã2 oleh regio engsel dan berhubungan secara fleksibel pada fragmen Fab. Sebaliknya rantai berat IgY dengan berat molekul 65 sampai 70 kDa , dan 2 rantai ringan (22 sampai 30 kDa). IgY memiliki berat molekul 180 kDa , tidak memiliki regio engsel dan memiliki empat domain konstan pada rantai berat yaitu Cυ1, Cυ2, Cυ3, dan Cυ4 (Schade et al. 1996) . IgY kekurangan domain Fc dan tidak dapat berikatan dengan komplemen mamalia atau protein A atau G dari mikrob, sehingga protein A dan G tidak dapat digunakan untuk purifikasi IgY, tetapi dengan modifikasi menggunakan antibodi rabit-anti-IgY, protein A dapat digunakan untuk isolasi IgY (Magor et al. 1994a). Perbedaan struktur kedua Ig ini dapat dilihat pada Gambar 1. 12 Gambar 1 Perbedaan struktur IgY dan IgG (Sumber. Schade et al. 1996). Pada itik dilaporkan memiliki tiga tipe imunoglobulin serum yaitu IgM dan dua bentuk mirip (isoform) IgY yaitu IgY utuh dan IgY terpotong. IgY utuh memiliki berat molekul 200 kDa dengan koefisien sidementasi 7.8 S dan IgY terpotong memiliki berat molekul 130 kDa dengan koefisien sidementasi 5.7 S. IgY terpotong kehilangan dua domain terminal pada regio konstan dari rantai berat yaitu domain 3 dan 4 (Warr dan Higgins 1995). Tabel 1 Karakter imunoglobulin itik Jenis imuno globulin Koefisien sidementasi Molekul utuh (kDa) Ig M 800 –900 Ig Y utuh 7.8 S 178 – 200 Ig Y terpotong 5.7 S 118 - 130 Dikutip dari :Warr dan Higgins, (1995) Berat Molekul Rantai Berat (kDa) 86 62 – 67 35 – 42 Rantai Ringan (kDa) 23 – 25 22 – 25 22 – 25 Struktur 7.8S IgY merupakan IgY tipikal ayam, tetapi struktur 5.7S IgY (∆Fc) merupaka n ekspresi antibodi yang tidak lazim (Magor et al. 1992; Magor et 13 al. 1994). Struktur dan antigenitas 5.7S IgY mirip dengan fragmen F(ab’)2 dari 7.8S IgY (Warr dan Higgins 1995). Itik membentuk dalam jumlah besar IgY()Fc). Bentuk ini cacat karena kehilangan dua domain C-terminal pada rantai H (υ). Struktur abnormal dari IgY()Fc) menyebabkan penurunan fungsi biologis Ig seperti aglutinasi, presipitasi, fiksasi komplemen, opsonisasi (Chan et al. 1999; Lundqvist et al. 2001), walaupun level serum dari boster meningkat (Warr dan Higgins 1995). Faktor lain yang berpengaruh yaitu pembentukan sterik dari lengan Fab (berfungsi monovalensi), regio engsel (hinge) yang kaku, keragaman yang sempit atau terbatas, kegagalan dalam pematangan ikatan antigen pada antibodi (Magor et al. 1994). Respon imun mukosa dependen-IgA itik perkembangannya terlambat selama penetasan dibandingkan dengan ayam (Lundqvist et al. 2001). Pada itik IgA mulai dideteksi pada umur 14 hari setelah menetas dan berfungsi optimal setelah umur 35 hari, sedangkan pada ayam telah berfungsi optimal pada umur 5 hari setelah menetas (Magor et al. 1998; Chan et al. 1999). Berbagai metode ekstraksi dan purifikasi telah dilaporkan oleh beberapa ahli. Ekstraksi IgY me lalui water dilusi (pelarutan dalam air) kuning telur (Akita dan Nakai 1992); presipitasi lemak dengan dektran sulfat yang mengandung CaCl2 (Szabo et al. 1998). Hasil ekstraksi dilakukan purifikasi dengan kromatografi menggunakan ion exchange (DEAE-Sephacel) dan filtrasi gel (Szabo et al.1998), mencampur serum dengan asam caprylat, diendapkan dengan amonium sulfat dan didialisis dengan PBS. Teknik ini sangat cepat, murah, sederhana dibandingkan dengan menggunakan metode ion exchange atau gel filtrasi kromatografi (Bhanushali et al. 1994). Purifikasi IgY dari telur dengan thiophilic interaction chromatography merupakan prosedur purifikasi untuk homogenitas IgY dalam langkah kromatogra fi tunggal setelah fraksinasi amonium sulfat. Recoveri dengan prosedur ini mampu sampai 100% (Hansen et al. 1998). Metode pelarutan dalam air dilakukan untuk memisahkan plasma protein terlarut dari granul kuning telur. IgY aktif dengan tingkat kemurnian yang tinggi didapat dari kombinasi beberapa teknik seperti presipitasi garam, filtrasi gel dan ion exchange chromatography. Presipitasi garam, ultrafiltrasi, dan gel filtrasi dianjurkan dilakukan secara berurutan (Akita dan Nakai 1992). Metode purifikasi 14 lain untuk isolasi adalah metode dua langkah purifikasi yaitu presipitasi dengan PEG diikuti de ngan perlakuan alk ohol. Uji spesifisitas dilakukan dengan cara hemaglutinasi indirek, uji imunodifusi, dan imunoelektroporesis (Hassl et al. 1987). Jumlah Ig spesifik yang terdapat dalam telur dari ayam yang diimunisasi adalah 1% dari total IgY (Hansen et al. 1998). Keuntungan Penggunaan Imunoglobulin Y Sistem imun ayam dilaporkan telah dipelajari lebih dari satu abad yang lalu, di awali dengan pengamatan pada ayam yang diimunisasi menunjukkan adanya transfer imunoglobulin dari serum ke kuning telur (Camenisch et al. 1999). Transfer ini diperlukan embrio aves dan anak untuk melawan berbagai penyakit. Penelitian pada sistem imun ayam berkontribusi secara substansial untuk memahami konsep mendasar dari imunologi dan perkembangan kelas Ig yang berbeda. Perkembangan penelitian pada imunoglobulin unggas terutama ayam juga di dukung oleh perkembangan ilmu pengetahuan dan semakin tingginya kesadaran akan animal welfare. Perkembangan penelitian itu melaporkan ayam sebagai alternatif terbaik untuk produksi antibodi poliklonal (Akita dan Nakai 1992; Shimizu et al.1992; Hatta et al. 1993; Schade dan Hlinak 1996; Camenisch et al. 1999). Penggunaan ayam sebagai sumber imunoglobulin mempunyai beberapa keuntungan antara lain : pemeliharaan ayam tidak mahal, koleksi te lur tida k invasif, isolasi dan afinitas purifikasi IgY cepat dan sederhana, aplikasi IgY sangat luas (Camenisch et al. 1999) . Ekstraksi IgY dari telur lebih menguntungkan dibandingkan dengan ekstraksi Ig mamalia. Keuntungan yang nyata adalah : lebih mudah mengkoleksi telur dari ayam dibandingkan koleksi serum dari mamalia, ketika mengambil darah dari mamalia memerlukan keahlian khusus sedangkan telur dapat dikoleksi oleh tenaga yang tidak dilatih secara khusus, harga pakan dan kandang ayam lebih murah diba ndingkan dengan hewan laboratorium (Camenisch et al. 1999) . Ayam dapat bertelur secara normal sebanyak 240 butir setahun, sedangkan pada kelinci darah hanya dapat diambil secara periodik dengan volume maksimum 50 ml (Nakai e t al. 1994) , dan saat koleksi telur tid ak menyebabkan cekaman pada ayam (Gassmann 2002). Koleksi antibodi melalui serum, ayam 15 tidak mengalami cekaman meskipun dalam periode bertelur. Sehingga penggunaan ayam menjadi metode alternatif untuk mengurangi penderitaan hewan. Jumlah hewan yang diperlukan untuk produksi antibodi lebih sedikit, karena ayam mampu memproduksi antibodi lebih tinggi dibandingkan kelinci (Gross dan Speck 1996). Antibodi ayam memiliki lebih banyak epitop terhadap antigen mamalia (Carlander et al. 1999) , dapat digunakan untuk menghindari kesalahan immunoassay akibat sistem komplemen (Fryer et al. 1999), faktor rheumatoid, dan reseptor Fc bakteri (Carlander et al. 1999). Pada pengukuran High-sensitivity C-reaktive protein (hs-CRP) yang merupakan salah satu marker untuk pengukuran resiko jantung, penggunaan antibodi mamalia seperti kelinci, tikus, dan kambing memberikan hasil kurang memuaskan, hal ini akibat faktor rheumatoid dalam sampel meyebabkan reaksi positif palsu. Permasalahan itu dapat ditanggulangi dengan penggunaan IgY (Tsen et al. 2003). Perbedaan jarak pilogenetik antara mamalia dan avian menyebabkan protein mamalia yang conserved (sulit isolasi juga unik) lebih imunogenik pada ayam dibandingkan dengan mamalia dan respon antibodi spesifik yang dihasilkan sangat tinggi (Akita dan Nakai 1992; Lee et al. 1997; Halper et al. 1999; Orsini et al. 2001). Sehingga ayam sebagai pilihan terbaik untuk produksi antibodi dibandingkan dengan mamalia jika antigen berasal dari manusia atau mamalia. Isolasi dan metode purifikasi IgY sederhana dan mudah (Gassmann, 2002). Kuning telur mengandung lemak yang tinggi (lipoprotein, granul phospitin yang bercampur dengan livetin dan low density lipoprotein ), yang bermasalah jika digunakan secara langsung (Makvandhi dan Fiuzi 2002). IgY yang telah o dimurnikan dapat bertahan satu tahun pada suhu 4 C dengan ditambahkan anti pertumbuhan bakteri seperti Na-azide. Pada suhu kamar stabil selama sebulan. Untuk freeze antibodi hendaknya dibuat aliquot dan hindari freeze dan thawing. Freeze dan thawing lebih merusak antibodi dibandingkan disimpan pada suhu 4 o C selama satu minggu atau sebulan (Polson 1990) . Imunoglobulin Y diisolasi secara noninvasive dari kuning telur. IgY yang telah dimurnikan di uji dengan berbagai metode dan teknik diagnosis, seperti presipitasi, elektroporesis, ELISA, mikroskup elektron, dan western blotting. 16 Beberapa dari metode itu telah dimodifikasi untuk menyesuaikan dengan sifat antibodi ayam. Hasil penelitian menunjukkan IgY ayam mampu menggantikan IgG yang dihasilkan dengan metode tradisional dari mamalia. Penggunaan IgY sangat memperhatikan keamanan hewan, produktivitas tetap tinggi, dan kekhususan tertentu yang dimiliki IgY untuk tujuan diagnosis (Gross dan Speck 1996), dan modifikasi diagnostik (Higgins et al.1995; Doellgast et al. 1997; Kummer dan Li-Chan 1998; Kim et al. 1999). Penggunaan IgY pada uji ELISA tidak berkompetitor dibandingkan dengan menggunakan antibodi mamalia (Benkirane et al. 1998). Aplikasi potensial penggunaan IgY terus meningkat untuk pencegahan penyakit, agen diagnostik dan biologis, suplemen pakan, dan pemberian secara oral untuk propilaksis (Akita dan Nakai 1992). Tabel 2 Kelebihan IgY dibandingkan dengan IgG mamalia No IgY Unggas IgG (Mamalia) 1 Cara Pengambilan sampel Tidak hewan 2. Jumlah antibodi 50 -100 mg Ig 200 mg Ig G/40 ml darah Y/butir telur 5 – 7 butir telur/ minggu 3. Jumlah antibodi spesifik 2 – 10 % 5% 4. Reaksi dengan rheumatoid faktor Tidak ada Ada 5. Reaksi dengan protein A Tidak ada dan G Ada 6. Reaksi dengan mamalia G Tidak ada Ada Tidak ada Ada Ig 7. Aktivasi komplemen Sumber : Schade et al. (1996) menyakiti Menyakiti hewan Penggunaan teknologi IgY lebih ditekankan pada perlindungan terhadap hewan, penggunaan ilmu pengetahuan, dan segi ekonomi. Perlindungan terhadap hewan seperti pengurangan, penggantian, dan menjadikan lebih baik; penggunaan ilmu pengetahuan yaitu kekhasan sistem imun bangsa avian dan bagian IgY; dan secara ekonomi, jumlah IgY yang dihasilkan dari satu ekor ayam lebih tinggi dari 17 kelinci (Schade dan Hlinak 1996). Secara ringkas beberapa kelebihan lain dari IgY dibandingkan dengan IgG mamalia dipaparkan pada Tabel 2. Penggunaan Teknologi IgY Teknologi IgY telah digunakan untuk berbagai hal sehubungan dengan imunoterapi dan imunodiagnostik (Sugita-Konishi et al. 1996). Telur (IgY) ayam sebagai makanan mempunyai peran ganda yaitu peran fungsional dan neutraceutical. Secara fungsional sebagai sumber protein, dan secara neutraceutical mampu meningkatkan fungsi imun. Peningkatan kekebalan dengan pemberian secara oral Ig telah dilakukan oleh sejumlah peneliti. Pemberian IgY dilakukan melalui produk makanan, terutama untuk formula anak-anak, karena anak-anak merupakan kelompok rentan terhadap penularan patogen melalui makanan (Akita dan Nakai 1992; Makoto et al. 1998). Dilaporkan `pencegahan E coli pada pedet sapi dengan pemberian kolustrum dicampur IgY, pencegaha n rotavirus berhasil dengan baik pada mencit, serta pencegahan diare perjalanan (wisata) (Davis dan Reeves 2002). Penggunaan IgG mamalia untuk diagnostik pada uji ELISA sering menghasilkan reaksi positif palsu. Hal itu akibat reaksi silang dari IgG suatu spesies dengan spesies lain. Masalah itu dapat ditanggulangi dengan pemakaian IgY ayam. Davis dan Reeves (2002) melaporkan IgY tidak bereaksi silang pada pemeriksaan laktoferin dan proteoglikan manusia dan sapi pada uji ELISA. Spesifitas IgY dari ayam dapat dimanfaatkan sebagai reagen standar untuk alat diagnostik dan mampu meningkatkan akurasi dalam penelitia n. Dilaporkan antibodi kuning telur ayam banyak digunakan untuk penelitian biomedis, diagnosis, propilaksis, dan terapi penyakit. Hal itu disebabkan oleh langkah ekstraksi IgY sangat sederhana dengan hasil purifikasi antibodi yang tinggi (Fischer et al. 1996). Produksi IgY secara mendasar dipengaruhi oleh tiga faktor yaitu: sifat alami ayam, prosedur imunisasi, dan modulasi nutrisi. Imunisasi pada ayam white leg horn menghasilkan lebih banyak telur dan IgY pada kuning telur dibandingkan dengan ayam lain (Li et al. 1998). 18 Stabilitas IgY Pengetahuan terhadap stabilitas molekul IgY sangat penting, jika IgY digunakan sebagai reagen dalam berbagai kondisi. Stabilitas dari molekul IgY dapat dipengaruhi oleh berbagai perubahan fisik maupun kimia seperti suhu, asam, dan enzim pencernaan. Stabilitas IgY menjadi sangat penting jika dipakai untuk terapi imunisasi pasif yang diberikan secara oral. Aplikasi yang praktis pemberian suatu antibodi pasif dilakukan dengan mencampur antibodi dengan makanan atau material farmaceutikal, sehingga pertimbangan stabilitas antibodi terhadap panas, pH atau enzim digesti harus diketahui dengan baik (Hatta et al. 1993). Valensi dari IgY adalah dua, sama dengan antibodi mamalia. Regio engsel pada IgY tidak ada menyebabkan IgY kurang fleksibel. Mobilitas yang terbatas akibat kakunya regio engsel berpengaruh terhadap kemampuan antibodi dalam presipitasi atau aglutinasi antigen. Stabilitas IgY dibawah kondisi asam dan digesti pepsin lebih rendah dibandingkan dengan IgG sapi. Tetapi IgY lebih stabil terhadap digesti enzim protease internal seperti tripsin dan kemotripsin, dan terlihat ada subpopulasi IgY tahan terhadap digesti papain (Hatta et al. 1993). Para peneliti melaporkan, stabilitas IgG kelinci terhadap panas dan asam lebih tinggi dibandingkan dengan IgY. Bentuk dari molekul IgY sering berubah karena pengaruh asam, yang berakibat penurunan aktivitas antibodi (Shimizu et al. 1992). Stabilitas IgY anti HRV pada temperatur di atas 70 oC dan pH 2 sampai 3 lebih rendah diba ndingkan dengan IgG anti HRV kelinci. Temperatur maksimum untuk denaturasi IgG kelinci adalah 77 o C (Hatta et al. 1993). Aktivitas IgY pada kuning telur dan ekstrak kasar menurun dengan meningkatnya suhu dari 70 oC sampai 80 o C, tetapi denaturasi panas antara kedua sampel tidak berbeda. (Chang et al. 1999). Aktivitas IgY turun setelah diinkubasikan pada pH 3.5 dan hilang total pada pH 3, sedangkan aktivitas IgG dilaporkan tidak berubah sampai pH 2. sedangkan pada pH alkalis (pH 11 sampai 13) tidak menunjukkan perubahan, dan sedikit berkurang setelah diinkubasi pada pH 12. Penurunan aktivitas yang sangat cepat dari IgY disebabkan kerusakan pada antigen binding site karena pengaruh asam (Shimizu et al. 1992). 19 Digesti pepsin sangat cocok untuk preparasi dan purifikasi Fab. Isolasi Fab optimum didapat setelah digesti pepsin terhadap IgY pada pH 4 selama 9 jam dalam konsentrasi NaCl rendah. Kondisi itu mendigesti secara lengkap fragmen Fc antibodi dan hanya menyisakan fragmen Fab (Akita dan Nakai 1993a). Liofilisasi kuning telur dengan 5% gum arabic serbuk sangat baik untuk menjaga stabilitas terhadap protease (Chang et al. 1999). Tetanus Tetanus adalah salah satu penyakit yang lazim terjadi pada manusia dan hewan vertebrata. Tetanus telah dikenal oleh manusia sejak sejarah kesehatan mulai dikenal, tetapi sampai saat ini masih merupakan masalah besar pada kesehatan masyarakat di beberapa negara berkembang, terutama pada negara miskin dengan kondisi kesehatan buruk, beriklim panas dan lembab (Bizzini 1993). Agen penyebab tetanus adalah Clostridium tetani, tumbuh dalam kondisi anaerob, spora berbentuk batang (Kiefer 2004) , di bawah mikroskop terlihat seperti stik drum dengan gelembung di kedua ujungnya, dengan pewarnaan gram sel bakteri menyerap warna sedangkan spora tidak terwarnai. C. tetani tumbuh optimum pada media agar darah yang diinkubasikan pada suhu tubuh manusia. Bakteri akan berada dalam bentuk inaktif dengan menghasilkan spora ketika lingkungan tempat tumbuhnya tertekan. Dalam kondisi seperti itu, bakteri sangat toleran dengan kondisi lingkungan yang ekstrim, sedangkan dalam bentuk aktif mensekresikan eksotoksin yang sangat poten menyebabkan penyakit tetanus (Anonim 2003). Habitat alami kuman tetanus adalah tanah, debu, saluran cerna beberapa hewan, dan kadang-kadang pada feses manusia (Ray 2004). Beberapa varian dari kuman ini telah dipetakan secara genomik. C. tetani E88 merupakan varian dari strain Massachussetts, genomnya tersusun atas 2 799 250 bp kromosum dengan 2 372 ORF (Oven Reading Frame) dengan kandungan G+C 28.6%. Toksin tetanus dan enzim kolagenase disandi pada plasmid 74 082 bp, yang terdiri atas 61 ORF, dengan kandungan G+C 24.5%. Sedangkan faktor virulen yang lain seperti susunan lapisan permukaan dan protein adesi terdapat pada 61 ORF. Kebanyakan 20 gen terlihat tidak berfungsi karena terjadi penurunan ORF akibat insertion, delesi, dan poin mutasi. Variasi G+C pada genom sangat rendah, hanya pada region yang kandungan G+C nyata tinggi (sebanding 50%) memiliki 6 gen cluster rRNA dan gen penyanding protein ribosom. Rendahnya fluktuasi dari G+C menyebabkan genom dari C. tetani lebih stabil dibandingkan enteropatogen lain. C. tetani terus dapat tumbuh apabila tersedia ion sodium secara ekstensif sebagai bioenergetik (Bruggemann e t al. 2003). Semua spesies hewan rentan terhadap toksin tetanus, tetapi tingkat kerentanannya berbeda -beda. Manusia dan kuda paling rentan sedangkan kucing dan burung lebih tahan. Berdasarkan LD50/kgBB, pada burung diperlukan 10 000 sampai 300 000 kali dosis toksin lebih tinggi dibandingkan dengan kuda untuk menimbulkan sakit (Bizzini 1993). Manifestasi penyakit tetanus dikelompokkan menjadi empat yaitu : paralisis spastis umum (general), cephalic , lokal, dan neonatal. Tetanolisin dan tetanospasmin merupakan toksin yang dihasilkan oleh kuman tetanus dan sangat berbahaya (Ray 2004). Pada manusia dosis letal dari toksin adalah 1 ng/kg BB. (Bruggemann et al. 2003). Tetanus lokal ditandai dengan kekakuan otot disekitar luka. Gejala ini akibat kegagalan inhibisi dari inervasi syaraf spinal dan medula pada otot yang terserang. Tetanus lokal serangan ringan dan mortalitas kurang dari 1%. Tetanus cephalic kejadiannya jarang. Masa inkubasi sangat pendek yaitu satu sampai dua hari, dan penyakit muncul apabila te rjadi luka di daerah wajah dan kepala. Kelumpuhan daerah wajah dan okulomotoris merupakan gejala utama dan sering diikuti dengan dispagia. Prognosisnya jelek karena penyakit sering ke arah tetanus general. Tetanus neonatal terjadi karena kontaminasi pada daerah umbilikalis. Dengan masa inkubasi yang sangat pendek sehingga bayi tak bisa terawat. Kegagalan terjadi karena gangguan pernafasan dengan kematian empat sampai 14 hari (Bizzini 1993). Penyakit tetanus terjadi karena kontaminasi langsung spora C. tetani pada berbagai luka akibat benda tajam seperti luka tusuk (puncture) oleh benda berkarat, luka bakar, ulcer, fraktur (patah tulang), luka operasi (infeksi saat operasi) atau saat injeksi obat (Kiefer 2004). Spora dari kuman tetanus akan cepat mengalami germinasi pada luka dengan tekanan oksigen rendah. Kondisi ini 21 ditemukan pada luka nekrosis yang tertutupi oleh keropeng, tanah, debu dan terbungkus kain (Siegmund 1979; Mims 1982). Infeksi dari spora C. tetani juga dapat melalui luka saat kastrasi, potong ekor, pencukuran bulu, dan tali pusar (Lewis 1998). Luka dengan kondisi oksidasi-reduksi yang rendah mempercepat spora germinasi dan berubah menjadi sel bakteri yang aktif (Kiefer 2004). Keparahan kejadian tetanus tergantung atas jumlah toksin yang mampu mencapai CNS, dan masa inkubasi yang pendek. Periode inkubasi (waktu yang diperlukan dari saat inokulasi sampai muncul gejala pertama) dapat dibedakan atas periode onset atau waktu yang diperlukan dari gejala pertama muncul sampai reflek spasmus yang pertama. Bakteri ini bersifat noninvasif dan gejala yang timbul karena pengaruh toksin yang akan terbentuk setelah periode inkubasi. Lamanya periode inkubasi dan keparahan penyakit dipengaruhi oleh jumlah toksin yang terbentuk pada awal infeksi dan toksigenitas strain yang menginfeksi, jumlah dan kecepatan toksin mencapai neural pathways dan sirkulasi darah, kemampuan perpindahan toksin pada neural pathways, panjang dari neural pathways, dan kerentanan reseptor pada CNS (tergantung spesies). Pada manusia masa inkubasi 14 hari sedangkan pada hewan 24 jam sampai dua minggu atau lebih (Bizzini 1993). Angka kematian akibat C. tetani menjadi sangat tinggi jika penanganan luka tidak baik dan terjadi dekat organ vital (Ray 2004). Awal infeksi, gejala pada lesi tidak teramati. Apabila kondisi lingkungan tidak mendukung spora akan dorman dalam beberapa hari sampai minggu (Kiefer 2004), jika kondisi mendukung spora mengalami germinasi, dan sel yang baru terbentuk melepaskan toksin yaitu tetanolisin dan tetanospasmin. Angka mortalitas lebih tinggi pada kuman dengan masa inkubasi pendek. C. tetani memerlukan adanya infeksi bakteri lain untuk berkembang di tempat infeksi awal, terutama untuk menimbulkan reaksi peradangan (Ray 2004), sehingga pemberian antitetanus sering dikombinasikan dengan obat untuk bakteri lain (Guidolin et al. 1998). Toksin yang terbentuk berjalan secara retrograde sepanjang serabut syaraf, dan menetap pada jaringan syaraf. Target utama dari toksin adalah daerah sekitar batang otak. Perkembangan gejala klinis penyakit tetanus diawali kontraksi otot secara intermiten disekitar tempat masuk kuman, selanjutnya lock jaw diikuti 22 dengan kekakuan seluruh tubuh, kemudian spasmus otot. Kematian terjadi karena kegagalan pernafasan (Kiefer 2004). Kejadian penyakit lebih sering terjadi di daerah pedesaan di negara dengan iklim panas terutama pada petani yang mendapat luka saat pengolahan tanah pertanian. Pada negara dengan program imunisasi tidak teratur, kejadian tetanus lebih banyak bersifat neonatal (Ray 2004). Di negara maju seperti Amerika, kejadian tetanus masih ditemukan meskipun rendah (50 orang pertahun) terutama pada orang yang tidak diimunisasi, imunisasi tidak lengkap atau teratur, dan telah diimunisasi dengan lengkap tetapi dosis boster tidak ma mpu memberikan perlindungan yang protektif (Ray 2004). Toksin Tetanus Toksigenesis adalah kemampuan bakteri patogen memproduksi toksin untuk menimbulkan penyakit. Ditinjau dari sifat biokimia, ada dua tipe toksin bakteri, yaitu toksin yang tersusun atas lipopolisakarida dan protein. Sedangkan berdasarkan atas proses pembentukan dibedakan atas endotoksin dan eksotoksin. Endotoksin adalah toksin yang dihasilkan bakteri gram negatif dari komponen struktural membran luar sel bakteri, dilepaskan dari sel bakteri yang lisis akibat pertahanan inang (enzim lisosim). Komponen penyusun endotoksin adalah lipopolisakarida (LPS) (Emsley 2002) . Eksotoksin merupakan tipe toksin protein terlarut (soluble), disekresikan oleh bakteri hidup selama masa pertumbuhan eksponensial. Produksi eksotoksin spesifik dari masing-masing spesies bakteri karena memiliki aktivitas sitotoksik pada sel yang khusus seperti tetanus dan botulinum hanya menyerang sel syaraf sedangkan pada tipe sel yang lain kerusakan yang ditimbulkan tidak khas. Dalam aksi sitotoksiknya memerlukan substrat khusus. Substrat itu merupakan komponen dari sel, organ atau cairan tubuh inang. Terminologi terhadap toksin protein bakteri disesuaikan dengan tempat kerja toksin itu seperti enterotoksin, neurotoksin, leukosidin, atau hemolisin. Toksin merupakan faktor virulensi dan hanya diproduksi oleh strain bakteri yang virulen (Todar 2002). Toksin tetanus merupakan suatu protein yang disintesis sebagai polipeptida rantai tunggal dengan berat molekul 150 kDa, terdiri atas dua komponen yaitu: Ujung amino (A-terminal atau fragmen A) rantai ringan (L) 23 dengan berat molekul 50 kDa, dan ujung carboxyl (C-terminal atau fragmen B) rantai berat (H) dengan berat molekul 100 kDa. Kedua komponen tersebut dihubungkan oleh ikatan disulf ida (Emsley 2000). Toksin dari kuman tetanus merupakan protein yang sangat poten apabila berikatan dengan axon neural syaraf perifer. Toksin yang terbentuk akan mencapai neuron motor dan menyebar secara lokal untuk mencapai sistem syaraf pusat (Mims 1982). Pada sekuen tingkat DNA, toksin tetanus memiliki homolog dengan neurotoksin botulinum. Memiliki dua rantai disulfida yang berlokasi antara rantai berat dan rantai ringan (cys 438 sampai cys 466), dan dalam fragmen C (cys 1076 sampai cys 1092). Toksin yang dihasilkan oleh kuman tetanus yaitu : tetanospasmin (zink metalloprotease) yang sangat poten menyerang jaringan syaraf (neurotoksin) , dan tetanolisin dengan sifat seperti hemolisin. Produksi toksin tergantung atas kondisi luka dan kultur yang tersedia. Tetanolisin dihasilkan dalam jumlah sedikit oleh strain patogenik dan tidak memainkan peran penting dalam proses penyakit (Bizzini 1993). Toksin tidak stabil terhadap panas, cahaya, asam, dan enzim proteolitik, sehingga harus disimpan dalam ruang gelap dan dingin. Toksin dapat dipecah oleh enzim proteolitik seperti tripsin, kemotripsin, elastase, clostripain (Habermann 1988), dan papain (Rowe et al. 2000). Digesti toksin dengan enzim papain akan memecah molekul toksin menjadi dua fragmen, yaitu rantai ringan dan rantai berat (Marvaud et al. 1998). Fragmen tunggal toksin kurang toksik dibandingkan dengan toksin secara utuh, untuk penghambatan neuromuskular. Rantai berat dan ringan dari toksin dapat dipisahkan secara isoelektrik. Rantai berat berperan dalam pelepasan noradrenalin dari otak dan K+ dari eritrosit. Pemberian toksin tidak efektif lewat mulut. Toksin dapat diendapkan dengan amonium sulfat dan dalam kondisi kering sangat poten dalam jangka lama (Bizzini 1993). Produksi toksin tetanus diperankan oleh gen TeTx (gen tetanus toksin) ditemukan pada 74 kb pE88 plasmid C.tetani. Regulasi aktivator transkripsi dari gen TeTx dilakukan oleh gen TetR (Bruggemann et al. 2003). Gen TetR berlokasi di upstream gen TeTx di daerah flanking 5’ disandi ole h 29 asam amino terminal. Gen TetR mempunyai berat molekul 21.562 kDa tersusun atas 24 178 asam amino, dengan gambaran pada DNA-binding protein bermotif helixturn-helix. Mekanisme pengaturan oleh gen TetR merupakan mekamisme regulasi conserved untuk gen neurotoksin. Selain mekanisme pengaturan melalui gen, produksi toksin pada C. tetani dipengaruhi oleh suatu peptida rantai pendek pada casein hydrolysate, dan faktor lain yang penting adalah signal lingkungan di tempat kuman yaitu keberadaan ion Zn (Marvaud et al. 1998). Plasmid pE88 juga menyandi faktor virulen yang lain seperti kolagenase (114 kDa) yang ditandai dengan ColT, tetanolisin O, hemolisin, protein binding-fibronektin. Enzim kolagenase memainkan peranan penting pada patogenesis C. tetani, karena fungsi dari enzim ini untuk merusak integritas jaringan dari inang yang terinfeksi. ColT mirip dengan ColB yang dihasilkan oleh C. botulinum sedangkan dengan spesies clostridium yang lain berbeda (segmen 2 pada ColT tidak ada) (Bruggemann et al. 2003). Sifat toksisitas toksin protein dapat dihilangkan tetapi sifat antigeniknya tetap dipertahanka n, yang disebut dengan toksoid. Toksoid dibuat dengan cara memberikan perlakuan pada toksin dengan berbagai reagen seperti formalin, iodine, pepsin, asam askorbat, dan keton. Larutan diinkubasikan pada suhu 37 oC dengan pH 6 sampai 9 selama beberapa minggu. Toksoid dapat digunakan dalam imunisasi buatan dan mampu menimbulkan titer antitoksin yang tinggi dalam serum (Todar 2002). Fragmen HC yang juga disebut fragmen C rantai berat adalah fragmen terminal karboksil (COOH-terminal) dari toksin tetanus dengan berat molekul 50 kDa, diperlukan pada stadium awal proses intoksikasi untuk aktivitas perlekatan pada gangliosida (Halpern dan Loftus 1993). Topologi dari fragmen HC, terdiri atas dua domain yaitu domain amino-terminal jelly roll dan domain carboksilteminal β-trefoil (Gambar 2). Domain carboksil-teminal β-trefoil mengandung bagian untuk berikatan dengan gangliosida (Fotinou et al. 2001), sedangkan domain amino-terminal jelly roll memiliki struktur mirip dengan lektin, sebagai kandidat untuk berikatan dengan gangliosida, sehingga dapat dikatakan toksin tetanus memiliki banyak binding site karbohidrat (Emsley et al. 2000). 25 Gambar 2 Fragmen Hc toksin tetanus (Emsley et al. 2000). Beberapa peneliti menyebutkan toksin protein khususnya yang bereaksi intraseluler terdiri atas dua komponen yaitu : subunit A (rantai ringan) berespon untuk aktivitas enzimatik dari toksin; subunit B (rantai berat) untuk berikatan dengan reseptor spesifik pada sel membran inang dan tempat transfer enzim untuk melewati membran sel. Toksin tetanus disintesis sebagai polipeptida tunggal, dibagi menjadi domain A dan B yang dapat dipisahkan dengan enzim proteolitik. Komponen enzimatik (subunit A) ini tidak aktif sampai dilepaskan dari toksin natif (A+B). Isolasi subunit A secara enzimatik aktif tetapi kurang mampu berikatan dan masuk ke dalam sel. Isolasi subunit B mampu berikatan dengan sel target tetapi tidak toksik (Todar 2002). Mekanisme Kerja Toksin Tetanus Pada luka yang terkontaminasi spora C. tetani dengan kondisi lingkungan anaerob, maka spora akan mengalami germinasi dan menjadi bentuk aktif. Pada masa pertumbuhan eksponensial akan dilepaskan eksotoksin yang disebut tetanospasmin. Toksin mempengaruhi kerja sistem syaraf menjadi irregular. Transmisi menuju otak melalui neuron secara retrograde (Anonim 2003). 26 Ada dua mekanisme toksin masuk ke sel target (sel syaraf). Pertama, disebut mekanisme langs ung, yaitu subunit B pada toksin natif berikatan dengan reseptor spesifik pada sel target (ujung syaraf motorik) dan menyebabkan terbentuknya lubang pada membran sel sebagai tempat masuknya subunit A ke dalam sitoplasma sel. Proses terikatnya toksin pada syaraf diawali terikatnya toksin dengan afinitas rendah pada gangliosida, selanjutnya kompleks membrangangliosida-toksin bergerak ke arah lateral sampai berikatan dengan afinitas tinggi pada reseptor protein spesifik toksin. Proses ini diikuti dengan langkah internalisasi toksin setelah itu bergerak retrograde pada axon ke ventral spinal cord dan batang otak (Bizzini 1993). Toksin yang terbentuk menyebar ke otot disekitarnya melalui ikatan dengan terminal presinaptik pada axon motor. Selanjutnya toksin masuk ke sistem limpatik dan vascular darah untuk menyebar ke seluruh otot dan ujung syaraf. Cara penyebaran toksin seperti ini menyebabkan tetanus general atau juga disebut descending tetanus. Blood brain barier dan blood barier nerve perifer merupakan jalan masuk langsung toksin ke sistem syaraf (Bizzini 1993). Kedua, disebut mekanisme alternatif, toksin natif berikatan dengan sel target dan struktur A/B masuk ke dalam sel melalui proses endocitosis mediatedreseptor (RME). Toksin yang berada dalam sel membentuk vesikel yang disebut endosom. Ion H+ masuk ke dalam endosom menyebabkan pH di dalam endosom menjadi rendah, hal itu mengakibatkan terpisahnya subunit A/B. Selanjutnya subunit B melepaskan subunit A dari endosom menuju target di sitoplasma sel (Gambar 3). Subunit B tetap di endosom dan mendaur ulang permukaan sel. Kedua kejadian itu memerlukan pemasukan molekul protein dalam jumlah besar ke dalam dan menembus membran bilayer lipid (pada sel membran atau membran endosom). Aktivitas itu sebagai refleks i dari kemampuan toksin A/B atau komponen B untuk masuk ke lapisan lipid membentuk jalur permeabel ion (Todar 2002). Mekanisme kerja toksin mirip untuk seluruh kuman yang memproduksi toksin protein hanya sel targetnya yang berbeda, seperti bakteri dipteria dan pseudomonas menggunakan jalur langsung dan RME sedangkan bordetella pertusis dan anthrax dengan cara mengkatalisis pembentukan cAMP dari ATP intraselular sel inang (Todar 2000). 27 Gambar 3 Proses perlekatan toksin bakteri pada sel (Rappuoli dan Montecucco 1997). Mekanisme kerja toksin tetanus meliputi empat proses yaitu : perlekatan pada sel ganglion; internalisasi (masuk) ke dalam vesicular; translokasi sitoplasmik; dan pelepasan proteolitik pada subs trat neuron. Perlekatan toksin tetanus pada sel ganglion diawali dengan terikatnya toksin pada gangliosida permukaan sel syaraf. Gangliosida sel syaraf mengandung sialogangliosida yang sering disebut protein-G pada membran sel. substansia Hal ini dimungkinkan karena ujung karbonil (HC) fragmen rantai berat dari toksin tetanus mengandung ganglioside-binding site (Gambar 4) . Masing-masing kuman menggunakan protein-G yang berbeda, misalnya toksin kolera menggunakan ganglioside GM1 (Bruggemann et al. 2003), toksin botulinum menggunakan ganglioside GT1b (Yowler et al. 2002), dan toksin tetanus menggunakan ganglioside GT1 dan atau GD1b; dan N-glikosilat p15 (Miana-Mena et al. 2002). C. tetani juga memiliki gen signel-recognition particle (SRP) sebagai sistem translokasi protein, protein ini mirip dengan SRP manusia. Sistem ini dipercaya berperan dalam proses translokasi dan masuknya toksin ke membran protein sel (Bruggemann et al. 2003). Perlekatan toksin tetanus pada permukaan neuron untuk dapat internalisasi ke dalam sel neuron juga terjadi melalui lipid 28 raft. Lipid raft (anyaman lipid) adalah suatu kompleks yang terbentuk dari protein glycosylphospatidylinositol (GPI), gangliosida, kolesterol dan spingolipid yang terletak dipermukan neuron. Komponen tersebut membentuk suatu anyaman yang lebih dominan kandungan lipidnya (Herreross et al. 2001). Perlekatan toksin tetanus pada lipid raft juga karena pengaruh marker rafts yang terkandung didalamnya. Marker rafts tersusun atas glikoprotein yang mempunyai berat molekul 15 kDa, sehingga sering disebut p15 (Herreros et al. 2000). Ketahanan dan keutuhan dari lipid rafts itu dipengaruhi oleh kandungan kolesterol pada permukaan neuron. Beberapa toksin yang dikenal sebagai pore-forming toxin berikatan pada komponen lipid rafts dipermukaan sel (Herreros et al. 2001). Anyaman lipid (lipid raft) adalah mikrodomain pada membran plasma. Komponen ini berfungsi untuk menyeleksi zat yang akan masuk ke dalam vesikel, lalu lintas menuju puncak membran, dan penerima tanda (signaling) (Brown dan London 2000). Gambar 4 Interaksi gangliosida pada dua permukaan binding site fragmen Hc. Lokasi Gal4-GalNAc3 adalah celah dalam pada Hc (warna merah) dan Sia7-Sia6 adalah lekuk yang dangkal (Fontinou et al. 2001). Protein agrin juga sangat berperan dalam pembentukan neuromuscular junction. Protein ini berperan dalam mereorganisasikan mikrodomain membran lipid (lipid raft) dan memediasi transpor langsung pada sel syaraf yang berdekatan. Agrin ini disekresikan dari neuron motor dan sel otot, bekerja secara ekstraseluler untuk memacu agregasi molekul secara lokal. Sehingga masuknya toksin tetanus ke dalam sel syaraf selalu melalui kompartemen membran sel (Miana-Mena et al. 2002). 29 Molekul gangliosida merupakan kelas glikospingolipid, ditemukan dalam konsentrasi tinggi pada membran sel neuron (Fotinou et al. 2001). Gangliosida tersusun atas asam sialat (N-acetylneuranimic) yang terikat pada oligosakarida (galaktose dan N-acetylgalaktosamin) dan linked dengan ceramide. Bentuk dasar gangliosida adalah Galβ3 GalNAc β 4 (NeuAcα 3) Galβ4 Glc βCer, dengan satu atau lebih asam sialat. GM1 dan GD 1b memiliki residu asam monosialik dan disialik yang berikatan dengan residu internal galaktosa, sedangkan GT1b dan 6Q1b berikatan dengan residu terminal galaktosa (Emsley 2000). Fragmen HC toksin tetanus akan mengenali reseptor gangliosida dan satu gangliosida akan berikatan secara simultan terhadap lebih dari satu molekul toksin tetanus (Lalli et al. 1999; Williamson et al. 1999; Knight et al. 1999). Toksin tetanus berikatan pada bagian Gal4-GalNac3 dan Sia7-Sia6 (Gambar 4)(Fotinou et al. 2001). Perlekatan toksin tetanus pada gangliosida, dan patogen lain seperti toksin E coli heat-labil tipe I, toksin kolera dan simian virus untuk menghindari degradasi oleh lisosim (MianaMena et al. 2002). Terikatnya fragmen HC dari subunit B menyebabkan terbentuknya lubang pada membran sel syaraf, melalui lubang ini toksin masuk ke dalam vesikular sel. Fragmen Hc mempunyai kemampuan melekat pada neuron dan diperlukan sebagai alat transporasi intraseluler oleh toksin tetanus (Lalli et al. 1999). Toksin tetanus mengalami proses pemecahan proteolitik menjadi ujung amino rantai L dan rantai H. Rantai H dapat dipecah menjadi fragmen HC dan HN. Masingmasing fragmen memiliki fungsi yang berbeda. Fragmen HC untuk berikatan pada sel yang disensitisasi kemudian internalisasi ke vesikel. Sedangkan fragmen HN untuk translokasi rantai L melewati membran vesikular (Fotinou et al. 2001). Setelah internalisasi, rantai ringan (L) bertranslokasi ke dalam sitosol (Rummel et al. 2003). Keberadaan residu asam sialat tunggal pada residu internal Gal pada GM1, tak cukup untuk tempat berikatan toksin tetanus, diperlukan residu asam sialik yang lebih banyak. Untuk perle katan fragmen Hc diperlukan dua tempat yang berbeda pada gangliosida. Pengetahuan tentang perlekatan neurotoksin clostridium pada reseptor sel neuron, memberikan suatu informasi yang penting untuk membuat agen terapeutik antitetanus (Fotinou et al. 2001). Pelepasan proteolitik ujung amino rantai ringan (L) menyebabkan aktivitas katalitik 30 metaloprotease untuk melawan sinaptobrevin dan merangsang terjadinya keracunan (Emsley et al. 2000; Fotinou et al. 2001). Aktivitas proteolitik dari rantai L terjadi secara selektif pada protein sinap, yaitu hanya pada sinaptobrevin (Herreros et al. 2001). Sinaptobrevin yaitu suatu komponen esensial untuk eksositosis sel neuron. Keberadaan bioenergetika ion sodium yang ekstensif dipercaya sebagai faktor tambahan keberhasilan invasi kuman tetanus ke jaringan (Bruggemann et al. 2003). Toksin untuk sampai pada sistem syaraf pusat (CNS) melalui syaraf perifer mene mbus sawar darah pada sinap (Mims 1982). Toksin berkumpul pada ujung syaraf (presinaptik) dan translokasi pada alpa motor neuron (Habermann 1988; Lewis 1998) kemudian berjalan sepanjang axis silinder syaraf motorik. Rantai berat dari toksin akan berikatan dengan reseptor gangliosida neuron dan rantai ringan (sangat toksik) akan mengganggu kontrol horn anterior. Motor syaraf pada batang otak sangat pendek sehingga toksin akan cepat sampai di nervus cranialis I yang berakibat spasmus otot mata dan rahang (Mims 1982). Toksin yang terlepas awalnya terserap oleh motor syaraf yang ada disekitar luka dan melalui traktus syaraf mencapai spinal cord, proses ini disebut ascenden tetanus. Peristiwa ini menyebabkan gejala spasmodik, kontraksi tonik. Jika toksin yang dilepaskan pada tempat infeksi, menyebar melalui jaringan limpe kemudian buluh darah kemudian sampai pada CNS, proses ini disebut descenden tetanus dengan gejala berupa tetanus general (Siegmund 1979). Pergerakan toksin pada organel axonal diperlukan mikrofilamen dan setelah axonal retrograde diperlukan peran myosin Va dan motor mikrotubuli (Lalli et al. 2003). Waktu yang diperlukan untuk perjalanan toksin menuju otak berhubungan dengan masa inkubasi penyakit (Gambar 5). Pemutusan syaraf itu akan memperlambat perjalanan toksin. Pemotongan spinal cord akan mencegah toksin sampai di otak. Sedangkan gangglion spinal dari syaraf sensoris sebagai barier penyebaran toksin (Lewis 1998). Masa inkubasi penyakit bervariasi dari tiga sampai 10 hari setelah infeksi pada luka. Gejala awal yang terlihat pada hewan adalah diam dan malas bergerak, kekakuan seluruh tubuh, kemudia n berbaring dalam 12 sampai 24 jam, gejala selanjutnya spasmus tetanik, opistotonos, dan hiperaestesia. Kematian terjadi tiga 31 sampai empat hari setelah muncul gejala klinis pertama (Lewis 1998). Tempat berikatan toksin tetanus dan toksin botulinum sama pada ujung terminal neuromuscular motor junction , tetapi mekanisme intraseluler pada sistem syaraf berbeda sehingga kedua toksin menunjukan gejala yang berbeda. Toksin botulinum (BoNTs) kerjanya bersifat lokal pada sistem syaraf perifer dengan mengganggu perlepasan neurotransmiter yaitu menghambat pelepasan a setilkolin 3. Gejala klinis Kekakuan,dan paralisis pada nervus motor cranialis dan perifer . Contoh lockjaw Gagal Jantung Gagal Respirasi 1. Luka terkontaminasi spora C. tetani 2. Penyebaran Toksin Gambar 5 Patogenesis penyakit tetanus (Anonim 2003). dan menyebabkan paralisis lemah. Sebaliknya toksin tetanus (TeNT) bekerja pada sistem syaraf pusat, berjalan secara retrograde pada axon neuron inhibitor dalam spinal cord dan memecah sinaptobrevin. Pelepasan rantai ringan juga menghalangi pelepasan neurotransmiter dengan cara mencegah pembentukan komplek SNARE sinaptik (Fotinou et al. 2001; Herreros et al. 2001). MianaMena et al. (2002) melaporkan toksin tetanus mengambat aktivitas neuromuskular presinaptik melalui penghambatan (menutupi) reseptor tempat berikatan ion sodium pada membran sel. Toksin tetanus hanya menghambat transmisi sinaptik tanpa merusak integritas dari syaraf. Sedangkan toksin botulinum dilaporkan 32 menghambat transmisi pada postsinaptik, yang khusus berikatan dan menghambat reseptor asetilkolin tanpa mempengaruhi fungsionalitas syaraf seperti aliran ion ke dalam sel syaraf. Gambar 6 Proses penghambatan toksin tetanus terhadap reseptor transmiter inhibitor (Emsley et al. 2000). Toksin tetanus menghambat pelepasan neurotransmiter dari membran presinaptik pada neuron inhibitor nervus terminal (Gambar 6) (Emsley 2000), kemudian berjalan melalui transpor retrograde dari neuromuskular junction ke sistem syaraf pusat dengan target penghambatan pada neuron di dalam spinal cord dan batang otak mamalia (Bruggemann et al. 2003). Transpor toksin ke tempat aksi di CNS tergantung atas te rikatnya toksin pada reseptor membran presinaptik (keterlimpahan disialo-dan trisialogangliosida atau sialoglikoprotein pada vehikel sinaptik) dan internalisasi ke dalam membran transpor retroaxonal dalam sistem carrier reticulum endoplasmic smooth. Toksin akan menghambat pelepasan glisin dan GABA dengan cara menghambat pelepasan stimulasi K+ , memblok secara lengkap Ca ++ serta menstimulasi sekresi katekolamin, dan mengganggu metabolisme cGMP. Tiga langkah aksi toksin yaitu: 1) toksin berikatan untuk fiksas i, hal itu tergantung pada suhu dan bersifat reversible, 2) molekul toksin bertranslokasi pada membran sel, hal itu tergantung pelepasan transmiter, 3) paralisis sangat tergantung suhu dan tidak berhubungan dengan pelepasan transmiter. Perubahan metabolisme yang menyertai tetanus adalah cairan tubuh, asam basa, keseimbangan elektrolit, karbohidrat, protein, lipid, dan metabolisme asam nukleat. Tetanus yang berat diawali oleh alkalosis respirasi diikuti oleh acidosis dan terus meningkat karena terbentuk asam laktat akibat aktivitas otot berlebih (Bizzini 1993). 33 Waktu yang diperlukan oleh toksin untuk sampai di batang otak tergantung dari lokasi lesi, dari percobaan injeksi pada otot lidah diperlukan waktu kurang dari dua jam mencapai batang otak, sedangkan injeksi melalui otot gastrocnemius diperlukan waktu lebih dari enam jam (Miana -Mena et al. 2002). Toksin mengkatalisis vesikel protein sinaptobrevin pada sinap melalui pelepasan proteolitik. Hal ini akan menyebabkan konstraksi otot secara kontinyu yang pertama kali dilihat pada otot dagu dan leher (lockjaw) (Bruggemann et al. 2003). Tetanospasmin merupakan Zink metaloprotease, dilepaskan dalam luka dan berikatan dengan motor neuron terminal daerah perifer, masuk ke dalam akson dan melalui transpor retr ograde intraneural mencapai nervus cell body di batang otak dan spinal cord. Toksin mengalami migrasi dari daerah sinap ke terminal presinap. Di daerah presinap toksin memblok pelepasan inhibitor neurotransmiter glisin dan gamma-aminobutyric acid (GABA) dengan cara memecah protein yang penting untuk fungsi pelepasan vesikel sinaptik. Salah satu protein penting itu yaitu sinaptobrevin. Protein itu menyebabkan penurunan efek penghambatan dan meningkatkan resting firing rate pada neuron motor sehingga terjadi kekakuan otot (Ray 2004). Berkurangnya waktu aktivitas reflek, berakibat polisinaptik menyebar ke impul (aktivitas glicinergik). Frekuensi agonis dan antagonis lebih sering dibandingkan dengan inhibisi sehingga terjadi spasmus. Hilangnya inhibisi juga mempengaruhi neuron preganglion simpatetik di daerah lateral substansia abu-abu spinal cord dan menyebabkan hiperaktivitas simpatik dan kadar katekolamin yang bersirkulasi tinggi (Ray 2004). Regulasi sintesis dan sekresi toksin tetanus dikontrol secara ketat oleh elemen regulator yang sangat sensitif terhadap signal lingkungan. Aktivitas ekstraseluler toksin tetanus sangat tergantung pada Zn++ untuk menghambat neurotransmisi pada sinap inhibitor, sedangkan produksi toksin dipteri dipengaruhi oleh ketersediaan ion Fe pada medium pertumbuhan bakteri, ekspresi toksin cholera dan faktor virulen adesin dikontrol oleh osmolaritas dan temperatur lingkungan (Todar 2002) . 34 Imunitas Terhadap Toksin Tetanus Faktor utama ketahanan tubuh terhadap toksin adalah fungsi barier tubuh, terutama blood brain barier ketika toksin bergerak pada neural pathways, barier uterin dan intestinal. Makrofag sebagai pertahanan utama terhadap kuman, tetapi kehadiran toksin dapat mengganggu pelepasan lisosim dari makrofag. Imunitas spesifik tidak berkembang pada pasien surviving karena jumlah toksin yang menyebabkan sakit tidak banyak untuk dapat imunogenik, toksin yang diproduksi secara insitu selalu berikatan pada reseptor pada nervus terminal yang menginervasi area itu (Bizzini 1993). Toksin tetanus merupakan antigen yang sangat baik, dan dapat dibuat antitoksin pada serum dengan titer tinggi. Kuda adalah produser antitoksin tetanus yang sangat baik. Pemakaian antitetanus kuda harus hati-hati jika pasien menderita alergi seperti asma atau eksem infantile atau alergi terhadap semua injeksi antiserum (Schroder dan kuhlmann 1991; Maple et al. 2001). Untuk dapat digunakan sebagai vaksin, toksin harus dihilangkan sifat toksisitasnya tanpa mengurangi sifat antigeniknya melalui perlakuan tertentu, seperti formalin, iodine, pepsin, asam askorbat, dan keton. Toksoid bersifat inaktif sehingga memerlukan adjuvan untuk stimulasi sistem imun (Bizzini 1983). Pada domba, imunisasi awal memerlukan dua kali dosis dengan interval pemberian empat sampai enam minggu. Imunisasi pertama dapat diberikan dosis sensitizing dan imunisasi kedua dapat diberikan dosis confirming (dosis yang diperkuat). Imunisasi ketiga diberikan satu tahun kemudian (Bizzini 1993). Kekebalan akan berkurang dalam periode tahun dan memer lukan boster secara berkala setiap lima tahun (Lewis 1998). Pada manusia imunisasi pertama diberikan saat umur dua tahun kemudian diulang setiap 10 tahun (Anonim 2003). Vaksin generasi baru yang telah dikembangkan dibuat dari C-terminal (fragmen C) rantai berat toksin tetanus yang diinaktivasi menggunakan formaldehid, fragmen ini tidak toksik dan mampu meningkatkan fungsi netralisasi antibodi (Marvaud et al. 1998). Kadar imunitas antitetanus berdasarkan atas memori imunologis yang bervariasi dan sangat tergantung umur, dengan bertambahnya umur dalam suatu populasi kemungkinan terserang infeksi tetanus tinggi (Schatz et al. 1998; Matos et al. 2002). 35 Pencegahan dengan Antitoksin Pada kedokteran hewan, penggunaan antitoksin untuk pencegahan penyakit member ikan hasil yang memuaskan. Pemberian imunisasi pasif dan dikombinasikan dengan imunisasi aktif juga baik. Standar internasional kandungan antitoksin tetanus tiap ampul adalah 120 IU (Sesardic et al. 1993). Antitetanus serum direkomendasikan dapat diberikan secara kontinyu pada orang yang mudah mendapat tetanus dari luka, terutama yang mempunyai sejarah imunisasi tidak lengkap atau status imunisasinya tidak jelas (Porter et al. 1992). Pemberian imunoglobulin (ATS) harus diikuti dengan imunisasi untuk pengobatan tetanus yang sering terjadi mengikuti kejadian luka, hal ini untuk mendapatkan kekebalan dalam waktu lebih panjang karena kekebalan dari imunisasi tetanus baru muncul 7 hari post imunisasi (Forrat et al. 1998). Pengobatan terhadap luka yang beresiko terkontaminasi infeksi tetanus dengan cara imunisasi aktif, manajemen pengobatan luka lokal, dan imunisasi pasif. Imunisasi pasif awalnya berkembang mulai abad ke-20, dan masih relevan sampai saat ini untuk pencegahan tetanus pada pasien yang mendapat luka. Hal itu juga dilakukan pada pasien penderita tetanus (Forrat et al. 1998). Proteksi untuk melawan efek letal toksin tetanus hanya dapat diproduksi dari dosis antigen yang sangat tinggi diikuti dengan imunisasi dengan bakteri hidup yang telah dilemahkan (Grangette et al. 2001). MATERI DAN METODE Lokasi dan Waktu Penelititan Penelitian dilakukan di laboratorium Imunologi Departemen Kitwan Fakultas Kedokteran Hewan Institut Pertanian Bogor , Laboratorium Uji Hewan PT Biofarma Bandung, dan Klinik Hewan Fakultas Kedokteran Hewan Universitas Udayana, berlangsung selama 27 bulan, dari bulan Januari 2004 sampai Maret 2006 Materi Hewan Percobaan Penelitian ini menggunakan ayam layer pulet (siap telur) jenis Isa brown berumur 34 minggu untuk produksi IgY antitetanus, dan mencit (Mus mu scculus L) strain DDY umur 4 sampai 5 minggu dengan kisaran berat badan 15 sampai 17 gram untuk uji potensi antitetanus dan uji tantang (in vivo). Pakan yang diberikan pada ayam adalah pakan komersial produksi PT Charoen Pokhpand jenis CP 324 sebanyak 60 gram/ekor/hari. Sedangkan untuk mencit diberikan pakan berbentuk pelet standar untuk pakan hewan laboratorium PT Biofarma Bandung, diberikan sebanyak 6 gram/ekor/hari dan air minum diberikan secara ad libitum. Ayam dipelihara pada kandang individual, dibuat dari besi dengan sistem baterai 40 x 30 x 60 cm. Kandang mencit dibuat dari kotak plastik berukuran 30 x 60 x 15 cm untuk enam ekor mencit. Pemeliharaan mencit dilakukan dalam ruang tertutup dengan suhu 25 o C sampai 26 oC dan kelembaban 54% sampai 60%, dengan penerangan selama 10 jam/hari. Toksoid Tetanus Toksoid tetanus dibuat dari toksin tetanus yang diisolasi dari mikrob C. tetani strain Massachuset, diproduksi oleh PT. Biofarma Bandung. Mikrob itu ditanam pada medium Pitmann, kemudian dibiakkan dala m fermentor yang diisi medium sintetik. Fermentasi dilakukan selama 8 hari pada suhu 34 o C sampai 35 o C. Setelah diproduksi toksin dengan limit flocciculi (Lf) cukup tinggi kultur 37 dipanen, disaring dan filtrat yang mengandung toksin ditampung dalam vessel. Detoksifikasi dilakukan dengan penambahan formalin sedemikian sehingga didapatkan konsentrasi 0.5%, dieramkan selama 4 minggu pada suhu 37 oC. sekali-sekali dihomogenkan. Setelah lolos dari uji toksisitas, cairan toksoid diultrafiltrasi dalam Amicon hollow fibre menghasilkan toksoid pekat. Pemurnian dilakukan dengan pengendapan amonium sulfat (Nasution et al. 1987). Bahan Bahan-bahan yang digunakan adalah bahan untuk uji imunodifusi yaitu : Agarose (Serva, Jerman), Polyethylene glikol 6000 (Merck, Jerman), Phosphate Buffer Saline (Merck, Jerman) pH 7.2, Aquadest, NaCl fisiologis (Merck, Jerman), NaN3 (Merck, Jerman). Bahan untuk pemurnian protein yaitu : Chloroform (Merck, Jerman), Phosphate Buffer Saline (Merck, Jerman) 100 mM dengan pH 7.6, Polyethy lene glikol 6000 (Merck, Jerman), NaCl fisiologis (Merck, Jerman), kantong dialisis (SIGMA), kolom Hi-trap IgY (Amersham Bioscience) spesifik untuk IgY , Potassium sulfat (K2SO4 ) (Merck, Jerman), NaH2PO4 (Merck, Jerman), propanol (Merck, Jerman), etanol, dan air bebas ion. Bahan untuk uji Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) menggunakan Tetra Methyl Etilen Diamin (TEMED) (Merck, Jerman), Acrylamide (Merck, Jerman), Bisacrylamide (Merck, Jerman), Sodium Dodecyl sulfat (SDS) (Merck, Jerman), Tris HCl dan ammonium ferosulfat dan alkohol 70%. Serta bahan-bahan untuk enzyme linkage immunosorbent assay (ELISA) yaitu NA2 CO 3 (Merck, Jerman), NaHCO (Merck, Jerman), air deionisasi, NaCl (Merck, Jerman), KCl (Merck, Jerman), NaHPO4 (Merck, Jerman), KH 2PO4 (Merck, Jerman), Tween 20 (SIGMA), citrate phosphate buffer (C6H 8O7H2O) (SIGMA), ABTS (2.2-azino-di 3 ethylbenzothiazoline -6-sulphonic acid) (SIGMA), Bovine Serum Albumin (BSA) (SIGMA), H2O2 (Merck, Jerman). Peralatan Peralatan yang digunakan dalam penelitian ini adalah syringe volume 3 ml, 1 ml dan 10 ml (Terumo®), tabung reaksi, tabung sentrifus, pipet 1 ml, 5 ml. 10 ml, mikropipet (efendorf ®), mikrotip, gelas obyek, kandang ayam dan mencit 38 beserta kelengkapannya, refrigrator (Sa nyo Medicool), tabung Eppendorf, botol volume 3 ml, sentrifus (Himac and Kokusan H-1500 DR), penangas air (Eyela NTS – 1300), petridish, gel puncher, inkubator, timbangan, dan gelas ukur. Metode Produksi IgY pada Telur Ayam Produksi IgY menggunakan 5 ekor ayam betina dewasa siap bertelur ya ng dipelihara dalam kandang baterai dan diberi pakan komersial standar CP 324 dan air minum secara ad libitum. Ayam diimunisasi dengan toksoid dosis bertingkat (Guidolin et al. 1998; Matos et al. 2002). Imunisasi perta ma secara intra vena dengan dosis 15 Lf tanpa adjuvan kemudian dilanjutkan secara intra muskular dengan interval satu minggu. Pada minggu pertama secara intra muskular ayam diimunisasi dengan toksoid tetanus dosis 100 Lf dan dilakukan pengulangan pada minggu kedua dengan dosis toksoid 200 Lf serta minggu ketiga dengan dosis toksoid 300 Lf. Penyuntikan pertama, toksoid dicampur dengan Freund adjuvant complete dan penyuntikan selanjutnya dengan Freund adjuvant incomplete . Semua ayam diambil darahnya melalui arteri daerah sayap sebanyak 2 ml, dengan menggunakan spuite setiap minggu. Darah dalam spuite diinkubasikan dalam suhu 37 0C atau suhu kamar selama 1 jam kemudian diinkubasikan dalam suhu 4 0 C selama 24 jam. Serum dipisahkan dari bekuan sel-sel darah, kemudian dilakukan deteksi antibodi spesifik dengan uji AGP terhadap toksoid dan titernya. Bila antibodi dalam darah sudah terdeteksi, maka telur yang dihasilkan dikoleksi. Ekstraksi IgY dari Kuning Telur Metode PEG – kloroform Kuning telur dipisahkan dari bagian putih telur, dan dicuci dengan air deionisasi. Kuning telur diletakkan di atas kertas saring untuk menghilangkan putih telur yang masih melekat. Membran kuning telur dilubangi dengan cara diangkat dengan pinset dan cairan kuning telur ditampung pada tabung dengan volume 50 ml. Tambahkan 25 ml sodium phosphat buffer (100 mM, pH 7.6) dan campurkan secara perlahan. Selanjutnya tambahkan 20 ml kloroform dan campur secara perlahan sampai terlihat bentukan semisolid. Larutan itu disentrifus dengan 39 kecepatan 1200 g selama 30 menit. Supernatan diambil dan tambahkan PEG 6000 sehingga didapat konsentrasi akhir 12% (w/v). Larutan itu kemudian disentrifus dengan kecepatan 15 700 g selama 10 menit. Supernatan dibuang dan pelet diresuspensikan dengan 2 ml PBS. Selanjutnya dilakukan dialisis selama 24 jam dalam larutan PBS pH 8. Tampung larutan hasil dialisis dan tambahkan dua tetes 0.1% Na azide, dan simpan pada suhu – 80 oC (Comenisch et al. 1999). Purifikasi Ig Y Purifikasi dilakukan dengan fast protein liquid chromatography (FPLC) mengunakan alat Hi-trap IgY (Amersham Bioscience). Semua selang pada alat FPLC dicuci dengan etanol 20% selanjutnya dengan air bebas ion untuk menghilangkan sisa -sisa protein dan zat lainnya supaya tidak mengkontaminasi bahan yang akan dipurifikasi. Matriks dalam kolom dibilas dengan buffer K 2 SO4 0.5 M dalam larutan NaH2PO4 20 mM dengan pH 7.5. Sampel IgY hasil ekstraksi dilarutkan dengan buffer K2SO4 0.5 M kemudian dimasukkan ke dalam kolom Hi Trap IgY Purification Hp 5 ml yang telah terpasang pada alat sebanyak 2 ml. Alirkan larutan binding (K2 SO4 0.5 M dalam larutan NaH 2PO4 20 mM pH 7.5) ke dalam kolom untuk memberikan kesempatan matriks dalam kolom mengikat IgY dan protein-protein selain IgY akan lolos dan dibuang. Selanjutnya dilakukan elusi terhadap IgY yang telah terikat pada matriks dengan larutan NaH2PO4 20 mM pH 7.5. Imunoglobulin Y yang terelusi akan terdeteksi oleh monitor absorban yang ditandai dengan naiknya garis sampai terbentuk garis puncak. Setiap fraksi dari larutan itu ditampung pada tabung di alat fraksimeter. Fraksi yang berisi larutan konsentrasi puncak diambil, dipekatkan kembali ke volume awal dan didialisis selama 24 jam dalam larutan PBS pH 8 untuk menghilangkan garamgaram yang ikut terlarut. Matriks dicuci dengan larutan propanol 30% (Cleaning buffer) dalam larutan NaH 2PO4 20 mM pH 7.5. Identifikasi Kemurnian Ig Y Identifikasi kemurnian Ig Y ditentukan secara colorimetri (λ = 595 nm), uji Agar Gel Presipitation (AGP) dan analisis pita protein dengan Sodium 40 Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) (Wibawan et al. 2003). Metode Bradford Metode ini berdasarkan pengikatan protein pada larutan dye coomassie brilliant blue. Pada pH rendah larutan dye yang bebas diabsor psi secara bebas pada panjang gelombang 470 dan 650 nm, tetapi setelah berikatan dengan protein diabsor psi secara maksimum pada panjang gelombang 595 nm (Wilson dan Walker 2000). Larutan Bradford dibuat dengan cara : sebanyak 100 mg comassie brilliant blue dicampur dengan 50 ml ethanol 95%, dan asam orto fosfat 85% kemudian diencerkan dengan akuades sampai satu liter. Campuran larutan itu disaring dengan kertas saring. Larutan itu merupakan larutan stok lima kali dan disimpan pada suhu 4 oC. Jika mau digunakan, encerkan satu bagian larutan stok dengan empat bagian akuades. Pemeriksaan sampel dilakukan dengan cara : 100 µl sampel dilarutkan dengan satu ml larutan Bradford, diinkubasikan selama 10 menit, kemudian diperiksa pada spektrofotometer dengan panjang gelombang 595 nm. Kurva standar dibuat dari pengenceran BSA (bovine serum albumin ) kemudian dibuat persamaan regresinya yaitu : Y = ax + b, Y adalah besarnya absorpsi, a adalah koefisien regresi, x adalah konsentrasi sampel dan b adalah suatu konstanta . Uji Imunodifusi Uji ini disebut uji AGP (agar gel presipitation). Medium dibuat dari campuran 0.4 g agarose (Serva, Jerman), 1.2 g PEG 6000 (Merck, Jerman), 20 ml aqudes dan 20 ml PBS dengan pH 7.2 (Merck). Campuran tersebut ditangas pada air mendidih sampai jernih. Dengan menggunakan pipet 10 ml, agar cair tersebut dituang di atas petridis atau cetakkannya dan dibiarkan sampai mengeras. Setelah mengeras dibuat lubang-lubang untuk tempat antigen dan antiserum dengan menggunakan alat gel puncher. Ke dalam lubang-lubang tersebut diisikan antigen (lubang tengah) dan antiserum dilubang sekitarnya. Sediaan kemudian diletakkan di tempat yang lembab, kemudian diamati terjadinya presipitasi setelah disimpan 41 selama 24 jam. Adanya garis presipitasi menunjukkan antara antiserum dan antigen tersebut terjadi reaksi homolog. Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) Untuk mengetahui pola protein dari IgY yang terbentuk dilakukan karakterisasi dengan elektroforesis SDS-PAGE terhadap IgY yang telah dimurnikan. Prosedur elektroforesis sebagai berikut : Pembuatan gel pemisah (running gel) konsentrasi 10% terdiri dari : 14 ml akrilamid stock 30% ditambah 10 ml aquades; 5 ml larutan 3 M Tris HCl pH 8.9; 0.4 ml larutan Sodium Dodecyl Sulphate (SDS) 10%; 0.02 ml TEMED; 14.4 ml aquades dan 0.4 ml larutan amonium persulfat (0.5 g dalam 4.5 ml aquades, harus selalu dalam keadaan baru dilarutkan). Setelah gel pemisah mengeras disiapkan gel pengumpul (stacking gel) yang terdiri dari: 1 ml akrilamid stock 30%; 7.54 ml aquades; 1.25 ml larutan 0.5 M Tris HCl, pH 7; 0.1 ml larutan SDS 10%; 0.005 ml TEMED dan 0.1 ml larutan amonium persulfat (0.5 g dalam 4.5 ml aquades, harus selalu dalam keadaan baru dilarutkan). Untuk preparasi gel pengumpul dicetak dengan bantuan “sisir” (comb) untuk membuat sumur-sumur tempat memasukkan contoh yang akan dipisahkan. Ketebalan gel yang dibuat adalah 4 mm. Setelah gel mengeras, sisir diangkat. Preparasi sampel menggunakan bufer disosiasi (Dissociation Buffer) yang terdiri dari 10 ml SDS 10%; 5 ml gliserin ; 5 ml Tris HCl 0.5 M pH 8.8; 0.5 ml bromphenol blue; 0.5 ml 2-Mercaptoethanol; 10 ml aquades. Sebanyak 100 µl sampel dicampur dengan 100 µl buffer disosiasi atau 25 µl sampel dicampur dengan 200 µl buffer disosiasi (disesuaikan dengan kandungan protein sampel). Untuk sampel dengan konsentrasi protein rendah digunakan buffer disosiasi yang dipekatkan lima kali konsentrasi awal, yang terdiri dari : 1.25 ml Tris 2 M pH 8.8 didalam 10% SDS; 0.4 ml Bromphenol blue 5%; 0.5 ml 2-Mercaptoethanol dan 5 ml glycerin. Sebanyak 200 µl sampel dicampur dengan 25 µl buffer contoh. Sebelum dimasukkan ke dalam sumur gel, sampel dipanaskan selama 2 menit kemudian ditambahkan 2 tetes 2-Mercaptoethanol dan divortek. Dipanaskan kembali selama 5 menit (sampel siap untuk di lalukan). Sebanyak 20 µl sampel dimasukkan ke sumur-sumur yang telah tersedia pada gel. 42 Proses pemisahan protein menggunakan buffer pemisah (running buffer) yang terdiri dari Tris HCl 0.025 M/l; glycine 0,192 M/l dan SDS 0.1% pH 8.8. Pemisahan dilakukan pada kekuatan arus 30 sampai 40 mA dengan voltage maksimum untuk setiap gel dalam kodisi dingin (ke dalam alat elektrophoresis dialirkan air es) selama 4 jam atau jika zat warna contoh telah hampir sampai (jangan sampai melewati) ujung bawah gel pemisah. Setelah elektroforesis selesai, gel difiksasi dengan larutan Tricloroacetic acid (TCA) konsentrasi 12% selama 24 jam. Gel diwarnai dengan larutan 0.25% biru komasi yang dilarutkan dalam 55 ml methanol dan 7.5% asam cuka dalam 1 liter akuades. Pewarnaan dilakukan selama 24 jam (digoyang di atas titertek), setelah itu, gel dipucatkan dengan larutan yang terdiri dari campuran metanol, asam cuka dan akuades dengan perbandingan 5 : 4 : 1 sambil digoyang-goyang selama 24 jam (diamati setiap 1jam) Teknik ELISA Teknik enzyme linked immunosorbent assay (ELISA) digunakan untuk mengetahui aktivitas IgY, terutama untuk mengetahui antibodi yang aktif dari keseluruhan fraksi IgY. Prinsip dari ELISA adalah antigen ditutupi bagian permukaannya. Antibodi sampel diikatkan pada antigen. Ikatan dari sampel antibodi itu dideteksi dengan antibodi yang telah diberi label. Jumlah ikatan dari antibodi itu di hitung dari ikatan antibodi yang telah diberi label. Teknik ELISA yang digunakan sesuai dengan Carlander (2002) dengan beberapa modifikasi, Secara lebih detail adalah sebagai berikut: Mikrotiter plate (dasar cembung) dilapisi dengan 50 uL antigen. Konsentrasi larutan yang diinginkan adalah 2 sampai 10 µg/ml dalam 0.1 M NaHCO3, pH 9.5. Plate kemudian diinkubasikan selama 24 jam pada suhu 4oC. Plate kemudian dicuci sebanyak empat kali dengan 0.15 M NaCl, 0.02 M NaHPO4 , 0.01% Tween 20, pH 7.2 (PBS-T) yang khusus digunakan sebagai larutan pencuci dalam ELISA. Plate kemudian diblok dengan 100 µL Bovine serum albumin 1% dalam 0.1 M NaHCO3 , pH 9.5 selama 90 menit pada suhu 37 o C. Pemblokan dilakukan untuk mencegah antibodi berikatan dengan tempat yang berada diluar tempat ikatan. Kemudian plate dicuci sebanyak empat kali dengan 43 PBS-T dan 50 µL sampel yang telah dilarutkan dalam PBS-T ditambahkan ke setiap lubang dari plate yang dibuat duplikat atau triplikat. Plate diinkubasikan selama satu jam dalam suhu 37 oC, setelah itu dicuci lagi sebanyak empat kali dengan PBS-T. Selanjutnya 50 µL antibodi yang telah dilabel di masukkan ke dalam lubang plate dan diinkubasikan selama satu jam pada suhu 37 oC, kemudian ditambahkan substrat peroksidase sebanyak 100 µL. Plate dibaca setelah 30 menit dengan spectraMax panjang gelombang 415 nm . Aktivitas Biologis IgY. Aktivitas biologis IgY diuji terhadap pengaruh pH, panas dan enzim pencernaan seperti pepsin, tripsin, dan protease. Setelah perlakuan dengan pH, panas, dan enzim aktivitas biologis dari IgY diuji dengan ELISA dan SDS-PAGE. Pengujian ini perlu dilakukan berkaitan dengan kemungkinan aplikasi pencegahan secara oral . Uji Aktivitas IgY Setelah perlakuan pH Masing-masing larutan IgY dilakukan perlakuan pH 2, pH 3, pH 7,dan pH 9. Pada pH 2 ditambah dengan 10 µl HCL 25%, pH 3 ditambah dengan 5 µl HCL 25%, pH 7 tanpa penambahan apapun, dan pH 9 ditambah dengan 12 µl NaOH. Diinkubasi selama 15, 30, 45, 60, dan 120 menit pada suhu 37 ºC, setelah inkubasi pH larutan perlakuan dikembalikan ke pH 7. Aktivitas IgY setelah perlakuan diuji dengan metode enzym linked imunosorbent assay ( ELISA). Uji Aktivitas IgY Setelah Perlakuan Suhu Masing-masing larutan IgY dilakukan perlakuan suhu. Tiap botol dipanaskan di waterbath selama 5, 10,15, dan 20 menit pada suhu 50 ºC, 60 ºC, 70 ºC, 72.5 ºC, 75 ºC, 80 ºC, 90 ºC dan 100 ºC. Setelah habis waktu pengamatan, sampel diambil dan langsung dicelupkan pada icebath untuk menghentikan reaksinya. Sampel diuji aktivitasnya dengan metode Elisa. 44 Uji Aktivitas IgY Setelah Perlakuan Enzim Pepsin, Tripsin, dan Protease Masing-masing larutan IgY dengan dosis 15 µg/ml diberi perlakuan enzim pepsin. Tiap botol ditambahkan dengan 45 µl enzim pepsin dan untuk mengaktifkan kerja enzim ditambahkan dengan 10 µl HCL 25% sehingga larutan pH 2. Larutan tersebut kemudian divorte k dilanjutkan dengan inkubasi pada 37 ºC selama 30, 60, dan 120 menit. Setelah inkubasi masing-masing sampel dinetralkan dengan 5 µl NaOH 30%. Sedangkan untuk perlakuan enzim tripsin dan protease , masing-masing sampel ditambahkan dengan 45 µl enzim trips in dan protease untuk mengaktifkan kerja enzimnya ditambahkan dengan 12 µl NaOH 0.1% sehingga pH menjadi 8. Kemudian sampel divortek dan diinkubasi pada 37 ºC selama 30, 60, dan 120 menit. Setelah inkubasi masing-masing sampel dinetralkan dengan menambahkan 2 µl HCL 25% sehingga pH menjadi 7. Uji Potensi IgY Potensi IgY antitetanus ditentukan dari : perbandingan jumlah yang diperlukan antara IgY antitetanus dengan ATS standar untuk melindungi mencit (berat badan berkisar 17 g sampai 22 g) dari efek dos is paralitik (Lp/10) dari toksin (Brit 2002). Dalam penelitian ini digunakan standar toksin tetanus dari WHO (PT Biofarma 2003). Penentuan potensi IgY anti tetanus Sediaan antitoksin tetanus standar diencerkan dengan larutan NaCl fisiologis sehingga kandungan antitoksin tetanus standar dalam larutan adalah 1 IU/ml. Sediaan sampel uji (IgY antitetanus) diencerkan dengan NaCl fisiologis sampai diperoleh konsentrasi larutan sekitar 1 IU/ml. Toksin tetanus standar dilarutkan dengan PBS sehingga kandungan toksin tetanus dalam larutan 0.4 IU/ml. Siapkan sepuluh buah tabung reaksi volume 10 ml, masing – masing lima tabung untuk mencapur larutan toksin tetanus dengan IgY antitetanus yang akan diuji dan lima buah tabung untuk sediaan antitoksin tetanus standar untuk kontrol. Dibuat lima seri pengenceran dari standar antitoksin tetanus dan IgY antitetanus dengan faktor pengenceran 1.10 sedemikian sehingga volume akhir setelah ditambah 2 ml larutan toksin 0.4 IU/ml menjadi 4 ml setiap tabung. Ditambahkan 45 sebanyak 2 ml toksin tetanus standar pada setiap tabung reaksi, kemudian vortek dalam beberapa detik. Campuran dibiarkan dalam posisi tegak, dalam suhu ruang, dan terlindungi dari sinar selama selama 60 menit. Masing–masing campuran larutan tiu diinjeksikan sebanyak 0.5 ml secara subkutan pada mencit. Setiap campuran larutan itu memerlukan 6 ekor mencit untuk pengujian. Amati dan catat jumlah mencit yang hidup selama lima hari masa observasi. Penghitungan potensi IgY antitetanus dilakukan dengan metode Spearman-Karber berdasarkan jumlah mencit yang bertahan hidup hingga akhir masa observasi dan dinyatakan dalam satuan internasional unit (IU) per mililiter. Rumus perhitungan PD50 adalah sebagai berikut : Log PD50 = - [Xo – (0.5)d + d (Ri/Ni)] Xo = Negatif Log10 dari pengenceran terendah, semua hewan uji pada kelompok tersebut memiliki respon positif. d = Log10 faktor pengenceran atau beda log10 antar pengenceran. Ri = jumlah hewan uji yang menunjukan respon positif . Ni = jumlah hewan uji setiap pengenceran. Bila uji valid maka potensi IgY antitetanus dihitung dengan kalkulasi statistik sebagai berikut : Pot ATS Uji = PD50 ATS Standar X Faktor Pengenceran ATS Uji X Pot ATS Std ( IU/ml) PD50 ATS Uji Potensi yang baik adalah tidak kurang dari 100 IU antitoksin tetanus setiap ml larutan. Batas dasar kesalahan (P= 0.95) pada perkiraan potensi berkisar antara 80% sampai 125% (Brit 2002). Uji Tantang pada Hewan Coba Uji tantang pada hewan coba dilakukan untuk melihat perbedaan daya netralisasi IgY terhadap toksin tetanus pada berbagai dosis secara in vivo menggunakan hewan model. Uji dilakukan dengan cara mencit diberi antitoxin (IgY) lewat suntikan subcutan (0.5 ml) dan secara per oral. Rancangan percobaan yang digunakan adalah rancangan acak lengkap, dengan 4 perlakuan, yaitu pemberian dengan IgY dosis 0.2, 0.4, 0.8, dan 1 IU/0.5 ml/ekor , masing-masing 46 dos is disuntikkan pada 6 ekor mencit. Masing-masing perlakuan ditantang dengan toksin tetanus dosis 0.1, 0.2, 0.3, 0.4 IU/0.5ml/ekor . Perlakuan secara per oral, mencit dibagi ke dalam tiga kelompok, masing-masing diberikan telur matang 0.5 ml sebanyak satu, dua , dan tiga hari (sekali sehari), kemudian ditantang dengan toksin tetanus seperti perlakuan secara subkutan. Peubah yang diamati yaitu angka kesakitan dan angka kematian dari mencit, gejala klinis tetanus yaitu gemetar, punggung bengkok, kaki pincang, dan lock jaw, berat badan, feed intake, refleks dan laju respirasi. Pengamatan dilakukan selama lima hari. Berat badan diperoleh dengan menimbang mencit setiap hari dengan timbangan analitik. Feed intake dihitung dari selisih antara jumlah pakan yang diberikan pada hari ke (n) dan jumlah pakan yang tersisa pada hari ke (n-1) dibagi dengan jumlah mencit yang hidup. Refleks diamati pada hari kelima dari kemampuan mencit bertahan di air untuk berenang. Kemampuan berenang diukur dari saat mencit diletakan di air sampai mencit berhenti menggerakan kaki. Laju respirasi diamati pada hari ke -0, hari ke-3 dan hari ke-5. Laju respirasi diukur dengan alat respirometer Scholander untuk mamalia kecil dengan indikator penunjuk adalah larutan Brodie. Data yang diperoleh dianalisis dengan program SPPS 10.0 for window. HASIL DAN PEMBAHASAN Produksi IgY Antitetanus pada Telur Ayam Produksi IgY antitetanus dilakukan dengan menyuntikkan toksoid tetanus dosis bertingkat selama 4 minggu. Toksoid tetanus diperoleh dari PT Biofarma (Persero) Bandung dengan konsentrasi 2000 Lf /ml. Antigen toksoid diemulsikan dengan Freund’s adjuvant. Antibodi spesifik terhadap toksoid tetanus pada serum ayam dideteksi dengan menggunakan uji agar gel presipitasi (AGP) (Gambar 8). Antibodi mulai terdeteksi minggu kelima dan tidak terdeteksi lagi minggu kesembilan dari imunisasi awal (Tabel 3). Setelah dilakukan pengulangan imunisasi, seminggu kemudian IgY antitetanus terdeteksi lagi. Sedangkan telur mulai dikoleksi seminggu setelah IgY antitetanus positif di serum. Mgg 1* 2* 3* 4* 5 6 7 8 9** 10 11 Tabel 3 Hasil uji AGP serum 1 2 3 + + + + + + + + + + + + + + + + IgY antitetanus pada serum dan telur ayam telur 4 5 1 2 3 4 *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** + + *** *** *** *** + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + 5 *** *** *** *** *** + + + + + Keterangan * Waktu imunisasi * * Imunisasi ulang *** belum dilakukan koleksi telur + terjadi garis presipitasi pada agar AGPT tidak terjadi garis presipitasi pada agar AGPT Titer IgY antitetanus mencapai puncak dalam serum pada minggu keenam, sedangkan dalam telur pada minggu ketujuh dari awal imunisasi (minggu ketiga sejak mulai terdeteksi di serum). Rataan total titer IgY spesifik antitetanus pada serum adalah 13.84 ± 2.89 IU/ml sedangkan pada telur adalah 28.23 ± 7.62 IU/ml. Rataan titer tertinggi dari kelima ayam pada serum 34.53 ± 14.94 IU/ml dan terendah 2.68 ± 1.32 IU/ml. Pada telur rataan titer tertinggi dari kelima ayam adalah 80. 16 ± 33.55 IU/ml dan terendah 1.69 ± 0.63 IU/ml (Gambar 7). 48 Titer IgY antitetanus Titer (IU/ml) 100 80 60 serum 40 telur 20 0 1 2 3 4 5 6 7 8 9 10 11 Minggu Gambar 7 Rataan titer IgY antitetanus pada serum dan telur. Titer IgY antitetanus dalam serum mengalami penurunan pada minggu kedelapan. Hasil uji AGP (Tabel 3) menunjukkan nilai negatif pada beberapa sampel, tetapi pada pemeriksaan ELISA konsentrasinya masih tinggi yaitu berkisar antara 0.18 IU/ml sampai 2.68 IU/ml. Kristiansen et al. (1997) melaporkan efek toksik dari kuman tetanus tidak terjadi pada penderita yang memiliki konsentrasi antitetanus dalam serum di atas 0.01 IU/ml. 2 2 2 1 2 2 2 Gambar 8 Hasil uji imunodifusi IgY antitetanus Ayam. (1) toksoid tetanus, (2) IgY antitetanus ayam. Hasil positif ditandai dengan terbentuknya garis presipitasi antara toksoid tetanus (1) dengan sampel (2). Imunogenitas suatu bahan berhubungan langsung dengan berat molekul. Bahan dengan berat molekul lebih besar dari 5 kDa adalah imunogen yang baik, bahan dengan berat molekul 4.5 kDa imunogen yang jelek dan dengan berat molekul kurang dari 1 kDa tidak imunogenik. Jumlah antigen yang umum dipakai untuk imunisasi adalah 50 sampai 100 ug (Liddell dan Weeks 1995) . Pada penelitian ini toksoid yang digunakan mempunyai berat molekul 150 kDa dengan jumlah 300 Lf per ekor. Sehingga dari syarat berat molekul sudah memenuhi sebagai imunogen yang baik. 49 Gambar 7 memperlihatkan titer IgY antitetanus pada serum mengalami penurunan mulai minggu ketujuh walaupun dengan uji AGP masih positif. Penurunan secara nyata terjadi pada minggu ke sembilan. Begitu juga halnya dengan titer IgY antitetanus pada telur, penurunan pada minggu kesembilan sangat nyata dibandingkan minggu sebelumnya dan terjadi peningkatan pada minggu kesepuluh setelah imunisasi ulang. Beberapa faktor yang berpengaruh terhadap terbentuknya antibodi adalah umur hewan, ukuran molekul antigen, kerumitan struktur kimiawi antigen, genetik, rute imunisasi, dan dosis antigen, serta waktu dan jumlah pengulangan imunisasi (Liddell dan Weeks 1995; Behn et al. 1996). Struktur antigen bakteri utuh lebih kompleks dan rumit sehingga dengan dosis yang sedikit mampu merangsang antibodi dibandingkan dengan komponen metabolit bakteri atau komponen sel bakteri. Kapsul bakteri S equi subsp. Zooepidemicus yang tersusun atas asam hyaluronat kurang imunogenik karena komponen biokimiawi penyusun asam hyaluronat terdiri atas ulangan polisakarida yang sama dengan struktur oligosakarida kompleks hanya pada bagian tertentu saja (Wibawan et al.1999). Begitu juga halnya dengan toksoid yang merupakan metabolit bakteri strukturnya sederhana sehingga mudah dipecah oleh enzim dalam tubuh. Rawendra (2005) melaporkan imunisasi pada ayam menggunakan antigen whole cel l EPEC K1.1 secara intravena tanpa penambahan adjuvan, antibodi dalam serum sudah dideteksi pada hari ketujuh, dan tetap bertahan sampai minggu kedelapan. Sedangkan Paryati (2006) melaporkan penggunaan antigen idiotipe virus rabies, antibodi pada serum ayam baru muncul pada minggu ketujuh, dan antibodi masih terdeteksi selama 10 min ggu. Penggunaan venom sebagai antigen yang dicampur adjuvan komplit, dilaporkan antibodi terdeteksi dua minggu setelah vaksinasi. Titer antibodi meningkat setelah imunisasi boster dan tetap tinggi sampai 24 minggu (Almeida et al. 1998). Aplikasi imunisasi secara intravena memerlukan dosis antigen dua kali lebih tinggi diba ndingkan dengan imunisasi intramuskular dan konsentrasi antibodi di serum cepat turun. Ayam diimunisasi dengan antigen whole blood tanpa menggunakan adjuvan didapatkan titer yang tinggi empat minggu setelah vaksinasi pertama dan tetap stabil selama 7 minggu (Gutierrez et al. 2001). 50 Carlender (2002) melaporkan penggunaan adjuvan menyebabkan titer antibodi pada serum tetap tinggi sampai 6 bulan. Ayam yang di imunisasi dengan rotavirus terus bertelur tanpa ada perubahan periode bertelur. Produksi anti HRV pada ayam menunjukkan 15 sampai 20 kali lebih efektif dibandingkan diproduksi pada kelinci dengan titer netralisasi dalam kuning telur tetap tinggi dalam jangka waktu lebih dari setahun (Hatta et al. 1993). Sedangkan Chang et al. (1999) melaporkan imunisasi secara intra muskular dengan adjuvan mampu meningkatkan antibodi 10 kali lebih tinggi dibandingkan imunisasi secara subcutan. Penurunan kadar antibodi dalam serum merupakan cermin dari hilangnya populasi sel plasma penghasil antibodi spesifik. Setiap berdiferensiasi penuh, sel plasma mati setelah tiga sampai enam hari, dan antibodi yang dihasilkan menurun karena proses katabolisme (Tizard 1988). Efektivitas produksi antibodi pada serum tergantung atas pelepasan antigen yang konstan untuk merangsang sistem imun. Substansia yang digunakan untuk itu adalah adjuvan(Behn et al. 1996). Injeksi antigen tiga kali berturut-turut setiap 4 minggu tanpa pemberian adjuvan menimbulkan titer antibodi rendah, titer antibodi yang tinggi dicapai pada imunisasi menggunakan adjuvan (Behn et al. 1996). Penggunaan Freund’s adjuvant komplit dan tidak komplit yang dicampur antigen merangsang terbentuknya titer antibodi tinggi pada serum dan telur ayam. Komponen penyusun Freund’s adjuvant komplit adalah minyak mineral, deterjen, dan mikobakterium mati. Minyak mineral bersifat hidrofobik cenderung tertahan pada tempat injeksi dan lambat diabsor psi, droplet dari minyak ini akan disingkirka n secara perlahan oleh makr ofag sistem retikuloendotelial sehingga antigen yang terkandung dapat secara maksimal memapar sistem imun. Deterjen berfungsi mempertahankan emulsi minyak mineral dengan antigen. Emulsi air dalam minyak lebih baik dibandingkan minyak dalam air, sehingga komposisi perbandingan adjuvan dengan antigen dianjurkan 2 : 1 atau lebih. Mikobakterium yang telah mati menyebabkan rangsangan nonspesifik terhadap sistem retikuloendotelial dan sistem imun dengan cara proliferasi makrofag dan limfosit secara lokal dan sistemik. Bahan aktif lain yang sering digunakan pada adjuvan adalah bordetella pertusis , corynebakterium parvum, dan levamisol. Vaksin rekombinan hepatitis B dicampur dengan adjuvan aluminium hydroxide 51 (AL2(HO)3) juga mampu merangsang terbentuknya antibodi pada serum dan telur ayam. Freund’s adjuvant sangat kuat dalam merangsang respon imum dan digunakan hanya pada hewan coba, sedangkan adjuvan aluminum hydroxide adalah adjuvan yang aman digunakan pada manusia dan hewan (Makvandi dan Fiuzi 2002). Untuk tetap mempertahankan titer IgY antitetanus yang tinggi (hiperimun) pada serum dan telur perlu dilakukan imunisasi secara berkala. Waktu imunisasi berbeda pada masing-masing hewan. Pada mencit dilakukan setiap dua minggu, pada hewan besar bisa sampai tiap dua bulan sedangkan boster dilakukan dua minggu menjelang panen. Pada kuda imunisasi dilakukan setiap satu bulan dilanjutkan boster tiap 4 hari untuk mendapatkan titer antitetanus yang tinggi (PT Biofarma 2003). Pada mencit boster dilakukan beberapa hari menjelang panen. Pada ayam belum ada laporan secara pasti tentang waktu boster yang baik untuk mendapatkan titer yang tinggi. Sehingga perlu dilakukan penelitian lebih lanjut. Pada`pengujian selanjutnya, sampel dengan titer tinggi dikumpulkan, sedangkan sampel dengan titer rendah disingkirkan. Dari hasil pemeriksaan titer tertinggi pada serum sebesar 83.82 IU/ ml sedangkan pada telur 165.65 IU/ml (Tabel 4). Tabel 4 Hasil pengukuran titer IgY antitetanus (IU/ml) No Pengukuran 1 2 3 4 5 6 7 8 9 10 rataan Serum (IU/ml) 83. 82 36.53 19.73 12.93 21.01 45.12 38.32 11.08 9.18 19.44 Telur (IU/ml) 153.54 165.65 38.63 42.04 57.51 61.08 37.13 96.26 93.07 48.64 29.72 79.36 Titer pada telur lebih tinggi karena telur bertindak sebagai penampung dan persiapan calon anak ketika akan lahir. IgY pada telur tidak mengalami degradasi oleh enzim yang ada di kuning telur, karena ada granul-granul komponen 52 lipoproteinsakarida pada kuning telur yang melindungi IgY (Scmidt et al. 1989). Pada serum, imunoglobulin mengalami degradasi sesuai dengan waktu paruhnya. Waktu paruh dari IgY adalah 36 jam (Carlendar 2002). Ekstraksi, Purifikasi dan Karakterisasi IgY Antitetanus dari Kuning Telur Ekstraksi IgY antitetanus dari kuning telur bertujuan untuk memisahkan protein dari lemak telur. Secara umum metode ekstraksi IgY terdiri atas empat tahap : (1) pelarutan kuning telur dengan buffer, (2) pengendapan lemak, (3) pengendapan protein, (4) pelarutan endapan protein (Szabo et al. 1998). Ada bermacam-macam metode ekstraksi seperti presipitasi garam, presipitasi isoelektik, dan presipitasi dengan larutan organik. Selain metode itu protein dapat juga diendapkan dengan polimer organik. Polimer organik yang sering digunakan adalah polyethylene glycol (PEG) dengan berat molekul 6000 sampai 20 000. Pada penelitian ini ekstraksi IgY antitetanus dari kuning telur dengan teknik PEGkloroform. Langkah pertama ekstraksi IgY antitetanus dari kuning telur mengendapkan lemak telur dengan kloroform sehingga diperoleh supernata n yang mengandung IgY antitetanus berwarna jernih (Gambar 9). Kloroform merupakan senyawa nonpolar, apabila ditambahkan pada lipid dalam bentuk fase cair akan membentuk larutan lipid yang semisolid dan mengendap jika disentrifus (Wilson dan Walker 2000). A B Gambar 9 A. Penambahan kloroform pada larutan kuning telur. B. Pemisahan supernatan yang mengandung IgY antitetanus dari lemak telur yang telah mengendap. Pengendapan protein dari supe rnatan dilakukan dengan penambahan PEG 6000 sampai mencapai konsentrasi 12% (w/v) diperoleh endapan (pelet) protein 53 yang berwarna putih di dasar tabung setelah disentrifugasi. Pelet dilarutkan kembali dengan PBS dan dikoleksi (Gambar 10). A B Gambar 10 Penambahan PEG 6000 pada supernatan. B. Pemisahan pelet dari supernatan setelah disentrifuse Penambahan PEG 6000, bertujuan meningkatkan konsentrasi bahan yang mampu bersaing dengan protein untuk mengikat air, sehingga afinitas antara molekul protein meningkat, yang berakibat daya larut protein berkurang dan mengendap dengan sentrifugasi. Sedangkan komponen lain (bebas) akan tetap larut dalam air. Proses ini dipengaruhi perubahan muatan elektrostatik larutan yang sangat dipengaruhi oleh titik isoeletrik bahan dan pH (Chard 1990). Konsentrasi protein (IgY) dari ekstraksi diperoleh sebesar 0.65 ± 0.04 mg/ml (Tabel 5). Protein yang telah diisolasi dilihat pola pita proteinnya dengan SDSPAGE (Gambar 11). Berbagai teknik telah dilaporkan untuk memisahkan IgY dari komponen lemak telur. Metode PEG–Kloroform terpilih karena metode ini sangat sederhana, waktu untuk isolasi singkat, dan sangat efisien dengan kehomogenan IgY lebih dari 90%. Disamping itu kloroform juga tidak berefek terhadap aktivitas antibodi (Polson 1990). Tahapan dari setiap metode purifikasi dapat memungkinkan IgY ikut terbuang atau tertinggal pada alat atau terikutnya protein lain karena memiliki massa molekul yang sama, sehingga tidak mungkin dapat mengisolas i IgY 100% murni. Hal ini dipengaruhi oleh beberapa hal seperti : jeratan (perangkap) fisik komponen bebas di dalam kompleks komponen terikat, adanya kotoran dalam media pelarut yang memiliki struktur kimia mirip dengan komponen terikat, penyerapan ligan yang kurang terhadap komponen bebas, pemisahan komponen 54 bebas dan terikat tidak sempurna , disosiasi (terpisahnya kembali) kompleks komponen terikat (Liddell dan Weeks 1995). Tabel 5 Konsentrasi protein hasil ekstraksi dan purifikasi IgY antitetanus No Pengukuran 1 2 3 4 5 6 7 8 9 10 Rataan Ekstraksi PEG-Chloroform (mg/ml) 0.65 0.71 0.71 0.71 0.61 0.62 0.62 0.64 0.64 0.62 0.65 Purifikasi FPLC (mg/ml) 1.02 1.99 1.99 2.22 2.13 1.16 1.48 1.68 1.34 1.42 1.64 Persamaan regresi untuk pengukuran PEG- Kloroform : Y= 0.5500X + 0.0788, r = 0.975 Persamaan regresi untuk pengukuran FPLC : Y= 0.5772X - 0.0319, r = 0.987 (Y= Nilai Absorbsi pada panjang gelombang 565nM, X= Konsentrasi protein, r = koefisien regresi) Faktor-faktor yang mempengaruhi pengendapan protein adalah jumlah dan posisi grup polar, berat molekul protein, pH larutan, dan temperatur. Protein akan mengendap pada kondisi 50% jenuh. Metode ekstraksi lain seperti yang dilaporkan oleh Akita dan Nakai (1992) yaitu ekstraksi IgY me lalui water dilusi (pelarutan dalam air) dilanjutkan presipitasi IgY dari water soluble fraction (WSF) menggunakan amonium sulfat. Hasil isolasi dari WSF sangat dipengaruhi oleh pH larutan, tingkat kelarutan kuning telur, dan lama inkubasi. Penurunan pH dapat mengurangi LDL pada supernatan. Pada telur segar tanpa penurunan pH didapatkan lebih banyak kontamina n lemak dan diperlukan waktu lebih la ma mendapatkan supernatan yang jernih. Hal ini karena lipid berikatan secara nonkovalen pada protein terutama lipoprotein. Pengaruh pH akan mengubah integritas granul kuning telur terhadap ikatan lipid. Prepsipitasi lemak telur juga dapat dilakukan dengan dektran sulfat yang mengandung CaCl2 (Szabo et al.1998), mencampur dengan asam kaprilat kemudian diendapkan dengan amonium sulfat dan didialisis dengan PBS (Bhanushali et al. 1994). 55 kDa 220 M S kDa 180 170 116 53 50 21.5 18 Gambar 11 Profil pita protein IgY antitetanus ekstraksi dengan metode PEG kloroform. M= marker, S = Sampel Polson (1990) melaporkan penggunaan PEG dengan berat molekul 6000 sangat baik untuk IgY dibandingkan dengan pelarut organik yang lain seperti ether , toluene dan amonium sulfat. Sedangkan Jensenius et al. (1981) menggunakan dextran sulfat untuk mengendapkan IgY dari WSF. Penggunaan teknik ultrafiltrasi untuk memisahkan IgY dari WSF berdasarkan perbedaan berat molekul sangat sulit karena membran tersumbat oleh material lemak. Penggunaan teknik ini harus diawali pengendapan IgY dengan amonium sulfat (Akita dan Nakai 1993b), atau me ngubah pH larutan WSF menjadi pH 9.0 (Nakai et al. 1994). Untuk menghilangkan residu lemak dari WSF dapat juga digunakan food gum grade , sodium alginate, dan λ-carrageenan (Hatta et al.1997) atau dengan anionic polysaccharide (Chang et al. 2000). Kriteria utama dalam pemilihan metode ekstraksi adalah efisiensi dan praktis. Efisiensi berarti terpisahnya secara sempurna komponen bebas dengan komponen terikat, meskipun secara nyata sulit didapatkan. Kepraktisan metode itu, yang menyangkut hal kecepatan proses, sederhana, mudah diaplikasikan, dan murah. Hasil ekstraksi selanjutnya didialisis dalam larutan PBS pH 8 selama 24 jam pada suhu 4 oC. Dialisis merupakan proses buffer exchanges dari larutan konsentrasi rendah ke larutan konsentrasi tinggi, dalam proses ini terjadi pertukaran buffer dari tabung yang berisi PBS dengan larutan yang ada dalam tabung dialisis. Bersamaan dengan pertukaran buffer ikut juga terbuang molekulmolekul garam atau protein yang memiliki berat molekul kecil yang menkontaminasi sampel. Dalam penelitian ini digunakan tabung dialisis dengan 56 cut off 12 kDa, artinya hanya molekul dengan ukuran berat molekul kurang dari 12 kDa lolos dari tabung dialisis sedangkan ukuran molekul lebih besar akan tetap tertahan dalam tabung (Ford 2004). Selanjutnya, hasil ekstraksi IgY antitetanus dipurifikasi untuk mendapatkan IgY antitetanus murni. Dari Gambar 11 terlihat masih ada pita protein dengan berat molekul tidak sama dengan IgY , hal itu membuktikan masih ada cemaran. Teknik pemurnian yang sering digunakan yaitu kromatografi dengan prinsip ion exchange (DEAE-Sephacel) (Akita dan Nakai 1992), filtrasi gel (Szabo et al.1998), thiophilic interaction chromatography (Hansen et al. 1998). Yokohama et al. (1993) melaporkan purifikasi IgY dengan hydoxypropyl methylcellulose phthalate 5% dilanjutkan dengan afinitas kromatografi menggunakan gel avil AL synthetic mendapatkan IgY konsentrasi tinggi dan tidak merusak aktivitas biologis IgY. Gambar 12 Kromatogram hasil FPLC IgY antitetanus. Dalam penelitian ini metode purifikasi setelah ekstraksi adalah secara kromatografi dengan teknik fast purification liquid chromatografi (FPLC) menggunakan alat AKTATM explorer 10S dengan kolom HiTrapT M IgY Purification (Amersham pharmacia biotech). Kromatogram hasil pengujian IgY antitetanus 57 ditampilkan pada (Gambar 12). Kolom ini berisi matriks dengan medium absorpsi thiophilic, 2-mercaptopyridine digandengkan dengan sepharose high performance , merupakan kolom yang mempunyai afinitas spesifik terhadap IgY. Interaksi antara IgY dan ligan (matriks) terjadi akibat kombinasi antara pertukaran (donor) elektron dan penerimaan aksi pada ligan atau gabungan antara interaksi hidrofilik dan hidrofobik antara ligan dan IgY. Fraksi yang ditampung dan digunakan untuk uji selanjutnya adalah fraksi dengan puncak tertinggi (fraksi 4). Untuk meyakinkan bahwa fraksi itu merupakan protein (IgY) yang diharapkan, dilanjutkan dengan uji AGP untuk mengetahui spesifitasnya (Gambar 13) dan pengujian dengan SDS-PAGE untuk menentukan berat molekul dari protein yang diisolasi. Karakterisasi IgY antitetanus dari kuning telur dilihat dari kespesifikan reaksi antara IgY antitetanus dengan toksoid tetanus yang diuji menggunakan uji AGP memperlihatkan terbentuknya garis presipitasi di antara lubang tengah (antigen) dan lubang sekeliling (antibodi) (Gambar 13). Presipitasi merupakan reaksi sekunder sebagai akibat dari interaksi primer antara antibodi dan antigen (Roit 2003), interaksi nonkovalen antara determinan antigen, epitop antigen, dan regio hipervariabel pada molekul antibodi (Kuby 2003). Hal itu menunjukkan bahwa antibodi yang diisolasi adalah IgY antitetanus. Penggunaan teknik AGP untuk deteksi terbentuknya antibodi (IgY) pada serum memerlukan keseimbangan jumlah antigen dan antibodi untuk membentuk garis presipitasi (Kuby 1997), karena AGP merupakan teknik difusi pasif (Liddell dan Weeks 1995). 2 2 1 2 Gambar 13 Hasil uji agar gel presip itasi IgY antitetanus setelah pemurnian dengan FPLC. Reaksi toksoid (1) dengan IgY (2). 58 Profil pita protein hasil pemurnian menggunakan kromatografi (FPLC) dianalis is menggunakan SDS-PAGE dengan pewarnaan comassie blue (Gambar 14). Metode SDS-PAGE digunakan mendeteksi keberadaan protein berdasarkan atas ukuran protein. SDS adalah detergen anionik yang mampu bereaksi dengan bagian hidrofobik dari protein. Dengan pemanasan maka seluruh bagian polipeptida akan terselimuti sehingga menjadi tidak bermuatan (Hames dan Rickwood 1987). Profil pita protein setelah pemurnian pada sumur satu menunjukkan pita protein dengan berat molekul 180 kDa dan 198 kDa merupakan protein IgY utuh. Tidak ada pita protein yang lain menandakan tidak ada cemaran, dibandingkan dengan hasil SDS-PAGE hasil ekstraksi (Gambar 11) masih ditemukan banyak pita protein. Hal ini menandakan purifikasi dengan FPLC menghasilkan sampel protein lebih murni. Beberapa peneliti melaporkan berat molekul IgY berkisar antara 160 kDa sampai 200 kDa (Sun et al. 2001; Zhang 2003). Kadang-kadang pada SDS-PAGE didapatkan dua pita protein dengan berat 70 kDa untuk IgY rantai berat dan 21 kDa untuk IgY rantai ringan (Hatta et al. 1993). kDa 220 170 116 M 1 198 180 76 53 21.5 Gambar 14 Hasil SDS-PAGE IgY antitetanus setelah pemurnian FPLC. M=Marker BM, 1 = IgY Murni Hasil purifikasi diidentifikasi kandungan proteinnya menggunakan spektrofotometri dengan metode Bradford. Pada Tabel 5 terlihat konsentrasi protein hasil purifikasi dengan FPLC sebesar 1.64 ± 0.42 mg/ml. Ini berarti konsentrasinya lebih tinggi dibandingkan dengan konsentrasi hasil ekstraksi. Hal 59 ini disebabkan sebelum dimasukkan ke dalam alat FPLC telah dilakukan pemekatan dengan PEG 6000. Selanjutnya hasil purifikasi dipekatkan kembali sampai diperoleh konsentrasi protein 5.31 mg/ml, yang akan dipakai sebagai larutan stok IgY antitetanus untuk uji-uji berikutnya. Metode purifikasi harus dilakukan secara berurutan tahap demi tahap, diawali dengan ekstraksi untuk pemisahan lemak telur, memisahkan plasma protein terlarut dari granul kuning telur dilanjutkan purifikasi secara kromatografi (Akita dan Nakai 1992). Pemilihan teknik perlu dipertimbangkan dalam memfasilitasi pengembangan pasar ke depan terutama untuk produk yang punya nilai tambah. Pertimbangan biaya produksi IgY merupakan masalah yang krusial dan perlu dicermati supaya produk itu tidak terlalu mahal dan terjangkau konsumen. Pengembangan teknik pemisahan dan purifikasi IgY dari kuning telur yang sederhana , efisien, otomatis, proses berlangsung secara kontinyu tanpa menggunakan zat kimia perlu dipertimbangkan. Aktivitas Biologis Ig Y Antitetanus. Titrasi toxoid, sampel IgY antitetanus, dan konjugate enzim Konsentrasi toxoid optimal dalam uji Elisa untuk IgY antitetanus pada konsentrasi 4 Lf/ml buffer carbonat-bicarbonats. Konjugate yang dipakai adalah Rabbit anti–chicken horseradish peroxidase konjugate No Product A 9046 (SIGMA). Konjugate anti-chicken diencerkan 1:20 000 dengan menggunakan larutan PBS yang mengandung Tween 20 (PBST). Konsentrasi sampel IgY antitetanus murni yang digunakan adalah 4 µg/ml . Aktivitas IgY antitetanus Setelah perlakuan pH Hasil pengujian pengaruh pH terhadap aktivitas IgY antitetanus dapat dilihat pada Gambar 15. Aktivitas biologis IgY antitetanus menurun sangat nyata (p<0.01) pada perlakuan pH. Penurunan sangat nyata terutama terjadi pada perlakuan pH 2 dan pH 3. Penurunan aktivitas IgY antitetanus terjadi pada semua perlakuan pH (pH 7.6 sebagai kontrol). Penurunan aktivitas bertambah besar sejalan dengan peningkatan waktu inkubasi terutama pada pH 2 dan 3 (Gambar 16), dengan waktu inkubasi 15, 30, 45, 60, dan 120 menit, persentase penurunan 60 pada pH 2 adalah : 26.98%, 30.88%, 50.35%, 55.21%, dan 91.16%, pH 3 masingmasing 15.67%, 21.04%, 35.55%, 51.01%, 87.63%, pH 7 masing-masing 14.96%, 15.22%, 19.69%, 19.69%, 20.97% , dan pH 9 masing-masing 16. 11%, 16.94%, 15.09%, 28.06%, 23.33% . Hasil penelitian ini sejalan dengan penelitian Shimizu et al. (1992) dan Hatta et al. (1993) yang menyatakan stabilitas IgY terhadap pH 2 sampai 3 lebih rendah dibandingkan dengan IgG sapi dan IgG kelinci (Camenisch et al. 1999). Shin et al.(2002) melaporkan penurunan aktivitas IgY pada pH 2 dan pH 3 sampai 80% dan 70% dan aktivitasnya baik pada pH 4 sampai 8. Penurunan aktivitas IgY antitetanus diinkubasi 15 menit berbeda nyata pada semua pH perlakuan dibandingkan de ngan kontrol (p<0.5) (Gambar 16). Aktivitas IgY antitetanus pada pH 7 dan pH 9 tidak berbeda nyata (P>0.5) pada inkubasi sampai 120 menit. Sedangkan aktivitas IgY antitetanus pada pH 2 dan pH 3 menurun secara nyata sejalan dengan bertambahnya waktu inkubasi, penurunan yang sangat nyata terjadi setelah diinkubasikan selama 120 menit baik pada pH 2 maupun pH 3. pengaruh pH Nilai elisa unit 1200.00 1000.00 pH2 800.00 pH3 600.00 pH7 400.00 pH9 200.00 0.00 0 15 30 45 60 120 waktu inkubasi Gambar 15 Pola aktivitas IgY antitetanus setelah perlakuan pH. Penurunan aktivitas ini terjadi karena variasi struktur protein yang dimiliki oleh IgY bersifat lebih sensitif terhadap pH asam dibandingkan dengan pH basa (Hatta et al. 1993). Begitu pula secara struktural, lemahnya ikatan disulfida dan fleksibilitas regio hinge yang terbatas secara keseluruhan mempengaruhi stabilitas molekul IgY (Narat 2003). IgY secara natural dilindungi oleh granul-granul 61 kuning telur (Schmidt et al. 1989). Jika zat kimia itu hilang saat purifikasi dan IgY diseliputi lagi (encapsulated) maka ketahanan IgY terhadap pH dan enzim pencernaan meningkat (Akita dan Nakai 1993a). Penurunan aktivitas IgY yang sangat cepat disebabkan kerusakan antigen binding site akibat inkubasi pada asam. Perubahan IgY ke bentuk Fab juga diikuti peruba han antigen binding site. Perubahan struktur skunder IgY (domain konstan) juga terjadi setelah perlakuan asam. Ketahanan molekul IgY dipengaruhi oleh ikatan nonkovalen intermolekular (s-s) antara tempat reduksi rantai berat dan rantai ringan, ikatan itu lebih lemah pada IgY dibandingkan dengan IgG. Setelah terjadi reduksi rantai berat dan rantai ringan, IgY lebih mudah dipisahkan dibandingkan dengan IgG. Hal itu juga dipengaruhi oleh kekuatan intramolekular molekul protein IgY. Faktor struktural yang berkontribusi terhadap perubahan itu tidak diketahui dengan pasti, karena imunoglobulin merupakan molekul besar yang rumit dengan polipeptida heterogenous, domain rantai H dan L banyak, dan perubahan bentuk masingmasing domain terjadi secara bebas. pH Nilai Elisa Unit 1200 1000 pH2 800 pH3 600 pH7 400 pH9 200 0 0 15 30 45 60 120 Waktu Inkubasi (Menit) Gambar 16 Penurunan aktivitas IgY antitetanus setelah perlakuan pH. Kandungan asam amino struktur β-sheet yang lebih rendah menyebabkan domain IgY lebih mudah terganggu dan kurang stabil. Lingkage intrachain IgY pada rantai L tidak ditemukan, sedangkan ikatan ini mempengaruhi ketahanan 62 terhadap asam. IgY memiliki dua residu cys tambahan yaitu cys331 dan cys338 di pertautan CH2–CH3, dan residu SH bebas tidak ditemukan seperti halnya pada IgG. Residu cys berpengaruh terhadap inter-H chain disulfide lingkage. Pada IgG mamalia hanya ada satu tempat glycosylation terletak pada domain CH2, sedangkan pada IgY memiliki tempat glycosylation pada domain CH2 dan CH3. Kurangnya regio hinge pada IgY juga diperkirakan mempengaruhi kestabilan IgY (Shimizu et al. 1992). Aktivitas IgYAntitetanus Setelah Perlakuan Suhu Hasil pengujian pengaruh suhu terhadap akt ivitas IgY antitetanus menunjukkan suhu berpengaruh sangat nyata (P<0.01) terhadap aktivitas IgY antitetanus . Pola aktivitas IgY antitetanus setelah per lakuan suhu dapat dilihat pada Gambar 17. Suhu Nilai Elisa Unit 1200 1000 50 800 60 70 600 72.5 400 75 200 80 0 90 0 5 10 15 20 100 Waktu Inkubasi (menit) Gambar 17 Pola aktivitas IgY antitetanus setelah perlakuan suhu. Aktivitas IgY antitetanus pada perlakuan suhu 50 ºC menunjukkan hasil tidak berbeda nyata pada semua waktu inkubasi (P>0.05), pada suhu 60 ºC dengan waktu inkubasi 5 menit (Gambar 18) penurunan aktivitas IgY antitetanus tidak berbeda nyata (P>0.05) sedangkan pada waktu inkubasi 10 menit menurun secara nyata (P<0.05) sementara itu dari waktu inkubasi 10 sampai 20 menit tidak berbeda nyata. Pada suhu 70 ºC menunjukkan hasil berbeda nyata (P<0.05) 63 setelah inkubasi 5 menit kemudian aktivitasnya terus menurun secara tidak nyata, penurunan aktivitas sangat nyata (P< 0.01) pada perlakuan suhu 72.5 o C, 75 oC, 80 oC, 90 oC, dan 100 oC setelah 5 menit inkubasi, aktivitasnya terus menurun seiring dengan penambahan waktu inkubasi. 1000 1000 800 800 600 5 menit 400 Nilai Elisa Unit 1200 Nilai Elisa Unit 1200 600 10 menit 400 200 200 0 0 k k 50 60 70 72.5 75 80 90 100 50 60 Suhu 1200 1200 1000 1000 800 800 600 15 menit 400 Nilai Elisa Unit Nilai Elisa Unit Suhu 70 72.5 75 80 90 100 200 600 20 menit 400 200 0 0 k 50 60 70 72.5 75 80 90 100 k Suhu 50 60 70 72.5 75 80 90 100 Suhu Gambar 18 Penurunan aktivitas IgY antitetanus setelah perlakuan suhu dengan waktu inkubasi berbeda. Penurunan persentase aktivitas IgY antitetanus pada suhu 50 inkubasi selama 20 menit adalah 5.27%, o C setelah sedangkan 15 menit sebelumnya o aktivitasnya masih utuh. Pada suhu 60 C setelah waktu inkubasi 5, 10, 15, dan 20 menit penurunan aktivitas IgY antitetanus masing-masing adalah : 5.44%, 28.99%, 30.35%, dan 30.78%. Pada suhu 70 oC adalah 39.45%, 46.00%, 56.04%, dan 64.01%, pada suhu 72.5 oC adalah : 80.16%, 92.67%, 94.58%, dan 97.87%, pada suhu 75 o C adalah 83.35%, 91.13%, 95.64%, dan 96.50%, pada suhu 80 oC adalah 86.81%, 95.73%, 96.79%, 97.38%, pada suhu 90 o C adalah 95.92%, 64 97.94%, 98.39%, dan 100.%, sedangkan pada suhu 100 o C adalah 95.36%; 97.18%; 99.23% dan 100%. Penambahan larutan sukrosa konsentrasi 25% ke dalam larutan IgY masih mampu mempertahankan aktivitas IgY antitetanus sampai 50% pada inkubasi suhu 75 oC selama 5 menit (Gambar 19), dengan bertambahnya waktu inkubasi aktivitas IgY antitetanus mengalami penurunan. Sedangkan pada suhu yang lebih tinggi yaitu 80 oC dan 90 o C penambahan larutan sukrosa konsentrasi 25% tidak mampu mempertahankan aktivitas IgY antitetanus sampai 50% . Semakin tinggi konsentrasi larutan sukrosa yang digunakan semakin tinggi pula kemampuan untuk mempertahankan aktivitas IgY. sukrosa terhadap suhu 75 sukrosa terhadap suhu 70 1200 1000 70 800 600 400 S5% S12.5% S25%. 200 0 nilai elisa unit nilai elisa unit 1200 1000 75 800 S5%. 600 S12.5%. 400 S25%. 200 0 0 5 10 15 0 waktu inkubasi (menit) 10 15 sukrosa terhadap suhu 90 sukrosa terhadap suhu 80 1200 1200 1000 1000 80 S5% 600 S12.5%. 400 S25% 200 90 800 nilai elisa unit 800 nilai elisa unit 5 waktu inkubasi (menit) S5% 600 S12.5% 400 S25% 200 0 0 0 5 10 waktu inkubasi (menit) 15 0 5 10 15 waktu inkubasi (menit) Gambar 19 Penambahan larutan sukrosa pada larutan IgY antitetanus. Penambahan larutan glukosa konsentrasi 50% berpengaruh nyata terhadap peningkatan aktivitas IgY antitetanus pada inkubasi suhu 75 o C dibandingkan dengan penambahan konsentrasi larutan glukosa lebih rendah dan tanpa 65 penambahan larutan glukosa (Gambar 20). Peningkatan aktivitas secara nyata ditemukan pada inkubasi suhu 80 oC selama 5 menit. Sedangkan pada inkubasi suhu 90 oC tidak berpengaruh secara nyata, meskipun aktivitas IgY antitetanus lebih tinggi dibandingkan tanpa penambahan larutan glukosa. glukosa terhadap suhu 75 glukosa terhadap suhu 70 1200 1200 70 1000 600 400 G12.5%. 200 G50% G25% nilai elisa unit nilai elisa unit 800 0 0 5 10 800 G5%. 600 G12.5% 400 G25%. 200 0 G50% 0 15 5 10 waktu inkubasi (menit) waktu inkubasi (menit) Glukosa terhadap suhu 80 Glukosa terhadap suhu 90 1200 15 1200 80 1000 800 G5% 600 400 G12.5% G25% 200 G50% 0 0 5 10 waktu inkubasi (menit) 15 nilai elisa unit nilai elisa unit 75 1000 G5% 1000 800 90 600 400 G12.5%. 200 0 G50% G5%. G25%. 0 5 10 15 waktu inkubasi (menit) Gambar 20 Penambahan larutan glukosa ke dalam larutan IgYantitetanus. Peningkatan suhu sebesar 2.5 o C dari 70 oC menjadi 72.5 oC menyebabkan penurunan aktivitas IgY antitetanus sampai 97.87%, hal ini berarti IgY antitetanus sudah terdenaturasi pada suhu 72.5 oC, sedangkan Hatta et al.(1993) mendapatkan bahwa IgY mulai terdenaturasi pada suhu 73.9 ºC. Whitaker (1994) menyatakan jika protein dipanaskan akan terdenaturasi, menyebabkan terputusnya ikatan nonkovalen yang melibatkan perubahan interaksi elektrostatik, interaksi hidrofobik, ikatan hidrogen dan ikatan Van der Walls. Penurunan aktivitas lebih dari 50% diamati pada waktu inkubasi 20 menit pada suhu 70 oC. Dalam hal ini waktu inkubasi berpengaruh terhadap penurunan aktivitas IgY, semakin lama terpapar panas maka ikatan nonkovalen protein IgY akan terputus. Stabilitas IgY 66 anti Helicobacter pylori (IgY -Hp) terhadap panas, dilaporkan stabil pada suhu 40 oC, aktivitasnya turun 20% pada suhu 60 o C selama 10 menit, dan aktivitasnya sangat nyata turun pada suhu 80 o C sampai 90%. Secara imunologik IgY -Hp tetap aktif pada suhu 60 oC selama 10 menit (Shin et al. 2002), sedangkan Horie et al. (2004) melaporkan aktivitas IgY masih 95% pada suhu 60 oC sampai 65 oC, dengan demikian pasteurisasi suhu rendah (63 oC selama 30 menit) dapat diperlakukan untuk sterilisasi produk. Penambahan kadar maltosa, gliserol atau glisina yang tinggi sangat efektif untuk melindungi IgY dari denaturasi panas. Larutan gula mengakibatkan peningkatan interaksi hidrofobik dalam molekul protein dan me ngubah kelarutan molekul protein sehingga stabil selama proses pemanasan (Shimizu et al. 1992) . Konsentrasi IgY yang tinggi (7.75 mg/ml) lebih resisten terhadap panas (Chang et al. 1999). Sedangkan pada penelitian ini digunakan konsentrasi IgY 4 µg/ml. Jauh di bawah konsentrasi itu. Sehingga dalam produksi dengan konsentrasi IgY yang le bih tinggi, produk dari imunoglobulin akan lebih aman dari pengaruh panas saat prosesing. Chang et al. (1999) mengamati sifat dari IgY selama food prosesing , dilaporkan aktivitas IgY murni dan IgY kuning telur crude menurun sejalan dengan peningkatan suhu dari 70 o C sampai 80 o C. Larutan IgY crude menunjukkan ketahanan yang lebih tinggi. Komponen yang terdapat dalam larutan IgY crude diduga membantu dalam menjaga stabilitas IgY melawan panas. Stabilitas IgG sapi juga menurun sejalan peningkatan suhu (Shimizu et al. 1992). Gula dan beberapa asam amino seperti actomyosin dan myosin efektif dalam mencegah denaturasi dan destruksi protein selama perlakuan suhu dan freezing (Hatta et al. 1993). Konsentrasi 5% maltos a dan fruktosa, dan 2% glisina mampu melindungi IgG sapi pada suhu 95 oC setelah inkubasi selama 15 menit. Konsentrasi protein dalam larutan berpengaruh terhadap kecepatan denaturasi protein. Kadar ß-lactoglobulin yang rendah dalam larutan bertanggung jawab terhadap denaturasi panas , menyebabkan penurunan proteksi terhadap ikatan disulfida intramolekul dan interaksi hidrofobik di antara protein menjadi sangat tinggi (Chang et al. 1999). 67 Struktur β-sheet di domain konstan IgY lebih rendah dari IgG dan fleksibilitas regio hinge IgY kurang fleksibel dari IgG (Polson et al. 1980). Rantai gula IgY merupakan struktur yang unik, karena glukosa berkonjugasi dengan sisi non reduksi dari rantai gula yang lain, mungkin hal itu berpengaruh terhadap ketahanan terhadap pH dan suhu (Hatta et al. 1993). Kekurangan secara struktural dari IgY dibandingkan IgG, seperti lemahnya ikatan disulfida dan fleksibelitas regio hinge berpengaruh terhadap stabilitas molekul IgY (Narat 2003). Aktivitas IgY Antitetanus Setelah Perlakuan Enzim Pepsin, Tripsin, dan Protease Pola aktivitas IgY antitetanus setelah perlakuan pepsin, tripsin, dan protease dapat dilihat pada Gambar 21. Aktivitas IgY antitetanus menunjukkan hasil sangat berbeda nyata (P<0.01) untuk ketiga perlakuan enzim. Persentase penurunan aktivitas IgY antitetanus pada inkubasi pepsin 30, 60, dan 120 menit adalah: 85.02%, 95.83%, dan 98.13%. Pada perlakuan enzim tripsin, aktivitas IgY antitetanus menurun secara nyata setelah perlakuan inkubasi 30 menit, sedangkan inkubasi 60 menit sampai 120 menit aktivitasnya tidak berbeda dengan perlakuan inkubasi 30 menit. Hal yang sama juga terjadi pada perlakuan enzim protease. Penurunan aktivitas IgY antitetanus setelah perlakuan enzim tripsin dan protease berkisar antara 75% sampai 95%. Penelitian ini memperkuat simpulan Sunwoo et al. (2002) bahwa IgY lebih sensitif terhadap pepsin dibandingkan dengan tripsin. Hatta et al. (1993) menyatakan profil IgY setelah inkubasi pepsin pada pH 2 dan dianalis is dengan SDS-PAGE, IgY dihidrolis is menjadi peptida kecil dan tidak tampak pita pada hasil analisis. Aktivitas IgY stabil terhadap pengaruh enzim pepsin selama 2 jam pada saluran cerna ikan, setelah IgY diberi pelindung (microencapsulated) mikrobial transglutaminase (TGase) dan diproses dalam bentuk pelet (Lee et al. 2000), sedangkan pa da belut bertahan sampai 6 jam (Gutierrez et al. 1993). Whitaker (1994) melaporkan setelah inkubasi pH 2 pada suhu 37 o C, enzim pepsin akan memulai aktivitasnya menghidrolisis ikatan peptida menjadi asam amino. Enzim pepsin merupakan endopeptidase bersifat ekstensif, tetapi dalam lambung tidak menghidrolisis protein secara keseluruhan. Sehubungan dengan hal itu, hasil ini 68 dapat digunakan sebagai acuan dalam penentuan dosis secara oral dan usaha enkapsulasi saat proses pemurnian (Lee et al. 2000). Penurunan aktivitas imunoglobulin itu juga karena pengaruh ganda dari pH 2 dan enzim pepsin (Hatta et al. 1993). enzim nilai elisa unit 1200 1000 800 pepsin 600 tripsin 400 protease 200 0 0 30 60 120 waktu inkubasi (menit) Gambar 21 Pola aktivitas IgY antitetanus setelah perlakuan enzim pepsin, tripsin, dan protease. Aktivitas IgY antitetanus terhadap pengaruh tripsin dan protease masih lebih tinggi dibandingkan pengaruh pepsin, hal yang sama juga dilaporkan oleh Othani et al. (1991). Sedangkan Hatta et al. (1993) melaporkan inkubasi tripsin tidak mengubah ikatan rantai berat maupun rantai ringan IgY. Persentase penurunan aktivitas pada IgY murni lebih tinggi dibandingkan dengan IgY crude. Penurunan aktivitas IgY murni mencapai 80% sedangkan IgY crude hanya 25%. Stabilitas IgY crude akibat denaturasi tripsin sedikit mengalami kerusaka n, dengan demikian IgY crude masih stabil dalam arti masih menunjukkan aktivitas netralisasi yang baik (Hatta et al. 1993). Enzim tripsin merupakan endopeptidase yang memecah ikatan peptida protein dengan cara menghidrolisis daerah karboksil dari lisin dan arginin. Enzim tripsin dihasilkan oleh pankreas dalam bentuk tripsinogen dan disalurkan ke usus halus. Enzim tripsin bersifat autokatalitik yaitu mampu mengkatalisis sendiri tripsinogen menjadi tripsin. IgG tidak mengalami perubahan aktivitas setelah perlakuan enzim tripsin. IgG mempunyai struktur molekul yang lebih stabil dibandingkan dengan IgY, demikian juga fleksibilitas regio hingenya lebih baik sehingga mampu mempertahankan stabilitas molekulnya akibat pengaruh enzim 69 tripsin (Carlender 2002). Tepung kuning telur yang diselaputi gum arabic dihidrolisis lebih rendah. Penggunaan gum arabic saat proses liopilisasi mampu mencegah kerusakan IgY karena enzim protease (Chang et al. 1999). Hasil SDS-PAGE IgY Antitetanus Setelah Perlakuan Fisik dan Kimia Pola pita protein IgY antitetanus setelah perlakuan fisik dan kimia dapat dilihat pada Gambar 22. Pada perlakuan suhu 60 o C pola pita protein dari IgY antitetanus masih utuh, hal ini membuktikan IgY antitetanus masih stabil pada suhu tersebut. Perlakuan suhu 80 oC dan 90 o C, enzim tripsin dan pepsin serta perlakuan pH 2 dan pH 3 tidak ditemukan pita protein IgY utuh maupun dari rantai berat dan ringan IgY, hal ini berarti terjadi denaturasi protein IgY . 1 220 170 116 76 2 3 4 5 6 7 8 9 . 56 21.5 Gambar 22 Hasil SDS-PAGE IgY antitetanus setelah perlakuan fisik dan kimia. 1. Marker BM; 2 Perlakuan suhu 60 oC; 3. Perlakuan Suhu 80 o C; 4. Perlakuan Suhu 90 oC; 5. Perlakuan enzim pepsin 60 menit; 6. Perlakuan enzim tripsin 60 menit; 7. Perlakuan pH 2; 8. Perlakuan pH 3; 9. Kontrol Penurunan aktivitas IgY pada pH rendah karena perubahan kompormational molekul imunoglobulin, sehingga tidak ditemukan pemecahan polipeptida pada SDS-PAGE (Gambar 22). Shimizu et al. (1988) melaporkan IgY lebih mudah rusak terhadap digesti pepsin dibandingkan dengan IgG. Digesti pepsin terhadap IgG mamalia pada pH 4 menghasilkan FAb’ dengan dua binding site yang memiliki aktivitas seperti IgG utuh. Pada digesti pepsin terhadap IgG 70 dihasilkan pita protein dengan BM 110 kDa, sedangkan IgY didigesti menjadi BM yang lebih rendah yaitu 40 sampai 60 kDa. Pada pemberian secara oral proteksi IgY terhadap digesti lambung perlu dipikirkan(Chang et al. 1999). Penurunan stabilitas IgY terhadap pH juga diperkirakan akibat kerusakan struktur protein antigen binding site oleh asam. Polson et al. (1980) melaporkan titik isoelektrik IgY lebih rendah 1 pH unit dari IgG, karena kandungan karbohidrat IgY lebih tinggi dibandingkan dengan IgG mamalia (Nakai et al.1994). Dilaporkan juga struktur β-sheet domain konstan IgY lebih sederhana dari IgG. Proses hidrolisis terhadap protein akan mengurangi berat molekul protein (Niellsen 1997). Potensi IgY Antitetanus Potensi netralisasi antitoksin tetanus dihitung dengan metode SpearmanKarber. Penghitungan berdasarkan prote ctive dose 50 (PD50) dari antitoksin. Pengujian dinyatakan valid apabila memenuhi syarat : (1) log atau interval dosis tetap, dibuat sangat rapat dan tetap; (2) ada respon penuh dari 0% sampai 100%, dan terlihat rentang persentase viabilitas hewan coba pada uji potensi toksin dan serum antitetanus memenuhi syarat ini, yakni dari 0% mati (respon negatif) sampai 100% mati (respon positif); (3) distribusi respon simetris, maksudnya dari satu set percobaan ada yang mati seluruhnya dan hidup seluruhnya dengan distribusi yang merata. Bila uji valid maka potensi IgY antitetanus dihitung dengan kalkulasi statistik sebagai berikut : Pot ATS Uji = PD50 ATS Standar X Faktor Pengenceran ATS Uji X Pot ATS Std ( IU/ml) PD50 ATS Uji Potensi netralisasi dari serum antitetanus (SAT) uji yang didapat diharapkan sama dengan nilai PD50 atau lebih besar dari SAT standar yakni 1500 IU/ml. SAT standar untuk setiap pengujian adalah serum standar yang sama dan merupakan serum referensi internasional yang dikeluarkan oleh WHO. Nilai potensi biologis dari ATS dapat ditentukan secara in vivo melalui data kematian mencit dalam beberapa dosis pengenceran serum kemudian dibandingkan dengan 71 sediaan standar yang telah dibakukan. Produk SAT dikalibrasi dari 1 IU/ml untuk mencit menjadi 1500 IU/ml untuk manusia (Nasution e t al. 1987). Tabel 6 Uji Potensi IgY antitetanus Nama bahan uji ATS Standar ATS Uji Enceran Jumlah hewan Dosis antitoksin Vol PBS tabung 1 2 3 4 5 1 2 3 4 5 ekor 6 6 6 6 6 6 6 6 6 6 (ml) 0.88 0.80 0.73 0.66 0.60 0.88 0.80 0.73 0.66 0.60 (ml) 1.12 1.20 1.27 1.34 1.40 1.12 1.20 1.27 1.34 1.40 Vol Toksin 0.4 IU/ml (ml) 2 2 2 2 2 2 2 2 2 2 Jumlah mencit hidup-harian 1 6 6 6 6 6 6 6 6 6 6 2 6 6 6 4 1 6 6 6 6 4 3 6 6 6 2 0 6 6 6 0 0 4 6 6 6 0 0 6 6 6 0 0 5 6 6 6 0 0 6 6 6 0 0 survivor 6 6 6 0 0 6 6 6 0 0 Kelompok mencit yang masih hidup 100% sampai yang tidak hidup (mati) dari pengenceran dosis antitetanus dilakukan perhitungan PD50 antitetanus standar dan sampel. Perhitungan PD50 standar ATS dan sampel ditampilkan pada Tabel 7 dan 8. Tabel 7 Prote ctive dose-50 ATS standar Dosis std ATS 1 IU/ml (ml) P Log dosis 0.80 0.73 0.66 -0.09691 -0.13668 -0.18046 1 1 0 Dosis Uji ATS 1 IU/ml (ml) P Log dosis survivo r (D) (H/ N) 0.80 0.73 0.66 -0.09691 -0.13668 -0.18046 (D) survivor Pn – Pn-1 Dn + Dn-1 (H/ N) (p) (d) 0 1 -0.23359 -0.31714 (p)(d) Kn+Kn -1 (K) 0 -0.31714 Log PD50 Antilog PD50 ATS Std 0.5 (Kn+Kn-1) -0.31714 -0.15857 0.6941 Log PD50 Antilog PD50 ATS uji Tabel 8 Protective dose-50 ATS uji 1 1 0 Pn – Pn -1 (p) 0 1 Dn + Dn-1 (d) -0.23359 -0.31714 (p)(d) Kn+Kn -1 (K) 0 -0.31714 0.5 (Kn+Kn1) -0.31714 -0.15857 0.6941 Potensi ATS Sampel uji dilakukan berdasarkan atas PD50 ATS standar dengan PD50 ATS sampel, perhitungan potensi itu seperti berikut : Pot ATS Uji = PD50 ATS Standar X Faktor Pengenceran ATS Uji X Pot ATS Std PD50 ATS Uji Pot ATS Uji = 0.6941 0.6941 Pot ATS Uji = 35 IU/ml X 35 X 1 IU/ml 72 Berdasarkan perhitungan Spearman-Karber diperoleh nilai potensi IgY antitetanus sebesar 35 IU/ml. Potensi ini lebih rendah sampai 50% dari titer yang didapat pada penghitungan hasil ekstraksi. Hal ini mungkin disebabkan faktor fisik selama proses ekstraksi sampai proses purifikasi, dilakukan proses pemekatan dan pengenceran pada tiap tahap purifikasi. Selama proses itu juga terjadi perubahan suhu, pengaruh waktu penyimpanan, pengaruh dari tidak adanya stabiliser (penyangga) selama proses penyimpanan. Faktor-faktor tersebut perlu dipikirkan peranannya. Telur diekstraksi dalam jumlah banyak sekaligus, tidak satu butir-satu butir, untuk mengurangi resiko terhanyutnya IgY dan mengurangi faktor fisik. Perlu juga dipertimbangkan teknik imunisasi yang tepat sehingga diperoleh titer yang tinggi pada serum, yang sekaligus berimplikasi dengan tingginya titer pada telur. Uji Tantang Pada Hewan Coba Uji ini dilakukan untuk mengetahui kemampuan IgY antitetanus yang diberikan secara sub kutan pada mencit dalam menetralisasi toksin tetanus yang diinjeksikan 2 jam berikutnya . Pengujian ini diperlukan supaya bahan antitoksin yang dihasilkan aman digunakan pada pemakai. Penggunaan mencit sebagai hewan model karena tingkat sensitivitas dari galur ini menunjukkan respon fisiologis spesifik. Kemampuan netralisasi antitoksin diamati dari mencit yang bertahan hidup sebanyak 100% pada setiap kelompok perlakuan. Mencit yang bertahan hidup terbebas dari gejala khas tetanus yaitu tremor, punggung melengkung (opistotonus), kejang, locked jaw, dan lumpuh (spatic paralisis), serta normal secara fisiologis yang diukur dari pertambahan berat badan, kemampuan respirasi, refleksitas diamati dari kemampuan renang, dan feed intake yang meningkat. Kelompok mencit yang masih bertahan hidup sebanyak 100% dapat dilihat pada Tabel 9. Kelompok sentinel untuk mengetahui efek pemeliharaan terhadap perlakuan, kontrol positif untuk menguji toksin yang digunakan masih efektif dan mampu membunuh mencit seratus persen, sedangkan kontrol negatif untuk mengetahui pengaruh IgY antitetanus. 73 Tabel 9 Persentase mencit yang bertahan hidup pada setiap kelompok perlakuan Tok sin (IU/e kor) Stl Ktr Ktr + - 0.1 100 0 0.2 100 0.3 0.4 Dosis IgY (IU/ekor) 0.2 0.4 0.8 1 100 100 100 100 100 0 100 83.33 100 100 100 100 0 100 0 0 83.33 100 100 0 100 0 0 83.33 100 Keterangan: Stl : Sentinel, tidak diperlakukan dengan IgY dan Uji tantang toksin Ktr + : Kontrol positif, tidak diberikan IgY tetapi di tantang dengan toksin Ktr - : Kontrol negatif, diberikan IgY tetapi tidak ditantang toksin Gejala klinis khas tetanus muncul hari pertama pasca injeksi toksin, kemudian berangsur berkurang sampai hari kelima (Gambar 23). Pada hari pertama dan kedua kasus yang muncul sudah tinggi. Mencit yang bertahan sampai hari ketiga akan dapat pulih dari pengaruh toksin, dan berangsur-angsur akan sembuh. Peningkatan 100% dosis toksin dari dosis letal dengan pemberian IgY 0.8 dan 1 IU/ekor , kelompok perlakuan yang bertahan hidup masing-masing 83.33% sampai 100% sedangkan pada dosis IgY 0.2 dan 0.4 IU/ekor semua mencit mati (IgY tidak mampu menetralisasi toksin). Jumlah Kasus Jumlah Kasus 45 40 35 30 25 20 15 10 5 0 1 2 3 4 5 Hari Ke Gambar 23 Frekuensi pemunculan kasus dengan gejala klinis khas tetanus Pada kelompok perlakuan dengan imbangan dosis toksin dan ATS yang tidak besar, gejala klinis mulai muncul pada hari kedua. Gejala klinis yang 74 pertama muncul sebagian besar punggung bengkok, dan mencapai puncak hari kedua (Gambar 24). Kematian mulai terjadi di hari pertama pasca injeksi toksin sampai hari kelima (kelompok IgY 0.8 IU dengan toksin 0.3 dan 0.4 IU) hal ini terjadi karena kemampuan antitoksin menetralisasi toksin agak tinggi tetapi tidak optimal. Gejala kaki pincang juga terlihat hari pertama, mencit-mencit yang menunjukkan gejala pincang akan lebih cepat mati. Hal ini karena mencit mengalami kesulitan mencari tempat makan dan minum. Gejala lock jaw agak sulit diamati karena mencit lebih cepat mati. Gejala Klinis 30 Jumlah kasus 25 20 15 10 5 0 1 G 2 3 4 Hari ke P K 5 L M Gambar 24 Jumlah gejala klinis yang muncul harian. G = Gemetar, K = kaki pincang, P = punggung bengkok, L = lock jaw, M = mati. Kasus Klinis Jumlah Kasus 25 20 G K 15 P 10 L M 5 0 0.2 0.4 0.8 1 Dosis IgY (IU/ekor) Gambar 25 Gejala klinis yang muncul pada dosis IgY antitetanus berbeda. G = Gemetar, K = kaki pincang, P = punggung bengkok, L = lock jaw, M = mati. Mencit lebih banyak mati pada kelompok perlakuan yang diberikan dosis IgY antitetanus yang lebih rendah (0.2 IU/ekor dan 0.4 IU/ekor), dengan dosis tantang toksin lebih tinggi (0.3 IU/ekor dan 0.4 IU/ekor). Pada pemberian dosis 75 IgY antitetanus lebih tinggi (0.8 IU/ekor dan 1 IU/ekor) gejala klinis yang banyak muncul adalah punggung bengkok. Mencit yang menunjukkan gejala punggung bengkok pergerakannya masih lincah, masih mampu mencapai tempat pakan dan minum sehingga jika bertahan sampai hari ketiga kemungkinan untuk sembuh tinggi (Gambar 25). Pada dosis IgY 0.2 IU/ekor dan dosis 0.4 IU/ekor gejala khas tetanus lebih banyak muncul, terutama pada dosis tantang toksin 0.3 IU/ekor dan 0.4 IU/ ekor, dengan dosis tantang ini mencit mati 100% (Tabel 7). Berat Badan Secara umum berat badan mengalami peningkatan secara nyata pada mencit yang masih bertahan hidup dengan pemberian dosis IgY antitetanus yang semakin besar, ditantang dengan dosis toksin semakin kecil. Peningkatan berat badan juga nyata sejalan dengan bertambahnya hari. Pada uji dosis IgY antitetanus 0.2 IU/ekor, didapatkan hasil bahwa kecenderungan garis regresi berat badan meningkat pada dosis tantang 0.1 IU/ekor dan 0.2 IU/ekor sedangkan pada dosis toksin tantang 0.3 IU/ekor dan 0.4 IU/ekor berat badan mencit kecenderungannya turun. Hal ini berarti bahwa pada dosis toksin tantang 0.1 IU/ekor dan 0.2 IU/ekor IgY masih mampu melindungi mencit dari pengaruh toksin sehingga proses metabolisme tubuh dalam produksi energi berlangsung normal. Metabolisme merupakan proses yang terjadi pada setiap tubuh mahluk hidup melibatkan sejumlah energi dalam semua reaksi kimia sederhana pada semua sel tubuh meliputi reaksi pembentukan, penguraian, pengangkutan serta pengaturan (Guyton 1995). Pada organisme hidup, makanan dan minuman merupakan sumber energi yang masuk, sedangkan feses dan urin merupakan energi yang hilang atau dibuang. Pertambahan berat badan merupakan akibat pertumbuhan jaringan karena hasil dari energi metabolisme (Martini 2001). Pertumbuhan dipengaruhi oleh berbagai faktor intrinsik yaitu hereditas, jenis kelamin, usia, dan spesies, serta faktor ekstrinsik seperti nutrisi, lingkungan dan penyakit. Pada dosis IgY antitetanus 0.4 IU/ekor kecenderungan garis regresi berat badan hanya turun pada dosis toksin 0.3 IU/ekor, sedangkan pada perlakuan lain 76 semuanya meningkat (Gambar 26). Pada dosis tantang 0.3 IU/ekor semua mencit mati begitu juga pada dosis tantang toksin 0.4 IU/ekor . IgY Dosis 0.4 IU/ekor IgY dosis 0.2 IU/ekor 25 20 20 15 15 10 Berat Badan Berat badan (gram) 10 5 5 0 0 -5 0 1 2 3 4 5 -5 0 6 1 2 4 5 6 Hari Ke Hari ke 0.1 ktr Linear (0.3) 0.2 sentinel Linear (0.4) 0.3 Linear (0.1) Linear (ktr -) 0.4 Linear (0.2) Linear (sentinel) 0.1 0.2 0.3 0.4 ktr - sentinel Linear (sentinel) Linear (0.1) Linear (0.2) Linear (0.3) Linear (0.4) Linear (ktr -) IgY Dosis 0.8 IU/ekor IgY dosis 1IU/ekor 25 20 20 15 Berat badan (gram) 15 Berat Badan (gram) 3 10 10 5 5 0 0 0 1 2 3 4 5 6 0 Hari Ke 0.1 0.4 Linear (0.1) Linear (0.4) 0.2 ktr Linear (0.2) Linear (ktr -) 0.3 sentinel Linear (0.3) Linear (sentinel) 0.1 0.4 Linear (0.1) Linear (0.4) 1 2 3 Hari Ke 0.2 ktr Linear (0.2) Linear (ktr -) 4 5 6 0.3 sentinel Linear (0.3) Linear (sentinel) Gambar 26 Pola kecenderungan garis regresi berat badan mencit. Pada pemberian IgY antitetanus 0.2 IU/ekor, berat badan mencit pada dosis tantang toksin 0.2 IU/ekor mengalami penurunan pada hari pertama dan kedua, kemudian terus meningkat hari ketiga, empat dan lima. Pada dosis tantang toksin 0.3 IU/ekor mencit mati semua pada hari ketiga, dan dosis tantang toksin 0.4 IU/ekor mencit mati semua pada hari kedua. Pada kelompok sentinel dan kelompok kontrol negatif berat badan mencit terus meningkat (Gambar 27). Pada dosis IgY antitetanus 0.4 IU/ekor, berat badan mencit pada dosis tantang toksin 0.1 IU/ekor menurun pada hari pertama kemudian hari kedua dan seterusnya meningkat, pola yang sama juga diperlihatkan pada dosis tantang 0.2 77 IU/ekor, sedangkan pada dosis tantang 0.3 IU/ekor dan 0.4 IU/ekor mencit sudah mati hari kedua (Gambar 27), meskipun kecenderungan pada dosis toksin 0.4 IU/ekor (Gambar 26) meningkat karena hari pertama berat badannya tidak turun secara nyata. IgY dosis 0.2 IU/ekor IgY dosis 0.4 IU/ekor 25 15 20 15 Berat Badan (gram) Berat Badan (gram) 20 10 10 5 0 0 1 2 3 4 5 0 5 0 1 2 Hari ke 4 5 Hari Ke 0.1 0.2 0.3 0.4 ktr - sentinel 0.1 0.2 0.3 0.4 ktr - sentinel IgY dosis 1IU/ekor IgY dosis 0.8 IU/ekor 25 20 20 15 15 Berat Badan (gram) Berat Badan (gram) 3 10 10 5 5 0 0 0 1 2 3 4 Hari ke 0.1 0.2 0.3 0.4 ktr - sentinel 5 0 1 2 3 4 5 Hari Ke 0.1 0.2 0.3 0.4 ktr - sentinel Gambar 27 Pola pertambahan berat badan mencit . Pada dosis IgY antitetanus 0.8 IU/ekor , kecenderungan persamaan garis regresi semuanya meningkat dari keempat dosis tantang (Gambar 26). Hal ini berarti IgY antitetanus mampu menetralisasi toksin, dan semua mencit pada kelompok perlakuan ini masih bertahan hidup 100% (Tabel 7). Pola peningkatan berat badan mencit dari keempat kelompok perlakuan sama, yaitu mengalami peningkatan sejak hari pertama pasca injeksi toksin (Gambar 27). Pola dari dosis IgY antitetanus 0.8 IU/ekor juga ditemukan mirip dengan pola peningkatan berat 78 badan pada dosis IgY antitetanus 1 IU/ekor (Gambar 27). Kecenderungan garis persamaan regresi semuanya positif, berarti meningkat, begitu juga berat badannya terus meningkat sejak hari pertama sampai ke lima (Gambar 26). Dari hasil di atas dapat disimpulkan IgY antitetanus dosis 0.8 IU/ekor dan 1 IU/ekor mampu melindungi mencit dengan baik dengan waktu tantang 2 jam, sedangkan pada dosis 0.2 IU/ekor dan 0.4 IU/ekor perlindungan hanya pada dosis toksin 0.1 IU/ekor dan 0.2 IU/ekor , apabila dosis toksin ditingkatkan perlindungannya menurun. Peningkatan berat badan berarti kemampuan saluran cerna dalam mencerna pakan masih berfungsi baik, tidak terjadi kekakuan otot daerah perut yang mempengaruhi kinerja saluran cerna, sehingga metabolisme untuk pembentukan energi berjalan baik. Feed Intake Pengukuran feed intake dilakukan untuk mengetahui gangguan fisiologis dari kontraksi otot daerah wajah yang mempunyai fungsi untuk mengunyah, toksin tetanus menyebabkan gangguan otot disekitar wajah yang ditunjukkan dengan kekakuan otot rahang (lock jaw). Sehingga gangguan ini dapat dilihat dari kemampuan hewan itu untuk memakan pakan. Laju konsumsi pakan atau feed intake yaitu kemampuan mengkonsumsi pakan setiap hari yang dinyatakan dalam satuan gram pakan per ekor hewan perhari. Kemampuan itu dipengaruhi oleh beberapa faktor internal seperti preferensi (kecenderungan untuk menyukai satu jenis makanan dibandingkan dengan makanan jenis lain), kondisi fisiologis (termasuk tingkat kesakitan atau distres serta tingkat kelelahan), kondisi kesehatan, serta faktor eksternal seperti jenis makanan (Carlson 1994). Kebutuhan pakan mencit normal berkisar 15 gr/100 gram BB/hari dengan kisaran berat badan mencit 15 sampai 17 gram maka kebutuhan pakannya berkisar 6 sampai 8 gram/hari/ekor. Pertambahan berat badan mencit masa pertumbuhan 4 sampai 5 minggu adalah senilai 1 ± 0.5 gram/ekor/hari. Pada pengamatan feed intake pemberian IgY antitetanus dengan dosis tantang toksin 0.1 IU/ekor menunjukan kecenderungan yang meningkat baik pada dosis IgY antitetanus 0.2, 0.4, 0.8 dan 1 IU/ekor. Hal yang sama juga 79 ditemukan pada dosis tantang 0.2 IU/ekor. Pada dosis tantang toksin 0.3 IU/ekor kecenderungan garis regresi menurun kecuali pada dosis IgY antitetanus 0.8 IU/ekor meningkat, sedangkan pada dosis tantang toksin 0.4 IU/ekor kecenderungan garis regresi menurun hanya pada dosis IgY antitetanus 0.2 IU/ekor karena hewan kebanyakan sudah sakit sehingga kesulitan mencari tempat pakan. Dosis Toksin 0.1IU/ekor Dosis Toksin 0.2 IU/ekor 12 12 10 10 8 Feed intake (g/ekor) Feed intake (g/ekor) 8 6 4 2 6 4 2 0 0 0 0 1 2 3 4 5 1 0.4. Linear (0.4.) 0.8 Linear (0.8) 3 4 5 6 Hari Ke 6 Hari Ke 0.2 Linear (0.2) 2 1 Linear (1) 0.2 0.4. 0.8 1 Linear (0.2) Linear (0.4.) Linear (0.8) Linear (1) Dosis Toksin 0.3 IU/ekor Dosis Toksin 0.4 IU/ekor 12 8 8 6 6 Feed Intake (g/ekor) 10 Feed intake (g/ekor) 10 4 2 0 -2 0 1 2 3 4 5 6 4 2 0 0 1 2 3 4 5 Hari Ke Hari ke 0.2 0.4. 0.8 1 0.2 0.4. 0.8 1 Linear (0.2) Linear (0.4.) Linear (0.8) Linear (1) Linear (0.2) Linear (0.4.) Linear (0.8) Linear (1) Gambar 28 Pola kecenderungan garis regresi feed intake mencit 6 80 Laju Respirasi Energi metabolisme biasanya dapat dihitung dengan mengukur besarnya konsumsi oksigen yang dibutuhkan dalam jangka waktu tertentu. Laju konsumsi oksigen yaitu banyaknya oksigen yang dikonsumsi per gram berat badan per satuan waktu dalam jam pada tekanan dan suhu tertentu. Satuan laju konsumsi oksigen adalah mL oksigen/gram berat badan/jam (Suripto 1998). Laju konsumsi salah satunya dipengaruhi kemampuan otot respirasi dalam mengerakan rongga dada. Pada kasus tetanus kekakuan otot daerah dada yang berperan dalam proses respirasi mengalami kekakuan, sehingga laju respirasi digunakan sebagai indikator fisiologis pengaruh toksin tetanus. Dosis IgY 0.4 IU/ekor Dosis IgY 0.2 IU/ekor 6.00 6.00 5.00 5.00 4.00 4.00 mL O2/g BB/jam 3.00 mL O2/g BB/jam 3.00 2.00 2.00 1.00 1.00 0.00 -1.00 0 1 2 3 4 5 0.00 6 -1.00 0 1 2 Hari ke 0.1 0.4 Linear (0.1) Linear (0.2) 0.2 Ktr Neg Linear (Stl) Linear (0.3) 0.1 0.4 Linear (0.1) Linear (0.4) 0.3 Stl Linear (Ktr Neg) Linear (0.4) 4 5 6 0.2 Ktr Neg Linear (0.2) Linear (Ktr Neg) 0.3 Stl Linear (0.3) Linear (Stl) Dosis IgY 1IU/ekor Dosis IgY 0.8 IU/ekor 7.00 3 Hari Ke 6.00 6.00 5.00 4.00 4.00 mL O2/g BB/jam mL O2/g BB/jam 5.00 3.00 3.00 2.00 2.00 1.00 1.00 0.00 0.00 0 1 2 3 4 5 6 Hari Ke 0.1 0.4 Linear (0.1) Linear (0.4) 0.2 Ktr Neg Linear (0.2) Linear (Ktr Neg) 0.3 Stl Linear (0.3) Linear (Stl) 0 1 0.1 0.4 Linear (Stl) Linear (0.3) 2 3 Hari Ke 0.2 Ktr Neg Linear (0.1) Linear (0.4) 4 5 6 0.3 Stl Linear (0.2) Linear (Ktr Neg) Gambar 29 Pola kecenderungan garis regresi laju respirasi mencit. Peningkatan konsumsi oksigen pada dosis IgY antitetanus 0.8 IU/ekor berbeda nyata dengan dosis 0.2 IU/ekor (Gambar 30). Dibandingkan dengan 81 dosis yang lain meskipun meningkat tetapi peningkatannya tidak berbeda nyata. Peningkatan konsumsi oksigen nyata pada hari ketiga, kemudian menurun secara nyata pada hari kelima. Konsumsi oksigen nyata lebih rendah dibandingkan hari ke-0 (kontrol). Gradien garis regresi pada semua perlakuan menurun kecuali pada dosis IgY antitetanus 1 IU/ekor dengan dosis tantang 0.4 IU/ekor (Gambar 29). Kebutuhan oksigen meningkat pada hari ketiga, kemudian turun pada hari kelima. Peningkatan kebutuhan oksigen hari ketiga dapat disebabkan hewan dalam masa kritis untuk penyembuhan sehingga diperlukan banyak oksigen untuk pemulihan, sedangkan pada hari kelima, hewan mulai pulih atau tetap sakit. Dosis IgY 0.2 IU/ekor Dosis IgY 0.4 IU/ekor 6.00 6.00 5.00 5.00 4.00 mL O2/g BB/jam mL O2/g BB/jam 4.00 3.00 2.00 1.00 3.00 2.00 1.00 0.00 0.00 0 3 0 5 3 Hari Ke Hari Ke 0.1 0.2 0.3 0.4 Ktr Neg 0.1 Stl 0.2 Dosis IgY 0.8 IU/ekor 0.3 0.4 Ktr Neg Stl Dosis IgY 1IU/ekor 7.00 6.00 6.00 5.00 5.00 4.00 4.00 mL O2/g BB/jam mL O2/g BB/jam 5 3.00 2.00 3.00 2.00 1.00 1.00 0.00 0.00 0 0.1 0.2 3 Hari Ke 0.3 0.4 5 0 3 5 Hari Ke Ktr Neg Stl 0.1 0.2 0.3 Gambar 30 Konsumsi oksigen mencit. 0.4 Ktr Neg Stl 82 Mencit sehat memiliki kisaran laju respirasi senilai 6.66 ml O2/jam/kg BB atau 1.65 ml O2/jam/g BB yang digunakan untuk aktivitas harian. Metabolisme basal mencit yang lebih muda lebih tinggi dari mencit dewasa karena ukuran tubuhnya yang lebih kecil membutuhkan energi yang tinggi untuk pertumbuhan. Beberapa faktor internal yang mempengaruhi laju respirasi adalah jenis kelamin, aktivitas, dan pertumbuhan. Laju respirasi akan lebih tinggi pada hewan jantan, aktif bergerak, dan dalam masa pertumbuhan (Suripto 1998), faktor lain yang berpengaruh adalah suhu udara, kelompok hewan eksoterm atau endoterm, habitat, kadar oks igen udara, dan tekanan parsial O2 Persamaan garis regresi pengujiannya menggunakan gradien, dengan persamaan y = ax + b dengan R2 = c. Nilai gradien a positif menunjukkan dosis tertentu pada parameter tersebut meningkat seiring dengan pertambahan waktu. Standar deviasi b menunjukkan seberapa besar penyimpangan yang diberikan terhadap nilai rataan dari setiap populasi data. Nilai korelasi kuadrat c dipandang sebagai nilai kedekatannya dengan respon homogen tiap populasi. Semakin dekat nilai R2 ke 1, maka semakin sempit penyimpangan terhadap grafik yang diberikan. Refleksitas Hewan coba yang masih bertahan hidup sampai hari kelima (hari terakhir pengamatan) di ukur daya refleksitasnya dengan melihat kemampuan renang dari mencit. Hal ini dilakukan untuk mengetahui terbebasnya mencit dari pengaruh kekakuan otot gerak. Pada pemberian dosis IgY antitetanus 0.4 IU/ekor dengan dosis tantang toksin 0.2 IU/ekor memiliki kemampuan renang mirip dengan kelompok sentinel dan kontrol negatif sedangkan perlakuan yang lain kemampuan renang lebih rendah dari kelompok kontrol (Gambar 31). Effendi (2005) melaporkan kemampuan berenang mencit selama 2 sampai 5 menit secara penuh. Pada penelitian ini, kemampuan berenang diukur saat mulai dilepas di air sampai mencit itu berhenti menggerakan kaki, meskipun dalam beberapa detik lagi mencit akan berenang kembali. Dalam hal ini pengukuran tidak secara penuh. Rendahnya kemampuan renang dari mencit menandakan bahwa kelelahan dari otot gerak masih terjadi, meskipun mencit terlihat jalannya normal. Perlu dipikirkan, dalam penanganan kasus tetanus selain pemberian serum 83 antitetanus dan imunisasi dengan toksoid, diberikan juga obat-obatan atau vitamin untuk mempercepat pulihnya reflek otot. Lama renang (detik) Kemampuan berenang 90 80 70 60 50 40 30 20 10 0 Toksin 0.1 Toksin 0.2 Toksin 0.3 Toksin 0.4 0.2 0.4. 0.8 1 Ktr- sentinel Dosis IgY (IU/ekor) Gambar 31 Kemampuan lama berenang mencit Pemberian IgY antitetanus Secara Oral Pada perlakuan pemberian secara oral, masing-masing mencit di cekok lewat mulut dengan sonde. Mencit dibagi dalam tiga kelompok dengan pemberian masing-masing sekali, dua kali dan tiga kali IgY antitetanus. Dari ketiga kelompok mencit itu setelah di tantang dengan toksin semua mencit mati pada hari pertama (Tabel 10). Tabel 10 Persentase mencit yang hidup setelah diberi IgY antitetanus secara oral Dosis Jumlah Hari Pemberian (0.5 Ktr + Ktr Sentinel Toksin ml/ekor) (IU/ekor) 1 2 3 0.1 0 0 0 0 100 100 0.2 0 0 0 0 100 100 0.3 0 0 0 0 100 100 0.4 0 0 0 0 100 100 Keterangan: Stl : Sentinel, tidak diperlakukan dengan IgY dan Uji tantang toksin Ktr + : Kontrol positif, tidak diberikan IgY tetapi di tantang dengan toksin Ktr - : Kontrol negatif, diberikan IgY tetapi tidak ditantang toksin Hal ini menunjukkan IgY anti tetanus tidak efektif diberikan secara oral untuk tujuan imunoterapi pasif pencegahan penyakit secara sistemik pada hewan dewasa, tetapi perlu dilakukan uji lebih lanjut dengan pemberian secara oral lebih 84 lama dan dosis yang lebih tinggi untuk memperkuat temuan di atas. Pemberian IgY untuk imunoterapi sistemik yang diberikan pada bayi dengan mencampurkan pada susu formula perlu dilakukan penelitian lanjutan. Peluang untuk diberikan pada bayi baru lahir secara oral sangat prospektif mengingat hasil penelitian beberapa ahli. Beberapa peneliti melaporkan IgY dapat diserap melalui saluran cerna pada umur bayi. Yokohama et al. (1993) melaporkan IgY diserap dan ditransfer secara efesien ke dalam darah seperti kolustrum pada anak babi. IgY diserap secara efisien dari usus sampai umur 34 jam setelah lahir, setelah umur itu penyerapan IgY melalui usus tertutup. IgY mempunyai waktu paruh 1.85 hari dalam serum anak babi baru lahir. Waktu ini lebih pendek dibandingkan dengan IgG (12 sampai 14 hari). Penyerapan IgY bervariasi tergantung umur babi, pada babi umur 10 jam IgY telah dapat diidentifikasi pada darah 2 jam setelah pemberian secara oral. Konsentrasi puncak pada serum (85.2 µg/ml) ditemukan 24 jam setelah pemberian dan menurun secara bertahap setelah 21 hari (Yokohama et al. 1993). Pemberian IgY peroral memberikan dampak sistemik sehingga mampu mengertak sistem imun humoral dan selular pada sapi penderita mastitis (Coleman 2000) Hambatan absorbsi IgY pada usus untuk menjadi setengahnya dicapai pada 1.73 jam. Secara normal penurunan konsentrasi imunoglobulin darah karena fungsi katabolisme protein dan pengaruh pengenceran karena bertambahnya ukuran tubuh sejalan dengan peningkatan volume darah. Sifat dari struktur IgY seperti berat molekul, bentuk domain IgY, ikatan intramolekul, kekurangan ikatan disulfida yang menghubungkan rantai ringan, dan rendahnya fleksibilitas regio hinge mempengaruhi secara umum sifat dari IgY dan faktor struktur ini mempengaruhi stabilitas molekul IgY (Shimizu et al. 1992). IgY juga kurang tahan dan stabil terhadap kondisi asam, dan perjalanan molekul IgY pada lambung dengan pH rendah menurunkan stabilitas IgY yang akan mempengaruhi penurunan konsentrasi IgY pada serum (Yokohama et al. 1993). Faktor-faktor yang mempengaruhi efisiensi penyerapan imunoglobulin dalam saluran cerna hewan neonatus adalah umur hewan saat pertama kali mengkonsumsi kolostrum, jenis kelamin, ras atau bangsa hewan, metode 85 pemberian kolustrum, lingkungan hewan saat baru lahir, konsentrasi IgG dalam kolostrum, dan jumlah kolostrum yang dikonsumsi. Pada kambing dilaporkan efisiensi penyerapan IgG berkisar antara 2% sampai 46% (Esfandiari 2005). Kemampuan sel-sel epitel usus halus untuk menyerap makromolekul utuh akan menghilang sekitar 24 jam setelah lahir, hal ini disebabkan karena sel saluran pencernaan telah mengalami maturasi dan perkembangan segera setelah lahir. Rendahnya efisiensi penyerapan juga disebabkan degradasi oleh enzim pencernaan yang segera disekresikan setelah sel pencernaan matang. Sekresi enzim percernaan itu nyata setelah 12 jam lahir (Esfandiari 2005). pH pada lambung bayi sampai umur 5 bulan berkisar antara 4sampai 5, setelah 2 sampai 3 hari minum susu, sehingga denaturisasi IgY tidak perlu dikhawatirkan, tetapi jika untuk konsumsi orang dewasa, proteksi IgY terhadap digesti lambung perlu dipikirkan. Kerusakan IgY setelah didigesti dengan tripsin dan kemotripsin lebih rendah, sehingga mampu melindungi infeksi pada usus (Shimizu et al. 1988) , dengan demikian IgY memiliki ketahanan bila digunakan produk makanan terutama susu formula untuk anak-anak (Davis dan Reeves 2002). KESIMPULAN DAN SARAN Kesimpulan : Dari penelitian karakteristik imunoglobulin Y antitetanus diisolasi dari telur ayam sebagai pengganti antitetanus serum kuda dapat disimpulkan sebagai berikut : 1. Ayam mampu membentuk IgY spesifik antitetanus pada serum da n terkumpul pada kuning telur dengan titer pada serum 34.53 ± 14.94 IU/ml dan pada telur 80.16 ± 33.55 IU/ml dengan nilai potensi sebesar 35 IU/ml. 2. Aktivitas biologis IgY antitetanus menurun setelah perlakuan pH 2 dan 3, enzim protease, tripsin dan pepsin, dan suhu 72.5 oC. Penambahan larutan sukrosa dan larutan glukosa mampu meningkatkan aktivitas biologis IgY antitetanus terhadap perlakuan panas. 3. Pemberian IgY antitetanus secara sub kutan mampu melindungi mencit dari pengaruh dosis letal toksin, sedangkan pemberian secara oral tidak efektif untuk tujuan imunoterapi pasif pada hewan dewasa. Saran Guna mendapatkan titer antitetanus yang tinggi di serum dan telur perlu dilakukan penelitian lebih lanjut mengenai jadwal imunisasi (waktu boster) dan dosis antigen yang tepat yang mampu merangsang pembentukan antibodi secara maksimal. Perlu dilakukan penelitian mengenai zat stabiliser yang tepat dan cocok untuk mempertahankan keutuhan IgY dalam proses penyimpanan dan proses ekstraksi sehingga titer tetap konstan sampai proses akhir purifikasi. DAFTAR PUSTAKA Abbas AK, Lichtman AH, Pober JS. 1997. Cellular and molekular immunology. USA. W. B Saunders Co. Akita EM, Naka S. 1992. Immunoglobulins from egg yolk : isolation and purification. J Food Sci. 57(3):629-634. Akita EM, Nakai S. 1993a. Production and purification of Fab’ fragments from chickens egg yolk immunoglobulin Y (IgY). J Immunol Methods 162:155164. Akita EM, Nakai, S. 1993b. Comparison of four purification methods for the production of immunoglobulins from eggs laid by hens immunized with an enterotoxigenic E. coli strain. J Immunol Methods 160:207–214 Almeida CMC et al. 1998. Development of snake antivenom antibodies in chickens and their purification from yolk. Vet. Rec 143: 579-584. Anonim. 2002. Hyperimmune egg background. http://www.hyperimmuneegg.org/background.htm (4 Maret 2002) Anonim. 2003. Clostridium. http://www.bacteriology.edu/clostridium.htm (10 September 2003). Babu U, Scott M, Myres MJ, Okamura M, Gaines D, Yancy HF, Lillehoj H, Heckert RA, Raybourne RB. 2003. Effects of live attenuated and killed salmonella vaccine on t-lymphocyte mediated immunity in laying hens. Vet Immun And Immunopathol 91:39-44. Benkirane R, Gottschalk MG, Jacques M, Dubreuil JD. 1998. Immunochemical characterization of an IgG-binding protein of Streptococcus suis. FEMS Immunol Med Microbiol 20:121-127. Behn I, Hommel U, Oertel M, Hauschild S. 1996. Kinetics of IgY formation after immunisation of hens with different protein antigens. ALTEX 13: 18-21. Bhanushali JK, Gilbert JM, McDougald LR. 1994. Simple method to purify chic ken immunoglobulin G. Poultry Sci 73:1158-1161. Bizzini B. 1983. Anti-tetanus vaccines. Boll Ist Sieroter Milan 62(6):550-554. Bizzini B. 1993. Clostridium tetani. Dalam C.L. Gyles and C. O. Thoen Edited. Patogenesis of bacterial infections in animal. Ed ke-2. USA. Iowa State University Pr. Bleck TP. 1991. Tetanus : pathophysiology, management, and prophylaxis. Dis Mon 37(9):545-603. Bogoyavlensky AP, Bersin VE, Tolmachva VP. 1999. Immunogenicity of influenza glycoprotein with different forms of supramolecular organization in hens. Balt J Lab Anim Sci 4:99-105. [Brit Ph] British P harmacopoeia. 2002. British Pharmacopoeia. Volume I. (CD Room). United Kingdom.The Stationery Off. Ltd. Brown DA, London E. 2000. Structure, and function of sphingolipid-, and cholesterol-rich membrane raft. J Biol Chem 275:17221-17224. Bruggemann H, Baumer S, Fricke WF, Wiezer A, Liesegang H, Decker I, Herzberg C, Arias RM, Merkl R, Henne A, Gottschalk G. 2003. The genome sequence of Clostridium tetani, the causative agent of tetanus disease. PNAS 100(3):1316-1321. 88 Camenisch G, Tini M, Chilov D, Kvietikova I, Srinivas V, Caro J, Spielmann P, Wenger RH, Gassmann M.1999. General applicability of chicken egg yolk antibodies: the performance of IgY immunoglobulins raised against the hy poxia -inducible factor-1 alpha. FASEB J 13:81-88 Chard T. 1990. Laboratory techniques in biochemistry and molecular biology. An introduction to radioimmunoassay and related techniques.4th Revised Ed. Vol 6, part II. Amsterdam. Elsevier. Carlander D, Stålberg J, Larsson A. 1999. Chicken antibodies: a clinical chemistry perspective. Ups. J Med Sci 104:179-189. Carlander D, Kollberg H, Wejaker PE, Larsson A. 2000. Peroral immunotherapy with yolk antibodies for the prevention and treatment of enteric infections. Immunol Res 21(1):1-6. Carlander D. 2002. Avian IgY antibody. in vitro and in vivo. Dissertations. Canada: Acta Universitatis Upsaliensis. Uppsala. Carlson NR. 1994. Physiology of behavior. 5 th Edition. Allyyn and Bacon. Boston. Cavuslu S, Oncu O, Altunay H, Ozsoy MF, Kocak N. 2003. Seroprevalence of tetanus antibody in Turkish population and effectiveness of single-dose tetanus toxoid. Eur J Clin Microbiol Infect Dis Chan`s. WS, Bando Y, Warr GW, Middleton DL, Higgins DA. 1999. Duck lymphocytes. VIII. T-lymphoblastoid cell lines from reticuloendotheliosis virus-induced tumors. Avian Pathology 28:171-186. Chang HM, Ou-Yang RF, Chen YT, Chen CC. 1999. Productivity and some properties of immunoglobulin specific against streptococcus mutans serotype C in chicken egg yolk (IgY). J Agric Food Chem 47: 61-66. Chang HM, Lu TC, Chen CC, Tu YY, Hwang JY. 2000. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. J Agric Food Chem 48 : 995-999. Coillie EV, Block JD, Reybroeck W. 2004. Development of an indirect competetive ELISA for flumequine residues in raw milk using chicken egg yolk antibodies. J Agric Food Chem Vol 52(16): 4975-4978. Coleman MA. 2000. Using eggs antibodies to treat disease. In Eggs ntrition and technology. Sim JS, Nakai S and Gueter W (Eds). CABI Publishing, Wallingford. UK. Covarelli E, Marconi P. 1980. Prevention of tetanus in the hospital first-aid service. Boll Ist Sieroter Milan 59(5):544-549. Davis C, Reeves R. 2002. High value opportunities from the chicken egg. A report for the rural industries research and development corporation. RIRDC Pub. Doellgast GJ, Brown JE, Koufman JA, Hatheway CL. 1997. Sensitive assay for measurement of antibodies to Clostridium botulinum neurotoxins A, B, and E: use of hapten-labeled-antibody elution to isolate specific complexes. J Clin Microbiol 35:578-583. Effendi CQ. 2005. Efek pengenceran serum antitetanus terhadap netralisasi toksin tetanus pada mus musculus L.strain DDY ditinjau dari respon fisiologis spesifik. (skripsi). Bandung. Departemen Biologi. FMIPA ITB. 89 Emsley P, Fotinou C, Black I, Fairweather NF, Charles IG, Watts C, Hewitt E, Isaacs NW. 2000. The Structures of the Hc fragment of tetanus toxin with carbohydrate subunit complexes provide insight into ganglioside binding. J Biol Chem 275 (12):8889-8894. Erhard MH, Göbel E, Lewan B, Lösch U, Stangassinger M. 1997. Systemic avail ability of bovine immunoglobulin G and chicken immunoglobulin Y after feeding colostrum and whole egg powder to newborn calves. Arch Tierernahr 50:369-380. Esfandiari A. 2005. Studi kinerja kesehatan anak kambing peranakan etawa (PE) neonatus setelah pemberian berbagai sediaan kolostrum. disertasi. Bogor. Pascasarjana Institut Pertanian Bogor. Ester. 2004. Isolasi IgY dari kuning telur ayam arab (Gallus galus) terhadap canine parvovirus serta aplikasinya untuk perangkat pemeriksaan dengan ELISA. Skripsi. PS Kimia. FMIPA. IPB Bogor. Fischer M, Hlinak A, Montag T, Claros M, Schade R, Ebner D. 1996. Comparison of standard methods for the preparation of egg yolk antibodies. Tierarztl Prax 24: 411-418. Ford RC. 2004. Isolasi of protein and nucleic acid. Course notes. http://www.bi.umist.ac.uk/teaching/module/. 24 Juli 2004. Forrat R, Dumas R, Seiberling M, Merz M, Lutsch C, Lang J. 1998. Evaluation of the safety and pharmacokinetic profile of a new, pasteurized, human tetanus immunoglobulin administered as sham, postexposure prophylaxis of tetanus. Antimicrobial Agents and Chemotherapy. 42(2):298-305. Fortgens PH, Dennison C, Elliott E. 1997. Anti-cathepsin D chicken IgY antibodies: Characterisation, cross-species reactivity and application in immunogold labelling of human splenic neutrophils and fibroblasts. Immunopharmacology 36:305-311. Fotinou C, Emsley P, Black I, Ando H, Ishida H, Kiso M, Sinha KA, Fairweather NF, Isaacs NW 2001. The crystal structure of tetanus toxin Hc fragment complexed with A synthetic GT1b analogue suggest cross -linking between ganglioside receptor and the toxin. J Biol Chem 276 (34): 32274-32281. Fryer J, Firca J, Leventhal J, Blondin B, Malcolm A, Ivancic D, Gandhi R, Shah A, Pao W, Abecassis M, Kaufman D, Stuart F, Anderson B.1999. IgY antiporcine endothelial cell antibodies effectively block human antiporcine xenoantibody binding. xenotransplantation 6:98-109. Grangette C, Alouf HM, Goudercourt D, Geoffroy MC, Turneer M, and Mercenier A. 2001. Mucosal immune responses and protection against tetanus toxin after intranasal immunization with recombinant Lactobacillus plantarum. Infect and Immun. 69 (3):1547-1553. Gassmann M, Thommes P, Weiser T, Hubscher U. 1990. Efficient Production of Chicken Egg Yolk Antibodies Against A Conserved Mammalian protein. FASEB J Vol 4: 2528-2532. Gassman M. 2002. Generation of polyclonal antibodies in the egg yolk. Dalam Ronald Ross Watson Edited. Egg and health promotion. Iowa State Pr. Pp.61-67. Gross M, Speck J. 1996. Avian yolk antibodies in diagnosis and research. Dtsch Tierarztl Wochenschr 103:417-22. 90 Guildolin R, Stephano MA, Morais JF, Sakaguti EH, Prado SMA, Fratelli F, Vancetto MDC, Higashi HG. 1998. Production of an effective antibothrops - tetanus mixed hyperimmune serum of equine origin. J Venom Anim Toxins 4(1):252-260. Gutierrez MA, Miyazaki T, Hatta H, Kim M. 1993. Protective properties of egg yolk IgY containing anti –Edwardsiella tarda antibody against paracolo disease in the Japanese eel, Aquilla japonica Temmick and Schlegel. J Fish Dis 16 : 113-122. Gutierrez CG, Garcia RMG, Schade R. 2001. Human haemoclassification by use of spesifik yolk antibodies obtained after immunisation of chickens against human blood group antigens. Altern Lab Anim 29:717-726. Guyton AC.1995. Fisiologi Manusia dan mekanisme Penyakit. Penerbit Buku Kedokteran EGC. Jakarta. Habermann E. 1988. Structure and function of tetanus toxin. Approaches by DNA and protein chemistry. Dalam Charlotte L. Ownby & George V. Odell Edited. Natural toxins. Characterization, pharmachology, and therapeutics. Proceedings of the 9th World Congress On Animal, Plant, and Microbial Toxins. Stillwater, Oklahoma. August, 1988. Pergamon. Hadge D. 1985. Evolution of the immunoglobulins. Allerg Immunol (Leipz ) 31: 231-243. Hadge D, Ambrosius H. 1984. Evolution of low molecular weight immunoglobulins. IV. IgY -like immunoglobulins of bird, reptile, and amphibians, precursors of mammalian IgA. Molecular Immunology 21(8): 699-707. Hadge D, Ambrosius H.1986. Evolution of Low Molecular Weight Immunoglobu lins. V. Degree of Antigenic Relationship Between The 7S Immunoglobulins of Mammals, Bird, and lower Vertebrates to The Turkey IgY. Dev Comp Immunol 10:377-85. Halliwell REW, and Gorman NT. 1989. Veterinary Clinical Immunology. Phila delphia.W. B. Saunders. Halper J, Grubman MJ, Jacobsen KL. 1999. Development of chicken Antibodies to bovine interferon alpha. Immunol Invest 28 : 19-27. Halpern JL, Loftus A. 1993. Characterization of the receptor-binding domain of tetanus toxin. J Biol Chem 268:11188-11192. Hamada S, Horikoshi T, Minami T, Kawabata S, Hiraoka J, Fujiwara T, Ooshima T. 1991. Oral passive immunization against dental caries in rats by use of hen egg yolk antibodies specific for cell-associated glucosyltransferase of Streptococcus mutans. Infect Immun 59 (11):4161-4167. Hames BD, Rickwood D. 1987. Gel electrophoresis of protein. Oxford Washington DC. IRL Press. Hansen P, Scoble JA, Hanson B, Hoogenraad NJ. 1998. Isolation and Purification of Immunoglobulins from Chicken Eggs Using Thiophilic Interaction Chromatography. J Immunol Methods 215:1-7 Hassl A, Aspock H, Flamm H. 1987. Comparative Studies on the Purity and Specificity of Yolk Immunoglobulin Y Isolated from Eggs Laid by Hens Immunized with Toxoplasma gondii. Zentralbl Bakteriol Mikrobiol Hyg (A) 267 : 247 – 253. 91 Hatta H, Tsuda K, Akachi S, Kim M, and Yamamoto T. 1993. Productivity and some properties of egg yolk antibody (IgY) against human rotavirus compared with rabbit IgG. Biosci Biotechnol Biochem 57: 450–454 Hatta H, Tsuda K, Ozeki M, Kim M, Yamamoto T, Otake S, Hirasawa M, Katz J, Childers NK, Michalek SM. 1997. Passive immunization against dental plaque formation in humans: effect of a mouth rinse containing egg yolk antibodies (IgY) specific to Streptococcus mutans. Caries Res 31:268274. Hedlund GP, Hau J. 2001. Oral immunisation of chickens using cholera toxin B subunit and soft antigen as adjuvants results in high antibody titre in the egg yolk. In Vivo 15(5):381-384. Herreros J, Lalli G, Montecucco C, Schiavo G. 2000. Tetanus toxin fragment C binds to a protein present in neuronal cell lines, and motor neurons. J Neurochem 74: 1941-1950 Herreros J, Tony Ng, Schiavo G. 2001. Lipid rafts act as specialized domains for tetanus toxin binding and internalization into neurons. Mol Biol Cell 12 (10): 2947-2960. Higgins DA, Cromie RL, Liu SS, Magor KE, and Warr GW. 1995. Purification of duck immunoglobulins: an evaluation of protein A and protein G affinity chromatography. Vet Immunol Immunopathol 44: 169–180. Horie K, Horie N, Abdou AM, Yang JO, Yun SS, Chun HN, Park CK, Kim M, Hatta H. 2004. Suppressive effect of fungtional drinking yogurt containing specific egg yolk immunoglobulin on Helicobacter pylori in human. J Dairy Sci 87: 4073-4079. Ikemori Y et al. 1997. Passive protection of neonatal calves against bovine corona virus-induced diarrhea by administration of egg yolk or colostrum antibody powder. Vet Microbiology 58: 105-111 Jensenius JC, Andersen I, Hau J, Crone M, Koch C. 1981. Eggs: Convenently packaged antibodies. Methods for purification of yolk IgG. J. Immunol Meth. 46:63-68. Karlsson M, Kollberg H, Larsson A. 2004. Chicken IgY: Utilizing the evolutionnary advantage. World’s Poultry Sci J Vol 60 :341-347. Katz D, Lehrer S, Kohn A. 1985. Use of chicken and rabbit antibodies in a solid phase protein A radioimmunoassay for virus detection. J Virological Methods 12 : 59-70. Kermani-Arab V, Moll T, Cho BR, Davis WC, Lu YS. 2001. Effects of Ig Y anti bodi on the development of marek’s. disease. Avian Dis 20: 32 – 41. Kiefer K. 2004. Tetanus- Clostridium tetani. http://www.bacterialdisease.edu/clostridiumtetani.html (10 Maret 2004) Kim HO, Durance TD, Li-Chan EC. 1999. Reusability of avidin-biotinylated immunoglobulin Y columns in immunoaffinity chromatography. Anal Biochem 268 : 383-397. Knight A, Carvajal J, Schneider H, Coutelle C, Chamberlain S, Fairweather N. 1999. Non-viral neuronal gene delivery mediated by the HC fragment of tetanus toxin. Eur J Biochem 259:762-769. Kristiansen M, Aggebeck H, Heron I. 1997. Improved ELISA for determination of anti-diphtheria and/or anti-tetanus antitoxin antibodies in sera. APMIS 105: 843-853. 92 Kuby J. 1997. Immunology. Ed ke -3. New York W.H. Freeman and Co. Kummer A, Li-Chan EC. 1998. Application of an ELISA-elution assay as a screening tool for dissociation of yolk antibody-antigen complexes. J Immunol Methods 211 : 125-137. Lalli G, Herreros J, Osborne SL, Montecucco C, Rossetto O,. Schiavo G. 1999. Fungtional characterization of tetranus and botulinum neurotoxins binding domains. J Cell Science 112:2715-2724. Lalli G, Gschmeissner S, Schiavo G. 2003. Myosin Va and microtubule-based motors are required for fast axonal retrograde transport of tetanus toxin in motor neurons. J Cell Science 116:4639-4650. Larsson A, Balow R-M, Lindahl TL, and Forsberg P-O. 1993. Chicken antibodies taking advantage of evolution. (A Review). Poultry Sci 72 : 1807 – 1812. Lee SC, Lee KN, Schwartzott DG, Jackson KW, Tae WC, McKee PA. 1997. Purification of human alpha 2-antiplasmin with chicken IgY specific to its carboxy-terminal peptide. Prep Biochem Biotechnol 27 : 227-237. Lee SB, Mine Y, Stevenson RMW. 2000. Effect of hen egg yolk immunoglobulin in passive protection of Rainbow trout against Yersinia ruckeri. J. Agric. Food. Chem. 48 : 110 – 115. Lee EN, Sunwoo HH, Menninen K, Sim JS. 2002. In vitro studies of chicken egg yolk antibody (IgY) against Salmonella enteritidis and Salmonella typhimurium. Poult Sci 81(5):632-641. Lewis C. 1998. Aspects of clostridial disease in sheep. In Practice. Oktober 1998. Li X, Nakano T, Sunwoo HH, Paek BH, Chae HS, Sim JS. 1998. Effects of egg and yolk weights on yolk antibody (IgY) production in laying chickens. Poult Sci 77(2) : 266-270. Liddell E, Weeks I. 1995. Antibody Technology. BIOS Bioscience Publisher Limited. UK. Losch U, Schranner I, Wanke R, and Jurgen L.1986. The chicken egg, an antibodi source. J Vet Med B33: 609 – 619. Losonczy S, Szabó C, Kiss Z, Bárdos L. 1999. Application of an anti-HQIgY antibody for the measurement of IgY concentrations of hen's and quail's serum and yolk. Acta Physiol Hung 86 : 253-258 . Lundqvist ML, Middleton DL, Hazard S, and Warr GW.2001.The immunoglobulin heavy chain locus of the duck. genomic organization and expression of D, J, and C region genes. J Boil Chemistry 276(50): 4672946736. Magor KE, Warr GW, Middleton D, Wilson MR, and Higgins DA. 1992. Structural relationship between the two igy of the duck, anas platyrhynchos: molecular genetic evide nce. The J of Immunology149 (8) : 2627-2633. Magor KE, Higgins DA, Middleton DL, Warr GW. 1994a. One gene encode the heavy chains for three different from of IgY in the duck. The J of Immunology 153 : 5549-5555 Magor KE, Higgins DA, Middleton DL, Warr GW. 1994b. cDNA sequence and organization of the immunoglobulin light chain gene of the duck, Anas platyrhynchos. Devl and Comp Immunol.18 (6): 523-531. 93 Magor KE, Warr GW, Bando Y, Middleton DL, Higgins DA. 1998. Secretory immune system of duck (Anas platyrhynchos). Identification and expression of the genes encoding IgA and IgM heavy chains. Eur J Immunol 28: 1063 – 1068. Makoto SC, Robert F, Shuryo N. 1998. Anti-E. coli immunoglobulin in Y isola ted from egg yolk of immunized chicken as a potensial food ingredient. J Food Sci 53:1361–1365. Makvandi M, Fiuzi R. 2002. Purification of anti-HbsAg from egg yolks of immunized hens and its application for detection of HbsAg. Arch Iranian Med 5 (2) : 91 – 93. Male D, Champion B, Cooke A.1987. Advan immunology. London. JB. Lippincott Co. Maple PAC, Jones CS, Andrews NJ. 2001. Time resolved fluorometric immunoassay, using europium labelled antihuman IgG, for the detection of human tetanus antitoxin in serum. J Clin Pathol 54:812-815. Maral I, Cirak M, Aksakal FN, Baykan Z, Kayikcioglu F, Bumin MA. 2001. Tetanus immunization in pregnant women. serum levels of antitetanus antibodies at time of delivery. Eur J Epidemiol 17(7): 661-665. Marti E, Peveri P, Griot-Wenk M, Muntwyler J, Crameri R, Schaller J, Gerber H, Lazary S. 1997. Chicken antibodies to a recombinant fragment of the equine immunoglobulin epsilon heavy-chain recognising native horse IgE. Vet Immunol Immunopathol 59:253-270. Martini FH. 2001. Fundamentals of anatomi and physiology. New Jersey. Prentice hall Inc. Marvaud JC, Eisel U, Binz T, Niemann H, and Popoff MR. 1998. TetR is a positive regulator of the tetanus toxin gene in Clostridium tetani and is homologous to BotR. Infec and Immun 66(12):5698-5702. Matos DCS, Marcovistz R, Cabello PA, Georgini RA, Sakauchi D, Silva LL da. 2002. Immunogenicity test of tetanus component in adsorbed vaccines by toxin binding inhibition test. Mem Inst Oswaldo Cruz, Rio de Janeiro 97(6): 909-913. Miana-Mena FJ, Roux S, Benichou JC, Osta R, and Brulet P. 2002. Neuronal activity-dependent membran traffic at the neuromuscular junction. PNAS 99(5): 3234-3239. Mims CA. 1982. The pathogenesis of disease . Infectious disease. Second Ed. Academic Pr. London. Murata T, Saito S, Shiozaki M, Lu RZ, Eto Y, Funaba M, Takahashi M, Torii K. 1996.Anti-activin A antibody (IgY) specifically neutralizes various activin A activities. Proc Soc Exp Biol Med 211:100-107 . Nakai S, Li-Chan E, and Lo KV.1994. Separation of immunoglobulin from egg yolk. Dalam Eggs uses and processing technologies new developments. Edited by J.S. Sim and S. Nakai. Cab International.pp 95-105 Narat M. 2003. Production of antibodies in chickens. Food Technol. Biotechnol (3):259-267 Nasution MS. 1987. Hal ihwal imunisasi dan aplikasinya. Perum Biofarma Gorawastu. Bandung. 94 Nielsen PM. 1997. Fungtionality of protein hydrolysates. Di dalam Food protein and their application, S Damodaran and A Paraf. New York. Marcell Dekker. pp 443-472. Orsini G, Lavoie P, Smith CE, and Nanci A. 2001. I mmunochemical characterization of a chicken egg yolk antibody to secretory forms of rat incisor amelogenin. J Histochem Cytochem 49:285-292. Othani H, Matsumoto K, Saeki A, Hasono A. 1991. Comparative studies on properties of hen egg yolk IgY and rabbit serum IgG antibodies. Lebensm Wiss Technol 24 : 152-158. Paryati SPY. 2006. Antibodi anti-idiotipe sebagai kandidat vaksin rabies. (disertasi). Bogor: Program Pascasarjana, Institut Pertanian Bogor. Plessis, DH du, Wyngaardt W van, Romito M, Plessis M du, Maree S. 1999. The use of chicken IgY in a double antibody sandwich ELISA for detecting african horsesickness virus. Onderstepoort J Vet Res 66:25-28. Polson A, Wechmar MB von, and Regenmortel MHV von. 1980. Isolation of viral IgY antibodies from yolk of immunized hens. Immunological Communication 9 : 475 – 493. Polson A. 1990. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunol Invest 19 (3) : 253-258. Porter JD, Perkin MA, Corbel MJ, Farrington CP, Watkins JT, Begg NT. 1992. Lack of learly antitoxin respone to tetanus booster. Vaccine 10(5) : 334-6 . PT Biofarma. 2003. Prosedur baku uji potensi baku pembanding ATS. Bandung. PT Biofarma (Persero). Rappuoli R, Montecucco C. 1997. Guidebook to protein toxins and their use in cell biology. United Kingdom. Oxford University Press. Rawendra R. 2005. Prospek pengembangan imunoglobulin Y (IgY) kering beku sebagai nutraceutical food anti enteropathogenic escherichia coli (EPEC). (disertasi). Bogor: Program Pascasarjana, Institut Pertanian Bogor. Ray S. 2004.Tetanus. http://www.emedicine.com/cgi-bin/tetanus/ (10 Maret 2004) Regenmortel MHV van. 1993. Eggs as protein and antibodi factory. Dalam proceedings of the European symposium on the quality of poultry meat. Tours , France INRA . pp 257 -263. Roitt IM. 2003. Imunologi. Essential immunology. Alih bahasa Harahap A,. Kurni awan L, Djauzi SL, Kresno SB, Dachlan YP. Ed ke-8.Cetakan I. Jakarta. Widya Medika. Rowe J, Macaubas C, Monger TM, Holt BJ, Harvey J, Poolman JT, Sly PD, Holt PG. 2000. Antigenic -specific responses to diphtheria -tetanus-acellular pertussis vaccine in human infants are initially Th2 polarized. Infec And Immun 68(7): 3873-3877. Sasse M, Krüger M, Schade R, Hlinak A. 1998. Generation and characterrization of avian vitelline antibodies against lipopolysaccharide and lipid A. 1. Induction and preparation of specific egg yolk antibodies (IgY) against endotoxins. Berl Munch Tierarztl Wochenschr 111 : 121-126. Rummel A, Bade S, Alves J, Bigalke H, Binz T. 2003. Two carbohydrate binding sites in the Hcc-domain of tetanus neurotoxin are required for toxicity. J Mol Biol 326: 835-847. 95 Schade R, Staak C, Hendriksen C, Erhard M, Hugl H, Koch G, Larsson A, Pollmann W, Rogenmortel M van, Rijke E, Spielmann H, Steinbusch H, Straughan D.1996. The Production of avian (egg yolk) antibodies : Ig Y. Alternatives to Laboratorium Animal 24 : 925 – 934. Schade R, Hlinak A. 1996. Egg yolk antibodies, state of the art and future prospects. ALTEX 13(5):5-9. Schatz D, Ellis T, Ottendorfer E, Jodoi E, Barrett D, Atkinson M. 1998. Aging and the immune respon to tetanus toxoid : diminished frequency and level of cellular immune reactivity to antig enic stimulation. Clin and Diag Lab Immun 5 (6):894-896. Schroder JP, and Kuhlmann WD. 1991. Detection of tetanus antitoxin using Eu3+labeled anti-human immunoglobulin G monoclonal antibodies in a timeresolved fluorescence immunoassay. J of Clin Microbiol 29(1): 15041507. Schmidt P, Hafner A, Reubel GH, Wanke R, Franke V, Losch U, Dahme E. 1989. Production of antibodies to canine distemper virus in chickens eggs for immunochemistry. J. Vet. Med. B 36:661-668. Sesardic DM, Wong Y, Das GRE, Corbel MJ. 1993. The first international standard for antitetanus immunoglobulin, human; pharmaceutical evaluation nd international collaborative study. Biologicals 21(1):67-75. Sharma JM. 1997. Biochemical characterization of mammalian translation initiation factor 3 (eIF3). The structure and function of the avian immune system. Acta Vet Hung 45 : 229-238. Shimizu M, Fitzsimmons RC, and Nakai S. 1988. Anti-E. coli immunoglobulin Y isolated from egg yolk of immunized chicken as a potential food ingredient. J Food Sci 53(5):1360-1366. Shimizu M, Nagashima H, Sano K, Hashimoto K, Ozeki M, Tsuda K, Hatta H. 1992. Molecular stability of chicken and rabbit immunoglobulin G. Biosci Biotechnol Biochem 56, 270–274 Shin JH, Yang M, Nam SW, Kim JT, Myung NH, Bang WB, R oe IH. 2002. Use of egg yolk-derived immunoglobulin as an alternative to antibiotic treatment for control of Helicobacter Pylori infection. Clin Diagn Lab Immunol. 9(5):1061-1066. Shin JH, Roe IH, Kim HG. 2004. Production of anti- Helicobacter pylori ureasespecific immunoglobulin in egg yolk using an antigenic epitope of H. pylori urease. J Med Microbiol 53 : 31-34. Siegmund O H. 1979. The merck veterinary manual. a handbook of diagnosis and therapy for the veterinarian. Ed ke-7. USA.Merck &Co. Soeharsono. 5 Pebruari 2005. Tetanus serang manusia dan hewan. mewaspadai korban-korban pascatsunami. Kompas : 50 (kolom 1- 5). Song CS, Yu JH, Bai DH, Hester PY, and Kim KH.1985. Antibodies to the α sudunit of insulin receptor from eggs of immunized hens. The J of Immunology 135(95):3354-3359. Sriram V, Jebaraj CE, Yogeeswaran G. 1999. Chicken egg yolk anti-asialo GM1 immunoglobulin (IgY): an inexpensive glycohistochemical probe for localization of T-antigen in human colorectal adenocarcinomas. Indian J Exp Biol 37:639-649. 96 Suartha IN, Watiniasih NL, Fuentes A. 2002. Kesembuhan luka monyet ekor pan jang di obyek wisata wanarawana Padang Tegal Ubud. J Vet 3(2) : 50-54. Sugita-Konishi Y et al. 1996. Immune functions of immunoglobulin Y isolated from egg yolk of hens immunized with various infectious bacteria. Biosci Biotechnol Biochem 60 : 886-888 . Sun S, Mo W, Ji Y, Liu S. 2001. Preparation and mass spectrometric study of edd yolk antibody (IgY) against rabies virus. Rapid commun. Mass spedtrom. 15:708-712. Sunwoo HH, Lee EN, Menninen K, Suresh MR , Sim JS. 2002. Growth inhibitory effect of chickens eggs yolk antibody (IgY) on Escherichia coli O 157:H7. J.Food. Sci. 67(4): 1486-1494 Svendsen L, Crowley A, Ostergaard LH, Stodulski G, Hau J. 1995. De velopment and comparison of purification strategies for chicken antibodies from egg yolk. Lab Anim Sci 45:89–93. Szabo CS, Bardos L, Losonczy S, Karchesz K. 1998. Isolation of antibodies from chicken and quail eggs. http://www.mcmaster.ca/inabis98/immunology/szabo0509/index.html. (23 Juni 2003) Suripto. 1998. Fisiologi Hewan. Penerbit ITB Bandung. Tizard IR. 1988. Pengantar imunologi veteriner. Edisi kedua. Partodiredjo M. Penerjemah. Surabaya. Penerbit Universitas Airlangga. Todar K. 2002. Mechanisms of bacterial pathogenicity : Protein toxins. http://www.textbookofbacteriology.net/ (6 Maret 2004). Tsen YC et al. 2003. Evaluation and validation of a duck IgY antibody-based immunoassay for high-sensitivity c-reactive protein: avian antibody application in clinical diagnostics. Clinical Chemistry 49: 810-813. Vandelaer J, Birmingham M, Gasse F, Kurrian M, Shaw C, Garnier S. 2003. Tetanus in developing countries : an update on the maternal and neonatal tetanus elimunation initiative. Vaccine 21(4):3442-3445. Warr GW, Higgins DA. 1995. Duck Immunoglobulins : Structure, functions and melecular genetics. Avian Pathol 22 : 211- 236. Wibawan IWT, Pasaribu FH, Utama IH, Laemmler C. 1999. The role of hyaluronic acid capsular material of Streptoccocus equi subsp. zooepidemicus in mediating adherence to HeLa cells and resist phagocytosis. Res Vet Sci. 67:131-135. Wibawan IWT, Djannatun T, dan Halimah LS. 2003. Pengujian teknik koaglutina si tidak langsung untuk deteksi penyakit unggas. Hibah Bersaing XI 2003 – 2004 Whitaker JR. 1994. Principles of enzymology for the food sciences. 2nd ed. p. 499503. Food Science and Technology. New York. Mercel Dekker. Williamson LC, Bateman KE, Clifford JCM, Neale EA. 1999. Neuronal sensitivity to tetanus toxin requires gangliosides. J Biol Chem 274:2517325180. Wilson K, and Walker J, Editor. 2000. Principles and techniques of practical biochemistry. Ed ke-7. United Kingdom. Cambridge University. Yang J, Jin Z, Yu Q, Yang T, Wang H, Liu L. 1997. The selective recognition of antibody IgY for digestive system cancers. Chin J Biotechnol 13 : 85-90. 97 Yokohama H, Peralta RC, Horikoshi T, Hiraoka J, Ikemori Y, Kuroki M, Kodama Y. 1993. A Two-step procedure for purification of hen egg yolk immunoglobulin g: utilization of hydroxypropylmethylcellulose phthalate and synthetic affinity ligand gel (Avil AL® ). Poultry Sci 72: 275-281. Yokohama H, Peralta RC, Umeda K, Hashi T, Icalto FC, Kuroki M. 1998. Prevention of fatal salmonellosis in neonatal calves, using orally administered chicken egg yolk salmonella -spesific antibodies. Am J Vet Res 59 (4) :416 – 420. Yowler BC, Kensinger RD, Schengrund CL. 2002. Botulinum neurotoxin a activity is dependent upon the presence of spesific gangliosides in neuroblastoma cells expressing synaptotagmin I. J Biol Chem 277 (36): 32815-32819. Zhang WW. 2003. The use of gene spesifik IgY antibodie s for drug target discovery. DDT Vol 8. Elseiver Science Ltd.