BABn TINJAUAN PUSTAKA 2.1.Tidjauan Umum Pirazolin Soiyawa
advertisement
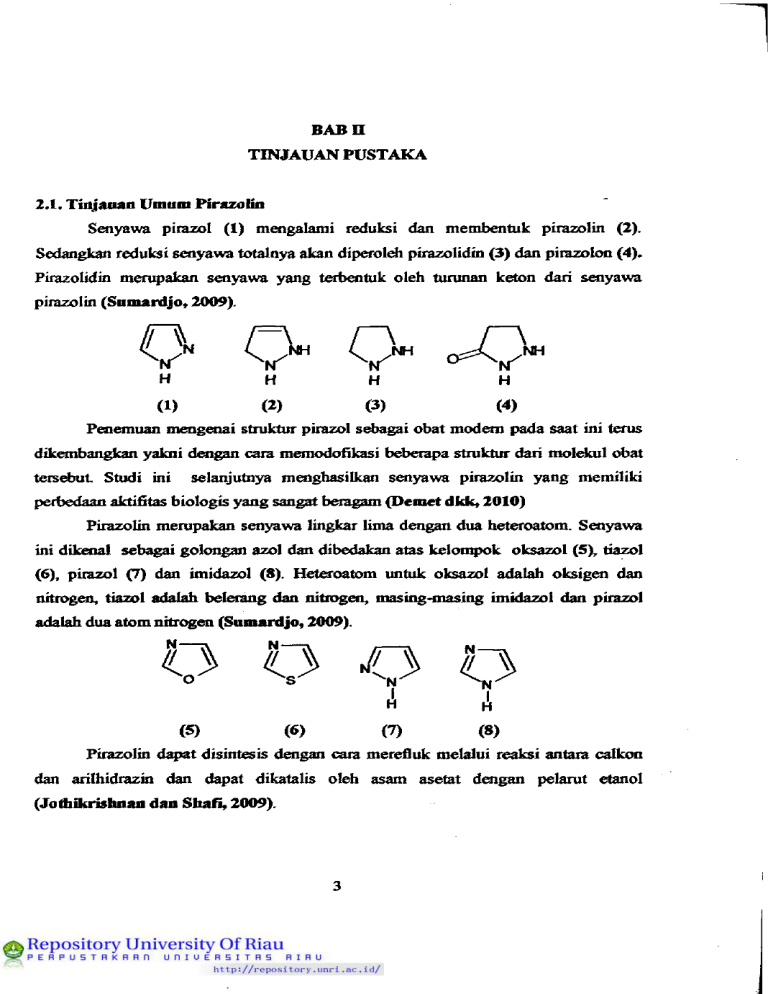
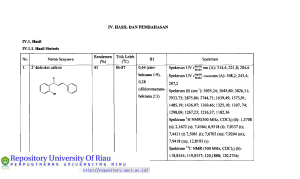
BABn TINJAUAN PUSTAKA 2.1. Tidjauan Umum Pirazolin Soiyawa pirazol (1) moigalami reduksi dan membmtuk pirazolin (2). Sedangkan reduksi senyawa totalnya akan diperol^ piiazolidin (3) dm pirazolon (4). Pirazolidin merupakan senyawa yang terbentuk oleh turunan keton dari s«iyawa pirazolin (Samardjo, 2009). o o o ^ H H H H (1) (2) (3) (4) Penemuan mengenai struktur pirazol sd)agai obat modem pada saat ini terns dikembangkan yakni d^gan cara memodofikasi beberapa stmktur dari moldail obat tersebut Studi ini selanjutnya menghasilkan senyawa pirazolin yang memiliki perbedaan aktifitas biologis yang sangat beragam (Demet dkk, 2010) Pirazolin mempakan senyawa lingkar lima dengan dua heteroatom. Senyawa ini dikenat sebagai golongan azol dan dibedakan atas kelon^k oksazol (5), tiazol (6), pirazol (7) dan imidazol (8). Heteroatom untuk oksazol adalah oksigen dan nitrogai, tiazol adalah belerang dan nitrogen, masing-masing imidazol dan pirazol adalah dua atom nitrogen (Sumardjo, 2009). (5) (6) (7) (8) Pirazolin d ^ t disintesis doigan cara merefluk melalui reaksi antara calkon dan arilhidrazin dan dapat dikatalis oleh asam asetat dengan pelarut etanol (Jotliikrisluian dan Sliafi, 2009). 3 Pirazolin atau dihidropirazol mempakan suatu senyawa yang terbentuk dari reaksi antara hidrazin dengan akrolein (Respati, 1990). Kelaziman pirazol sd)agai senyawa heterosiklik merupakan suatu soiyawa yang memiliki aktivitas biologis dan menunjukkan adanya senyawa yang efisien terfaadap kebutuhan obat (Sahu dkk, 2008). Gambar 1. Reaksi pembentukan senyawa pirazolin Senyawa pirazolin memiliki aktivitas biologis yang beragam yaitu s^agai antifungi, antibakteri, antidqiresi, antiinflamasi, antitumor dan antidiabetes (Jadhav dkk, 2009). Pirazolin dapat dihasilkan doigan mereaksikan smyawa £»iilhidrazin dengan calkon yang dikatalis oleh suatu basa. Fenilhidrazin mempakan turunan dari hidrazin yang m^liki mmus kimia PhNHNH2 (9). (9) Aktivitas feimakologis dari s^iyawa pirazolin pada umumnya yaitu sd>agai antimikroba, antibakteri, antiinflamasi dan antitumor. Beibag^i kelompok flmgsional seperti kloro,fluoio,nitro, metoksi men^nmyai peranan peatixig dalam kimia obat 2JZ, Pembagian Senyawa Pirazolin 2^.1. Pirazolon Senyawa pirazolon mempakan turunan oksi dari senyawa pirazolin. Hasilhasil subtitusinya d^peroldi dari reaksi antara ester aseto asetat dan fenilhidrazin, sehingga akan teri^entuk l-fenil-3-metil pirazolon. 4 Gambar 2. Reaksi pemboitukan senyawa pirazolon 2Jt.l.l. Dimetfl fenil pirazolon (Antipirin) Reaksi antara ester aseto asetat dengan lHnetil-2-fenilhidrazin akan menghasilkan senyawa dimetilfenilpirazokm. CH3 Gambar 3. Reaksi pemboitukan sei^wa dimetilfenilpirazolon Efek &nnakologi dimetilfenilpirazolon, yaitu: <* Digunakan sebagai obat penolak detnam dan mmimnkan suhu tubuh. Contoh: antipirin mudah larut dalam alkohol dan larut dalam air, jqpabila ditambah dengan lamtan FeCb akan terbentuk wama meiah. <* Jika dimetil fenil pirazolon direaksikan dengan asam nitrit dapat menghasilkan tumnan 4-nitro yang memiliki wama hijau k^iru-binian dan dapat direduksi menjadi 4-amino antipirin. Proses metilasi seayzwa. 4-amino antipirin ta^aAi 4 (dimetil amino) antipirin atau piramidon, yang mempunyai daya pengobatan lebih baik dari pada antipirin. 5 /=\ H. " ^ " v ^ CH3 CH3 /=\ CH3 H3C \ CH3 Gambar 4. Reaksi pembentukan piramidon 222, Imidazol Imidazol merupakan isomer dari pirazol yang si&t basanya lebih kuat dibandingkan doigan pirazol. Imidazol dalam air dapat moi^iasilkan garam yang stabil dan pada temperatur normal, imidazol ben^a kristal yang mudah lamt dalam air dan alkohol, tetsqii sukar larut dalam eter. Carapembuatan: Kondoisasi dari glioksal (12 diketon) doigan NH3 dan alddiid dalam lanitan air atau alkohol. .0 H 0* 3H2O Gambar 5. Reaksi pembentukan imidazol Berdasaikan cara pembuatan diatas maka imidazol digambaikan doigan stmktur 3H1,2,4-oksadiazol-l-ium (10), Iff-imidazol (11) dan 4H-imidazol (12). C> (10) 0 H (11) 6 O (12) 2 J, Calkon Calkon (13) merupakan suatu senyawa metabolit sekunder dari golongan flavonoid yang beiasal dari jalur "sikimaf^ dan "asetat maJonar (Markfaam, 1988). Calkon dapat berasal dari isolasi tumbuhan yang memiliki aglikon flavonoid G^aitu flavonoid tanpa gula t^ikat) maupun doigan cara sintesis melalui kondensasi aldoL (13) Calkon dapat diperoldi d^gan cara mmgisolasi suatu tumbuhan, namun untuk men^roleh senyawa calkon ters^ut terdapat keterbatasan diantaranya jumLahnya yang sangat teibatas dibandingkan dengan soiyawa flavonoid lain, serta persentase dan variasi struktumya dalam tumbuhan relatif sedikit (Harbone, 1994). Modifikasi soiyawa flavonoid lebih lanjut dapat terjadi pada bobagai tahap dan moi^iasilkan penambahan atau pengurangan hidroksilasi dari suatu senyawa. Flavonoid yang dianggap pertama kah terbentuk pada proses bbsintesis yaitu h&nxpa calkon. Hasil biosintesisnya, calkon d^^at dikatakan sdiagai salah satu srayawa metabolit sekunder yang beiasal dari turunan flavtmoid yang memiliki aktivitas biologis sangat beragam (Maridiam, 1988). Struktur umum calkon, terdiri dari dua buah dncin aromatik yang togabung oleh suatu keton a ^ tak jenuh. Melalui sintesis kimia, kerangka dasar senyawa calkon d^^t dimodivikasi substituennya oldi alddiid atau keton yang membentuk calkon tersebut Diantara aktivitas biologis yang dimiliki oldi calkon antara lain sd)agai antibakteri, antivirus, antikanker, maupun antiinflamasi (Solankee dkk, 2009). Pada dasanQra soiyawa flavonoid teid^t pada semua bagian tumbuhan termasuk daun, akar, batang, kulit, bunga atau biji (Markfaam, 1988). 7 Gambar 6, Hubmigan biogenetik bobagai jenisflavonoid(moiumt Gmd>ach) (Manitto, 1992) Senyawa tumnan calkon d^at disintesis melalui kondensasi Aldol atau melalui kondoisasi Clasein-Schmidt dari suatu keton aromatik dengan alddiid aromatik. Kondoisasi Aldol mempalon salah satu metode yang ramah lingkungan dalam pemboitukan ikatan katbon-karbon, karena dalam proses sintesisnya tidak banyak mraggunakan bahan Idmia yuig berbahaya. Reaksi ini d^at dikatalis doigan suatu asam atau basa, aldehid atau keton yang mempunyai minimal satu atom hidrogoi a akan mengalami reaksi adisi sesamanya, reaksi ini kemudian diikuti 8 d^gan reaksi d^idrasi atau pelepasan molekul air (H2O) sdiingga dihasilkan suatu keton a, tak jenuh. Calkon merupakan peismyawaan kimia yang penting dalam flavonoid maupun isoflavonoid. Senyawa ini dapat disintesis melalui kondensasi ClaisenSdimidt antara alddiid dan metil keton pada kondisi basa. Senyawa calkcm juga dapat dq>eroldi dari kondisi asam yakni dengan moiggunakan asam perklorat dan asam asetat (Asaddkk, 2008). Gambar 7. Mdcanisme reaksi pembentukan calkon 2.4. Metode Refluk Refluk merupakan suatu cara menguapkan lanitan dan mengembunkan uapnya kembali ke dalam labu reaksi. Teknik refluk ini digunakan dalam reaksireaksi oiganik dengan mraipertahankan jumLah pereaksi dan suhu yang konstan. Metode refluk ini dapat mencegah poididihan lamtan ld)ih dari yang dibutuhkan, sdiingga eneigi tidak teibuang pada saat lefluk beriangsung (Mbhrig dkk, 1979). 2.5. Analisis Kromatografi Lapis Tipis Kromatografi lapis tipis (KLT) adalah suatu metode kromatografi cair yang paling sedediana yang banyak digunakan tmtuk keperluan pemisahan komponea campuran. Fase diam KLT adalah sdniah l^isan tipis dan &se geiaknya mengalir karena gaya kq>iler. Biasanya yang sering digunakan untuk materi pelapisnya adalah silika gel, leiapi kadang-kadang bubuk selulosa dan tanah diatom, kieselguhr juga dapat digunakan (Khopkar, 2002). Dalam kromatografi lapis tipis, ^vitas penjer^ teigantung teibadap eluoi yang berpengaruh terhad^ hasil kromatografi. Keakti&n zat penjerap meningkat karena udara lembab, poiahanan (retensi) bahan atau seayswa. yang dipisahkan 9 menurun sdiingga ada kemun^cinan harga Rf dari senyawa yang dipisahkan itu bertukar (AuterfaofTdan Kovar, 2002). 2.6. Rekrutalj«ui Pada dasaraya hasil yang didapat dalam suatu penelitian, baik melalui isolasi bahan alam maupun sintesis hasil yang didapatkan tidak selalu mumi, sdiingga smyawa yang didapat tersebut hams dimumikan terld>ih dahulu. Rekristalisasi mempakan metode yang biasa dilakukan di laboratorium untuk memisahkan senyawa yang masih bercanqmr dengan sedikit pengotoraya. Pada prinsipnya metode pemumian dengan cara rekristalisasi men^iakan suatu proses pembentukan kristal kembali suatu padatan melalui pengendapan yang salah satunya baik pengotor maupun hasil isolasi dalam pelarut panas, tetapi tidak melantdcan salah satunya pada suasana dingin (M$^o dkk, 1994). Rekristalisasi mempakan metode yang sangat penting dalam pemumian senyawa organik yang bempa padatan. Prinsip dasar rekristalisasi adalah poigkristalan kmibali yang salah satunya baik pragotor maupun hasil isolasi dalam pelarut panas (Yuharmen dan SyafrO, 2003). 2.7. Penentaan Thik Ldeh Poientuan titik leldi diperiukan untuk dua hal yaitu: a. Penentuan kemumian Pada penoituan titik leleh suatu senyawa, bila haiga yang diperoleh memiliki selisih angka kecildari 2^C, tasks, scayawa itu dikatakan sudah mumi. Bila selisihnya besar dari I'C maka senyawa itu dikatakan belum mumi. b. IdentifilQisi senyawa yang tak dikenal Dalam hal ini, data titik leleh yang diperoleh dicocokkan d^gan data standar (hand book). Jika titik leldi soiyawa tak dikoial tersd^ut sesuai dengan data dan hand book, maka soiyawa tersdnit dapat diketahui. 10 2Ji. Metode KarakterbMi 2.8.1. Spektroskopi ultraviolet Semua s^yawa organik m^yer^ sinar ultraviolet. Spektra ultraviolet dan tampak dari senyawa-senyawa organik mempakan transisi antara tingkat-tingkat energi eldctronik yang meliputi eksitasi elektron dari orbital ikatan dan bukan ikatan ke orbital anti-ikatan (Jasril, 2005). Kegunaan ^)dctioskopi ultraviolet ini adalah untuk moigetahui adanya ikatan rangkap terkonyugasi dalam suatu senyawa. Dalam spektroskopi ultraviolet terd^at \xberapn istilah antara lain : - Kromofor : suatu gugus kovalen tidak jenuh yang dapat moijalani transisi n—*n dann—*x *sertamenq>engaruhi serapan eldctronik. Sebagai contoh: C=C, C=0, N=N-, NO2, dan Iain-lain. - Ausokrom : suatu gugus jenuh doigan electron tidak terikat dimana bila menempel kqmda suatu kromofor, membah baik panjang gelombang dan intetisitas dari serapan. Gugus ausokrom tidak d^)at menjalani transisi n -* %, tetapi d^at menjalani transisi elektron. Sebagai contoh: -OH, -OR, -NH2, -NHR, NR2,-X - Geseran batokromik : geseran dari serapan ke panjang gelombang yang ld>ih panjang karma sisipan atau pengamh pelarut (gesoan merah). - Geseran hipsokromik : geseran dari serapan ke panjang gelombang yang ld>ih pendek karoia gugus ganti atau poiganih pelamt (gesoan bim) (Silverstein dkk, 1986). Identifikasi soiyawa yang tidak berwama pada kromatogram dilakukan dengan menggunakan spektroskopi ultraviolet (sinar UV) yakni pada panjang gelombang antara 254-366 nm, ditandai dengan ada atau tidaknya fluoresensi dari suatu senyawa yang diteliti (AuterhofT dan Kovar, 2002). 2.8.2. Spektroskopi inframerah Kegunaan utama dari infiamerah dalam analisis stmktur senyawa oiganik adalah untuk mengidoitifikasi gugus fimgsi dari suatu molekul. Bila suatu sei^wa 11 ditenqjatkan pada pancaian infiamerah, oiergi yang diserap menyebabkan penibahanpembahan vibrasi ikatan karena setiap gugusfimgsimemihki karakteristik frekuensi vibrasi tersendiri (Jasrfl, 2005) Diantara man&at yang sangat poiting dari spektmm infiamerah adalah memberikan gambaran tentang molekul. Saapan setiap tipe ikatan (N-H, C-H, 0-H, C-X, C=0, C-0, C-C, C=C, C=N, dan sdbagainya) hanya diperoldi bagian-bagian kecil t^tentu dari daerah vibrasi infiameiah. Kisaian serapan yang kecil dapat digunakan untuk menoitukan sdiap tipe ikatan (Sastrohamidjojo, 15>92). Spektrum infiamerah dapat memberikan puncak-^ucak maksimal yang jelas sebaik pimcak minimumnya. Posisi relatif atom dalam molekul tidak pasti, tetapi beiubah-ubah terus-menerus karena moldail teisd)ut moigalami vibrasi. Umumnya vibrasi diklasifikasikan sd>agai vibrasi ulur dan vibrasi tekuk. Vibrasi ulur menyangkut konstanta vibrasi antata dua atom disepanjang sumbu ikatan, sedangkan vibrasi tekuk disd)abkan bembahnya sudut antara dua ikatan (Khopkar, 2002). Dengan moiggunakan hukum Hooke, frdcuoisi vibrasi suatu i k a ^ d ^ t dihitung dengan mmggunakan mmus: dimana: 6=frekuensivibrasi (an'') k= konstanta gaya untuk ikatan kimia (N cm '*) ml .m2 = massa atom yang teriibat (gram) c= kecq)atan cahaya (S-IO'** cm S'') 2Ji3. Spektroskopi resonansi magnet nnklir (NMR) Resonansi Magnet Nuklir (NMR) adalah sebuah metode yang sangat poiting pada bidang kimia organik dibandingkan dengan spd(troskopi infiam^ah. Banyak inti atom yang mungkin bisa dipelajari melalui tdcnik NMR ini, yang sangat umum digunakan pada spektroskopi NMR adalah karbon dan hidrogoi. Jika spektroskopi infiamerah menerangkan tentang jenis gugusfimgsiyang ada dalam suatu molekul, maka NMR memberikan informasi tentaag si&t magnet atom-atom yang berbeda dari 12 senyawa Perpaduan antara data IR dan NMR sudah cukup untuk menentukan dengan lengkap struktur dari molekul yang belum diketahui (Pavia, 1995). Apabiia molekul senyawa organik berada dalam medan magnet yang kuat, spektroskopi NMR didasaikan pada penyerapan gelombang radio oldi inti-inti tertentu dalam molekul organik tersebut. Dalam spektroskopi NMR, s^yawa yang digunakan sebagai mjukan (referensi) ialah tetrametilsilana (TMS), (CH3)4Si, yang proton-protonnya menyeiap pada ujung kanan dalam spektmm NMR. Absorbsi proton lain kebanyakan dijun^ai dibawah n^dan absoibsi TMS. Selisih antara posisi absoibsi TMS dan posisi absoibsi suatu proton tetteata disc^ut doigan pergeseran kimia (chemical shift) yang dilambangkan dengan 5 (Fesseaden, 1994). 2S. Senyawa Antibakteri Soiyawa antibakteri mempakan senyawa yang dapat men^iambat dan menguiangi p^mbuhan bakteri yang hcrsi£st patogen maupun yang non^togen. Soiyawa-senyawa kimia yang d^at meng^iambat pertumbuhan bakteri terdiri dari garam logam-logam, senyawa fenol, foimalddiid, alkohol, yodium, senyawa klor, deterjen, sulfonamida dan antibiotik (Tortora, 2001). Menurut Dwidjosepntro (1994), bakteriostatik adalah suatu zat kimia yang hanya dapat moighambat pertumbuhan bakteri. Sedangkan bakterisida mempakan zat kimia yang dapat mematikan bakteri. Proses kerja senyawa antibakteri dalam menghambat pertumbuhan bakteri, yaitu (Ajizah dkk, 2007). 1. Menghambat sintesis dinding sel bakteri 2. Moigganggu fiingsi dari membran sel bakteri 3. Menghambat sintesis protein dan asam nukleat bakteri 4. Mengganggu metabolisme sel bakteri 13 2.10. Mikroorganisme 2.10.1. Bakteri Bakteri merupakan suatu mikroorganisme hM-p bersel satu (uni seluler) yang sangat penting dan beraneka ragam yang dapat berfaubungan dengan makanan bahkan dengan manusia. Ada bakteri yang dapat moigakibatkan pembusukan yang tidak diinginkan pada makanan dan menimbulkan penyakit dan ada pula bakteri yang menguntungkan diantaranya dapat melangsungkan fermentasi (Buckle dkk, 1985). Berdasarkan moifologinya ukuran bakteri sangat kecil. Tubuh bakteri bam d^at dilihat dengan mikroski^ dengan peibesaran antara 1.000 kali atau lebih. Satuan perbesarannya adalah mikrometer atau mikron. Satu mikron sama dengan 1/1.000 mihmeter. Sedangkan lebar tubuh bakteri biasanya satu sampai dua mikron, dan panjangnya antara dua sampai lima mikron (Volk dan Wheeler, 1993). Sel-sel individu bakteri d ^ t beibentuk s^erti clips, bola, batang (silindris), atau spiral (heliks). Masing-masing ciri ini penting dalam mencirikan morfologi suatu spesies (Pdczar dan Chan, 2005). Irianto (2006), moigatakan bahwa bakteri memiliki bentuk yang bermacammacam, antara lain: <* Bakteri beibentuk bulat (coccus) <r Bakteri beibentuk batang (Bacillus) <* Bakteri berbentuk spiral (Spirillum) Berdasarkan ieknik pewamaaimya, bakteri dapat dikelompokkan taenjadi dua kelompok besar, yakni (Pelczar dan Chan, 2005): > Bakteri Gram positif Bakteri yang dapat menyerap zat wama utama pada pewamaan Gram dan dapat menahan zat wama tersebut dengan kuat setelah proses poicucian, sdiingga tidak dapat diwamai lagi dengian zat wama berikutnya. Dinding sel bakteri Gram positif cukup td>al sddtar20-80 nm, terdiri atas 60-100% peptidokglikan. > Bakteri Gram negatif Bakteri yang tidak menyerap zat wama utama pada pewamaan Gram sdiingga pada proses pencucian akan luntur dan mudah diwamai lagi dengan zat wama 14 berikutnya. Dinding selnya terdiri atas 10-20% pqrtidoglikan. Diluar lapisan ada struktur membran kedua yang tersusun dari protein, fosfolipid, dan lipopolisakarida. BdTerapa jenis bakteri yang digunakan untuk uji aktivitas antibakteri adalah sebagai berikut: 1. Escherichia coli Bakteri Escherichia coli atau sering disebut sebagai E. coli mempakan bakteri Gram negatif bergerak, beibentuk batang yang bersifet anaerob fekuhatif dan mempunyai flagel peritrik (Buckle dkk, 1997). Bakteri ini disebut juga dengan bakteri kolon, karena dapat ditemukan pada sistem pencemaan (usus besar) manusia dan hewan. Infeksi Kcoli yang patogen pada seseorang bersifet verotoksigenik yang disd)abkan adanya kontak langsung dengan hewan infektif atau akibat mengkonsumsi makanan s^iti daging, buah, sayur dan air yang telah teikontaminasi oleh bakteri ini (Sartika dkk, 2005). 2. Staphylococcus aureus Staphylococcus aureus adalah bakteri Gram-positif yang beibentuk bulat (coccus) dengan diameter antara 0,7-0,9 (mikron) yang d^at hidup dalam lingkungan rentang pH 2,6-10 dan c^timum pada pH 6,8-S,2 yang pada umumiQra berkelompok dengan koloni berwama kuning. Biasanya bakteri ini vimlensinya ringan, tetapi jika kulit luka atau tericena iritasi bakteri ini dapat moiimbulkan peaanahan (Tranggono dan Latifah, 2007) 3. Bacillus subtilis Bacillus subtilis merupakan bakteri Gram-positif bersi&t a^ob dan berbentuk basil panjang yang disebut streptobasiL Bacillus subtilis banyak ditemukan dalam tanah, air dan beibagai jenis makanan. Sporanya banyak berbentuk oval atau silinder dan lebamya tidak melebihi dari sel induknya (Hans dan Sdimidt, 1994). Bakteri ini dikenal sebagai penyebab keasaman dari makanan kaleng karena fennentasi gula yang dikandung pada makanan teisebut (Buckle dkk, 1985). 15