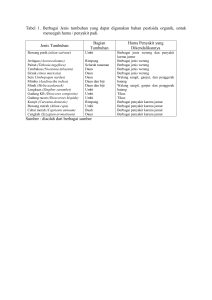
plagiat merupakan tindakan tidak terpuji
advertisement

PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI UJI POTENSI ANTIBAKTERI EKSTRAK ETANOL UMBI BINAHONG (Anredera cordifolia (Tenore) Steen) TERHADAP Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 SKRIPSI Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm) Program Studi Farmasi Oleh: Martina Herlianawati NIM : 038114009 FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA YOGYAKARTA 2007 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI iii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Setiap masalah yang terjadi adalah proses, tantangan, dan pilihan untuk tidak menyerah pada keadaan. Kita yang harus mengendalikan keadaan, dan bukan keadaan yang mengendalikan kita. Jadi, jalani dengan maksimal karena Tuhan punya cara sendiri untuk melihat dan menilainya. Le Gra, Karyaku ini ada untuk: My Lord Jesus and My Holy Marry, Papa, Mama, Sisca, Seluruh Sahabat dan Kerabat, serta Almamaterku iv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI v PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI INTISARI Binahong Anredera cordifolia (Tenore) Steen, secara empiris digunakan masyarakat untuk menyembuhkan beberapa penyakit salah satu diantaranya adalah untuk mengobati infeksi pada luka. Penyebab yang paling umum pada infeksi kulit yang terluka adalah Staphylococcus aureus dan Pseudomonas aeruginosa. Oleh karena itu perlu dilakukan penelitian untuk mengetahui potensi ekstrak etanol umbi binahong terhadap Staphylococcus aureus dan Pseudomonas aeruginosa. Selain itu perlu diketahui pula kandungan kimia dalam umbi binahong yang berperan sebagai senyawa antibakteri. Maka dilakukan uji tabung dari serbuk umbi binahong dan ui KLT dari ekstrak etanol. Penelitian ini termasuk penelitian eksperimental murni rancangan acak lengkap pola satu arah. Subyek uji dalam penelitian ini adalah Staphylococcus aureus ATCC 25923 yang merupakan bakteri gram positif dan Pseudomonas aeruginosa ATCC 27853 yang merupakan bakteri gram negatif. Penentuan aktivitas antibakteri umbi binahong dilakukan dengan metode difusi paperdisk. Sedangkan penentuan Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) ekstrak umbi binahong dilakukan dengan metode dilusi padat. Uji kandungan kimia terhadap serbuk umbi binahong dilakukan dengan uji tabung dan uji kandungan kimia ekstrak etanol umbi binahong dilakukan dengan metode Kromatografi Lapis Tipis (KLT). Analisis hasil KLT dilakukan secara deskriptif komparatif. Hasil penelitian dengan metode difusi menunjukkan bahwa ekstrak etanol umbi binahong tidak memiliki potensi antibakteri. Berdasarkan uji tabung, serbuk umbi binahong diketahui mengandung flavonoid, alkaloid, polifenol, tanin, dan saponin. Untuk uji KLT, diketahui bahwa ekstrak etanol umbi binahong mengandung flavonoid, polifenol, tanin dan saponin. Kata kunci : potensi antibakteri, umbi binahong, Staphylococcus aureus, Pseudomonas aeruginosa, uji tabung, uji KLT vi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ABSTRACT Binahong Anredera cordifolia (Tenore) Steen empirically are used to threat some illness, one of them is to threat wound infection. Usually, wound infection ware caused by Staphylococcus aureus and Pseudomonas aeruginosa. So it was needed to research the potency of ethanolic extract of binahong’s tubers against Staphylococcus aureus and Pseudomonas aeruginos. Beside that, the tubes test and the TLC test were needed to know the chemical contents of binahong tubers which can be used as a antibacterial agent. This research was a pure experimental research with the one way pattern of complete-random research design. The subject in this research were Staphylococcus aureus ATCC 25923 which is positive gram bacterial and Pseudomonas aeruginosa ATCC 27853 which is negative gram bacterial. Antibacterial activity was determined by diffusion method using paperdisk. Whereas, the Minimum Inhibitory Consentration (MIC) and Minimum Bacterisidal Consentration (MBC) of ethanolic extract of binahong’s tubers were conducted by solid dilution method. The identification of chemical contents of powders of binahong’s tubers was conducted by tubes test and the ethanolic extract of binahong’s tuber was conducted by TLC test. The result of TLC test was analysed using comparative-descriptive analysing method. The result showed that the ethanolic extract of binahong’s tuber has not antibacterial activities against Staphylococcus aureus and Pseudomonas aeruginosa. Based on the tube test, the powder of binahong’s tubers maybe contain flavonoid, alkaloid, polyphenol, tannin, and saponin. The TLC result showed that the ethanolic extract of binahong’tuber contents of flavonoid, polyphenol, tannin, and saponin. Keyword : Antibacterial potency, binahong’s tubers, Staphylococcus aureus Pseudomonas aeruginosa, tubes test, TLC test vii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI KATA PENGANTAR Kasih dan karunia-Nya yang berlimpah, membuat penulis tak hentihentinya mengucap puji dan syukur atas terselesaikannya skripsi dengan judul UJI POTENSI ANTIBAKTERI EKSTRAK ETANOL UMBI BINAHONG (Anredera cordifolia (Tenore) Steen) TERHADAP Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 ini. Penyusunan skripsi ini merupakan syarat untuk mendapatkan gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Semua yang tertuang dalam skripsi ini diperoleh dengan kerja keras dan tidak lain karena peran, bantuan, bimbingan, motivasi, dukungan, dan doa dari beberapa pihak, dan karenanya, penulis ingin mengucapkan terimakasih kepada: 1. Ibu Rita Suhadi, M.Si., Apt selaku Dekan Fakultas Farmasi Sanata Dharma, 2. Ibu Erna Tri Wulandari, M.Si., selaku dosen pembimbing yang sudah meluangkan waktu dan perhatian, serta banyak membantu selama diskusi, bimbingan, dan revisi, 3. Bapak Ign. Y. Kristio Budiasmoro, M.Si, selaku dosen penguji atas diskusi dan masukan kepada penulis, 4. Bapak Yohanes Dwiatmaka, M.Si, selaku dosen penguji atas diskusi dan masukan kepada penulis, 5. Papa dan mama tercinta, Fx. Untung Puryanto dan Tarsicia Sri Setyani atas kesabaran dan kepercayaan yang mungkin sedikit terkikis, tulusnya viii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI doa dan cinta, dukungan moral dan material, serta semangat yang mengiringi langkah penulis, 6. Satu-satunya adik ‘kecil’ku Fransisca Kurnianingsih, atas telinga, hati, dan pikiran yang selalu menjadi jawaban atas segala keluh kesahku, 7. Nella, seorang sahabat, tempat curhat, mbak, dan teman se‘binahong’ atas seluruh moment yang terjadi dan segala pengalaman yang membuat kita lebih kaya dalam memaknai hidup. 8. Mas Wahyu, Meta, Mas Alfren dan Budhe, Pakdhe terimakasih banyak atas perhatian, waktu, dan tenaga yang tersita untukku. 9. Mas Sarwanto, Mas Wagiran, Mas Sigit, dan Mas Andre, laboran sekaligus teman dalam canda dan kerjasama selama penelitian 10. Sahabat-sahabat hatiku, Johan, Wati, Ratih, Totok, Bambang, Ana, Tusti, Tica, Ceu Sri, Bernan, Mas Wondo, Bayu, dan Top-X, atas senyum, canda, tawa, tangis, perhatian, dan semangat yang pernah, masih dan selalu ada buat aku. You make me standing still with everything you do, Thanks a lot guys… 11. Teman-teman baikku, Otong, Surya, Evelyn, Beni, Rinto, Punto, Sutaman, Kris, Helmi, De Eya, Nice, De Esti, Agnes, dik Henong, mb Dinta, mb Devi, Vivi, Dewi&albert, Rosalia Guruh, Vian, Sakundita, Yohana, Netly, Bangun, mb Obe, abang Franky, pakdhe Muji, Ci’ Mey, Mba Endar, Jeng Fitri, dan Pak Ciek Hendro, atas detik, menit, hari, bulan, dan tahun yang menyertai kebersamaan kita. Without you all, I’m nothing. ix PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 12. Every single guy in : The 10th generation of VL, Wisma Rosari, Farmasi 2003, Kelompok Praktikum A, Tim layat kelas A, kelp. KKN Ceporan angkatan XXXIII, asisten mikro 2006/2007, dan Skripsi Lantai 3 atas untaian cerita yang mengisi hari-hariku, 13. Dan semua pihak yang langsung ataupun tidak langsung sudah membantu dalam penyusunan skripsi ini. Penulis menyadari bahwa skripsi ini jauh dari sempurna, untuk itu penulis dengan rendah hati mohon maaf apabila terdapat kesalahan dalam penulisan, dan untuk itu, penulis menerima segala kritik maupun saran yang membangun. Akhirnya penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan pada umumnya dan semua orang yang membaca skripsi ini pada khususnya. Tuhan memberkati. Yogyakarta, Juni 2007 Penulis, Martina Herlianawati x PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR ISI HALAMAN JUDUL........................................................................................ i HALAMAN PERSETUJUAN PEMBIMBING .............................................. ii HALAMAN PENGESAHAN ......................................................................... iii HALAMAN PERSEMBAHAN ..................................................................... iv PERNYATAAN KEASLIAN KARYA ......................................................... v INTISARI ........................................................................................................ vi ABSTRACT ...................................................................................................... vii KATA PENGANTAR .................................................................................... viii DAFTAR ISI ................................................................................................... xi DAFTAR TABEL ........................................................................................... xv DAFTAR GAMBAR ...................................................................................... xvii DAFTAR LAMPIRAN ................................................................................... xviii BAB I. PENGANTAR .................................................................................... 1 A. Latar Belakang Masalah ............................................................................. 1 1. Permasalahan ...................................................................................... 3 2. Manfaat Penalitian .............................................................................. 4 3. Keaslian Penelitian .............................................................................. 4 B. Tujuan Penelitian ........................................................................................ 5 BAB II. TINJAUAN PUSTAKA .................................................................... 6 A. Binahong Anredera cordifolia (Tenore) Steen ........................................... 6 1. Deskripsi ............................................................................................. 6 2. Ekologi dan penyebaran ...................................................................... 7 xi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3. Kandungan Kimia ............................................................................... 7 4. Kegunaan ............................................................................................ 7 B. Penyarian .................................................................................................... 8 C. Ekstrak Etanol ............................................................................................ 9 D. Sterilisasi .................................................................................................... 10 E. Bakteri Uji .................................................................................................. 11 1. Staphylococcus aureus ....................................................................... 11 2. Pseudomonas aeruginosa .................................................................. 12 F. Amoksisilin ................................................................................................. 12 G. Metode Pengujian Potensi Antibakteri ....................................................... 13 H. Kromatografi Lapis Tipis ........................................................................... 16 I. Flavonoid ..................................................................................................... 18 J. Akaloid ........................................................................................................ 19 K. Senyawa Polifenol ...................................................................................... 20 L. Tanin ........................................................................................................... 21 M. Saponin ...................................................................................................... 22 N. Keterangan Empiris .................................................................................... 23 BAB III. METODOLOGI PENELITIAN ...................................................... 24 A. Jenis dan Rancangan Penelitian ................................................................. 24 B. Variabel dan Definisi Operasional ............................................................. 24 1. Variabel Penelitian .............................................................................. 24 2. Definisi Operasional ........................................................................... 25 xii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI C. Bahan dan Alat Penelitian .......................................................................... 26 1. Bahan .................................................................................................. 26 2. Alat ...................................................................................................... 27 D. Jalannya Penelitian ..................................................................................... 27 1. Determinasi Tanaman Binahong ......................................................... 27 2. Pengumpulan Bahan ........................................................................... 28 3. Penyerbukan Bahan ............................................................................. 28 4. Pembuatan Ekstrak Etanol dengan Metode Maserasi ......................... 28 5. Skrining Fitokimia .............................................................................. 28 a. Uji Tabung ....................................................................................... 29 b. Uji kualitatif secara Kromatografi Lapis Tipis ............................... 31 6. Uji Potensi Antibakteri Ekstrak Etanol Umbi Binahong terhadap Staphylococcus aureus dan Pseudomonas aeruginosa .................... 34 E. Analisis Data .............................................................................................. 36 BAB IV. HASIL DAN PEMBAHASAN ....................................................... 37 A. Determinasi ................................................................................................ 37 B. Pengumpulan dan Penyerbukan Bahan ...................................................... 37 C. Pembuatan Ekstrak dengan Metode Maserasi ............................................ 38 D. Skrining Fitokimia ..................................................................................... 41 1. Uji Tabung .......................................................................................... 41 2. Uji Kualitatif secara Kromatografi Lapis Tipis .................................. 46 xiii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI E. Uji potensi antibakteri ekstrak etanol umbi binahong terhadap Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 ............................................................................................... 53 BAB V. KESIMPULAN DAN SARAN ......................................................... 58 A. Kesimpulan ................................................................................................ 58 B. Saran ........................................................................................................... 58 DAFTAR PUSTAKA ..................................................................................... 59 LAMPIRAN .................................................................................................... 62 BIOGRAFI PENULIS .................................................................................... 79 xiv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR TABEL Tabel I Pembuatan Variasi Konsentrasi Uji ........................................ 35 Tabel II Hasil pengamatan uji tabung terhadap serbuk umbi binahong ......................................................................... 41 Tabel III Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254 dan fase gerak butanol : asam asetat : air (4:1:5 ) dan pembanding rutin 0,05% untuk analisis flavonoid ........................................................... 47 Tabel IV Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak etil asetat : methanol : air (70:20:10)dan pembanding skopolamin untuk analisis alkaloid…………………………………………………………….. 49 Tabel V Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak toluen, etil asetat, metanol (70:20:10) dan pembanding eugenol untuk analisis senyawa fenolik………………………………………………… ... 50 Tabel VI Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak etil asetat : metanol : air (100 : 13,5 : 10) dan pembanding asam tanat untuk analisis tanin………………………………………………….......... 51 Tabel VII Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak toluen : etil asetat (93:7) dan pembanding Glycyrrhiza Radix untuk analisis saponin……………. 52 xv PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Tabel VIII Diameter zona hambat ekstrak etanol umbi binahong terhadap Staphylococcus aureus ATCC 25923……………… 55 Tabel IX Diameter zona hambat ekstrak etanol umbi binahong terhadap Pseudomonas aeruginosa ATCC 27853…………… 56 xvi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR GAMBAR Gambar 1. Kerangka Flavonoid ………………………………………. 18 Gambar 2. Reaksi antara Senyawa Fenolik dengan FeCl3…….............. 44 Gambar 3. Reaksi antara NaCl dengan Senyawa fenolik …………….. 44 Gambar 4. Reaksi flavonoid dengan CaSO4 membentuk Gambar 5. kompleks khelat…………………………………………… 46 Reaksi antara Flavonoid dengan NH3 ……………………. 48 xvii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR LAMPIRAN Lampiran 1. Surat Keterangan Selesai Melakukan Determinasi dari BalaiPenelitian Tanaman Obat................................................. 62 Lampiran 2. Determinasi Tanaman Binahong (Anredera cordifolia (Tenore) Steen)......................................................................... 63 Lampiran 3. Foto Tanaman Binahong (Anredera cordifolia (Tenore) Steen) dan foto serbuk umbi binahong..................................... 64 Lampiran 4. Foto Hasil Uji Pendahuluan Serbuk Umbi Binahong Dengan UjiTabung .................................................................... 65 Lampiran 5. Foto Hasil Uji Alkaloid Serbuk Umbi Binahong Dengan UjiTabung .................................................................... 66 Lampiran 6. Foto Hasil Uji Antrakinon Serbuk Umbi Binahong Dengan Uji Tabung .................................................................. 67 Lampiran 7. Foto Hasil Uji Polifenol Serbuk Umbi Binahong Dengan UjiTabung ................................................................... 68 Lampiran 8. Foto Hasil Uji Tanin Serbuk Umbi Binahong Dengan Uji Tabung .................................................................. 69 Lampiran 9. Foto Hasil Uji Saponin Serbuk Umbi Binahong Dengan Uji Tabung ................................................................... 70 Lampiran 10. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, dan uap amoniak pada Analisis Flavonoid ................................................................... 71 xviii PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 11. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, pereaksi Dragendorf pada Analisis Alkaloid ...................................................................... 72 Lampiran 12. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, dan pereaksi FeCl3 pada Analisis Polifenol .................................................................................... 73 Lampiran 13. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, dan pereaksi FeCl3 pada Analisis Tanin ........................................................................................ 74 Lampiran 14. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, dan pereaksi Anisaldehid Asam Sulfat pada Analisis Saponin .................................................... 75 Lampiran 15. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Umbi Binahong terhadap Staphylococcus aureus ATCC 25923 Dengan Metode Difusi Paperdisk ............................................. 76 Lampiran 16. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Umbi Binahong terhadap Pseudomonas aeruginosa ATCC 27853 Dengan Metode Difusi Paperdisk ............................................. 77 Lampiran 17. Foto Kontrol Pertumbuhan Staphylococcus aureus ATCC 25923 dan Kontrol pertumbuhan Pseudomonas aeruginosa ATCC 27853 .......................................................... 78 xix PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB I PENGANTAR A. Latar Belakang Masalah Tumbuhan obat dan obat tradisional (OT) merupakan aset nasional yang perlu terus digali, diteliti, dikembangkan dan dioptimalkan pemanfaatannya. Untuk itu perlu dilakukan penelitian dan pengembangan tanaman obat dan obat tradisional dalam sistem pelayanan kesehatan formal (Sumaryono, 2000). Penggunaan obat tradisional memiliki kelebihan antara lain yaitu bahannya mudah didapat, murah dan dapat diramu sendiri. Karena alasan itulah masyarakat berusaha memanfaatkan alam sekitar untuk memenuhi kebutuhan obat ketika menderita sakit. Binahong (Anredera cordifolia (Tenore) Steen merupakan tanaman yang mudah didapatkan. Binahong sangat mudah tumbuh di beberapa kondisi secara vegetatif, mempunyai karakteristik agresif dan sulit dikendalikan. Hal ini dikarenakan umbi sebagai alat reproduksi secara vegetatif tumbuh di dalam maupun di atas tanah (Vivian et al, 2005). Dalam kehidupan sehari-hari, masyarakat mengenal binahong sebagai tanaman yang dapat digunakan untuk mengobati beberapa penyakit. Namun penggunaan binahong tersebut belum dibuktikan sampai tahap uji klinik. Penelitian yang pernah dilakukan, mengemukakan bahwa ekstrak kloroform dari herba binahong Anredera cordifolia (Tenore) Steen dapat menghambat 1 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI pertumbuhan beberapa bakteri (Meyer, 2004). Sedangkan dalam masyarakat, penggunaannya hanya secara empiris yaitu berupa perasan, rebusan, seduhan, dimakan secara langsung, maupun dioleskan pada daerah yang akan diobati. Binahong dipercaya dapat menyembuhkan beberapa penyakit antara lain sebagai obat antiinflamasi, anti-ulcer, obat untuk menyembuhkan luka dan juga dapat sebagai liver-protective. Selain itu juga digunakan untuk mengobati infeksi pada luka (Anonim, 2006a). Infeksi pada luka itu sendiri terjadi karena fungsi kulit sebagai pertahanan (barrier) hilang. Hilangnya pertahanan kulit dan terkelupasnya lapisan jaringan di bawah kulit yang basah dan kaya akan nutrien merupakan hal yang ideal untuk kolonisasi bakteri pada area kulit yang terluka atau terbakar. Penyebab yang paling umum pada infeksi kulit yang terluka adalah Pseudomonas aeruginosa dan Staphylococcus aureus (Naim, 2006). P. aeruginosa merupakan bakteri gram negatif sedangkan S. aureus merupakan gram positif (Jawetz, Melnick, dan Adelberg, 1996). Seperti telah disebutkan di atas, pada penelitian sebelumnya digunakan kloroform untuk menyari senyawa yang terdapat dalam herba binahong. Kloroform merupakan penyari yang bersifat non polar, sehingga senyawasenyawa yang tersari dimungkinkan hanya senyawa-senyawa yang bersifat non polar. Untuk itu dalam penelitian ini, digunakan etanol yang bersifat semi polar. Dengan demikian senyawa-senyawa yang tersari tidak hanya yang bersifat non polar tetapi juga yang bersifat polar. 2 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pada penelitian sebelumnya, bahan yang digunakan berupa herba binahong. Untuk iu perlu diketahui bagian mana dari herba binahong tersebut yang dapat menghambat pertumbuhan bakteri. Oleh karena itu, penulis melakukan penelitian mengenai ekstrak etanol umbi binahong, terutama potensinya sebagai antibakteri terhadap S. aureus dan P. Aeruginosa, sehingga dapat diketahui khasiat dari umbi binahong sebagai obat menyembuhkan infeksi pada luka. 1. Permasalahan Ditinjau dari latar belakang yang ada, maka permasalahan yang ingin diangkat dalam penelitian ini adalah: 1. Apakah ekstrak etanol umbi binahong berpotensi sebagai antibakteri terhadap S. aureus dan P. aeruginosa? 2. Berapa besar Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) dari ekstrak etanol umbi binahong terhadap S. aureus dan P. aeruginosa ? 3. Kandungan kimia apa sajakah yang terdapat di dalam umbi binahong yang bermanfaat sebagai antibakteri? 3 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 2. Manfaat penelitian a. Manfaat teoritis Penelitian ini diharapkan dapat memberikan sumbangan ilmiah terutama mengenai tanaman obat baru yang dapat dikembangkan menjadi obat tradisional dan fitofarmaka. b. Manfaat praktis Penelitian ini diharapkan dapat menjadi sumbangan yang berharga untuk mendalami pengobatan penyakit infeksi yang disebabkan oleh S. aureus dan P. aeruginosa dengan menggunakan tanaman yang berpotensi digunakan sebagai obat. 3. Keaslian penelitian Sejauh penelusuran pustaka dan pengamatan peneliti, pernah dilakukan penelitian mengenai potensi antibakteri ekstrak kloroform dari herba Anredera cordifolia (Tenore) Steen terhadap Bacillus cereus, Bacillus pulmilus, Bacillus subtilis, Staphylococcus aureus, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Serratia marcescens, dan Enterobacter aerogenes (Meyer, 2004). Bahan yang digunakan dalam penelitian tersebut adalah herba dari binahong, maka perlu dilakukan penelitian mengenai potensi antibakteri dari salah satu organ tanaman binahong terhadap bakteri penyebab infeksi pada luka dalam hal ini yaitu umbinya. 4 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI B. Tujuan penelitian Penelitian ini bertujuan untuk: 1. Mengetahui ada tidaknya potensi antibakteri ekstrak etanol umbi binahong terhadap S. aureus dan P. aeruginosa. 2. Mengetahui Konsentrasi Hambat Minimum dan Konsentrasi Bunuh Minimum ekstrak etanol umbi binahong pada pertumbuhan S. aureus dan P. aeruginosa. 3. Mengetahui kandungan kimia yang terdapat di dalam umbi binahong yang bermanfaat sebagai senyawa antibakteri secara kualitatif melalui uji tabung dan uji Kromatografi Lapis Tipis. 5 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB II TINJAUAN PUSTAKA A. Anredera cordifolia (Tenore) Steen 1. Deskripsi Binahong merupakan tumbuhan yang termasuk dalam familia Basellaceae, genus Anredera, dengan nama spesies Anredera cordifolia (Tenore) Steen. Sinonim dari Anredera cordifolia (Tenore) Steen adalah Boussingaultia baselloides Auct.non H.B.K, Boussingaultia gracillis Miers, Boussingaultia pseudobasselloides (Vivian, 2005). Di beberapa negara binahong dikenal sebagai ‘uala hupe, anredera, enredarera del mosquito, filikafa, Gulf madeiravine, hearthleaf madeiravine, lamb’s tails, Madeira vine, mignonette vine, parra de Madeira (Vivian, 2005). Habitus; herba, menjalar, panjang mencapai lima meter. Batang; lunak, warna merah tua kehijauan, permukaan halus dan licin, pada bagian aksiler daun, tumbuh umbi tunggal maupun berkelompok. Daun; tunggal, tata letak daun tersebar, permukaan daun halus dan licin, daging daun tebal, warna hijau muda, pertulangannya menyirip, helaian daun bentuk jantung, ujung runcing, tepi rata – bergelombang, pangkal berbelah, panjang helaian 2-10 cm, lebar 17 cm, panjang tangkai daun kurang lebih 1 cm. Bunga; majemuk, bentuk tandan atau malai bercabang, panjang perbungaan 10 -35 cm, daun kelopak pada bagaian basal berlekatan dengan daun mahkota, putih – krem, bentuk oval – memanjang, panjang 1- 2 mm, lebar 1 mm, ujung membulat, daun 6 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI mahkota pada bagain basal berlekatan, putih – krem, bentuk oval – membulat, panjang 2-3 mm, lebar 1-2 mm, benang sari; berdaging, tangkai sari pada bagian basal berlekatan, panjang 2-4 mm, putik; satu panjang 1-2 mm. Akar; tunggang (Backer, 1968) 2. Ekologi dan Penyebaran Binahong hidup liar di hutan, ladang, dan padang rumput. Tumbuh tersebar di berbagai kawasan di dunia termasuk di antaranya di Afrika, Australia dan wilayah Pasifik, Eropa, dan Amerika. Tumbuhan ini sangat mudah tumbuh di beberapa kondisi secara vegetatif, mempunyai karakteristik agresif dan sulit dikendalikan. Hal ini dikarenakan umbi sebagai alat reproduksi secara vegetatif tumbuh di dalam maupun di atas tanah (Vivian, 2005). 3. Kandungan Kimia Binahong mengandung asam askorbat dan fenol dalam jumlah kecil (Sato, Nagata, dan Engle, 2005). Basellaceae lainnya yaitu Anredera diffusa mengandung asam oleanolic yang berperan dalam proses penyembuhkan luka (Moura-Letts dan Marcalo,2006). Selain itu, terdapat pula serat, karbohidrat, air, protein, abu, flavonoid, dan lendir pada Anredera baselloides (Anonim, 2006b). 4. Kegunaan Secara empiris binahong digunakan untuk menyembuhkan beberapa penyakit antara lain sebagai obat antiinflamasi, anti-ulcer, menyembuhkan luka dan juga dapat sebagai liver-protective. Selain itu juga digunakan untuk 7 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI mengobati infeksi pada luka (Anonim, 2006a). Ada pula penelitian yang mengemukakan bahwa ekstrak kloroform dari herba (Anredera cordifolia (Tenore) Steen dapat menghambat pertumbuhan beberapa bakteri (Meyer, 2004). B. Penyarian Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan yang tidak dapat larut dengan pelarut cair. Faktor yang mempengaruhi kecepatan penyarian adalah kecepatan difusi zat yang larut melalui lapisan-lapisan batas antara cairan penyari dengan bahan yang mengandung zat tersebut. Zat aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam alkaloida, glikosida, flavonoid dan lain-lain. (Anonim, 1986). Cara penyarian dapat dibedakan menjadi : 1. Infundasi Infundasi adalah proses penyarian (menyari simplisia dengan air pada suhu 90oC selama 15 menit) yang umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati (Anonim, 1986). 2. Maserasi Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak keluar. 8 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel (Anonim,1986). 3. Perkolasi Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia. Prinsip perkolasi adalah sebagai berikut : serbuk simplisia ditempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya beratnya sendiri dan cairan diatasnya, dikurangi daya kapiler yang cenderung untuk menahan (Anonim, 1986). C. Ekstrak etanol Tahap awal pemisahan suatu senyawa dari suatu tumbuhan dapat disebut sebagai ekstraksi. Faktor yang perlu dipertimbangkan dalam pemilihan metode ekstraksi antara lain kesesuaian antara senyawa kimia yang terkandung dalam bahan dengan sifat pelarut yang digunakan (Houghton dan Raman, 1998). Dalam buku Farmakope Indonesia Edisi IV, disebutkan bahwa ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan masa serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan (Anonim, 2000a). 9 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pelarut yang sering digunakan untuk ekstraksi adalah etanol. Etanol (C2H5OH) merupakan cairan yang mudah menguap, jernih, dan tidak berwarna. Sebagai pelarut, etanol mempunyai kelebihan antara lain mempunyai toksisitas rendah dibanding metanol, lebih stabil dan lebih murah. Etanol bersifat semipolar, maka dapat digunakan untuk mengekstrasi senyawa-senyawa yang bersifat polar dan non polar (Houghton dan Raman, 1998). D. Sterilisasi Sterilisasi ialah suatu proses untuk mematikan semua mikroorganisme yang terdapat pada atau di dalam suatu benda. Pemilihan metode sterilisasi didasarkan pada sifat bahan yang akan disterilkan (Pelczer dan Chan, 1986 ) Cara umum yang sering digunakan untuk sterilisasi, antara lain: 1. Sterilisasi dengan panas Cara ini paling banyak digunakan. Dapat digunakan untuk sterilisasi baik alat maupun media. Sterilisasi dengan panas dapat dibedakan menjadi tiga jenis, yaitu: dengan udara panas kering, panas lembab, dan pemijaran (Pelczer dan Chan, 1986 ). Untuk sterilisasi dengan udara panas kering, rentang suhu yang khas yang dapat diterima di dalam bejana sterilisasi kosong adalah lebih kurang 15 menit, jika alat sterilisasi beroperasi pada suhu tidak kurang dari 250oC sedangkan untuk proses satu siklus autoklaf yang ditetapkan dalam Farmakope Indonesia untuk media atau pereaksi adalah selama 15 menit pada suhu 121oC (Anonim, 1994). 10 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 2. Sterilisasi dengan penyaringan Sterilisasi ini digunakan untuk bahan-bahan yang sangat peka terhadap pemanasan (serum, antibiotika, toksin) atau bahan yang relatif tidak tahan terhadap pemanasan tinggi (medium yang mengandung senyawa gula). Untuk keperluan ini dibutuhkan alat filter atau saringan bakteri. 3. Sterilisasi dengan bahan kimia Bahan yang mudah rusak apabila disterilkan pada suhu tinggi, dapat disterilkan secara kimia dengan menggunakan gas radiasi. Bahan kimia yang digunakan untuk sterilisasi gas antara lain etilanoksida, asam parasetat, formaldehid, dan glutaraldehide alkalin (Suriawinata, 1986). E. Bakteri uji 1. Staphylococcus aureus S. aureus termasuk dalam familia Micrococcaceae adalah bakteri dengan sel-sel berbentuk bola dengan garis tengah sekitar 1µm dan tersusun dalam kelompok-kelompok tak beraturan. Pada biakan cairan tampak juga kokus tunggal, berpasangan, atau berbentuk rantai. Kokus muda bersifat gram positif kuat, sedangkan pada biakan yang lebih tua, banyak sel menjadi gram negatif. S aureus tidak bergerak dan tidak membentuk spora. Oleh obat-obatan seperti penisilin S. aureus dilisiskan. S. aureus tumbuh paling cepat pada suhu 11 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 37ºC. S. aureus membentuk koloni berwarna abu-abu sampai kuning emas (Jawetz, et al, 1996). Bakteri ini menyebabkan penyakit pada hampir semua jaringan tubuh yang terutama adalah abses. S. aureus merupakan flora normal pada rongga hidung bagian depan, perineum, saluran pencernaan, atau kulit ( Jawetz, et al, 1996). 2. Pseudomonas aeruginosa P. aeruginosa termasuk dalam familia Pseudomonadaceae berbentuk batang, bergerak, dan merupakan bakteri gram negatif aerob yang menghasilkan pigmen yang larut dalam air dan berdifusi melalui pembenihan buatan, tidak meragikan laktosa, dan membentuk koloni bulat halus dengan berfloresensi kehijau-hijauan dan bau aromatis (Jawetz, et al, 1996). P. aeruginosa menyebabkan infeksi pada luka kulit seperti luka bakar, dan membentuk nanah yang berwarna biru hijau, meningitis. Bakteri ini juga dapat menginfeksi saluran kemih atau saluran pernafasan (Jawetz, et al, 1996). F. Amoksisilin Amoksisilin merupakan suatu antibiotik golongan beta laktam derivat penisilin dengan spektrum luas. Amoksisilin mempunyai aktivitas bekterisida terhadap bakteri gram positif maupun gram negatif dengan mekanisme menghambat pembentukan atau sintesis dinding sel mikroba (Surini, 2006). Amoksisilin ditemukan tahun 1972 merupakan antibiotik yang umum dipakai karena cukup manjur dalam membunuh bakteri (Hendriyana, 2004). 12 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Amoksisilin mempunyai aktivitas yang sama dengan ampisilin. Bedanya, amoksisilin diserap di gastro intestinal lebih efektif dibandingkan ampisilin. Ampisilin merupakan antibakteri yang mempunyai spektrum penghambatan yang lebih luas dibanding dengan penisilin. Ampisilin dapat menghambat tidak hanya pneumococci, meningococco, gonococci dan streptococci yang lain, tetapi juga dapat menghambat beberapa bakteri bacillus (Harvey et all, 2003). Untuk masing-masing antibiotik dan jenis kumannya, mempunyai diameter yang berbeda-beda untuk dinilai sebagai antibiotik yang sensitif (poten dalam terapi). Untuk Stapylococcus akan memberikan makna resisten terhadap ampisilin jika diameter zona hambat yang terjadi sama atau kurang dari 20 mm dan dinyatakan sensitif apabila diameter zona hambat yang terjadi lebih dari 29 mm. Sedangkan untuk Pseudomonas dikatakan resisten apabila diameter zona hambatnya kurang dari atau sama dengan 11 mm dan dikatakan sensitif apabila diameter zona hambatnya lebih dari 14 mm (Anonim, 1993). G. Metode Pengujian Potensi Antibakteri Bahan antibakteri secara umum diartikan sebagai bahan yang mengganggu pertumbuhan dan metabolisme bakteri. Obat yang digunakan untuk membasmi bakteri, penyebab infeksi pada manusia, ditentukan harus memiliki sifat toksisitas selektif setinggi mungkin (Anonim, 1995). Berdasarkan sifat toksisitas selektif, ada antibakteri yang bersifat menghambat pertumbuhan bakteri, dikenal sebagai aktivitas bakteriostatik dan ada yang bersifat membunuh bakteri, dikenal sebagai aktivitas bakterisid. Kadar 13 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI minimal yang diperlukan untuk menghambat pertumbuhan bakteri atau membunuhnya, masing–masing dikenal sebagai Kadar Hambat Minimal (KHM) dan Kadar Bunuh Minimal (KBM) (Anonim, 1995). Metode pengujian potensi antibakteri dapat dibedakan menjadi 2 yaitu: 1. Metode difusi Metode ini mengukur aktivitas mikroba berdasarkan pengamatan luas daerah hambat pertumbuhan mikroba karena obat berdifusi dari titik awal pemberian ke daerah difusi. Mikroba ditanam pada media yang sesuai dan di atasnya diletakkan kertas cakram yang mengandung bahan obat atau dibuat sumuran dengan diameter tertentu yang diisi larutan bahan obat dengan kadar tertentu (Hugo & Russel, 1987). Metode difusi ada tiga macam yaitu: a. Cara Kirby Bauer Metode ini dilakukan dengan cara mengoleskan suspensi bakteri dengan konsentrasi tertentu, umumnya 108 Colony Forming Unit (CFU) per ml permukaan media hingga rata. Kertas yang mengandung antibiotika diletakkan di atas media lalu diinkubasikan pada 37ºC selama 18-24 jam, setelah itu baca hasilnya. Potensi antibakteri ditentukan dengan mengukur diameter zona hambatan yang terbentuk. Pada zona hambatan akan terlihat adanya pertumbuhan yang kurang subur jika dibandingkan dengan daerah di luar pengaruh antibiotik tersebut (Hugo dan Russel, 1987). 14 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI b. Cara sumuran Penyiapan dilakukan seperti cara Kirby Bauer. Pada agar yang telah diolesi bakteri uji dibuat sumuran dengan garis tengah tertentu dan tegak lurus terhadap permukaan media. Kemudian ke dalam sumuran ini diberi larutan uji dan diinkubasi pada 37ºC selama 24-28 jam, hasilnya dibaca seperti cara Kirby Bauer (Hugo dan Russel, 1987). c. Cara Pour Plate Mula-mula satu mata ose suspensi bakteri dicampur dengan 4 ml agar 1,5% pada temperature 50ºC. Setelah suspensi mikrobia homogen, tuangkan di atas media agar dan dibiarkan membeku, kemudian di atasnya diletakan disk dan diinkubasi pada suhu 37ºC selama 18-24 jam, hasilnya dibaca dengan mengukur diameter hambat (Hugo dan Russel, 1987). 2. Metode dilusi Ada dua macam metode dilusi yaitu: a. Cara pengenceran serial dalam tabung (dilusi cair) Pada cara ini zat antibakteri yang akan diuji aktivitasnya diencerkan secara serial dengan metode pengenceran kelipatan dua di dalam medium cair dan selanjutnya diinokulasikan dengan mikroba uji. Setelah diinkubasi pada suhu 37ºC selama 18-24 jam untuk bakteri dan fungi, aktivitas zat antibakteri ditentukan sebagai Konsentrasi Hambat Minimum, yaitu konsentrasi terendah yang masih dapat menghambat pertumbuhan mikroba (Hugo dan Russel, 1987). 15 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI b. Cara penapisan lempeng agar (dilusi padat) Pada cara ini zat yang akan ditentukan aktivitas antibakterinya diencerkan secara serial dengan metode pengenceran berkelipatan dua di dalam medium agar bersuhu 40-50ºC kemudian dituangkan ke dalam cawan petri. Setelah lempeng agar membeku, ditanamkan inokulum mikroba dan kemudian diinkubasi pada suhu 37ºC dalam jangka waktu yang sesuai dengan pertumbuhan mikroba yang diuji, aktivitas zat antibakteri ditentukan sebagai Konsentrasi Bunuh Minimum yaitu konsentrasi terendah yang masih dapat membunuh mikroba (Hugo dan Russel, 1987). H. Kromatografi Lapis Tipis Kromatografi adalah cara pemisahan berbagai senyawa yang ada dalam sediaan dengan jalan penyarian berfraksi, penyerapan, dan pertukaran ion, pada zat berpori dengan menggunakan cairan atau gas yang mengalir (Stahl, 1985). 1. Kromatografi Lapis Tipis Kromatografi Lapis Tipis merupakan salah satu metode kromatografi cair yang paling sederhana. Kromatografi cair dapat dikembangkan dengan pelarut tunggal atau bisa juga dengan campuran dua pelarut atau lebih (Stahl, 1985). Absorban yang sering digunakan yaitu silika gel. Silika gel adalah bahan yang berpori dan amorf. Struktur dasar dari silika gel terbentuk selama pembentukan gel asam polisiklik dari asam monosiklik (Stahl, 1985). 16 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pada metode ini, setelah pengembangan, harus dilakukan pembandingan antara bentuk bercak, daerah bercak, resolusi, bercak-bercak yang lain yang terdapat dalam lempeng. Nilai Rf dapat digunakan sebagai nilai yang menggambarkan jarak elusi. Nilai Rf dapat dihitung dengan menggunakan rumus: Rf = jarak bercak dari tempat penotolan jarak pengembangan Kelebihan KLT antara lain yaitu pemisahan senyawa yang amat berbeda seperti senyawa organik ataupun anorganik dapat dilakukan dengan alat yang harganya tidak terlalu mahal. Jumlah cuplikan dengan konsentrasi rendah dapat ditangani yaitu sekitar 0,1μg – 5mg. Pemakaian pelarut dan jumlah cuplikan yang diperlukan sedikit, sedangkan penotolan cuplikan berganda dimungkinkan. Selain itu juga dapat memisahkan campuran yang mengandung sampai empat komponen yang berbeda (Stahl, 1985). Kekurangan teknik ini yaitu pada pembuatan fase diam pada lempeng yang membutuhkan tambahan waktu, kecuali bila sudah tersedia lempeng yang diproduksi secara komersial (Sulasmono, 1995). 2. Fase gerak Fase gerak merupakan medium angkut yang terdiri dari satu atau beberapa pelarut (Stahl, 1985). Dalam beberapa kasus, penggunaan pelarut tunggal sudah memberikan hasil yang memuaskan. Akan tetapi pada sebagian besar kasus, satu pelarut tidak dapat mengembangkan fase diam cukup jauh. 17 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Karena itu harus dicampur antara pelarut untuk memperoleh kepolaran yang diinginkan (Gritter, 1991). 3. Pengembangan dan Deteksi Lempeng yang telah ditotoli ditaruh di dalam bejana kecil yang berisi pelarut yang tingginya beberapa cm. Tinggi pelarut di dalam bejana harus di bawah tempat penotolan lempeng. Bejana ditutup dan pelarut dibiarkan merambat naik sampai 10-15 cm (Gritter, 1991). Pengembangan memerlukan waktu sekitar 5 menit, bergantung pada penyerap dan pelarut. Pengembangan lempeng biasanya dilakukan dalam bejana kaca yang dapat menampung beberapa lempeng. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan sehelai kertas saring yang tercelup ke dalam pengembang. Keefisienan pemisahan dapat ditingkatkan dengan cara pengembangan berganda (Gritter, 1991). I. Flavonoid Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6 yaitu kerangka karbonnya terdiri atas 2 gugus C6 (cincin benzene tersubtitusi) yang disambungkan oleh rantai alifatik dengan 3 karbon. Kerangka flavonoid tersebut dapat digambarkan sebagai A C H2 C H2 C H2 B Gambar 1. Kerangka flavonoid 18 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoid yang manapun mungkin saja terdapat dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida (Robinson, 1991). Ada beberapa fase gerak yang biasa digunakan untuk menghasilkan pemisahan yang baik pada lempeng selulosa. Butanol : Asam asetat : Air (40:50:10) fase atas, merupakan fase gerak yang sering digunakan. Aglikon dari flavonoid mempunyai nilai Rf yang tinggi dan waktu elusi yang lama (Stahl, 1969). Pada UV 254 nm, semua flavonoid menyebabkan pemadaman fluoresensi, dimana terlihat sebagai warna biru gelap pada lempeng KLT. Pada UV 365 nm, tergantung pada strukturnya, flavonoid berfluoresensi kuning, biru, atau hijau (Wagner, 1984). J. Alkaloid Alkaloid adalah senyawa organik yang berasal dari alam yang mengandung satu atau lebih atom nitrogen, berada dalam distribusi terbatas dan dalam dosis yang rendah memiliki efek farmakologi. Di alam, alkaloid terdapat dalam bentuk bebas, sebagai garam dan N-Oksida. Alkaloid biasanya berupa zat padat, tetapi ada pula yang berupa zat cair, seperti ephedrine dan spartein. Alkaloid berasa pahit dan sukar larut dalam air, tetapi mudah larut dalam kloroform, eter, dan pelarut organik lain yang relatif non polar. Sebaliknya bila berupa garam, alkaloid akan mudah larut dalam air, tetapi tidak larut dalam pelarut organik (Samuelson, 2002). 19 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pemisahan alkaloid secara KLT dapat menggunakan fase diam silika gel, alumina, selulosa atau kieselguhr. Pemisahan yang baik diperoleh jika silika gel sudah diaktifkan. Banyak alkaloid dapat dideteksi secara visibel. Sebagian besar alkaloid juga memiliki bercak yang berfloresensi di bawah sinar UV 365. Reagent yang biasanya dipakai untuk mendeteksi adalah reagen Dragendorf (Stahl, 1969). Dengan penyemprotan reagen Dragendorff, menunjukkan warna cokelat atau orange (visibel) yang tidak stabil (Wagner, 1984). K. Senyawa polifenol Senyawa fenolik dapat digolongkan menjadi senyawa fenol sederhana, fenol asam karboksilat, α-Pyrones, Lichens, Lignan, chromones, flavonoid, dan Quinone. Pemisahan senyawa fenolik dapat dilakukan dengan metode KLT menggunakan fase diam silika gel. Pemilihan fase geraknya tergantung tingkat polaritas campuran yang akan dipisahkan. Contoh fase gerak yang sering digunakan adalah benzene : kloroform (50: 50), kloroform : methanol (97:3), dan lain-lain (Stahl, 1969) Aktivitas fisiologis senyawa fenolik tumbuhan banyak dan beragam. Beberapa senyawa fenolik bersifat racun terhadap hewan pemangsa tumbuhan (herbivora) dan beberapa bersifat racun serangga. Senyawa fenolik lain mempunyai aktivitas antiinflamasi, karena senyawa ini menghambat sintesis prostaglandin (Robinson, 1991). Hanya antosianin dan beberapa derivat quinon yang dapat dideteksi secara langsung dengan sinar tampak pada lempeng silika gel. Senyawa fenolik lainnya, 20 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI merupakan senyawa yang tidak berwarna dan harus diwarnai. Dengan FeCl3 bercak akan terlihat berwarna kuning tua sampai ungu tergantung jenis polifenolnya. Biasanya bercak yang terjadi berwarna biru kehijauan (Stahl, 1969). L. Tanin Tanin merupakan senyawa yang sangat kompleks, biasanya terdapat sebagai campuran polifenol yang sangat sulit dikristalkan. Tanin dengan air membentuk larutan koloidal, mempunyai reaksi asam dan rasanya sangat sepat. Makin murni tanin, makin kurang kelarutannya dalam air dan makin mudah diperoleh dalam bentuk kristal. Tanin larut pula dalam pelarut organik yang polar, setidak-tidaknya sampai batas tertentu, tetapi tidak larut dalam pelarut organik non polar seperti benzene dan kloroform. Larutan tanin dalam air dapat diendapkan dengan penambahan asam mineral atau garam (Robinson,1991). Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae teradapat khusus dalam jaringan kayu. Terdapat dua jenis tanin, yaitu tanin terhidrolisis dan tanin terkondensasi. Tanin terhidrolisis dapat dihidrolisis oleh asam atau enzim seperti tannase. Tanin jenis ini terbentuk dari beberapa molekul asam fenolik seperti asam galat dan asam heksahidroksidipenik yang disatukan oleh ikatan ester dengan molekul glukosa. Sedangkan tanin terkondendasi tidak terhidrolisis menjadi molekul yang lebih sederhana dan tidak mengandung gugus gula. Tanin terkondensasi akan berubah warna menjadi cairan tidak larut berwarna merah ketika bereaksi dengan asam atau enzim terkondensasi, sedangkan tanin 21 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI terhidrolisis akan membentuk warna biru ketika bereaksi dengan garam besi (Trease dan Evans, 2002). Tanin merupakan senyawa asam karboksilat fenol yang dapat dipisahkan menggunakan fase diam silica gel dan fase gerak toluene: etil formate: asam format (50:40:10) (Stahl, 1969). Beberapa tanin terbukti mempunyai aktivitas antioksidan, menghambat pertumbuhan tumor, tanin juga dapat meracuni hati (Robinson,1991). Tanin juga berfungsi sebagai anthelmintik, anti HIV, antibakteri, antikanker, dan anti karsinogenik (Duke, 1992). M. Saponin Saponin tersebar luas di berbagai jenis tumbuhan. Keberadaan saponin sangat mudah ditandai dengan pembentukkan larutan koloidal dengan air apabila digojok menimbulkan buih yang stabil. Saponin merupakan senyawa berasa pahit menusuk dan menyebabkan bersin dan sering mengakibatkan iritasi pada selaput lendir (Gunawan, 2004). Beberapa saponin bekerja sebagai senyawa antimikroba. (Robinson, 1991). Adanya saponin dapat ditunjukkan dengan beberapa cara antara lain dengan indeks buih. Indeks buih menunjukkan angka pengenceran dari bahan yang diperiksa. Reaksi identifikasi ini akan memberikan lapisan buih setinggi 1 cm bila larutan sampel ditambah air digojok dalam gelas ukur selama 15 detik dan selanjutnya dibiarkan selama 15 menit (Gunawan, 2004). 22 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Pengujian KLT untuk saponin menggunakan fase gerak contohnya kloroform : methanol : air (65: 35 : 10) untuk memisahkan campuran glikosida terpenoid yang netral. Dengan fase diam yang sering digunakan adalah silika gel (Wagner, Bladt, dan Zgainski, 1984). N. Keterangan Empiris Binahong digunakan masyarakat secara empiris untuk mengobati beberapa penyakit antara lain yaitu sebagai obat antiinflamasi, anti-ulcer, penyembuh luka dan juga dapat sebagai liver-protective. Selain itu binahong juga dapat mengobati infeksi mikroba, salah satunya adalah penyakit infeksi pada luka (Anonim, 2005). Luka pada kulit dapat disebabkan oleh infeksi Staphylococcus aureus dan Pseudomonas aeruginosa (Naim, 2006). Staphylococcus aureus merupakan bakteri yang menyebabkan penyakit pada hampir semua jaringan tubuh yang terutama adalah abses. Staphylococcus aureus merupakan flora normal pada rongga hidung bagian depan, perineum, saluran pencernaan, atau kulit. Sedangkan Pseudomonas aeruginosa merupakan bakteri menyebabkan infeksi pada luka kulit seperti luka bakar, dan membentuk nanah yang berwarna biru hijau, meningitis. Bakteri ini juga dapat menginfeksi saluran kemih atau saluran pernafasan (Jawetz, et al, 1996). Penelitian ini bersifat eksploratif, belum ada informasi yang menyatakan secara langsung dalam sistem pelayanan kesehatan formal mengenai manfaat dari tumbuhan ini. Untuk itu penelitian dilakukan berdasarkan penggunaan binahong secara empiris oleh masyarakat. 23 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 24 BAB III METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian Penelitian ini termasuk jenis penelitian eksperimental yang bersifat eksploratif dengan perlakuan pemberian konsentrasi ekstrak etanol umbi binahong yang berbeda terhadap S. aureus dan P. aeruginosa. Analisis yang dilakukan merupakan rancangan acak lengkap pola satu arah. Penelitian dilakukan di Laboratorium Farmakognosi Fitokimia dan Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma. B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian a. Variabel bebas yaitu ekstrak etanol umbi binahong dengan konsentrasi 100%, 75%, 50% dan 25%. b. Variabel tergantungnya adalah diameter zona hambat pertumbuhan S. aureus dan P. aeruginosa. c. Variabel terkendali antara lain waktu inkubasi (24 jam), suhu inkubasi (37ºC), jenis bakteri uji, volume suspensi bakteri uji yang diinokulasikan dalam media (0,2 ml), konsentrasi suspensi bakteri uji setara dengan larutan standar Mc. Farland II (6x108 CFU/ml), volume larutan uji yang diinokulasikan dalam paperdisk (20µl), dan tempat tumbuh binahong di Balai Penelitian Tanaman Obat (BPTO) Tawangmangu. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 25 d. Variabel tak terkendali antara lain suhu pengeringan bahan di bawah matahari. 2. Definisi operasional a. Potensi antibakteri adalah kemampuan ekstrak etanol umbi binahong yang dapat membunuh atau menghambat pertumbuhan bakteri bakteri S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853 yang dapat dilihat dari zona jernih yang menggambarkan zona hambat pertumbuhan bakteri, dibandingkan dengan DMSO sebagai pelarut. b. Ekstrak etanol umbi binahong merupakan hasil maserasi dari 175g umbi batang dari tanaman binahong dengan menggunakan pelarut etanol pa 70% sebanyak 1312,5ml dimana pergantian cairan penyari dilakukan setiap 24 jam sekali dengan jumlah yang sama dan diperoleh ekstrak kental sebanyak 14,23 gram. c. Staphylococcus aureus ATCC 25923 merupakan stock strain bakteri gram positif, berbentuk coccus dengan diameter 0,5 -1,5 µm, nonmotil, mengalami metabolisme secara respirasi dan fermentasi, menunjukkan reaksi positif untuk uji katalase, dan negatif untuk reaksi oksidasi, diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta dengan nomor contoh uji S. 34.4, asal contoh uji : Komersial Oxoid tahun 2004. d. Pseudomonas aeruginosa ATCC 27853 merupakan stock strain bakteri gram negatif, berbentuk batang, tidak tahan asam, menunjukkan reaksi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 26 positif untuk uji katalase, diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta dengan nomor contoh uji P.10.4. asal contoh uji : Komersial Oxoid tahun 2004. e. Zona hambat adalah daerah di sekitar paperdisk yang tidak ditemukan adanya pertumbuhan bakteri S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853 dan yang terdapat pertumbuhan bakteri dalam jumlah sedikit yang berupa zona jernih. C. Bahan dan Alat Penelitian 1. Bahan Bahan yang digunakan dalam penelitian adalah umbi binahong yang diperoleh dari Balai Penelitian Tanaman Obat di Tawangmangu, nutrien agar (oxoid) , DMSO sebagai kontrol negatif, aquadest steril, amoksisilin injeksi kering (Danoxilin® 1000 mg) sebagai kontrol positif, bakteri Staphylocuccus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 yang diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta. Fase diam : lempeng KLT silika Gel GF 254, dan selulosa, fase gerak toluene: etil asetat (93:7), etil asetat: metanol: air (70:20:10), toluene: etil asetat : metanol (70:20:10), n-Butanol: Asam asetat: Air (4: 1: 5), etil asetat : metanol : air (100 : 13,5 : 10), pembanding rutin, skopolamin, eugenol, asam tanat, Glycyrrhiza Radix, deteksi uap amoniak, dragendroff LP, larutan FeCl3, dan anisaldehid-asam sulfat. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 27 2. Alat Alat-alat yang digunakan dalam penelitian ini antara lain: a. Alat untuk preparasi sampel uji: Alat-alat gelas (Pyrex), Paltform Shaker (Innova 2001, New BrunswickScientific), Rotary evaporator (janke dan Kunkel, Ika- Labotechnik, RV 05-ST), Waterbath (Memmert, Tipe BE 400, GmbH+ CoKG-D91126, Swahaban FRG Germany), b. Alat- alat untuk pengujian potensi antimikroba : Vortek (Stuart Scientic), Micro Safety Cabinet, Mikropipet 10μl Nichiryo Model 5000 DG, Jarum Ose, spreader, Bunsen, Almari es (Sharp), Timbangan analitik (Metter Toledo AB 204). c. Alat untuk KLT : Bejana pengembangan KLT/ Chamber, lampu UV dengan panjang gelombang 365nm dan 254 nm mikropipet 5µl, alat semprot, kertas saring. D. Jalannya Penelitian 1. Determinasi tanaman binahong Tanaman binahong dideterminasi oleh Balai Penelitian Tanaman Obat (BPTO) Tawangangmangu dengan menggunakan pustaka acuan C. A. Backer (1968). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 28 2. Pengumpulan bahan Umbi binahong diperoleh dari Balai Penelitian Tanaman Obat Tawangangmangu. Umbi yang diperoleh berupa umbi batang yang sudah dikeringkan. 3. Pembuatan Serbuk Pembuatan serbuk dilakukan dengan menggunakan blender. Kemudian serbuk yang telah diperoleh, diayak dengan menggunakan pengayak 12/50, sehingga diperoleh serbuk dengan derajad halus yang homogen. 4. Pembuatan ekstrak etanol dengan metode maserasi Sebanyak 175 g serbuk umbi binahong, diletakkan ke dalam 7 erlenmeyer terpisah, kemudian direndam dengan 187,5 ml pada tiap erlenmeyer selama 3 hari (serbuk : cairan penyari = 10:75) dan cairan penyari diganti setiap hari dengan jumlah yang sama. Proses perendaman juga disertai dengan penggojogan dengan shaker. Setelah itu, hasil maserasi (maserat) disaring dan kemudian diuapkan dengan menggunakan rotary evaporator. Untuk menghilangkan seluruh pelarut yang masih terdapat di dalam ekstrak, hasil penguapan dari rotary evaporator diuapkan kembali di atas waterbath. Hasil penyaringan ditempatkan dalam cawan porselin yang telah ditara sebelumnya. 5. Skrining Fitokimia Skrining fitokimia meliputi uji tabung dan uji KLT. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 29 a. Uji Tabung Uji tabung serbuk umbi binahong meliputi uji pendahuluan, uji alkaloida, uji antrakinon, uji polifenol, uji tanin, uji kardenolida, dan uji saponin. 1) Uji pendahuluan Serbuk tumbuhan (2g) ditambah air (10 ml), dipanaskan selama 30 menit di atas air mendidih. Larutan disaring menggunakan kapas. Lalu ditambahkan larutan kalium hidroksida (beberapa tetes). 2) Uji alkaloida Serbuk tumbuhan (2g) dipanaskan dalam tabung reaksi besar dengan asam klorida 1% (10ml) selama 30 menit dalam penangas air mendidih. Suspensi disaring dengan kapas ke dalam tabung reaksi A1 dan tabung reaksi A2 sama banyak. Larutan A1 ditambah pereaksi Dragendorf (3 tetes) dan larutan A2 ditambah pereaksi mayer (3 tetes). 3) Uji antrakinon Serbuk tumbuhan (300 mg) dididihkan selama 2 menit dengan kalium hidroksida 0,5 N (10 ml) dan larutan hidrogen peroksida (1 ml). Setelah dingin, suspensi disaring melalui kapas. Filtrat (5 ml) ditambah asam asetat glacial (10 tetes) sampai pH 5, lalu ditambahkan toluene (10 ml). Lapisan atas (5 ml) dipisahkan dengan pipet dan dimasukkan ke dalam tabung reaksi. Kemudian ditambah kalium hidroksida 0,5 N. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 30 4) Uji polifenol Serbuk tumbuhan (2 g) dipanaskan dengan air (10 ml) selama 10 menit dalam penangas air mendidih. Disaring panas-panas, setelah dingin ditambah 3 tetes pereaksi besi (III) klorida. 5) Uji tanin (zat samak) Serbuk tumbuhan (2 g) dipanaskan dengan air (10 ml) selama 30 menit di atas tangas air. Disaring, filtrat (5 ml) ditambahkan larutan natrium klorida 2 % (1 ml), bila terjadi suspensi atau endapan disaring melalui kertas saring, kemudian filtrat ditambahkan 5ml larutan gelatin 1% 6) Uji saponin a) Tambahkan air (10 ml) ke dalam tabung reaksi yang berisi serbuk tumbuhan (100 mg), tutup dan kocok kuat-kuat selama 30 detik. Biarkan tabung dalam kondisi tegak selama 30 menit. b) Uji lain dilakukan dengan menggunakan pipa kapiler (diameter 1 mm, panjang 12,5 cm). Larutan hasil pemanasan serbuk tumbuhan (2 g) dengan air (10 ml) selama 30 menit di atas tangas air, setelah disaring, filtrat dimasukkan ke dalam pipa kapiler penuh-penuh. Kapiler diletakkan dalam posisi tegak vertikal, kemudian cairan dibiarkan mengalir bebas. Sebagai pembanding, dikerjakan hal serupa untuk air suling. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 31 b. Uji kualitatif secara Kromatografi Lapis Tipis Ekstrak Etanol Umbi Binahong a. Pembuatan Larutan Uji untuk KLT dari Ekstrak Etanol Umbi Binahong Ekstrak etanol umbi binahong yang digunakan untuk uji KLT adalah ekstrak etanol dengan konsentrasi 10%. Pembuatannya dilakukan dengan cara ekstrak etanol umbi binahong ditimbang sebanyak 0,5 g, kemudian dilarutkan dengan 5 ml etanol p.a 70%. b. Pembuatan Fase Diam Fase diam yang digunakan dalam uji KLT untuk senyawa saponin, alkaloid, tanin dan senyawa fenolik adalah silika gel GF 254 sedangkan untuk flavonoid digunakan selulosa. Fase diam selulosa yang digunakan merupakan selulosa p.a, yang berupa lembaran kertas mika yang dilapisi dengan selulosa. Untuk silika gel GF 254, dibuat dengan perhitungan : dibutuhkan 1,5 g silika gel GF untuk tiap lempeng. Jadi penimbangan silika gel GF disesuaikan dengan jumlah lempeng yang akan dibuat. Kemudian serbuk silika gel yang sudah ditimbang tersebut, dilarutkan dengan 3 ml aquadest untuk tiap gramnya (jumlah aquadest yang digunakan juga menyesuaikan serbuk silika gel GF yang ditimbang). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 32 c. Penjenuhan Fase Gerak di dalam Bejana Bejana kromatografi yang akan digunakan, dilapisi dengan kertas saring yang telah dipotong dengan ukuran yang sesuai di bagian dalamnya. Fase gerak yang digunakan dimasukkan ke dalam bejana. Kemudian bejana ditutup rapat dan dibiarkan hingga seluruh isi bejana jenuh dengan uap fase gerak yang ditandai dengan seluruh permukaan kertas saring pada dinding bagian dalam bejana telah terbasahi oleh fase gerak. 1) Uji KLT flavonoid Fase diam yang digunakan yaitu selulosa dan fase gerak yang digunakan adalah butanol: asam asetat : air (4:1:5). Pembanding yang digunakan adalah rutin. Sampel dan pembanding ditotolkan pada lempeng KLT kemudian dielusi pada batas tertentu (10 cm). Setelah itu dideteksi dengan UV 254 nm, UV 365 nm dan dengan uap amonia. 2) Uji KLT alkaloid Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak yang digunakan adalah etil asetat: methanol: air (70:20:10). Sebagai pembanding digunakan skopolamin. Sampel dan pembanding ditotolkan bersama-sama pada lempeng KLT, kemudian dielusi pada batas tertentu (10 cm). Setelah itu dideteksi dibawah sinar UV 254 nm dan UV 365 nm, kemudian dideteksi dengan pereaksi semprot Dragendorff 3) Uji KLT senyawa fenolik Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 33 yang digunakan adalah toluene: etil asetat: metanol (70:20:10). Pembanding yang digunakan yaitu Eugenol. Sampel dan pembanding ditotolkan pada lempeng KLT, kemudian dielusi pada batas tertentu (10 cm) dan dikeringkan. Deteksi dilakukan dibawah sinar UV 254 nm dan pereaksi semprot FeCl3. 4) Uji KLT tanin Uji KLT tanin menggunakan fase diam silika gel GF 254 dan fase gerak etil asetat : metanol : air (100 : 13,5 : 10). Sampel dan pembanding yang berupa asam tanat 1% ditotolkan pada lempeng KLT kemudian dielusi pada batas tertentu (10 cm). Setelah itu dideteksi dengan UV 254 nm, UV 365 nm dan FeCl3. 5) Uji KLT saponin Fase diam yang digunakan adalah silika gel GF 254. Fase gerak yang digunakan adalah toluen : etil asetat (93 : 7). Ekstrak etanol umbi binahong 10% dan pembanding yaitu Glycyrrhiza Radix 1% ditotolkan pada lempeng silika gel GF 254 menggunakan mikropipet berukuran 5µl, kemudian dielusi pada batas tertentu (10 cm). Setelah elusi selesai, bercak dideteksi dengan pereaksi anisaldehid - asam sulfat dan diamati secara visibel. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 34 6. Uji potensi antibakteri ekstrak etanol umbi binahong terhadap Staphylococcus aureus dan Pseudomonas aeruginosa a. Penyiapan stok bakteri uji Diambil dua ose kultur dari kultur bakteri stok menggunakan jarum ose steril. Diinokulasikan pada 5 ml Nutrian Agar miring dan diinkubasi selama 24 jam pada suhu 37ºC di inkubator. b. Pembuatan suspensi Bakteri uji Pembuatan suspensi bakteri dilakukan dengan mengambil 1-2 ose bakteri dari stok yang telah dibuat sebelumnya, diinokulasikan pada 3 ml media Nutrien Broth. Suspensi tersebut diinkubasikan selama 24 jam pada suhu 37ºC. Kemudian divortex, dan disetarakan kekeruhannya dengan larutan standard Mc. Farland II (6x108 CFU/ml) menggunakan Nutrien Broth. c. Pembuatan variasi konsentrasi larutan uji Larutan uji yang digunakan untuk uji potensi antibakteri, merupakan ekstrak etanol yang dibuat dalam berbagai konsentrasi yaitu 25%, 50%, 75%, 100%. Ekstrak etanol dengan konsentrasi 100% (stok larutan uji) dibuat dengan cara: ekstrak kental (hasil penyarian) yang diperoleh ditimbang sejumlah 10g yang kemudian dilarutkan ke dalam 10 ml DMSO. Larutan itu merupakan stok. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 35 Dari stok larutan uji tersebut, dapat dibuat variasi konsentrasi larutan uji sebagai berikut: Tabel I. Pembuatan Variasi Konsentrasi Uji Konsentrasi Volume yang diambil Di ad dengan pelarut larutan uji dari stok larutan uji sampai (ml) (%) (ml) 75 7,5 10 50 5,0 10 25 2,5 10 d. Pembiakan suspensi bakteri uji secara spread platting Media NA sebanyak 20 ml dituang ke dalam cawan petri, dan didiamkan sampai memadat. Suspensi bakteri sebanyak 0,2 ml dipindahkan ke dalam media yang sudah memadat lalu diratakan menggunakan spreader. e. Metode difusi Setelah pembiakan secara spread platting, siapkan paperdisk yang telah dijenuhkan dengan amoksisilin sebagai kontrol positif, DMSO sebagai kontrol negatif, ekstrak etanol umbi binahong dengan konsentrasi 25%, 50%, 75%, dan 100% Petri-petri tersebut diinkubasikan selama 24 jam pada suhu 37ºC kemudian diamati ada tidaknya zona hambat di sekitar paperdisk. Zona hambat yang terbentuk diukur dengan penggaris. Pada uji potensi antibakteri ini dilakukan replikasi sebanyak 3 kali. f. Metode dilusi padat Pada uji potensi antibakteri pada metode difusi, didapatkan konsentrasi terkecil dari ekstrak umbi binahong. Dari konsentrasi terkecil PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 36 tersebut, dibuat rentang konsentrasi yang lebih rendah sebanyak 5 variasi konsentrasi untuk mengetahui KHM dari masing-masing ekstrak. Pengujian dimulai dengan membuat suspensi bakteri yang disetarakan kekeruhannya dengan standard Mc. Farland II (6x108 CFU/ml). Dari suspensi tersebut, diambil 0,5 ml, ditambah dengan larutan uji sebanyak 0,5 ml dengan kadar tertentu dan dicampur rata dengan 20 ml NA yang dicairkan. Setelah itu dituang dalam cawan petri dan diinkubasi selama 24 jam pada suhu 37ºC. Diamati banyak sedikit atau ada tidaknya pertumbuhan bakteri uji pada berbagai variasi konsentrasi dengan diberi tanda. E. Analisis Data Analisis uji antibakteri dengan metode difusi paperdisk dilakukan dengan mengukur diameter zona hambat yang dapat dilihat dari zona jernih di sekitar paperdisk Analisis hasil KLT bersifat deskriptif dan komparatif, dilakukan dengan menghitung harga Rf dan mengamati bercak yang timbul dari ekstrak etanol dan membandingkannya dengan standar yang sesuai. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB IV HASIL DAN PEMBAHASAN A. Determinasi Determinasi tanaman dilakukan di Balai Penelitian Tanaman Obat (BPTO) Tawangmangu. Diidentifikasi di BPTO menurut acuan C. A. Backer (1968). Identifikasi tanaman ini bertujuan untuk memastikan bahwa tanaman yang digunakan adalah binahong (Anredera cordifolia (Tenore) Steen). Dari hasil determinasi tersebut, tanaman binahong yang digunakan dalam penelitian ini diketahui memiliki nama ilmiah Anredera cordifolia (Tenore) Steen (Lampiran 1 dan lampiran 2). Bagian tanaman yang digunakan yaitu umbinya. Menurut Tjitrosoepomo (1985), umbi merupakan metamorfosis (penjelmaan, perubahan bentuk) dari batang dan akar. Umbi biasanya merupakan suatu bagian yang membengkak, bangun bulat, seperti kerucut atau tidak beraturan, merupakan tempat penimbunan makanan, dapat merupakan metamorfosis dari batang, dapat pula merupakan metamorfosis dari akar. Dalam penelitian ini umbi yang dimaksud adalah umbi batang yaitu metamorfosis dari batang. B. Pengumpulan Bahan dan Pembuatan Serbuk Umbi binahong yang digunakan diperoleh dari BPTO Tawangmangu. Umbi yang diperoleh, merupakan umbi yang sudah dikeringkan. Tujuan dari pengeringan adalah untuk mendapatkan simplisia yang tidak mudah rusak, sehingga dapat disimpan dalam waktu yang lebih lama. Pengeringan bahan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 38 dilakukan untuk mengurangi kadar air dari bahan. Air merupakan media yang baik untuk pertumbuhan mikroba, dengan demikian pengeringan dapat mencegah terjadinya pembusukan. Selain itu, juga dapat untuk menghentikan reaksi-reaksi enzimatik yang terjadi pada bahan tersebut. Penyerbukan dilakukan dengan menggunakan blender. Penyerbukan ini bertujuan untuk memperkecil ukuran partikel bahan dan meningkatnya luas permukaan bahan. Dengan meningkatnya luas permukaan bahan, maka kontak antara cairan penyari dengan bahan semakin besar, sehingga serbuk akan semakin mudah terbasahi oleh penyari. Dengan demikian diharapkan penyarian akan lebih efektif dan mempermudah penarikan senyawa dari serbuk oleh penyari. Serbuk yang diperoleh kemudian diayak dengan ayakan nomor 12/50. Nomor pengayak menunjukkan jumlah lubang tiap-tiap 2,54 cm, dihitung searah dengan panjang kawat. Jadi derajat halus serbuk dengan pengayak nomor 12/50 adalah 4,7/19,7. Hasil ini mendekati derajat halus serbuk simplisia pada umumnya yaitu 4/18. Derajat halus serbuk dapat dinyatakan dengan satu nomor atau dua nomor. Jika derajat halus dinyatakan dengan dua nomor, berarti semua serbuk dapat melalui pengayak dengan nomor terendah dan tidak lebih dari 40% melalui pengayak nomor tertinggi (Anief, 2000). Dalam hal ini, berarti semua serbuk dapat melalui pengayak nomor 12 dan tidak lebih dari 40% dapat melalui pengayak nomor 50. C. Pembuatan Ekstrak Etanol dengan Metode Maserasi Serbuk umbi binahong yang diperoleh, kemudian diekstraksi dengan pelarut etanol. Proses ekstraksi dilakukan secara maserasi, yaitu dengan cara merendam sejumlah serbuk dengan sejumlah cairan penyari yang sudah PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 39 ditentukan. Mekanisme metode maserasi yaitu cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel (Anonim,1986). Menurut Anonim (1986), maserasi pada umumnya dilakukan dengan cara 10 bagian simplisia dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi dengan 75 bagian cairan penyari, ditutup dan dibiarkan selama 5 hari, sambil berulang-ulang kali diaduk. Dalam penelitian ini, serbuk yang digunakan sebanyak 175g dibagi ke dalam 7 Erlenmeyer (tiap Erlenmeyer berisi 25 gram serbuk), kemudian direndam dengan 187,5 ml etanol pa 70% pada tiap erlenmeyer. Perbandingan serbuk dan cairan penyari 10:75. Pengadukan dilakukan dengan cara digojok menggunakan mesin pengaduk yang berputar-putar terus menerus (shaker). Ini merupakan salah satu modifikasi dari maserasi. Proses penggojokkan itu sendiri hanya dilakukan selama 3 hari. Hal ini dilakukan karena pada hari ke-3 cairan penyari yang digunakan sudah jernih. Dengan demikian diasumsikan sebagian besar senyawa sudah tersari. Untuk menghindari terjadinya penjenuhan cairan penyari, maka cairan penyari yang digunakan yaitu etanol diganti setiap 24 jam sekali, sehingga etanol yang digunakan tetap baru. Metode maserasi dipilih karena selain cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan, metode ini juga dapat dimodifikasi. Sebagai contoh yaitu dilakukan penggojokan dengan mesin pengaduk (maserasi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 40 mekanik). Proses pengadukan tersebut akan meningkatkan kelarutan senyawa yang terdapat dalam serbuk, sehingga dimungkinkan senyawa yang tersari akan lebih banyak. Selain itu, penggojogan akan meratakan konsentrasi di luar sel, sehingga perbedaan konsentrasi di dalam dan di luar sel yang sebesar-besarnya terjaga. Modifikasi lain yang dapat dilakukan yaitu remaserasi dimana dilakukan pergantian cairan penyari setelah dilakukan penyaringan pada maserat sebelumnya. Keuntungan lain dari maserasi adalah secara metodologis, keterulangan proses lebih terjamin. Hal ini dikarenakan perbandingan jumlah pelarut dengan jumlah serbuk dan lama waktu penyarian proses maserasi dapat ditentukan. Setelah itu, hasil maserasi (maserat) disaring dan kemudian diuapkan dengan menggunakan rotary evaporator. Supaya hasil maserat lebih pekat, maka harus diuapkan lagi di atas waterbath, dan kemudian disimpan di dalam oven pada suhu 30oC. Penguapan ini bertujuan untuk menguapkan cairan penyari, sehingga didapatkan ekstrak kental. Proses penguapan ini dilakukan bertahap di rotary evaporator kemudian dilanjutkan di atas waterbath untuk alasan teknis. Maksudnya tidak mungkin penguapan hanya dilakukan di rotary evaporator sampai menjadi kental. Jadi sebelum benar-benar kental, ekstrak harus dipindahkan ke dalam cawan porselin yang sudah ditara dan diuapkan di atas waterbath. Cawan porselin harus ditara lebih dahulu agar memudahkan penghitungan ekstrak yang diperoleh. Ekstrak kental yang diperoleh yaitu sebanyak 14,23 gram. Kelebihan ekstrak kental yaitu lebih tahan lama dibanding dengan ekstrak cair. Umbi binahong mengandung lendir, sehingga proses PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 41 penguapan tidak dapat benar-benar kering, jadi hasil yang diperoleh berupa ekstrak kental. D. Skrining Fitokimia Tujuan utama skrining fitokimia adalah untuk mensurvei tumbuhan untuk mendapatkan kandungan bioaktif atau kandungan yang berguna untuk pengobatan. Dalam penelitian ini skrining perlu dilakukan untuk mengetahui ada tidaknya senyawa yang berpotensi sebagai antibakteri. Sebagai contoh yaitu senyawa saponin, alkaloid, fenolik, flavonoid, tanin dan lain-lain. Analisis kualitatif untuk mengetahui golongan senyawa dalam tumbuhan tersebut dapat dilakukan dalam dua tahap, yaitu uji tabung dan uji kualitatif secara KLT. 1. Uji tabung Tujuan utama uji tabung yaitu untuk mengetahui kandungan kimia umbi binahong, yang kemudian dipertegas dengan KLT. Uji tabung itu sendiri meliputi uji pendahuluan, uji alkaloida. uji antrakinon, uji polifenol, uji tanin, uji kardenolida, dan uji saponin. No 1 2 3 Tabel II. Hasil pengamatan uji tabung terhadap serbuk umbi binahong Pengujian Pengamatan Hasil Uji pendahuluan Larutan hasil penyaringan Warna merah Filtrat + larutan KOH Warna merah semakin intensif Uji alkaloid Filtrat A1 + dragendorf Terbentuk endapan coklat + Filtrat A2 + mayer Terbentuk endapan coklat + Tidak terbentuk endapan - Uji antrakinon Filtrat + KOH 0, 5 N 4 + Uji polifenol PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 42 5 Filtrat + FeCl3 Larutan berwarna hijau biru + Filtrat + etanol 80% Larutan berwarna hijau biru + Tidak terdapat endapan + Pembentukkan buih Terbentuk buih + Filtrat dimasukkan dalam kapiler Tinggi cairan uji lebih rendah + Uji tanin Filtrat + NaCl 2% + gelatin 1% 6 Uji saponin daripada tinggi air suling a. Uji pendahuluan Uji pendahuluan ini berfungsi untuk mengetahui apakah senyawa tersebut mengandung kromofor seperti flavonoid antrakinon, dll atau gugus hidrofilik seperti gula, asam, fenolat, dsb. Dari hasil penelitian, didapat hasil positif karena larutan berwarna merah tua dan warna menjadi lebih intensif ketika ditambahkan beberapa tetes kalium hidroksida. Kesimpulan sementara yang diperoleh bahwa serbuk diduga mengandung senyawa yang mempunyai gugus kromofor dan gugus hidrofilik. b. Uji alkaloida. Alkaloid adalah senyawa yang mengandung atom N dan kebanyakan bersifat basa. Untuk identifikasi alkaloid dapat dilakukan dengan cara reaksi pengendapan dan reaksi warna yaitu dengan cara penambahan 2 gram serbuk binahong dengan HCl. Penambahan HCl ini bertujuan untuk mengubah alkaloid yang bersifat basa menjadi garam alkaloid, agar bisa larut dalam air. Untuk mempercepat reaksi pembentukan garam alkaloid, maka dapat dilakukan dengan pemanasan di atas penangas air. Setelah dingin, disaring dan kemudian direaksikan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 43 dengan larutan meyer. Reaksi positif terjadi jika terbentuk endapan menggumpal. Dari hasil penelitian diperoleh bahwa terdapat endapan yang berarti di dalam sampel dimungkinkan terdapat alkaloid. c. Uji antrakinon Pada uji ini, serbuk dididihkan selama 2 menit dengan KOH dan larutan hidrogen peroksida, kemudian disaring dengan kapas. Pemanasan dengan kalium hidroksida bertujuan untuk menghidrolisis glikosida antrakinon menjadi aglikonnya (antrakinon). Sedangkan larutan hidrogen peroksida berfungsi untuk mengoksidasi bentuk tereduksi dari antrakinon yaitu antron, oksantron, dan diantron menjadi antrakinon. Penambahan asam asetat sampai pH 5 dan toluen bertujuan untuk memisahkan lapisan air (basa) dengan fase pelarut organik. Setelah dingin, disaring kemudian filtrat ditambah asam asetat glasial yang berfungsi untuk menghidrolisis antrakinon menjadi komponen gula dan aglikonnya. Hasil hidrolisis ini akan diekstraksi dalam pelarut toluene yang bersifat non polar. Jika terjadi warna merah pada lapisan air, menunjukkan adanya antrakinon. Dari penelitian, tidak terjadi warna merah. Hal ini berarti sampel tidak mengandung antrakinon. d. Uji polifenol Polifenol merupakan senyawa yang larut di air panas. Oleh karena itu untuk melarutkannya serbuk tumbuhan dipanaskan dengan air selama 10 menit dalam penangas air mendidih. Penambahan pereaksi besi (III) klorida, mengindikasikan adanya gugus fenol. Reaksi senyawa polifenol PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 44 dengan FeCl3 akan membentuk kompleks warna. Terjadinya warna hijau – biru menunjukkan adanya polifenol. Reaksinya adalah sebagai berikut: HOOC COOH OH HO COOH OH O OH 6 FeCl3 HO HOOC Fe 3+ O OH OH OH HO HO HO HO OH COOH 3 HCl OH HO O OH OHHO : ikatan van der wals : ikatan kovalen HOOC COOH Gambar 2. Reaksi antara senyawa fenolik dengan FeCl3 Dari hasil penelitian, terjadi warna hijau kebiru-biruan. Jadi kemungkinan terdapat senyawa polifenol dalam serbuk. e. Uji tanin (zat samak) Serbuk tumbuhan dilarutkan dalam air dan diakukan pemanasan untuk mempercepat reaksi. Penambahkan larutan natrium klorida 2 % dimaksudkan untuk membentuk endapan garam Na asam dari tanin. Reaksinya adalah sebagai berikut : O C OH O C O Na NaCl HCl OH HO HO OH OH OH Gambar 3. reaksi antara NaCl dengan senyawa fenolik Sedangkan penambahan gelatin dimaksudkan untuk mempercepat pengendapan tanin yang terlarut dalam air. Gelatin merupakan senyawa PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 45 yang bisa menyerap air, sehingga air akan tertarik oleh gelatin, selain itu gelatin mengandung protein dimana tanin dapat mengendapkan protein dan NaCl akan berekasi semakin cepat dengan tanin untuk membentuk endapan garam Na asam. Hasil penelitian dari serbuk binahong adalah positif yaitu terjadi endapan. f. Uji saponin Pada uji saponin, terbentuk buih setelah ditambah dengan air dan digojok kuat selama 30 detik setinggi 1,8 cm. Buih yang terbentuk ini akan tahan dalam jangka waktu relatif lama. Hal ini dibuktikan dengan buih akan tetap ada setelah dibiarkan selama 30 menit. Buih yang terbentuk disebabkan karena terbentuknya sabun pada saat penggojogan dengan air suling. Saponin merupakan suatu senyawa yang mempunyai gugus hidrofob dan gugus hidrofil. Sifat ini menyerupai surfaktan / sabun yang dapat menurunkan tegangan permukaan antara udara/gas dengan air yang berupa emulsi gas dalam air (buih). Sedangkan cara lain untuk mengidentifikasi adanya saponin yaitu dengan menggunakan pipa kapiler. Pada identifikasi dengan pipa kapiler, larutan serbuk umbi binahong yang sudah disaring, dimasukkan ke dalam pipa kepiler penuh-penuh dalam posisi tegak, kemudian cairan dibiarkan mengalir bebas. Jika serbuk mengandung saponin, maka cairan serbuk umbi binahong yang tertinggal dalam kapiler akan lebih rendah dari pada tinggi air suling yang tertinggal. Uji ini menandakan bahwa dengan adanya saponin, partikel dengan ukuran tertentu akan dapat lolos dari filter dengan pori yang cukup kecil. Hal ini disebabkan karena saponin dapat menaikkan permeabilitas membran. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 46 2. Uji kualitatif secara Kromatografi Lapis Tipis Identifikasi kualitatif ekstrak etanol umbi binahong dilakukan dengan menggunakan Kromatografi Lapis Tipis (KLT). Analisis dengan KLT mempunyai beberapa keuntungan yaitu penanganannya sederhana, selain itu cuplikan dan pelarut yang digunakan sedikit. a. Uji KLT flavonoid Fase diam yang digunakan yaitu selulosa gel dan fase gerak yang digunakan adalah butanol: asam asetat : air (4:1:5). Selulosa digunakan sebagai fase diam, karena jika digunakan silika gel, maka akan terbentuk kompleks khelat antara salah satu gugus yang terdapat pada flavonoid dengan gypsum (CaSO4). Kompleks khelat yang terjadi tersebut terikat kuat pada fase diam jadi dapat menyebabkan tidak terjadinya elusi. Reaksinya adalah sebagai berikut: O OH HO O OH o O 2 CaSO4 O gula OH Ca O O O o gula o Ca Gambar 4. Reaksi flavonoid dengan CaSO4 membentuk kompleks khelat Pembanding yang digunakan adalah rutin. Penotolan bercak dan pembanding pada fase diam dilakukan dengan mikropipet 5µl. Sampel dan pembanding ditotolkan pada lempeng KLT kemudian dielusi pada batas tertentu (10 cm). Elusi dilakukan sepanjang 10 cm di dalam bejana yang sudah jenuh. Bejana yang berisi larutan pengembang harus dijenuhkan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 47 terlebih dahulu agar proses elusi dapat berlangsung dengan baik. Selain itu juga untuk menghindari terjadinya pengekoran pada bercak. Tabel III. Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254 dan fase gerak butanol: asam asetat glacial: air (4:1:5) dan pembanding rutin 0,05% untuk analisis flavonoid. Bercak No Deteksi UV 254 UV 365 Uap amoniak Rf Warna Rf Warna Rf Warna 1 0, 23 Kuning - - 0, 23 Kuning 2 0, 80 Kuning 0, 80 Ungu tua 0, 80 Kuning Pembanding 1 0, 64 Kuning 0,64 Ungu tua 0, 64 Kuning Sample Dilihat dari hasil yang dapat dilihat dari tabel, maka dapat disimpulkan sampel mengandung flavonoid. Hal ini terbukti dengan adanya bercak dengan warna bercak yang mirip antara sampel no 2 dengan bercak pembanding. Jika dilihat dari Rf nya, kemungkinan yang terjadi adalah flavonoid yang terdapat pada sampel berbeda dengan pembanding. Flavonoid mempunyai gugus auksokrom OH yang terikat pada atom karbon 4’ pada cincin B. Selain itu flavonoid juga mempunyai gugus O yang bersifat elektrofil (senang menarik elektron). Dengan adanya basa (NH3), OH akan mudah melepaskan H yang kemudian diikat oleh NH3, setelah itu terjadi reaksi penyusunan kembali untuk menstabilkan struktur. Penyusunan kembali ini menyebabkan O akan memiliki pasangan elektron tambahan. Dengan adanya tambahan elektron tersebut, maka energi yang diperlukan untuk mempromosikan elektronnya semakin kecil, sehingga akan terjadi pergeseran panjang gelombang menuju panjang gelombang yang lebih besar. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 48 Reaksinya sebagai berikut: OH O O HO OH O OH NH3 HO O OH gula O O OH NH4+ gula o Gambar 5. Reaksi antara flavonoid dengan NH3 Warna kuning yang terjadi, dapat dengan cepat hilang karena di udara terdapat banyak uap air (H-OH) sehingga H dari uap air akan berikatan dengan O yang kelebihan elektron, sehingga struktur senyawa tersebut akan kembali seperti semula. Oleh karena itu warna yang terbentuk merupakan warna yang reversibel. b. Uji KLT alkaloid Fase diam yang digunakan yaitu silika gel GF 254. Silika gel GF 254 merupakan fase diam yang bersifat polar. Silika gel merupakan adsorben yang paling banyak digunakan dalam Kromatografi Lapis Tipis (KLT) yang berupa silika gel yang dicampur perekat CaSO4 dan indikator floresensi. Sedangkan fase gerak yang digunakan adalah etil asetat : metanol : air (70:20:10). Sebagai pembanding digunakan skopolamin. Skopolamin merupakan alkaloid tropan. Sampel dan pembanding ditotolkan bersamasama pada lempeng KLT, kemudian dielusi pada batas tertentu (10 cm). Setelah itu dideteksi dibawah sinar UV 254 nm dan UV 365 nm, kemudian dideteksi dengan pereaksi semprot Dragendorf. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 49 Tabel IV. Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak etil asetat : methanol : air (70:20:10)dan pembanding skopolamin untuk analisis alkaloid. Bercak No Deteksi UV 254 UV 365 Dragendorf Rf Warna Rf Warna Rf Warna 1 0, 07 Ungu 0, 07 Ungu - - 2 0, 25 Meredam ungu 0, 25 Ungu - - 3 0, 53 Meredam ungu - - - - Pembanding 1 0, 52 Meredam ungu - - 0, 52 Orange Sampel Dari hasil tersebut dapat diketahui bahwa sampel tidak mengandung alkaloid. Hal ini dikarenakan baik warna dan Rf sampel tidak ada yang menyerupai warna dan Rf dari pembanding. Sampel mempunyai tiga bercak yang terlihat di bawah lampu UV 254 yaitu dengan Rf 0,07 bercak berwarna ungu, Rf 0,25 bercak berwarna ungu dan meredam flouroresensi dari silika, dan terakhir Rf 0,53 juga meredam flouroresensi berwarna ungu. Di bawah lampu UV 365, hanya terlihat dua bercak sampel yaitu bercak Rf 0,70 yang berwarna ungu dan bercak Rf 0,25 berwarna ungu. Ketika di semprot dengan pereaksi Dragendorf, tidak terlihat bercak. Sedangkan pembanding, hanya tampak satu bercak dengan Rf 0,52 berwarna ungu dan meredam flouresensi pada UV 254, dan akan nampak warna orange ketika disemprot dengan pereaksi Dragendorf. Hal ini menggambarkan beberapa senyawa organik non nitrogen berikatan secara konjugasi dengan keton atau aldehid atau gugus lakton akan berekasi secara khusus dengan alkaloid. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 50 Pada uji tabung yang sudah dilakukan, diperoleh hasil positif untuk uji alkaloid padahal setelah di uji dengan KLT, ternyata hasilnya negatif. Kemungkinan besar hal ini disebabkan karena alkaloid yang terdapat dalam ekstrak etanol umbi binahong tersebut merupakan alkaloid yang berada dalam bentuk basa. Alkaloid dalam bentuk basa akan larut pada pelarut yang non polar dan etanol kurang polar untuk dapat menyari alkaloid dengan baik. c. Uji KLT senyawa fenolik. Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak yang digunakan adalah toluene: etil asetat: metanol (70:20:10). Pembanding yang digunakan yaitu eugenol 1%. Sampel dan pembanding ditotolkan pada lempeng KLT, kemudian dielusi pada batas tertentu (10 cm) dan dikeringkan. Tabel V. Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak toluen, etil asetat, metanol (70:20:10) dan pembanding eugenol untuk analisis senyawa fenolik Bercak No Deteksi UV 254 UV 365 FeCl3 Rf Warna Rf Warna Rf Warna 1 0, 04 Ungu muda - - - - 2 0, 73 Ungu - - 0, 73 Ungu Pembanding 1 0, 73 Ungu - - 0, 73 Ungu Sampel Dari hasil yang terlihat pada tabel tersebut, dapat disimpulkan bahwa sampel mengandung senyawa fenolik. Hal ini terbukti dengan adanya Rf sampel yang mendekati Rf pembanding yaitu 0,73. Selain itu warna dari sampel dan pembandingnya juga sama. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 51 Hasil positif tersebut, dipertegas dengan terbentuknya warna ungu pada bercak yang disemprot dengan FeCl3. warna tersebut terjadi karena reaksi antara senyawa fenolik dengan FeCl3. d. Uji tanin Uji KLT tanin menggunakan fase diam silika gel GF 254 dan fase gerak etil asetat : metanol : air (100 : 13,5 : 10). Sampel dan pembanding yang berupa asam tanat 1% ditotolkan pada lempeng KLT kemudian dielusi pada batas tertentu (10 cm). Setelah itu dideteksi dengan UV 254 nm, UV 365 nm dan FeCl3 Tabel VI. Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak etil asetat : metanol : air (100 : 13,5 : 10)dan pembanding asam tanat untuk analisis tanin. Bercak No Deteksi UV 254 UV 365 FeCl3 Rf Warna Rf Warna Rf Warna 1 0,48 ungu 0,48 ungu 0, 48 ungu Pembanding 1 0,50 ungu 0,50 ungu 0, 50 ungu Sample Dari hasil yang terlihat, dapat disimpulkan sampel mengandung tanin. Hasil positif tersebut ditunjukkan dengan adanya perubahan warna bercak ketika disemprot dengan FeCl3. Hal ini terjadi karena adanya reaksi antara FeCl3 dengan gugus fenolik yang terdapat pada tanin. Perbedaan nilai Rf diduga karena adanya perbedaan jenis dari tanin. e. Uji KLT saponin Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak yang digunakan adalah toluen : etil asetat (93:7) yang bersifat lebih non polar dibandingkan dengan silika. Dengan perbedaan kepolaran dari fase PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 52 diam dan fase gerak ini, diharapkan senyawa uji dapat terelusi dengan baik. Saponin merupakan senyawa yang bersifat polar dalam bentuk glikosida, sedangkan dalam bentuk aglikonya saponin semipolar dengan demikian akan terikat dengan fase geraknya. Pembanding yang digunakan adalah Glycyrrhiza Radix 1% . Setelah proses elusi, langkah selanjutnya adalah deteksi dengan menggunakan lampu UV 254 , lampu UV 365 dan anisaldehid-asam sulfat. Hasilnya adalah sebagai berikut: Tabel VII. Nilai Rf dan warna bercak pada uji KLT dengan fase diam silika gel GF 254, fase gerak toluen : etil asetat (93:7) dan pembanding Glycyrrhiza Radix untuk analisis saponin. Bercak No Deteksi UV 254 UV 365 Vanilin asam sulfat Sample 1 Rf Warna Rf 0, 02 Meredam - Warna - Rf 0, 02 Warna Ungu muda 2 0,14 Meredam 0,14 Berfloresensi 0,14 Ungu 0, 01 Orange 0, 05 Merah 0,13 Ungu - - ungu Pembanding 1 0,01 Meredam 0, 01 Berfloresensi Ungu 2 0,05 Meredam 0, 05 Berfloresensi Ungu 3 0,13 Meredam 0,13 Berfloresensi ungu 4 - - 0, 20 Berfloresensi kuning PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 53 Dari hasil yang diperoleh, maka dapat disimpulkan bahwa sampel mengandung saponin. Warna dari bercak sampel sama dengan warna bercak pembanding. Namun ada sedikit perbedaan pada harga Rfsampel dan pembanding. Rf sampel 0,14 sedangkan Rf pembanding 0,13. Hal ini dimungkinkan sampel dan pembanding mengandung senyawa yang sama namun beda golongannya. Secara keseluruhan perbedaan nilai Rf disebabkan karena adanya perbedaan kepolaran dari senyawa-senyawa yang terkandung dalam sampel. Sehingga terdapat perbedaan afinitas ikatan antara fase gerak dan senyawa yang terkandung dalam sampel. E. Uji potensi antibakteri ekstrak etanol umbi binahong terhadap Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 Pengujian potensi antibakteri ekstrak etanol umbi binahong dilakukan dengan metode difusi paperdisk. Dipilih metode ini karena mempunyai keuntungan antara lain secara teknis, metode ini sederhana dan mudah dilakukan, tidak membutuhkan banyak cawan petri dan tidak membutuhkan alat khusus. Selain itu dapat diketahui luas zona hambat senyawa yang diuji terhadap bakteri. Sebelum dilakukan pengujian, bakteri uji yang digunakan yaitu Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853, dibuat suspensi yang kemudian disetarakan terlebih dahulu dengan Mc. Farland II yang mempunyai kekeruhan 6x108 CFU/ml. Penyetaraan ini PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 54 berfungsi untuk reprodusibilitas percobaan. Sehingga apabila dilakukan replikasi dalam percobaan, dapat diasumsikan jumlah bakteri per satuan yang digunakan selalu sama. Setelah disetarakan dengan standard Mc. Farland II, bakteri uji dibiakkan secara spread plate yaitu dengan cara bakteri disebar di permukaan media NA yang sudah memadat. Pembiakan bakteri ini disesuaikan dengan sifat Staphylococcus aureus dan Pseudomonas aeruginosa yang merupakan bakteri fakultatif aerob, dimana dalam pertumbuhannya, dibutuhkan ketersediaan oksigen yang cukup. Selain itu, disesuaikan pula dengan kondisi percobaan yang sesungguhnya, dimana infeksi pada luka biasa terjadi di permukaan kulit yang ketersediaan oksigennya cukup. Paperdisk yang digunakan mempunyai diameter 6 mm. Pada tiap paperdisk diteteskan ekstrak etanol umbi binahong dengan empat konsentrasi yang berbeda, kontrol positif, dan kontrol negatif. Konsentrasi ekstrak etanol yang digunakan yaitu 25%, 50%, 75%, 100%, sedangkan kontrol positifnya amoksisilin 0,03 g/ml, dan kontrol negatif yang digunakan yaitu DMSO yang merupakan pelarut ekstrak etanol. Amoksisilin merupakan suatu antibiotik golongan beta laktam derifat penisilin dengan spektrum luas. Amoksisilin mempunyai aktivitas bakterisida terhadap bakteri gram positif maupun gram negatif dengan mekanisme menghambat pembentukan atau sintesis dinding sel mikroba (Surini, 2006). DMSO merupakan pelarut yang bersifat nonpolar tetapi diindikasikan tidak mempunyai daya hambat terhadap pertumbuhan bakteri. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 55 Dengan menggunakan paperdisk, maka senyawa uji akan berdifusi ke dalam media dan menghambat pertumbuhan dan bahkan membunuh bakteri uji. Penghambatan pertumbuhan bakteri uji ini dapat dilihat dari zona hambat yang terbentuk setelah inkubasi selama 24 jam. Setelah diinkubasi selama 24 jam, hasil yang diperoleh untuk uji terhadap Staphylococcus aureus ATCC 25923 yaitu kontrol negatif tidak menunjukkan zona hambat, kontrol positif menunjukkan adanya zona jernih disekitar paper disk dengan rata-rata diameternya dari tiga replikasi yaitu 3,1 cm sedangkan semua variasi konsentrasi ekstrak tidak menunjukkan adanya zona hambat. Hal ini berarti tidak menunjukkan adanya penghambatan terhadap pertumbuhan bakteri uji yaitu Staphylococcus aureus ATCC 25923. Dalam penelitian ini ekstrak tersebut tidak menunjukkan potensi. Table VIII. Diameter zona hambat ekstrak etanol umbi binahong terhadap Staphylococcus aureus ATCC 25923 Senyawa Diameter zona hambat (cm) Replikasi I Replikasi II Replikasi III 3,00 3,25 3,00 DMSO - - - Konsentrasi 100% - - - Konsentrasi 75% - - - Konsentrasi 50% - - - Konsentrasi 25% - - - Amoxisilin Begitu pula pada uji terhadap bakteri uji Pseudomonas aeruginosa ATCC 27853. kontrol negatif tidak menunjukkan zona hambat, kontrol positif menunjukkan adanya zona jernih disekitar paper disk dengan rata-rata PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 56 diameter pada replikasi yaitu 2,2 cm sedangkan semua variasi konsentrasi ekstrak tidak menunjukkan adanya zona hambat. Table IX. Diameter zona hambat ekstrak etanol umbi binahong terhadap Pseudomonas aeruginosa ATCC 27853 Senyawa Diameter zona hambat (cm) Replikasi I Amoxisilin Replikasi II Replikasi III 2,20 2,30 2,20 DMSO - - - Konsentrasi 100% - - - Konsentrasi 75% - - - Konsentrasi 50% - - - Konsentrasi 25% - - - Hal ini berarti ekstrak etanol umbi binahong tidak menunjukkan adanya penghambatan terhadap pertumbuhan bakteri uji yaitu Pseudomonas aeruginosa ATCC 27853. Dalam penelitian ini ekstrak tersebut tidak berpotensi untuk dikembangkan menjadi antibakteri. Dari uji difusi yang dilakukan, dapat diketahui pula bahwa kedua bakteri baik Staphylococcus aureus maupun Pseudomonas aeruginosa tidak resisten terhadap amoksisilin. Menurut Anonim (1993), untuk masing-masing antibiotik dan jenis bakterinya, mempunyai diameter yang berbeda-beda, untuk dinilai sebagai antibiotik yang sensitif (poten dalam terapi). Amoksisilin dinyatakan sensitif bila diameter zona hambat terhadap Staphylococcus aureus yang terbentuk yaitu lebih dari 2,9 cm sedangkan terhadap Pseudomonas aeruginosa, zona hambat yang terbentuk sebesar 1,5 cm lebih. Dalam PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 57 penelitian ini diameter zona hambat terhadap Staphylococcus aureus adalah 3,1 cm sedangkan pada Pseudomonas aeruginosa sebesar 2,2 cm. Jika ditinjau ulang pada uji KLT, diketahui bahwa ekstrak etanol umbi binahong mengandung senyawa flavonoid, fenolik, tanin, dan saponin yang merupakan senyawa antibakteri. Namun ketika diuji, ternyata ekstrak etanol tersebut tidak mempunyai potensi untuk menghambat pertumbuhan bakteri uji. Ekstrak etanol umbi binahong itu sendiri berukuran yang besar. Hal ini akan menyulitkan senyawa uji untuk dapat masuk ke dalam sel bakteri tersebut, sehingga tidak mampu untuk menghambat pertumbuhan bakteri. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB V KESIMPULAN DAN SARAN A. Kesimpulan 1. Ekstrak etanol umbi binahong tidak mempunyai potensi antibakteri terhadap Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853. 2. Berdasarkan uji tabung yang dilakukan, serbuk umbi binahong diduga mengandung flavonoid, alkaloid, polifenol, tanin, dan saponin. Sedangkan berdasarkan uji KLT yang dilakukan, ekstrak etanol umbi binahong diketahui mengandung flavonoid, polifenol, tanin, dan saponin B. Saran 1. Perlu diteliti lebih lanjut mengenai kandungan kimia dari umbi binahong secara kuantitatif yaitu dengan metode KLT preparatif sehingga dapat diketahui berapa kadar senyawa-senyawa yang terkandung di dalam umbi binahong. 2. Perlu diteliti mengenai potensi antibakteri dari batang, bunga, atau bagian lainnya dari binahong. 58 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 59 DAFTAR PUSTAKA Anief, Moh. 2000. Ilmu Meracik Obat teori dan praktik, hal 33-34, Gadjah Mada University Press, Yogyakarta Anonim, 1986, Sediaan Galenik, 1, 5-6, 8, 10-11, 16-17, 25-26, Departemen Kesehatan RI, Jakarta Anonim, 1993. Dasar-Dasar Pemeriksaan Mikrobiologi. Hal 115-122. Fakultas Kedokteran UGM Bagian Mikrobiologi, UGM Press, Jogja Anonim, 1994. Farmakope Indonesia Edisi IV, 1110-1118, Departemen Kesehatan RI, Jakarta Anonim, 1995. Farmakologi dan Terapi, 571-583. Bagian Farmakologi Fakultas Farmasi Universitas Indonesia, Jakarta Anonim, 1996. Staphylococcus aureus .http://www.itis.gov/servlet/singleRpt/ RefRpt?search_topic=all&searchvalue=Staphylococcusaureus .Diakses tanggal 27 Februari 2007 Anonim, 2000a. Parameter Standar Umum Departermen Kesehatan RI, Jakarta Ekstrak Tumbuhan Obat. Anonim, 2000b. Plants For A Future: Database Search Results. http://www.pfaf.ogr/index.html. Diakses pada tanggal 27 Februari 2007 Anonim. 2004. PIW-result-Anredera cordifolia. index.php. Diakses tanggal 27 Februari 2007 http://permaculture.info/ Anonim, 2006a, Koran Merapi: Topik Klinik Alternatif Binahong http://www.koranmerapi.com/article.php?sid=8027). Diakses tanggal 27 Februari 2007 Anonim, 2006b. http://www.liberherbarum.com/pn5494.HTM. Diakses pada 29 Maret 2006 Backer, C.A, 1968. Flora of Java .Volume I. Hal. 240. Noordhoff, Groningen, the Netherlands Duke, J., 1992. Phytochemical and Ethnobotanical Database. http://www.arsgrin. gov. diakses 27 Januari 2007. Dwijoseputra, D., 1991. Dasar-Dasar Mikrobiologi. 41-55, Djambatan, Surabaya PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 60 Farnsworth, N.R., Phytochemical Screening. Hal 11-19, 35-40, 61-63. Departement of Pharmacognosy and Pharmacology. Colk of Pharmacy, University od Illinois of the Medical Center, Chicago Gritter, R.J., Bobbit, M. J.,Schwarting, A. E. 1991. Pengantar Kromatografi. Edisi II, 107-155. Penerbit ITB, Bandung Gunawan, Didik., Mulyani, Sri, 2004. Ilmu Obat Alam (Farmakognosi) jilid 1. Hal 87-90. Penebar Swadaya . Jakarta Harvey, B., Simon, M.D., 2003. Scientific American Medicine Volume 2. Edisi 2003. Hal 1397-1405. Web MD Inc : New York, USA. Hendriyana, Yulius 2004. Antibiotik Amoksisilin. http://yulian.firdaus.or.id/ 2004/12/08/antibiotik-amoksisilin Diakses tanggal 22 April 2007 Hugo, W.B dan Russel, A.D. 1987. Pharmaceutical Microbiology. 285-286. Blakwell Sientific Publication, Oxford Huoghton, P and Raman, A, 1998. Laboratory Handbook for The Fractination of Natural Ekstract .22-52. St. Edmundsburry Press : Sulffolk, Great Britain Jawetz,E. Melnick, J.L, Adelberg, E.A., 1996. Profesional Microbiology. Diterjemahkan oleh Nugroho, E dan Maulani,R.F, Penerbit Buku Kedokteran EGC, Jakarta Meyer, J. J. M, 2004. Antimicrobial activity, toxicity and the isolation of a bioactive compound from plants used to treat sexually transmitted disease. http://www.elsevier.com/locate/jethpharm. Diakses pada tanggal 27 Februari 2007 Moura-Letts, G., Marcalo,A., 2006. In vivo Wound Healing Activity of Oleanolic Acid Derived from the Acid Hydrolysis of Anredera diffusa. Journal of Natural Products, 2006, vol. 69, No. 6, hal 978-979. Kentucky. Naim, Rochman, 2006. Kulit Jadi Pertahanan Tubuh Pertama. http://www.kompas.com/kompas-cetak/0404/28/ilpeng/994047.htm. Diakses tanggal 27 Februari 2007 Pelzar, M.J., dan Chan E.C.S, 1986, Element of Microbiology. 299-303. Diterjemahkan oleh Hadioetomo, Imas, Tjitrosomo dan Angka. UI Press, Jakarta Robinson, Trevor.1991. Kandungan Organik Tumbuhan Tinggi. 156-158. Penerjemah: prof. Dr. Kosasih Padmawinata, FMIPA, Penerbit ITB, Bandung PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 61 Sato, T., Nagata, M., Engle, L.M., 2005. Evaluation of Antioxidant Activity of Indigenous Vegetables from South and Southeast Asia. http://ss.jircas.affrc.go.jp/english/publication/highlights/2002/pdf/200205.pdf . Diakses tanggal 16 Mei 2007 Sulasmono, 1995. Kimia Analisis Intrumen II. 23. Fakultas Farmasi USD, Yogyakarta Sumaryono , 2002, Prosiding Seminar Nasional Tumbuhan Obat Indonesia XXI, 3-7. Fak Farmasi Universitas Surabaya, Surabaya Suriawiria, U.1986. Pengantar Mikrobiologi Umum. 65-68, Penerbit Angkasa, Bandung Surini, silvia, 2006. Antiboitik si “Peluru ajaib” (bagian pertama) http://www.beritaiptek.com/zberita-beritaiptek-2006-01-10antibiotik,si’peluruajaib(bagianpertama).shtml. Diakses pada tanggal 22 April 2007 Stahl, Egon.1969. Thin Layer Chromatography A Laboratory Handbook. 6-7, 5259, 245-247, 421-425, 687-693, 705. translate By M.R.F Asworth. Toppan Printing, Singapore Trease and Evans, 2002. Pharmacognosy. 15th edition. Hal 214-227. University of Nothingham, UK Tjitrosoepomo, Gembong, 1985. Morfologi Tumbuhan. 104-105. Gadjah Mada University Press, Yogyakarta. Vivian, Gabrielle., Fletcher, Alan. 2005. Anredera cordifolia (vine,climber). http://issg.appfa.aucklan.ac.nz/database/species/distribution.asp?si=776&f r=1&sts=. Diakses tanggal 6 Maret 2006. Wagner, H. Bladt, S., and Zgainski, C.M., 1984. Plant Drug Analysis : a Thin Layer Cromatography Atlas, Springer-Verlag, Tokyo PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 59 Lampiran 1. Surat Keterangan Selesai Melakukan Determinasi dari Balai Penelitian Tanaman Obat PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 60 Lampiran 2. Determinasi Tanaman Binahong (Anredera cordifolia (Ten.) Steenis) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 61 Lampiran 3. Foto Tanaman Binahong (Anredera cordifolia (Ten.) Steenis) dan foto serbuk Foto Tanaman Binahong (Anredera cordifolia (Ten.) Steenis Foto Serbuk Umbi Binahong (Anredera cordifolia (Ten.) Steenis PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 62 Lampiran 4. Foto Hasil Uji Pendahuluan Serbuk Umbi Binahong dengan Uji Tabung PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 63 Lampiran 5. Foto Hasil Uji Alkaloid Serbuk Umbi Binahong dengan Uji Tabung Keterangan : Foto A1 : Larutan Uji + Pereaksi Dragendorff A2 : Larutan Uji + Pereaksi Meyer PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 64 Lampiran 6. Foto Hasil Uji Antrakinon Serbuk Umbi Binahong dengan Uji Tabung Keterangan : A. Lapisan atas yang dipisahkan dari larutan B. Lapisan bawah + KOH 0,5 N PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 65 Lampiran 7. Foto Hasil Uji Polifenol Serbuk Umbi Binahong dengan Uji Tabung Keterangan : A. Serbuk + air (dipanaskan di atas penangas air + FeCl3) B. Serbuk + etanol 80% (dipanaskan di atas penangas air + FeCl3) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 66 Lampiran 8. Foto Hasil Uji Tanin Serbuk Umbi Binahong dengan Uji Tabung Lampiran 9. Foto Hasil Uji Saponin Serbuk Umbi Binahong dengan Uji Tabung PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 67 Lampiran 10. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan Deteksi UV 254, UV 365, dan uap amoniak pada Analisis Flavonoid Keterangan : I : Deteksi UV 254 a. Sampel b. Pembanding Rutin 0,05 % II : Deteksi UV 365 a. Sampel b. Pembanding Rutin 0,05 % III : Deteksi Uap Amoniak a. Sampel b. Pembanding Rutin 0,05 % PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 68 Lampiran 11. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan deteksi UV 254, UV 365, pereaksi Dragendorf pada Analisis Alkaloid Keterangan : I : Deteksi UV 254 a. Sampel b. Pembanding Skopolamin (1%) II : Deteksi UV 365 a. Sampel b. Pembanding Skopolamin (1%) III: Deteksi pereaksi Dragendorf a. Sampel b. Pembanding Skopolamin (1%) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 69 Lampiran 12. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan deteksi UV 254, UV 365, dan pereaksi FeCl3 pada Analisis Polifenol Keterangan : I : Deteksi UV 254 a. Sampel b. Pembanding Eugenol 1% II : Deteksi UV 365 a. Sampel b. Pembanding Eugenol 1% III: Deteksi pereaksi FeCl3 a. Sampel b. Pembanding Eugenol 1% PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 70 Lampiran 13. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan deteksi UV 254, UV 365, dan pereaksi FeCl3 pada Analisis Tanin Keterangan : I : Deteksi UV 254 a. Sampel b. Pembanding Asam tanat 1% II : Deteksi UV 365 a. Sampel b. Pembanding Asam tanat1% III : Deteksi pereaksi FeCl3 a. Sampel b. Pembanding Asam tanat1% PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 71 Lampiran 14. Foto Hasil KLT Ekstrak Etanol Umbi Binahong dengan deteksi UV 254, UV 365, dan pereaksi Anisaldehid Asam Sulfat pada Analisis Saponin Keterangan : I : Deteksi UV 254 a. Sampel b. Pembanding Glizerizae Radix 1% II : Deteksi UV 365 a. Sampel b. Pembanding Glizerizae Radix 1% III : Deteksi pereaksi Anisaldehid Asam Sulfat a. Sampel b. Pembanding Glizerizae Radix 1% PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 72 Lampiran 15. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Umbi Binahong terhadap Staphylococcus aureus ATCC 25923 dengan Metode Difusi paperdisk Keterangan : A: Kontrol Positif (Amoksisilin 0,03 %) B: Kontrol Negatif (DMSO) C: Ekstrak etanol umbi binahong 100% D: Ekstrak etanol umbi binahong 75% E: Ekstrak etanol umbi binahong 50% F: Ekstrak etanol umbi binahong 25% PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 73 Lampiran 16. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Umbi Binahong terhadap Pseudomonas aeruginosa ATCC 27853 dengan Metode Difusi Paperdisk Keterangan : A: Kontrol Negatif (DMSO) B: Kontrol Positif (Amoksisilin 0,03 %) C: Ekstrak etanol umbi binahong 100% D: Ekstrak etanol umbi binahong 75% E: Ekstrak etanol umbi binahong 50% F: Ekstrak etanol umbi binahong 25% PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 74 Lampiran 17. Foto Kontrol Pertumbuhan Staphylococcus aureus ATCC 25923 dan Kontrol pertumbuhan Pseudomonas aeruginosa ATCC 27853 Foto Kontrol Pertumbuhan Staphylococcus aureus ATCC 25923 Foto kontrol pertumbuhan Pseudomonas aeruginosa ATCC 27853 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 75 BIOGRAFI PENULIS Skripsi ini disusun oleh Martina Herlianawati. Anak sulung dari dua bersaudara yang lahir di Klaten, 13 Juli 1985 dari pasangan Bapak FX. Untung Puryanto dan Tarsicia Sri Setyani. Penulis mulai mengenyam pendidikan di TK. St Maria Banyutemumpang (1989-1991), kemudian melanjutkan ke SD Kanisius Banyutemumpang (1991-1997), dan SLTPK St. Maria Banyutemumpang (1997-2000). Setelah itu penulis dibimbing dan didampingi oleh para pendamping dan pamong asrama di SMU PL. Van Lith Muntilan. Tiga tahun kemudian penulis lulus dan melanjutkan kuliah di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.