stoikiometri
advertisement

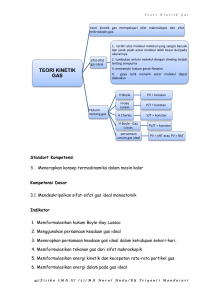
Stoikiometri OLEH Lie Miah 1 X STANDAR KOMPETENSI • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI Kimia dan penerapannya dalam • KESULITAN BELAJAR SISWA perhitungan kimia (Stoikiometri) • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Memahami hukum-hukum dasar 2 X KOMPETENSI DASAR • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Mendeskripsikan tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia 3 X INDIKATOR • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Setelah pembelajaran ini siswa mampu : 1. Menyetarakan reaksi sederhana dengan diberikan nama-nama zat yang terlibat dalam reaksi atau sebaliknya. 2. Membuktikan hukum lavoiser melalui percobaan. 3. Mendiskusikan data percobaan pada senyawa untuk membuktikan berlakunya hukum Dalton. 4 INDIKATOR (lanjutan) • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN 4. Menggunakan data percobaan untuk membuktikan hukum Gay Lussac. 5. Menggunakan data percobaan untuk membuktikan hukumhukum avogadro. 6.Mengkonversikan jumlah mol dengan jumlah partikel, massa, dan volum zat 5 INDIKATOR (lanjutan) • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN 7.Menentukan rumus empiris dan rumus molekul. 8. Menentukan kadar zat dalam suatu senyawa. 9.Menentukan pereaksi pembatas dalam suatu reaksi. 6 X KARAKTERISTIK MATERI • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Materi stoikiometri ini adalah materi bersifat riil dan perlu menggabungkan antara pemahaman konsep dan aplikasi. Materi ini membutuhkan kemampuan matematika yang baik Materi ini mmbutuhkan pemahaman konsep yang baik dan nalar logika yang tinggi dalam penyelesaian soal-soalnya. 7 X KESULITAN BELAJAR SISWA • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Siswa sulit memahami konsep yang mengakibatkan tidak bisa mengapikasikannya ketika menjawab soal. Siswa sulit memahami langkahlangkah menyelesaikan persamaan reaksi. Siswa kesulitan membedakan rumus dalam perhitungan kimia sehingga tidak bisa mengaplikasikannya dalam menjawab soal. 8 X STRATEGI PEMBELAJARAN • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN Strategi pembelajaran yang dipilih adalah dengan menggunakan PBL dan diskusi. 9 X • STANDAR KOMPETENSI • KOMPETENSI DASAR • INDIKATOR • KARAKTERISTIK MATERI • KESULITAN BELAJAR SISWA • STRATEGI PENGAJARAN YANG DIPILIH • MODEL PEMBELAJARAN YANG DIHASILKAN MEDIA Media berbasis komputer yang dikembangkan adalah media animasi power point yang dikolaborasikan dengan Macromedia Flash MX 10 PUSHME ME! PUSH AGAINT ! 11 STOIKIOMETRI 12 X PENDAHULUAN created by wiji & gratania 13 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas STOIKIOMETRI Stoikiometri merupakan bidang kajian ilmu kimia, yang mempelajari hubungan kuantitatif zat-zat kimia yang terlibat dalam reaksi Pengetahuan ini penting karena kita dapat memperkirakan bahan baku yang diperlukan atau produk yang akan dihasilkan dalam suatu reaksi kimia 14 PERSAMAAN REAKSI Created by Sri Wahyuna Saragih 15 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas PERSAMAAN REAKSI Persamaan reaksi ialah cara penulisan suatu perubahan kimia atau reaksi kimia menggunakan rumus kimia berdasarkan azas kesetaraan Persamaan reaksi dikatakan setara apabila jenis dan jumlah atom zat-zat yang direaksikan (pereaksi) sama dengan jenis dan jumlah atom hasil reaksi (produk) Pereaksi ditulis di sebelah kiri diikuti tanda panah kemudian produk 16 X ISTILAH-ISTILAH 2H2 (g) + O2 (g) → 2H2O (l) 17 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas LANGKAH-LANGKAH PENULISAN 1. Menulis zat-zat yang terlibat dalam reaksi 2. Menulis rumus kimia zat-zat yang terlibat dalam reaksi 3. Menyetarakan persamaan reaksi 4. Memperjelas dengan menambahkan wujud zat (g = gas, l = cairan, s = padat, aq = larutan) 18 X CONTOH PENULISAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Logam natrium bereaksi dengan gas klor menghasilkan suatu zat padat berwarna putih yang rasanya asin. Setelah dianalisis zat tersebut diketahui sebagai garam dapur atau natrium klorida Langkah 1 : natrium + gas klor → natrium klorida → NaCl Langkah 3 : 2Na + Cl2 → 2NaCl Langkah 4 : 2Na (s) + Cl2 (g) → 2NaCl(s) Langkah 2 : Na + Cl2 19 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 1. Belerang dibakar di udara (direaksikan dengan gas oksigen) menghasilkan gas belerang dioksida Langkah 1 : belerang + gas oksigen → gas belerang dioksida Langkah 2 : S + O2 → SO2 Langkah 3 : S + O2 → SO2 Langkah 4 : S (s) → SO2 (g) + O2 (g) 20 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 2. Kristal kalsium dimasukkan ke dalam larutan asam klorida (HCl) menjadi larutan kalsium klorida dan gas hidrogen Langkah 1 : kristal kalsium + larutan asam klorida → larutan kalsium klorida + gas hidrogen Langkah 2 : Ca + HCl → CaCl + H 2 Langkah 3 : Ca + 2HCl 2 → CaCl2 + H2 Langkah 4 : Ca (s) + 2HCl (aq) → CaCl2 (aq) + H2 (g) 21 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 3. Gas metana direaksikan dengan gas oksigen menghasilkan gas karbon dioksida dan air Langkah 1 : gas metana + gas oksigen → gas karbon dioksida + air Langkah 2 : CH4 + O2 → CO2 + H2O Langkah 3 : CH4 + 2O2 → CO2 + 2H2O Langkah 4 : CH4(g) + 2O2(g) → CO2(g)+ 2H2O(l) 22 HUKUM DASAR KIMIA 23 Em..ya sama Ada…. dong! ADA…. Yoi cuy ADA… dong Kalo perbandingan Kalo Kalo reaksi Massa yang Wah….Lengkap unsur-unsur yang sebelum melibatkan dan ! Mr. Mr. Guy Proust Lussac Mr. menyusun Lavoisier susudah gas, ada senyawa, ada Semua Mr. Mr. Avogadro Dalton Deh ada aturan reaksi khusus sama ngga? di sini!!!!! ngga ngga? ya? 24 HUKUM DASAR KIMIA STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas HUKUM LAVOISIER (hukum kekekalan massa) Dalam suatu reaksi kimia, massa zat sebelum dan sesudah reaksi tidak berubah 25 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X 1.Dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalan sempurna maka terjadi zat baru, yaitu tembaga (II) sulfida sebanyak 95,5 gram. Gunakan data tersebut untuk menguji berlakunya hukum Lavoisier. Jawab : Persamaan Reaksi : Cu(s) + S(s) Massa sebelum reaksi Belerang 32 gram Tembaga 63,5 gram → CuS(s) Massa sesudah reaksi tembaga (II) sulfida 95,5 gram Massa total sebelum reaksi = 32 + 63,5 = 95,5 gram Massa total setelah reaksi = 95,5 gram Kesimpulan : Hukum Lavoisier berlaku karena 26 massa zat sebelum dan sesudah reaksi tetap STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 2. Pada pembakaran 12 gram magnesium X dengan 10 gram gas oksigen, dihasilkan 20 gram magnesium oksida dan sisa gas oksigen 2 gram . Gunakan data tersebut untuk menguji berlakunya hukum Lavoisier. Jawab : Persamaan Reaksi : 2Mg (s) + O2 (g) 2MgO (s) Massa sebelum reaksi Massa sesudah reaksi Magnesium Gas oksigen Magnesium oksida Zat sisa 12 gram 10 gram 20 gram 2 gram Massa total sebelum reaksi =12 + 10 =22 gram Massa total setelah reaksi = 20 + 2 = 22 gram Kesimpulan : Hukum Lavoisier berlaku karena massa zat sebelum dan sesudah reaksi tetap 27 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 3. Dalam suatu cawan porselin direaksikan 130 gram tembaga dengan 64 gram belerang. Berapa gram tembaga (I) sulfida yang dihasilkan, jika diketahui massa tembaga yang tidak bereaksi 3 gram. Jawab : Persamaan Reaksi : 2Cu (s) + S (s) Cu2S (s) Massa sebelum reaksi Cu 130 gram S 64 gram Massa sesudah reaksi Cu2S x gram Zat sisa 3 gram Massa total sebelum reaksi = Massa total setelah reaksi 130 + 64 = x + 3 Jadi jumlah massa tembaga sulfida yang dihasilkan = (130 + 64) – 3 = 191 gram 28 HUKUM DASAR KIMIA X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM PROUST (hukum perbandingan tetap) HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Perbandingan massa unsur-unsur yang membentuk suatu senyawa selalu tetap Perbandingan massa C dan O dalam CO2 selalu 3 : 8 Perbandingan massa H dan O dalam H2O selalu 1 : 8 Perbandingan massa C , H dan O dalam asam cuka selalu 6 : 1 : 8 Dan lain sebagainya 29 STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas LATIHAN 1. Pada percobaan pembuatan senyawa tembaga (II) sulfida, tembaga dicampur dengan belerang kemudian dipanaskan. Dari hasil pengamatan diperoleh data sebagai berikut Perco baan ke- Massa Tembaga (gram) Massa Belerang (gram) 1 1,0 0,5 2 2,0 1,0 3 3,0 1,5 4 4,0 2,0 5 5,0 2,5 Perbandingan massa tembaga : belerang 2 : 2 : 2 : 1 1 1 2 : 2 : 1 1 Kesimpulan apa yang kalian dapatkan : Perbandingan massa tembaga dan belerang yang membentuk tembaga (II) sulfida selalu 2 : 1 30 (memenuhi hukum Proust) X X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 2. Air terbentuk dari unsur hidrogen dan oksigen dengan perbandingan massa 1 : 8. Apabila tersedia 4,0 gram hidrogen, berapa gram oksigen yang diperlukan agar seluruh hidrogen habis bereaksi membentuk air? Jawab : Perbandingan massa hidrogen : oksigen = 1 : 8 Massa hidrogen = 4 gram Massa oksigen = 8/1 x 4 = 32 gram Jadi massa oksigen yang dibutuhkan adalah 32 gram. 31 X 3. STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Belerang sebanyak 3,2 gram tepat bereaksi dengan sejumlah gas oksigen membentuk 8 gram senyawa belerang trioksida. Tentukan perbandingan massa belerang dan oksigen yang terdapat dalam belerang trioksida tersebut. Jawab : Massa belerang = 3,2 gram Massa belerang trioksida = 8 gram Massa oksigen = (8 – 3,2) = 4,8 gram Jadi perbandingan massa belerang : oksigen = 3,2 : 4,8 = 2 : 3 32 HUKUM DASAR KIMIA STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa HUKUM DALTON (hukum perbandingan berganda) PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X Apabila dua macam unsur membentuk lebih dari satu jenis senyawa, maka perbandingan massa unsur yang mengikat sejumlah yang sama unsur yang lain merupakan bilangan bulat dan sederhana. Unsur N dan O dapat membentuk senyawa NO, N2O3, NO2,, N2O5, maka perbandingan unsur O yang diikat sejumlah sama unsur N adalah 2 : 3 : 4 33 : 5 (bulat dan sederhana) X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 1. Unsur Nitrogen dan Oksigen dapat membentuk dua macam senyawa dengan data sebagai berikut Senyawa Massa Nitrogen Massa Oksigen I 28 gram 32 gram II 28 gram 64 gram Gunakan data tersebut untuk menguji berlakunya hukum Dalton Jawab : Senyawa I II Perbandingan Massa Nitrogen : Massa Oksigen 28 : 32 = 7 : 8 28 : 64 = 7 : 16 Jadi perbandingan massa oksigen yang mengikat sejumlah unsur nitrogen yang sama = 8 : 16 = 1 : 2 Perbandingan massa oksigen antara senyawa I dan senyawa II merupakan bilangan bulat dan sederhana 34 sehingga memenuhi hukum dalton X 2. Unsur Karbon dan Oksigen dapat membentuk dua macam senyawa dengan data sebagai berikut STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Senyawa Massa Karbon Massa Oksigen CO 0,12 gram 0,16 gram CO2 0,24 gram 0,64 gram Gunakan data tersebut untuk berlakunya hukum Dalton menguji Jawab : Senyawa CO CO2 Perbandingan Massa Karbon : Massa Oksigen 0,12 : 0,16 = 3 : 4 0,24 : 0,64 = 3 : 8 Jadi perbandingan massa oksigen yang mengikat sejumlah 4:8=1:2 unsur karbon yang sama = Kesimpulan : Hukum dalton berlaku, karena perbandingan massa oksigen antara senyawa I dan senyawa II merupakan bilangan bulat dan35 sederhana X 3. STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Unsur A dan B membentuk dua senyawa. Senyawa I mengandung 15 gram A dan 80 gram B. Senyawa II mengandung 30 gram A dan 240 gram B. Gunakan data tersebut untuk menguji berlakunya hukum Dalton Jawab : ` Senyawa Massa A Massa B I 15 gram 30 gram 80 gram 240 gram II Senyawa I II Perbandingan Massa A : Massa B 15 : 80 = 3 : 16 30 : 240 = 3 : 24 Jadi perbandingan massa B yang mengikat sejumlah massa A yang sama = 16 : 24 = 2 : 3 Kesimpulan : Sesuai dengan hukum dalton, karena perbandingan massa B antara senyawa I dan senyawa 36 II merupakan bilangan bulat dan sederhana HUKUM DASAR KIMIA X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas HUKUM GAY LUSSAC (hukum perbandingan volume) Apabila diukur pada suhu dan tekanan yang sama, maka perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana Dalam reaksi kimia perbandingan volume 37 gas = perbandingan koefisien X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 1. Pada reaksi antara gas hidrogen dan gas oksigen menghasilkan uap air. Berapa liter gas oksigen yang diperlukan dan berapa liter uap air yang dihasilkan apabila gas hidrogen yang direaksikan sebanyak 12 liter. Jawab : Persamaan reaksi : Perbandingan volume: Volume : 2H2(g) + O2(g) → 2H2O(g) 2 12 L 1 6L 2 12 L Jadi volume gas oksigen yang diperlukan 6 L sedangkan uap air yang dihasilkan 12 L 38 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 2. Pada temperatur dan tekanan yang sama direaksikan 30 mL gas hidrogen dengan 10 mL gas nitrogen menghasilkan gas amoniak. Tentukan jumlah volume gas amoniak yang terbentuk! Jawab : Persamaan reaksi : Perbandingan volume: Volume 3H2(g) + N2(g) 2NH3(g) 3 : 30 mL 1 10 mL 2 20 mL Jadi volume gas amoniak yang terbentuk 20 mL 39 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 3. Berapa volume gas belerang trioksida yang terbentuk apabila 2 Liter gas belerang dioksida bereaksi sempurna dengan gas oksigen? Jawab : Persamaan reaksi : 2SO2(g) + O2(g) 2SO3(g) Perbandingan volume : Volume : 2 1 2 2L 1L 2L Jadi volume gas belerang trioksida yang terbentuk 2 L 40 PERHITUNGAN KIMIA 41 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Menerapkan Hukum Gay Lussac dan Hipotesis Avogadro Apabila diukur pada suhu dan tekanan yang sama, maka perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana (Hk. Guy Lussac) Pada suhu dan tekanan yang sama, maka semua gas yang volumenya sama akan mengandung jumlah molekul yang sama (Hipotesis Avogadro) 42 LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X 1. Pada suhu dan tekanan tertentu, 2 liter gas nitrogen mengandung 8 x 1022 molekul. Berapa molekul yang ada pada 10 liter gas amonia jika diukur pada suhu dan tekanan yang sama? Jawab : Pada suhu dan tekanan yang sama, setiap gas yang volumenya sama mempunyai jumlah molekul yang sama 2 liter gas nitrogen = 8 x 1022 molekul 2 liter gas amonia = 8 x 1022 molekul 10 liter gas amonia = = 10/2 x 8 x 1022 molekul 4 x 1023 molekul 43 LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac X 2. Pada suhu dan tekanan tertentu, 5 liter gas N2 mengandung 6 x 1020 molekul. Berapa volume gas H2 yang mengandung 24 x 1020 molekul pada kondisi yang sama? Jawab : Pada suhu dan tekanan yang sama, setiap gas yang volumenya sama mempunyai jumlah molekul yang sama 5 liter gas N2 = 6 x 1020 molekul PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 5 liter gas H2 = 6 x 1020 molekul 24 x 1020 molekul H2 = = 24 x 1020 x 5 Liter 6 x 1020 20 Liter 44 LATIHAN X 3. STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Berapa liter gas oksigen yang diperlukan untuk membakar sempurna 5 L gas CH4 yang mengandung 1 x 1020 molekul? Reaksi tersebut diukur pada temperatur dan tekanan yang sama, dengan persamaan reaksi : CH4(g) + O2(g) CO2(g) + 2H2O(g) Berapa jumlah molekul H2O yang dihasilkan? Jawab : Persamaan reaksi: CH4(g) + O2(g) → CO2(g) + 2H2O(g) Perb. volume : 1 Volume : 5L Jml. Molekul : 1 2 5L 10 L 1 x 1020 2 x 1020 Jadi volume gas oksigen yang diperlukan 5 L Jumlah molekul H2O yang dihasilkan 2 x 1020 45 X KONSEP MOL STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa Dalam setiap satu mol suatu zat terdapat partikel zat tersebut (atom, molekul, ion) sebanyak 6,02 x 1023 Massa molekul/rumus relatif Massa atom relatif PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Volume (STP) MOL x 6,02 x 1023 Massa : 6,02 x 1023 Jumlah Partikel Keadaan gas pada t =00C & p = 1 atm Bilangan avogadro 46 Massa Atom Relatif (Ar) Massa atom relatif unsur X Massa rata - rata 1 atom unsur X 1 Massa 1 atom C -12 12 Beberapa data Ar unsur : Unsur Ar Unsur Ar Unsur Ar Unsur Ar Al 27 Au 197 K 39 O 16 Ba 137 P 31 Na 23 Mg 24 Br 80 F 19 Ca 40 N 14 Fe 56 H 1 C 12 Cu 63.5 S 32 I 127 Cl 35.5 Pb 207 Ag 108 Mn 55 Hg 201 Zn 65 47 Massa Molekul Relatif (Mr) Massa molekul relatif (Mr) sama dengan jumlah Ar dari semua massa penyusunnya. Mr = Jumlah Ar Atau Mr Senyawa AB = Ar A + Ar B Contoh : Mr C2H5OH = (2 x Ar C) + (6 x Ar H) + (1 x Ar O) = (2 x 12) + (6 x 1) + (1 x 16) = 46 48 Latihan Senya wa Uap H2O Ar Mr H =1 (1x 2) + O =16 (16x1) =18 Larutan H =1 H2SO4 X MOL Massa 0,01 mol 0,01 x 18 = 0,18 g 0,01 x 22,4 = 0,224 L 0,01 x 6,02 x 1023 = 6,02 x 1021 molekul 4,9 g Rumus hanya untuk gas 0,05 x 6,02 x 1023 = 3,01 x 1022 molekul (1x2) + 4,9 g / 98 S =32 (1x32) + = 0,05 mol (4x16) O =16 = 98 Volume (STP) Jumlah Partikel 49 X Senya wa Ar gas CO2 C =12 O=16 Mr Mol (1x12) + 11,2 L / (2x16) = 22,4 L = 44 0,5 mol larutan Ca =40 (1x40) + 3,01 x 10 23 23 CaCl2 Cl=35,5 (2x35,5) 6,02 x 10 = 111 = 0,5 mol padatan Cu=63,5 (1x63,5) 2 mol + (1x32) CuSO4. S =32 + (4x16) 5H2O O =16 + (5x18) H =1 = 249,5 Massa Volume Jumlah (STP) Partikel 0,5 x 44 = 11,2 L 0,5 x 6,02 x 22 gr 1023 = 3,01 x 1023 molekul 0,5 x 111 Rumus hanya = 55,5 gr untuk gas 2x 249,5= 499 gr Rumus hanya untuk gas 3,01 x 1023 molekul 2 x 6,02 x 1023 = 12,04 x 1023 molekul 50 X PENENTUAN KADAR ZAT STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Kadar zat dalam suatu senyawa ditetapkan berdasarkan hasil percobaan analisis kimia. Tetapi jika rumus senyawa dan Ar masing-masing zat penyusun diketahui maka kadar zat penyusun dalam senyawa tersebut dapat dihitung Prosentase zat = Jumlah zat x Ar zat x 100 % Mr senyawa Jumlah zat x Ar zat x Massa senyawa Massa zat = Mr senyawa 51 LATIHAN No STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa 1 PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas H2O Ar H = 1 O = 16 PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac Rumus Kimia Senyawa 2 X Kadar Zat Penyusun Prosentase H = 2 x 1 x 100 % = 11,11 % 18 1 x16 x 100 % = 88,89 % Prosentase O = 18 CO (NH2)2 Ar C = 12 N = 14 H=1 Prosentase C = Prosentase O = Prosentase N = Prosentase H = 52 X STOIKIOMETRI 3 PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa CaCO3 2 gram Ar Ca = 40 C = 12 O = 16 Massa Ca = 40 x 2 0.8 gram 100 Massa C = 12 x 2 0.24 gram 100 Massa O = 48 x 2 0.96 gram 100 Massa C = 72 x 5 2 gram 180 PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 4 C6H12O6 5 gram Ar C = 12 H=1 O = 16 Massa H = Massa O = 12 x 5 0.33 gram 180 96 x 5 2.67 gram 180 53 RUMUS KIMIA STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X Rumus kimia merupakan simbol dari senyawa kimia yang dinyatakan oleh huruf dan angka, rumus kimia menyatakan jenis atom unsur dan jumlah relatif atom-atom yang terdapat di dalam zat itu Rumus Empiris Rumus empiris menyatakan angka perbandingan bilangan bulat terkecil dari jumlah atom dalam suatu senyawa. Rumus empiris senyawa dapat ditentukan berdasarkan data kadar zat dalam suatu senyawa dan Mr senyawa. Rumus Molekul Rumus molekul menyatakan banyaknya atom suatu unsur yang terdapat dalam satu molekul suatu senyawa. Rumus molekul merupakan kelipatan bulat dari rumus empiris. Air kristal merupakan rumus molekul senyawa garam yang mengikat air. Contoh CuSO4. 5H2O. Rumus air kristal dapat ditentukan berdasarkan54data kadar air yang terikat oleh suatu garam. X Contoh rumus molekul : STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa Nama Rumus Molekul PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Arti Metana CH4 Tiap molekul metana terdiri atas 1 atom C dan 4 atom H Amoniak NH3 Tiap molekul amoniak terdiri atas 1 atom N dan 3 atom H Karbon dioksida CO2 Tiap molekul karbon dioksida terdiri atas 1 atom C dan 2 atom O PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac Model Molekul 55 CH4 C6H12O6 56 1C 4H Tiap molekul metana terdiri atas 1 atom C dan 4 atom H 57 ) 6C 12H 6O 1 : 2 :1 Misalkan rumus empiris Glukosa (C6H12O6) adalah CH2O ini menunjukkan jumlah atom karbon, hidrogen, dan oksigen memiliki perbandingan 1 : 2 : 1 58 X Hubungan antara rumus molekul dan rumus empiris STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa Nama Rumus Molekul (RM) Rumus Empiris (RE) Perbandingan Atom-Atom pada RE Glukosa C6H12O6 CH2O C : H : O = 1 : 2 :1 C2H6 CH3 C:H=1:3 KI KI K:I=1:1 PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Etana Kalium Iodida 59 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Nama Heksena Rumus Molekul (RM) Rumus Empiris (RE) Perbandingan Atom-Atom pada RE C 6H 6 CH C:H=1:1 H2C2O4 HCO2 C : H : O = 1 : 1 :2 Dinitrogen tetraoksida N 2O4 NO2 N:O=1:2 Asam asetat CH3COOH CH2O C : H : O = 1 : 2 :1 Urea CO(NH2)2 CO(NH ) 2 2 Asam oksalat C:O:N:H = 1: 1:2:4 60 X CONTOH STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI 1. Hasil analisis kimia yang dilakukan terhadap senyawa hidrazin ( Mr = 32) ditemukan bahwa senyawa tersebut terdiri atas 87,42 % massa N dan 12,48 % massa H. Tentukan rumus empiris dan rumus molekul senyawa hidrazin. Jawab perbandingan jumlah atom = perbandingan mol HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac Mol atom N = 87,42 = 87,42 = 6,24 mol Ar N 14 Mol atom H = 12,48 = 12,48 = 12,48 mol Ar H 1 PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Perbandingan mol N : mol H = 6,24 : 12,48 = 1 : 2 Perbandingan jumlah atom N : H = 1 : 2 Rumus empiris hidrazin = NH2 Rumus molekul hidrazin = (NH2)n Mr hidrazin = n x Ar N + n x 2 x Ar H 32 = 14n + 2n n =2 Jadi rumus molekul hidrazin = (NH2)2 = N2H4 61 LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X 2. Suatu senyawa dianalisis mempunyai komposisi karbon 82,8 % dan hidrogen 17,2 %. Massa molekul relatif senyawa tersebut 58. Tentukan rumus empiris dan rumus molekulnya. Jawab : perbandingan jumlah atom = perbandingan mol 82.5 82.5 6.9 mol mol atom C = Ar C 12 17.2 17.2 mol atom H = 17.2 mol Ar H 1 Perbandingan mol C : mol H = 6,9 : 17,2 = 1 : 2 Perbandingan jumlah atom C : H = 1 : 2 Rumus empiris senyawa tersebut = CH2 Rumus molekul = (CH2)n Mr senyawa = n x Ar C + n x 2 x Ar H 58 = 12n + 2n n = 4 Jadi rumus molekulnya = (CH2)n = (CH2)4 = C4H8 62 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 3. Seorang siswa memanaskan kristal tembaga (II) sulfat (CuSO4. xH2O) sebanyak 4,98 gram. Massa senyawa tersebut setelah airnya terlepas adalah 3,18 gram. Tentukan rumus air kristal tersebut. Jawab : Massa CuSO4 = 3,18 gram Massa Air = (4,98 – 3,18) gram = 1,8 gram Mol CuSO4 = 3,18/159,5 = 0,02 mol Mol Air = 1,8 / 18 = 0,1 mol Perbandingan mol CuSO4 : mol H2O = 0,02 : 0,1 = 1 : 5 Perbandingan jumlah CuSO4 : jumlah H2O = 1 : 5 Rumus air kristal : CuSO4. 5H2O 63 STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERHITUNGAN BERDASAR PERSAMAAN REAKSI PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Koefisien-koefisien dalam suatu persamaan reaksi merupakan angka banding antara mol pereaksi dengan mol hasil reaksi 64 X X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac LATIHAN 1. Berapa mol oksigen yang diperlukan untuk membakar 1,8 mol C2H5OH menurut reaksi C2H5OH + 3O2 → 2CO2 + 3H2O Jawab : Persamaan Reaksi : C2H5OH + 3O2 → 2CO2 + 3H2O Perb. Mol : 1 3 Mol : 1,8 5,4 2 3 PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 65 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac 2. Berapa mol karbon dioksida dan uap air yang dihasilkan bila 1,8 mol C2H5OH dibakar menurut reaksi C2H5OH + 3O2 → 2CO2 + 3H2O Jawab : Persamaan Reaksi : C2H5OH + 3O2 → 2CO2 + 3H2O Perb. Mol : 1 Mol : 1,8 3 2 3 3,6 5,4 PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 66 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa 3. Berapa gram O2 yang diperlukan untuk bereaksi dengan 0,3 mol Al, menurut reaksi 4Al + 3O2 → Al2O3 Jawab : Persamaan Reaksi : 4 Al + 3O 2 → 2Al2O3 PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Perb. Mol : 4 3 Mol : 0,3 0,225 2 0,225 mol O2 = (0,225 x Mr O2 ) gram = (0,225 x 32) gram = 7,2 gram 67 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 4. Berapa gram Al2O3 yang terbentuk jika 12,5 gram O2 bereaksi sempurna dengan Alumunium, menurut reaksi : 4Al + 3O2 → Al2O3 Jawab : mol O2 = massa O2 / Mr O2 = (12,5 / 32) mol = 0,39 mol Persamaan Reaksi : 4 Al + 3O2 → 2Al2O3 Perb. Mol : Mol : 4 3 2 0,39 0,26 0,26 mol Al2O3 = ( 0,26 x Al2O3) gram = (0,26 x 102) gram = 26,52 gram 68 X PENENTUAN PEREAKSI PEMBATAS STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Dalam reaksi kimia, pereaksi tidak selalu dicampurkan dalam perbandingan yang tepat sehingga semua pereaksi habis bereaksi Sering terjadi kondisi dimana salah satu pereaksi dalam keadaan berlebih Sehingga salah satu pereaksi sudah habis bereaksi sementara pereaksi lain masih bersisa Pereaksi yang duluan habis bereaksi disebut pereaksi pembatas 69 X CONTOH STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI 1. Satu mol Mg dan 4 mol HCl direaksikan menurut persamaan reaksi : Mg + 2HCl → MgCl2 + H2 Manakah yang merupakan pereaksi pembatas? HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac Jawab : Persamaan Reaksi: Mg Mol mula-mula : 1 PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Perb. Mol : 1 + 2HCl MgCl2 + H2 3 - - 2 1 1 Apabila 1 mol Mg habis bereaksi maka membutuhkan 2 mol HCl, sedangkan bila 4 mol HCl habis bereaksi memerlukan 2 mol Mg. Berdasarkan data yang ada maka Mg merupakan pereaksi pembatas karena lebih dulu habis bereaksi 70 X 2. 0,5 mol O2 bereaksi dengan 0,3 mol Al, STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas menurut persamaan reaksi : 4 Al + 3O2 → 2Al2O3 Tentukan manakah yang merupakan pereaksi pembatas? Jawab : Persamaan Reaksi: 4 Al Mol mula-mula : 0,3 Perb. Mol : 4 + 3O2 0,5 3 2Al2O3 - 2 Apabila 0,3 mol Al habis bereaksi maka membutuhkan 0,225 mol O2, sedangkan bila 0,5 mol O2 habis bereaksi memerlukan 0,67 mol Al. Berdasarkan data yang ada maka Al merupakan pereaksi pembatas karena lebih dulu habis bereaksi 71 X 3. 12 gram seng dan 6,5 gram belerang bereaksi membentuk seng sulfida menurut persamaan reaksi STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Zn + S → ZnS Tentukan manakah yang merupakan pereaksi pembatas? Jawab : mol Zn = massa Zn / Ar Zn = 12/65 = 0,18 mol mol S = massa S / Ar S = 6,5 / 32 = 0,20 mol Persamaan Reaksi: Zn + Mol mula-mula : 0,18 Perb. Mol : 1 S 0,20 1 ZnS 1 Apabila 0,18 mol Zn habis bereaksi maka membutuhkan 0,18 mol S, sedangkan bila 0,20 mol S habis bereaksi memerlukan 0,20 mol Zn. Berdasarkan data yang ada maka Zn merupakan pereaksi pembatas karena lebih dulu habis bereaksi 72 LKS PRATIKUM 73 Menguji Hukum Lavoiser STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas ALAT DAN BAHAN ALAT - 1 buah tabung Y beserta sumbat penutupnya - 2 buah pipet tetes - neraca timbangan BAHAN - Pb(NO3)2 (aq) - KI (aq) 74 X Menguji Hukum Lavoiser STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas LANGKAH KERJA Dengan menggunakan pipet tetes, isilah salah satu kaki tabung Y dengan larutan Pb(NO3)2 dan kaki tabung Y lainnya dengan larutan KI. Kemudian tutup dengan sumbat dan ditimbang. Catat massa tabung beserta isinya. Reaksikan kedua larutan dengan cara me miringkan tabung, sedemikian rupa sehingga larutan Pb(NO3)2 bercampur dengan larutan KI Catat perubahan yang terjadi. Kemudian timbang kembali tabung tersebut. 75 X Menguji Hukum Lavoiser STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X LEMBAR PENGAMATAN - Kondisi sebelum direaksikan Kaki Tabung Y Larutan Warna Larutan Kiri …………… ……………………… Kanan …………… ……………………… - Kondisi setelah direaksikan Perubahan yang terjadi Berat tabung Y sebelum reaksi …… gram Berat tabung Y setelah reaksi …… gram - Kesimpulan percobaan : …………………………………. ………………………………………………………………. 76