TEKNIK PENGAMBILAN SAMPEL DARI BURUNG AIR LIAR UNTUK
advertisement

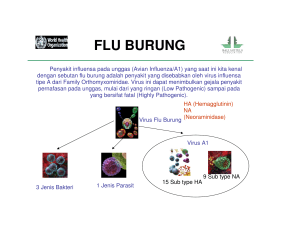
83 Pudji Kurniadhi dan Suparno: Pengambilan Buletin Teknik Pertanian Vol. 14, No. 2, 2009:sampel 83-86 dari burung air liar untuk pengujian flu burung TEKNIK PENGAMBILAN SAMPEL DARI BURUNG AIR LIAR UNTUK PENGUJIAN PENYAKIT FLU BURUNG Pudji Kurniadhi1 dan Suparno2 1 Teknisi Litkayasa Penyelia pada Balai Besar Penelitian Veteriner Jalan R.E. Martadinata No. 30, Bogor 16114, Telp. (0251) 8331048, Faks. (0251) 8336425 E-mail: [email protected] 2 Teknisi Litkayasa Lanjutan pada Pusat Penelitian Biologi-LIPI Jalan Raya Jakarta - Bogor km 46, Cibinong 16911, Telp. (021) 8765067 Faks: (021) 8765062, E-mail: [email protected] P enyakit flu burung (avian influenza/AI) disebabkan oleh virus influenza tipe A yang menyerang unggas. Burung air liar seperti Acepalus spp., Alcedo coerulensens, Cisticola juncialis, dan masih banyak jenis lainnya merupakan inang alami virus AI. Walaupun virus tersebut tidak menyebabkan burung air liar tersebut sakit, pada unggas domestik (piaraan) seperti ayam dan itik, virus dapat menyebabkan infeksi yang mengakibatkan sakit bahkan mati (Swayne et al. 1998). Virus influenza tipe A dengan inang alami burung air liar dapat menginfeksi manusia, burung, babi, kuda, anjing laut, paus, dan hewan lainnya, sedangkan tipe B dan C pada umumnya ditemukan pada manusia (Foni 2003). Virus AI termasuk dalam famili Orthomyxovirus. Virus bersifat sangat akut dengan menimbulkan gejala klinis yaitu gangguan pernapasan bagian atas dan gangguan reproduksi, serta dapat menimbulkan kematian hingga 100% pada kasus yang sangat patogen (Easterday et al. 1997). Di Indonesia, virus AI mewabah sejak awal Agustus 2003 pada peternakan ayam di Jawa, Bali, Sumatera, dan Kalimantan dengan tingkat kematian yang sangat tinggi. Virus penyebab penyakit AI telah berhasil diisolasi dan dikarakterisasi secara lengkap oleh Balai Besar Penelitian Veteriner (Bbalitvet) di Bogor, yaitu berupa virus influenza tipe A dengan subtipe H5N1 (Damayanti et al. 2004; Dharmayanti et al. 2004; Wiyono et al. 2004). Beberapa uji untuk mendeteksi penyakit AI telah dikembangkan di Bbalitvet, meliputi uji serologi haemaglutinasi inhibisi (HI), uji agar gel presipitasi (AGP), uji secara Enzyme Linked Immunosorbent Assay (ELISA), uji isolasi Reverse Tanscriptase-Polymerase Chain Reaction (RT-PCR), dan uji jaringan immuno-histochemistry (IHC). Untuk mendapatkan hasil uji yang akurat diperlukan teknik pengambilan sampel yang benar dari burung air liar. Sampel yang diambil dapat berupa darah, usap trakea dan orofaringeal, serta jaringan. Tujuan penulisan adalah untuk menguraikan teknik pengambilan sampel darah, usap trakea dan orofaringeal, serta jaringan pada burung air liar. Selanjutnya dilakukan pengujian HI terhadap serum darah burung air liar yang dikumpulkan. BAHAN DAN METODE Bahan dan Alat Bahan yang digunakan adalah 18 ekor burung air liar yang tertangkap di daerah Tanjung Pasir, Tangerang, Banten pada tanggal 2-6 April 2008, yaitu Acepalus spp., A. coerulensens, C. juncialis, Galinago stenura, Halcyon chloris, Nyticorax nicticorax, Porzana cinerea, Rostrata bengalensis, dan Tringa stagnatilis. Dari burung air liar tersebut dilakukan pengambilan darah, usap trakea dan orofaringeal, serta jaringan untuk selanjutnya dilakukan analisis untuk mendeteksi penyakit flu burung. Bahan lainnya adalah alkohol 70%, formalin 10%, kapas, sarung tangan, dan masker penutup mulut. Bahan untuk uji HI terdiri atas larutan dapar phosphate buffer saline (PBS), antigen AI (H5N1) dari hasil isolasi, butir darah merah (BDM) dari ayam donor, dan serum darah burung air liar yang telah dipisahkan dari sampel darah. Peralatan yang digunakan adalah spuit berikut jarum suntik, refrigerator, termos es, sentrifuse mikro, microtube, swab steril, tiv, pipet single channel, dan plat mikro. Pengambilan Darah Sebelum melakukan pekerjaan, petugas membersihkan tangan dengan alkohol 70% lalu memakai perlengkapan pengambilan sampel yaitu sarung tangan dan masker penutup mulut. Burung yang akan diambil darahnya dipegang dengan lembut dan hati-hati. Leher burung dibersihkan dengan kapas yang beralkohol 70% dan dicari vena jugularisnya. Setelah venanya terlihat, darahnya diambil dengan spuit berikut jarum suntik ukuran 1 ml. Untuk burung berukuran kecil, darah yang diambil minimal 0,30 ml dan untuk burung 84 Pudji Kurniadhi dan Suparno: Pengambilan sampel dari burung air liar untuk pengujian flu burung ukuran besar minimal 0,50 ml (Gambar 1). Setelah darah berhasil diambil, leher burung dibersihkan kembali dengan kapas yang beralkohol 70%. Darah yang telah diambil dan masih dalam spuit dibiarkan beku dan disimpan dalam refrigerator (4°C) atau termos yang diberi es batu. Pemisahan Serum dari Darah Darah yang telah disimpan 10-12 jam (semalam) dalam refrigerator dimasukkan ke dalam microtube, lalu disentrifus dengan sentrifuse mikro pada kecepatan 13.400 rpm selama 15 detik. Setelah disentrifus, darah merah dan serum akan terpisah; darah merah berada di bagian bawah sedangkan serum di bagian atas. Serum diambil dengan tiv dan pipet single channel ukuran 0,20 ml dan ditampung dalam microtube ukuran 1,50 ml, kemudian dilabel dan disimpan dalam refrigerator (4°C) atau termos yang diberi es batu. media transpor, kemudian dilabel dan disimpan dalam refrigerator (4°C) atau termos yang diberi es batu. Pengambilan Usap Kloaka Paha dan badan burung dipegang dengan hati-hati, lalu dibalik dengan posisi kepala di bawah dan ekor di atas. Selanjutnya, ekor ditekuk hingga kelihatan anusnya, lalu anus dibuka dengan hati-hati sampai kelihatan lubangnya. Setelah lubang anus terbuka, swab steril yang ujungnya terbuat dari bahan rayon dimasukkan ke anus dan diusapkan di daerah kloaka (Gambar 3). Swab yang telah ada lendirnya lalu dimasukkan ke dalam tabung yang berisi media transpor, kemudian dilabel dan disimpan dalam refrigerator (4°C) atau termos yang diberi es batu. Pengambilan Jaringan Pengambilan Usap Trakea dan Urofaringea Mulut burung dibuka dengan hati-hati sampai kelihatan lubang trakeanya, lalu swab steril yang ujungnya terbuat dari bahan rayon dimasukkan ke mulut burung dan diusapkan di daerah trakea dan orofaringeal (Gambar 2). Swab yang telah ada lendirnya lalu dimasukkan ke dalam tabung yang berisi Gambar 1 . Pengambilan darah burung melalui vena jugularis dari burung air liar yang tertangkap di Tanjung Pasir, Tangerang, April 2008 Burung yang mati ketika tertangkap maupun karena akan dibuat spesimennya diambil organ dalamnya, yaitu otak, trakea, paru-paru, jantung, hati, dan usus dengan cara dikuliti terlebih dahulu. Kulit berikut bulunya diawetkan untuk dibuat spesimen. Organ yang telah diambil kemudian dipotong-potong kecil dan dimasukkan ke dalam cairan pengawet formalin 10% serta disimpan pada suhu ruang. Gambar 2. Pengambilan usap trakea dan orofaringeal dari burung air liar yang tertangkap di Tanjung Pasir, Tangerang, April 2008 Gambar 3. Pengambilan usap kloaka dari burung air liar yang tertangkap di Tanjung Pasir, Tangerang, April 2008 85 Pudji Kurniadhi dan Suparno: Pengambilan sampel dari burung air liar untuk pengujian flu burung Uji HI Uji HI dilakukan terhadap sampel serum darah burung air liar untuk mengetahui ada/tidaknya antibodi terhadap AI. Sebanyak 25 µl larutan dapar PBS dimasukkan ke dalam plat mikro. Selanjutnya ditambahkan 25 serum darah yang akan diuji, lalu dilakukan pengenceran secara seri. Setelah itu ditambahkan 25 µl antigen AI (4 HAU-Haemoglutination Unit) dan diinkubasi selama 30 menit pada suhu kamar. Selanjutnya ditambahkan 25 µl BDM 1% dan diinkubasi kembali selama 30 menit pada suhu kamar sampai terbentuk seperti gumpalan (haemoglutinasi). Untuk pengamatan haemoglutinasi secara manual, jika terbentuk haemoglutinasi maka serum darah tersebut tidak mengandung antibodi AI atau burung air liar tidak terpapar AI. HASIL DAN PEMBAHASAN Dari 18 ekor burung air liar yang ditangkap, 9 jenis dapat diambil sampelnya, yang terdiri atas 18 sampel trakea, 16 sampel kloaka, 12 sampel serum darah, dan 4 sampel jaringan (Tabel 1). Jumlah sampel yang diambil pada tiap burung ada yang tidak lengkap karena ukuran burung terlalu kecil. Untuk sampel jaringan, hanya diambil dari burung yang mati, karena kegiatan yang dilakukan hanya berupa pemantauan sehingga dilarang membunuh burung. Dari burung yang mati tersebut lalu dibuat spesimen. Tabel 1. Burung air liar yang tertangkap berikut sampelnya di daerah Tanjung Pasir, Tangerang, Banten, 2-6 April 2008 Nama burung Acepalus spp. Alcedo coerulensens Alcedo coerulensens Alcedo coerulensens Alcedo coerulensens Alcedo coerulensens Alcedo coerulensens Alcedo coerulensens Cisticola juncialis Galinago stenura Galinago stenura Halcyon chloris Nyticorax nicticorax Porzana cinerea Porzana cinerea Rostrata bengalensis Rostrata bengalensis Tringa stagnatilis Jumlah sampel Trakea Kloaka Serum Jaringan Keterangan √ - - √ √ √ - √ √ - √ √ √ √ √ √ √ √ √ √ √ √ √ - √ √ √ √ - - √ √ √ √ √ √ √ √ √ √ √ √ √ - √ √ √ √ √ √ √ √ √ √ √ √ √ 18 16 12 4 √ = berhasil dilakukan pengambilan sampel Spesimen Jika hasil uji HI positif, untuk konfirmasi selanjutnya perlu dilakukan uji RT-PCR terhadap usap trakea dan orofaringeal, dan uji IHC terhadap jaringan. Dari semua uji tersebut, uji RT-PCR dari usap trakea dan orofaringeal adalah yang paling sensitif untuk mendeteksi adanya penyakit flu burung pada burung air liar. KESIMPULAN DAN SARAN Pengambilan sampel burung air liar yang benar akan mendapatkan hasil analisis yang akurat. Dari 18 sampel serum burung air liar, semuanya tidak mengandung antibodi terhadap AI, yang berarti burung air liar tersebut tidak terpapar penyakit AI. Waktu pengambilan sampel perlu memperhatikan kelangsungan hidup burung; burung harus tetap hidup dan dapat dilepas kembali ke habitatnya. Pengambilan sampel burung air liar harus dilakukan dengan hati-hati dan memperlakukan burung dengan kasih sayang untuk mengurangi stres akibat penangkapan. DAFTAR PUSTAKA Spesimen √ Salah satu contoh analisis yang dilakukan terhadap sampel yang diperoleh adalah pengujian serum darah untuk mengetahui ada tidaknya antibodi terhadap penyakit flu burung tipe A dengan uji HI. Hasil uji HI menunjukkan semua serum darah burung air liar negatif atau tidak mengandung antibodi terhadap penyakit flu burung tipe A (H5N1-H5N16), yang berarti burung air liar tersebut tidak terpapar penyakit flu burung. Untuk mendeteksi antibodi terhadap penyakit flu burung, selain dengan uji HI dapat digunakan uji yang lain yaitu AGP dan ELISA. Uji AGP mendeteksi antibodi penyakit flu burung secara spesifik, yaitu khusus dari antibodi H5N1, sedangkan uji ELISA mendeteksi antibodi penyakit flu burung secara spesifik dan sensitif khusus dari antibodi H5N1. Spesimen Spesimen Damayanti, R., A. Wiyono, R. Indriani, N.L.P.I. Dharmayanti, dan Darminto. 2004. Gambaran klinis dan patologis pada ayam terserang flu burung sangat pathogenic (HPAI) di beberapa peternakan di Jawa Timur dan Jawa Barat. Jurnal Ilmu Ternak dan Veteriner 9: 128-135. Dharmayanti, N.L.P.I., R. Damayanti, A. Wiyono, R. Indriani, dan Darminto. 2004. Identifikasi virus avian influenza isolat Indonesia dengan Reverse Transcriptase Polymerase Chain Reaction (RT-PCR). Jurnal Ilmu Ternak dan Veteriner 9: 136143. Easterday, B.C., V.S. Hinsaw, and D.A. Halvorson. 1997. Influenza: Diseases of poultry. p. 583-595. In B.W. Calnek, H.J. Barnes, C.W. Beard, L.R. Mc Dougald, and Y.M. Saif (Eds.). 86 Pudji Kurniadhi dan Suparno: Pengambilan sampel dari burung air liar untuk pengujian flu burung Foni, E. 2003. Detection of swine influenza virus by RT-PCR and standard methods. Fourth International Symposium on Emerging and Re-emerging Pig Diseases. p. 270-271. Swayne, D.E., A.S. Dennis, and W.B. Charles. 1998. Avian ifluenza. p. 150-155. In D.E. Swayne, G.R. John, W.J. Mark, E.P. James, and M.R. Willie (Eds.). A Laboratory Manual for the Isolation and Identification of Avian Pathogens. Fourth Edition. Rose Printing, Florida. Wiyono, A., R. Indriani, N.L.P.I. Dharmayanti, R. Damayanti, dan Darminto. 2004. Isolasi dan karakterisasi virus highly pathogenic avian influenza subtipe H5 dari ayam asal wabah di Indonesia. Jurnal Ilmu Ternak dan Veteriner 9: 61-71.