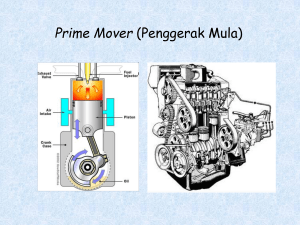
Untitled
advertisement

BAB I PENDAHULUAN A. Latar Belakang Produksi ikan di Indonesia cukup besar, baik ikan laut maupun ikan air tawar. Ikan memiliki sifat yang sangat mudah rusak selain itu kondisi penanganan pascapanen yang kurang baik juga membuat ikan menjadi cepat busuk. Kerusakan mekanis dapat terjadi akibat benturan selama penangkapan, pengangkutan, dan persiapan sebelum pengolahan (Astawan, 2003). Sebagai contoh volume limbah pengalengan ikan di Muncar, Kabupaten Banyuwangi, Jawa Timur, mencapai 50-60 ton per bulan. Sehingga perlu dilakukan pemanfaatan lebih jauh mengenai penanganan limbah ikan. Salah satunya adalah mengolahnya menjadi biodiesel. Biodiesel merupakan salah satu bahan bakar alternatif dari bahan mentah terbarukan (renewable). Biodiesel bisa digunakan dengan mudah karena dapat bercampur dengan segala komposisi dengan minyak solar. Biodiesel merupakan bahan bakar mesin diesel yang diperoleh dari minyak nabati atau lemak hewani dan dapat digunakan pada mesin diesel konvensional meskipun tanpa modifikasi (Rahayu, 2005). Lemak hewan yang biasa digunakan meliputi lemak babi, lemak ayam, lemak sapi, dan juga lemak yang berasal dari ikan (Wibisono, 2007). Pembuatan biodiesel dengan bahan baku lemak hewan belum banyak diteliti, menurut Winarno (1997) biodiesel hasil konversi trigliserida dari lemak hewan umumnya mengandung asam lemak berupa asam palmitat sekaitar 15-50% dari seluruh asam-asam lemak yang ada, sedangkan jenis lainnya sekitar 25% diantaranya asam stearat, dimana jenis asam tersebut juga terkandung dalam biodiesel dari minyak nabati. Hal ini menunjukkan lemak juga potensial sebagai bahan baku pembuatan biodiesel. Guru (2008) ilmuwan dari Turki ini membuat biodiesel dari sisa-sisa lemak hewan menggunakan dua katalis yakni H2SO4 dan NaOH 0,01 (w/w) menggunakan pereaksi metanol membutuhkan waktu 2 jam. Selanjutnya dilakukan penambahan Nikel dan Magnesium berlebih untuk meningkatkan karakteristik biodiesel. Adi Setyono (2005) telah melakukan pembuatan biodiesel dari lemak babi menggunakan 1 2 pereaksi metanol dan katalis asam sulfat. Kandungan metil ester yang diperoleh adalah metil ester palmitat, metil ester 11,12-eikosadinot, metil ester 11oktadekanoat, dan metil ester stearat. Tri Harjanti (2008) juga telah melakukan hal yang serupa namun menggunakan katalis basa natrium. Karakterisasi biodiesel yang dihasilkan memenuhi standar American Society fot Testing Materials (ASTM) dan dirjen Migas. Pembuatan biodiesel yang dilakukan oleh El-Mashad (2008) menggunakan bahan dasar dari minyak ikan salmon dengan katalis KOH 0,5% dan perbandingan metanol:minyak 9,2:1 dihasilkan konversi biodiesel 99%. Reaksi transesterifikasi dapat dikatalisis dengan katalis asam atau basa. Katalis asam yang sering digunakan adalah asam sulfat dan asam klorida. Penggunaan katalis asam membutuhkan waktu refluk yang sangat lama (48-96 jam), perbandingan mol metanol yang dibutuhkan besar (30-150:1). Sedangkan katalis basa yang sering digunakan adalah kalium hidroksida, natrium hidroksida dan karbonatnya. Aktivitas katalis basa lebih cepat dibandingkan katalis asam, katalis asam lebih korosif, sehingga katalis basa lebih disukai dan sering digunakan (Ilgen, 2007). Minyak dan metanol tidak saling melarutkan secara sempurna, sehingga dibutuhkan suhu tinggi untuk membentuk metil ester. Metanolisis minyak kedelai menggunakan katalis basa dua fasa dengan tetrahidrofuran sebagai kosolven lebih cepat dari proses dua fasa. Pembuatan biodiesel menggunakan katalis homogen basa tanpa kopelarut biasanya menggunakan temperatur sekitar 50-60 °C dan waktu reaksi sekitar 2 jam (waktunya lama) (Foon, 2004 dan Van Garpen, 2004). Kopelarut digunakan untuk membentuk satu fasa yang mana metanol yang bersifat polar dapat saling larut dengan trigliserida yang bersifat nonpolar. Eter merupakan pelarut yang bagus untuk banyak reaksi organik. Eter siklik dengan masa molar kecil saling larut dengan air dalam banyak perbandingan dan menjadi kopelarut yang bagus dalam sistem metanol/minyak. Tetrahidrofuran merupakan pilihan terbaik untuk eter siklik. Studi penggunaan kopelarut diketahui dapat meningkatkan kecepatan reaksi transesterifikasi. Pada umumnya penggunaan kopelarut meningkatkan kecepatan reaksi dengan menjadikan minyak larut dalam metanol sehingga meningkatkan kontak yang terjadi pada reaktan dan reaksi berada pada satu fase (Ilgen, 2007). 3 Beberapa contoh kopelarut yang biasa digunakan merupakan turunan dari senyawa eter yaitu Tetrahidroferon (THF), dietil eter, diisopropil eter dan metil tert-butil eter (MTBE). MTBE biasa digunakan untuk meningkatkan bilangan oktan pada bahan bakar, selain itu MTBE mudah dipisahkan dan digunakan lagi dengan metanol. Sebelumnya, Lirong Chi (1999) telah berhasil mensintesis metil ester dari minyak kedelai menggunakan kopelarut MTBE. Penelitian ini dilakukan untuk mereaksikan minyak ikan hasil dari limbah ikan menjadi biodiesel melalui reaksi transesterifikasi menggunakan katalis basa dan MTBE sebagai kopelarut. Biodiesel yang dihasilkan diidentifikasi menggunakan HNMR dan GC-MS. B. Perumusan Masalah 1. Identifikasi Masalah Beberapa faktor yang dapat mempengaruhi kecepatan reaksi transesterifikasi diantaranya adalah pengaruh air dan asam lemak bebas, perbandingan molar alkohol dan bahan mentah, temperatur dan jenis katalis. Penggunaan katalis dalam sistem ini dapat menggunakan katalis basa homogen maupun heterogen. Katalis basa homogen yang biasa digunakan adalah NaOH, KOH, dan karbonatnya. Reaksi transesterifikasi trigliserida menjadi metil ester dengan katalis NaOH membutuhkan waktu kurang lebih 2 jam dan temperatur di atas suhu kamar (50-60 °C). Waktu yang lama dan suhu yang tinggi tersebut diperlukan karena kelarutan metanol dalam minyak pada kondisi kamar tidak besar, sehingga reaksi lambat pada kondisi kamar. Upaya untuk meningkatkan kelarutan metanol dalam minyak adalah dengan penambahan kopelarut. 2. Batasan Masalah Berdasarkan identifikasi masalah tersebut, maka dibuat batasan masalah sebagai berikut : a. Minyak ikan yang digunakan berasal dari limbah usaha tepung ikan, di waduk Gajah Mungkur Wonogiri b. Katalis yang digunakan adalah NaOH sejumlah 1 % berat minyak ikan. 4 c. Kondisi dalam pembuatan biodiesel adalah sebagai berikut: 1. Perbandingan mol methanol dengan minyak 27:1. 2. Reaksi dilakukan pada suhu kamar. 3. Waktu reaksi yaitu 5, 10, 15, 20 dan 25 menit. 4. Perbandingan volume MTBE dengan minyak adalah 0,5; 1,0; 1,5; dan 2,0. 3. Rumusan Masalah Berdasarkan identifikasi masalah dan batasan masalah di atas, rumusan masalah penelitian adalah sebagai berikut : a. Bagaimana pengaruh perbandingan volume MTBE dalam pembuatan biodiesel dari minyak ikan terhadap kecepatan reaksinya? b. Bagaimana pengaruh perbandingan volume MTBE dalam pembuatan biodiesel dari minyak ikan menggunakan kopelarut MTBE pada suhu kamar terhadap kemurniannya? c. Apakah karakterisasi sifat fisik biodiesel yang dihasilkan memenuhi standar American Society for Testing Materials (ASTM) dan Dirjen Migas? C. Tujuan Penelitian Tujuan dari penelitian ini adalah sebagai berikut : 1. Mengetahui bahwa minyak dari limbah ikan dapat dimanfaatkan menjadi biodiesel melalui reaksi transesterifikasi dengan katalis basa pada suhu kamar. 2. Mempelajari pengaruh variasi jumlah kopelarut MTBE dan waktu reaksi transesterifikasi minyak ikan pada suhu kamar. 3. Mengkarakterisasi sifat fisik biodiesel yang dihasilkan berdasarkan standar American Society for Testing Materials (ASTM) dan Dirjen Migas. D. Manfaat Penelitian Manfaat dari penelitian ini adalah : 1. Memanfaatkan minyak ikan dari limbah ikan untuk produksi biodiesel sehingga dapat mengurangi dampak negatif terhadap lingkungan. 5 2. Memberi informasi tentang penggunaan MTBE sebagai kopelarut dalam pembuatan biodiesel. BAB II LANDASAN TEORI A. TINJAUAN PUSTAKA 1. Minyak Ikan Sebagai bahan pangan, ikan merupakan sumber protein, lemak, vitamin, dan mineral yang sangat baik dan prospektif. Keunggulan utama protein ikan dibandingkan dengan produk lainnya adalah kelengkapan komposisi asam amino dan kemudahannya untuk dicerna. Dibandingkan dengan negara-negara lain, konsumsi ikan per kapita per tahun di Indonesia saat ini masih tergolong rendah, yaitu 19,14 kg. Hal ini sangat disayangkan, terutama mengingat betapa besar peranan gizi ikan bagi kesehatan. Untuk mengatasi masalah rendahnya konsumsi ikan laut akibat harganya yang relatif mahal, perlu upaya pengembangan ikan air tawar (Astawan, 2003). Budidaya ikan air tawar biasa dilakukan di kolam, tambak atau karambakaramba di sekitar waduk. Namun, yang yang menjadi perhatian adalah ikan merupakan bahan pangan yang sangat mudah mengalami kerusakan karena berbagai jenis bakteri dapat menguraikan komponen gizi ikan menjadi senyawa-senyawa berbau busuk dan anyir, seperti indol, skatol, H2S, merkaptan, dan lain-lain. Sehingga pada budidaya ikan setiap harinya akan menghasilkan limbah ikan berbau busuk yang menumpuk. Limbah ikan tersebut perlu diolah untuk menjadikannya lebih bermanfaat, salah satunya adalah mengambil kandungan minyak didalamnya. Minyak ikan adalah minyak yang berasal dari jaringan ikan yang berminyak. Minyak ikan dianjurkan untuk diet kesehatan karena mengandung asam lemak omega-3, EPA (eikosapentanoat), DHA (dokosaheksanoat) yang dapat mengurangi peradangan pada tubuh. Tidak semua ikan menghasilkan asam lemak omega-3 akan tetapi hanya ikan yang mengkonsumsi mikroalga saja yang dapat menghasilkan asam lemak tersebut misalkan saja ikan herring dan ikan sarden atau ikan-ikan predator yang memangsa ikan yang yang mengandung asam lemak omega-3 seperti ikan air tawar, ikan air danau, ikan laut yang gepeng, ikan tuna dan ikan salmon dimungkinkan mengandung asam lemak omega-3 yang tinggi. 6 7 Minyak ikan mengandung asam lemak yang beragam. Kandungan asam lemak jenuh rendah sedangkan asam lemak tak jenuhnya tinggi terutama asam lemak tak jenuh rantai panjang yang mengandung 20 atau 22 atom C atau lebih. Beberapa asam ini termasuk EPA dan DHA (De Man, 1997). Asam lemak komponen beberapa minyak ikan air tawar dan ikan laut dapat dilihat pada Tabel 1. Tabel 1. Asam lemak komponen utama beberapa minyak ikan air laut dan air tawar. Asam lemak Ikan 14:0 18:0 18:1 22:1 18:2ω 18:3ω 20:4ω 20:5ω 22:5ω 6 3 3 3 3 Haring 6.4 0,9 12,7 20,8 1,1 0,6 0,3 8,4 0,8 Turbot 6,5 0,9 17,4 17,8 0,5 0,2 0,1 3,0 0,6 Ikan 6,7 1,9 29,0 14,8 0,7 0,2 0,3 1,4 0,5 Pedang 1,4 3,8 13,8 1,0 0,7 0,1 2,5 17,0 1,3 Cod 4,3 2,4 12,2 Tr 0,3 2,0 4,0 11,9 10,6 Sole 0,8 9,0 12,3 5,0 Tr Tr 1,4 13,0 2,5 Halibut 3,1 4,3 28,3 - 13,2 2,3 2,5 3,2 - Carp 2,7 8,3 18,4 - 7,3 1,6 1,7 5,8 Tr Trout 1,0 3,9 29,7 - 10,0 0,5 0,8 0,2 0,2 lele Tr = Sesepora Sumber: De Man, 1997 Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid, yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5), kloroform (CHCl3), benzena dan hidrokarbon lainnya. Lemak dan minyak dapat larut dalam pelarut tersebut karena mempunyai polaritas yang sama dengan pelarut tersebut (Herlina, 2002). Lemak dan minyak adalah trigliserida dan triasilgliserol. Trigliserida alami adalah triester dari asam lemak berantai panjang (C12 sampai C24) dan gliserol, merupakan penyusun utama lemak hewan dan minyak nabati. Trigliserida juga banyak diubah menjadi monogliserida dan digliserida, karena baik monogliserida dan digliserida luas penggunaannya sebagai bahan pengemulsi. Oleh 8 karena itu trigliserida melalui reaksi transesterifikasi dengan gliserol diubah menjadi monogliserida dan digliserida dengan bantuan katalis seperti natrium metoksida dan basa lewis lainnya. Hanya saja proses ini menghasilkan campuran yang terdiri atas 40-80% monogliserida, 30-40% digliserida 5-10% trigliserida, 0,2-9% asam lemak bebas dan 4-8% gliserol (Juliati, 2002). Asam-asam lemak yang ditemukan di alam biasanya merupakan asam-asam monokarboksilat dengan rantai yang tidak bercabang dan mempunyai jumlah atom genap. Asam-asam lemak yang ditemukan di alam dapat dibagi menjadi dua golongan yaitu asam lemak jenuh dan asam lemak tidak jenuh. Asam-asam lemak tidak jenuh berbeda dalam jumlah dan posisi ikatan rangkapnya, dan berbeda dengan asam lemak jenuh dalam bentuk molekul keseluruhannya. Asam lemak tak jenuh biasanya terdapat dalam bentuk cis karena itu molekul akan bengkok pada ikatan rangkap, walaupun ada juga asam lemak tidak jenuh dalam bentuk trans (Padley, 1994). Lemak hewani mengandung banyak sterol yang disebut kolesterol, sedangkan lemak nabati mengandung fitosterol dan lebih banyak mengandung asam lemak tak jenuh sehingga umumnya berbentuk cair. Lemak hewani ada yang berbentuk padat yang biasanya berasal dari lemak hewan darat seperti lemak susu, lemak sapi, lemak babi. Lemak hewan laut seperti minyak ikan paus, minyak ikan Cod, minyak ikan herring berbentuk cair dan disebut minyak. Bahan pangan hampir semua banyak mengandung lemak dan minyak, terutama bahan yang berasal dari hewan (Winarno, 1997). Asam-asam lemak tak jenuh yang terdapat pada tumbuhan dan hewan dapat dilihat pada Tabel 2. Tabel 2. Asam-asam lemak tak jenuh yang terdapat pada tumbuhan dan hewan Nama Sistematis Nama Trivial Shorthand 9,12-oktadekadinoat Linoleat 18:2 (n-6) 6,9,12-oktadekatrinoat Gamma-linoleat 18:3 (n-6) 9,12,15-oktadekatrinoat Alfa-linoleat 18:3 (n-3) 5,8,11,14-eikosatetranoat Arachidonat 20:4 (n-6) 5,8,11,14,17-eikosapentanoat EPA 20:5 (n-3) 4,7,10,13,16,19-dokosaheksanoat DHA 22:5 (n-3) 9 Untuk asam lemak jenuh pada minyak ikan biasanya adalah asam miristat dan asam palmitat dengan asam stearat yang jumlahnya sangat sedikit. Kadar asam lemak polienoat yang tinggi menyebabkan mimyak ikan rentan terhadap autooksidasi (De Man, 1997). Asam-asam lemak jenuh yang terdapat pada tumbuhan dan hewan dapat dilihat pada tabel 3. Tabel.3 Asam-asam lemak jenuh yang terdapat pada tumbuhan dan hewan. Nama Sistematis Nama Trivial Shorthand Etanoat Asetat 2:0 Butanoat Butirat 4:0 Heksanoat Kaproat 6:0 Oktanoat Kaprilat 8:0 Dekanoat Kaprat 10:0 Dodekanoat Laurat 12:0 Tetradekanoat Miristat 14:0 Heksadekanoat Palmitat 16:0 Oktadekanoat Stearat 18:0 Eikosanoat Arachidat 20:0 Dokosanoat Behenat 22:0 2. Biodiesel Biodiesel merupakan bahan bakar alternatif dari bahan mentah terbaharukan (renewable) selain bahan bakar diesel dari minyak bumi. Biodiesel tersusun dari berbagai macam ester asam lemak yang dapat diproduksi dari minyak-minyak tumbuhan seperti minyak sawit (palm oil), minyak kelapa, minyak jarak pagar, minyak biji kapok randu, dan masih ada lebih dari 30 macam tumbuhan Indonesia yang potensial untuk dijadikan sumber energi bentuk cair ini. (Prakoso, 2003). Selain minyak nabati, biodiesel juga dapat dibuat dari lemak hewani seperti lemak babi (Harjanti, 2008). Biodiesel dikenal sebagai produk yang ramah lingkungan, tidak mencemari udara, mudah terbiodegradasi, dan berasal dari bahan baku yang dapat diperbaharui. 10 Pada umumnya biodiesel disintesis dari ester asam lemak dengan rantai karbon antara C6-C22. Biodiesel bisa digunakan dengan mudah karena dapat bercampur dengan segala komposisi dengan minyak solar, mempunyai sifat-sifat fisik yang mirip dengan solar biasa sehingga dapat diaplikasikan langsung untuk mesin-mesin diesel yang ada hampir tanpa modifikasi. (Prakoso, 2003) Dibanding bahan bakar solar, biodiesel memiliki beberapa keunggulan, yaitu: § Biodiesel diproduksi dari bahan pertanian, sehingga dapat diperbaharui. § Biodiesel memiliki nilai cetane yang tinggi, volatile rendah, dan bebas sulfur. § Ramah lingkungan karena tidak ada emisi SOx. § Menurunkan keausan ruang piston karena sifat pelumasan bahan bakar yang bagus (kemampuan untuk melumasi mesin dan sistem bahan bakar). § Aman dalam penyimpanan dan transportasi karena tidak mengandung racun. § Meningkatkan nilai produk pertanian. § Biodegradabel: jauh lebih mudah terurai oleh mikroorganisme dibandingkan minyak mineral. Pencemaran akibat tumpahnya biodiesel pada tanah dan air bisa teratasi secara alami (Park, 2008). Oleh karena itu, pengembangan biodiesel di Indonesia dan dunia menjadi sangat penting seiring dengan semakin menurunnya cadangan bahan bakar diesel berbasis minyak bumi, isu pemanasan global, serta isu tentang polusi lingkungan. Pengembangan biodiesel didunia sudah dilakukan sejak tahun 1980-an sehingga pada saat ini beberapa bagian dunia telah dilakukan komersialisasi bahan bakar ramah lingkungan ini. Adapun pembuatan biodiesel dari minyak yang berasam lemak bebas tinggi ini menggunakan reaksi transesterifikasi seperti pembuatan biodiesel pada umumnya dengan pretreatment untuk menurunkan angka asam pada minyak tersebut. Biodiesel dapat dibuat dari minyak berasam lemak bebas tinggi dengan proses konversi trigliserida menjadi metil atau etil ester dengan proses yang disebut transesterifikasi. Proses transesterifikasi mereaksikan alkohol dengan minyak untuk memutuskan tiga rantai gugus ester dari setiap cabang trigliserida. Reaksi ini memerlukan panas dan katalis basa untuk mencapai derajat konversi tinggi dari minyak menjadi produk 11 yang terdiri dari biodiesel dan gliserin. (Prakoso,2008). Tahapan reaksi dalam pembuatan biodiesel adalah sebagai berikut: a. Esterifikasi Esterifikasi adalah tahap konversi dari asam lemak bebas menjadi ester. Esterifikasi mereaksikan minyak lemak dengan alkohol. Katalis-katalis yang cocok adalah zat berkarakter asam kuat seperti asam sulfat, asam sulfonat organik atau resin penukar kation. Asam kuat merupakan katalis-katalis yang biasa terpilih dalam praktek industrial (Soerawidjaja, 2006). Untuk mendorong agar reaksi bisa berlangsung ke konversi yang sempurna pada temperatur rendah (misalnya paling tinggi 120 °C), reaktan metanol harus ditambahkan dalam jumlah yang sangat berlebih (biasanya lebih besar dari 10 kali nisbah stoikhiometrik) dan air produk ikutan reaksi harus disingkirkan dari fasa reaksi, yaitu fasa minyak. Melalui kombinasi-kombinasi yang tepat dari kondisi-kondisi reaksi dan metode penyingkiran air, konversi sempurna asam-asam lemak ke ester metilnya dapat dituntaskan dalam waktu 1 sampai beberapa jam. Reaksi esterifikasi dapat dilihat pada Gambar 1. RCOOH + Asam lemak CH OH RCOOCH + H O methanol metil ester 3 3 2 Gambar 1. Reaksi esterifikasi dari asam lemak menjadi metil ester Esterifikasi biasa dilakukan untuk membuat biodiesel dari minyak berkadar asam lemak bebas tinggi (berangka-asam ≥ 5 mg-KOH/g). Pada tahap ini, asam lemak bebas akan dikonversikan menjadi metil ester. Tahap esterifikasi biasa diikuti dengan tahap transesterfikasi. Namun sebelum produk esterifikasi diumpankan ke tahap transesterifikasi, air dan bagian terbesar katalis asam yang dikandungnya harus disingkirkan terlebih dahulu. b. Transesterifikasi Transesterifikasi (biasa disebut dengan alkoholisis) adalah tahap konversi dari trigliserida menjadi alkil ester, melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Di antara alkohol-alkohol monohidrik yang menjadi kandidat sumber/pemasok gugus alkil, metanol adalah yang paling umum digunakan, 12 karena harganya murah dan reaktifitasnya paling tinggi (sehingga reaksi disebut metanolisis). Jadi, di sebagian besar dunia ini, biodiesel praktis identik dengan ester metil asam-asam lemak (Fatty Acids Metil Ester, FAME). Transesterifikasi juga menggunakan katalis dalam reaksinya. Tanpa adanya katalis, konversi yang dihasilkan maksimum namun reaksi berjalan dengan lambat (Mittlebatch, 2004). Katalis yang biasa digunakan pada reaksi transesterifikasi adalah katalis basa, karena katalis ini dapat mempercepat reaksi. Reaksi transesterifikasi dapat dilihat pada Gambar 2 (Schuchardt, 1998). O H 2C O C HC O C H 2C O C O O O R1 R2 (katalis) NaOH H2C OH HC OH H2C OH + 3 CH3OH R3 Trigliserida methanol + H3C O C H3C O C H3C O C gliserol O O R1 R2 R3 metil ester Gambar 2. Reaksi Transesterifikasi Dimana mekanisme reaksi yang terjadi dalam reaksi diatas dapat dilihat pada gambar 3. CH3O Na + H2O NaOH + CH3OH O O R C OR' R OCH3 C O OR' R C OCH3 OR' OCH3 OR' + H2O OH + Na R'OH + OH NaOH Gambar 3. Mekanisme reaksi transesterifikasi dalam katalis basa Hal-hal yang mempengaruhi reaksi transesterifikasi perlu diperhatikan agar didapatkan produk biodiesel dengan jumlah yang maksimum. Beberapa kondisi 13 reaksi yang mempengaruhi konversi serta perolehan biodiesel melalui transesterifikasi adalah sebagai berikut (Freedman, 1984): 1) Pengaruh air dan asam lemak bebas Minyak yang akan ditransesterifikasi harus memiliki angka asam yang lebih kecil dari 1. Banyak peneliti yang menyarankan agar kandungan asam lemak bebas lebih kecil dari 0,5% (<0,5%). Selain itu, semua bahan yang akan digunakan harus bebas dari air. Karena air akan bereaksi dengan katalis, sehingga jumlah katalis menjadi berkurang. Katalis harus terhindar dari kontak dengan udara agar tidak mengalami reaksi dengan uap air dan karbon dioksida. 2) Pengaruh perbandingan molar alkohol dengan bahan mentah Secara stoikiometri, jumlah alkohol yang dibutuhkan untuk reaksi adalah 3 mol untuk setiap 1 mol trigliserida untuk memperoleh 3 mol alkil ester dan 1 mol gliserol. Perbandingan alkohol dengan minyak nabati 4,8:1 dapat menghasilkan konversi 98%. Secara umum ditunjukkan bahwa semakin banyak jumlah alkohol yang digunakan, maka konversi yang diperoleh juga akan semakin bertambah. Pada rasio molar 6:1, setelah 1 jam konversi yang dihasilkan adalah 98-99%, sedangkan pada 3:1 adalah 74-89%. Nilai perbandingan yang terbaik adalah 6:1 karena dapat memberikan konversi yang maksimum. 3) Pengaruh jenis alkohol Pada rasio 6:1, metanol akan memberikan perolehan ester yang tertinggi dibandingkan dengaan menggunakan etanol atau butanol. 4) Pengaruh jenis katalis Alkali katalis (katalis basa) akan mempercepat reaksi transesterifikasi bila dibandingkan dengan katalis asam. Katalis basa yang paling populer untuk reaksi transesterifikasi adalah natrium hidroksida (NaOH), kalium hidroksida (KOH), natrium metoksida (NaOCH3), dan kalium metoksida (KOCH3). Katalis sejati bagi reaksi sebenarnya adalah ion metilat (metoksida). Reaksi transesterifikasi akan menghasilkan konversi yang maksimum dengan jumlah katalis 0,5-1,5%-b minyak. 5) Pengaruh temperatur Reaksi transesterifikasi dapat dilakukan pada temperatur 30 – 65 °C (titik didih metanol sekitar 65 °C). Semakin tinggi temperatur, konversi yang diperoleh 14 akan semakin tinggi untuk waktu yang lebih singkat. Untuk waktu 6 menit, pada temperatur 60 oC konversi telah mencapai 94% sedangkan pada 45 oC yaitu 87% dan pada 32 oC yaitu 64%. Temperatur yang rendah akan menghasilkan konversi yang lebih tinggi namun dengan waktu reaksi yang lebih lama (Destianna, 2007). Suatu teknik pembuatan biodiesel hanya akan berguna apabila produk yang dihasilkannya sesuai dengan spesifikasi (syarat mutu) yang telah ditetapkan dan berlaku di daerah pemasaran biodiesel tersebut. Persyaratan mutu biodiesel di Indonesia sudah dibakukan dalam SNI-04-7182-2006, yang telah disahkan dan diterbitkan oleh Badan Standarisasi Nasional (BSN) (Soerawidjaja, 2006). 3. Metil Tert-Butil Eter (MTBE) Metil tert-butil eter juga dikenal dengan nama lain metil tersier butil eter dan MTBE. MTBE merupaka senyawa kimia dengan rumus molekul C5H12O. MTBE memiliki sifat volatil (mudah menguap), mudah terbakar dan berwarna jernih serta mudah larut dalam air. Hal tersebut dapat dilihat dari sifat fisik senyawa MTBE pada Tabel 4. Tabel 4. Sifat senyawa MTBE Keterangan Rumus molekul C5H12O Massa molekuler 88.15 g/mol Berat jenis 0.7404 g/cm³ Titik beku -109 °C, 164 K, -164 °F Titik Didih 55.2 °C, 328 K, 131 °F MTBE dibuat dengan mereaksikan metanol dengan metil propana. Reaksi ini ditemukan di Amerika serikat pada tahun 1994. reaksi dapat dilihat pada gambar 4 dibawah ini. 15 CH3OH + CH3C(CH3)=CH2 (CH3)3C-O-CH3 Gambar 4. Reaksi pembuatan MTBE MTBE merupakan zat aditif pada bahan bakar yang digunakan sebagai donor oksigen dan dapat meningkatkan angka oktan. Namun MTBE ditemukan dapat mudah memberikan polusi dalam jumlah besar dalam air tanah jika terjadi kebocoran pada tangki bahan bakar karena sifatnya yang mudah larut dalam air. MTBE juga digunakan dalam kimia organik sebagai pelarut dengan harga yang relafit tidak mahal jika dibandingkan dengan dietil eter yang memiliki titik didih tinggi dan sulit larut dalam air (Putrajaya, 2008). Sebagai kopelarut, MTBE memiliki keuntungan yang lebih dibandingkan senyawa-senyawa eter yang lain. MTBE memiliki kecenderungan lebih rendah dalam membentuk senyawa organik peroksida yang mudah meledak. Pada kondisi keadaan botol yang terbuka, dietil eter dan THF berada pada level yang berbahaya sebagai senyawa peroksida jika dibiarkan selama 1 bulan, berbeda dengan MTBE yang relatif aman meskipun dibiarkan selama 1 tahun. Karena alasan titik didih yang tinggi ini, MTBE digunakan sebagai pelarut dalam skala industri karena lebih aman jika dibandingkan dengan dietil eter, THF, atau eter lain yang lebih sulit dan mahal. Walaupun MTBE biasa digunakan dalam bidang industri, namun penggunaannya sebagai pelarut dalam bidang pendidikan masih jarang sebagai contoh penggunaan volume MTBE dalam penelitian lebih sedikit, padahal MTBE bertujuan mengurangi resiko berbahaya dibanding eter lain, dan juga penggunaan MTBE sebagai pelarut sangat jarang ditemukan pada literatur prosedur sintetik sebagai pelarut kimia (Fischer, 2005 ). Dalam pembuatan biodisel studi penggunaan kopelarut diketahui dapat meningkatkan kecepatan reaksi transesterifikasi (Ilgen, 2007). Namun kopelarut yang digunakan harus dapat larut dalam kepolaran metanol dan triglisireda yang bersifat nonpolar serta pelarut harus bersifat inert. Beberapa contoh pelarut yang biasa digunakan merupakan turunan dari senyawa eter yaitu Tetrahidroferon (THF), 1,4-dioksan, dietil eter, diisopropil eter dan metil tert-butil eter (MTBE). MTBE biasa digunakan untuk meningkatkan bilangan oktan pada bahan bakar, selain itu 16 MTBE mudah di pisahkan dan digunakan lagi dengan metanol. MTBE terbukti dapat digunakan sebagai kopelarut dalam reaksi transesterifikasi minyak kedelai (Chi, 1999). 4. Karakterisasi Biodiesel a. Kromatografi Gas-Spektroskopi Massa (GC-MS) Kromatografi adalah salah satu metode pemisahan senyawa untuk mendapatkan senyawa murni dari senyawa campuran. Pemisahan didasarkan pada perbedaan distribusi (migrasi) zat dalam dua fasa yang berbeda yaitu fasa diam dan fasa gerak. Fasa diam biasanya berupa padatan atau cairan yang tertapis (percolated) pada padatan pendukung (solid support), sedangkan fasa gerak dapat berupa zat cair atau gas. Perbedaan interaksi senyawa terhadap senyawa lain (zat pada fasa gerak maupun pada fasa diam) menyebabkan senyawa tersebut berbeda dalam hal distribusinya dalam fasa gerak maupun dalam fasa diam. Distribusi senyawa campuran yang terserap dalam fasa diam dan fasa gerak merupakan proses kesetimbangan. Kromatografi gas-spektroskopi massa merupakan gabungan dari kromatografi gas yang menghasilkan pemisahan dari komponen-komponen dalam campuran dan spektroskopi massa yang merupakan alat untuk mengetahui berat senyawa dari setiap puncak kromatogram. Pada metode ini komponen-komponen dalam sampel dipisahkan oleh kromatografi gas dan hasil pemisahan dianalisis oleh spektroskopi massa. Metode ini digunakan untuk mengidentifikasi sampel campuran dari beberapa komponen. Puncak-puncak kromatogram memberikan informasi jumlah komponen yang ada dalam sampel dan spektra dari spektroskopi massa memberikan kunci-kunci penting dalam proses identifikasi senyawa. Prinsip dari instrumen ini adalah menguapkan senyawa organik dan mengionkan uapnya dalam spektroskopi, molekul-molekul organik ditembak dengan berkas elektron dan diubah menjadi ion-ion bermuatan positif (ion molekul) yang dapat dipecah menjadi ion-ion yang lebih kecil. Molekul organik mengalami proses pelepasan satu elektron menghasilkan ion radikal yang mengandung satu elektron tidak berpasangan. Ion-ion radikal ini akan dipisahkan dalam medan magnet akan 17 menimbulkan arus ion pada kolektor yang sebanding dengan limpahan relatifnya. Spektra massa merupakan gambar antara limpahan relatif lawan perbandingan massa/muatan (m/z) (McLafferty, 1988). Spektra massa biasanya dibuat dari massa rendah ke massa tinggi. Cara penyajian yang jelas dari puncak-puncak utama dapat diperoleh dengan membuat harga mass/muatan (m/z) terhadap kelimpahan relatif. Kelimpahan tersebut disebut puncak dasar (base peak) dari spektra dan dinyatakan sebagai 100%. Puncak-puncak lain mempunyai harga relatif terhadap puncak dasar. Dengan data tersebut dapat diperkirakan bagaimana struktur molekul awal dari senyawa yang dianalisis (Cresswell, 1982). Kromatografi gas-spektroskopi massa ini biasa digunakan untuk analisis kualitatif senyawa organik yang pada umumnya bersifat dapat diuapkan. Campuran metil ester hasil transesterifikasi minyak nabati memenuhi kriteria ini sehingga dapat dianalisis dengan kromatografi gas-spektroskopi massa. Pemisahan yang dihasilkan dari setiap jenis senyawa yang dianalisis bersifat khas untuk tiap senyawa. Demikian juga untuk senyawa-senyawa metil ester. Ion-ion pecahan dari metil ester diakibatkan penataan ulang hidrogen dan pecahan satu ikatan yang dipisahkan dari gugus C=O. b. Hidrogen Nuclear Magnetic Resonance (1HNMR) Partikel dari atom (elektron-elektron, proton-proton, neutron-neutron) dapat berputar pada porosnya. Di beberapa atom seperti 12 C, perputarannya saling berpasangan dan berlawanan satu sama lain jadi inti dari atom tidak memiliki spin pelindung. Akan tetapi di beberapa atom seperti 1H, dan 13C intinya hanya memiliki sebuah pelindung. Saat inti berada dalam medan magnet, populasi terinisiasi dari tingkatan energi ditentukan oleh termodinamikanya yang didiskripsikan oleh distribusi Boltzman. Sebuah inti dengan spin ½ dalam suatu medan magnet dimana inti ini berada dalam tingkat energi yang lebih rendah. Inti tersebut akan berputar pada porosnya. Ketika diberi medan magnet, maka pusat rotasi akan terpresisi mengelilingi medan 18 magnet. Jika energi magnet diserap oleh inti maka sudut presisi akan berubah dan menyebabkan perputaran spin berlawanan arah. Medan magnet pada inti tidaklah sama dengan medan magnet yang digunakan, elektron-elektron disekeliling inti melindunginya dari medan yang ada. Perbedaan antara medan magnet yang dipakai dengan medan magnet inti disebut sebagai perisai inti. Medan magnet yang diberikan akan berpengaruh terhadap pergeseran kimia (chemical shift) karena proton yang memiliki banyak perisai (shielding) akan semakin sedikit menerima medan magnet yang diberikan. Efek pergeseran kimia adalah perbedaan frekuensi absorbsi proton akibat perbedaan lokasi letak atom terikat. Atom C yang semakin terlindung akan mengalami pergeseran kimia semakin ke kanan atau semakin terperisai sehingga spektra yang terbentuk akan semakin mendekati TMS (Tetra metil silan) yang digunakan sebagai standar. Puncak spektra 1HNMR akan mengalami pemecahan dipengaruhi oleh jumlah atom H tetangga. Jika tidak terdapat atom H maka disebut singlet yang berarti tidak terjadi pemecahan puncak. Satu atom H disebut duplet dengan pemecahan puncak sebanyak 2 puncak. Demikian juga untuk triplet dan kuartet menunjukkan pemecahan puncak sebanyak 3 dan 4 (Skoog, 1997). Untuk mengetahui persentase konversi metil ester yang diperoleh digunakan 1 H-NMR. Nilai konversi metil ester (yang dinyatakan sebagai konsentrasi metil ester) ditentukan dengan rumus: C ME (%) = 100 x 5 I ME 5 I ME + 9 I TAG Keterangan: CME = konversi metil ester, % IME = nilai integrasi puncak metil ester, %, dan ITAG = nilai integrasi puncak triasilgliserol, %. Faktor 5 dan 9 adalah jumlah proton yang terdapat pada gliseril dalam molekul trigliserida mempunyai 5 proton dan tiga molekul metil ester yang dihasilkan dari satu molekul trigliserida mempunyai 9 proton (Knothe, 2000). 19 c. American Society for Testing Materials (ASTM) Uji bahan bakar yang dilakukan di laboratorium sebagian bersifat fisis dan sebagian lainnya bersifat kimia. Agar dapat dibuat duplikat uji, maka dalam uji-uji diperlukan alat-alat baku dan prosedur-prosedur baku. Komite D-2 American Society for Testing Materials menerbitkan suatu publikasi tahunan Annual Book of ASTM Standards yang memuat secara rinci mengenai prosedur-prosedur baku dan alat-alat baku uji bahan baker. Disamping itu, prosedur-prosedur baku dan alat-alat baku uji minyak bumi dan produknya dapat juga diperoleh dari Standard Methods and Testing petroleum and Its products, suatu publikasi tahunan dari The Institut of Petroleum. Sifat biodiesel komersial tergantung pada pemurnian dan sifat dasar minyak yang dapat diketahui menggunakan ASTM. Beberapa metode ASTM yang digunakan sebagai standar sifat fisik biodiesel disajikan dalam Tabel 5. Tabel 5. Beberapa Standar Parameter Sifat Fisik Biodiesel Parameter 1. Dirjen Migas Specific Gravity at 60/60 oF Metode ASTM ASTM Standar D 1298 Tidak diatur Viscosity Kinematic at 40 oC, mm/s D 445 1,9 – 6,0 2,3 – 6,0 Flash Point P.M C.C., oC D 93 Min. 130 Min. 100 Cloud Point D 97 Maks. 26 Maks. 26 Copperstrip Corrosion (3 hrs/50 oC) D 130 Maks. No. 3 Maks. No. 3 Conradson Carbon Residue, % wt. D 189 Maks. 0,1 Maks. 0,1 Water Content, % vol. D 95 Maks. 0,05 Maks. 0,05 Sediment, % wt. D 473 Maks. 0,05 Maks. 0,05 0,840– 0,920 Berat jenis (specific grafity) Specific grafity didefinisikan sebagai perbandingan berat dari sejumlah volume minyak bakar terhadap berat air untuk volume yang sama pada suhu tertentu. 20 Densitas bahan bakar relatif terhadap air, disebut specific grafity. Specific grafity air ditentukan sama dengan 1. karena specific grafity tidak memiliki perbandingan maka tidak memiliki satuan. Specific grafity digunakan dalam perhitungan yang melibatkan berat dan volume. Berat jenis minyak dapat ditentukan dengan beberapa macam cara, antara lain dengan menggunakan cara hidrometer (ASTM D 1298-85) yang umumnya dikenakan pada minyak mentah dan produknya yang berupa cairan dan yang mempunyai tekanan uap Red kurang dari 179 kPa. Pada dasarnya uji ini dilakukan dengan menempatkan hidrometer yang mempunyai skala berat jenis atau gravitasi API pada sampel yang diuji yang mempunyai suhu tertentu dan selanjutnya dibaca skala hidrometer yang dipotong oleh permukaan sampel sebagai berat jenis atau gravitasi API sampel pada suhu yang berlaku. Harga yang diperoleh harus dikembalikan ke suhu 15 oC (60 oF), dengan menggunakan Petroleum Measurement Tables (ASTM D 1250-80). Uji tidak harus dilakukan pada suhu 15 oC (60 oF), tetapi disesuaikan dengan keadaan sampel. Namun pengukuran yang paling teliti adalah apabila suhu sampel 15 oC (60 oF). Gambar alat uji dapat dilihat pada Gambar 5. Gambar 5. Penentuan berat jenis dengan cara hidrometer (Hardjono,2001) 2. Kekentalan kinematis (viscosity kinematic) Kekentalan kinematis minyak bumi dan produknya dapat ditentukan dengan viskometer. Ada bermacam-macam viskometer tipe pipet yang dapat digunakan untuk menentukan kekentalan kinematis. Pada dasarnya pengukuran kekentalan kinematis produk minyak adalah mengukur waktu alir produk minyak yang mempunyai volume tertentu melalui pipa kapiler viskometer pada suhu tertentu. Selanjutnya kekentalan kinematis sampel dapat dihitung dengan persamaan : 21 v=Ct dimana v adalah kekentalan kinematis dan centistoke. T adalah waktu alir dalam detik dan C adalah tetapan viskometer. Apabila tetapan viskometer belum diketahui, maka perlu dilakukan kalibrasi dengan menggunakan cairan baku. Alat uji viskometer dapat diliha pada Gambar 6. Gambar 6. Viskometer pipa kapiler 3. Titik Nyala (flash point) Titik nyala adalah suhu terendah dimana uap minyak dalam campurannya dengan udara akan menyala kalau dikenai nyala uji (test flame) pada kondisi tertentu.Ada tiga macam alat uji yang dapat digunakan untuk menentukan titik nyala bahan bakar, yaitu a) Alat uji cawan terbuka Cleveland (ASTM D 92-90) dapat digunakan untuk menentukan titik nyala minyak, kecuali minyak bakar yang mempunyai titik nyala cawan terbuka dibawah 79 oC (175 oF). b) Alat uji cawan tertutup Pensky-Martens (ASTM D 93-80) yang dapat digunakan untuk menentukan titik nyala minyak bakar, minyak pelumas, dan suspensi padatan. c) Alat uji cawan tertutup Abel, yang dapat digunakan untuk menentukan titik nyala produk minyak yang mempunyai titik nyala antara -18 oC (0 oF ) dan 71 oC (160 oF). Gambar alat uji titik nyala dapat dilihat pada Gambar 7. 22 Gambar 7. Alat uji titik nyala cawan tertutup Pensky-Martens (ASTM D 93-80) 4. Titik kabut (cloud point) Cloud point suatu bahan bakar yang sudah terdestilasi adalah temperatur dimana bahan bakar menjadi berkabut karena kehadiran dari kristal-kristal lilin. Cloud point sangat dipengaruhi oleh harga ssalinitas, bila salinitas tinggi harga cloud point cenderung turun. Berikut dapat dilihat alat uji untuk penentuan titik kabut pada Gambar 8. Gambar 8. Alat uji penentuan titik kabut 5. Korosi terhadap tembaga (copperstrip corrosion) Metode ini digunakan untuk deteksi terhadap korosifitas lempeng tembaga pada aviation gasoline, bahan bakar turbin, automotif gasolin, atau hidrokarbon lain yang memiliki tekanan uap Reid tidak lebih besar dari 18 psi (124 Pa) seperti kerosin, bahan bakar diesel, minyak pelumas dan produk petroleum yang lain. Pengujian ini dilakukan dengan memasukkan lempeng tembaga dalam sejumlah sampel minyak, kemudian dipanaskan dan pada waktu tertentu material akan diujikan. Pada akhirnya lempeng tembaga dipisahkan, dicuci dan dibandingkan 23 dengan standar ASTM Copper Strip Corrosion. Berikut ini disajikan klasifikasi pengujian pada lempeng tembaga pada Tabel 6. Tabel 6. Klasifikasi Uji Korosifitas pada Lempeng Tembaga No. Klasifikasi Penggolongan korosifitas jenis korosifitas tipe 1. 1 tidak ada bercak a ada bercak dan memudar b a b c 2. 6. 2 3. 3 Bercak gelap 4. 4 karatan d e a b a b c Penggambaran / Kenampakkan Orange terang, mengkilap, hampir sama halnya baru Orange gelap Merah anggur bordeaux Lembayung muda Beraneka warna Dengan Lembayung muda Yang biru atau perak atau kedua-duanya perak seperti kuningan atau emas Warna merah keungu-unguan Beraneka warna mempertunjukkan hijau dan merah tetapi tidak kelabu Gelap kelabu transparan Grafit atau hitam tanpa kilau Glossery dan hitam pekat Residu karbon conradson (conradson carbon residue) Metode D189 ini digunakan untuk menentukan sejumlah residu karbon setelah proses evaporasi dan pirolisis pada minyak, selain itu juga dapat memberikan indikasi kecenderungan coke-forming. Metode ini umumnya digunakan pada produk petroleum nonvolatil, dimana sebagian minyak terdekomposisi pada tekanan atmosfer saat destilasi. Produk petroleum yang mengandung ash-forming dapat ditentukan dengan metode D482 atau metode IP4 namun akan memberikan hasil yang tidak tepat pada tingginya residu karbon. Perhitungan residu karbon pada sampel atau pada 10 % residu terdestilasi adalah: Residu karbon = (A x 100)/ W Keterangan: A = massa residu karbon (gr) W = massa sampel (gr) 24 7. Kandungan air (water content) Metode ASTM D95 ini bertujuan untuk menentukan kandungan air pada petroleum, serta material-material bitumen yang lain menggunakan metode destilasi. Pengukuran pada emulsi bitumen merujuk pada metode ASTM D244 yang sejalan dengan ASTM D4006. Air yang terkandung dalam bahan bakar menyebabkan penurunan mutu bahan bakar karena: - menurunkan nilai kalor dan memerlukan sejumlah kalor untuk penguapan, - menurunkan titik nyala, - memperlambat proses pembakaran, dan menambah volume gas buang. Keadaan tersebut mengakibatkan: - pengurangan efisiensi ketel uap ataupun efisiensi motor bakar, - penambahan biaya perawatan ketel, - menambah biaya transportasi, merusak saluran bahan bakar cair (“fuel line”) dan ruang bakar. Alat uji kandungan air dapat dilihat pada Gambar 9. Gambar 9. Alat uji kandungan air menggunakan metode destilasi Perhitungan kandungan air dalam sampel dinyatakan dalam % berat atau % volume, dengan rumus sebagai berikut: Air (%) = V / W x 100 Keterangan: V = volume air pada tabung trap 25 W = berat (atau volume sampel) Jika ada material yang larut dalam air maka diukur sebagai kandungan air. 8. Kandungan sedimen Metode ASTM D473 ini digunakan untuk menentukan kandungan sedimen pada minyak murni atau bahan bakar dengan metode ekstraksi menggunakan toluena panas. Alat uji kandungan sedimen dapat di lihat pada Gambar 10. Gambar 10. Alat uji kandungan sedimen dengan metode ekstraksi Uji sampel minyak dalam tabung refraktori di ekstraksi menggunakan toluena panas hingga diperoleh residu konstan. Massa dari residu diperoleh dalam persen menggunakan rumus % massa = massa sedimen x 100 massa sampel awal Pada umumnya uji minyak bumi dan produknya dapat dikerjakan dengan cepat, mudah dibuat duplikat oleh teknisi laboratorium biasa dan hasil ujinya dapat diinterpretasikan sebagai fungsi kinerja produk selama penggunaan. Pengertian duplikat hasil uji tidaklah berarti bahwa uji yang kedua hasilnya harus persis sama dengan hasil uji yang pertama. Hasil uji kedua sudah boleh dikatakan sama dengan hasil uji pertama apabila telah memenuhi harga-harga repitibilitas dan reprodusibilitas yang diisyaratkan untuk setiap uji. Repitibilitas adalah hal diulanginya kembali sesuatu uji apabila hasil kedua uji yang dilakukan oleh seorang melampaui harga yang telah ditetapkan. Sedangka nreprodusibilitas adalah hal 26 diulanginya kembali sesuatu apabila hasil kedua uji yang dilakukan oleh dua orang melampaui harga yang ditetapkan (Hardjono, 2001). B. Kerangka Pemikiran Minyak ikan memiliki kandungan trigliserida yang dapat diubah menjadi metil ester melalui reaksi transesterifikasi. Kandungan asam lemak yang tinggi pada minyak ikan dapat menghambat reaksi pembentukan metil ester karena terbentuknya banyak sabun. Untuk mengatasinya maka dilakukan reaksi esterifikasi yang bertujuan untuk mengkonversi asam lemak bebas menjadi alkil ester, sehingga pada reaksi transesterifikasi akan diperoleh biodiesel yang lebih banyak dan terbentuk sabun yang lebih sedikit. Reaksi transesterifikasi dengan katalis basa seperti KOH dan NaOH membutuhkan waktu kurang lebih 2 jam dan temperatur diatas suhu kamar (50-60 °C). Laju reaksi dalam reaksi transesterifikasi tersebut cukup lambat, hal tersebut disebabkan karena kelarutan metanol dalam minyak yang rendah. Laju reaksi dalam reaksi transesterifikasi sebanding dengan tingkat tumbukan antar molekulnya, dimana semakin tinggi tingkat tumbukan maka laju raksi akan semakin cepat. Besarnya tingkat tumbukan ini dipengaruhi oleh energi yang diberikan salah satunya melalui temperatur reaksi, sehingga dibutuhkan suhu tinggi untuk meningkatkan laju reaksi. Alternatif lain agar reaksi dapat berjalan lebih cepat pada suhu kamar adalah dengan penambahan kopelarut MTBE. Ilgen pada tahun 2007 telah menggunakan kopelarut dalam pembuatan biodiesel menggunakan minyak nabati untuk mempercepat reaksi transesterifikasi, sehingga dalam studi ini penggunaan kopelarut dalam minyak hewani juga diperkirakan dapat meningkatkan kecepatan reaksi. Penambahan kopelarut ini bertujuan untuk mendekatkan sistem polar dan non polar antara metanol dengan minyak, sehingga akan membantu kontak reaktan keduanya. Dengan penambahan kopelarut ini mengakibatkan metanol menjadi mudah larut dalam minyak sehingga laju reaksi semakin besar dalam waktu yang singkat. 27 C. Hipotesis 1. Semakin banyak penggunaan MTBE sebagai kopelarut pada reaksi transesterifikasi, maka diperoleh biodiesel dengan waktu reaksi yang singkat. 2. Semakin banyak penggunaan MTBE sebagai kopelarut pada reaksi transesterifikasi, kemurnian biodiesel akan mencapai optimum. BAB III METODOLOGI PENELITIAN A. Metode Penelitian Penelitian dilakukan dengan menggunakan metode eksperimental di laboratorium. Pembuatan biodiesel dari minyak ikan menggunakan katalis basa NaOH dan kopelarut MTBE. Kondisi optimal diperoleh dengan memvariasi perbandingan volume MTBE dengan minyak dan waktu reaksi. Biodiesel yang diperoleh selanjutnya dikarakterisasi menggunakan GC-MS, 1HNMR, dan ASTM B. Waktu dan Tempat Penelitian Penelitian dilakukan pada bulan April 2009 sampai September 2009. Produksi biodiesel dan karakterisasi biodiesel hasil produksi dilakukan di Laboratorium Kimia Dasar FMIPA dan Sub-Laboratorium Kimia Pusat UNS Surakarta, Sub Laboratorium Kimia dan Sub Laboratorium Teknik Kimia UGM Yogyakarta, serta Laboratorium Kimia Instrumen UPI Bandung. C. Alat dan Bahan 1. Alat-alat Alat-alat yang digunakan dalam penelitian ini adalah : a. Magnetic stirrer b. Thermometer 100oC c. Seperangkat alat refluks d. Piknometer 10 ml Duran e. Peralatan gelas pyrex f. Neraca Analitik Sartorius Bp-110 g. Pemanas listrik cole palmer h. Seperangkat alat titrasi i. Vacuum rotary evaporator IKA j. H-Nuclear Magnetic Resonanse (HNMR) 28 29 k. Gas Chromatography-Mass Spectroscopy (GC-MS) shimadzus l. Saringan kopi m. Lumpang porselin n. Penggerus porselin 2.Bahan-bahan Bahan-bahan yang digunakan dalam penelitian ini adalah : a. Minyak limbah ikan b. NaOH p.a (E. Merck) c. KOH p.a (E. Merck) d. Aquades (Laboratorium Kimia Pusat MIPA UNS) e. Metanol (CH3OH) (E. Merck) f. Etanol (C2H5OH) (E. Merck) g. H2SO4 (E. Merck) h. Na2SO4 anhidrat (E. Merck) i. MTBE (E.Merck) j. Indikator PP k. pH universal D. Prosedur Penelitian 1. Pembuatan Biodiesel a. Penyaringan minyak ikan Penyaringan dilakukan untuk menghilangkan partikel berukuran besar atau pengotor yang ada pada minyak limbah ikan. Minyak dipanaskan terlebih dahulu pada suhu 30-35 ºC lalu disaring menggunakan saringan kopi. b. Esterifikasi Minyak yang telah disaring dipanaskan pada suhu 45 ºC kemudian ditambahkan metanol dan katalis H2SO4 0,5% berat minyak dengan volume metanol 30% volume minyak. Campuran direfluks pada suhu 52 ºC selama 1 jam. Penetralan H2SO4 dengan pencucian menggunakan akuades berulang ulang sampai diperoleh pH netral. Sebelum dan sesudah esterifikasi dicek bilangan asamnya. 30 c. Penentuan bilangan asam Sebanyak 1 ml minyak dalam erlenmeyer ditambah 2 tetes indikator penolftalen, kemudian campuran dititrasi dengan KOH 0,005 N menghasilkan warna merah jambu. d. Transesterifikasi menggunakan kopelarut MTBE Selanjutnya pembuatan NaOCH3 dengan mencampur katalis NaOH 1% berat minyak dengan sebagian metanol. Secara terpisah minyak hasil esterifikasi yang bebas air dan metanol ditambah metanol sedemikian sehingga jumlah metanol mempunyai perbandingan mol 1:27 dengan mol minyak serta ditambahkan MTBE dengan berbagai variasi perbandingan volume. NaOCH3 ditambahkan dalam campuran dan waktu reaksi mulai dihitung. Reaksi transesterifikasi dihentikan dengan variasi waktu menggunakan H2SO4 0,1 M sebagai penetral. e. Pencucian dan pemurnian biodiesel Hasil transesterifikasi kemudian ditambahkan H2SO4 hingga pH 4, keasaman metil ester diketahui menggunakan kertas lakmus. Untuk menghilangkan gliserol dan sabun, biodiesel dicuci menggunakan aquades berulang-ulang. Biodiesel kemudian ditambahkan dengan Na2SO4 anhidrat untuk menghilangkan air yang tersisa dan dialirkan gas N2 untuk menghilangkan metanol dan MTBE sehingga diperoleh biodiesel murni. 2. Uji Komposisi biodiesel Biodiesel yang diperoleh selanjutnya dilakukan uji karakteristik dengan 1 HNMR, GC-MS, dan ASTM. Berikut prosedur pengujian sifat fisik biodiesel menggunakan metode ASTM. a). Pengukuran berat jenis dengan ASTM D1298 Sampel dengan suhu yang sesuai dituang dalam tabung yang mempunyai suhu yang kira-kira sama dengan dengan suhu sampel. Hidrometer yang sesuai ditempatkan dalam sampel. Setelah suhu kesetimbangan dicapai, dibaca dan dicatat skala hidrometer dan suhu sampel. Tabung dan isinya ditempatkan dalam penangas 31 pada suhu tetap untuk menghindarkan perubahan suhu yang berlebihan selama pengujian. b). Pengukuran kekentalan kinematis dengan ASTM D445 Viskometer yang telah diisi sampel dimasukkan ke dalam viskometer bath yang telah diset pada suhu 100oF selama 20 menit. Cairan dalam viskometer disedot dengan pompa vakum sampai di atas garis batas pertama. Waktu yang diperlukan cairan bahan untuk mengalir mulai dari garis batas pertama sampai garis batas kedua dihitung dengan stopwatch. Viskositas kinematik dihitung dengan mengalirkan waktu alir dengan konstanta viskometer yang sesuai. c). Pengukuran titik nyala dengan ASTM D93 Cara pengukuran titik nyala yaitu cawan uji diisi sampel sampai tinggi tertentu. Suhu sampel mula-mula dinaikkan dengan cepat dan kemudian dengan kecepatan lambat yang tetap sampai flash point dicapai. Pada interval tertentu suatu nyala uji kecil dilewatkan melintasi cawan. Suhu terendah dimana penggunaan nyala uji menyebabkan uap di atas permukaan cairan menyala diambil sebagai flash point. d). Pengukuran titik kabut dengan ASTM D97 Cara pengukuran titik kabut yaitu sampel didinginkan dengan rentan suhu tertentu dan diperiksa secara periodik. Temperatur dimana sampel berkabut yang terlihat pertama kali di atas tempat sampel diteliti dan dicatat sebagai titik kabut e). Pengukuran korosi terhadap tembaga dengan ASTM D130 Lempeng tembaga dimasukkan dalam sejumlah sampel minyak, kemudian dipanaskan dan pada waktu tertentu material akan diujikan. Pada akhirnya lempeng tembaga dipisahkan, dicuci dan dibandingkan dengan standar ASTM Copper Strip Corrosion. f). Pengukuran residu karbon conradson dengan ASTM D189 Sejumlah sampel diletakkan dalam crucible kemudian didestruksi dengan destilasi. Residu yang terletak di dasar kemudian diambil dan dipanaskan dengan pengadukan secara berkala. Pada akhir pemanasan cruicible yang berisi residu 32 karbon didinginkan dalam desikator dan ditimbang. Residu selanjutnya dihitung sebagai prosentase dari sampel murninya dan dilaporkan sebagai residu karbon conradson. g). Pengukuran kandungan air dengan ASTM D95 Sampel yang akan diuji dipanaskan dengan cara refluks menggunakan pelarut yang tak bercampur dengan air dimana pelarut tersebut akan membantu pemisahan air dalam sampel. Selanjutnya pelarut dan air terkondensasi dipisahkan dalam beberapa fraksi, air akan mengalir keluar sedangkan pelarut akan kembali ke glass still (tempat sampel). Perbandingan volume air dengan volume sampel dinyatakan sebagai kandungan air dalam sampel. h). Pengukuran kandungan sedimen dengan ASTM D473 Sampel minyak dimasukkan dalam tabung refraktori, kemudian diekstraksi menggunakan toluena panas hingga diperoleh residu dengan massa konstan. Massa dari residu dihitung sebagai prosentase dan dilaporkan sebagai sedimen dari ekstrak. E. Teknik Pengumpulan Data Untuk membuktikan hipotesis penelitian, maka dilakukan penelitian dengan menentukan variabel bebas: 1. Perbandingan volume MTBE terhadap minyak dengan variasi 0,5:1; 1:1; 1,5:1 dan 2:1 yang dilambangkan dengan v/v. 2. Waktu reaksi dengan variasi 5, 10, 15, 20, dan 25 menit yang dilambangkan dengan t (menit). Variabel bebas di atas dapat digunakan untuk menentukan variabel terikat yaitu kadar metil ester yang dilambangkan dengan CME (%). Rumus yang digunakan adalah: C ME (t, v/v) (%) = 100 x Keterangan : CME(t,v/v) 5 I ME (t, v/v) 5 I ME (t, v/v) + 9 I TAG (t, v/v) = kadar metil ester (%) 33 IME(t,v/v) = nilai integrasi puncak metil ester (%) ITAG(t,v/v) = nilai integrasi puncak triasilgliserol (%) Kadar metil ester yang diperoleh merupakan variabel terikat yang dilambangkan dengan CME(%). Dari data yang diperoleh, dapat dibuat tabel kadar metil ester pada setiap perbandingan MTBE dan waktu reaksi sebagai berikut. t 0,5:1 (V/V) (mnit) 1:1 (V/V) 1,5:1 (V/V) 2:1 (V/V) ITAG IME CME ITAG IME CME ITAG IME CME ITAG IME CME (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) 5 10 15 20 25 Selanjutnya, dibuat grafik dengan plot kadar metil ester (C) Vs waktu (t). Data uji karakteristik biodiesel diperoleh menggunakan: 1. GC-MS Dari uji ini akan diperoleh kromatogram dari GC dan masing-masing puncak akan dijelaskan menggunakan MS yang dibandingkan dengan standar sehingga dapat di tentukan jenis metil ester spesifik dari asam lemaknya. 2. ASTM Dari uji ASTM diperoleh data sifat fisik biodiesel yang meliputi berat jenis, kekentalan kinematis, titik nyala, titik kabut, korosi terhadap tembaga, residu karbon conradson, kandungan air, dan kandungan sedimen. F. Teknik Analisis Data Analisis dilakukan menggunakan metode scatter grafic dengan plot antara kecepatan (v) Vs volume MTBE terhadap minyak (v/v). Dari grafik tersebut kecepatan dapat dihitung dari waktu reaksi, dimana kecepatan merupakan 1/t untuk mencapai 100% kadar metil ester. Kesimpulan diambil dengan hipotesis benar jika 34 semakin banyak MTBE yang digunakan reaksi akan berjalan lebih cepat hingga mencapai optimum pada t tertentu. Dari grafik tersebut di lihat apakah harga kecepatan dari masing-masing volume MTBE memiliki harga yang sama atau berbeda. Untuk mengetahuinya maka perlu dihitung tingkat kesalahan pengukuran atau standar deviasinya (SD), sehingga harga kecepatan dapat ditulis dengan v ± SD . Selanjutnya adalah menghitung selisih rata-rata dari vA dan vB, jika harga selisih kecepatan rata-rata tersebut lebih besar dari tingkat kesalahannya maka dapat dinyatakan bahwa kecepatan vA dan vB itu berbeda, dan jika berbeda maka dapat dibuat trendline misalkan garis melengkung atau linear sehingga bisa ditentukan kondisi optimumnya. Sedangkan jika harga selisih rata-rata kecepatan tersebut lebih kecil maka vA dan vB merupakan harga yang sama sehingga merupakan garis lurus. Berdasarkan hasil kromatogran GC dan fragmen MS dari masing-masing senyawa, suatu senyawa dikatakan mirip dengan standar jika memiliki berat molekul yang sama dan memiki pola fragmen yang mirip serta harga SI (indeks kemiripiran) yang tinggi. Untuk lebih memperkuat dugaan dapat dilihat base peak pada senyawa metil ester yang memiliki ciri khas pada m/z = 74. Jika kandungan metil ester pada senyawa biodiesel tinggi maka dimungkinkan tingginya konversi trigliserida dalam minyak ikan menjadi metil ester. Sehingga semakin besar kandungan metil ester maka kemurnian biodiesel juga semakin besar. Harga pengukuran sifat fisik biodiesel selanjutnya dibandingkan dengan standar baku ASTM sebagai standar internasional dan standar Dirjen Migas sebagai standar nasional. Jika harga tersebut berada pada range standar maka dapat disimpulkan biodiesel tersebut memenuhi standar sebagai bahan bakar diesel. BAB IV HASIL PENELITIAN DAN PEMBAHASAN A. Esterifikasi Asam Lemak Bebas Minyak Ikan Penentuan asam lemak bebas minyak ikan dilakukan untuk mengetahui kandungan asam lemak bebas dalam minyak ikan. Jika kandungan asam lemak bebas terlalu tinggi akan mengakibatkan pembentukan sabun (saponifikasi) dan menimbulkan masalah pada reaksi pembuatan biodiesel. Prosentase asam lemak bebas pada minyak ikan dihitung dari angka asamnya. Berdasarkan perhitungan (Lampiran 1) didapatkan bilangan asam minyak ikan sebesar 28,18 mg KOH/gr sampel atau setara dengan 2,23 % berat. Harga tersebut menunjukkan adanya asam lemak bebas yang tinggi dalam minyak ikan. Berdasarkan teori, bilangan asam yang diperbolehkan dalam sistem katalis basa adalah lebih rendah dari 1 % (Garpen, 2004) atau setara dengan 2 mg KOH/gr sampel (Berrios, 2007). Bilangan asam yang tinggi harus diturunkan melalui reaksi esterifikasi. Reaksi esterifikasi minyak ikan dilakukan dengan menambahkan katalis asam H2SO4 dan pereaksi methanol. Penggunaan katalis asam lebih baik daripada basa karena tidak menghasilkan sabun dan dapat meningkatkan produksi biodiesel, Hal tersebut dikarenakan reaksi esterifikasi merupakan reaksi pembentukan suatu ester (Marchetti, 2008). Minyak hasil reaksi esterifikasi kemudian di ukur kembali bilangan asamnya, berdasarkan perhitungan (Lampiran 1) diperoleh bilangan asam 0,42 mg KOH/gr sampel. Hal ini menunjukkan asam lemak bebas yang pada mulanya tinggi telah terkonversi menjadi ester sehingga kandungan asam lemak bebas menjadi kecil. B. Pembuatan Biodiesel Menggunakan Kopelarut MTBE Biodiesel dibuat dengan melakukan reaksi transesterifikasi antara minyak hasil esterifikasi dengan pereaksi methanol dan katalis NaOH serta penambahan kopelarut MTBE. Hasil yang diperoleh adalah biodiesel berwarna kuning jernih, berbau agak amis, dan viskositas lebih rendah dari minyak ikan. Kenampakan fisik 35 36 biodiesel yang dihasilkan berbeda-beda pada setiap variasi kondisi, ada yang membeku dan tidak membeku. Kenampakan fisik biodiesel dapat dilihat pada Tabel 7. Tabel 7. Kenampakan Fisik Biodisel Pada Berbagai Variasi Kondisi Volume MTBE Waktu reaksi Pembekuan terhadap minyak (menit) biodisel 5 Ya 10 Ya 15 Tidak 20 Tidak 25 Tidak 5 Ya 10 Ya 15 Tidak 20 Tidak 25 Tidak 5 Ya 10 Tidak 15 Tidak 20 Tidak 25 Tidak 5 Ya 10 Ya 15 Tidak 20 Tidak 25 Tidak (V/V) 0,5 1 1,5 2 Pada kondisi waktu 5-10 menit memberikan hasil yang kurang baik, yakni terjadi pembekuan pada biodiesel. Pembekuan ini`dimungkinkan terjadi karena reaksi transesterifikasi berjalan kurang sempurna pada waktu yang singkat. Semakin 37 lama waktu reaksi, biodiesel yang dihasilkan tidak mengalami pembekuan. Biodiesel yang terbentuk selanjutnya dianalisis secara kualitatif dan kuantitatif menggunakan 1 HNMR, GC-MS, dan ASTM. C. Analisis Kualitatif Hasil Biodiesel menggunakan 1HNMR Analisis menggunakan 1HNMR bertujuan untuk dapat mengetahui seberapa besar kemurnian biodiesel yang diperoleh dari hasil reaksi transesterifikasi minyak ikan. Kemurnian ini dilihat dari besarnya prosentase metil ester yang terbentuk. Analisis ini dilakukan pada semua rasio waktu dan volume MTBE yang digunakan. Spektra pembentukan metil ester dapat dilihat pada Gambar 11. Gambar 11. Spektra 1H-NMR biodiesel MTBE 1x dan waktu 25 menit Proton disekitar gugus gliserida ditunjukkan oleh spektra pada daerah 4 – 4,3 ppm, sedangkan proton metil ester pada daerah 3,7 ppm dan proton α-CH2 pada daerah 2,3 ppm. Pada gambar 5 di atas, muncul puncak kecil di daerah 4,3 ppm dan puncak lebih tinggi di daerah sekitar 3,7 ppm, hal ini menunjukkan konversi metil ester belum sempurna karena masih terdapat puncak gliserida meskipun luas areanya lebih kecil. Ini berarti biodiesel pada spektra di atas merupakan biodiesel belum murni. Pembentukan metil ester yang sempurna akan terjadi jika tidak muncul puncak di sekitar proton gliserida. 38 Spektra yang muncul pada daerah 5 - 6 ppm merupakan proton di sekitar gugus aldehid pada rantai panjang asam lemak, posisinya berada paling jauh dengan TMS karena gugus ini tidak terlindungi. Kondisi ini disebabkan adanya elektron phi menyebabkan rapat elekton menjadi kecil sehingga proton ini tidak terlindungi. Pada daerah 1 – 2 ppm muncul puncak yang lebar dan tinggi, puncak ini terjadi karena proton-proton pada CH2 asam lemak berada terlalu dekat sehingga geseran kimia juga menjadi terlalu dekat akibatnya puncak-puncak akan bergabung menjadi suatu singlet dimana puncak-puncak tengah suatu multiplet makin tinggi sementara puncak-punvak pinggir akan mengecil ini disebut juga gejala pemiringan atau learning (Fessenden, 1999) D. Analisis Kuantitatif Hasil Biodiesel menggunakan 1HNMR Pembuatan biodiesel ini dilakukan pada variasi waktu 5, 10, 15, 20 dan 25 menit pada setiap variasi volume MTBE 0,5; 1; 1,5; dan 2. Berdasarkan hasil spektra HNMR (Lampiran 3-22) dibuat suatu kurva hubungan waktu dan kandungan metil ester pada setiap variasi yang dapat dilihat pada Gambar 12. kandunagn ME (%) 100 90 0,5 MTBE 1 MTBE 1,5 MTBE 2 MTBE 80 70 60 5 10 15 20 25 t (menit) Gambar 12. Kurva hubungan waktu dengan kandungan metil ester pada setiap volume MTBE 39 Gambar di atas menunjukkan data yang tidak teratur, data pencapaian hasil pengukuran (% C dari puncak 5 I ME (t, v/v) 5 I ME (t, v/v) + 9 I TAG (t, v/v) ´ 100% ) tidak konsisten dan tidak bisa dikatakan bahwa reaksi merupakan reaksi dapat balik. Karena reaksi dapat balik selamanya tidak akan mencapai 100%. Data penelitian dianggap data benar hanya untuk latihan analisis data skripsi. Dari gambar di atas kemurnian biodiesel terjadi pada setiap perbandingan volume MTBE. Pada perbandingan volume MTBE 0,5 dan 2 kemurnian dicapai pada waktu 20 menit serta pada volume MTBE 1 dan 1,5 kemurnian dicapai pada waktu 15 menit. Pada waktu 15 menit hingga 20 menit kandungan metil ester mencapai kemurnian 100%. Berbeda dengan waktu 5 - 10 menit, biodiesel yang dihasilkan belum murni dikarenakan adanya gliserida yang belum terkonversi menjadi metil ester. Untuk mengetahui pengaruh penambahan MTBE terhadap waktu reaksi dan kemurniannya, dibuat kurva hubungan kecepatan dengan perbandingan MTBE. Kecepatan dapat dihitung dari 1/t, dimana kecepatan didefinisikan sebagai kebalikan dari waktu untuk mencapai kandungan metil ester 100%. Hubungan kecepatan Vs perbandingan MTBE dapat dilihat pada gambar 13. Gambar 13. Kurva hubungan kecepatan Vs perbandingan volume MTBE Dengan mengabaikan kesalahan pengukuran, laju dapat dilihat pada ekstrapolasi (lihat gambar 13), dot data ekstrapolasi berpuncak pada V/V MTBE = 40 1,25. Karena percobaan tidak dilanjutkan secara lebih pendek pada variasi perbandingan MTBE (V/V) di selisih puncak kecepatan optimum (vmaks), maka vmaks tidak dapat ditentukan. Tetapi dengan grafik tersebut dapat diprediksikan ada 3 kemungkinan: 1. Optimum pada titik ekstrapolasi, vmaks1 = 0,077/menit 2. Optimum pada titik awal lengkungan, vmaks2 = 0,067/menit 3. Optimum antara vmaks1 dan vmaks2 = 0,072/menit Semakin tinggi perbandingan volume MTBE yang digunakan maka reaksi berjalan lebih cepat, namun pada V/V MTBE melebihi 1 kali volume minyak tidak memberikan pengaruh yang signifikan, bahkan pada V/V MTBE 2 kemurnian justru tercapai dengan waktu lebih lama. Semakin banyak penambahan kopelarut justru reaksi tidak mencapai optimum, hal ini disebabkan karena penambahan kopelarut yang berlebih akan mengakibatkan terlalu banyak solvasi, sehingga dimungkinkan reaktan akan tersolvasi dengan kopelarut berlebih. E. Analisis Hasil Biodiesel Menggunakan GC-MS Untuk mengetahui struktur senyawa yang terkandung dalam metil ester dari minyak ikan maka dilakukan analisis menggunakan GC-MS. Dengan analisis ini akan menghasilkan puncak-puncak yang masing-masing menunjukkan jenis ester yang spesifik. Hasil analisis GC-MS ditunjukkan pada Gambar 14. Gambar 14. Kromatrografi gas metil ester dari minyak ikan pada perbandingan MTBE 0,5 dan waktu 20’ 41 Berdasarkan data MS, berbagai metil ester dapat ditentukan. Kandungan metil ester ditunjukkan pada Tabel 8. Tabel 8. Jenis Senyawa Metil Ester Dalam Biodiesel No Nama Senyawa Puncak ke- % Senyawa SI 1 Metil Ester Miristat 4 7,30 98 2 Metil Ester Palmitoleat 5 11,09 94 3 Metil Ester Palmitat 6 22,84 96 4 Tidak diketahui 8 1,54 87 5 Tidak diketahui 9 3,27 90 6 Metil-6-Oktadekanoat 10 22,66 87 7 Metil Ester stearat 11 9,98 94 8 Tidak diketahui 12 7,79 94 9 Tidak diketahui 15 1,46 90 10 Metil Ester 11-eikosenoat 16 4,85 93 Dari 10 senyawa diatas hanya terdapat 5 senyawa utama yang benar-benar merupakan suatu metil ester, yakni metil ester miristat, metil ester palmitoleat, metil ester palmitat, metil ester stearat, dan metil ester 11-eikosenoat. Senyawa lainnya kemungkinan hanya merupakan alkil ester turunan dari masing-masing asam lemaknya. Kandungan ester tertinggi pada biodiesel adalah metil ester palmitat yang ditunjukkan oleh puncak nomor 6 dengan kandungan senyawa 22,84%. Spektroskopi massa dari 5 senyawa utama beserta fragmentasinya dapat dilihat pada lampiran 24. F. Analisis Sifat Fisik Biodiesel Pengukuran sifat fisik biodiesel hasil transesterifikasi minyak ikan menggunakan kopelarut MTBE bertujuan untuk mengetahui kemiripannya dengan standar sifat biodiesel yang diperbolehkan sehingga dapat diaplikasikan pada mesin diesel. Pengukuran sifat fisik dilakukan dengan metode ASTM untuk biodiesel dan hasilnya dibandingkan dengan standar parameter yang sesuai dengan ASTM dan Dirjen Migas. Hasil pengujian sifat fisik biodiesel dapat dilihat pada Tabel 9. 42 Tabel 9. Data Hasil Pengujian Parameter Fisik Biodiesel No Jenis Pemeriksaan 1 Specific Gravity pada 60/60 oF Viscosity Kinematic pada 40 oC, mm/s Flash Point P.M C.C., oC Cloud Point Copperstrip Corrosion (3 hrs/50 oC) Conradson Carbon Residue, % wt. Water Content, % wt. 2 3 4 5 6 7 8 Hasil Metode Pemeriksaan ASTM 0,8776 D 1298 4,356 ASTM Standar Dirjen Migas D 445 Tidak diatur 1,9 – 6,0 0,840– 0,920 2,3 – 6,0 182,5 D 93 Min. 130 Min. 100 12 1a D 97 D 130 0,078 D 189 Trace D 95 0,091 D 473 Maks. 26 Maks. No. 3 Maks. 0,1 Maks. 0,05 Maks. 0,05 Maks. 26 Maks. No. 3 Maks. 0,1 Maks. 0,05 Maks. 0,05 Sediment, % wt. 1. Pengukuran Kerapatan Relatif (Specific Gravity) Kerapatan relatif adalah perbandingan massa cairan yang mempunyai volume tertentu pada 15 oC (60 oF) dengan massa air murni yang mempunyai volume dan suhu yang sama dengan volume dan suhu contoh. Kerapatan relatif digunakan untuk mengetahui adanya kontaminasi minyak ringan atau berat yang bercampur dalam biodiesel. Dari hasil pemeriksaan sesuai dengan metode pemeriksaan ASTM D 1298 diperoleh harga 0,8776. Harga tersebut telah memenuhi standar ASTM (tidak diatur) dan Dirjen Migas (min. 0,840 dan maks. 0,920). Hal ini berarti bahwa biodiesel yang dihasilkan tidak terkontaminasi minyak fraksi ringan maupun fraksi berat. 2. Pengukuran Kekentalan Kinematis (Viscosity Kinematic) Kekentalan atau viskositas adalah suatu karakteristik bahan bakar yang penting karena berhubungan dengan sifat pemompaan dan sistem injeksi solar ke ruang bakar. Pelumasan, gesekan antara bagian-bagian yang bergerak dan keausan mesin semua dipengaruhi oleh kekentalan. Bahan bakar dengan nilai viskositas dibawah standar berarti banyak mengandung fraksi ringan, sehingga boros dalam pemakaiannya, walaupun kerja pompa ringan. Sedangkan bila nilai 43 viskositasnya lebih besar dari standar berarti mengandung fraksi berat, sehingga minyak solar sulit untuk dikabutkan, dan kerja pompa berat. Viskositas diukur dari laju alir fluida atau minyak dalam suatu pipa kapiler atau viscometer yang sudah terkalibrasi dan dilakukan secara gravitasi. Hasil pemeriksaan dengan menggunakan metode ASTM D 445 menunjukkan harga 4,356. Harga kekentalan diatas telah memenuhi standar ASTM D 445 (1,9 – 6,0) dan Dirjen Migas (2,3 – 6,0). 3. Pengukuran Titik Nyala (Flash Point) Titik nyala suatu senyawa adalah suhu terendah dimana sejumlah uap minyak bercampur dengan udara dan apabila tersambar api maka minyak akan terbakar. Titik nyala tidak berkaitan langsung dengan unjuk kerja mesin, namun sangat penting sehubungan dengan keamanan dan keselamatan, terutama dalam handling and storage. Titik nyala yang tinggi akan memudahkan penanganan bahan bakar, karena tidak perlu disimpan pada suhu rendah, sebaliknya titik nyala yang terlalu rendah akan membahayakan karena tingginya resiko terjadi penyalaan. Hasil pemeriksaan titik nyala biodiesel didasarkan pada metode pemeriksaan ASTM D 93 adalah 182,5. Harga diatas telah memenuhi standar ASTM (min 130 oC) dan Dirjen Migas (min. 100 oC), sehingga biodiesel diatas dalam batas aman terhadap bahaya kebakaran selama penyimpan, penanganan dan transportasi. 4. Pengukuran Titik Kabut (Cloud Point) Titik kabut suatu bahan bakar yang sudah terdestilasi adalah temperatur dimana bahan bakar menjadi berkabut karena kehadiran dari kristal-kristal lilin. Titik kabut sangat dipengaruhi oleh harga salinitas, bila salinitasnya tinggi harga titik kabut cenderung turun. Hasil pengukuran biodisel berdasar metode pemeriksaan ASTM D 97 adalah 12oC. Harga diatas sudah sesuai dengan standar ASTM (maks. 26 oC) dan Dirjen Migas (maks. 26 oC). 5. Pengukuran Korosi Terhadap Lempeng Tembaga (Copperstrip Corrosion) Metode copper strip corrotion digunakan untuk memprediksi derajat korosivitas relatif lempeng tembaga yang diujikan pada biodiesel. Hasil 44 pemeriksaan biodiesel berdasar metode standar ASTM D 130 diperoleh 1a. Hasil pengujian korosi lempeng tembaga untuk ketiga jenis biodiesel tersebut telah memenuhi standar ASTM (maks. No. 3) dan Dirjen Migas (maks. No.3). 6. Pengukuran Sisa Karbon Conradson (Conradson Carbon Residue) Residu karbon bahan bakar yang tinggi menyebabkan silinder cepat terabrasi, selain itu akan mengakibatkan terbentuknya deposit karbor dan zat yang kental pada piston dan silinder. Akibat residu karbon lainnya adalah dapat menyebabkan lekatnya ring piston dan valve system (Kuntari, 2002 dalam Supandi, 2003) Hasil pemeriksaan biodiesel berdasar metode standar ASTM D 189 adalah 0,078. Dari ketiga harga tersebut diatas telah memenuhi standar ASTM D 189 (maks. 0,1) dan Dirjen Migas (maks. 0,1). Hal ini berarti biodiesel tersebut tidak mengandung sisa karbon di atas standar. 7. Pengukuran Kandungan Air (Water Content) Pengukuran kandungan air dilakukan untuk mengetahui banyaknya air yang terdapat dalam biodiesel. Keberadaan air menyebabkan turunnya panas pembakaran, busa, dan bersifat korosif pada bahan bakar minyak. Apabila suhu dingin, air dapat mengkristal sehingga dapat menyumbat saluran bahan bakar atau saringan. Hasil pemeriksaan biodiesel berdasar standar ASTM D 95 diperoleh harga Trace (sedikit sekali) sampai tidak terdeteksi volumenya.. Dari harga di atas maka kandungan air memenuhi standar ASTM (maks. 0,05% vol) dan Dirjen Migas (maks. 0,05% vol.). 8. Pengukuran Kandungan Sedimen (Sediment) Pengukuran kandungan sedimen bertujuan untuk mengetahui jumlah kandungan sediment yang terdapat dalam biodiesel. Sedimen merupakan zat yang tidak dapat larut dan dianggap sebagai kontaminan. Apabila biodiesel mengandung banyak sedimen maka sangat mempengaruhi kelancaran distribusi bahan bakar pada ruang pembakaran sehingga mempengaruhi akselerasi kerja mesin diesel. 45 Hasil pengukuran berdasar standar ASTM D 473 diperoleh kadar 0,091. Nilai ini tidak memenuhi standar ASTM D 473 (maks. 0,05% wt.) dan Dirjen Migas (maks. 0,05% wt.). Hal ini berarti biodiesel yang dihasilkan mengandung kotoran tersuspensi. BAB V KESIMPULAN DAN SARAN A. Kesimpulan Dari hasil dan pembahasan maka dapat diambil kesimpulan sebagai berikut: 1. Penggunaan kopelarut MTBE pada reaksi transesterifikasi minyak ikan dapat meningkatkan laju reaksi pada kecepatan reaksi 0,072 0,004 yang berada pada waktu reaksi optimum 13,89 menit 2. Pembuatan biodiesel dari minyak ikan menggunakan kopelarut MTBE mencapai kemurniannya pada kondisi optimum perbandingan volume MTBE terhadap minyak adalah 1,25 V/V 3. Struktur senyawa yang dihasilkan dari biodiesel berbahan dasar minyak ikan adalah Metil Ester Miristat, Metil Ester Palmitoleat, Metil Ester Palmitat, Metil Ester Stearat, dan Metil Ester 11-eikosanoat. Dan kandungan terbesarnya adalah metil palmitat dengan kandungan senyawa 22, 84%. 4. Sifat fisik biodiesel yang meliputi kerapatan relatif, kekentalan kinematis, titik nyala, titik kabut, korosi terhadap lempeng tembaga, sisa karbon conradson, dan kandungan air telah memenuhi standar ASTM dan Dirjen Migas, namun kandungan sedimennya tidak memenuhi standar. B. Saran Berdasarkan hasil penelitian dari percobaan yang telah dilakukan, penulis memberikan saran sebagai berikut: 1. Perlu dilakukan penelitian lebih lanjut untuk mengatasi pembekuan yang terjadi pada biodiesel yang dihasilkan pada suhu kamar dengan waktu yang singkat. 2. Perlu penelitian lebih lanjut untuk mengetahui kondisi optimum perbandingan molar minyak limbah ikan dan methanol pada pembuatan biodiesel 46 DAFTAR PUSTAKA Astawan, Made., 2003, Ikan Air Tawar Kaya Protein dan Vitamin. http://www.senior.co.id/kesehatan/news/senior/gizi/0307/04/gizi.htm Berrios, M., Siles, J., Martin, M.A., Martin, A., 2007, A Kinetic Study of The Esterification of Free Fatty Acid (FFA) in Sunflower Oil. Fuel (86): 2383 2388 Chi, Lirong., 1999, The Production of Methyl Esters from Vegetable Oil/ Fatty Acid Mixture. Tesis S2, Jurusan Teknik Kimia, Universitas Toronto. Cresswell, Clifford, J., Runquist, Olaf, A., Campbel, Malcom, M.,1982, Analisis Spektrum Senyawa Organik Edisi ke 2, ITB press, Bandung. De Man, John., 1997, Kimia Makanan Edisi kedua, Institut Teknologi Bandung Press, Bandung Destianna, Mescha dkk, 2007, Intensifikasi Proses Produksi Biodiesel. LKIM, Institut Teknologi Bandung. El-Mashad, H. M., Ruihong, Z., and Roberto J., 2008, A Two-Step Process for Biodiesel Production from Salmon Oil, Biosystem Engineering., 99, p 220227 Fessenden and Fessenden, 1991, Kimia Organik Jilid 1 Edisi ke empat, Erlangga, Jakarta Fischer, A., Oehm, C., Selle M., Werner P., 2005. Biotic and abiotic transformations of methyl tertiary butyl ether (MTBE). Environ Sci Pollut Res Int 12 (6): 381– 6 Foon, Cheng Sit., May, C,Y., Ngan,M,A., and Hock, C,C., 2004, Kinetics Study on Transesterification of Palm Oil, Journal of Oil Palm Research Vol.16 No.2, 19-29 Freedman, B., Pride, E.H., and Mounts, t.L., 1984, Variable Affecting the Yields of Fatty Esters from Transesterified Vegetable Oil, JAOCS, 61 (10), 1643-1683 Guru, Metin., Artukoglu, B.D., Keskin, A., and Koca, A., 2008, Biodiesel Production from Waste Animal Fat and Improvement by Synthesized Nickel and Magnesium Additive, Energy Convertion and Management, Vol.50., 3, p 498502 Harjanti, Tri. B.S, 2008, Pembuatan Biodiesel dari Lemak Babi dengan Pereaksi Metanol dan Katalis Logam Natrium, Skripsi S1, Jurusan Kimia MIPA, UNS, Surakarta. 47 48 Hardjono, A., 2001, Teknologi Minyak Bumi, Edisi pertama, Gadjah Mada University Press, Yogyakarta. Herlina, Netti, et. al., 2002, Lemak dan Minyak, Jurusan Teknik Kimia Fakultas Teknik Universitas Sumatra Utara, Medan. Ilgen, O., Dincer, I., Yildiz, M., Alptekin, E., Boz, N., Canakci, M., Akin, A, N, 2007, Investigation of Biodiesel Production from Canola Oil using Mg-Al Hydrotalcite Catalysts, Turk J Chem. Juliati, Br. et. al., Ester Asam Lemak, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatra Utara, Medan. Knothe, G., 2000, Monitoring a Progressing Transesterification Reaction by FiberOptic Near Infrared Spectroscopy with Correlation to 1H Nuclear Magnetic Resonance Spectroscopy, J. Am. Oil Chem. Soc., 77, 9483, 489–493. McLafferty, 1988, Interpretasi Spektra Massa. Gadjah Mada University, Yogyakarta. Mittlebach, M., Remschmidt, Claudia, 2004, “Biodiesel The Comprehensive Handbook”, Vienna: Boersedruck Ges. Padley, FB., Gunstone, F.D., and Harwood, J.L., 1994, Occurrence and Characteristic of Oil and Fat. In Lipid Handbook, p.47-223, London. Park, Young Mo., et. Al., The Heterogeneous Catalyst System for The Continuous Conversion of Free fatty Acid in Used Vegetable Oil for The Production of Biodiesel, Catalysis Today 13, 238-243 Prakoso, Tirto, 2003, Potensi Biodiesel Indonesia. Laboratorium Termofluida dan Sistem Utilitas, Departemen Teknik Kimia ITB, Bandung. Putrajaya, Hidayat, 2008, Antara Bensin, Timbal dan Etanol, http://hematbensinsolar.blog.detik.com/2008/09/26/antarabensin-timbal-danetanol-2 Rahayu, Martini, 2005, Teknologi Proses Produksi Biodiesel dalam Prospek Pengembangan Bio-fuel sebagai Substitusi Bahan Bakar Minyak, www.geocities.com/markal_bppt/publish/biofbbm/biraha.pdf Schuchardt, Ulf., Sercheli, R., and Vargas., 1998, Transesterification of Vegetable Oil: a Review, J.Braz.Chem. Soc,Vol. 9 (2): 199-210. Setiyono, Adi, 2005, Pembuatan dan Karakterisasi Biodiesel dari Lemak Babi, Skripsi S1, Jurusan Kimia FMIPA Universitas Sebelas Maret, Surakarta. 49 Skoog, D.A., Holler, F.J & Nieman, A.T., 1997, Principle of Instrumental Analysis, Fifth Edition, New York, Hancourt Brace & Company. Soerawidjaja, Tatang H, 2006, Fondasi-Fondasi Ilmiah dan Keteknikan dari Teknologi Pembuatan Biodiesel, Handout Seminar Nasional; Biodiesel Sebagai Energi Alternatif Masa Depan, UGM Yogyakarta. Supandi, 2003, Pembuatan Biodiesel Melalui Transesterifikasi Minyak Kelapa Menggunakan Metanol dengan Katalis Natrium Metoksida (NaOCH3), Skripsi S1, Jurusan Kimia MIPA, UNS, Surakarta Van, Gerpen, J., Shanks, B., Pruszko, R., 2004, Biodiesel Production Technology, National Renewable Energy Laboratory, Collorado. Wibisono, Ardian, 2007, Conoco Phillips Produksi Biodiesel dari Lemak Babi, Jakarta. Winarno F.G, 1997, Kimia Pangan dan Gizi, Gramedia Pustaka, Jakarta. 50 Lampiran 1. Perhitungan Bilangan Asam Bilangan asam dihitung dari titrasi 1 ml minyak dalam erlenmeyer kemudian dititrasi dengan KOH 0,005 M. Bilangan asam dihitung menggunakan persamaan: Bilangan asam = ml KOH ´ M KOH ´ 56,1 berat sampel Sedangkan % berat asam lemak dihitung menggunakan persamaan: % asam lemak bebas = ml KOH ´ M KOH x BM minyak 100% berat sampel x 1000 Dari titrasi terhadap minyak hasil esterifikasi dengan variasi presentase katalis diperoleh: Minyak A B N KOH 0,5 0,005 V1 (ml) V2 (ml) V3 (ml) V (ml) 4,45 1,32 4,48 1,35 4,46 1,32 4,46 1,33 Keterangan: A = Minyak Ikan tanpa perlakuan awal B = Minyak ikan hasil esterifikasi Bilangan asam 28,18 0,42 % asam lemak bebas 2,23 6,65 x 10-3 51 Lampiran 2. Spektra 1H-NMR Minyak ikan 52 Lampiran 3. Spektra 1H-NMR Metil Ester 0,5x MTBE, 5 menit 53 Lampiran 4. Spektra 1H-NMR Metil Ester 0,5x MTBE, 10 menit 54 Lampiran 5. Spektra 1H-NMR Metil Ester 0,5x MTBE, 15 menit 55 Lampiran 6. Spektra H-NMR Metil Ester 0,5x MTBE, 20 menit 56 Lampiran 7. Spektra 1H-NMR Metil Ester 0,5x MTBE, 25 menit 57 Lampiran 8. Spektra 1H-NMR Metil Ester 1x MTBE, 5 menit 58 Lampiran 9. Spektra 1H-NMR Metil Ester 1x MTBE, 10 menit 59 Lampiran 10. Spektra 1H-NMR Metil Ester 1x MTBE, 15 menit 60 Lampiran 11. Spektra 1H-NMR Metil Ester 1x MTBE, 20 menit 61 Lampiran 12. Spektra 1H-NMR Metil Ester 1x MTBE, 25 menit 62 Lampiran 13. Spektra 1H-NMR Metil Ester 1,5x MTBE, 5 menit 63 Lampiran 14. Spektra 1H-NMR Metil Ester 1,5x MTBE, 10 menit 64 Lampiran 15. Spektra 1H-NMR Metil Ester 1,5x MTBE, 15 menit 65 Lampiran 16. Spektra 1H-NMR Metil Ester 1,5x MTBE, 20 menit 66 Lampiran 17. Spektra 1H-NMR Metil Ester 1,5x MTBE, 25 menit 67 Lampiran 18. Spektra 1H-NMR Metil Ester 2x MTBE, 5 menit 68 Lampiran 19. Spektra 1H-NMR Metil Ester 2x MTBE, 10 menit 69 Lampiran 20. Spektra 1H-NMR Metil Ester 2x MTBE, 15 menit 70 Lampiran 21. Spektra 1H-NMR Metil Ester 2x MTBE, 20 menit 71 Lampiran 22. Spektra 1H-NMR Metil Ester 2x MTBE, 25 menit 71 Lampiran 23. Tabel Kemurnian Biodiesel pada Berbagai Kondisi t 0,5:1 (v/v) (menit) 1:1 (v/v) 1,5:1 (v/v) 2:1 (v/v) IME ITAG CME IME (%) ITAG CME IME ITAG CME IME ITAG CME (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) (%) 5 13750,0 504,0 93,81 4725,0 19,0 99,28 6099,0 632,8 84,26 7745,4 231,4 94,89 10 15951,6 1618,3 84,56 3417,7 262,8 87,84 6355,2 281,8 92,61 8648,8 540,0 89,89 15 5833,0 71,2 97,85 6048,9 0,0 100,0 7377,8 278,4 93,64 20 7433,0 0,0 100,0 6934,1 267,0 93,52 6236,0 126,4 96,48 5550,2 0,0 100,0 25 6618,7 115,5 96,95 6533,0 91,3 90,73 6825,6 237,0 93,57 Rumus yang digunakan: C ME (%) = 100 x 5 I ME 5 I ME + 9 I TAG 100,0 7108,0 0,0 97,55 6040,0 343,0 72 Lampiran 24. Gambar kromatografi gas Metil Ester pada 0,5 MTBE, 20 menit 73 Lampiran 25. Kondisi Operasi Kromatografi Gas Spektrometer Massa (GC-MS) Jenis Kolom : DB 5 MS panjang 30 meter Suhu kolom : 60 oC Suhu detektor : 300 oC Suhu injektor : 310 oC Injection Mode : Split Flow Control Mode : Pressure Pressure : 100 kPa Total flow : 36,6 mL/min Column Flow : 1,6 mL/min Linear Velocity : 46,4 cm/sec 74 Lampiran 26. Fragmentasi senyawa Metil Ester Miristat Spektra Massa senyawa I Spektra Massa senyawa Metil Ester Miristat Struktur senyawa metil ester miristat O O Perkiraan Fragmentasi CH3(CH2)12C O OCH3 -CH3(CH2)8 -CH3(CH2)9CH=CH2 O + (CH2)4-C OCH3 m/z = 115 H2C=C O CH2CH2C m/z = 87 OH OCH3 m/z = 74 (puncak dasar) -CH2=CH2 + + OCH3 75 Lampiran.27. Fragmentasi senyawa Metil Ester Palmitoleat Spektra Massa senyawa II Spektra Massa senyawa Metil Ester Palmitoleat Struktur metil ester palmitoleat. O O Perkiraan Fragmentasi O CH3(CH2)5CH=CH(CH2)7C OCH3 O -CH3(CH2)5CH=CH(CH2)4CH=CH2 + H2C=C OH OCH3 m/z = 74 -(CH2)7C OCH3 CH3(CH2)5CH=CH+ m/z = 111 - CH3(CH2)2CH=CH2 - CH3CH2CH=CH2 CH3CH2CH=CH+ m/z = 55 (puncak dasar) - CH3CH=CH2 + CH3(CH2)2CH=CH m/z = 69 CH3CH=CH+ m/z = 41 76 Lampiran 28. Fragmentasi senyawa Metil Ester Palmitat Spektra Massa senyawa III Spektra Massa senyawa Metil Ester Palmitat Struktur metil ester palmitat O O Perkiraan Fragmentasi O CH3(CH2)14C - CH3(CH2)11CH=CH2 O + (CH2)6C OCH3 + OCH3 m/z = 143 CH2=C - CH3CH2CH=CH2 + CH2CH2CH2CH3 O + CH2CH2C m/z = 87 OH OCH3 m/z = 74 (puncak dasar) - OCH3 OCH3 CH3C=O+ m/z = 43 77 Lampiran 29. Fragmentasi senyawa Metil Ester Stearat Spektra Massa senyawa IV Spektra Massa senyawa Metil Ester Stearat Struktur metil ester stearat. O O Perkiraan fragmentasi O CH3(CH2)16C OCH3 - CH3(CH2)10 - CH3(CH2)13CH=CH2 O + (CH2)6C + OCH3 m/z = 143 O CH2CH2C m/z = 87 CH2CH2CH2CH3 CH2=C OCH3 m/z = 57 - CH3CH2CH=CH2 + + OH OCH3 - OCH3 CH3C=O+ m/z = 43 78 Lampiran 30. Fragmentasi senyawa Metil Ester 11-eikosenoat Spektra Massa senyawa V Spektra Massa senyawa Metil Ester 11-eikosenoat Struktur metil ester 11-eikosenoat O O Perkiraan fragmentasi O CH3(CH2)7CH=CH(CH2)9C OCH3 O -(CH2)9C OCH3 CH3(CH 2)7CH=CH+ m/z = 139 -CH3(CH2)4CH=CH2 -CH3(CH2)3CH=CH2 + CH=CH-CH3 m/z = 41 + CH=CH-CH2-CH3 m/z = 55 puncak dasar -CH3(CH2)2CH=CH2 + CH=CH(CH2)2CH3 m/z = 69 79 Lampiran 31. Gambar hasil uji analisa ASTM