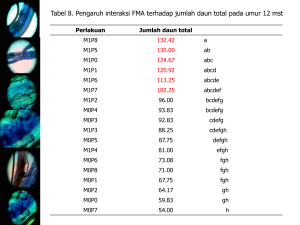
FULL TEXT TESIS 2015 - Official Site of MOH.EGA ELMAN MISKA
advertisement

RESPON PERTUMBUHAN BIBIT AREN (Arenga pinnata (Wurmb) Merr.) TERHADAP INOKULASI FUNGI MIKORIZA ARBUSKULA INDIGENOUS MOH. EGA ELMAN MISKA SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2015 PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA* Dengan ini saya menyatakan bahwa tesis berjudul Respon Pertumbuhan Bibit Aren (Arenga pinnata (Wurmb) Merr.) terhadap Inokulasi Fungi Mikoriza Arbuskula Indigenous adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor. Bogor, September 2015 Moh. Ega Elman Miska NIM A252130021 * Pelimpahan hak cipta atas karya tulis dari penelitian kerjasama dengan pihak luar IPB harus didasarkan pada perjanjian kerjasama yang terkait. RINGKASAN MOH. EGA ELMAN MISKA. Respon Pertumbuhan Bibit Aren (Arenga pinnata (Wurmb) Merr.) terhadap Inokulasi Fungi Mikoriza Arbuskula Indigenous. Dibimbing oleh AHMAD JUNAEDI, ADE WACHJAR, dan IRDIKA MANSUR. Tanaman aren (Arenga pinnata (Wurmb.) Merr.) termasuk famili Arecaceae yang dikelompokkan ke dalam tanaman multi guna (multiple purpose trees). Tanaman aren merupakan tanaman yang pemanfaatannya paling luas dibandingkan dengan spesies lainnya. Potensi dari tanaman aren sangat tinggi dalam pemenuhan kebutuhan pangan dan alternatif energi terbarukan. Kendala yang dihadapi dalam pengembangan dan budidaya tanaman aren adalah pertumbuhan bibit yang lambat. Salah satu alternatif yang dikembangkan dalam mengatasi kendala tersebut adalah pemanfaatan Fungi Mikoriza Arbuskula (FMA). Adanya FMA pada bibit aren diharapkan dapat meningkatkan pertumbuhan, terutama peningkatan serapan hara sehingga bibit mampu tumbuh baik di lapangan dan mengatasi keadaan lingkungan yang beragam. Tahap pembibitan ini merupakan langkah awal untuk menghasilkan bibit aren yang bermutu. Sejauh ini, belum ada informasi mengenai teknik budidaya dalam upaya peningkatan pertumbuhan bibit aren melalui pemanfaatan mikoriza untuk mendapatkan bibit aren yang berkualitas. Penelitian terdiri atas tiga percobaan yang memiliki keterkaitan yaitu (1) isolasi dan karakterisasi tipe FMA dari rhizosfer aren, (2) status keberadaan FMA pada tanaman aren, dan (3) uji keefektifan inokulum tanah FMA dari bawah tegakan aren dalam meningkatkan pertumbuhan bibit aren. Isolasi dan karakterisasi FMA dari contoh tanah yang diamati berasal dari rhizosfer aren yang tersebar di tiga lokasi kabupaten, yaitu Cianjur, Sukabumi, dan Lebak. Berdasarkan hasil dari contoh tanah yang memiliki jumlah kepadatan spora terbanyak dari penangkaran (trapping) dan memiliki jumlah propagul infektif tertinggi dari penghitungan Most Probable Number (MPN), selanjutnya akan diuji keefektifannya dalam meningkatkan pertumbuhan bibit aren. Uji keefektifan inokulum tanah FMA indigenous pada bibit aren menggunakan Rancangan Acak Lengkap (RAL) 2 faktor. Faktor pertama adalah pemupukan P (P0 = tanpa pemupukan P dan P1 = dengan pemupukan P). Faktor ke-dua adalah inokulasi FMA (M0 = tanpa inokulum FMA, M1 = inokulum FMA indigenous, dan M2 = inokulum FMA mycofer ). Hasil isolasi dan karekterisasi FMA menunjukkan bahwa terdapat empat genus FMA dari bawah tegakan aren, yaitu: Glomus sp. (7 tipe spora), Acaulospora sp. (5 tipe spora), dan Scutellospora sp. (1 tipe spora) ditemukan di Cianjur, Sukabumi, dan Lebak, sedangkan Gigaspora sp. (1 tipe spora) hanya ditemukan di Sukabumi. Hasil penelitian status keberadaan FMA pada rhizosfer aren menunjukkan bahwa contoh tanah dari lokasi Sukabumi memiliki kepadatan spora dan propagul infektif lebih tinggi dibandingkan contoh tanah dari Cianjur dan Lebak. Hasil uji keefektifan inokulum FMA menunjukkan bahwa inokulum FMA indigenous mampu meningkatkan pertumbuhan bibit aren berdasarkan parameter tinggi tanaman, panjang pelepah daun, diameter pangkal pelepah, bobot kering tajuk, biomassa total, serapan hara P, jumlah spora, dan persen infeksi akar. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA menunjukkan adanya peran inokulum FMA terhadap panjang pelepah daun, jumlah spora, dan persen infeksi akar dengan nilai tertinggi diperoleh pada perlakuan inokulum FMA indigenous tanpa pemupukan P. Kata kunci: inokulum tanah, keefektifan, status FMA SUMMARY MOH. EGA ELMAN MISKA. Growth Response of Sugar Palm Seedling (Arenga pinnata (Wurmb) Merr.) to Inoculations of Indigenous Arbuscular Mycorrhyzal Fungi. Supervised by AHMAD JUNAEDI, ADE WACHJAR, and IRDIKA MANSUR. Sugar palm (Arenga Pinnata (Wurmb) Merr.) is a multiple-purpose tree (MPT) from the Arecaceaae family. Besides yielding sugars, it provides a great number of benefits than the other products. It also one of the most diversified species in multipurpose tree culture and has a high potential for food and renewable energy fulfillment. Availability of quality seed is the constraints in the development and cultivation. One of the alternatives to developed the constratints through by inoculation of Arbuscular Mycorrhyzal Fungi (AMF). The AMF on sugar palm seedlings are expected to increase growth, especially to increase nutrient uptake so that the seedlings could grow well in the fields and the state of the diverse environment. The seedlings stage is the first step to produce of sugar palm seed quality. There is no information regarding the cultivation technique to increase seedlings growth through using mychorrhiza to obtain the seed quality. This research consists of three trials with interrelated experiments: (1) isolation and characterization of the types of Arbuscular Mychorrizal Fungi (AMF) on the rhyzosphere of sugar palms, (2) the existence of Arbuscular Mychorrizal Fungi (AMF) status on sugar palm, (3) the effectiveness of the AMF soil inoculum from under sugar palm stands on sugar palm seed. The isolation and characterization of AMF of soil sample was observed from sugar palm rhizosfer over three districts location, i.e: Cianjur, Sukabumi, and Lebak. Based on soil samples results, the highest number of spores density of trapping and inefective propagules of Most Probable Number (MPN) counting would have the effectiveness of sugar palm seeds. This research used completely randomized design with two factor. The first factor is Posphorus (P) fertilizing were used two levels: without (P0) and with P fertilizer (P1). The second factor is Inoculation of AMF were used three levels: without inoculum (M0); AMF indigenous inoculum (M1); AMF mycofer inoculum (M2). The isolation and characterization of AMF result showed that there are four genera of AMF under sugar palm stands, i.e.: Glomus sp. (7 species), Acaulospora sp. (5 species), and Scutellospora sp. (1 species) founded in Cianjur, Sukabumi, and Lebak, whereas Gigaspora sp. (1 species) only found in Sukabumi. The result on the existance of AMF status on the rhyzosphere of sugar palm showed that soil samples from Sukabumi had a higher density both of spores and inefective propagules than Cianjur and Lebak. The result on the effectiveness showed that AMF indigenous inoculum increase growth on sugar palm seedling based on parameters of plant height, rachis length, stem diameter, shoot dry weight, root dry weight, total biomassa, P nutrient absorption, number of spore, and percent of root colonization. Interaction between P fertilizer with AMF inoculum showed the role of AMF inoculum to rachis length, number of spore, and percent of root colonization with the highest value was obtained in treatment AMF indigenous inoculum without P fertilizer. Keywords: AMF status, effectiveness, soil inoculum © Hak Cipta Milik IPB, Tahun 2015 Hak Cipta Dilindungi Undang-Undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB RESPON PERTUMBUHAN BIBIT AREN (Arenga pinnata (Wurmb) Merr.) TERHADAP INOKULASI FUNGI MIKORIZA ARBUSKULA INDIGENOUS MOH. EGA ELMAN MISKA Tesis sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Agronomi dan Hortikultura SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2015 Penguji Luar Komisi pada Ujian Tesis: Dr Ir Supijatno, MSi Judul Tesis : Respon Pertumbuhan Bibit Aren (Arenga pinnata (Wurmb) Merr.) terhadap Inokulasi Fungi Mikoriza Arbuskula Indigenous Nama : Moh. Ega Elman Miska NIM : A252130021 Disetujui Komisi Pembimbing Dr Ir Ahmad Junaedi, MSi Ketua Dr Ir Ade Wachjar, MS Anggota Dr Ir Irdika Mansur, MForSc Anggota Diketahui oleh, Ketua Program Studi/Mayor Agronomi dan Hortikultura Dekan Sekolah Pascasarjana IPB Dr Ir Maya Melati, MS, MSc Dr Ir Dahrul Syah, MScAgr Tanggal ujian: 18 September 2015 Tanggal lulus: PRAKATA Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dipilih dan dilaksanakan sejak bulan Maret 2014 hingga Juni 2015 ialah Respon Pertumbuhan Bibit Aren (Arenga pinnata (Wurmb) Merr.) terhadap Inokulasi Fungi Mikoriza Arbuskula Indigenous. Terima kasih penulis ucapkan kepada 1. Dr Ir Ahmad Junaedi, MSi selaku ketua komisi pembimbing yang telah membimbing mulai dari awal penyusunan proposal penelitian hingga penulisan tesis ini. Penulis juga mengucapkan terima kasih atas masukan dan sumbangan ide-idenya dalam penelitian. 2. Dr Ir Ade Wachjar, MS selaku anggota komisi pembimbing yang telah membimbing mulai dari awal penyusunan proposal penelitian hingga penulisan tesis ini. 3. Dr Ir Irdika Mansur, MForSc selaku anggota komisi pembimbing yang telah membimbing mulai dari awal penyusunan proposal penelitian hingga penulisan tesis ini. 4. Dr Ir Supijatno, MSi selaku penguji luar komisi pembimbing yang telah memberikan masukan dan koreksian dalam perbaikan tesis ini. 5. Penulis juga mengucapkan terima kasih atas bantuan dana penelitian yang dibiayai melalui program DIPA, SEAMEO BIOTROP tahun 2015. 6. Orang tua dan Istri tercinta yang selalu memberikan dukungan penuh terhadap penulis untuk mencari ilmu setinggi-tingginya. 7. Teman-teman seperjuangan di Mayor Agronomi dan Hortikultura angkatan 20l3 yang telah membantu selama proses penelitian, pengolahan data, maupun semangat yang diberikan terhadap penulis. Sebagian hasil penelitian telah diterima dan akan diterbitkan di jurnal nasional Jurnal Silvikultur Tropika. Semoga karya ilmiah ini bermanfaat. Bogor, September 2015 Moh. Ega Elman Miska DAFTAR ISI DAFTAR TABEL vi DAFTAR GAMBAR vii DAFTAR LAMPIRAN vii PENDAHULUAN Latar belakang Perumusan masalah Tujuan penelitian Hipotesis penelitian 1 2 2 2 TINJAUAN PUSTAKA Botani dan ekologi tanaman aren Penelitian aren terdahulu Fungi mikoriza arbuskula (FMA) Peranan fungi mikoriza arbuskula bagi tanaman Inokulum Tanah Faktor-faktor yang mempengaruhi pembentukan mikoriza 3 5 6 7 9 9 ISOLASI DAN KARAKTERISASI SPORA FUNGI MIKORIZA ARBUSKULA PADA RHIZOSFER AREN (Arenga pinnata (Wurmb.) Merr.) Pendahuluan Metode Penelitian Hasil dan Pembahasan Kesimpulan dan Saran 13 13 14 20 POTENSI DAN STATUS FUNGI MIKORIZA ARBUSKULA PADA RHIZOSFER TANAMAN AREN (Arenga pinnata (Wurmb.) Merr.) Pendahuluan Metode Penelitian Hasil dan Pembahasan Kesimpulan dan Saran 22 22 24 26 UJI KEEFEKTIFAN INOKULUM TANAH FMA DARI BAWAH TEGAKAN AREN PADA BIBIT AREN (Arenga pinnata (Wurmb.) Merr.) Pendahuluan Metode Penelitian Hasil dan Pembahasan Kesimpulan dan Saran 28 28 32 43 DAFTAR PUSTAKA 44 LAMPIRAN 51 DAFTAR TABEL 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. Hasil analisis kimia tanah dari rhizosfer aren pada tiga lokasi kabupaten Kerapatan spora FMA pada contoh tanah dari bawah tegakan aren di tiga lokasi kabupaten Karakterisasi tipe spora FMA yang berasal dari bawah tegakan aren di tiga lokasi kabupaten Hasil perhitungan uji MPN pada inokulum tanah FMA dari bawah tegakan aren di tiga lokasi kabupaten Analisis tanah media di awal dan akhir penelitian Analisis hara N, P, dan K pada jaringan tanaman Pengaruh faktor pemupukan P dan inokulum FMA terhadap tinggi tanaman bibit aren sampai 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap jumlah pelepah daun bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap panjang pelepah bibit aren pada 24 MSP Interaksi pemupukan P dan inokulum FMA terhadap rata-rata panjang pelepah daun bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap diameter pangkal pelepah bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap luas daun bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap volume dan panjang akar bibit aren pada 24 MSP Interaksi pemupukan P dan inokulum FMA terhadap rata-rata jumlah akar primer bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap bobot kering tajuk dan akar bibit aren pada 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap biomassa total bibit aren pada 12 dan 24 MSP Pengaruh faktor pemupukan P dan inokulum FMA terhadap laju tumbuh relatif bibit aren pada 12-24 minggu Pengaruh pemupukan P dan inokulum FMA terhadap serapan unsur P bibit aren pada 24 MSP Interaksi pemupukan P dan inokulum FMA terhadap rata-rata jumlah spora bibit aren pada 24 MSP Interaksi pemupukan P dan inokulum FMA terhadap rata-rata persen infeksi akar bibit aren pada 24 MSP Efisiensi pemupukan P pada perlakuan dosis pupuk 6.3 g P tanaman-1 15 16 17 26 32 32 33 34 34 35 36 36 37 38 38 39 40 40 41 41 43 DAFTAR GAMBAR 1. Kondisi lahan pengambilan contoh tanah dan akar di tiga lokasi kabupaten 2. Presentase kolonisasi FMA pada akar dari bawah tegakan aren pada tiga lokasi kabupaten 3. Kepadatan spora FMA hasil penangkaran dari contoh tanah pada tiga lokasi kabupaten 4. Tipe spora FMA yang ditemukan setelah penangkaran 5. Infeksi FMA pada bibit aren 15 24 25 25 42 DAFTAR LAMPIRAN 1. Kriteria penilaian sifat kimia tanah RIWAYAT HIDUP 52 53 PENDAHULUAN Latar Belakang Tanaman aren (Arenga pinnata (Wurmb) Merr.) termasuk famili Arecaceae yang dikelompokkan ke dalam tanaman multi guna (multiple purpose trees). A. pinnata merupakan tanaman yang pemanfaatannya paling luas dibandingkan dengan spesies lainnya. Hasil utama tanaman aren yang bernilai ekonomi tinggi adalah nira (Akuba 2004; Rindengan dan Manaroinsong 2009). Potensi dari tanaman aren sangat tinggi dalam pemenuhan kebutuhan pangan dan alternatif energi terbarukan. Salah satu komponen pengembangan produksi yang perlu dikelola dengan baik ke depan dalam bentuk agribisnis tanaman aren, yaitu penyediaan benih bermutu dan pembibitan sebagai bahan tanam (BPKPL 2014). Beberapa provinsi di Indonesia telah melakukan usaha peningkatan produksi tanaman aren. Pada tahun 2009 total areal tanaman aren di seluruh Indonesia mencapai 66 441 ha dengan produksi gula sebesar 42.18 ton (Ditjenbun 2011). Pertumbuhan bibit aren sangat lambat dan membutuhkan waktu 15 sampai 18 tahun untuk memasuki tahap menghasilkan buah sejak tanam. Bunga muda akan muncul dari bagian paling atas tanaman dan bunga muda berikutnya muncul pada bagian bawah. Sekitar 4 sampai 7 bunga pada bagian atas merupakan bunga betina yang akan menghasilkan buah, sedangkan bagian bawah dari bunga betina akan muncul bunga jantan yang akan disadap dan diambil niranya (Harada et al. 2005; Chantaraboon et al. 2010). Budidaya aren secara konvensional mengalami kendala, terutama perbanyakan aren melalui benih. Benih aren memiliki struktur kulit yang keras dan tebal. Hal inilah yang menyebabkan permeabilitasnya rendah dan dormansi benih aren cukup lama, yaitu berkisar 1 sampai 12 bulan sehingga menyebabkan keterbatasan bibit di pasaran (Mujahidin et al. 2003). Penelitian mengenai teknik budidaya aren dari benih telah dikaji dengan baik. Hasil penelitian Rofik dan Murniati (2008) menunjukkan bahwa metode deoperkulasi/skarifikasi pada embrio merupakan teknik sederhana untuk mematahkan dormansi benih aren. Kendala lain yang dihadapi dalam pengembangan dan budidaya tanaman aren adalah ketersediaan bibit yang bermutu. Penurunan mutu bibit menjadi faktor memperlambat masa pindah tanam ke lapangan. Salah satu upaya untuk mempercepat pertumbuhan bibit dan meningkatkan mutu bibit aren, yaitu pemanfaatan fungi mikoriza arbuskula (FMA). Salah satu peran dari fungi mikoriza arbuskula (FMA), yaitu bioprosesor, mampu membantu tanaman untuk meyerap hara dan air dari lokasi yang tidak terjangkau oleh rambut akar (Nusantara et al. 2012). Susanti (2004) melaporkan bahwa inokulasi FMA dari tegakan jati Cepu dan FMA Mycofer mampu meningkatkan rata-rata pertumbuhan tinggi bibit jati masing-masing 31% dan 11%, pertambahan diameter 23.1% dan 28.1%, serta berat kering total 45.04% dan 21.5% dibandingkan dengan kontrol. Penelitian ini diharapkan dapat berguna sebagai informasi untuk mendapatkan bibit aren yang bermutu dan dijadikan acuan untuk pengembangan bibit aren unggul. 2 Perumusan Masalah Aren ditinjau dari aspek budidaya belum banyak dilakukan, sampai saat ini masyarakat masih memanfaatkan aren yang tumbuh secara alamiah. Aren memliki prospek yang sangat baik untuk dikembangkan, baik dari segi ekonomi, sosial maupun dari segi ekologi. Oleh karena itu, budidaya aren mulai dari penyediaan bibit, penanaman sampai pemeliharaan sangat diperlukan. Teknologi budidaya aren secara ilmiah masih belum banyak dikaji sehingga perlu dilakukan penelitian untuk memperoleh teknologi budidaya anjuran sebagai Good Agricultural Practice (GAP). Kajian mengenai respon pertumbuhan bibit aren terhadap inokulasi Fungi Mikoriza Arbuskula (FMA) indigenous penting dilakukan, karena dalam usaha budidaya tanaman, ketersediaan bibit tanaman mutlak diperlukan. Ketersediaan bibit aren yang bermutu diperoleh melalui teknologi pembibitan yang baik. Salah satu teknologi penting dalam pembibitan adalah teknik inokulasi mikoriza, yang dapat menunjang pertumbuhan dan peningkatan mutu bibit tanaman. FMA berperan aktif membantu tanaman untuk menyerap hara (terutama serapan unsur P) dan air dari lokasi yang tidak terjangkau oleh rambut akar. Fungi mikoriza arbuskula ditemukan pada hampir di sebagian besar tanah dan umumnya tidak memiliki inang yang spesifik. Walaupun demikian, tingkat populasi dan komposisi jenis FMA sangat beragam dan dipengaruhi oleh karakteristik tanaman dan faktor lingkungan. Dengan demikian, setiap ekosistem kemungkinan memiliki keanekaragaman FMA dengan jenis yang sama atau berbeda. Penelitian mengenai status mikoriza dan pengaruh inokulasi FMA terhadap pertumbuhan aren masih sangat terbatas. Tujuan Penelitian Tujuan penelitian ini adalah 1) mengisolasi dan mengkarakterisasi tipe spora FMA dari bawah tegakan aren pada lokasi yang berbeda; 2) mengetahui keberadaan FMA yang efektif dan berpotensi dari bawah tegakan aren; 3) menguji keefektifan inokulum tanah FMA dari bawah tegakan aren terhadap pertumbuhan bibit aren. Hipotesis Penelitian 1. Terdapat perbedaan keanekaragaman tipe FMA indigenous pada beberapa lokasi tegakan aren. 2. Terdapat perbedaan keberadaan FMA yang efektif dan berpotensi dari bawah tegakan aren. 3. Terdapat inokulum FMA indigenous yang memiliki keefektifan yang sama atau lebih tinggi dari inokulum standar Mycofer. 3 TINJAUAN PUSTAKA Botani dan Ekologi Tanaman Aren Botani Tanaman aren menurut klasifikasi tanaman termasuk ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, bangsa Spadicitlorae, suku Palmae dan jenis Arenga pinnata Merr. Tanaman aren tumbuh dan tersebar pada beberapa daerah di Indonesia dengan nama yang berbeda-beda, seperti halnya di Batak Karo disebut Paula, di Nias disebut Peto, di Minangkabau disebut Biuluk, di Lampung disebut Hanau, di Madura disebut Are, di Jawa Tengah disebut Aren, di Aceh disebut Bakjuk, dan di Bali disebut Hano, di daerah Nusa Tenggara memiliki delapan nama yang berbeda, yaitu Jenaka, Pola, Nao, Karodi, Moka, Make, Bale dan Bone, sedangkan di daerah Sulawesi memiliki lima nama, yaitu Seko, Siho, Tuna, Nawa, dan Roni dan di Jawa Barat disebut Kawung (Rindengan dan Manaroinsong 2009). Botani tanaman aren dibedakan ke dalam tiga jenis tanaman yaitu aren (Arenga pinnata (Wurmb) Merr.), aren gelora (Arenga undulatifolia), dan aren sagu (Arenga microcarpa). Jenis aren yang termasuk suku Arecaceae (pinangpinangan) yang merupakan tumbuhan biji tertutup (Angiospermae) adalah aren, aren gelora, dan aren sagu (Mogea et al. 1991). Akar pohon aren berbentuk serabut, menyebar dan cukup dalam mencapai lebih dari 5 m sehingga tanaman aren diandalkan sebagai vegetasi pencegah erosi, terutama untuk daerah yang tanahnya mempunyai kemiringan lebih dari 20%. Batang pohon aren sangat padat dan kuat serta diselimuti oleh selubung daun yang berwarna hitam yang disebut ijuk. Selubung daun muda menutupi bagian batang bawah dengan bentuk yang masih lembut hampir seperti rambut putih (Orwa et al. 2009). Batang tanaman aren tidak memiliki lapisan kambium, sehingga tidak dapat tumbuh semakin besar lagi. Diameter batang mencapai 65 cm, sedangkan tinggi mencapai 15 sampai 20 m (jika terhitung dengan tajuk daun yang menjulang di atas batang) (Florido dan Mesa 2003; Orwa et al. 2009). Morfologi tanaman aren hampir mirip dengan tanaman kelapa (Cocos nucifera), perbedaannya terletak pada batang bawahnya, pada tanaman kelapa batang bawahnya bersih, sedangkan batang tanaman aren diselimuti ijuk berwarna hitam dan sangat kuat. Kondisi tersebut menyebabkan batang tanaman aren ditumbuhi banyak tanaman paku-pakuan (Smits 1996; Orwa et al. 2009). Tanaman aren mulai berbunga pada umur 6 sampai 12 tahun. Karangan bunga pertama dari ruas batang yang berada di pucuk pohon, kira-kira letaknya sedikit di bawah tempat tumbuh daun muda, tetapi makin tua tanaman aren maka keluarnya bunga jantan akan muncul bergantian dengan bunga betina di ketiak daun daerah bawah (Mogea et al. 1991). Bunga jantan tanaman aren terdapat pada untaian buah yang berjumlah sekitar 25, pangkalnya melekat pada sebuah tandan. Bunga betina berbentuk bulat panjang 1.2 sampai 1.5 cm berwarna ungu. Tanaman aren yang berumur 12 tahun dan banyak membentuk tongkol bunga betina, biasanya tidak dilakukan penyadapan nira. Setelah muncul tandan bunga jantan yang disebut ubas, disusul 4 oleh bunga-bunga jantan lainnya yang disebut adik ubas, penyadapan nira sudah mulai dilakukan pada masa itu (Elberson dan Oyen 2010). Bentuk daun tanaman aren yang sudah dewasa dan tua bersirip ganjil seperti daun kelapa, secara ukuran daun dan pelepah daunnya lebih besar dan kuat. Warna daun tanaman aren hijau gelap, semakin tua umur daun aren tidak akan melengkung ke bawah tapi tetap kaku ke atas atau menempel agak miring pada batangnya. Daun aren yang sudah tua, helaian daunnya akan rontok dan lepas bersama dengan pangkal pelepahnya yang menempel pada batang. Pelepah daun aren melebar di bagian pangkalnya, semakin ke pucuk makin menyempit dan sepanjang 5 m merupakan bagian tangkai daun (Mogea et al. 1991; Orwa et al. 2009). Panjang buah aren berkisar 5 sampai 8 cm dan terdapat tiga biji yang keras berwarna hitam. Waktu untuk perkecambahan biji sangat sulit diprediksikan secara alami, tetapi biasanya perkecambahan muncul antara 1 bulan sampai lebih dari 12 bulan. Tanaman aren dapat membentuk sampai 250 000 buah, jika tidak dilakukan penyadapan (Elberson dan Oyen 2010). Ekologi Tanaman aren populasinya tersebar antara 75 0BT sampai 145 0BT dan 25 LU sampai 10 0LS. Penyebarannya terdapat di beberapa wilayah basah Asia Tenggara, meluas mulai dari India, Indonesia (Jawa, Sumatera dan Irian jaya), Malaysia, Filipina, Papua Nugini, Myanmar, Thailand, Vietnam, dan sampai utara ke Kepulauan Ryukyu (Mogea et al. 1991; Elberson dan Oyen 2010). Tanaman aren tidak membutuhkan sinar matahari yang terik sepanjang hari, sehingga tanaman aren mampu tumbuh dengan subur di daerah-daerah perbukitan yang lembab dan banyak ditumbuhi oleh berbagai tanaman keras. Kondisi yang diperlukan pada masa pertumbuhannya, tanaman aren membutuhkan suhu 20 sampai 25 0C, dalam kisaran suhu tersebut dapat membantu tanaman aren untuk berbuah. Tanaman aren memerlukan kelembaban tanah dan ketersediaan air dengan kondisi curah hujan yang cukup tinggi 1 200 sampai 3 500 mm/tahun. Hal tersebut sangat berpengaruh dalam pembentukan mahkota pada tanaman aren (Polnaja 2000). Tanaman aren mampu tumbuh dengan baik dan mampu berproduksi pada ketinggian 500 sampai 1 200 m di atas permukaan laut. Tanaman aren dapat tumbuh dengan optimal baik di hutan primer maupun sekunder (Florido dan Messa 2003). Tanah yang mengandung batu cadas dan air tanah yang menggenang di lapisan dangkal yang kurang dari 1 m mampu menghambat perakaran tanaman aren. Tanaman aren secara umum tidak membutuhkan jenis tanah yang khusus untuk pertumbuhannya sehingga tanaman aren dapat tumbuh pada tanah-tanah liat (berlempung), berkapur, dan berpasir (Akuba 2004). 0 5 Penelitian Aren Terdahulu Kajian mengenai eksplorasi tanaman aren telah dilakukan oleh beberapa peneliti. Mogea et al. (1991) melakukan kajian terkait sebaran aren secara geografis dengan mengambil studi kasus beberapa lokasi di Indonesia untuk megetahui kegunaan dan penyebaran aren pada setiap daerah. Konservasi dan kearifan lokal dari tanaman aren telah diteliti dengan baik, hasil eksplorasi tersebut melaporkan bahwa tanaman aren dianggap memiliki potensi dan mampu menunjang kehidupan bagi warga lokal di Taman Nasional Gunung Halimun. Oleh karena itu, masayarakat sekitar membutuhkan bantuan untuk pengembangan tanaman yang berkelanjutan, sehingga ekosistem hutan di Taman Nasional Gunung Halimun tidak rusak (Harada et al. 2005). Identifikasi dan karakterisasi tanaman aren banyak dilakukan penelitian guna mendapatkan informasi bibit aren yang terbaik dalam menunjang peningkatan dan pengembangan produktivitas aren. Pongsattayapipat dan Barfod (2009) mengidentifikasi aren lokal Thailand. Hasil penelitian menunjukkan bahwa terdapat tiga spesies Arenga yang memiliki karakteristik yang sama. Identifikasi yang dilakukan meliputi karakter vegetatif dan reproduktif, yaitu perilaku dan morfologi daun, fenologi waktu pembungaan, bentuk bunga, dan buah. Tujuan penelitian tersebut supaya dalam penentuan taksonomi dapat dilakukan secara benar dan tepat sehingga dapat dilakukan pemetaan yang tepat serta sebagai sumber manajemen serta usaha konservasi ke depan. Penelitian mengenai teknik budidaya aren dari benih telah dikaji dengan baik, salah satunya dengan metode deoperkulasi. Hasil penelitian Rofik dan Murniati (2008) menunjukkan bahwa metode deoperkulasi/skarifikasi tepat pada embrio, merupakan teknik sederhana untuk mematahkan dormansi benih aren, sehingga dengan mematahkan dormansi biji mempercepat untuk pertumbuhan bibit aren. Media tanam yang digunakan sebagai media alternatif penyemaian benih aren adalah pasir, kokopit, dan arang sekam. Chantaraboon et al. (2009, 2010) mengkaji tentang perbedaan umur masak buah terhadap daya berkecambah dan waktu yang tepat untuk memisahkan bibit dari indukan untuk ditanam ke persemaian serta pengaruh pemupukan selama pembibitan. Spesies yang digunakan adalah Arenga westerhoutii. Hasil penelitian tersebut menunjukkan bahwa benih aren yang berumur 36 bulan dengan pelukaan kedua sisi memberikan hasil tertinggi tehadap perkecambahan benih. Penentuan waktu yang tepat untuk menanam bibit ke persemaian adalah ketika bibit memiliki satu daun dan dipotong 2/3 bagian. Metode ini dianggap mampu mengurangi evaporasi dan membantu pertumbuhan akar. Perlakuan pemupukan pada fase pembibitan tidak memberikan respon yang berbeda terhadap kontrol (tanaman berumur 1 sampai 3 tahun). Berbeda dengan penelitian selanjutnya yang menyatakan bahwa perlakuan pemupukan memberikan respon yang nyata jika dibandingkan dengan kontrol yang tanpa pemupukan. Furqoni (2014) mengkaji tentang karakterisasi dan respon pertumbuhan aren pada tingkat naungan berbeda selama fase pembibitan. Karakterisasi dilakukan dengan studi kasus enam ekotipe aren yang berbeda, hal ini dilakukan untuk membandingkan ekotipe tersebut dengan tingkat naungan sehingga mendapatkan ekotipe yang terbaik. Hasil penelitian menunjukkan bahwa pertumbuhan tanaman aren yang terbaik adalah di bawah naungan 50 sampai 64%. 6 Penelitian Matana (2013) tentang pengaruh penyadapan dan posisi tandan terhadap mutu benih serta teknik konservasi kecambah terhadap pertumbuhan bibit aren. Hasil penelitian tersebut menunjukkan benih dapat berasal dari pohon yang tandan bunga jantannya disadap maupun tidak disadap, sedangkan bunga betina dengan posisi tandan pertama sampai kelima bisa dijadikan sumber benih. Fungi Mikoriza Arbuskula (FMA) Mikoriza dalam ilmu botani merupakan suatu struktur (bentuk) sistem perakaran yang memiliki peran sebagai manifestasi adanya simbiosis. Kondisi yang bersamaan dan akar yang sama dapat diinfeksi oleh dua jenis endomikoriza yang berbeda. Hubungan antara cendawan dan perakaran tumbuhan tingkat tinggi merupakan hubungan mutualistik (saling menguntungkan). Endomikoriza merupakan salah satu bentuk fungi yang banyak ditemukan pada jaringan perakaran. Tipe fungi ini ditemukan pada setiap lapisan tanah yang subur dan memiliki karakteristik khas yang merupakan sebagai tempat penyimpanan dan transfer hara antara jamur dan tumbuhan inangnya (Bagyaraj 1991; Smith dan Read 2008). Fungi Mikoriza Arbuskula (FMA) memiliki struktur karakteristik khusus yang disebut arbuskul dan vesikel. Peranan arbuskul, yaitu membantu dalam mentransfer nutrien (terutama fosfat) dari tanah ke sistem perakaran (Rao 1994). Mikoriza dikelompokkan menjadi dua tipe berdasarkan bentuk dan cara infeksi funginya terhadap tumbuhan inangnya, yaitu endomikoriza dan ektomikoriza. Berdasarkan struktur tubuh dan cara infeksinya terhadap tanaman inang dikelompokkan menjadi tiga golongan besar, yaitu ektomikoriza, endomikoriza, dan ektendomikoriza (Imas et al. 1989; Smith dan Read 1997). Sifat dari endomikoriza atau FMA adalah cendawan yang bersifat obligat dan memiliki toleransi yang sangat luas di ekosistem. Beberapa tumbuhan yang dapat bersimbiosis dengan FMA, yaitu Angiospermae, Gymnospermae, Pteridophyta, dan Bryopita. Tanaman yang tergolong pada dicotyledonous 83% dan monocotyledonous 79% mampu bersimbiosis dengan FMA (Sieverding 1991; Smith dan Read 2008). Klasifikasi terbaru dari Glomeromycota didasarkan pada konsensus daerah mencakup gen RNA ribosom memiliki sembilan ordo, yaitu 1) Glomeraceae, memiliki empat famili Funnelifornis, Septoglmus, Glomus, dan Rhizopagus; 2) Archaespoceae yang memiliki satu famili Archaeospora; 3) Paraglomeraceae, memiliki satu famili Paraglomus; 4) Diversisporaceae, dengan famili Diversispora dan Redeckera; 5) Pacisporaceae, memiliki satu famili Pacispora; 6) Acaulosporaceae yang memiliki famili Acaulospora; 7) Gigasporaceae, memiliki lima famili Gigaspora, Dentiscutata, Cetraspora, Racocetra, dan Scutellospora; 8) Claoroideo-Glomeraceae, memiliki famili Claroideoglomus; 9) Ambisporaceae, memiliki dua famili Ambispora dan Geosiphon (Redecker et al. 2013). Bentuk spora FMA, yaitu globose, elips, sub-globose dengan atau tanpa hifa substending. Ukuran spora bervariasi dari yang terkecil 20 sampai 50 µm hingga terbesar 200 sampai 1 000 µm. Spora genus Glomus memiliki ukuran diameter berkisar 10 µm dan spora genus Scutellospora memiliki ukuran lebih dari 1 000 µm. Warna spora Ordo Glomales memiliki keragaman mulai dari hyaline, hitam, 7 merah, coklat, kuning, hitam, atau warna lainnya, sampai dengan atau tanpa orname seperti spot (Sylvia 2004). Menurut Brundrett (2004) bahwa secara anatomi spora berbeda-beda, dalam hal jumlah dan ketebalan lapisan dinding sel spora maupun isi sel. Peranan Fungi Mikoriza Arbuskula bagi Tanaman Peranan Fungi Mikoriza Arbuskula (FMA) sampai saat ini telah banyak diketahui secara spesifik dalam mendapatkan karbohidrat. FMA memberikan keuntungan nitrat bagi tanaman budidaya (Bagyaraj 1991; Alexapoulus et al. 1996). Peranan FMA lainnya, yaitu membantu dalam proses pertumbuhan diantaranya memperbaiki nutrisi tanaman dengan meningkatkan penyerapan fosfat dan ketahanan terhadap kekeringan serta serangan patogen (Setiadi dan Hariangbanga 2007). Simbiosis mutualis FMA dengan tanaman terjadi pada akar yang bersentuhan dengan propagul fungi. Hifanya menyebar di dalam tanah menyerap air, fosfor, dan hara lainnya (Alexopoulus et al. 1996). Fosfat adalah salah satu unsur hara essensial yang diperlukan dalam jumlah relatif banyak oleh tanaman, tetapi ketersediaannya terbatas terutama pada tanah-tanah masam. Keberadaan mikoriza sangat bermanfaat dalam penyerapan air dan unsur hara terutama fosfor (Smith dan Read 1997). Struktur yang terbentuk berupa arbuskula sebagai tempat aktivasi enzim fosfatase tertinggi (van Aerle et al. 2005) Fungsi hifa intra dan eksternal, yaitu meningkatkan efisiensi penyerapan air dan hara serta tempat pertukaran dengan fotosintat dari inang, dan struktur vesikula yang kaya kandungan lemak (Nusantara 2007). Karakter pertumbuhan tanaman yang bermikoriza pada umumnya pertumbuhannya lebih baik dibandingkan tidak bermikoriza. Hal tersebut karena kerja mikoriza secara efektif mampu meningkatkan penyerapan unsur hara makro dan beberapa unsur hara mikro (Setiadi 1989). Smith dan Read (1997) menambahkan bahwa akar yang bermikoriza ternyata lebih cepat menyerap unsur seng dan sulfur dari dalam tanah dibandingkan tanaman yang tidak bermikoriza. Perbedaan kecepatan dalam penyerapan merupakan bagian dari refleksi perbedaan antara luas permukaan akar dan berat kering dari akar tanaman yang bermikoriza dan tidak bermikoriza. Perbedaan rata-rata penyerapan disebabkan oleh perbedaan status fosfor dari dua jenis tanaman tersebut (Abbot et al. 1984). Selain itu, akar bermikoriza dapat menyerap unsur hara dalam bentuk terikat dan tidak tersedia bagi tanaman (Setiadi 1989). Akar tanaman yang terbungkus oleh mikoriza akan menghambat infeksi patogen dan akar terhindar dari serangan patogen. Mekanisme adaptasi lainnya, yaitu mikoriza menggunakan semua kelebihan karbohidrat dan eksudat akar lainnya untuk menciptakan lingkungan yang tidak cocok bagi pertumbuhan patogen. Mikoriza mampu menghasilkan antibiotik (Abbot et al. 1984). Hal tersebut membuktikan salah satu fungsi FMA pada tanaman, yaitu mampu meningkatkan ketahanan terhadap serangan patogen (Setiadi dan Hariangbanga 2007). Hifa FMA mampu menyerap air dari pori-pori tanah saat akar tanaman sulit memanfaatkannya. Selain itu, penyebaran hifa dalam tanah sangat luas sehingga mendukung untuk dapat mengambil air relatif lebih banyak (Setiadi 1988). 8 Kemampuan FMA dalam meningkatkan ketahanan inang terhadap kekeringan telah dibuktikan oleh beberapa peneliti. Penelitian Muok dan Ishii (2006), Querejeta et al.(2006) dan Subramanian et al. (2006) melaporkan bahwa inokulasi Glomus sp. mampu meningkatkan ketahanan tanaman terhadap lingkungan semi arid. Hal tersebut dibuktikan dengan adanya kolonisasi FMA yang mampu mempengaruhi status hara inang, status air pada pertumbuhan kondisi lapangan dan mampu mengubah pola aktivitas fisiologi tanaman pada saat cukup air dan pada saat terkena cekaman kekeringan. Kondisi akar dan hifa yang bersimbiosis dengan FMA memiliki kemampuan dalam mengikat partikel-partikel menjadi satu kesatuan sejalan dengan pelepasan senyawa-senyawa organik yang merekatkan. Hal ini memberikan dampak positif dalam penangkapan karbon oleh tanah (Bronick dan Lal 2005). Hasil penelitian Driver et al. (2005) menunjukkan bahwa FMA mampu memproduksi glomalin (protein tanah) dan hifa FMA merupakan media utama dalam pelepasan protein ke tanah. Pemanfaatan FMA sebagai pupuk hayati merupakan langkah yang tepat sebagai alternatif teknologi masa depan. Manfaat yang dihasilkan tidak terbatas pada dua simbion saja, akan tetapi mampu memberikan manfaat terhadap ekosistem dan lingkungan. Manfaat fungi mikoriza arbuskula bagi ekosistem dan lingkungan tidak memiliki pengaruh yang negatif bahkan tidak menyebabkan polusi tanah. FMA memiliki peranan yang sangat penting dalam memperbaiki struktur tanah, siklus hara dan membebaskan karbohidrat dari akar terhadap organisme tanah lain. Hifa mikoriza mampu mengkonversi hara agar tidak hilang dari ekosistem (Mansur 2007). Pengaruh Fungi Mikoriza Arbuskula bagi Pertumbuhan Bibit Tanaman Sampai saat ini informasi mengenai penelitian tentang Fungi Mikoriza Arbuskula (FMA) pada tanaman aren belum ditemukan. Penelitian mengenai pengaruh inokulasi FMA terhadap pertumbuhan tanaman telah dilakukan pada beberapa tanaman kehutanan. Hasil penelitian pada beberapa tanaman kehuntanan, yaitu hasil penelitian Budiyanto (2003) menunjukkan bahwa inokulasi FMA pada bibit jati yang tidak dipangkas akarnya cenderung mampu meningkatkan pertumbuhan tinggi dan diameter masing-masing sebesar 34% dan 22%. Hasil penelitian Susanti (2004) menunjukkan bahwa rata-rata pertumbuhan yang diinokulasi FMA tegakan jati Cepu dan FMA Mycofer bila dibandingkan dengan kontrol nilainya secara berurutan lebih besar 31% dan 11%, rata-rata pertambahan diameter FMA Mycofer Bogor 28.1% dan FMA tegakan jati Cepu sebesar 23.1% dibanding kontrol sedangkan berat kering total tanaman jati yang diinokulasi dengan FMA tegakan jati cepu 45.04% dan FMA Mycofer Bogor sebesar 21.5% dibanding dengan kontrol. Hasil penelitian Umam (2004) menunjukkan bahwa inokulasi FMA dan penambahan tepung tulang pada semai jati dapat meningkatkan pertambahan tinggi semai 36%, diameter semai 57%, berat kering pucuk 110%, berat kering akar 108% dan berat kering total 118% dibanding dengan kontrol. 9 Penelitian inokulasi FMA pada tanaman pangan telah dilakukan khususnya tanaman kedelai. Hasil penelitan Bertham (2006) melaporkan bahwa kombinasi FMA dan Bradyrhizobium mampu meningkatkan pertumbuhan dan hasil kedelai melampaui yang dihasilkan oleh pupuk buatan, baik di lahan monokultur maupun agroforestri Kayu Bawang (Scorodacarpus borneensis). Selain itu, penelitian tentang inokulasi FMA telah dibuktikan pada beberapa penelitian tanaman perkebunan. Hasil penelitian Widiastuti et al. (2002) menunjukkan bahwa lebih baiknya pertumbuhan bibit kelapa sawit yang diinokulasi Acaulospora tubercalata dibandingkan Gigaspora margarita. Inokulum Tanah Inokulum tanah adalah bagian tanah yang berasal dari bawah tegakan pohon bermikoriza. Teknik inokulasi cukup sederhana, yaitu dengan mencampur inokulum tanah dengan media tumbuh (5 sampai 10% volume media), diberikan dengan cara membenamkan pada sekeliling akar dengan kedalaman 0.5 sampai 1 cm (Marx dan Kenny 1982). Turjaman et al. (2006) menambahkan bahwa pada umumnya untuk inokulasi diperlukan 30 sampai 50 spora per tanaman, apabila jumlah spora kurang dari kisaran tersebut kemungkinan tingkat kolonisasinya rendah. Jenis tanaman yang digunakan sebagai inang dalam perbanyakan inokulum Fungi Mikoriza Arbuskula (FMA) perlu diperhatikan. Tanaman inang yang digunakan harus mampu beradaptasi pada tempat produksi inokulum yang dikerjakan, bersimbiosis dengan fungi yang diproduksi, dan tidak rentan terhadap patogen yang dapat mengganggu produk inokulum serta harus cepat tumbuh dan menghasilkan akar yang banyak. Ciri dan keberlimpahan propagul mikoriza dalam tanah akan berbeda-beda bergantung kepada kemampuannya dalam merespon perubahan yang terjadi di dalam tanah (Setiadi 1992). Bever (2002) menyatakan adanya perbedaan dari jenis tanaman inang yang digunakan, mampu mempengaruhi produksi spora FMA. Inokulum FMA terbagi ke dalam empat bentuk, yaitu tanah terinfeksi, akar tanaman terinfeksi, kultur murni fungi, dan spora. Inokulum tanah yang berisi spora, akar, dan hifa yang semuanya dapat menginokulasi bibit tanaman (Brundrett et al. 1999). Widiastuti et al. (2002) melaporkan adanya koloniasi FMA pada tanaman yang tidak diinokulasi menujukkan eksistensinya FMA di dalam tanah. Menurut Bertham (2006) ketergantungan mikoriza sangat identik dengan kenaikan bobot kering tanaman yang diinokulasi mikoriza dibandingkan dengan yang tidak diinokulasi. Setiadi dan Hariangbanga (2007) menambahkan bahwa ternyata tidak semua jenis tanaman memberikan respon terhadap kolonisasi FMA. Faktor-faktor yang Mempengaruhi Pembentukan Mikoriza Kolonisasi mikoriza ditentukan oleh keefektifan isolat, status hara media, dan tingkat ketergantungan tanaman terhadap mikoriza. Respon tanaman terhadap simbiosis Fungi Mikoriza Arbuskula (FMA) bergantung pada interaksi tiga faktor, antara tanah, fungi, tanaman inang (Setiadi 1992; Brundrett 2004), populasi hifa eksternal, kepekaan inang, dan daya hidup fungi. Walaupun FMA mempunyai 10 spesifitas yang lebih rendah dibandingkan dengan mikroba simbiosis lainnya seperti rhizobia, akan tetapi setiap spesies FMA memiliki respon yang berbeda terhadap lingkungannya. Interaksi spesies FMA dengan lingkungannya mampu menghasilkan respon yang spesifik dari masing-masing spesies. Sebagian besar FMA mampu beradaptasi pada kondisi tanah habitatnya (Widiastuti 2004; Hasbi 2005). Kolonisasi akar dan produksi spora dipengaruhi oleh dua faktor, yaitu jenis dan lingkungan. Faktor jenis fungi dibedakan menjadi faktor kerapatan inokulum dan persaingan antara jenis fungi (Hetrick 1984). Faktor-faktor yang merangsang atau menghambat proses kolonisasi akar juga memberikan dampak penghambatan pembentukan spora FMA (Brundett et al. 1999). Walaupun kolonisasi mempunyai hubungan yang erat, menurut Raguphaty dan Mahadevan (1991) bahwa tidak ada korelasi yang tetap antara kepadatan spora FMA dan presentase kolonisasi FMA. Kolonisasi FMA secara umum sangat dipengaruhi oleh kepekaan inang terhadap kolonisasi, faktor iklim, dan tanah (Tuheteru 2003). Faktor lingkungan yang mempengaruhi kolonisasi akar dan produksi spora, yaitu: suhu, cahaya matahari, derajat kemasaman (pH) tanah, Oksigen, dan air. Suhu Suhu terbaik untuk perkembangan FMA adalah pada suhu 30 0C, tetapi untuk kolonisasi miselia yang terbaik adalah pada suhu antara 28 sampai 34 0C (Hetrick 1984). Suhu rendah sangat dibutuhkan dalam fase awal kehidupannya. Suhu tanah yang lebih dari 17 0C mengakibatkan penurunan keefektifan perkembangan FMA dan suhu tinggi mempengaruhi penurunan viabilitas spora dan bahkan kematian spora (Sieverding 1991; Suhardi 1997). Bowen (2000) menyatakan bahwa respon tanaman yang bermikoriza terhadap suhu akan berbeda-beda menurut spesies fungi yang mengoloninya. Cahaya Matahari Intensitas cahaya mampu mempengaruhi FMA terutama berhubungan dengan suplai fotosintat yang dibutuhkan oleh fungi. Tumbuhan dengan laju fotosintesis yang tinggi sangat membantu dalam memperbaiki suplai fotosintat bagi FMA, akibat meningkatnya karbohidrat di dalam akar (Sieverding 1991). Derajat Kemasaman (pH) Tanah Pembentukan FMA setiap jenis mempunyai kisaran pH optimum yang berbeda-beda serta untuk kondisi lingkungannya pun berbeda pula, ada yang memiliki kisarannya luas dan sempit. Nilai pH optimum untuk proses perkecambahan spora tidak bergantung pada spesies dari FMA, tetapi juga kandungan nutrient yang tersedia di dalam tanah. Nilai pH secara langsung mempengaruhi aktivitas enzim yang berperan dalam proses perkecambahan spora (Hetrick 1984). Jenis spora yang memiliki kisaran pH yang cukup luas untuk perkembangannya berkisar 3.8 sampai 8.0, yaitu Acaulospora scrobiculata, A. morrawi, A. spinosa, Glomus agregatum, G. versiforme, dan Scuttelospora pellucida (Sieverding 1991). Kondisi kemasaman tanah sangat mempengaruhi 11 kolonisasi dan perkembangan FMA dalam hal proses infeksi pertumbuhan hifa, secara umum FMA berkembang dengan baik pada pH 5 sampai 8 (Bowen 2000). Aerasi dan Air Tanah yang tergenang air menghambat perkembangan baik tanaman maupun mikoriza karena kekurangan oksigen. Sieverding (1991) melaporkan bahwa kadar air 40 sampai 80% dari kapasitas cekapan maksimum merupakan kondisi optimum untuk perkembangan dan keefektifan kerja FMA. Produksi FMA akan semakin baik jika tanaman dilakukan penyiraman setiap hari (Nova 2005). 12 ISOLASI DAN KARAKTERISASI SPORA FUNGI MIKORIZA ARBUSKULA PADA RHIZOSFER AREN (Arenga pinnata (Wurmb) Merr.) Isolation and Characterization of The Types of Arbuscular Mychorrizal Fungi on The Rhyzosphere of Sugar Palms (Arenga pinnata (Wurmb) Merr.) Abstrak Setiap rhizosfer pada tanaman dalam suatu ekosistem memiliki berbagai jenis mikroorganisme termasuk FMA. Masing-masing ekosistem mengandung tipe FMA yang beragam dan untuk mengetahui tipe FMA, perlu dilakukan isolasi dan karakterisasi spora FMA. Penelitian ini bertujuan mengisolasi dan mengkarakterisasi tipe spora FMA dari bawah tegakan aren pada lokasi yang berbeda. Percobaan menggunakan metode deskriptif dengan mengamati kerapatan jenis spora, dan karekterisasi tipe spora FMA. Contoh tanah diambil dari rhizosfer tegakan aren di tiga lokasi kabupaten. Kerapatan tipe spora dianalisis per 50 g contoh tanah sebanyak lima ulangan pada setiap lokasi. Karakterisasi tipe spora FMA menggunakan metode tuang dan saring serta metode sentrifugasi. Hasil penelitian menunjukkan bahwa terdapat empat genus FMA dari bawah tegakan aren, yaitu: Glomus sp. (7 tipe spora), Acaulospora sp. (5 tipe spora), dan Scutellospora sp. (1 tipe spora) yang ditemukan di Cianjur, Sukabumi dan Lebak, sedangkan Gigaspora sp. (1 tipe spora) hanya ditemukan di Sukabumi. Kata kunci: contoh tanah, keanekaragaman FMA, mikoriza indigenous Abstract Every rhizosphere of a plant within any ecosystem has various kinds of microoganism, including AMF. Each ecosystem also has different species and strains of AMF, and in order to identify for further use, the isolation and characterization steps of AMF spore are required. The study was conducted on isolating and characterizing the types spore of Mycorrizal Arbuscular Fungi (AMF) under sugar palm stands in different locations. Descriptive research by observing and characterizing the types of AMF spores. The soil samples were sampled from the rhyzospher part of sugar palm stands in three different districts. The density of spores was analyzed per 50g of soil samples with five repetitions for each location. “tuang dan saring” as well as sentrifugation method were used to characterized the types of AMF spores. Results shows that there are four genera of AMF under sugar palm stands, i.e.: Glomus sp. (7 species), Acaulospora sp. (5 species), and Scutellospora sp. (1 species) were found in Cianjur, Sukabumi, and Lebak, whereas Gigaspora sp. (1 species) only found in Sukabumi. Keyword: indigenous mychorrizal, soil sample, AMF diversity 13 Pendahuluan Studi keanekaragaman Fungi Mikoriza Arbuskula (FMA) di hutan alam daerah pegunungan di Pulau Jawa terutama di Jawa Barat, telah dilaporkan oleh beberapa peneliti, diantaranya: Delvian (2003) mengeksplorasi keanekaragaman FMA dari lahan pantai kawasan hutan lindung Leuweung Sancang Garut, Puspitasari et al. (2010) melaporkan penelitian keanekaragaman FMA dari hutan pantai Ujung Genteng, dan Kramadibrata (2012) mengeskplorasi keanekaragaman FMA dari Taman Nasional Ujung Kulon. Keberadaan FMA di rhizosfer tumbuhan di alam memiliki peranan penting karena sifatnya yang bersimbiosis secara mutualistik dengan hampir sekitar 90% jenis tumbuhan terestrial. FMA merupakan komponen mikroorganisme yang berperan aktif membantu tanaman untuk menyerap hara dan air dari lokasi yang tidak terjangkau oleh rambut akar (Smith dan Read 1997). Keanekaragaman FMA di dunia tercatat sekitar 250 jenis yang bersimbiosis dengan tumbuhan yang tersebar dari daerah tropik sampai temperata bahkan kutub utara (Schussler dan Walker 2010; INVAM 2014). Secara umum di daerah tropik FMA bersimbiosis dengan hampir semua tumbuhan, kecuali Dipterocarpaceae, karena kelompok tumbuhan ini bersimbiosis dengan FMA ektomikoriza (Bearley 2012). Lokasi penelitian (Cianjur, Sukabumi dan Lebak) memiliki keadaan lingkungan yang berbeda sehingga kemungkinan akan memiliki keanekaragaman tipe FMA yang berbeda. Sejauh ini penelitian mengenai isolasi dan karakterisasi tipe FMA pada rhizosfer aren belum pernah dilaporkan. Penelitian ini bertujuan mengisolasi dan mengkarakterisasi tipe spora FMA dari bawah tegakan aren yang tumbuh di lokasi yang berbeda. Metode Penelitian Tempat dan Waktu Pengambilan contoh tanah dilakukan pada tanah dari bawah tegakan aren di tiga lokasi, yaitu Desa Selagedang Kecamatan Cibeber Kabupaten Cianjur, Desa Batununggal Kecamatan Cibadak Kabupaten Sukabumi (Provinsi Jawa Barat) dan Desa Ciminyak Kecamatan Muncang Kabupaten Lebak (Provinsi Banten) pada bulan Mei 2014 sampai Juli 2014. Analisis tipe spora FMA dilaksanakan di Laboratorium Silvikultur SEAMEO BIOTROP. Analisis contoh tanah dari rhisozfer aren pada tiga lokasi kabupaten dilaksanakan di Laboratorium Tanah dan Tanaman SEAMEO BIOTROP. Bahan dan Alat Bahan yang digunakan dalam penelitian ini adalah contoh tanah yang diambil dari bawah tegakan aren, aquades, larutan glukosa 60%, dan polyvynil alkohol lactogliserol (PVLG). Alat yang digunakan dalam penelitian ini adalah saringan spora (saringan betingkat tiga 500 µm, 125 µm, dan 45 µm) mikroskop binokuler Olympus CX-21, tabung sentrifuse, sentrifuse, pinset spora, kaca preparat, kaca penutup, pipet tetes, cawan petri, dan timbangan analitik. 14 Pengambilan Contoh Tanah Contoh tanah diambil dari bawah tegakan aren sebanyak 500 g pada setiap lokasi kabupaten. Pengambilan contoh tanah setiap pohon dilakukan pada jarak 30 sampai 150 cm dari pangkal batang dengan empat titik sesuai arah mata angin pada zona rhizosfer dengan kedalaman 10 sampai 20 cm. Dari Cianjur diambil lima sampel tanah, Sukabumi (lima sampel tanah), dan Lebak (lima sampel tanah). Contoh tanah dilakukan analisis kimia untuk mengetahui beberapa sifat kimia contoh tanah, diantaranya kandungan N-total, P-tersedia, KTK, pH, dan C organik. Isolasi dan Karakterisasi Tipe Spora FMA Ekstraksi FMA dilakukan untuk memisahkan spora dari contoh tanah sehingga dapat dilakukan karakterisasi FMA guna mengetahui genus spora FMA. Isolasi spora dari contoh tanah dilakukan dengan dengan mengacu metode tuang dan saring basah (Gerderman dan Nicolson 1963) dengan modifikasi sentrifugasi (Brundrett et al. 1999). Prosedur teknik tuang dan saring ini, pertama adalah mencampurkan contoh tanah sebanyak 50 g dengan 200-300 ml air, kemudian diaduk sampai butiranbutiran tanah hancur. Selanjutnya disaring dalam satu set saringan dengan ukuran 500 µm, 125 µm, dan 45 µm secara berurutan dari atas ke bawah. Dari saringan atas disemprot dengan air untuk memudahkan spora lolos. Kemudian saringan teratas dilepas dan sejumlah tanah sisa yang tertinggal pada saringan 125 µm dan 45 µm dipindahkan ke dalam tabung sentrifuse. Isolasi spora teknik tuang dan saring kemudian diikuti dengan teknik sentrifugasi. Hasil saringan dalam tabung sentrifuse ditambah gukosa 60% dengan menggunakan pipet. Tabung sentrifuse ditutup dan disentrifuse dengan kecepatan 3 000 rpm selama 5 menit. Selanjutnya larutan supernatan tersebut dituang ke dalam kertas saring berukuran 45 µm. Endapan hasil saringan diletakkan ke dalam cawan petri dan diamati di bawah mikroskop binokuler untuk penghitungan kerapatan spora dan pembuatan preparat guna karakterisasi spora FMA yang ada. Pembuatan preparat spora menggunakan bahan pengawet PVLG yang diletakkan pada kaca preparat. Kerapatan tipe spora dianalisis per 50 g contoh tanah sebanyak lima ulangan pada setiap lokasi, kemudian tipe spora dihitung jumlahnya dan ditentukan kerapatannya. Hasil penghitungan spora diletakkan dalam larutan PVLG. Selanjutnya dilakukan karakterisasi tipe FMA. Pengamatan karakterisasi tipe FMA dilakukan berdasarkan ciri morfologi spora. FMA diidentifikasi sampai tingkat genus dengan mengacu deskripsi morfologis genus FMA, yaitu berdasarkan bentuk, warna, dan ukuran spora (Brundrett et al 1996). Analisis data dilakukan secara deskriptif pada analisis kerapatan spora untuk karekterisasi jenis spora dari FMA. Hasil dan Pembahasan Kondisi Umum Percobaan Contoh tanah dan akar diambil dari bawah tegakan aren pada tiga lokasi kabupaten. Pengambilan contoh tanah dan akar di bawah tegakan aren yang telah berumur lebih dari 15 tahun pada setiap lokasi. Kondisi lingkungan dari ketiga lokasi memiliki karakteristik yang berbeda, seperti pH tanah, level P, vegetasi maupun tipe penggunaan lahan. 15 Masyarakat Cianjur dan Lebak memanfaatkan aren untuk membuat gula merah dan minuman tradisional (lahang). Selain itu masyarakat memanfaatkan lahan dengan sistem tumpang sari dan agroforestry (sengon dengan aren), sedangkan di Sukabumi pengolahan lahan tidak intensif, bahkan tanaman aren tumbuh secara liar. Kondisi lahan pengambilan contoh tanah dan akar di tiga lokasi ditampilkan pada Gambar 1. A B C Gambar 1. Kondisi lahan pengambilan contoh tanah dan akar di tiga lokasi kabupaten: A = Cianjur; B = Sukabumi; C = Lebak. Vegetasi yang umum dijumpai pada ketiga lokasi, yaitu paku-pakuan (Pteridophyta), Mikania sp, Axonopus, Musaceae, Eupatorium odoratum, Cratoxylon sp, dan Colona scabra. Analisis tanah juga dilakukan pada ketiga lokasi pengambilan contoh tanah. Hasil analisis kimia tanah dari rhizosfer aren pada tiga lokasi kabupaten disajikan pada Tabel 1. Tabel 1. Hasil analisis kimia tanah dari rhizosfer aren pada tiga lokasi kabupaten Sifat kimia tanah pH H2O C-organik (%) N-total (%) P-tersedia (ppm) KTK (me/100 g) Keterangan : Cianjur 4.5 (M) 3.82 (T) 0.40 (S) 11.1 (R) 40.27 (ST) Lokasi Sukabumi 5.0 (M) 1.56 (R) 0.18 (R) 17.9 (S) 24.30 (S) Lebak 5.2 (M) 1.92 (R) 0.25 (S) 3.4 (SR) 16.14 (R) Hasil analisis contoh tanah dari tiga lokasi kabupaten di Laboratorium Analisis Tanah dan Tanaman SEAMEO BIOTROP 2014; Berdasarkan kriteria penilaian sifat kimia tanah, Hardjowigeno 2010: (M) = Masam, (SR) = Sangat Rendah, (R) = Rendah, (S) = Sedang, (T) = Tinggi, (ST) = Sangat Tinggi; Kriteria penilaian sifat kimia tanah disajikan pada Lampiran 1. 16 Isolasi dan Karakterisasi Tipe Spora FMA Berdasarkan hasil isolasi spora FMA dari contoh tanah ditemukan empat genus spora FMA, yaitu Glomus sp., Acaulospora sp., Scutellospora sp., dan Gigaspora sp. Genus Glomus sp. terdiri atas 7 tipe diikuti oleh Acaulospora sp. (5 tipe), sedangkan Scutellospora sp. dan Gigaspora sp. masing-masing hanya ditemukan satu tipe spora. Tabel 2 menunjukkan kerapatan spora yang ditemukan. Tabel 2. Kerapatan spora FMA pada contoh tanah dari bawah tegakan aren di tiga lokasi kabupaten Tipe spora FMA Kerapatan spora Sukabumi Cianjur Lebak ----------------------(spora per 50 g tanah)----------------------Glomus sp.1 107 56 80 Glomus sp.2 64 25 42 Glomus sp.3 15 4 5 Glomus sp.4 18 9 22 Glomus sp.5 38 14 3 Glomus sp.6 32 9 10 Glomus sp.7 20 6 6 Acaulospora sp.1 43 95 11 Acaulospora sp.2 20 83 7 Acaulospora sp.3 23 34 18 Acaulospora sp.4 8 15 12 Acaulospora sp.5 19 29 5 Scutellospora sp.1 4 8 2 Gigaspora sp.1 6 0 0 Total 417 387 223 Genus Glomus sp., Acaulospora sp., dan Scutellospora sp. merupakan spora yang umum dijumpai di tiga lokasi kabupaten, sementara genus Gigaspora sp. hanya ditemukan di lokasi Sukabumi. Genus Gigaspora sp. diduga bersimbiosis dengan vegetasi lain, yaitu Setaria laxa yang berada disekitar tanaman aren di Sukabumi. Setaria laxa merupakan salah satu vegetasi yang hanya dijumpai di Sukabumi. Hasil penelitian Tuheteru (2007) menunjukkan bahwa jenis tanaman Setaria laxa bersimbiosis dengan semua jenis spora. Lokasi Sukabumi dan Lebak dengan pH 5.0 dan 5.2 genus Glomus sp. banyak ditemukan pada setiap tegakan aren. Berbeda dengan lokasi Cianjur dengan pH 4.5 genus Acaulospora sp. lebih banyak ditemukan. Hal ini sesuai dengan pernyataan Tuheteru (2003) bahwa beberapa FMA dapat berkembang baik dengan pH optimum berkisar antara 5-7 untuk Glomus sp.; 4-6 untuk Gigaspora sp. dan 4-5 untuk Acaulospora sp. Contoh tanah dari Sukabumi memiliki kerapatan dan distribusi tipe spora tertinggi dibandingkan Cianjur dan Lebak. Tipe penggunaan lahan yang tidak intensif diduga menghasilkan kerapatan spora dan distribusi jenis spora yang lebih tinggi dibandingkan tipe penggunaan lahan yang intensif. Pengolahan lahan intensif menyebabkan terjadinya degradasi lahan (kerusakan tanah dan kekahatan bahan organik). Degradasi lahan berdampak pada pemadatan tanah yang akan mempengaruhi perkembangan hifa di dalam tanah sehingga menyebabkan 17 produksi spora menurun. Hal ini sesuai dengan hasil penelitian Rini (2011) yang menunjukkan bahwa rotasi tanaman beserta pengolahan lahan yang intensif (lebih dari dua kali dalam setahun) menurunkan populasi dan keanekaragaman spesies FMA. Hasil penelitian tersebut sama dengan hasil penelitian Oehl et al. (2003) yang menunujukkan bahwa jumlah spora dan keanekaragaman spesies FMA tertinggi ditemukan pada lahan yang ditumbuhi rumput diikuti dengan lahan yang memperoleh input rendah-sedang, dan terendah pada lahan yang ditanami jagung terus menerus secara intensif. Karakterisasi Tipe Spora FMA Karakter morfologi yang digunakan untuk mengidentifikasi 14 tipe spora adalah bentuk, warna, dan ukuran spora. Karakterisasi tiap tipe spora FMA tercantum pada Tabel 3. Tabel 3. Karakterisasi tipe spora FMA yang berasal dari bawah tegakan aren di tiga lokasi kabupaten Tipe spora FMA Glomus sp.1 Bentuk Bulat Ciri-ciri spora Warna Kuning Ukuran (µm) 59-60 x 60-62 Bulat Kuning kecoklatan 65-99 x 67-101 Bulat panjang Kuning kecoklatan 47-49 x 57-60 Bulat panjang Hialin 85-110 x 97-129 50 µm Glomus sp.2 50 µm Glomus sp.3 50 µm Glomus sp.4 50 µm 18 Tabel 3. (Lanjutan) Tipe spora FMA Glomus sp.5 Bentuk Bulat panjang Ciri-ciri spora Warna Kuning kecoklatan Ukuran (µm) 85-122 x 99-127 Bulat Kuning kecoklatan 87-110 x 89-111 Bulat Coklat 85-110 x 88-116 Bulat Kuning kecoklatan 73-103 x 73-103 Bulat Hialin 90-211 x 90-211 Bulat Hialin 98-246 x 98-246 50 µm Glomus sp.6 50 µm Glomus sp.7 50 µm Acaulospora sp.1 50 µm Acaulospora sp.2 50 µm Acaulospora sp.3 50 µm 19 Tabel 3. (Lanjutan) Tipe spora FMA Acaulospora sp.4 Bentuk Bulat Ciri-ciri spora Warna Hialin Ukuran (µm) 95-104 x 95-104 Bulat Kuning kecoklatan 86-120 x 86-120 Bulat Kuning kecoklatan 185-293 x 195-317 Bulat Kuning 320-344 x 343-367 50 µm Acaulospora sp.5 50 µm Scutellospora sp.1 50 µm Gigaspora sp.1 50 µm Glomus sp. adalah genus mikoriza dari famili Glomeraceae. Glomus sp. adalah genus yang memiliki keberagaman jenis tertinggi dari yang lain. Beberapa ciri khas dari genus ini yaitu spora terbentuk secara tunggal ataupun berpasangan dua pada terminal hifa nongametangium yang tidak berdiferensiasi dalam sporocarp. Pada saat dewasa spora dipisahkan dari hifa pelekat oleh sebuah sekat. Spora berbentuk globose, sub-globose, ovoid, ataupun obovoid dengan dinding spora terdiri atas lebih dari satu lapis, berwarna hyaline sampai kuning, merah kecoklatan, coklat, dan hitam, berukuran antara 20-400 μm (Morton dan Benny 1990; INVAM 2014). Acaulospora sp. adalah genus mikoriza yang termasuk dalam famili Acaulosporaceae. Genus ini memiliki beberapa ciri khas antara lain yaitu memiliki 2-3 dinding spora, spora terbentuk di sisi samping leher sporiferous saccule, berbentuk globose hingga elips, berwarna hyaline, kuning, ataupun merah kekuningan, berukuran antara 100-400 μm (Morton dan Benny 1990; INVAM 2014). Scutellospora sp. adalah genus mikoriza yang termasuk dalam famili Gigasporaceae. Genus ini memiliki beberapa ciri khas antara lain yaitu spora dengan atau tanpa hiasan, spora terdiri atas dinding bilayer spora dan bagian dinding dua bilayer yang fleksibel, struktur spora yang terbentuk biasanya globose atau sub-globose tetapi lebih sering berbentuk ovoid, obovoid, pyriformis, 20 atau irregular. Proses terbentuknya spora pada Scutellospora sp. sama dengan pembentukan spora pada genus Gigaspora sp. Pembeda genus Gigaspora sp. dengan Scutellospora sp. adalah pada Scutellospora sp. terdapat germination shield, dan pada saat berkecambah hifa akan keluar dari germanation shield tersebut (Walker dan Sanders 1986; INVAM 2014). Gigaspora sp. adalah genus mikoriza yang termasuk dalam famili Gigasporaceae. Genus ini memiliki ciri khas, antara lain yaitu spora dihasilkan secara tunggal di dalam tanah, tidak memiliki lapisan dinding spora dalam, terdapat bulbous suspensor, berbentuk globose atau sub-globose, berwarna krem hingga kuning, berukuran 125-600 μm (Bentivenga dan Morton 1995; INVAM 2014). Kesimpulan dan Saran Kesimpulan Terdapat empat genus FMA dari bawah tegakan aren, yaitu: Glomus sp. (7 tipe spora), Acaulospora sp. (5 tipe spora), dan Scutellospora sp. (1 tipe spora) yang ditemukan di Cianjur, Sukabumi, dan Lebak, sedangkan Gigaspora sp. (1 tipe spora) hanya ditemukan di Sukabumi. Saran Karakterisasi FMA sampai tingkat spesies pada tanaman aren sangat penting. Informasi lengkap karakterisasi spora FMA sampai tingkat spesies akan memberikan informasi deskripsi yang berguna dalam identifikasi keanekaragaman FMA yang bersimbiosis dengan tanaman aren. 21 POTENSI DAN STATUS FUNGI MIKORIZA ARBUSKULA PADA RHIZOSFER TANAMAN AREN (Arenga pinnata (Wurmb) Merr.) The Potential and Status of Arbuscular Mycorrhizal Fungi in The Rhyzosphere of Sugar Palm (Arenga pinnata (Wurmb) Merr.) Abstrak Setiap jenis Fungi Mikoriza Arbuskula (FMA) memiliki keefektifan dan potensi yang berbeda pada tanaman aren. Demikian juga antara tipe FMA pada masing-masing ekosistem tanaman aren dapat bersifat sinergis atau antagonis dalam mempengaruhi pertumbuhan tanaman aren. Tujuan penelitan ini adalah mengetahui keberadaan FMA yang efektif dan berpotensi dari bawah tegakan aren. Contoh tanah dan akar diambil dari rhizosfer tegakan aren di tiga lokasi kabupaten. Kolonisasi akar menggunakan metode pewarnaan akar. Penangkaran menggunakan kultur pot terbuka dengan menggunakan media zeolit dan sorghum sebagai tanaman inang. Jumlah propagul infektif dihitung dengan metode Most Probable Number. Hasil penelitian menunjukkan bahwa presentase kolonisasi akar pada rhizosfer aren dari tiga kabupaten berkisar antara 16-42%, dengan kolonisasi tertinggi di daerah Lebak. Contoh tanah dari lokasi Sukabumi memiliki kepadatan spora dan propagul infektif lebih tinggi dibandingkan contoh tanah dari Cianjur dan Lebak. Kata kunci: kolonisasi akar, propagul infektif, spora FMA Abstract Each kind of AMF possesses different level of effectiveness and potential of sugar palm. Also, various kind of AMF on each ecosystem of sugar palm could act synergistically and antagonistically to each other in influencing the growth of sugar palm. The objective of this study to find out the existence of efective and potential AMF under sugar palm stands. Soil and root samples were sampled from the rhyzosphere of sugar palm stands in three different districts. Root coloring was used to cholonized the roots. Opened pot culture with zeolit as medium and shorgum as host plant was used for trapping. The number of infective propagules were calculated by the Most Probable Number method. Results shows that the percentage of root cholonization on the rhyzosphere of sugar palm from three district in range of 16-42%, the highest cholonization was from Lebak. Soil samples from Sukabumi has a higher density both for spores and infective propagules than soil samples from Cianjur and Lebak. Keyword: AMF spores, infective propagules, root cholonization 22 Pendahuluan Fungi Mikoriza Arbuskula bersimbiosis dengan lebih dari 90% spesies tanaman (Smith dan Read 1997). FMA memiliki peran penting dalam ekosisitem alami maupun ekosistem yang dikelola, sebab FMA memberikan keuntungan bagi tanaman dalam hal penyediaan hara, antagonisme bagi organisme parasit akar, sinergisme dengan mikroba tanah. Selain itu FMA terlibat dalam siklus hara, perbaikan struktur tanah, alat transpor karbon dari akar tanaman bagi organisme tanah lainnya. Simbiosis antara FMA dan tanaman inangnya merupakan mekanisme yang sangat penting dalam rangka untuk mengatasi keadaan lingkungan yang kurang menguntungkan. FMA mempunyai selang ekologis yang luas dan dapat dijumpai dalam ekosistem dari daerah tropik sampai sub tropik bahkan kutub utara (Schussler dan Walker 2010; INVAM 2010). Status FMA pada tanaman aren belum ada yang melaporkan. Diharapkan penelitian mengenai status keberadaan FMA pada tanaman aren dapat memberikan informasi ilmiah mengenai keefektifan dan potensi FMA dari bawaah tegakan aren untuk menunjang pertumbuhan tanaman aren. Penelitian ini bertujuan mengetahui keberadaan FMA yang efektif dan berpotensi dari bawah tegakan aren. Metode Penelitian Tempat dan Waktu Pengambilan contoh tanah dan akar dilakukan bersamaan dengan percobaan I pada bulan Mei 2014 sampai Agustus 2014. Analisis kolonisasi akar, kepadatan spora hasil penangkaran, dan penghitungan propagul infektif dilaksanakan di Laboratorium Silvikultur SEAMEO BIOTROP. Bahan dan Alat Bahan yang digunakan dalam penelitian ini adalah contoh tanah dan akar yang diambil dari bawah tegakan aren, benih Sorghum vulgare, zeolit, hyponex merah (25-5-25), larutan KOH 2.5%, HCl 2%, glyserin, asam laktat, fuchsin acid, aquades dan polyvynil alkohol lactogliserol (PVLG). Alat yang digunakan dalam penelitian ini adalah saringan spora (saringan betingkat tiga 500 µm, 125 µm, dan 45 µm) mikroskop binokuler Olympus CX-21, tabung sentrifuse, sentrifuse, pinset spora, kaca preparat, kaca penutup, pipet tetes, cawan petri, dan timbangan analitik. Pengambilan Contoh Tanah dan Akar Contoh tanah dan akar yang diambil dari bawah tegakan aren sebanyak 500 g pada setiap lokasi kabupaten. Pengambilan contoh tanah setiap pohon dilakukan pada jarak 30 sampai 150 cm dari pangkal batang dengan empat titik sesuai arah mata angin pada zona rhizosfer dengan kedalaman 10 sampai 20 cm. Dari Cianjur diambil lima sampel tanah dan akar, Sukabumi (lima sampel tanah dan akar), dan Lebak (lima sampel tanah dan akar). Contoh akar diambil sebanyak 3 bagian, yaitu bagian samping kiri, tengah, dan samping kanan pada akar serabut dari 23 masing-masing pohon di setiap lokasi kabupaten, kemudian dimasukkan ke dalam plastik zip lock dan diberi label sesuai dengan lokasi pengambilan. Kolonisasi Akar Tujuan utama pewarnaan akar adalah untuk menetapkan apakah akar tanaman dikolonisasi FMA atau tidak dan untuk menentukan derajat perkembangan mikoriza dalam sistem perakaran tanaman (Nusantara et al. 2012). Pewarnaan akar mengacu pada metode Phillips dan Hayman (1970) dimodifikasi Laboratorium Bioteknologi Hutan Institut Pertanian Bogor. Tahap pewarnaan, pertama adalah akar dicuci dengan air sampai bersih. Selanjutnya akar direndam dalam KOH 10% sampai berwarna putih atau kuning bening, setelah itu akar dibilas dengan air bersih agar KOH-nya hilang. Akar yang sudah dibilas selanjutnya direndam dalam HCl 2%, kemudian dibilas dan direndam dengan larutan staining fuchsin acid sampai akar berwarna merah. Hasil pewarnaan akar selanjutnya diamati dengan memotong akar yang telah diwarnai sepanjang 1 cm, kemudian akar ditata sejajar pada kaca preparat dan ditutup dengan kaca penutup, jumlah akar tiap kaca preparat sebanyak 10 potong. Kolonisasi dapat dilihat melalui adanya vesikula, arbuskula, hifa maupun spora yang mengkolonisasi akar. Perhitungan kolonisasi akar menggunakan rumus Giovannetti dan Mosse (1980) sebagai berikut: ∑ Kolonisasi FMA (%) ∑ Penangkaran (Trapping) Spora FMA Trapping atau penangkaran spora dilakukan untuk mengembangbiakkan spora dari contoh tanah yang telah diambil, sehingga dapat diketahui keseluruhan jenis spora. Teknik trapping (penangkaran) mengacu Brundrett et al. (1999) dengan metode kultur pot terbuka yang dimodifikasi. Media tanam yang digunakan berupa campuran contoh tanah sebanyak ± 50 g dan batuan zeolit berukuran 1-2 mm sebanyak ± 150 g. Teknik pengisian media tanam dalam pot kultur adalah pot kultur diiisi dengan zeolit sampai setengah volume pot, kemudian contoh tanah dimasukkan dan ditutup kembali dengan zeolit sehingga media tanam tersusun atas zeolit-contoh tanah-zeolit. Benih Sorghum vulgare yang akan digunakan sebagai tanaman inang terlebih dahulu direndam dalam klorox 1% selama 5-10 menit sebagai upaya sterilisasi permukaan. Selanjutnya benih direndam dalam air hangat selama ± 24 jam untuk memecahkan dormansi yang mungkin terjadi. Kemudian benih-benih tersebut disemaikan dalam bak kecambah dengan media tissue yang dibasahi selama ± 10 hari. Setelah itu kecambah dipindahkan ke dalam pot-pot kultur. Kultur spora diulang sebanyak tiga kali pada setiap lokasi contoh tanah. Pemeliharaan kultur meliputi penyiraman, pemberian hara, dan pengendalian hama secara manual. Larutan hara yang digunakan adalah Hyponex Merah (25-5-20) dengan konsentrasi 1 g/2 l air. Pemberian larutan hara dilakukan setiap minggu sebanyak ± 20 ml tiap pot kultur. Setelah kultur berumur 3.5 bulan dilakukan pemanenan untuk mendapatkan spora-spora yang akan digunakan pada percobaan ke-3. 24 Peubah yang diamati adalah penghitungan jumlah kepadatan spora per 50 g tanah dan identifikasi tipe spora. Kepadatan spora dihitung dengan rumus: Kepadatan spora Uji Propagul Infektif Setiap contoh tanah dihaluskan dan dilakukan pengenceran dengan kelipatan 10 sebanyak tujuh kali pengenceran dengan mencampur contoh tanah uji langsung dari lapangan dengan zeolit yang telah steril. Setiap seri pengenceran diulang lima kali. Campuran media dimasukkan ke pot plastik. Benih Sorghum vulgare yang telah disterilkan dan telah dikecambahkan ditanam pada pot kultur dan dipelihara di rumah kaca selama 5 minggu. Pemeliharaan meliputi penyiraman dan pemupukan dengan larutan hara Hyponex Merah (25-5-20). Setelah 5 minggu, dilakukan pemanenan akar dengan cara memotong bagian akar. Akar selanjutnya dicuci dan dipotong kemudian dimasukkan ke botol yang berisi Formalin Aceto Alcohol (FAA). Selanjutnya akar-akar tersebut diwarnai dengan larutan pewarna melalui teknik pewarnaan akar dari Phillips dan Hayman (1970) dimodifikasi Laboratorium Bioteknologi Hutan Institut Pertanian Bogor. Akar-akar yang telah didestaining diamati di bawah mikroskop untuk melihat ada tidaknya infeksi FMA, kemudian hasil pengamatan dihitung MPN-nya. Percobaan ke-2 merupakan langkah untuk menyeleksi inokulum tanah FMA yang efektif dan berpotensi dari bawah tegakan aren dengan berdasarkan hasil dari contoh tanah yang memiliki jumlah kepadatan spora terbanyak dari penangkaran dan propagul infektif tertinggi dari penghitungan MPN. Selanjutnya diuji keefektifannya pada percobaan ke-3. Hasil dan Pembahasan Kolonisasi Akar Hasil penghitungan kolonisasi FMA pada akar tanaman aren dari tiga lokasi pengambilan contoh akar dapat dilihat pada Gambar 2. Presentase kolonisasi akar berkisar antara 16-42%, dengan kolonisasi tertinggi di daerah Lebak. Bentuk-bentuk kolonisasi yang banyak dijumpai yaitu hifa internal dan eksternal. Presentase kolonisasi akar pada tiga lokasi termasuk kriteria kolonisasi akar klasifikasi rendah (16%) dan sedang (28-42%). Menurut kriteria yang digunakan pada Institute of Mycorrhizal Research and Development (Rajapakse dan Miller 1992) tingkat kolonisasi akar terbagi menjadi klasifikasi sangat rendah (<5%), rendah (6-25%), sedang (26-50%), tinggi (51-75%), dan sangat tinggi (>75%). Terdapat tiga faktor yang mempengaruhi kolonisasi FMA yaitu kepekaan inang, faktor iklim dan faktor tanah (Fakuara 1998; Setiadi 1996). Gambar 2. Presentase kolonisasi FMA pada akar dari bawah tegakan aren pada tiga lokasi kabupaten. 25 Penangkaran (Trapping) spora FMA Kepadatan spora FMA yang diperoleh dari hasil penangkaran pada tiga lokasi kabupaten yaitu, di Cianjur sebanyak 133 spora per 50 g tanah, Sukabumi sebanyak 452 spora per 50 g tanah, dan Lebak sebanyak 101 spora per 50 g tanah. Kepadatan spora FMA dari hasil penangkaran ditampilkan pada Gambar 3. Gambar 3. Kepadatan spora FMA hasil penangkaran dari contoh tanah pada tiga lokasi kabupaten. Hasil isolasi dari contoh tanah dari bawah tegakan aren terdapat tipe spora FMA yang tidak dijumpai sebelum penangkaran, yaitu tipe Glomus sp.8 dan Acaulospora sp.6 (Gambar 4). Adanya tipe FMA baru yang ditemukan pada penangkaran diduga respon pertumbuhan tanaman inang yang baik dan lingkungan yang mendukung sehingga sporulasi FMA berjalan dengan baik. Hal ini didukung dengan pernyataan Clark (1997) bahwa kemampuan suatu spesies FMA berada di suatu lingkungan sangat dipengaruhi oleh adaptasi spesies tersebut terhadap lingkungan setempat. Sedangkan menurut Brundrett et al. (1999) khususnya spora-spora yang dijumpai pada kultur hasil trapping dipengaruhi oleh umur, jenis tanaman inang, dan status hara media tanam. 50 µm A 50 µm B Gambar 4. Tipe spora FMA yang ditemukan setelah penangkaran: A = Glomus sp.8; B = Acaulospora sp.6. Uji Propagul Infektif Setiap contoh tanah dari tiga lokasi mengandung jumlah propagul infektif yang berbeda, yaitu di Cianjur sebanyak 11 000 propagul/50 g tanah, Sukabumi sebanyak 28 000 propagul/50 g tanah, dan Lebak sebanyak 9 500 propagul/50 g tanah. Jumlah propagul infektif yang tertinggi diperoleh pada lokasi Sukabumi (Tabel 4). Hal ini diduga jumlah dan tipe spora mempunyai kemampuan infektif yang tinggi dan sangat efektif bila dibandingkan dengan lokasi lainnya. Hal ini sejalan dengan yang dikemukakan Porter (1979) bahwa jumlah spora berkorelasi dengan kuantifikasi tipe FMA dengan metode Most Probable Number (MPN). 26 Tabel 4. Hasil perhitungan uji MPN pada inokulum tanah FMA dari bawah tegakan aren di tiga lokasi kabupaten Perlakuan Cianjur pohon 1 Cianjur pohon 2 Cianjur pohon 3 Cianjur pohon 4 Cianjur pohon 5 Sukabumi pohon 1 Sukabumi pohon 2 Sukabumi pohon 3 Sukabumi pohon 4 Sukabumi pohon 5 Lebak pohon 1 Lebak pohon 2 Lebak pohon 3 Lebak pohon 4 Lebak pohon 5 Jumlah Propagul infektif Kisaran jumlah propagul pada Propagul per 50 g tanah selang kepercayaan 95% 4 0.170 x 10 0.080 – 0.361 x 104 1.100 x 104 0.518 – 2.328 x 104 4 0.700 x 10 0.331 – 1.485 x 104 1.100 x 104 0.518 – 2.328 x 104 4 0.170 x 10 0.080 – 0.361 x 104 4 2.200 x 10 1.037 – 4.466 x 104 2.800 x 104 1.321 – 5.929 x 104 4 1.400 x 10 0.660 – 2.964 x 104 0.950 x 104 0.448 – 2.013 x 104 4 2.200 x 10 1.037 – 4.655 x 104 0.170 x 104 0.080 – 0.361 x 104 4 0.120 x 10 0.056 – 0.254 x 104 0.950 x 104 0.440 – 2.220 x 104 4 0.120 x 10 0.056 – 0.254 x 104 0.092 x 104 0.043 – 0.194 x 104 Kesimpulan dan Saran Kesimpulan Presentase kolonisasi akar pada rhizosfer aren dari tiga kabupaten berkisar antara 16-42%, dengan kolonisasi tertinggi di daerah Lebak. Contoh tanah dari lokasi Sukabumi memiliki kepadatan spora dan propagul infektif lebih tinggi dibandingkan contoh tanah dari Cianjur dan Lebak. Saran Inokulum tanah FMA dari lokasi Cianjur dan Lebak perlu di uji keefektifannya terhadap pertumbuhan bibit aren. Diharapkan pada tahap penangkaran tanaman inang yang digunakan adalah aren. 27 UJI KEEFEKTIFAN INOKULUM TANAH FMA DARI BAWAH TEGAKAN AREN PADA BIBIT AREN (Arenga pinnata (Wurmb) Merr.) The Effectiveness of The AMF Soil Inoculum from Under Sugar Palm Stands on Sugar Palm Seed (Arenga pinnata (Wurmb) Merr.) Abstrak Tanaman aren belum banyak dibudidayakan. Pembibitan merupakan langkah awal dari seluruh rangkaian kegiatan pembudidayaan pada tanaman aren. Tujuan penelitian ini adalah menguji keefektifan inokulum tanah FMA dari bawah tegakan aren terhadap pertumbuhan bibit aren. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) 2 faktor. Faktor pertama adalah pemupukan P, terdiri atas 2 taraf, yaitu tanpa pemupukan P dan pemupukan P. Faktor kedua adalah inokulasi FMA, terdiri atas 3 taraf, yaitu tanpa pemberian inokulum, inokulum FMA indigenous, dan inokulum FMA mycofer. Hasil uji keefektifan menunjukkan bahwa inokulum FMA indigenous mampu meningkatkan pertumbuhan bibit aren berdasarkan parameter tinggi tanaman, panjang pelepah daun, diameter pangkal pelepah, bobot kering tajuk, biomassa total, serapan hara P, jumlah spora, dan persen infeksi akar. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA menunjukkan adanya peran inokulum FMA terhadap panjang pelepah daun, jumlah spora, dan persen infeksi akar dengan nilai tertinggi diperoleh pada perlakuan inokulum FMA indigenous tanpa pemupukan P. Kata kunci: inokulasi FMA indigenous, pembibitan aren, teknik budidaya Abstract The cultivation of sugar palm has never been conducted. Nursery is the first step in cultivating the sugar palm. The objective of this study to verify the effectiveness of the AMF soil inoculum from under sugar palm stands towards the growth of the seeds of sugar palm. This research uses a two factorial Completely Randomized Design. The first factor is posphorus (P) fertilizing, which were used two levels: with and without P fertilizer. The second factor is AMF inoculations, which were used three levels: without inoculum; AMF indigenous inoculum; and AMF mycofer inoculum. The result on the effectiveness showed that AMF indigenous inoculum increase growth on sugar palm seedling based on parameters of plant height, rachis length, stem diameter, shoot dry weight, root dry weight, total biomassa, P nutrient absorption, number of spore, and percent of root colonization. Interaction between P fertilizer with AMF inoculum showed the role of AMF inoculum to rachis length, number of spore, and percent of root colonization with the highest value was obtained in treatment AMF indigenous inoculum without P fertilizer. Keywords: cultivation techniques, indigenous AMF inoculations, sugar palm seedling 28 Pendahuluan Tanaman aren merupakan tanaman asli di wilayah kepulauan Indo-Malaya, dengan pusat penyebaran yang terdapat di beberapa wilayah Indonesia. Tanaman aren paling banyak terdapat di wilayah Pulau Jawa (19 757 ha), Sulawesi (16 951 ha), Sumatera (15 802 ha), dan Kalimantan (1 816 ha) (Kementan 2015). Pemanfaatan tanaman aren oleh masyarakat di daerah sentra sangat beragam. Di daerah Jawa Barat seperti masyarakat Cianjur dan Garut serta Banten aren dimanfaatkan sebagai sumber pembuatan gula merah, minuman tradisional (lahang), tepung sagu, dan kolang-kaling. Di beberapa masyarakat lainnya, hasil nira tanaman aren dimanfaatkan sebagai minuman tradisional, yaitu di Sumatera Utara (tuak) dan Sulawesi Utara (saguer) (Mogea et al. 1991). Kendala yang dihadapi dalam pengembangan dan budidaya tanaman aren adalah ketersediaan bibit yang bermutu. Penurunan mutu bibit menjadi faktor yang memperlambat masa pindah tanam ke lapangan. Alternatif yang mungkin dapat dikembangkan untuk mengatasi kendala tersebut yaitu meningkatkan mutu bibit aren dengan memanfaatkan mikroorganisme seperti Fungi Mikoriza Arbuskula (FMA). Beberapa hasil penelitian telah menunjukkan manfaat mikoriza pada kopi (Hanapiah 1997), padi sawah tadah hujan (Hanafiah 2001), kelapa sawit (Kartika 2006; Damayanti et al. 2014). Keberadaan FMA di rhizosfer tumbuhan di alam memiliki peranan penting karena sifatnya yang bersimbiosis secara mutualistik dengan hampir sekitar 90% jenis tumbuhan terestrial. FMA merupakan komponen mikroorganisme yang berperan aktif membantu tanaman untuk menyerap hara dan air dari lokasi yang tidak terjangkau oleh rambut akar (Smith dan Read 1997). Tahap pembibitan ini diharapkan mampu menghasilkan bibit yang berkualitas. Adanya FMA pada bibit aren diharapkan FMA dapat meningkatkan pertumbuhan, terutama peningkatan serapan hara sehingga bibit mampu tumbuh baik di lapangan dan mengatasi keadaan lingkungan yang beragam. Kajian respon pertumbuhan bibit aren terhadap inokulasi FMA sampai saat ini belum pernah dilakukan. Penelitian ini bertujuan menguji keefektifan inokulum tanah FMA dari bawah tegakan aren terhadap pertumbuhan bibit aren. Metode Penelitian Tempat dan Waktu Penelitian dilaksanakan di Rumah Kaca SEAMEO BIOTROP pada bulan Januari 2015 sampai dengan Juni 2015. Hasil destruktif tanaman di analisis di Laboratorium Silvikultur SEAMEO BIOTROP. Analisis tanah dan jaringan tanaman dilaksanakan di Laboratorium Tanah dan Tanaman SEAMEO BIOTROP. Bahan dan Alat Bahan yang digunakan dalam penelitian ini adalah inokulum tanah FMA dari bawah tegakan aren yang merupakan hasil dari percobaan kedua (penangkaran), inokulum mycofer (endomikoriza) produksi Laboratorium Bioteknologi Hutan dan Lingkungan Institut Pertanian Bogor, benih aren yang diperoleh dari populasi aren yang telah berumur di atas 15 tahun di Kabupaten 29 Cianjur, Provinsi Jawa Barat, tanah yang disterilkan, pupuk SP36, aquades, klorox 1%, arang sekam padi, larutan KOH 2.5%, HCl 2%, glyserin, asam laktat, dan fuchsin acid. Alat yang digunakan dalam penelitian ini adalah adalah saringan spora (saringan betingkat tiga 500 µm, 125 µm, dan 45 µm) mikroskop binokuler Olympus CX-21, tabung sentrifuse, sentrifuse, pinset spora, kaca preparat, kaca penutup, pipet tetes, cawan petri, timbangan analitik, bak kecambah, autoclave, jangka sorong digital, dan thermo recorder. Rancangan Percobaan Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) 2 faktor. Faktor pertama adalah pemupukan P, terdiri atas 2 taraf, yaitu tanpa pemupukan P (P0) dan pemupukan P (P1). Faktor ke-dua adalah inokulasi FMA, terdiri atas 3 taraf, yaitu tanpa pemberian inokulum (M0), inokulum FMA indigenous (M1), dan inokulum FMA mycofer (M2). Setiap unit percobaan terdiri atas 9 tanaman dan diulang sebanyak 3 kali. Dari total tanaman pada setiap unit percobaan diambil 5 tanaman contoh untuk diamati 4 minggu sekali dan pengamatan destruktif diamati 12 minggu sekali selama 24 MSP. Model statistik yang digunakan untuk Rancangan Acak Lengkap (RAL) adalah sebagai berikut: Yijk Yijk = µ αi ßj = = = (αβ)ij = εijk = = µ + αi + ßj + (αß)ij + εijk Nilai pengamatan pada perlakuan pemupukan P ke-i, inokulasi FMA ke-j, dan ulangan ke-k Nilai rata-rata Pengaruh perlakuan pemupukan P ke-i (i = 1, 2) Pengaruh perlakuan inokulasi FMA ke-j (j = 1, 2, 3) Pengaruh interaksi antara perlakuan pemupukan P ke-i dan inokulasi FMA ke-j. Galat pada perlakuan pemupukan P ke-i, inokulasi FMA ke-j dan ulangan ke-k Analisis Data Data hasil pengamatan dianalisis dengan uji F pada taraf α 5%, jika terdapat pengaruh yang nyata dilanjutkan dengan uji DMRT (Duncan Multiple Range Test) pada taraf α 5%. Analisis menggunakan program SAS Windows 9.1. Persiapan Benih Buah aren yang telah diperoleh direndam dalam air selama 5 hari. Daging buah dibersihkan dan dilakukan seleksi benih. Selanjutnya, diberi perlakuan pematahan dormasi dengan menggunakan teknik deoperkulasi/skarifikasi (Rofik dan Murniati 2008). Benih yang diberi perlakuan deoperkulasi direndam dalam klorox 1% selama 30 menit untuk mengurangi kontaminasi cendawan dan mencegah kerusakan benih karena embrio menjadi kering. Persiapan Media Perkecambahan dan Media Tanam Media perkecambahan yang digunakan adalah arang sekam padi. Media perkecambahan disterilkan secara basah, kemudian dimasukkan ke dalam bak plastik perkecambahan ukuran 32.5 cm x 22.5 cm dengan volume media adalah 1/2 bagian. 30 Media tanam yang digunakan adalah tanah steril. Tanah yang diambil dibersihkan dari akar-akar, kemudian diayak dan tanah tersebut disterilisasi. Tanah disterilkan dengan autoclave pada tekanan 1.5 atm selama 15 menit dengan suhu 121 0C. Selanjutnya, tanah yang telah disterilkan dimasukkan ke polybag ukuran 40 cm x 40 cm sebanyak 10 kg sebagai media tanam. Pindah Tanam Pindah tanam dilakukan pada saat kecambah telah terbentuk daun pertama yang diperkirakan kecambah tersebut berumur 120 hari setelah tanam (HST). Kecambah dipindahkan ke media tanam dalam polybag. Aplikasi Inokulum FMA Indigenous dan Inokulum FMA Mycofer (Endomikoriza) Aplikasi inokulum FMA indigenous dan inokulum FMA mycofer (mengandung Gigaspora margarita, Glomus moseae, dan Glomus intraradises) dilakukan pada saat pindah tanam, dengan cara dimasukkan ke dalam lubang tanam. Perlakuan aplikasi antara inokulum FMA indigenous dengan inokulum FMA mycofer yang dimasukkan ke dalam lubang tanam masing-masing sebanyak 50 g. Pemupukan Pemupukan P dengan dosis 6.3 g (dalam bentuk SP36) mengacu dosis pemupukan pada pembibitan utama kelapa sawit yang diberikan 1.5 bulan sekali (Pahan 2008). Pemupukan dilakukan sebanyak 4 kali pada 0, 45, 90, dan 135 HST. Pemberian Naungan Tanaman aren secara alami membutuhkan naungan. Pemberian naungan dengan menggunakan paranet dengan intensitas naungan sebesar 55%. Pemeliharaan Pemeliharaan meliputi penyiraman yang dilakukan pada pagi hari secara teratur sesuai kebutuhan sampai kapasitas lapang, penyiangan dilakukan dengan membuang gulma di sekitar tanaman utama secara manual, pengendalian hama dan penyakit dilakukan apabila terjadi gejala serangan hama dan penyakit. Pengamatan Pengamatan akan dilakukan terhadap peubah-peubah sebagai berikut: a. Tinggi tanaman, yang diukur mulai dari pangkal tanaman sampai daun terpanjang yang diberdirikan. b. Jumlah pelepah daun, pelepah daun yang dihitung adalah pelepah daun yang memiliki daun telah membuka sempurna. c. Panjang pelepah dan pelepah daun. Panjang pelepah diukur dari pangkal daun sampai anak daun pertama yang tumbuh pada pelepah, sedangkan panjang pelepah daun diukur dari anak daun pertama sampai ujung daun. d. Diameter pangkal pelepah. Pengukuran diameter pangkal pelepah dilakukan saat destruktif. Pengukuran akan dilakukan pada bagian 1 cm dari pangkal pelepah menggunakan jangka sorong digital. 31 e. Volume akar. Volume akar diukur menggunakan gelas ukur yang telah diisi air. Akar dimasukkan ke dalam gelas ukur dan dilihat penambahan volume. Volume ukur = V2 – V1 Keterangan: V1 = Volume gelas ukur yang diisi air awal V2 = Volume gelas ukur yang telah diisi akar f. Panjang akar primer. Panjang akar primer diukur dari pangkal pelepah sampai akar primer terpanjang. g. Jumlah akar. Jumlah akar hanya dibatasi pada jumlah akar primer. h. Luas daun. Luas daun diukur pada saat destruktif. Metode yang akan digunakan adalah metode gravimetri. i. Bobot kering tajuk dan akar. Bobot kering tajuk dan akar dihitung setelah pengeringan dengan di oven pada suhu 60 0C selama 72 jam. j. Laju Tumbuh Relatif. Perhitungan LTR menggunakan rumus sebagai berikut (Hunt 1990): LTR g/g/minggu Keterangan: W1 = Bobot kering tanaman pada saat t1 W2 = Bobot kering tanaman pada saat t2 k. Biomassa total. Biomassa total diperoleh dari total pengukuran bobot kering tajuk dan bobot kering akar. l. Persen infeksi akar. Pengamatan persen infeksi akar dilakukan pada akhir penelitian dengan Metode Phillips dan Hayman (1970) dimodifikasi Laboratorium Bioteknologi Hutan Institut Pertanian Bogor. m. Jumlah spora. Penghitungan jumlah spora dilakukan pada akhir penelitian. n. Serapan unsur P (g/tanaman). Nilai serapan unsur P diketahui melalui analisis laboratorium dan perhitungan. Nilai serapan unsur hara dihitung menggunakan rumus sebagai berikut: Serapan hara (g/tanaman) = konsentrasi jaringan (%) x biomassa total (g) o. Efisiensi pemupukan. Efisiensi pemupukan dilakukan di akhir penelitian pada perlakuan pemupukan P. Nilai efisiensi pemupukan dihitung menggunakan rumus sebagai berikut: Kadar hara pupuk (g) = kadar hara pupuk P (ppm) x bobot pupuk sesuai perlakuan (g) Kadar hara tanaman (g) = konsentrasi jaringan (%) x biomassa total (g) Efisiensi pemupukan (%) = Keterangan: a : kadar hara pupuk (g) b : kadar hara tanaman (g) ( ) Analisis Sifat Kimia Tanah Penetapan sifat kimia tanah dilakukan di Laboratorium Analisis Tanah dan Tanaman SEAMEO BIOTROP, Bogor. Analisis sifat kimia tanah dilakukan pada media di awal dan akhir penelitian. 32 Analisis Hara N, P, dan K pada Jaringan Tanaman Analisis hara N, P, dan K pada jaringan tanaman dilakukan di Laboratorium Analisis Tanah dan Tanaman SEAMEO BIOTROP, Bogor. Analisis hara N, P, dan K pada jaringan tanaman dilakukan pada akhir penelitian. Hasil dan Pembahasan Kondisi Umum Percobaan Bibit yang digunakan dalam penelitian ini adalah aren tipe dalam yang berasal dari Cianjur, Jawa Barat. Bibit aren yang digunakan berumur ± 5 bulan dengan kriteria telah muncul 1-2 helai pelepah daun per tanaman. Analisis tanah juga dilakukan terhadap media tanam yang digunakan. Analisis tanah media tanam dilakukan pada media di awal dan akhir penelitian disajikan pada Tabel 5. Tabel 5. Analisis tanah media di awal dan akhir penelitian Sifat kimia tanah Media awal P0M0 P0M1 Contoh uji P0M2 P1M0 P1M1 P1M2 pH H2O 5.4 (M) 4.8 (M) 4.9 (M) 4.8 (M) 4.9 (M) 5.0 (M) 5.0 (M) C-organik (%) 1.48 (R) 1.37 (R) 1.33 (R) 1.34 (R) 1.37 (R) 1.33 (R) 1.31 (R) N-total (%) 0.20 (R) 0.20 (R) 0.18 (R) 0.18 (R) 0.18 (R) 0.17 (R) 0.19 (R) P-tersedia (ppm) 15.8 (R) 9.6 (SR) 8.1 (SR) 9.6 (SR) 170.5 (ST) 205.4 (ST) 223.4 (ST) K (me/100g) 1.96 (ST) 1.84 (ST) 1.74 (ST) 1.94 (ST) 1.82 (ST) 1.55 (ST) 1.60 (ST) KTK (me/100g) 17.21 (S) 16.87 (R) 17.32 (S) 17.52 (S) 18.33 (S) 18.36 (S) 18.72 (S) Keterangan : Hasil analisis contoh tanah dari media awal dan akhir penelitian di Laboratorium Analisis Tanah dan Tanaman SEAMEO BIOTROP 2015; P0M0 = Kontrol, P0M1 = Inokulum indigenous, P0M2 = Inokulum mycofer, P1M0 = Pemupukan P, P1M1 = Pemupukan P dengan inokulum indigenous, P1M2 = Pemupukan P dengan inokulum mycofer; Berdasarkan kriteria penilaian sifat kimia tanah, Hardjowigeno 2010: (M) = Masam, (SR) = Sangat Rendah, (R) = Rendah, (S) = Sedang, (ST) = Sangat Tinggi; Kriteria penilaian sifat kimia tanah disajikan pada Lampiran 1. Analisis hara N, P, dan K pada jaringan tanaman dilakukan pada akhir penelitian. Analisis hara N, P, dan K pada jaringan tanaman dilakukan pada bagian akar, tajuk, dan daun (Tabel 6). Tabel 6. Analisis hara N, P, dan K pada jaringan tanaman Parameter pengujian N-total (%) P-total (%) K-total (%) Contoh uji P0M0 1.10 (ST) 0.15 (SR) 0.50 (S) P0M1 1.73 (ST) 0.22 (SR) 0.59 (S) P0M2 1.54 (ST) 0.21 (SR) 0.26 (R) P1M0 1.55 (ST) 0.25 (SR) 0.61 (T) P1M1 1.61 (ST) 0.28 (SR) 0.62 (T) P1M2 0.96 (ST) 0.25 (SR) 0.45 (S) Keterangan : Hasil analisis jaringan tanaman di Laboratorium Analisis Tanah dan Tanaman SEAMEO BIOTROP 2015; P0M0 = Kontrol, P0M1 = Inokulum indigenous, P0M2 = Inokulum mycofer, P1M0 = Pemupukan P, P1M1 = Pemupukan P dengan inokulum indigenous, P1M2 = Pemupukan P dengan inokulum mycofer; Berdasarkan kriteria penilaian sifat kimia tanah, Hardjowigeno 2010: (SR) = Sangat Rendah, (R) = Rendah, (S) = Sedang, (T) = Tinggi, (ST) = Sangat Tinggi; Kriteria penilaian sifat kimia tanah disajikan pada Lampiran 1. Suhu udara dan tanah juga dilakukan pengukuran dengan menggunakan thermo recorder. Suhu udara dan tanah diukur pada pukul 08.00-18.00 WIB. Suhu rata-rata udara adalah 28.9 0C, sedangkan suhu udara max 33.0 0C dan min 22.9 0 C. Suhu rata-rata tanah adalah 25.4 0C, sedangkan suhu tanah max 27.1 0C dan min 23.1 0C. 33 Tinggi Tanaman Tinggi tanaman bibit aren dipengaruhi oleh perlakuan inokulum FMA (indigenous dan mycofer) pada 24 minggu setelah perlakuan (MSP). Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap tinggi tanaman bibit aren pada 0 sampai 24 MSP. Inokulum FMA (indigenous dan mycofer) meningkatkan tinggi tanaman sebesar 8.3% dibandingkan tanpa inokulum FMA pada 24 MSP (Tabel 7). Hal ini mengindikasikan bahwa pemberian inokulum FMA berpengaruh baik terhadap tinggi tanaman, karena inokulum FMA mengandung berbagai jenis spora, adanya hifa, dan propagul lainnya sehingga dapat membantu tanaman dalam menyerap unsur hara dan air. Salah satu cara untuk membantu tanaman dalam meningkatkan penyerapan unsur hara pada media tempat tumbuh adalah menginokulasikan FMA pada tanaman (Setiadi 1989). Hal ini juga didukung hasil penelitian Kartika (2006) yang menunjukkan bahwa bibit kelapa sawit yang bersimbiosis dengan FMA menunjukkan tanggap pertumbuhan dan serapan P lebih tinggi dibandingkan bibit tanpa inokulasi FMA. Perlakuan pemupukan P memiliki tinggi tanaman yang lebih rendah dibandingkan perlakuan tanpa pemupukan (Tabel 7). Fosfat memiliki sifat slow realese yang menyebabkan fosfat tidak tersedia dalam tanah untuk pertumbuhan tanaman sehingga proses metabolik tanaman terhambat. Tabel 7. Pengaruh faktor pemupukan P dan inokulum FMA terhadap tinggi tanaman bibit aren sampai 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Keterangan : 0 MSP 8 MSP 16 MSP 24 MSP ---------------------(cm)--------------------------43.0 40.9 44.3 41.1 46.0 42.7 47.6 a 45.0 b 40.5 43.2 42.2 tn 41.4 44.4 42.3 tn 42.5 46.0 44.7 tn 43.9 b 47.5 a 47.6 a tn Angka-angka diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Jumlah Pelepah Daun Jumlah pelepah daun tidak dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 minggu setelah perlakuan (MSP). Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap jumlah pelepah daun bibit aren pada 24 MSP (Tabel 8). Tanaman aren termasuk famili Arecaceae dengan laju pertumbuhan pelepah daun yang sangat lambat jika dibandingkan dengan spesies lain. Tanaman aren memiliki laju pertumbuhan pelepah daun berkisar 3-6 helai pelepah daun per tahun (Smits 1996), sedangkan tanaman kelapa laju pertumbuhan pelepah daun relatif cepat dengan menghasilkan 1 helai pelepah daun baru tiap bulan. Dinamika laju pertumbuhan jumlah pelepah daun kelapa sawit berkisar 30–40 helai pelepah 34 daun per tahun pada tanaman berumur 5 atau 6 tahun, tetapi setelah itu pertumbuhan pelepah daun akan menurun pada tingkat 20-25 pelepah daun per tahun (Hartley 1977). Tabel 8. Pengaruh faktor pemupukan P dan inokulum FMA terhadap jumlah pelepah daun bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Jumlah pelepah daun -----------------------(helai)-----------------------3.5 3.6 3.6 3.6 3.4 tn Keterangan : tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Panjang Pelepah Panjang pelepah tidak dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap panjang pelepah bibit aren pada 24 MSP (Tabel 9). Perlakuan tanpa pemupukan P memiliki panjang pelepah yang lebih besar dibandingkan pemupukan P, sedangkan perlakuan inokulum FMA memiliki panjang pelepah yang lebih besar dibandingkan tanpa inokulum. Panjang pelepah diduga memiliki korelasi dengan tinggi tanaman. Hasil penelitian Furqoni (2014) menunjukkan bahwa tanaman aren yang memiliki tinggi tanaman lebih tinggi memiliki pelepah lebih tinggi pula. Tabel 9. Pengaruh faktor pemupukan P dan inokulum FMA terhadap panjang pelepah bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Panjang pelepah --------------------------(cm)------------------------29.7 29.6 28.4 30.4 30.2 tn Keterangan : tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. 35 Panjang Pelepah Daun Interaksi antara pemupukan P dan pemberian inokulum FMA berpengaruh nyata terhadap panjang pelepah daun bibit aren pada 24 MSP. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA pada 24 MSP menunjukkan adanya peran inokulum FMA terhadap panjang pelepah daun bibit aren. Perlakuan inokulum FMA tanpa pemupukan P memiliki nilai panjang pelepah daun yang lebih besar dibandingkan dengan perlakuan inokulum FMA dengan pemupukan P (Tabel 10). Hal ini diduga kemampuan FMA memperbaiki dan meningkatkan pertumbuhan tanaman yang berkaitan dengan penyerapan fosfor. Fosfor merupakan salah satu unsur hara makro yang penting dalam pertumbuhan dan perkembangan tanaman. Salah satu fungsi Fosfor yaitu molekul pentransfer ADP dan ATP. ATP merupakan senyawa penting bagi reaksi metabolit yaitu reaksi biosintetik pembentukan senyawa penting bagi pemeliharaan sel dan pertumbuhan. Dengan demikian, ketersedian P yang cukup oleh FMA akan meningkatkan pertumbuhan panjang pelepah daun. Tabel 10. Interaksi pemupukan P dan inokulum FMA terhadap rata-rata panjang pelepah daun bibit aren pada 24 MSP Pemupukan P Tanpa pemupukan Pemupukan P Keterangan : Inokulum FMA Tanpa Inokulum Inokulum inokulum indigenous mycofer -------------------------------(cm)--------------------------------19.0 c 25.3 a 24.4 ab 20.6 c 21.3 bc 21.8 abc Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%. Diameter Pangkal Pelepah Diameter pangkal pelepah bibit aren dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap diameter pangkal pelepah batang bibit aren pada 24 MSP. Pemupukan P meningkatkan diameter pangkal pelepah sebesar 19.5% dibandingkan tanpa pemupukan, sedangkan Inokulum FMA indigenous dan mycofer masing-masing meningkatkan diameter pangkal pelepah sebesar 20.5% dan 35.4% pada 24 MSP (Tabel 11). Ketersediaan unsur P melalui pemupukan diduga mendukung pertumbuhan pada fase vegetatif, sedangkan inokulum FMA membantu suplai fosfor bagi tanaman. Hasil penelitian Kartika (2006) menunjukkan bahwa bibit kelapa sawit yang diinokulasi FMA dengan inokulum campuran meningkatkan pertumbuhan diameter batang. Pertambahan diameter pangkal pelepah pada perlakuan pemupukan P sejalan dengan hasil penelitian Sudradjat et al. (2014) yang menunjukkan bahwa aplikasi pemupukan P meningkatkan pertumbuhan diameter batang bibit kelapa sawit. 36 Tabel 11. Pengaruh faktor pemupukan P dan inokulum FMA terhadap diameter pangkal pelepah bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Keterangan : Diameter pangkal pelepah ----------------------(mm)----------------------17.4 b 20.8 a 16.1 b 19.4 a 21.8 a tn Angka-angka diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Luas Daun Luas daun bibit aren tidak dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap luas daun bibit aren pada 24 MSP (Tabel 12). Perlakuan tanpa pemupukan P memiliki luas daun yang lebih tinggi dibandingkan pemupukan P, sedangkan perlakuan inokulum FMA memiliki luas daun yang lebih tinggi dibandingkan tanpa inokulum. Pada saat pengukuran luas daun, kondisi daun pada perlakuan tanpa pemupukan P dan inokulum mycofer telah membuka sempurna, sedangkan kondisi daun pada perlakuan pemupukan P, tanpa inokulum, dan inokulum indigenous masih banyak yang kuncup dibandingkan membuka sempurna. Tinggi tanaman berkorelasi terhadap fase pertumbuhan daun tanaman, jika luas daun tertinggi berada pada fase perkembangan daun (membuka sempurna) maka pertambahan tinggi tanaman meningkat, sebaliknya jika perkembangan daun tanaman berada pada fase muda (kuncup) maka pertambahan tinggi tanaman relatif sedikit. Tabel 12. Pengaruh faktor pemupukan P dan inokulum FMA terhadap luas daun bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Luas daun -----------------------(cm2)----------------------3 447 1 134 648 1 081 5 142 tn Keterangan : tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. 37 Volume dan Panjang Akar Volume akar dipengaruhi perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap volume akar bibit aren pada 24 MSP. Pemupukan P meningkatkan volume akar sebesar 26.9% pada 24 MSP dibandingkan dengan bibit tanpa pemupukan. Pemberian inoukulum FMA (indigenous dan mycofer) meningkatkan volume akar sebesar 48.7% pada 24 MSP dibandingkan dengan bibit tanpa inokulum (Tabel 13). Peningkatan volume akar diduga sistem perluasan hifa eksternal dari FMA untuk mengeksploitasi volume tanah dan mengoptimalkan unsur hara terutama fosfor untuk perkembangan akar. Panjang akar hanya dipengaruhi oleh perlakuan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap panjang akar bibit aren pada 24 MSP. Pemberian inokulum FMA (indigenous dan mycofer) meningkatkan panjang akar sebesar 25.1% pada 24 MSP dibandingkan tanpa inokulum FMA (Tabel 13). Peningkatan panjang akar diduga peran hifa eksternal dari FMA yang bekerja secara efektif dalam membantu akar untuk mendapatkan unsur hara dan air dalam tanah yang tidak terjangkau oleh akar. Tabel 13. Pengaruh faktor pemupukan P dan inokulum FMA terhadap volume dan panjang akar bibit aren pada 24 MSP 1. 2. 3. Perlakuan Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Keterangan : Volume akar (cm3) Panjang akar (cm) 17.5 b 22.2 a 52.9 54.4 15.0 b 20.0 ab 24.6 a tn 46.0 b 54.9 ab 60.2 a tn Angka-angka diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Jumlah Akar Interaksi antara pemupukan P dan inokulum FMA berpengaruh nyata terhadap jumlah akar primer bibit aren pada 24 MSP. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA pada 24 MSP menunjukkan adanya peran pemupukan P terhadap jumlah akar primer bibit aren. Perlakuan inokulum FMA dengan pemupukan P memiliki nilai jumlah akar primer yang lebih besar dibandingkan dengan perlakuan inokulum FMA tanpa pemupukan (Tabel 14). Pemupukan P menunjang ketersediaan hara bagi perkembangan akar pada bibit aren. Fosfor berperan dalam meningkatkan perkembangan akar dan sebagai sumber energi dengan membentuk ATP (Shaheen et al. 2007), akan tetapi pergerakan P di dalam tanah sangat lambat karena reaktivitas P yang tinggi dengan kation-kation dalam tanah dan P yang cepat dikonversi dalam bentuk P organik oleh aktivitas mikroba (Hebbar et al. 2004). 38 Tabel 14. Interaksi pemupukan P dan inokulum FMA terhadap rata-rata jumlah akar primer bibit aren pada 24 MSP Pemupukan P Tanpa pemupukan Pemupukan P Keterangan : Inokulum FMA Tanpa Inokulum Inokulum inokulum indigenous mycofer -------------------------------(cm)--------------------------------4.7 b 6.7 ab 7.7 a 8.0 a 7.0 a 8.3 a Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%. Bobot Kering Tajuk dan Akar Bobot kering tajuk dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Bobot kering akar tidak dipengaruhi oleh pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap bobot kering tajuk dan akar bibit aren pada 24 MSP. Pemupukan P meningkatkan bobot kering tajuk sebesar 53.1% dibandingkan tanpa pemupukan P, sedangkan inokulum FMA indigenous dan mycofer masing-masing meningkatkan bobot kering tajuk sebesar 49.5% dan 59.3% dibandingkan tanpa inokulum. Pemupukan P memiliki bobot kering akar yang lebih besar dibandingkan tanpa pemupukan, sedangkan inokulum FMA memiliki bobot kering akar yang lebih besar dibandingkan tanpa inokulum (Tabel 15). Hal ini menunjukkan bahwa pemupukan P memiliki peran dalam menunjang nutrisi selama pertumbuhan, sedangkan inokulum FMA membantu akar menyerap air dan hara dari tanah untuk mengimbangi laju fotosintesis dan transpirasi. Tabel 15. Pengaruh faktor pemupukan P dan inokulum FMA terhadap bobot kering tajuk dan akar bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Bobot kering tajuk Bobot kering akar ----------------------------(g)-------------------------9.8 b 15.0 a 3.5 3.7 9.1 b 13.6 a 14.5 a tn 3.2 3.4 4.2 tn Keterangan : Angka-angka diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. 39 Biomassa Total Bobot biomassa total dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA hanya pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap biomassa total bibit aren pada 12 dan 24 MSP. Pemupukan P meningkatkan bobot biomassa total sebesar 39.8% dibandingkan dengan bibit aren tanpa pemupukan, sedangkan inokulum FMA indigenous dan mycofer masing-masing meningkatkan bobot biomassa total sebesar 38.2% dan 52.0% dibandingkan dengan bibit aren tanpa pemberian inokulum FMA pada 24 MSP (Tabel 16). Peningkatan biomassa total diduga berkaitan dengan metabolisme tanaman atau karena kondisi pertumbuhan tanaman yang lebih baik bagi berlangsungnya aktivitas metabolisme tanaman. Muin (2003) menyatakan bahwa FMA meningkatkan konsentrasi P pada semua organ tanaman. Sementara, Laju fotosintesis pada tanaman dipengaruhi oleh meningkatnya unsur hara P (Darmawan 2006). Dengan demikian, pemupukan P dan pemberian inokulum FMA dapat meningkatkan kemampuan bibit untuk menyerap hara dari media tanam sehingga memiliki hasil fotosintesis yang lebih besar. Tabel 16. Pengaruh faktor pemupukan P dan inokulum FMA terhadap biomassa total bibit aren pada 12 dan 24 MSP Perlakuan 1. Pemupukan P Tanpa pemupukan Pemupukan P 2. Inokulum FMA Tanpa inokulum Inokulum indigeous Inokulum mycofer 3. Interaksi Keterangan : 12 MSP 24 MSP ---------------------------(g)---------------------------4.6 7.3 13.3 b 18.6 a 6.4 4.4 6.9 tn 12.3 b 17.1 a 18.7 a tn Angka-angka diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Laju Tumbuh Relatif Laju Tumbuh Relatif (LTR) tidak dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 12-24 minggu. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap laju tumbuh relatif bibit aren pada 12-24 minggu (Tabel 17). LTR pada bibit aren sangat lambat jika dibandingkan dengan tanaman kelapa sawit. Hal ini mengindikasikan bahwa pertumbuhan fase vegetatif tanaman aren sangat lambat. LTR diduga memiliki korelasi dengan biomassa total. Hasil penelitian Ibrahim et al. (2010) menunjukkan bahwa bibit kelapa sawit yang ditumbuhkan dengan mengatur kandungan CO2 pada taraf 400-1 200 μmol mol-1 selama 15 minggu menunjukkan LTR berkisar 0.35-0.70 g/g/minggu dan biomassa total menjadi faktor utama yang telah memberikan kontribusi terhadap peningkatan pertumbuhan yang ditandai dengan semakin tinggi nilai koefisien korelasi dengan LTR. 40 Tabel 17. Pengaruh faktor pemupukan P dan inokulum FMA terhadap laju tumbuh relatif bibit aren pada 12-24 minggu Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigeous Inokulum mycofer Interaksi Laju tumbuh relatif -------------------(g/g/minggu)------------------0.044 0.037 0.027 0.050 0.044 tn Keterangan : tn = tidak berbeda nyata pada uji F 5%; MSP = Minggu Setelah Perlakuan. Serapan Unsur P Serapan unsur P dipengaruhi oleh perlakuan pemupukan P dan inokulum FMA pada 24 MSP. Interaksi antara pemupukan P dan inokulum FMA tidak berpengaruh nyata terhadap serapan unsur P bibit aren pada 24 MSP (Tabel 18). Pemupukan P meningkatkan serapan unsur P sebesar 88.5% dibandingkan tanpa pemupukan, sedangkan inokulum FMA indigenous dan mycofer masing-masing meningkatkan serapan unsur P sebesar 69.2% dan 65.4% dibandingkan tanpa inokulum. Hal ini mengindikasikan bahwa pemupukan P menunjang ketersediaan P anorganik bagi tanaman, sedangkan inokulum FMA meningkatkan serapan P melalui perluasan permukaan akar oleh hifa eksternal dan menyerap P organik serta mengubahnya menjadi P anorganik yang dapat diserap tanaman dengan bantuan enzim fosfatase asam yang dihasilkan oleh FMA dan sel-sel tanaman tersebut. Tabel 18. Pengaruh pemupukan P dan inokulum FMA terhadap serapan unsur P bibit aren pada 24 MSP Perlakuan 1. 2. 3. Pemupukan P Tanpa pemupukan Pemupukan P Inokulum FMA Tanpa inokulum Inokulum indigenous Inokulum mycofer Interaksi Keterangan : Serapan unsur P ---------------------(g/tanaman)--------------------0.026 b 0.049 a 0.026 b 0.044 a 0.043 a tn Angka-angka yang diikuti oleh huruf yang sama pada kolom dan perlakuan yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%; tn = tidak berpengaruh nyata pada taraf 5%; MSP = Minggu Setelah Perlakuan. 41 Jumlah Spora Interaksi antara pemupukan P dan inokulum FMA berpengaruh nyata terhadap jumlah spora pada 24 MSP. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA pada 24 MSP menunjukkan adanya peran inokulum FMA terhadap jumlah spora bibit aren. Perlakuan inokulum FMA tanpa pemupukan P memiliki nilai jumlah spora yang lebih besar dibandingkan perlakuan inokulum FMA dengan pemupukan P (Tabel 19). Sedikitnya jumlah spora pada perlakuan inokulum FMA dengan pemupukan P disebabkan oleh kandungan P tersedia dalam tanah sangat tinggi berkisar antara 170.5-223.4 ppm (Tabel 5). Tingginya P tersedia di dalam tanah oleh pemupukan P menyebabkan terhambatnya perkembangan FMA di dalam tanah. Hal ini didukung oleh pernyataan Hidayat (2003), yang menyatakan bahwa kandungan unsur P yang tinggi menghambat perkembangan FMA. Tabel 19. Interaksi pemupukan P dan inokulum FMA terhadap rata-rata jumlah spora bibit aren pada 24 MSP Pemupukan P Tanpa pemupukan Pemupukan P Keterangan : Inokulum FMA Tanpa Inokulum Inokulum inokulum indigenous mycofer ------------------(spora FMA per 50 g tanah)------------1.7 d 70.3 a 68.3 a 14.3 cd 34.7 bc 59.7 ab Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%. Persen Infeksi Akar Interaksi antara pemupukan P dan inokulum FMA berpengaruh nyata terhadap persen infeksi akar pada 24 MSP. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA pada 24 MSP menunjukkan adanya peran inokulum FMA terhadap persen infeksi akar bibit aren. Perlakuan inokulum FMA tanpa pemupukan P memiliki nilai persen infeksi akar yang lebih besar dibandingkan dengan perlakuan inokulum FMA dengan pemupukan P (Tabel 20). Tabel 20. Interaksi pemupukan P dan inokulum FMA terhadap rata-rata persen infeksi akar bibit aren pada 24 MSP Pemupukan P Tanpa pemupukan Pemupukan P Keterangan : Inokulum FMA Tanpa Inokulum Inokulum inokulum indigenous mycofer ---------------------------------(%)--------------------------------0.0 c 70.0 a 46.7 b 3.3 c 40.0 b 43.3 b Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%. Mekanisme infeksi akar terdiri atas 3 tahap, yaitu: (1) Pra infeksi, spora dari mikoriza berkecambah membentuk appressoria, (2) Infeksi, dengan appressoria mikoriza melakukan penetrasi pada akar tanaman, (3) Pasca infeksi, setelah melakukan penetrasi, hifa akan tumbuh secara intraseluler (Smith dan Read 1997). Pemupukan P menghambat infeksi akar oleh mikoriza pada tahap infeksi. Hal ini 42 diduga pada kondisi pemupukan P, akar menyerap ion-ion fosfat dalam larutan tanah karena adanya perbedaan gradien konsentrasi unsur hara di daerah perakaran sehingga menyebabkan appressoria mikoriza tidak mampu melakukan penetrasi ke akar tanaman pada kondisi P tersedia sangat tinggi di dalam tanah oleh pemupukan P (Tabel 5). Tamin (2010) menyatakan bahwa pemupukan khususnya pupuk fosfat dan nitrogen mengakibatkan penurunan infeksi akar. Dengan demikian, pemupukan P berpengaruh negatif terhadap parameter persen infeksi akar. Infeksi akar pada penelitian ini hanya ditemukan struktur FMA yang terdiri atas hifa internal dan eksternal, sedangkan vesikula dan arbuskula tidak ditemukan. Hal ini diduga dalam simbiosisnya tumbuhan mendorong FMA untuk menyerap nutrien di lapangan sehingga pembentukan hifa eksternal lebih dominan. Hifa internal berfungsi sebagai alat translokasi unsur hara, eksternal berfungsi menyerap unsur hara dan air. Vesikula berfungsi sebagai tempat cadangan makanan terutama lipid, sedangkan arbuskula merupakan struktur infeksi yang sangat penting dalam simbiosis FMA, karena arbuskula berfungsi dalam proses transfer unsur hara antara kedua simbion (fungi dengan akar tanaman) (Smith dan Read 1997). A B Gambar 5. Infeksi FMA pada bibit aren. A = akar yang tidak terinfeksi, B = Hifa internal Efisiensi pemupukan Efisiensi pemupukan adalah perbandingan jumlah hara yang diserap oleh tanaman dengan jumlah hara yang diberikan, dengan asusmsi bahwa tanaman menyerap hara yang berasal dari pupuk anorganik yang diberikan. Efisiensi pemupukan dihitung pada perlakuan pemupukan P, yaitu perlakuan P1M0 (pemupukan P tanpa inokulum), P1M1 (pemupukan P dengan inokulum FMA indigenous), dan P1M2 (pemupukan P dengan inokulum FMA mycofer). Hasil perhitungan efisiensi pemupukan pada perlakuan P1M0, P1M1, dan P1M2 menunjukkan bahwa nilai efisiensi pemupukan P masing-masing sebesar 1.34%, 2.15%, dan 1.83% (Tabel 21). Nilai efisiensi pemupukan pada perlakuan pemupukan P dengan inokulum FMA (indigenous dan mycofer) memiliki nilai efisiensi pemupukan lebih besar dibandingkan perlakuan pemupukan P tanpa inokulum. Hal ini mengindikasikan bahwa inokulum FMA memiliki peran dalam peningkatan serapan hara P bagi tanaman. Peningkatan serapan P sebagian besar karena hifa eksternal dari FMA, hifa eksternal menyediakan permukaan yang lebih efektif dalam menyerap unsur hara dari tanah yang kemudian dipindahkan ke akar inang (Kramadibrata 1993). FMA menyerap fosfat organik dan mengubahnya menjadi fosfat anorganik yang dapat diserap tanaman dengan adanya bantuan enzim fosfatase asam yang dihasilkan oleh FMA dan sel-sel tanaman tersebut. Gunawan (1993) menjelaskan 43 bahwa enzim fosfatase asam yang dihasilkan oleh hifa FMA yang sedang aktif tumbuh dan peningkatan aktivitas fosfatase pada permukaan akar sebagai hasil infeksi FMA menyebabkan fosfat anorganik dibebaskan dari fosfat organik pada daerah dekat permukaan sel sehingga dapat diserap melalui mekanisme serapan hara. Efisiensi hara P secara umum adalah sebesar 10-15% (Busyra 2010). Hasil perhitungan menunjukkan bahwa terdapat hara P yang tidak terserap oleh tanaman (Tabel 21). Hara yang tidak terserap oleh tanaman terjadi karena pupuk yang diberikan tercuci (leaching), mengalami penguapan dan terikat oleh partikel mineral liat dan koloid tanah sehingga tidak tersedia bagi tanaman (Tisdale dan Nelson 1985; Brady dan Weil 2002). Jumlah pupuk P pada perlakuan P1M0, P1M1, dan P1M2 yang tidak terserap masing-masing sebesar 98.55%, 97.82%, dan 98.18% (Tabel 21). Hasil penelitian Darwis pada kelapa sawit (2012) menunjukkan bahwa pupuk P yang tidak terserap tertinggi pada pupuk P sebesar 84.9%, terendah pada pupuk N sebesar 73.7%, sementara untuk pupuk K mencapai 75.5%. Brady dan Weil (2002) menyatakan bahwa rendahnya serapan P disebabkan oleh sebagian besar P terikat oleh kation Al dan Fe dan tidak mudah larut dalam larutan tanah sehingga tidak tersedia dalam tanah untuk pertumbuhan tanaman. Tabel 21. Efisiensi pemupukan P pada perlakuan dosis pupuk 6.3 g P tanaman-1 Uraian P1M0 Pupuk (g) Serapan tanaman (g) Efisiensi pemupukan (%) Pupuk yang tidak terserap (%) 2.75 0.04 1.34 98.55 Kadar hara fosfor P1M1 2.75 0.06 2.15 97.82 P1M2 2.75 0.05 1.83 98.18 Keterangan: P1M0 = pemupukan P tanpa inokulum; P1M1 = pemupukan P dengan inokulum FMA indigenous; P1M2 = pemupukan P dengan inokulum FMA mycofer. Kesimpulan dan Saran Kesimpulan Hasil uji keefektifan menunjukkan bahwa inokulum FMA indigenous mampu meningkatkan pertumbuhan bibit aren berdasarkan parameter tinggi tanaman, panjang pelepah daun, diameter pangkal pelepah, bobot kering tajuk, biomassa total, serapan hara P, jumlah spora, dan persen infeksi akar. Interaksi yang terjadi antara pemupukan P dengan inokulum FMA menunjukkan adanya peran inokulum FMA terhadap panjang pelepah daun, jumlah spora, dan persen infeksi akar dengan nilai tertinggi diperoleh pada perlakuan inokulum FMA indigenous tanpa pemupukan P. Saran Inokulasi FMA pada bibit aren dengan status hara P tanah yang rendah dapat meningkatkan serapan P sehingga tidak memerlukan pemupukan P anorganik. Penelitian lanjutan di lapangan dengan penanaman bibit aren bermikoriza diperlukan untuk melihat keefektifan inokulasi FMA terhadap pertumbuhan tanaman. 44 DAFTAR PUSTAKA Abbot LK, Robson AD, De Boer G. 1984. The effect of phosporus on the formation of hyphae in soil by the vesicular-arbuscular mycorrhizal fungi, Glomus fasciculatum. New Phytol. 97:347-356. Akuba RH. 2004. Profil aren. Di dalam: Effendi DS, editor. Prospek Pengembangan Tanaman Aren (Arenga pinnata (Wurmb) Merr.) Mendukung Kebutuhan Bioetanol di Indonesia; 2010 Jan 11; Bogor, Indonesia. Bogor (ID): Litbang Deptan. hlm 15-21. Alexopoulos CJ, Mims CW, Blackwell M. 1996. Introductory mycology. 4th Ed. United States of America (US): John Wiley & Sons Inc. Bagyaraj DJ. 1991. Ecology of vesikula-arbuskula mycorrhizae. In: Dilip KA, editor. Mycorrhizae and Endophytic Fungi. Soil and plants handbook of applied mycology. New York (US): Marcell Dekker Inc. Bearley FQ. 2012. Ecthomycorrhizal association of the Dipterocarpaceae. Biotropica. 4(5):637-648. Bentivenga SP, Morton JB. 1995. A monograph of the genus Gigaspora, incorporating development patterns of morphological characters. Mycologia. 87:720-732. Bertham YH. 2006. Pemanfaatan FMA dan Bradyrhizobium dalam meningkatkan produktivitas kedelai pada sistem agroforestri kayu bawang (Scorodocarpus borneensis Burm.F) di Ultisol [disertasi]. Bogor (ID): Institut Pertanian Bogor. Bever JD. 2002. Host-specifity of AM fungal population growth rates can generate feed back on plant growth. Plant and Soil. 244(1-2):281-290. Bowen GD. 2000. The biology and physiology of VA mycorrhizal infection and its development. In: Ecophysiology of VA Mycorrhizal Plants. Boca Raton Florida (US): CRC Press. p 32-36. [BPKPL] Balai Penelitian Kelapa dan Palma Lain (ID). 2014. Sumber benih dan teknologi pembibitan aren [Internet]. [diunduh 2014 Maret 2]; Tersedia pada: http://[email protected]. Brady NC, Weil RR. 2002. The Nature and Properties of Soils. 31th ed. New York (US): Prentice Hall. Bronick CJ, Lal R. 2005. Soil structure and management [review]. Geoderma. 124(1-2):3-22. Brundrett M, Abbott LK, Jasper JA. 1999. Glomalean mycorrhizal fungi from tropical Australia. I. Comparison of the effectiveness and specificity of different isolation procedures. Mycorrhiza. 8:305-314. Brundrett M, Dells B, Grove T, Malajczuk N. 1996. Working with Mychorrhizas in Forestry and Agriculture. Canberra (AU): ACIAR. Brundrett MC. 2004. Diversity and classification of mycorrhizal associations. Biol.Rev.79:473-495. Budiyanto W. 2003. Pengaruh inokulasi cendawan mikoriza arbuskula dan pemangkasan akar terhadap pertumbuhan bibit jati (Tectona grandis L. f.) di persemaian Pusbag SDH Perum Perhutani, Cepu, Jawa Tengah [skripsi]. Bogor (ID): Institut Pertanian Bogor. 45 Busyra BS. 2010. Kebutuhan fosfor berdasarkan status hara fosfat lahan sawah di provinsi Jambi. J Agron Indonesia. 8(1):69-74. Chantaraboon A, Burikam I, Pampasit S, Pongsattayapipat R. 2009. Improvement of sexual propagation in sugar palm (Tao) (Arenga westerhoutii Griff) seeds. Thai J Agric Sci. 42(3):67-70. Chantaraboon A, Burikam I, Pampasit S, Pongsattayapipat R. 2010. Method for the economic recovery of sugar palm (Tao) (Arenga westerhoutii Griff). comunity forests. Songklanakarin J Sci Technol. 32(4):357-362. Clark RB. 1997. Arbuscular mycorrhizal adaptation, spore germination, root colonization, and host plant growth and mineral acquisition at low pH. Plant Soil. 192:15-22. Damayanti ND, Rini MV, Evizal R. 2014. Respon pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.) terhadap jenis fungi mikoriza arbuskula pada dua tingkat pemupukan NPK. J Penel Perta Terap. 15(1): 33-40. Darmawan. 2006. Aktivitas fisiologi kelapa sawit belum menghasilkan melalui pemberian nitrogen pada dua tingkat ketersediaan air tanah. J Agrivigor. 6:41-48. Darwis A. 2012. Optimasi dosis pupuk nitrogen dan fosfor pada bibit kelapa sawit (Elaeis guineensis jacq.) di pembibitan utama [tesis]. Bogor (ID): Institut Pertanian Bogor. Delvian. 2003. Keanekaragaman cendawan mikoriza arbuskula di hutan pantai dan potensi pemanfaatannya. Studi kasus di hutan cagar alam Leuweung Sancang Kabupaten Garut, Jawa Barat [disertasi]. Bogor (ID): Institut Pertanian Bogor. [Ditjenbun] Direktorat Jendral Perkebunan. 2011. Statistik Perkebunan Aren 2009-2011. Jakarta (ID): Kementan RI. hlm 3-20. Driver JD, Holben WE, Rillig MC. 2005. Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry. 37(1):101-106. Elberson W, Oyen L. 2010. Sugar palm (Arenga pinnata). FACT Foundation. Florido HB, de Mesa PB. 2003. Sugar palm (Arenga pinnata (Wurmb.) Merr.). Research information series on ecosystems 15(2). Fakuara MY. 1988. Mikoriza, Teori dan Kegunaan dalam Praktek. Bogor (ID): PAU IPB. Furqoni H. 2014. Karakterisasi dan respon pertumbuhan aren (Arenga Pinnata (Wurmb) Merr.) pada tingkat naungan berbeda selama fase pembibitan [tesis]. Bogor (ID): Institut Pertanian Bogor. Gerdemann JW, Nicolson. 1963. Spores of mycorrhizae Endogone extracted from soil by wet sieving and decanting. Trans. Br. Mys. Soc. 46:235-244. Giovannetti M, Mosse B. 1980. An evaluation of techniques for measuring vesicular arbuscular mychorizal infection in roots. New Phytol. 84:489-500. Gunawan AW. 1993. Mikoriza Arbuskula. Bogor (ID): PAU IPB. Hanafiah KA. 2001. Pengaruh inokulasi ganda fungi mikoriza arbuskular dan Azospirilium brasilience dalam peningkatan efisiensi pemupukan P dan N pada padi sawah tadah hujan [disertasi]. Bogor (ID): Institut Pertanian Bogor. 46 Hanapiah T. 1997. Pengaruh inokulasi mikoriza arbuskula dan pemupukan fosfor terhadap pertumbuhan bibit kopi arabika (Coffe arabica L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor. Harada K, Mogea JP, Rahayu M. 2005. Diversity, conservation and local knowledge of rattans and sugar palm in Gunung Halimun National Park, Indonesia. Palms. 49(1):25-35. Hardjowigeno S. 2010. Ilmu Tanah. Jakarta (ID): Akademika Pressindo. Hartley CWS. 1977. The oil palm. New York (US): Longman Inc. Hasbi R. 2005. Studi diversitas fungi mikoriza arbuskula (FMA) pada berbagai tanaman budidaya di lahan gambut Pontianak [skripsi]. Pontianak (ID): Universitas Panca Bhakti. Hebbar SS, Ramachandrappa BK, Nanjappa HV, Prabhakar M. 2004. Studies on NPK drip fertigation in field grown tomato (Lycopersicon esculentum Mill.). Europ J Agro. 21:117-127. Hetrick BAD. 1984. Ecology of vesikular-arbuskular mycorrizal fungi. In: Powell CL, Bagyaraj DJ, editor. Vesicular-Arbuscular Mycorriza. Florida (US): CRS Press Inc. Hidayat MF. 2003. Pemanfaatan asam humat dan omega pada pemberian pupuk NPK terhadap pertumbuhan Gmelina arborea Roxb. yang diinokulasikan cendawan mikoriza arbuskula (CMA) [tesis]. Bogor (ID): Institut Pertanian Bogor. Hunt R. 1990. Basic growth analysis: Plant growth analysis for beginners. London (UK): Unwin Hyman Ltd. Ibrahim MH, Jaafar HZE, Harun MH, Yusop MR. 2010. Changes in growth and photosynthetic pattens of oil palm (Elaeis guineensis Jacq.) Seedlings exposed to short-term CO2 enrichment in a closed top chamber. Acta Physiol Plant. 32: 305-313. Imas, Hadioetomo TRS, Gunawan AW, Setiadi Y. 1989. Mikrobiologi Tanah. Ed ke-2. Bogor (ID): PAU Bioteknologi IPB. [INVAM] International culture collection of Vesikular Arbuscular Mychorizal fungi (US). 2014. The Fungi: classification, nomenclature and species descriptions [Internet]. [diunduh 2014 Maret 3]; Tersedia pada: http://invam.caf.wvu.edu Kartika E. 2006. Tanggap pertumbuhan, serapan hara dan karakter morfosiologi terhadap cekaman kekeringan pada bibit kelapa sawit yang bersimbiosis dengan CMA [tesis]. Bogor (ID): Institut Pertanian Bogor. [Kementan] Kementerian Pertanian (ID). 2015. Basis data statistik pertanian [Internet]. [diunduh 2015 Februari 26]; Tersedia pada: http://aplikasi.pertanian.go.id Kramadibrata. 1993. Jenis-jenis jamur Glomales dari DAS Cisadane. J Mikrobio Indonesia. 2(2): 24-26 Kramadibrata. 2012. Jamur arbuskula di Taman Nasional Ujung Kulon. Berita Biol. 11(2):205-209. Mansur I. 2007. Prospek dan potensi pemanfaatan simbiosis mikoriza. Di dalam: Makalah Workshop Mikoriza, Kongres Nasional Mikoriza Indonesia II; 2007 Juli 17-18. Bogor, Indonesia. Bogor (ID): Asosiasi Mikoriza Indonesia. 47 Marx D, Kenny D. 1982. Production of ectomycorrhizal fungi inoculum. In: Schenck NC, editor. Methods and Priciples of Mycorrhizal Research. Minnesota (US): The American Phytopathological Society. p 131-146. Matana YR. 2013. Pengaruh penyadapan dan posisi tandan terhadap mutu benih serta teknik konservasi kecambah terhadap pertumbuhan bibit aren (Arenga pinnata (Wurmb) Merr) [tesis]. Bogor (ID): Institut Pertanian Bogor. Mogea J, Seibert B, Smits W. 1991. Multipurpose palm: the sugar palm (Arenga pinnata (Wurmb) Merr.) Agroforestry systems. 13:111-129. Morton JB, Benny GL. 1990. Revised classification of arbuscular mychorrizal fungi (Zygomycetes). Mycotaxon. 37:471-491. Muin A. 2003. Pertumbuhan anakan ramin (Gonystylus bancanus (Miq.) Kurz) dengan inokulasi cendawan mikoriza arbuskula (CMA) pada berbagai intensitas cahaya dan dosis fosfat alam [disertasi]. Bogor (ID): Institut Pertanian Bogor. Mujahidin, Sutrisno, Dian L, Handayani T, Izu AF. 2003. Aren Budi daya dan Prospeknya. Bogor (ID): LIPI. Muok BO, Ishii T. 2006. Effect of arbuscular mycorrhizal fungi on tree growth and nutrient uptake of Sclerocarya birrea under water stress, salt stress and flooding. J Japan Soc For Hort Sci. 75(1):26-31. Nova H. 2005. Pemanfaatan tanah dari bawah tegakan jati Muna di Sulawesi Tenggara sebagai sumber inokulum CMA [tesis]. Bogor (ID): Institut Pertanian Bogor. Nusantara AD, Bertham YH, Mansur I. 2012. Bekerja dengan Fungi Mikoriza Arbuskula. Bogor (ID): IPB Press. Nusantara AD. 2007. Baku mutu inokulum fungi mikoriza arbuskula. Di dalam: Kongres Nasional Mikoriza Indonesia II; 2007 Juli 17-18. Bogor, Indonesia. Bogor (ID): Asosiasi Mikoriza Indonesia. Oehl F, Sieverding E, Ineichen K, Mader P, Boller T, Wiemken A. 2003. Impact of land use intensity on the species diversity of arbuscular mychorrhizal fungi in agroecosytems of Centeral Europe. Appl Environ Microbiol. 69(5): 2816-2824. Orwa C, Mutua A, Kindt R, Jamnadass R, Simsons A. 2009. Agroforesty database: a tree reference and selection guide version 4.0. Pahan I. 2008. Panduan Lengkap Kelapa Sawit. Jakarta (ID): Penebar Swadaya. Phillips JM, Hayman DS. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mychorizal fungi for rapid assessment of infection. Transact Brit Mycol Soc. 55:158-161. Polnaja M. 2000. Potensi aren sebagai tanaman konservasi dan ekonomi dalam pengusahaan hutan rakyat. Warta Penelitian dan Pengembangan Pertanian. 5:4 (kol 1-3). Pongsattayapipat R, Barfod A. 2009. Economic botany of sugar palms (Arenga pinnata Merr. and Arenga westerhoutii Griff., Arecaceae) in Thailand. Thai J Botany. 1(2):103-269. Porter WM. 1979. The Most Probable Number method for enumerating infective propagules of VAM fungi in soil. Aust. J Soil Res. 17: 515-519. 48 Puspitasari RT, Sukarno N, Kramadibrata K, Setiadi D. 2010. Identifikasi jamur mikoriza arbuskula asal hutan pantai Ujung Genteng, Sukabumi- Jawa Barat. Di dalam: Semangun H, Karwur FF, Martosupono M, Notosudarmo S, editor. Prosiding Cakrawala Pemikiran Teori Evolusi Dewasa ini; 2009 November 24-25; Salatiga, Indonesia. Salatiga (ID): Universitas Kristen Satya Wacana Salatiga. hlm 309-326. Querejeta JI, Allen MF, Caravaca F, Roldan A. 2006. Differential modulation of host plant delta 13C and delta 18O by native and nonnative arbuscular mycorrhizal fungi in a semiarid environment. New Phytol. 169(2):379-387. Raguphaty S, Mahadevan A. 1991. Vesicular Arbuscular Mychorrhizal (VAM) distribution influenced by salinity gradient in a coastal tropical forest. Didalam: Soerianegara, Supriyanto, editor. Proceeding of second Asian Conference on Mychorriza; 1991 Mar 11-15; Bogor, Indonesia. Bogor (ID): SEAMEO BIOTROP. hlm 91-97. Rajapakse S, Miller JC. 1992. Methods for studying vesicular-arbuscular mycorrhizal root colonization and related root physical properties. Norris JR, Read DJ, dan Varma AK, editor. Sandiego (US): Academic Pr. Rao S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Susilo H, Penerjemah. Jakarta (ID): UI Press. Terjemahan dari: Soil Microorganism and Plant Growth. Redecker, D., Schussler A, Stockinger H, Sturmer S, Morton J, dan Walker C. 2013. An evidence-based consensus for the classification of arbuscular mycorrhizal fungi (Glomeromycota). Mycorrhiza [Internet]. [diunduh 20 November 2014]; tersedia pada: doi:10.1007/s00572-013-0486-y. Rindengan B, Manaroinsong E. 2009. Aren, tanaman perkebunan penghasil bahan bakar nabati (BBM). Di dalam: Effendi DS, editor. Prospek Pengembangan Tanaman Aren (Arenga pinnata (Wurmb.) Merr.) Mendukung Kebutuhan Bioetanol di Indonesia; 2010 Januari 11; Bogor, Indonesia. Bogor (ID): Litbang Deptan. hlm 15-21. Rini MV. 2011. Populasi dan keanekaragaman Fungi Mikoriza Arbuskula pada tiga tipe penggunaan lahan yang berbeda di Sumber Jaya Lampung. Di dalam: Budi SW, Turjaman M, Mardatin NF, Nusantara AD, Trisilawati O, Sitepu IR, Wulandari AS, Riniarti M, Setyaningsih L, editor. Prosiding Seminar Naional Mikoriza II; 2007 Jul 17-21; Bogor, Indonesia. Bogor (ID): SEAMEO BIOTROP. hlm 177-181. Rofik A, Murniati E. 2008. Pengaruh perlakuan deoperlukasi benih dan media perkecambahan untuk meningkatkan viabilitas benih aren (Arenga pinnata (Wurmb) Merr). Bul. Agronomi. 36:33-40. Schussler A, Walker C. 2010. The Glomeromycota. A species list of with new families and new genera. Jerman (DE): Oregon State Univ. Setiadi Y, Hariangbanga G. 2007. Revegetation Techniques for Rehabilitating Degraded Land After Post Mining and Oil/Gas Operation. [tidak dipublikasikan] Setiadi Y. 1988. Peranan Spesifik Mikroorganisme untuk Memacu Pertumbuhan Tanaman Hutan. Bogor (ID): Laboratorium Silvikultur IPB. Setiadi Y. 1989. Pemanfaatan Mikroorganisme dalam Kehutanan. Bogor (ID): PAU Bioteknologi IPB. Setiadi Y. 1992. Mikoriza dan Pertumbuhan Tanaman. Bogor (ID): PAU IPB. 49 Setiadi Y. 1996. Mengenal Fungi Mikoriza Arbuskula dan Prospek Aplikasinya sebagai Pupuk Biologis untuk Pertumbuhan dan Kualitas Semai Tanaman Kehutanan. Bogor (ID): PAU IPB. Shaheen AM, Mouty MMA, Ali AH, Rizk FA. 2007. Natural and chemical phosporus fertilizers as affected onion plant growth, bulbs yield and its some physical and chemical properties. Austral J Basic Appl Sci. 1:519-524. Sieverding E. 1991. Vesicular Arbuscular Mycorrhiza management in tropical agrosystem. Eschborne. Deutsche Gesselschaft fur Technische Zusammenarbeit (GTZ). Smith SE, Read DJ. 1997. Mycorrhizal Symbiosis. 2nd ed. San Diego (US): Academic Press. Smith SE, Read DJ. 2008. Mycorrhizal Symbiosis. 3rd ed. San Diego (US): Academic Press. Smits WTM. 1996. Arenga pinnata (Wurmb) Merrill. Flach M dan Rumawas F, editor. Bogor (ID): Prosea Foundation. Subramanian KS, Santhanakrishnan P, Balasubramanian P. 2006. Responses of field grown tomato plants to arbuscular mycorrhizal fungal colonization under varying intensities of drought stress. Scientia Horticulturae. 107(3):245-253. Sudradjat, Darwis A, Wachjar A. 2014. Optimasi dosisi pupuk nitrogen dan fosfor pada bibit kelapa sawit (Elaeis guineensis Jacq.) di pembibitan utama. J Agron Indonesia. 42(3):222-227. Suhardi. 1997. Mikoriza Vesikular Arbuskular (MVA). Yogyakarta (ID): PAU Bioteknologi UGM. Susanti S. 2004. Pengujian inokulum cendawan mikoriza arbuskula yang berasal dari bawah tegakan jati dan non jati pada tanaman jati (Tectona grandis Linn. f.) [skripsi]. Bogor (ID): Institut Pertanian Bogor. Sylvia DM. 2004. Overview of mycorrhizal symbiosis: Based on a chapter in prinsples and application of soil microbiology [Internet]. [diunduh 9 Maret 2014]; tersedia pada: http://Cropsoil.psu.edu. Tamin RP. 2010. Pertumbuhan semai jabon (Anthocephalus cadamba Roxb Midq.) pada media pasca penambangan batubara yang diperkaya fungi mikoriza arbuskula, limbah batu bara dan pupuk NPK [tesis]. Bogor (ID): Institut Pertanian Bogor. Tisadle SL, Nelson WL, Benton JD. 1985. Soil Fertility and Fertilizers. New York (US): Macmilian Publ. Tuheteru FD, Basri A, Budiarti WS, Ibrahim S. 2007. Keanekaragaman FMA pada ekosistem hutan dan savana di Taman Nasional Rawa Aopa Watumohai, Sulawesi Tenggara Indonesia. Di dalam: Budi SW, Turjaman M, Mardatin NF, Nusantara AD, Trisilawati O, Sitepu IR, Wulandari AS, Riniarti M, Setyaningsih L, editor. Prosiding Seminar Naional Mikoriza II; 2007 Jul 17-21; Bogor, Indonesia. Bogor (ID): SEAMEO BIOTROP. hlm 210-217. Tuheteru FD. 2003. Aplikasi asam humat terhadap sporulasi CMA dari bawah tegakan alami Sengon [skripsi]. Bogor (ID): Institut Pertanian Bogor. 50 Turjaman M, Tamai Y, Santoso E, Osaki M, Tawaraya K. 2006. Arbuscular mychorizal fungi increased early growth of two nontimber forest product species Dyera polyphylla and Aquilaria filaria under greenhouse condition. Mycorrhiza. 16:459-464. Umam MD. 2004. Kajian efektivitas inokulasi mikoriza dengan penambahan tepung tulang dan batuan fosfat serta pengaruhnya terhadap pertumbuhan semai jati (Tectona grandis Linn. f.) [skripsi]. Bogor (ID): Institut Pertanian Bogor. van Aerle IM, Cavagnaro TR, Smith SE, Smith FA, Dickson S. 2005. Metabolic activity of Glomus intraradices in Arum- and Paris-type arbuscular mycorrhizal colonization. New Phytologist. 166(2):611-618. Walker C, Sanders FE. 1986. Taxonomic concepts in the endogoneceae: III. The separation of Scutellospora gen. nov. from Gigaspora Gerd dan Trappe. Mycotaxon. 27: 169-182. Widiastuti H, Guhardja RE, Soekarno N, Darusman LK, Goenadi DH, Smith S. 2002. Optimasi simbiosis cendawan mikoriza arbuskula Acaulospora tubercalata dan Gigaspora margarita pada bibit kelapa sawit di tanah masam. Menara perkebunan. 70:49-56. Widiastuti H. 2004. Biologi interaksi cendawan mikoriza arbuskula kelapa sawit pada tanah masam sebagi dasar pengembangan teknologi aplikasi dini [disertasi]. Bogor (ID): Institut Pertanian Bogor. 51 LAMPIRAN 52 Lampiran 1. Kriteria penilaian sifat kimia tanah (Hardjowigeno 2010) Sifat tanah C (%) N (%) C/N P2O5 HCl P2O5 Bray 1(ppm) P2O5 Olsen (ppm) K2O HCl KTK (Me/100g) K (me/100g) Na (me/100g) Mg (me/100g) Ca (me/100g) Kejenuhan basa (%) Kejenuhan Al (%) pH H2O Sangat Masam < 4.50 Sangat Rendah < 1.00 < 0.10 < 5.00 < 10.00 < 10.00 < 10.00 < 10.00 < 5.00 < 0.10 < 0.10 < 0.40 < 2.00 < 20.00 < 10.00 Rendah 1.00-2.00 0.10-0.20 5.00-10.00 10.00-20.00 10.00-15.00 10.00-25.00 10.00-20.00 5.00-16.00 0.10-0.20 0.10-0.30 0.40-1.00 2.00-5.00 20.00-35.00 10.00-20.00 Masam 4.50-5.50 Agak Masam 5.50-6.50 Sedang 2.01-3.00 0.21-0.50 11.00-15.00 21.00-40.00 16.00-25.00 26.00-45.00 21.00-40.00 17.00-24.00 0.30-0.50 0.40-0.70 1.10-2.00 6.00-10.00 36.00-50.00 21.00-30.00 Netral 6.60-7.50 Tinggi 3.01-5.00 0.51-0.75 16.00-25.00 41.00-60.00 26.00-35.00 46.00-60.00 41.00-60.00 25.00-40.00 0.60-1.00 0.80-1.00 2.10-8.00 11.00-20.00 51.00-70.00 31.00-60.00 Agak Alkalis 7.60-8.50 Sangat Tinggi > 5.00 > 0.75 > 25.00 > 60.00 > 35.00 > 60.00 > 60.00 > 40.00 > 1.00 > 1.00 > 8.00 > 20.00 > 70.00 > 60.00 Alkalis > 8.50 53 RIWAYAT HIDUP Penulis dilahirkan di Tegal pada tanggal 26 September 1990 sebagai anak pertama dari pasangan (Alm.) Abdul Ghoffar dan Sri Mujiharsih. Pada tanggal 11 Januari 2015 penulis menikah dengan Kiki Sri Lestari. Penulis menyelesaikan pendidikan sekolah dasar di Sekolah Dasar Negeri Slawi Wetan II Slawi-Tegal (Tahun 2002), sekolah menengah pertama di Madrasah Tsanawiyah Negeri Slawi- Tegal (Tahun 2005) dan sekolah menengah atas di Sekolah Menengah Atas 3 Slawi-Tegal (Tahun 2008). Pendidikan sarjana ditempuh di program studi Agroteknologi, Fakultas Pertanian, Universitas Jenderal Soedirman, Purwokerto, lulus pada tahun 2013. Pada tahun 2013 penulis mendapatkan kesempatan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) Calon Dosen untuk melanjutkan ke program magister di program studi Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penulis juga mengikuti kegiatan The Spring Bioresource Program yang diselenggarakan oleh College of Bioresource, Mie University, Japan pada 15 Maret – 18 April 2015 . Pada kegiatan tersebut penulis menyampaikan sebagian hasil penelitian.