II. KARAKTERISTIK ENZIM 2.1. Definisi Enzim Enzim
advertisement

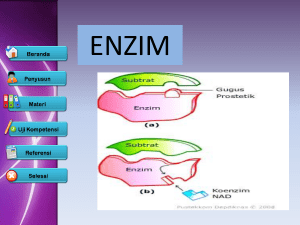
II. KARAKTERISTIK ENZIM 2.1. Definisi Enzim Enzim merupakan katalisator suatu reaksi, artinya dapat mempercepat suatu reaksi tanpa terjadinya perubahan yang permanen dalam struktur enzim itu sendiri. Kata "Enzim" berasal dari bahasa Yunani yang berarti "dalam yeast" dan pertama kali dikemukakan oleh Kuhne pada tahun 1878. Awal mulanya diketahui bahwa enzim berperan aktif dalam sel yeast untuk melakukan proses fermentasi. Enzim mempunyai sejumlah sifat yang spesifik dibandingkan dengan katalisator yang lain. Molekul ini dapat meningkatkan kecepatan reaksi kimia secara nyata dan sangat spesifik. Reaksi akan berjalan sangat lambat bila tidak terdapat enzim. Enzim tidak dapat mengubah titik keseimbangan reaksi yang dikatalisisnya, juga tidak akan habis setelah reaksi atau tidak dapat diubah oleh reaksi-reaksi tersebut. Enzim dapat meningkatkan kecepatan reaksi sebesar 10 14 kali pada keadaan tertentu. Kecepatan reaksi enzim sangat dipengaruhi oleh beberapa faktor diantaranya suhu, pH, substrat, konsentrasi enzim dan lain sebagainya. Bentuk atau struktur enzim adalah globuler (mudah larut dalam air). Enzim terdiri dari 20 macam asam amino, yang dapat dibedakan menjadi empat berdasarkan gugus R-nya. R hidrofobik Asam amino dalam globula : hidrofobik Asam amino dalam perifer : bermuatan Contoh : 1. Valin : R non polar 2. Prolin : R non polar Universitas Gadjah Mada R polar netral (tidak bermuatan) Contoh : Glisin R polar (-) Contoh : glutamat R polar (+) Contoh : lisin 2.2. Kinetika Enzim Suatu reaksi katalisis enzim akan mengalami penjenuhan kinetik terhadap konsentrasi substratnya (S). Bila dipergunakan konsentrasi total enzim (Eo), kecepatan mula-mula sebesar (Vo), maka produk yang dihasilkan akan Universitas Gadjah Mada mengikuti bentuk hiperbola terhadap substrat (S), seperti terlihat pada Gambar 2.1. Pada konsentrasi substrat yang cukup rendah, maka kecepatan reaksi (V), secara langsung dipengaruhi oleh konsentrasi substrat yang dipergunakan. Bila konsentrasi substrat dinaikkan, mengakibatkan terjadi penjenuhan, sehingga kecepatan reaksi akan berubah. Pada kecepatan reaksi yang maksimum (Vmak), besarnya sebanding dengan konsentrasi enzim (Eo). Hubungan ini dinyatakan dalam persamaan Michaelis-Menten sebagai berikut: Vo = ( Eo ) (S)kcat / (Km + (S) kcat (Eo ) = Vm aks Vo = Vmak s (S) (S) + Km Km : tetapan Michaelis, yaitu merupakan konsentrasi substrat pada saat Vo =½ Vmaks (s) Gambar 2.1. Ketergantungan kecepatan reaksi pada konsentrasi substrat pada saat Vo = ½ Vmaks Reaksi katalisis enzim terhadap substrat dapat digambarkan sebagai berikut: E + S ES ES E + P Universitas Gadjah Mada Km dan Vmaks sulit ditentukan dengan grafrk 2.1., untuk itu dibuat persamaan garis lurus menurut metode "Lineweaver-Burk" yang ditunjukkan pada persamaan berikut ini (Gambar 2.2.). ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) Gambar 2.2. Persamaan garis lurus menurut metode Lineweaver-Burk. 2.3. Spesifisitas Enzim Enzim mempunyai aktivitas katalitik dikarenakan sisi aktif enzim terdiri dari 2 gugus, yaitu gugus pengikatan (berupa gugus R-nya) dan gugus katalitik. Emil Fisher (1894) mengemukakan bahwa enzim dapat memetabolisme karbohidrat yang ditunjukkan dengan spesifisitas enzim untuk substratnya, yaitu Universitas Gadjah Mada suatu molekul yang dapat berperan pada enzim. Dasar tersebut menghasilkan suatu teori "gembok" dan "kunci" (lock&key), substrat harus sesuai dengan enzimnya yang digambarkan seperti gambar 2.3. Contoh: Urease urea Aspartase aspartat Gambar 2.3.Hipotesis Fisher tentang teori "Gembok" dan "Kunci" yang dapat memberi penjelasan tentang spesifisitas enzim (substrat harus sesuai dengan enzimnya : mutlak). Pada tahun 1958, Koshland mengemukakan suatu teori "induced fit" yang menunjukkan daya katalitik dan spesifisitas enzim. Pada kondisi tertentu sisi aktif enzim dapat menyesuaikan dengan bentuk substratnya (relatif). Dikemukakan pula aktivitas katalitik suatu enzim dapat menyebabkan perubahan kondisi frsiologik. Penerapan teknik DNA rekombinan untuk mempelajari enzim yang dihasilkan telah berhasil mengubah posisi sisi aktif dan spesifisitas enzim. Pengubahan tersebut dilakukan dengan prinsip mutasi dengan cara mutagenesis sisi langsung. Sebagai contoh spesifisitas enzim laktat dehidrogenase telah berubah menjadi malat dehidrogenase oleh tiga sisi aktifnya. Sebagian besar enzim mempunyai sifat spesifisitas yang tinggi baik terhadap substrat yang digunakan maupun reaksi yang dikatalisisnya. Dalam hal gugus spesifik dan spesifrsitas absolut suatu enzim hanya terjadi pada molekul substrat yang kecil. Bila molekul substrat besar posisi sisi aktif enzim terhadap molekul substrat akan berbeda karena yang menempel pada substrat hanya sebagian saja. Universitas Gadjah Mada Ciri lain dari sifat reaksi enzim adalah sifat stereospesifisitasnya, yang telah terbukti pada aktivitas enzim dehidrogenase yang memerlukan NAD + DAN NADP+. Enzim dehidrogenase mengkatalisis reaksi pemindahan hidrogen dari substrat ke dalam bagian cincin nikotinamid. Dasar spesifrsitas ini juga terjadi pada jenis dehidrogenase lain seperti alkohol dehidrogenase, laktat dehidrogenase dan gliseraldehid-3-P- dehidrogenase dalam hati. 2.4. Kofaktor Pada beberapa jenis enzim, untuk aktivasinya diperlukan tambahan komponen kimia. Komponen tersebut sering disebut sebagai kofaktor. Kofaktor dapat berupa satu molekul anorganik seperti ion Fe 2+, Mn2+ atau dapat molekul organik kompleks yang disebut koenzim. Beberapa enzim memerlukan baik kofaktor maupun koenzim untuk aktivasinya. Kofaktor yang berupa ion logam pada beberapa jenis enzim hanya terikat secara lemah, dan ada yang terikat secara kuat atau permanen sehingga dapat disebut sebagai gugus prostetik. Enzim yang mempunyai kofaktor dari logam dapat di inaktivasi dengan penambahan senyawa pengikat logam seperti EDTA. Sifat kofaktor yang terikat pada enzim secara kuat sulit dipisahkan dari bagian enzim walaupun telah dilakukan dialisis, kofaktor tersebut juga dapat dikatakan sebagai gugus prostetik. Suatu enzim yang mempunyai suatu kofaktor atau gugus prostetik yang terikat disebut suatu holoenzim, dan bila kofaktornya dihilangkan disebut apoenzim. Contoh apoenzim antara lain ribonuklease, khemotripsin, dan tripsin. Suatu molekul kecil atau jenis lain yang secara reversibel mengikat enzim dinamakan suatu ligand, dapat termasuk substrat, penghambat, ion logam dan lain sebagainya. 2.5. Nomenklatur dan Klasifikasi Enzim Secara umum pemberian nama trivial atau perdagangan adalah dengan menambahkan akhiran "ase" pada substrat yang diserang. Sebagai contoh urease menyerang substrat urea, arginase untuk substrat arginin. Namun ada juga yang berdasarkan reaksi yang dikatalisisnya, seperti laktat dehidrogenase mengkatalisis Universitas Gadjah Mada reaksi dehidrogenasi laktat sehingga dihasilkan piruvat. Ada enzim yang diberi nama dengan tidak menerangkan substratnya maupun reaksi katalisisnya, seperti enzim pepsin, tripsin, papain, katalase dan lain sebagainya. Komisi Enzim yang telah dibentuk oleh suatu perkumpulan Biokimia dunia (International Union of Biochemistry/IUB), yang telah direkomendasi oleh perkumpulan biokimia sedunia (International Union of Pure and Applied Chemistry) pada tahun 1955 membuat suatu persetujuan untuk memberi nama enzim. Sistem pemberian nama menempatkan semua enzim ke dalam enam kelas utama berdasarkan atas jenis reaksi yang dikatalisis, yaitu: 1. Oksidoreduktase, enzim yang mengkatalisis reaksi oksidasi-reduksi. 2. Transferase, enzim yang mengkatalisis suatu reaksi yang mentransfer gugus 3. Hidrolase, enzim yang mengkatalisis reaksi hidrolitik 4. Liase, enzim yang mengkatalisis reaksi eliminasi yang dapat membentuk suatu ikatan rangkap 3. Isomerase, enzim yang mengkatalisis reaksi isomerasi 4. Ligase/Sintetase, enzim yang mengkatalisis reaksi yang dapat menggabungkan dua molekul dengan bantuan energi (ATP) 2.6. Inhibitor dan Aktivasi Enzim Inhibitor. Inhibitor dapat menurunkan reaksi enzim. Sifat inhibitor dibedakan menjadi 2, yaitu: 1.2.irreversible : E + I El 2.2.reversible : E + I EI competitive non competitive uncompetitive Competitive Suatu senyawa inhibitor yang menyerupai substrat dan menghalangi masuknya substrat tersebut ke sisi aktif enzim. Senyawa tersebut dapat terikat Universitas Gadjah Mada pada sisi aktif enzim, sehingga substrat yang seharusnya terikat menjadi terhalang oleh senyawa tersebut. Contoh inhibitor asam melanoat dengan suksinat dehidrogenase. E + I ES E+P ki ↕ + I EI [ ( ) ( ) ] Noncompetitive Senyawa inhibitor tidak menyerupai substrat. Substrat tetap terikat di bagian sisi aktif enzim yang normal tetapi inhibitor membentuk lekukan pada bidang permukaan lain dari enzim. E + S <-> ES <---> E + P ki|+I ki| +I EI + S<->ESI Universitas Gadjah Mada [ ( ) ] [ ( ) ] Uncompetitive ES + 1 (ES) k ↕ +I tidak terbentuk produk _________ 1+ 1 + __ Km [ ( ) ( ) ] Aktivasi Enzim. Energi aktivasi suatu reaksi adalah jumlah energi dalam kalori yang diperlukan untuk membawa semua molekul pada satu mol senyawa pada suhu tertentu menuju ke tingkat transisi pada puncak Batas energi. Enzim dapat meningkatkan reaksi dengan cara menurunkan energi aktivasi dan dengan tidak merubah energi bebas (AG). Kecepatan reaksi dari substrat ke produk tergantung dari jumlah molekul substrat yang mencapai transisi per satuan waktu (Gambar 2.4). Universitas Gadjah Mada Gambar 2.4. Perubahan energi aktivasi enzim dalam membentuk produk Faktor-faktor yang mempengaruhi aktivitas enzim antara lain suhu, pH, kadar enzim, konsentrasi substrat, dan adanya kofaktor (Gambar 2.5.). Berdasarkaan gambar tersebut dapat dilihat pengaruh suhu, pH, konsentrasi enzim dan konsentrasi substrat terhadap aktivitas enzim. Bila suhu Universitas Gadjah Mada meningkat maka reaksi akan lebih cepat pula karena gerakan molekul zat semakin cepat. Enzim bekerja paling aktif dan paling stabil pada suhu optimum. Misalnya renin dari abomasum, paling aktif pada suhu optimum 42°C. Tetapi bila suhu terlalu tinggi melebihi suhu optimum enzim maka kecepatan reaksi justru akan menurun bahkan bisa menjadi in aktif. pH yang baik untuk proses enzimatis adalah pH netral. Kadar enzim, semuanya adalah konstan. Semakin tinggi konsentrasi enzim maka kecepatan reaksi akan meningkat. Begitu pula konsentrasi substrat, semakin tinggi konsentrasi substrat maka kecepatan reaksi akan meningkat sampai terjadi penjenuhan. Universitas Gadjah Mada