biokimia umum lipida
advertisement

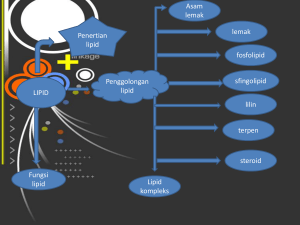
BIOKIMIA UMUM : LIPIDA DEFENISI: SENYAWA ORGANIK BERLEMAK/BERMINYAK YANG TIDAK LARUT DALAM AIR TETAPI DAPAT LARUT DAN DAPAT DIEKSTRAK DARI SEL DAN JARINGAN DENGAN PELARUT NONPOLAR SPT: BENZEN, ETHER, KHLOROFORM FUNGSI: 1. SUMBER ENERGI/ CADANGAN ENERGI. 2. PELARUT VIT. LARUT LEMAK. 3. SUMBER ASAM LEMAK ESENSIAL 4. KOMPONEN UTAMA MEMBRAN SEL (TEMPAT TERJADI REAKSI METABOLIK). 5. BAHAN INSULASI DIBAWAH KULIT DAN PENYAMPAI ISYARAT. 6. BAHAN PELINDUNG BAGI HEWAN VERTEBRATA DAN TANAMAN (DAUN/BUAH). 7. PENGOLAHAN PANGAN MEMBERI FLAVOUR PANGAN (AROMA, RASA, TEKSTUR) KLASIFIKASI LIPID 1. LIPID SEDERHANA ESTER ASAM LEMAK DENGAN BERMACAM-MACAM ALKOHOL. A. LEMAK ESTER ASAM LEMAK DENGAN GLISEROL. BENTUK CAIR MINYAK, BENTUK PADAT LEMAK B. LILIN ESTER ASAM LEMAK DENGAN ALKOHOL TINGGI (ALKOHOL DG RANTAI ATOM C YG PANJANG) 2. LIPID MAJEMUK ESTER ASAM LEMAK DG ALKOHOL YG MENGANDUNG SENYAWA LAIN (KARBOHIDRAT, ASAM AMINO, PROTEIN, FOSFAT, BASA NITROGEN DLL.) FOSFOLIPID FOSFAT SEREBROSID KH, NITROGEN LIPOPROTEIN PROTEIN AMINOLIPID AS. AMINO 3. LIPID TURUNAN SENYAWA TURUNAN DARI LIPID SEDERHANA DAN LIPID MAJEMUK YG DAPAT DIPEROLEH DG PROSES HIDROLISIS A.LEMAK, GLISEROL, ALKOHOL, ALDEHID, KETON, STEROID, TERPEN, VIT LARUT LEMAK,DLL ASAM LEMAK 1. ASAM ORGANIK BERANTAI PANJANG (# ATOM C 4 – 24) YANG MEMILIKI GUGUS KARBOKSIL TUNGGAL DAN EKOR HIDROKARBON NON POLAR YANG PANJANG. CH3 – CH2 – CH2- CH2 – (CH2)n - COOH 2. TERIKAT PADA BERBAGAI KELAS LIPID 3. DITEMUKAN DALAM 2 BENTUK: a. ASAM LEMAK JENUH (SATURATED FATTY ACID/ SFA) CH3 – CH2 – CH2 – CH2 - ……….. COOH b. ASAM LEMAK TIDAK JENUH (UNSATURATED FATTY ACID/ UFA) CH3 – CH2 – CH = CH – CH2 – CH = CH – CH2 - ……..COOH STRUKTUR DAN MODEL RUANG ASAM LEMAK JENUH DAN ASAM LEMAK TIDAK JENUH CONTOH BEBERAPA ASAM LEMAK JENUH NAMA UMUM SIMBOL AS.ASETAT 2: 0 AS.BUTIRAT 4:0 AS.KAPROAT 6:0 STRUKTUR T. LEBUR (oC) CH3-COOH -16,6 CH3-(CH2)2- COOH -7,6 CH3-(CH2)4- COOH -1,5 AS.KAPRILAT 8:0 CH3-(CH2)6 –COOH AS.KAPRAT 10:0 CH3-(CH2)8- COOH 31,5 AS.LAURAT 12:0 CH3-(CH2)10-COOH 44 AS.MIRISTAT 14:0 CH3-(CH2)12-COOH 54 AS.PALMITAT * 16:0 CH3-(CH2)14-COOH 63 AS.STEARAT * 18:0 CH3-(CH2)16-COOH 70 AS.ARACHIDAT 20:0 CH3-(CH2)18-COOH 76,5 CH3-(CH2)20-COOH 80 AS.BEHENAT AS.LIGNOSERAT 22:0 24:0 CH3- (CH2)22-COOH 86 * ASAM LEMAK YG PALING BANYAK DITEMUKAN DIALAM. ASAM LEMAK TIDAK JENUH (UFA) A. PALMITOLEAT 16: 1 9 -0,5 CH3- (CH2)5 – CH = CH – (CH2)7- COOH A. OLEAT 18: 1 9 13 CH3-(CH2)7 –CH = CH- (CH2)7- COOH A. LINOLEAT 18:2 9,12 -5 CH3-(CH2)4 –CH = CH- CH2-CH = CH-(CH2)7- COOH A. LINOLENAT 18:3 9,12,15 -11 CH3-CH2–CH = CH-CH2-CH = CH-CH2-CH = CH-(CH2)7- COOH A. ARACHIDONAT 20:4 5,8,11,14 -50 CH3-(CH2)4–CH = CH-CH2-CH = CH-CH2-CH =CH-CH2-CH =CH-(CH2)3- COOH BEBERAPA SIFAT ASAM LEMAK 1. HAMPIR SEMUA ASM LEMAK MEMPUNYAI JUMLAH ATOM C GENAP ( # C 16 DAN C 18) 2. DI ALAM DITEMUKAN JMLH ASAM LEMAK TIDAK JENUH >> AS. LEMAK JENUH 3. AS. LEMAK TIDAK JENUH PADA SUHU KAMAR CAIR AS. LEMAK JENUH (C12-24) PADA SUHU KAMAR PADAT SEDANGKAN (C2-C1O) CAIR 4. AS. LEMAK TIDAK JENUH BANYAK DITEMUKAN PD TUMBUHAN AS. LEMAK JENUH BANYAK DITEMUKAN PADA HEWAN 5. IKATAN GANDA TIDAK PERNAH TERKONYUGASI TETAPI SELALU DIPISAHKAN OLEH GUGUS METIL DAN BERADA PADA KONFIGURASI CIS 6. AS LEMAK UMUMNYA TIDAK LARUT DALAM AIR TETAPI DAPAT TERDISPERSI MEMBENTUK MISEL DALAM NaoH/KOH ENCER MEMBENTUK SABUN 7. IKATAN GANDA MUDAH MENGALAMI REAKSI OKSIDASI DENGAN ADANYA OKSIGEN MEMBENTUK SENYAWA RADIKAL BEBAS. REAKSI PENTING ASAM LEMAK 1. REAKSI HIDROGENASI/HALOGENASI H2 CH3-(CH2)7-CH = CH-(CH2)7-COOH ----- CH3-(CH2)16-COOH Ni/Pt 2. REAKSI OKSIDASI/AUTOOKSIDASI - CH –CH = CH –CH –CH - + O2 ---- - CH – CH - CH - CH- CH - 00* 00* PEROKSIDA RADIKAL O2 ALDEHID, KETON,ASAM LEMAK RANTAI PENDEK (OKSIDATIF RANCYDITY - CH - CH - CH - CH – CH – 00H* 00H* HIDROPEROKSIDA RADIKAL LEMAK (TRIGLISERIDA) ESTER 3 MOLEKUL ASAM LEMAK DENGAN GLISEROL H2-C-OH A. STEARAT H - C-OH A. OLEAT H2-C-OH GLISEROL + A. PALMITAT 1-STEAROIL 2-OLEIL PALMITOIL GLISEROL 3 MOLEKUL ASAM LEMAK O H2- C-O-C–(CH2)16-CH3 o H - C-O-c-(CH2)7-CH=CH- (CH2)7-CH3 o H2-C-O- c – (CH2)14 –CH3 + 3 H2O O H2-C-OH OH - C–(CH2)16-CH3 (AS. STEARAT) o H - C-OH + OH- c-(CH2)7-CH=CH- (CH2)7-CH3 (0LEAT) o OH- c – (CH2)14 –CH3 (AS. PALMITAT) H2-C-OH O H2- C-O-C–(CH2)16-CH3 o H - C-O-c-(CH2)7-CH=CH- (CH2)7-CH3 o H2-C-O- c – (CH2)14 –CH3 + 3 H2O STRUKTUR DAN DIMENSI RUANG TRIGLISERIDA REAKSI KIMIA TRIGLISERIDA 1. REAKSI HIDROLISIS OLEH BASA (NaOH/KOH) (REAKSI PENYABUNAN) C–O–C C–O-C C–O–C O CH2OH R1 O R2 O R3 NaOH -- CHOH + 3 RCOONa CH2OH GLISEROL 2. REAKSI HIDROLISIS OLEH AIR O C–O–C CH2OH R1 O H2O ------ C -O–C R2 CHOH O C–O–C R3 + 3 RCOOH (ASAM LEMAK BEBAS) CH2OH GLISEROL HIDROLITIC RANCIDITY (OFF FLAVOUR) LILIN (ESTER ASAM LEMAK RANTAI PANJANG DENGAN ALKOHOL TINGGI) O C MIRISIL ISOBEHENAT C21H43 COO C14H29 O CH2 CH2 CH2 CH2 MIRISIL LIGNOSERAT C23H47 COO • • CH3 (23) • • CH3 (30) • • SANGAT NON POLAR LEMAK PADAT VERTEBRATA UNGGAS DAUN DAN BUAH PLANKTON C30H61 “TRIACONTANOILPALMITAT” LILIN PADA LEBAH MADU (BEE) LIPID MAJEMUK: ESTER ASAM LEMAK DENGAN ALKOHOL/GLISEROL DAN SENYAWA LAIN 1. FOSFOLIPID : - ESTER ASAM LEMAK DENGAN GLISEROL, FOSFAT, - ALKOHOL STRUKTUR HAMPIR SAMA DENGAN TAG (tri asil gliserol) O C–O–C O l R1 (asam lemak jenuh) C–O–C O R2 l ll (as. Lemak tidak C – O – P – O – (X) (alkohol) jenuh) l OH STRUKTUR PHOSPHOLIPID TERDAPAT PADA JARINGAN OTAK DAN JARINGAN TANAMAN PENAMAAN TERGANTUNG KEPADA JENIS ALKOHOLNYA (X) SEPALIN LESITIN SIFAT-SIFAT FOSFOLIPID LIPID MEMBRAN LIPID POLAR AMPHIPATIC (HIDROFOBIK & HIDROFILIK) MISEL → TIDAK LARUT MUDAH TEROKSIDASI → PUTIH → COKLAT (GELAP) HIDROLISA → BASA DAN ENZIM (FOSFOLIPASE) FLA1 R1 FLA2 R2 FLC PHOSPHAT FLD ALKOHOL HIDROLISIS SEMPURNA PHOSPHLPID OLEH ENZIM PHOSPHOLIPASE 2. GLIKOLIPID (SEREBROSID) - GALAKTOSA ASAM LEMAK BM TINGGI SPINGOSIN (ALKOHOL) OH CH3 – (CH2)12 – CH = CH – CH – CH – NH - SPINGOSIN DIBEDAKAN BERDASARKAN ASAM LEMAK 1 KERASIN → ASAM LIGNOSERAT CH3 – (CH2)22 – COOH 2. SEREBRON → A. SEREBRONAT CH3 – (CH2)21 – CHOH – COOH 3. NERVON → ASAM NERVONAT CH3 – (CH2)7 – CH = CH – (CH2)13 – COOH 4. OKSINERVON → ASAM OKSINERVONAT CH3 – (CH2)7 - CH = CH – (CH2)13 – CHOH – COOH 3. LIPOPROTEIN * LIPID POLAR * MENGANDUNG PROTEIN , FOSFOLIPID, TAG, KOLESTEROL * FUNGSI UTAMA ADALAH TRANSPORTASI LIPID DALAM DARAH DARI USUS HALUS → DEPOT LEMAK → JARINGAN KOMPOSISI KIMIA LIPOPROTEIN PLASMA DARAH JENIS KILOMIKRON VLDL LDL HDL DENSITAS PROTEIN 0,92 – 0,96 1,7 0,95 – 1,00 10 1,00 – 1,06 25 1,06 – 1,21 50 VLDL (VERY LOW DENSITY LIPOPROTEIN) LDL (LOW DENSITY LIPOPROTEIN) HDL (HIGH DENSITY LIPOPROTEIN) TAG 96 60 10 3 FL 0,8 18 22 20 KOL 1,7 15 45 18 3. LIPID TURUNAN : STEROID DAN TERPEN 3.1. STEROID (LIPID TAK TERSABUNKAN) -SERING DITEMUKAN BERSAMA-SAMA DENGAN LEMAK SETELAH PROSES PENYABUNAN MEMPUNYAI INTI SIKLO FENANTREN DAN SIKLOPENTAN - KHOLESTEROL ERGOSTEROL KAPROSTEROL ASAM EMPEDU ALKALOID RACUN HORMON (cortisol, aldosteron, testosteron, progesteron) VITAMIN D GLIKOSID JANTUNG SITOSTEROL TANAMAN STRUKTUR KHOLESTEROL BEBERAPA STEROID: 1. TESTOSTERONE (MALE HORMON SEX) 2. ESTRADIOL (FEMALE HORMON SEX) 3. CORTISOL AND ALDOSTERON (REGULATE GLUKOSA METABOLISM) 4. PREDNISOLONE AND PREDNISON (SYNTHETIC STEROIDS ANTIINFLAMANTO RY AGENTS) 3.2 TERPEN (LIPID TAK TERSABUNKAN) BANYAK PADA TANAMAN MEMBERI SIFAT KHAS PADA BAU DAN RASA MINYAK TANAMAN (MINYAK ESSENSIAL) DIBANGUN OLEH 5 ATOM C ISOPREN H2C = C – CH = CH2 CH3 DAPAT BERUPA RANTAI LURUS BERUPA CINCIN (SIKLIS), ATAU KOMBINASI KEDUANYA CONTOH : GERANIOL,MENTHOL, LIMONA, VITAMIN A, BETAKAROTEN,VIT E, VIT K, KARET ALAM, KAMFER, DLL CH3 – C = CH – CH2 – CH2 – C = CH – CH2OH CH3 CH3 VITAMIN A CH2 CH2 C – CH3 HC CH2 HC CH2 2HC CH2 CH CH2 C C – CH3 HC CH2 CH3 CH20H GERANIOL (Jahe) LIMONEN (Jeruk) BEBERAPA KESIMPULAN TENTANG LEMAK LIPID MERUPAKAN SENYAWA BERMINYAK/BERLEMAK YANG TIDAK LARUT DALAM AIR TETAPI LARUT DALAM PELARUT NONPOLAR FUNGSI: LIPID SIMPANAN, LIPID MEMBRAN, VIT LARUT LEMAK, ASAM LEMAK ESENSIAL, INSULASI ASAM LEMAK MEMPUNYAI ATOM C GENAP 2 – 24 (# 16 DAN 18) JENIS ASAM LEMAK ADA 2 (SFA DAN UFA) USF MEMPUNYAI TITIK LEBUR RENDAH PEMBENGKOKAN PADA STRUKTUR (KONFIGURASI CIS) SFA PADA SUHU KAMAR BERBENTUK PADAT DAN BANYAK TERDAPAT PADA HEWAN UFA PADA SUHU KAMAR BERBENTUK CAIR DAN UMUMNYA BANYAK TERDAPAT PADA LEMAK TANAMAN. TAG UMUMNYA SEBAGAI LEMAK SIMPANAN LIPID MAJEMUK (LIPID POLAR ) LIPID MEMBRAN, LIPID TRANSPORTASI REAKSI PENTING ASAM LEMAK,, OKSIDASI, HIDROGENASI DAN HIDROLISA STEROID DAN TERPEN MERUPAKAN LIPID YANG TAK TERSABUNKAN ASAM AMINO, PEPTIDA DAN PROTEIN PROTEIN * MAKROMOLEKUL YANG PALING BANYAK DITEMUKAN DALAM SEL (50% BERAT KERING BADAN ORANG DEWASA ADALAH PROTEIN) * SUSUNAN SEJUMLAH ASAMA AMINO DALAM URUTAN YANG KHAS MELALUI IKATAN PEPTIDA DENGAN FUNGSI YANG KHAS PULA SEHINGGA PROTEIN JUGA DISEBUT SEBAGAI POLIPEPTIDA. • SANGAT BERVARIASI DIMANA RATUSAN JENIS PROTEIN YANG BERBEDA DAPAT DITEMUKAN DALAM SATU SEL DENGAN FUNGSI YANG BERBEDA PULA. Jumlah residu as amino Insulin Haemoglobin Lisosim Ribonuklease 51 574 129 124 jumlah rantai 2 4 1 1 • • • MEMPUNYAI BERBAGAI PERANAN BIOLOGIS. PROTEIN DIOKSIDASI DAN DISINTESA SETIAP HARI SECARA TERUS MENERUS PADA ORANG DEWASA (DIPERBAHARUI) TURN OVER PROTEIN 400 GR/HR 75-80% DIPAKAI KEMBALI UNTUK SINTESA PROTEIN. • PROTEIN HARUS DIKOMSUMSI SETIAP HARI UNTUK MENUTUPI KEHILANGAN SEWAKTU TURN OVER. • NEGATIF NITROGEN BALANCE PERTUMBUHAN ABNORMAL • OVER DISIMPAN DALAM BENTUK LEMAK (PEMBOROSAN) NILAI GIZI PROTEIN: -JUMLAH KOMSUMSI -DAYA SERAP TUBUH -KOMPOSISI ASAM AMINO (ESENSIAL DAN NON ESENSIAL) KEBUTUHAN PROTEIN DIPENGARUHI OLEH BBRP SITUASI SEPERTI: - MASA PERTUMBUHAN - AKTIFITAS - HAMIL DAN MENYUSUI, - SAKIT,DLL FUNGSI BIOLOGI PROTEIN FUNGSI BIOLOGI: 1. SEBAGAI ENZIM * PROTEIN KHUSUS YG MEMPUNYAI AKTIVITAS KATALISIS (BIOKATALISATOR) * LEBIH DARI 2000 JENIS ENZIM SUDAH DIKETAHUI DG FUNGSI YG KHAS. EX : UREASE → UREA → AMONIAK + CO2 2. PROTEIN SIMPANAN →PADA TANAMAN / TUMBUHAN EX : PROTEIN : JAGUNG, GANDUM, BERAS, KACANG2AN, Pada hewani OVALBUMIN, KASEIN 3. PROTEIN TRANSPORT → MEMBAWA MOLEKUL / ION SPESIFIK MELALUI DARAH DARI SATU ORGAN KE ORGAN LAIN. EX : LIPOPROTEIN HAEMAGLOBIN 4. PROTEIN KONTRAKTIL → PROTEIN YANG MEMBERIKAN KEMAMPUAN KEPADA SEL DAN ORGANISME UNTUK BERKONTRAKSI, MENGUBAH BENTUK / BERGERAK EX : AKTIN DAN MIOSIN KONTRAKSI OTOT/ KERANGKA TUBULIN PROTEIN PEMBENTUK MIKROTUBUL 5. PROTEIN PERTAHANAN → PROTEIN YANG BERFUNGSI UNTUK MEMPERTAHANKAN ORGANISME DARI SERANGAN SPECIES LAIN ATAU LUKA EX : FIBRINOGEN DAN TROMBIN, ANTIBODY, BISA ULAR 6. PROTEIN STRUKTURAL → MEMBANGUN STRUKTUR BIOLOGI, KEKUATAN , DAN PROTEKSI EX :PROTEIN SERABUT KOLAGEN TULANG RAWAN/URAT, KULIT ELASTIN PADA PERSENDIAN DAPAT MEREGANG KEDUA DIMENSI KERATIN PROTEIN STRUKTURAL PADA RAMBUT, KUKU, BULU BURUNG FIBROIN SUTRA, JARING LABA-LABA 7. PROTEIN PENGATUR MENGATUR AKTIVITAS SELULER ATAU FISIOLOGI EX :HORMON INSULIN METABOLISME GULA HORMON PARATIROID MENGATUR TRANSPORTASI Ca++, P. SIFAT ASAM AMINO 1. MEMPUNYAI STRUTUR UMUM (Amina) COOH l NH2 – C – H l R (karboksil) (hidrogen) (Gugus samping) R DIBEDAKAN : - STRUKTUR KELARUTAN MUATAN LISTRIK UKURAN 2. MEMPUNYAI ATOM C ASIMETRIK KECUALI – GLISIN – COOH NH2 – C – H CH3 L – ALA COOH H – C – NH2 CH3 D – ALA ISOMER OPTIK ( STEREO ISOMER ) UMUMNYA ASAM AMINO YG ADA DI ALAM BENTUK L RASEMASI 3. ASAM AMINO LARUT DALAM AIR TETAPI TIDAK LARUT DALAM PELARUT NON POLAR 4. DALAM LARUTAN DAPAT TERIONISASI SEBAGAI ASAM ( DONOR PROTON ) SEBAGAI BASA ( AKSEPTOR PROTON) H R – C – COO NH3+ H R – C – COO - + H + NH3+ SENYAWA AMPOTER H R – C – COO - + H+ NH2 H R – C – COOH NH3+ SIFAT INI DAPAT BERFUNGSI UNTUK : - MENENTUKAN ASAM AMINO PENYUSUN PROTEIN - MEMISAH ASAM AMINO PENYUSUN PROTEIN PENGGOLONGAN ASAM AMINO BERDASARKAN POLARITAS GUGUS R PADA PH 7 1. ASAM AMINO DENGAN GUGUS R NON POLAR Ala, Val, Leu, Ile, Pro, Met, Phe, Trp. 2. ASAM AMINO DENGAN GUGUS R POLAR TIDAK BERMUATAN Gly, Ser,Thr, Cys, Tyr, Asn, Gln. 3. ASAM AMINO DENGAN GUGUS R BERMUATAN NEGATIF (-) Asp dan Glu 4. ASAM AMINO DENGAN R BERMUATAN (+) Lys, Arg, His 1. ASAM AMINO DG R NON POLAR ( Ala, Val, Leu, Ile, Pro, Met, Phe, Trp ) 2. ASAM AMINO DENGAN GUGUS R POLAR TIDAK BERMUATAN (Gly, Ser,Thr, Cys, Tyr, Asn, Gln) 3. ASAM AMINO DENGAN GUGUS R BERMUATAN NEGATIF (-) (Asp dan Glu ) 4. Asam amino dengan R bermuatan (+) (Lys, Arg, His) SIFAT ASAM BASA (MENGION) ASAM AMINO Pk 2 pI pK 1 BEBERAPA INFORMASI: 1. AS. AMINO ALANIN MEMPUNYAI 2 KUTUB YG DAPAT MENGION: 1. GUGUS KARBOKSIL PADA pH 2,34. 2. GUGUS AMINA PADA Ph 9,69. 2. ASAM AMINO MEMPUNYAI 2 DAERAH BERDAYA BUFFER YANG BAIK YAITU PADA DAERAH YANG RELATIF DATAR PADA GRAFIK (Ph 2 – 3 dan Ph 9 – 10) DAN MEMPUNYAI DAYA BUFFER TERBURUK PADA Ph 6,02 (PI) 3. PADA pH 6,02 MUATAN AS. AMINO = 0 (ZWITTER ION/ MENGION SEMPURNA). PADA SAAT INI A. AMINO AKAN MENGENDAP. pH INI DISEBUT pH ISOELEKTRIK (PI). PI = (Pk1 + Pk2)/2 pH DIBAWAH PI -- MUATAN A.AMINO + (POSITIF) pH DIATAS PI -- MUATAN A.AMINO - (NEGATIF) pH = PI ------- MUATAN A. AMINO (0) (NETRAL) 4. AS. AMINO YG BERBEDA DAPAT DIPISAHKAN DARI YG LAIN ATAS KECEPATAN MIGRASI MASING2 AS. AMINO JIKA MOLEKUL INI DITEMPATKAN PD SUATU MEDAN LISTRIK PD PH TERTENTU. HARGA PK BAGI GUGUS MENGION ASAM AMINO A.AMINO GLISIN ALANIN LEUSIN SERIN THREONIN GLUTAMIN ASPARTAT GLUTAMAT HISTIDIN SISTEIN TIROSIN LISIN ARGININ pK1 (COOH) 2,34 2,34 2,36 2,21 2,33 2,17 2,09 2,19 1,82 1,71 2,2 2,18 2,17 METODA PEMISAHAN ASAM AMINO pK2 ( NH3+) 9,6 9,69 9,6 9,15 10,43 9,13 9,82 9,67 9,17 10,78 9,11 8,95 9,04 pK 3 (R) 13,6 (OH) 3,86 (COOH) 4,25 (COOH) 6,0 (NH+) 8,33 (SH) 10.07 (OH) 10,53 (NH3+) 12,48 (NH3+) 1. ELEKTROFORESIS KERTAS 2. KHROMATOGRAFI PENUKAR ION 3. AMINO ACID ANALYZER BEBERAPA REAKSI SPESIFIK ASAM AMINO 1. REAKSI PEMBENTUKAN IKATAN PEPTIDA R1 O H + H 2N – C - C H N – C – OH R1 H 2N - C H H O - H R2 H20 COOH ------- H2O H C - N - C - COOH H R2 dipeptida, tripeptida, tetrapeptida, pentapeptida, oligopeptida, polipeptida. Contoh: pentapeptida 2. REAKSI WARNA DENGAN NINHIDRIN AS.AMINO DG NINHIDRIN BERLEBIHAN MEMBENTUK SENYAWA BERWARNA UNGU/BIRU O H l R – C – COOH + l NH2 ASM AMINO O C OH C C ll O NINHIDRIN C - OH OH C C ll O H NINHIDRIN TEREDUKSI + NH3+ + CO2 + R – COOH + NINHIDRIN -- PIGMEN WARNA UNGU/ BIRU Ciri khas reaksi ini mengeluarkan gas co2 O ll C O ll C C C ll O = N–C + 3H2O + H+ C l O - Senyawa berwarna ungu/ biru - MENENTUKAN / MENDETEKSI ASAM AMINO SECARA KUANTITATIF - Dapat mendeteksi asam amino secara kolorimetrical - Prolin dan Hidroksiprolin kuning - Asparagin coklat Contoh: tripeptida H H HOOC - CH – CH2 - CH2 - C - N - CH - C - N - CH2 - COOH NH2 O CH2 O SH GLUTATION ( GLUTAMILSISTEINILGLISIN) CONTOH LAINNYA: INSULIN 2 RANTAI POLIPEPTIDA (51 RESIDU ASAM AMINO) HAEMOGLOBIN 4 RANTAI POLIPEPTIDA (574 AS. AMINO) GRAMISIDIN 10 RESIDU ASAM AMINO → ANTIBIOTIK ENKIFALIN 10 RESIDU ASAM AMINO → OBAT BIUS (ANALGESIK) Tyr – Gly – Gly - Phe – Met– Tyr – Gly – Gly– Phe – Leu BRADIKININ 9 ASAM AMINO → PENGHAMBAT PEMBENGKAKAN JARINGAN Arg– Pro – Pro- Gly – Phe – Ser – Pro – Phe - Arg 3. REAKSI PEMBENTUKAN SISTIN DARI 2 AS.AMINO SISTEIN IKATAN DISULFIDA COOH COOH l l NH2 – C – CH2 – SH + SH – CH2 – C – NH2 --- l l H H COOH COOH l l NH2 – C – CH2 – S - S – CH2 – C – NH2 l l H H IKATAN DISULFIDA TEKNIK PEMISAHAN ASAM AMINO 1. ELEKTROFORESIS KERTAS KERTAS FILTER YG DIBASAHI BUFFER PADA pH tertentu + Spot mengandung campuran asam amino ANION o ------- KATION - ------- T1 ........ T2 COCOKKAN DG MARKER .. . .. . . SEMPROT DG NINHIDRIN 2. CHROMATOGRAPHY PENUKAR ION PENGGOLONGAN PROTEIN BERDASARKAN BENTUK/STRUKTUR DAN SIFAT FISIK TERTENTU 1. 2. PROTEIN GLOBULAR PROTEIN SERABUT 1. ALPHA HELIKS 2. TRIPLE HELIKS 3. BETA PLEATED SHEET 1. BETA PLEATED SHEET PARALEL 2. BETA PLEATED SHEET ANTI PARALEL PROTEIN GLOBULAR PROTEIN YANG DITANDAI DG RANTAI POLIPEPTIDA YG BERLIPAT DAN MELINGKAR MEMBENTUK GLOBULAR PADAT DAN KOMPAK, DENGAN AKSIO RASIAL < 10, YAITU 3 – 4 TERMINAL AMINO NH3+ C R1 O R2 C C NH3+ NH3+ C C O R3 S -S S-S COOH TERMINAL KARBOKSIL Dst, dst PROTEIN GLOBULAR 1. 2. 3. 4. 5. 6. SIFAT: MEMPUNYAI KELARUTAN YANG TINGGI DALAM AIR BANYAK DISUSUN OLEH ASAM AMINO POLAR (HIDROFILIK) JIKA ADA ASAM AMINO HIDROFOBIK TERSEMBUNYI DIBAHAGIAN DALAM. BANYAK MENGANDUNG PROLIN PEMBENKOKAN. ASAM AMINO Ser, Thr, DAN Asn JUGA MENYEBABKAN PEMBENGKOKAN MEMPUNYAI FUNGSI SEPERTI: ENZIM, PROTEIN SIMPANAN, HORMON, ANTIBODI TRANSPORT. CONTOH : * HAEMOGLOBIN 4 RANTAI POLIPEPTIDA DG 574 ASAM AMINO (ALPHA 1 DAN 2 = 141 AA, BETA 1 DAN 2 = 146 AA). * INSULIN (2 RANTAI DG 51 ASAM AMINO) * ADENILAT KINASE 3 RANTAI Haemoglobin Alpha2 ( 141 as. amino) Alpha1 (141 as.amino) Beta 2 (146 as.amino) Beta 1 (146 as.amino Ilustrasi 4 rantai polipeptida haemoglobin A (21 AS.AMINO) S S S S B (30 as.amino) S-S S-S ILUSTRASI LIPATAN 2 RANTAI POLIPEPTIDA INSULIN PROTEIN SERABUT PROTEIN YANG RANTAI POLIPEPTIDANYA MEMANJANG MEMBENTUK SEPERTI SERAT DAN SALING MELILIT PADA SATU SUMBU DG RASIO AKSIAL > 10 SIFAT SANGAT TIDAK LARUT DALAM AIR SEHINGGA ASAM AMINO PENYUSUNNYA LEBIH BANYAK DARI GOLONGAN ASAM AMINO HIDROFOBIK. 1. 2. 3. FUNGSI: PROTEIN STRUKTURAL PROTEIN PERLINDUNGAN LUAR PROTEIN KONTRAKTIL ADA 3 JENIS: 1. ALPHA HELIKS ALPHA KERATIN (BULU BINATANG, KUKU, WOOL, SAYAP, SISIK, TANDUK, KULIT PENYU) 1. 1. TRIPLE HELIKS KOLAGEN (TULANG, TUL RAWAN, KULIT, URAT) BETA PLEETED SHEET PARALEL KERATIN BETA PLEETED SHEET ANTIPARALEL FIBROIN a. Alpha heliks b. Alpha heliks c. Triple heliks BETA PLEETED SHEET PRALEL BETA PLEETED SHEET ANTIPARALEL IKATAN KOVALEN DAN NON KOVALEN YANG MEMPERTAHANKAN STRUKTUR PROTEIN IKATAN KOVALEN: IKATAN NONKOVALEN 1. IKATAN PEPTIDA 2. IKATAN DISULFIDA 1. IKATAN HIDROGEN 2. IKATAN HIDROFOBIK 3. IKATAN ELEKTROSTATIK R1 H2N - C H O - H C - N - C - COOH H IKATAN PEPTIDA R2 COOH COOH l l NH2 – C – CH2 – S - S – CH2 – C – NH2 l l H H IKATAN DISULFIDA IKATAN NONKOVALEN 1. IKATAN HIDROGEN 2. IKATAN HIDROFOBIK/INTERAKSI HIDROFOBIK 3. IKATAN ELEKTROSTATIK IKATAN HIDROGEN TERJADI ANTARA RESIDU GUGUS R PADA SIMPUL YANG BERDEKATAN DIDALAM RANTAI ATAU ANTAR RANTAI. RANTAI 1 RANTAI 2 RANTAI 3 IKATAN HIDROFOBIK TERJADI ANTARA RESIDU GUGUS R DARI 2 ASAM AMINO YANG SAMA-SAMA HIDROFOBIK IKATAN ELEKTROSTATIK TERJADI ANTARA GUGUS RDARI ASAM AMINO YANG MUATANNYA BERLAWANAN. DENATURASI PROTEIN IKATAN-IKATAN NONKOVALEN YG MEMPERTAHANKAN STRUKTUR PROTEIN DAPAT DIRUSAK OLEH BERBAGAI MANIPULASI SEHINGGA PROTEIN AKAN KEHILANGAN AKTIFITAS BIOLOGISNYA DENATURASI PROTEIN FISIK SUATU PEROBAHAN KONFORMASI RANTAI POLIPEPTIDA YANG TIDAK MEMPENGARUHI STRUKTUR PRIMER. HAL-HAL YG DAPAT MENYEBABKAN TERJADINYA DENATURASI: PANAS 50 -60 ASAM BASA KUAT PELARUT ORGANIK (ALKOHOL, ASETON DLL) PENGGUNCANGAN YANG INTENSIF DETERGEN, UREA DLL DENATURASI RENATURASI HIDROLISIS PROTEIN HIDROLISIS PROTEIN BERGUNA UNTUK: 1. MEMUTUS IKATAN KOVALEN PD POLIPEPTIDA 2. MEMISAHKAN ASAM AMINO YG ADA PADA RANTAI POLIPEPTIDA. ADA 3 CARA UNTUK MENGHIDROLISIS PROTEIN: 1. HIDROLISIS DG ASAM. 6 NHCl, PADA SUHU 110oC SELAMA 20 – 70 JAM, PADA TABUNG REAKSI YG TERTUTUP RAPI SEHINGGA TDK ADA KONTAK DG OKSIGEN. TERJADI PEMUTUSAN SEMUA IKATAN PEPTIDA, TETAPI BBRP ASAM AMINO MENGALAMI DEAMINASI (Trp, Ser, Tre, Asp, Glu). 2. HIDROLISIS DG BASA 2 – 4 N NaOH, SUHU 100oC, SELAMA 4 – 8 JAM. UNTUK MENDAPATKAN Trp YG RUSAK PADA HIDROLISIS ASAM. 3. HIDROLISIS DG ENZIM TIDAK MEMUTUSKAN SEMUA IKATAN PEPTIDA PADA RANTAI POLIPEPTIDA KARENA ENZIM HANYA MEMUTUS PADA ASAM AMINO TERTENTU. TRIPSIN Lys, Arg KHEMOTRIPSIN Phe, Trp, Tyr SIANOGEN BROMIDA Met THERMOLISIN SEBELUM Ala PEPSIN Phe, Trp, Tyr 4. MEMUTUS IKATAN DISULFIDA MENGGUNAKAN SENYAWA: 1. MERKAPTOETANOL 2. ASAM PERFORMAT 3. DITIOREITOL (DTT) DTT (DITIOREITOL) HS-CH2-CHOH-CHOH-CH2SH ATAU ASAM PERFORMAT (HCOO-OH) MERKAPTOETANOL (HS-CH2-CH2-OH) ENZIM (BIOKATALISATOR) BEBERAPA SIFAT KHAS ENZIM: 1. ENZIM MEMPUNYAI TENAGA KATALITIK YG TINGGI (jauh lebih tinggi dari tenaga katalisator sintetik) SEHINGGA DAPAT MEMEPERCEPAT LAJU REAKSI. 2. ENZIM MEMPUNYAI SPESIFISITAS YG TINGGI TERHADAP SUBSTRATNYA, ( seringkali tiap enzim hanya mengkatalisis sejumlah kecil reaksi atau kadang kala hanya satu) 3. MEMPERCEPAT REAKSI TANPA MENGHASILKAN PRODUK SAMPINGAN. 4. DAPAT BEKERJA PADA SUHU DAN PH NORMAL. 5. BEKERJA TERKOORDINIR DG BAIK DAN MEMPUNYAI HUBUNGAN YG SANGAT TERATUR DG AKTIFITAS METABOLIK YG BERBEDA SEHINGGA TERJADI KEHARMONISAN UNTUK MENUNJANG KEHIDUPAN.( bbrp penyakit kemungkinan disebabkan karena kekurangan atau kehilangan satu enzim, atau aktifitas enzimnya berlebihan) 6. TIDAK MEROBAH TITIK KESEIMBANGAN REAKSI YG DIKATALISIR DAN JUGA TIDAK HABIS TERPAKAI ( enzim yg telah bebas dapat bekerja kembali). KLASIFIKASI ENZIM GRUP I. OKSIDOREDUKTASE ENZIM YANG BEKERJA MENGKATALISIS OKSIDASI REDUKSI ANTARA DUA SUBSTART. A (red) +B (ok) - A (ok) +B (red) Ex: Alkoholdehidrogenase C2H5OH + NAD+ CH3 CHO + NADH + H+ H H H–C-H H-C-H H - C – OH + NAD+ H-C =O + H etanol Asetaldehid NADH + H+ GRUP 2. TRANSFERASE ENZIM YANG BEKERJA UNTUK MENGKATALISA PEMINDAHAN ELEKTRON, ATOM ATAU GUGUS FUNGSIONAL (KARBON, ALDEHID,KETON, ASIL, ALKIL,P, S ) DLL. CTH : HEKSOKINASE ATP + D–HEKSOSA ADP + D-HEKSOSA 6 P C=O C=O H - C – OH H - C – OH ATP + HO – C - OH H – C - OH H – C - OH CH2OH ADP HO – C - OH + H – C - OH H – C - OH CH2OP 3 . HIDROLASE ENZIM YANG BEKERJA MENGKATALISIS REAKSI HIDROLISIS PADA IKATAN ESTER,ETER,GLIKOSID, PEPTIDA, C-N, C-C, P-N, ASAM ANHIDRAT, HALIDA) CTH: LIPASE TAG + H2O GLISEROL + 3 AS. LEMAK O C–O–C R1 H O + C–O–C R2 H2O H - C – OH H - C – OH H - C – OH O H C–O–C R3 R1COOH + R2COOH R3COOH 4. LIASE ENZIM YANG BEKERJA MENGKATALISIS PENAMBAHAN ATAU PEMBUANGAN GUGUS DARI SUBSTRAT DAN MENINGGALKAN IKATAN RANGKAP FUMARASE (MALATHIDROLIASE) L- MALAT FUMARAT + H2O COOH H COOH HO – C – H C H–C–H C COOH L- MALAT HOOC + H2O H FUMARAT 5. ISOMERASE SEMUA ENZIM YANG MENGKATALISIS KONVERSI ISOMER OPTIK,GEOMETRIK TRIOSA FOSFAT ISOMERASE SEMUA ENZIM YANG DAPAT MEROBAH SIS-TRANS FOSFOGLUKOISOMERASE D-Glukosa 6 fosfat D- Fruktosa 6 fosfat H C=O H – C – OH HO – C – H H – C – OH H – C – OH CH2 – O – PO3 CH2OH C=O HO – C – H H – C – OH H – C – OH CH2 – O – PO3 6. LIGASE ENZIM YANG MENGKATALISIS PENGGABUNGAN DUA SENYAWA DIIKUTI PEMECAHAN IKATAN PIROFOSPAT PADA ATP. Glutamin sintetase L Glu + NH4+ + ATP L-Gln + ADP + PPi COOH COOH H2N – C – H CH2 CH2 COOH L - Glu H2N – C – H + NH4+ + ATP CH2 CH2 C=o NH2 L- Gln + ADP ENZIM MEMPERCEPAT LAJU REAKSI DENGAN CARAMENURUNKAN “ENERGI AKTIFASI” ENERGI AKTIFASI ADALAH JUMLAH ENERGI DALAM KALORI YANG DIPERLUKAN UNTUK MEMBAWA SEMUA MOLEKUL PADA 1 MOL SENYAWA PADA SUHU TERTENTU MENUJU TINGKAT TRANSISI PADA PUNCAK BATAS ENERGI. PADA SAAT INI TERDAPAT PELUANG YANG SAMA BAGI MOLEKUL2 UNTUK MENGALAMI REAKSI MEMBENTUK PRODUK (P) ATAU KEMBALI MENUJU KUMPULAN MOLEKUL (S) KECEPATAN SETIAP REAKSI KIMIA TERGANTUNG KONSENTRASI SENYAWA PADA KEADAAN TRANSISI. KECEPATAN REAKSI KIMIA AKAN SEMAKIN TINGGI JIKA SEMAKIN BANYAK MOLEKUL A BERADA PADA KEADAAN TRANSISI 2 CARA UNTUK MENINGKATKAN KECEPATAN REAKSI 1. DENGAN PEMANASAN 2. DENGAN KATALISATOR C=O H - C – OH HO – C - OH H – C - OH H – C - OH CH2OH TEMPAT KATALITIK (CATALITIC SITE) EMIL FISCHER : UKURAN ENZIM JAUH LEBIH BESAR DIBANDING DENGAN UKURAN SUBSTRAT YANG AKAN DIKATALISIS. PENURUNAN ENERGI AKTIFASI OLEH ENZIM DIYAKINI KARENA ADANYA MODEL 3 DIMENSI ENZIM, YAKNI BAHWA BAGIAN PROTEIN YANG BEREAKSI DENGAN SUBSTRAT ADALAH JAUH LEBIH BESAR BAGIAN INI DISEBUT SEBAGAI ACTIVE SITE. DAERAH ACTIVE SITE HANYA SEBAGIAN KECIL DARI PROTEIN ENZIM, NAMUN SEMUA RESIDU ASAM AMINO LAINNYA SEBAGAI PENYUSUN PROTEIN ENZIM AKAN MEMPUNYAI PERANAN DALAM MENGKATALISIS REAKSI. 2 TEORI UNTUK MENGGAMBARKAN PENGIKATAN SUBSTRAT OLEH ENZIM PADA DAERAH ACTIVE SITE. 1. LOCK & KEY HYPOTHESIS OLEH EMIL FISHER DISINI DIYAKINI AKTIVE SITE MEMPUNYAI BENTUK YANG SAMA DENGAN SUBSTRAT KOMPLEK + ENZIM ENZIM-SUBSTRAT SUBSTRAT + PRODUK ENZIM 2. INDUCED – FIT HYPOTESIS OLEH KOSHLAND LEBIH FLEKSIBEL KARENA DAERAH AKTIVE SITE AKAN MENYESUAIKAN DIRI DENGAN BENTUK SUBSTRAT. KOMPLEK ENZIM-SUBSTRAT + ENZIM PRODUK + PRODUK ENZIM BEBERAPA ENZIM HANYA TERDIRI DARI POLIPEPTIDA (TIDAK MENGANDUNG SENYAWA LAIN SELAIN RESIDU ASM AMINO) RIBONUKLEASE PANKREAS ENZIM LAIN MEMERLUKAN SENYAWA LAIN UNTUK AKTIFITASNYA KOMPONEN INI DISEBUT KOFAKTOR 1. MOLEKUL ANORGANIK SEPERTI : 2. MOLEKUL ORGANIK KOMPLEKS DISEBUT (KOENZIM) EX : THIAMIN (B1) RIBOFLAVIN (B2) VIT B12 PYRIDOXIN (B6) NIACIN (NAD) PANTOTHENIC ACID (KOENZYM –A)(CO.A), BIOTIN, FOLATE NAD. KOFAKTOR DIPERLUKAN HANYA SEDIKIT TETAPI HARUS ADA. BEBERAPA ENZIM MEMERLUKAN KOFAKTOR (ION LOGAM & KOENZIM) SECARA BERSAMAAN (KEDUANYA) BEBERAPA ENZIM HANYA PERLU SALAH SATU ION LOGAM ATAU KOENZIM. KOFAKTOR KADANG2 HANYA TERIKAT SECARA LEMAH PADA ENZIM (SEMENTARA) KOFAKTOR KADANG2 TERIKAT SECARA KUAT PADA ENZIM GUGUS PROSTETIK HOLOENZIM PROTEIN + GUGUS PROSTETIK APOENZIM BAHAGIAN PROTEIN ENZIM KECEPATAN REAKSI ENZIM TERGANTUNG KEPADA 1. KONSENTRASI SUBSTRAT. 2. SUHU 37, 45, >55 STABIL SUHU TINGGI STABIL SUHU RENDAH 3. Ph MASING2 ENZIM PUNYA Ph OPTIMUM YG KHAS 7-9 4. INHIBITOR (PENGHAMBAT KERJA ENZIM) 1. KONSENTRASI SUBSTRAT MICHAELIS-MENTEN EQUATION Vo = kecepatan awal pada konsentrasi substrat [S] V max = Kecepatan maksimum Km = Tetapan Michaelis-Menten enzim bagi sustrat tertentu 2. pH MEMPENGARUHI KECEPATAN REAKSI Masing-masing enzim mempunyai pH optimum yang khas contoh: PENGHAMBAT KERJA ENZIM (INHIBITOR) 1. INHIBITOR KOMPETITIF SUBSTRAT MEMPUNYAI STRUKTUR YG ANALOG DG INHIBITOR ENZ-I PENCEGAHAN MENINGKATKAN KONSENTRASI SUBSTRAT E + P TIDAK TERBENTUK PRODUK 2. INHIBITOR NON KOMPETITIF - BERIKATAN DG ENZIM PADA SISI LAIN DARI ACTIVE SITE SHGG MEROBAH KONFORMASI ENZIM ENZIM MENJADI INAKTIF E+S E-S + I E-S-I TIDAK TERBENTUK PRODUK ENZIM PENGATUR/ENZIM ALOSTERIK SISTIM MULTI ENZIM - BEBERAPA ENZIM YANG BEKERJA SECARA BERSAMA-SAMA DALAM SEL - PRODUK ENZIM PERTAMA MENJADI SUBSTRAT BAGI ENZIM KE DUA, PRODUK ENZIM KEDUA MENJADI SUBSTRAT BAGI ENZIM KE TIGA DST. A ----- B ----- C ----- D ----- E ----- P Enz 1 Enz 2 Enz 3 Enz 4 Enz 5 ENZIM ALOSTERIK MODULATOR SIFAT ENZIM ALOSTERIK: 1. JAUH LEBIH BESAR DARI ENZIM BIASA ( MEMPUNYAI 2 ATAU LEBIH RANTAI POLIPEPTIDA) 2. MEMPUNYAI SISI PENGATUR YG BERIKATAN DG MODULATOR SECARA NON KOVALEN