tinjauan pustaka
advertisement

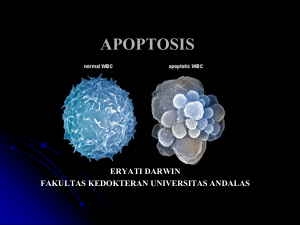
TINJAUAN PUSTAKA Radikal Bebas dan Apoptosis Radikal bebas adalah molekul yang kehilangan elektron, sehingga molekul tersebut menjadi tidak stabil dan selalu berusaha mengambil elektron dari molekul atau sel lain. Radikal bebas dapat dihasilkan dari hasil metabolisme tubuh dan faktor eksternal seperti asap rokok, hasil penyinaran ultraviolet, zat kimia dalam makanan dan polutan lain. Radikal bebas meliputi atom hidrogen, logam-logam transisi, dan molekul oksigen (Halliwel 1995). Radikal bebas dapat terbentuk dari proses metabolisme normal dalam tubuh. Salah satu contohnya yaitu pada proses reduksi molekul oksigen dalam rangkaian transpor elektron (Siregar 1992). Radikal bebas juga dapat dihasilkan dari berbagai proses kimia atau enzimatik selama proses metabolisme tubuh yang melibatkan senyawa organik maupun anorganik. Radikal bebas yang bersifat tidak stabil dan sangat reaktif dapat menimbulkan kerusakan berbagai komponen sel hidup seperti DNA/RNA, lipid, protein, karbohidrat, dan gugus tiol non protein. Radikal bebas juga dapat mengakibatkan peroksidasi lipid. Peroksidasi lipid merupakan reaksi yang terjadi antara asam lemak tak jenuh ganda yang menyusun membran sel (linoleat, linolenat, dan arakidonat) sehingga terbentuk radikal lipid peroksida (Murray 2003). Reaksi peroksidasi lipid akan menghasilkan produk akhir malonaldehida (MDA) yang merupakan senyawa dealdehida berkarbon tiga yang reaktif. Konsentrasi MDA yang dihasilkan dapat diukur dengan metode TBA, karena MDA dapat bereaksi dengan asam tiobarbiturat membentuk produk berwarna merah (Gambar 1) dan diukur pada panjang gelombang 532 nm (Kikuzaki dan Nakatani 1993). MDA TBA Produk Gambar 1 Reaksi MDA dan TBA Molekul radikal bebas dan senyawa turunannya antara lain reactive oxygen species (ROS) dapat menyerang sel sehingga menimbulkan berbagai kerusakan pada sistem sel dan kerusakan jaringan syaraf yang tidak dapat diperbaiki lagi yang disebut apoptosis (Silalahi 2006). ROS berperan penting dalam menginduksi apoptosis di bawah kondisi fisiologis dan patologis (Simon et al. 2000, Madeo et al. 2004). Apoptosis, yang berasal dari bahasa Yunani yaitu apo (dari) dan ptosis (jatuh), adalah mekanisme biologi yang merupakan salah satu jenis kematian sel terprogram. Apoptosis digunakan oleh organisme multisel untuk membuang sel yang sudah tidak diperlukan oleh tubuh. Apoptosis berbeda dengan nekrosis. Apoptosis pada umumnya berlangsung seumur hidup dan bersifat menguntungkan bagi tubuh, sedangkan nekrosis adalah kematian sel yang disebabkan oleh kerusakan sel secara akut (Dash 2007). Contoh nyata dari keuntungan apoptosis adalah pemisahan jari pada embrio. Apoptosis yang dialami oleh sel-sel yang terletak di antara jari menyebabkan masing-masing jari menjadi terpisah satu sama lain. Apoptosis dapat terjadi misalnya ketika sel mengalami kerusakan yang sudah tidak dapat diperbaiki lagi. Keputusan untuk melakukan apoptosis berasal dari sel itu sendiri, dari jaringan yang mengelilinginya, atau dari sel yang berasal dari sistem imun. Bila sel kehilangan kemampuan untuk melakukan apoptosis (misalnya karena mutasi), atau bila inisiatif untuk melakukan apoptosis dihambat (oleh virus), sel yang rusak dapat terus membelah tanpa terbatas, yang akhirnya menjadi kanker (Dash 2007). Seperti halnya sel mamalia, sel khamir juga mengalami apoptosis. S. cerevisiae yang mutan pada gen cdc48 menunjukkan tanda apoptosis, antara lain pelepasan fosfatidil serin pada membran sitoplasma bagian luar, fragmentasi DNA, dan kondensasi kromatin. Khamir yang mengalami apoptosis akan memperlihatkan karakteristik morfologis berupa pengerutan sel yaitu ukuran sel menjadi lebih kecil (petite), sitoplasma dan organel lebih padat. Kondensasi kromatin terlihat dari terjadinya agregasi kromatin di pinggir nukleus di bawah membran inti, membentuk massa berbatas jelas dengan berbagai bentuk dan ukuran kemudian inti dapat pecah menjadi beberapa bagian. Pembentukan badan apoptosis terjadi ketika sel membentuk gelembung sitoplasma kemudian terbagi menjadi gelembung kecil terbungkus membran sitoplasma disebut badan apoptosis, berisi organel dan sitoplasma serta fragmen nukleus. Fagositosis badan apoptosis oleh sel didekatnya, baik oleh sel parenkim maupun oleh makrofag (Ligr et al. 1998). Berdasarkan hal tersebut S. cerevisiae dapat digunakan sebagai organisme model untuk studi apoptosis (Madeo et al. 2002) Sinyal apoptosis dapat berasal dari luar maupun dari dalam sel (Gambar 2). Dari luar sel, sinyal apoptosis dibawa oleh Sel T, yaitu protein Fas atau sinyal kematian lainnya misalnya protein Tumor Necrosis Factor τ (TNF). Bila proteinprotein tersebut berikatan dengan masing-masing reseptornya, maka proses apoptosis dimulai. Sinyal apoptosis tersebut ditangkap oleh death domain yang teraktivasi oleh kehadiran Fas dan TNF. Sebelum dilanjutkan, apoptosis diyakinkan kembali untuk diteruskan atau dihambat melalui mekanisme seleksi oleh protein Flice/caspase-8 inhibitory protein (FLIP). Ekspresi yang berlebihan dari FLIP, akan menyebabkan proses apoptosis terhenti. FLIP inilah sebagai penyeleksi awal dan memastikan apakah sel layak mati atau tidak. Model penghambatan apoptosis melalui mekanisme FLIP terjadi pada apoptosis ekstrinsik yaitu mekanisme apoptosis dengan sinyal kematian berasal dari luar sel. Bila ekspresi FLIP rendah, maka sinyal kematian akan diteruskan oleh mediator apoptosis selanjutnya yaitu caspase-8 (Shi et al. 2003). Apoptosis Ekstrinsik Luar Sel Apoptosis Intrinsik Dalam Sel Sel T (Fas & TNF) Sitoplasma Bax (Bcl-2) Apaf-1 TNF Fas Death Domain Sitokrom C FLIP FLIP Caspase 9 Caspase 8 Memotong histon Caspase 3 Memotong histon Gambar 2 Jalur Apoptosis (Shi et al. 2003) Caspase 3 Lingkungan sekitar dapat mempengaruhi kondisi sel. Beberapa protein dapat terekspresi pada kondisi lingkungan yang ekstrem. Protein Bax, yang merupakan anggota keluarga protein Bcl-2, merupakan protein pembawa sinyal apoptosis dari dalam sel. Ekspresi yang berlebihan dari Bax dalam sitoplasma, dapat menyebabkan membran mitokondria berlubang. Mitokondria adalah organ sel yang berfungsi sebagai tempat pembangkit energi sel. Rusaknya membran mitokondria menyebabkan sel kehilangan energi dan salah satu protein terpenting di dalamnya, yaitu sitokrom C lepas menuju sitoplasma. Sebelum Bax masuk ke membran mitokondria, kerja protein tersebut harus sesuai dengan protein Bcl-2 terlebih dahulu. Bila tidak sesuai, maka ekspresi protein Bcl-2 akan meningkat dan mendesak keberadaan protein Bax sehingga apoptosis tidak terjadi. Kehadiran sitokrom C di dalam sitoplasma dapat menyebabkan teraktivasinya protein Apaf1, yang nantinya bersama-sama dengan caspase-9 akan melanjutkan perjalan akhir dari sinyal kematian. Mekanisme tersebut merupakan bagian dari jalur apoptosis intrinsik, yang dilihat dari asal sinyal kematian yaitu dari dalam sel. Perjalanan akhir sinyal apoptosis, akan dieksekusi oleh salah satu anggota keluarga protein caspase, yaitu caspase-3. Bila sinyal apoptosis sudah mencapai caspase-3, maka kepastian dari apoptosis sudah final. Caspase-3 akan memotongmotong protein histon yang berfungsi mengikat rangkaian DNA, menjadi beberapa bagian (Shi et al. 2003). Apoptosis terjadi jika monitor internal mendeteksi adanya kerusakan atau disfungsi dan memberi signal untuk memulai serangkaian proses (cascade) yang akhirnya mengaktifkan caspases dan endonuklease untuk membunuh sel kanker. Salah satu fungsi apoptosis adalah mencegah kanker dengan cara mengeliminasi sel-sel preneoplastik dan neoplastik (pertambahan baru yang tidak normal). Pada hampir semua proses kematian sel, signal cascade terjadi melalui bantuan ROS sebagai molekul pembawa isyarat. Antioksidan bersifat meredam atau menetralkan radikal bebas dan ROS, dengan demikian antioksidan bersifat menghambat apoptosis. Antioksidan seperti tokoferol yang tedapat dalam kompartemen lipida sel, atau N-asetilsistein (suatu peredam radikal bebas yang berada di dalam fase air sitosol), akan memicu pertumbuhan kanker. Sebaliknya, dengan meniadakan antioksidan dalam makanan mungkin akan menginduksi apoptosis sehingga akan menekan pertumbuhan kanker (Zeisel 2004). Kondisi yang mengakibatkan sel mengalami stress, misalnya kelaparan, atau kerusakan DNA akibat racun atau paparan terhadap ultraviolet atau radiasi (misalnya radiasi gamma atau sinar X), dapat menyebabkan sel memulai proses apoptosis. Pada organisme dewasa, jumlah sel dalam suatu organ atau jaringan harus bersifat konstan pada kisaran tertentu. Sel darah dan kulit selalu diperbarui dengan pembelahan diri sel-sel progenitornya, tetapi pembelahan diri tersebut harus dikompensasikan dengan kematian sel yang tua. Diperkirakan 50-70 milyar sel mati setiap harinya karena apoptosis pada manusia dewasa. Dalam satu tahun, jumlah pembelahan sel dan kematian yang terjadi pada tubuh seseorang mencapai kurang lebih sama dengan berat badan orang tersebut (Thompson 1995). Kematian sel terprogram merupakan bagian penting pada perkembangan jaringan tumbuhan dan metazoa (organisme multisel). Sel yang mengalami apoptosis mengkerut dan inti selnya mengecil, sehingga sel tersebut dapat dengan mudah difagositosis. Proses fagositosis memungkinkan komponen-komponen sel yang tersisa digunakan kembali oleh makrofag atau sel-sel yang berada di sekitarnya (Jalal 1999). Saccharomyces cerevisiae sebagai Model Apoptosis Saccharomyces cerevisiae adalah mikroorganisme uniseluler eukariot yang secara tradisional telah dianggap baik dan secara luas digunakan sebagai model organisme untuk mempelajari fisiologi sel manusia dan penyakit manusia. Ada beberapa contoh penyakit yang kondisi dan prosesnya relevan dengan kesehatan manusia dan dipelajari pada khamir, diantaranya adalah: kanker, metabolisme DNA, apoptosis, penyakit jantung, kolesterol, diabetes, penyakit yang terkait dengan kerusakan mitokondria,infeksi retroviral dan penyakit prion, serta sejumlah besar penyakit neuodegenarive seperti parkinson, Alzheimer, Huntington dan penyakit Batten’s (Petranovic dan Nielsen, 2008). Penelitian terbaru telah mengembangkan khamir sebagai model untuk mempelajari mekanisme regulasi apoptosis (Mazzoni et al. 2005). Khamir yang telah dimutasi pada gen siklus pembelahan sel (cdc48) menunjukkan karakteristik morfologi dan ciri molekuler yang merupakan indikator apoptosis yaitu perpindahan fosfatidilserin ke membran sitoplasma bagian luar, kerusakan DNA, kondensasi kromatin, fragmentasi DNA, dan morfologi sel abnormal dengan sejumlah tunas kecil yang disebut badan apoptosis (Ligr et al. 1998). Sel khamir yang digunakan dalam penelitian ini termasuk dalam divisi Thallophyta, subdivisi Ascomycotina, kelas Eumycetes, subkelas Ascomycetes, ordo Eucomycetes, famili Saccharomycetaceae, subfamily Saccharomycetoideae, genus Saccharomyces, dan spesies Saccharomyces cerevisiae (Gambar 3). Suhu optimum untuk pertumbuhan sel S. cerevisiae berkisar antara 25-35oC, suhu minimum berkisar 0-0.5oC dan suhu maksimum pertumbuhan sel khamir ini berada pada 33.5-47oC (Patarau 1982). Khamir merupakan organisme kemoorganotrof karena menggunakan senyawa organik sebagai sumber energi dan tidak membutuhkan cahaya untuk tumbuh. Sumber utama karbonnya adalah heksosa seperti glukosa dan fruktosa atau disakarida seperti sukrosa dan maltosa (Patarau 1982). Khamir dapat tumbuh dengan baik pada kondisi aerobik (tersedianya oksigen), namun beberapa khamir dapat juga tumbuh pada kondisi anaerobik (tidak tersedia oksigen). Proses respirasi pada kondisi aerobik selanjutnya digantikan proses fermentasi pada kondisi anaerobik karena tidak tersedia lagi oksigen. Khamir akan selalu berespirasi pada setiap keadaan yang memungkinkan karena energi yang dihasilkan pada resprasi jauh lebih besar dibandingkan pada proses fermentasi. Pada kondisi aerobik, sebagian besar organisme akan melewati siklus krebs dan transport elektron untuk menghasilkan ATP. Pada eukariota seperti khamir, proses ini terjadi pada mitokondria, sedangkan pada prokariota terjadi di sitoplasma (Bradford et al. 1979). Gambar 3 Saccharomyces cerevisiae Keberadaan oksigen akan menghambat jalur fermentasi di dalam sel khamir sehingga sumber karbon yang ada akan digunakan melalui jalur respirasi. Fenomena ini sering disebut sebagai Pasteur effect (Walker 1998). Berdasarkan Pasteur effect, produksi etanol oleh khamir terjadi pada kondisi anaerob. Namun ternyata Pasteur effect pada sel khamir diamati pada sel yang telah memasuki fase stasioner (resting), sedangkan produksi alkohol terjadi ketika sel berada pada fase pertumbuhan (fase log) (Alexander & Jeffries 1990). Hal inilah yang membuat Pasteur effect diduga bukan fenomena yang terjadi saat produksi etanol oleh Saccharomyces cerevisiae. Pada tahun 1948, Swanson dan Clifton pertama kali menunjukkan bahwa fenomena tersebut terjadi pada sel Saccharomyces cerevisiae yang sedang tumbuh dan menghasilkan etanol sebagai produk fermentasi selama terdapat glukosa dalam jumlah tertentu di dalam medium pertumbuhannya (Alexander & Jeffries 1990). Fenomena tersebut adalah Crabtree effect (de Dekken 1966). Crabtree effect pada khamir dapat diamati ketika medium pertumbuhan mengandung glukosa dalam konsentrasi yang tinggai (diatas 5 mM) (Walker 1998). Menurut penelitian yang dilakukan oleh Alexander dan Jeffries (1990), yang menumbuhkan S. cerevisiae dalam medium yang mengandung glukosa, menunjukkan bahwa saat konsentrasi sel rendah, jalur metabolisme yang digunakan adalah respirasi, sedangkan ketika konsentrasi sel telah mencapai suatu angka kritis, fermentasi etanol terjadi. Dari hasil tersebut diduga pada konsentrasi sel yang rendah, enzim-enzim respirasi masih mencukupi untuk melakukan jalur respirasi, namun saat konsentrasi sel bertambah, konsentrasi enzim tidak bertambah sebab ditekan sintesisnya oleh glukosa, sehingga jalur respirasi terhenti dan digantikan oleh fermentasi. Selain represi terhadap sintesis enzim, konsentrasi gula yang tinggi juga akan mengganggu struktur mitokondria khamir, sebagai contoh hilangnya membran dalam dan kristae. Namun struktur tersebut akan kembali normal saat jalur respirasi menggantikan fermentasi etanol (Walker 1998). Perubahan struktur tersebut akan menghambat siklus Krebs dan fosforilasi oksidatif yang berlangsung di mitokondria. Inaktivasi katabolit terjadi ketika glukosa menonaktifkan enzim kunci dalam jalur respirasi, contohnya fruktosa 1,6-bifosfatase (FBPase). Inaktivasi terjadi pertama-tama melalui proses fosforilasi enzim, kemudian diikuti dengan pencernaan protein enzim di dalam vakuola Mekanisme inaktivasi FBPase pada S. cerevisiae dimulai dengan peningkatan konsentrasi cAMP dan FBPase di dalam sel oleh glukosa. Kenaikan kedua molekul tersebut akan memicu cAMPdependent protein kinase untuk melakukan fosforilasi terhadap FBPase (Walker 1998). Mekanisme terakhir yang menjelaskan Crabtree effect pada khamir adalah keterbatasan kapasitas respirasi khamir yang diusulkan oleh Bardford & Hall (1979). Mereka berpendapat bahwa khamir-khamir yang mampu melakukan fermentasi aerob memiliki keterbatasan kapasitas respirasi. Ketika glukosa terdapat dalam konsentrasi tinggi, glikolisis akan berjalan dengan cepat sehingga menghasilkan piruvat dalam jumlah yang tinggi. Namun keterbatasan khamir tersebut untuk menggunakan piruvat dalam jalur respirasi selanjutnya (Siklus Krebs dan fosforilasi oksidatif) menyebabkan piruvat yang tersisa diubah secara fermentatif menjadi etanol. Kebalikannya, khamir yang tidak melakukan fermentasi aerob dianggap memiliki kapasitas respirasi yang tidak terbatas sehingga mampu menggunakan seluruh piruvat yang dihasilkan dari glikolisis walaupun jumlah glukosa di medium tinggi (Alexander & Jeffries 1990). Ada beberapa hal yang menyebabkan S. cerevisiae baik untuk dijadikan organisme model yang ideal. Pertama, S. cerevisiae adalah mikroorganisme uniseluler yang dapat tumbuh dengan cepat dalam jumlah yang besar dan dalam media yang relatif murah. Kedua, S. cerevisiae dapat mengekspresikan gen heterolog secara baik dari episomal plasmid atau dari integrasi kromosom dan relatif mudah untuk disisipkan, dihapus atau dimutasi apapun urutan genomnya karena kehadirannya yang sangat efisien pada jalur rekombinasi homolog. Selain itu, Kromosom III dari S. cerevisiae merupakan kromosom lengkap pertama dari beberapa organisme yang telah diurutkan, dan pada tahun 1996 S. cerevisiae menjadi organisme eukariot pertama yang seluruh genom telah lengkap (Petranovic dan Nielsen, 2008). Pada Saccharomyces cerevisiae telah dideteksi kematian sel, dengan ciri khas apoptosis seperti fragmentasi DNA, eksternalisasi fosfatidilserin dan kondensasi kromatin, dalam galur yang membawa mutasi dalam gen CDC48 AAA-ATPase (Madeo et al. 1997). Menurut dan Ribeiro et al. 2006, kerusakan DNA pada sel khamir yang mengalami apoptosis dapat diinduksi antara lain oleh hidrogen peroksida, asam asetat dan tekanan hiperosmotik. Paparan dosis rendah asam asetat dapat meningkatkan produksi spesies oksigen reaktif (ROS) dan menginduksi apoptosis pada sel khamir sehingga ROS merupakan regulator kunci dari apoptosis sel khamir (Madeo et al. 1999 dan Ludovico et al. 2001). Menurut Granot et al. (2003) terdapat kesamaan fenomena apoptosis antara sel khamir dan sel mamalia dan terjadinya apoptosis dipicu dan dikontrol oleh serangkaian sinyal sel yang dapat berasal dari luar maupun dalam sel. Granot dan Snyder (1991) melaporkan bahwa glukosa 2 % dapat menginduksi positif apoptosis pada sel khamir. Glukosa dapat menyebabkan kematian sel khamir dalam beberapa jam tanpa penambahan nutrisi lain untuk mendukung pertumbuhannya. Glukosa dapat memicu kematian sel yang ditandai dengan produksi spesies oksigen reaktif (ROS) yang cepat, degradasi RNA dan DNA, kerusakan membran, fragmentasi dan penyusutan inti sel (Granot et al. 2003). Saccharomyces cerevisiae mempunyai sekitar 14.000 kb DNA kromosom (85 % dari DNA total) yang terdistribusi ke dalam 16 kromosom yang berbeda dan telah dikarakterisasi secara genetik. Selain itu Saccharomyces cerevisiae mempunyai dua unsur genetik yang lain, yaitu DNA mitokondria dan DNA plasmid 2m. Beberapa galur mengandung unsur ketiga yang disebut plasmid pembunuh (killer plasmid) (Watson et al. 1987). Setiap sel haploid ragi mempunyai sekitar 10 - 15 mitokondria yang terdistribusi sepanjang sitoplasma (± 10% dari massa sel). Mitokondria ini mempunyai unsur genetik tersendiri (DNA mitokondria) (Watson et al. 1987). DNA mitokondria Saccharomyces cerevisiae berbentuk sirkuler dan peta restriksinya telah diketahui. Ukuran DNA mitokondria ini sekitar 75-80 kb bergantung pada jenis galurnya. DNA mitokondria ini berada dalam 40-50 kopi per sel dan sekitar 10% dari DNA total sel ragi (Guthrie et al. 1991). Perbedaan antara DNA kromosom dengan DNA mitokondria di antaranya adalah dalam DNA mitokondria tidak ditemukan aktivitas proofreading, sehingga menyebabkan laju mutasi di mitokondria lebih tinggi dibandingkan dalam gen kromosom. Protein yang dikode oleh DNA mitokondria disintesis dalam bagian mitokondria yang disebut mitoribosom. Perbedaan lain dalam sistem genetik mitokondria adalah bahwa kodon UGA tidak dibaca sebagai kodon terminasi melainkan dikode untuk asam amino triptofan (Watson et al. 1987). Mitokondria merupakan organela yang berperan penting dalam metabolisme respirasi untuk menghasilkan ATP. Kerusakan pada fungsi DNA mitokondria menyebabkan mutan tidak dapat melakukan respirasi dan akibatnya tidak lagi dipengaruhi oleh Efek Pasteur, misalnya supresi oksigen selama glikolisis (Hutter et al. 1998). Peristiwa ini diduga menyebabkan laju fermentasi etanol menjadi lebih tinggi. Mutasi pada DNA mitokondria akan menghasilkan mutan yang disebut mutan petit. Hutter et al. (1998) telah melaporkan bahwa mutan petite mampu meningkatkan kadar etanol 30 - 40% dibanding tipe liarnya. Dalam penelitian tersebut digunakan Saccharomyces cerevisiae galur ATCC. Antioksidan Asal Tanaman Obat Penyakit yang disebabkan oleh radikal bebas bersifat kronis, yang membutuhkan waktu bertahun-tahun untuk penyakit tersebut menjadi nyata. Contoh penyakit yang sering dihubungkan dengan radikal bebas adalah serangan jantung dan kanker. Untuk mencegah atau mengurangi penyakit kronis karena radikal bebas diperlukan antioksidan. Pada penelitian ini digunakan ekstrak daun dari beberapa tanaman yang sering digunakan dalam pengobatan kardiovaskular dan memiliki potensi sebagai antioksidan. Antioksidan didefinisikan sebagai senyawa yang dapat menunda, memperlambat dan mencegah proses oksidasi lipid walaupun dalam konsenterasi yang sedikit (Sampels, 2005). Antioksidan menstabilkan radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yang dapat menimbulkan stres oksidatif (Simpson, 2006). Antioksidan dapat diartikan sebagai senyawa pemberi elektron yang diperlukan oleh radikal bebas dalam rangka menstabilkan dirinya. Dengan demikian, antioksidan dapat menghentikan pembentukan radikal bebas, mengurangi radikal bebas, dan memperbaiki kerusakan yang ditimbulkannya (Irawan 2006). Berdasarkan mekanisme kerjanya, antioksidan terbagi menjadi tiga, yaitu: antioksidan primer, sekunder, dan tersier. Antioksidan primer berperan untuk mengurangi pembentukan radikal bebas baru dengan memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Antioksidan primer terdiri atas superoksida dismutase (SOD), katalase, dan glutation peroksidase. Ketiganya ini dapat mengubah radikal superoksida menjadi air. Antioksidan sekunder berperan mengikat radikal bebas dan mencegah amplifikasi radikal. Antioksidan sekunder terdiri atas vitamin C, vitamin B, vitamin E, β-karoten, dan lain-lain. Antioksidan tersier terdiri atas enzim perbaikan DNA, metionin sulfoksida reduktase dan lainlain (Murray 1999). Vitamin C dan E dapat mencegah penyakit jantung. Vitamin C berperan dalam pembentukan kolagen dan merupakan faktor positif untuk mencegah serangan jantung koroner. Kekurangan vitamin C menyebabkan kerusalan susunan sel arteri sehingga dapat terisi kolesterol dan menyebabkan aterosklerosis atau proses pengapuran dan penimbunan elemen kolesterol. Sedangkan vitamin E merupakan antioksidan yang berperan mencegah terjadinya proses oksidasi dalam tubuh, di mana kolesterol LDL yang menembus dinding arteri dapat menyumbat pembuluh darah setelah mengalami oksidasi (Jishage et al. 2005). Vitamin E dapat ditemukan di minyak nabati (minyak kedelai, minyak jagung dan minyak biji bunga matahari), kacang-kacangan, biji-bijian dan padi-padian. Pada penelitian ini digunakan vitamin E sebagai standar antioksidannya. Gambar 4 Struktur alfa Tokoferol (Vitamin E) Vitamin E (tokoferol) merupakan suatu komponen lipid yang esensial terdiri dari selaput-selaput biologi yang saling berhubungan dengan radikal peroxyl yang berfungsi dalam mencegah perkembangan lipid peroksida (Jishage et al. 2005). Tokoferol pertama kali ditemukan tahun 1922 sebagai salah satu faktor anti ketidak suburan (anti-infertilitas). Lebih lanjut dijelaskan oleh (DuttaRoy, 1994) vitamin E merupakan vitamin yang larut dalam lemak yang terdiri atas campuran dan substansi tokoferol (a, b, g, dan d) dan tokotrienol (a, b, g, dan d), pada manusia a-tokoferol merupakan vitamin E yang paling penting untuk aktifitas biologi tubuh. Bentuk vitamin E ini dibedakan berdasarkan letak berbagai grup metil pada cincin fenil rantai cabang molekul dan ketidakjenuhan rantai cabang (Gambar 4). Menurut (Dutta-Roy, 1994) a-tokoferol merupakan bentuk vitamin E yang paling aktif, berdasarkan penelitian pada rodentia dan anak ayam. Suplemen a-tokoferol juga mampu melindungi peningkatan konsentrasi total kolesterol plasma dan mengurangi kolesterol pada plak arteri kelinci (Schwenke 2002). Pada penelitian ini digunakan tiga ekstrak tanaman yaitu : Salam (Eugenia polyantha Wight. ), Jati Belanda (Guazuma ulmifolia Lamk.), dan Jambu Biji (Psidium guajava). Tanaman ini banyak ditemukan di daerah Bogor dan sekitarnya. Tanaman ini telah digunakan dalam pengobatan kardiovaskular dan berpotensi sebagai antioksidan. Salam (Eugenia polyantha Wight. ) Tanaman ini memiliki klasifikasi divisi Spermatophyta, sub divisi Angiospermae, kelas sebagai berikut: Dicotyledonae, ordo Myrtales, familia Myrtaceae, genus Eugenia dan spesies Eugenia polyantha Wight (Gambar 5). Gambar 5 Daun Salam (Eugenia polyantha Wight ) Salam tumbuh liar di hutan dan pegunungan, atau ditanam di pekarangan dan sekitar rumah. Tanaman ini dapat ditemukan dari dataran rendah sampai pegunungan dengan ketinggian 1800 m di atas permukaan laut. Pohon bertajuk rimbun, tinggi mencapai 25 m, berakar tunggang, batang bulat, permukaan licin. Daun salam merupakan daun majemuk, menyirip genap, permukaan licin. Daunnya memiliki tepi yang rata, ujung meruncing, pangkal runcing. Panjang daun berkisar antara 10-14 cm, lebar 4-8 cm, tangkai panjang ± 1 cm, letaknya berhadapan, bertangkai yang panjangnya 0,5-1 cm. Helaian daun bentuknya lonjong sampai elips atau bundar telur sungsang, pertulangan menyirip, permukaan atas licin berwarna hijau tua dan permukaan bawah warnanya hijau muda (Deptan 2003). Kandungan kimia daun dan kulit batang Eugenia polyantha mengandung saponin, minyak Atsiri (0,05 %), Sitral dan Eugenol, Tanin dan Flavonoida, di samping itu daunnya juga mengandung alkaloida dan polifenol, sedangkan kulit batangnya juga mengandung tanin (Wijayakusumah et al. 1996). Daun salam adalah jenis rempah daun yang biasa digunakan untuk berbagai masakan. Namun dibalik itu daun salam juga memiliki khasiat untuk menyembuhkan berbagai macam penyakit. Beberapa penelitian menyatakan bahwa ektrak daun salam memiliki khasiat sebagai antioksidan (Wong et al. 2006, Lelono et al. 2009). Khasiat lain dari daun salam adalah dapat menurunkan kadar asam urat darah mencit jantan yang diinduksi dengan potasium oksonat (Ariyanti 2007). Jati Belanda (Guazuma ulmifolia Lamk.) Jati Belanda merupakan jenis tanaman kayu keras tropis dari divisi Spermatophyta, sub divisi Angiospermae, kelas Dycotyledone, ordo Steruliaceae, genus Guazuma, spesies Guazuma ulmifolia Lamk (Gambar 6). Jati Belanda ditemukan di Karibia, Asia Tenggara, Meksiko, Amerika Tengah dan Kolumbia, Ekuador, Peru, Bolivia, Paraguay, Argentina, dan Brasil. Tanaman ini telah dibudidayakan di India selama lebih dari 100 tahun. Jati Belanda merupakan tanaman pohon, tinggi lebih kurang 10 meter. Batang keras, bulat, berkayu, bercabang, warna hijau keputih-putihan. Daun tunggal, permukaan kasar, tepi bergerigi, ujung daun runcing, pangkal berlekuk, pertulangan menyirip, panjang 10-16 cm, lebar 3-6 cm, warna hijau (Deptan 2003). Gambar 6 Daun Jati Belanda (Guazuma ulmifolia Lamk.) Hasil pemeriksaan pendahuluan terhadap komposisi daun Jati Belanda menunjukkan adanya kandungan flavonoid, asam fenolat, tanin, steroid, triterpenoid, karotenoid dan kandungan lendir yang cukup tinggi yaitu 8,08% (Andriani 2004). Daun jati belanda mengandung zat lendir yang merupakan serat (fiber) bersifat lubricating atau melicinkan sehingga dapat menghambat penyerapan lemak, glukosa, kolesterol yang terdapat dalam makanan dan memperlancar buang air besar. Kandungan tanin bekerja sebagai astrigen yaitu zat yang akan mengendapkan protein yang terdapat pada mukus yang melapisi bagian dalam usus sehingga lapisan ini sukar ditembus dan akan mengurangi penyerapan lemak. Penelitian Raharjo 2004 menyatakan bahwa ekstrak etanol daun jati belanda dapat menghambat aktivitas enzim lipase serum Rattus norvegicus. Jambu Biji (Psidium guajava) Jambu biji adalah salah satu tanaman buah jenis perdu, dalam bahasa Inggris disebut Lambo guava. Tanaman ini berasal dari Brazilia Amerika Tengah, menyebar ke Thailand kemudian ke negara Asia lainnya seperti Indonesia. Hingga saat ini telah dibudidayakan dan menyebar luas di daerah-daerah Jawa. Jambu biji termasuk dalam kerajaan Plantae, divisio Magnoliophyta, kelas Magnoliopsida, Ordo Myrtales, familia Myrtaceae, genus Psidium dan spesies Psidium guajava (Gambar 7). Daun jambu biji memiliki daun tunggal, bulat telur, ujung tumpul, pangkal membulat, tepi rata, berhadapan, panjang 6-14 cm, lebar 3-6 cm dan pertulangan berwarna hijau. (Deptan 2003). Daun jambu biji banyak mengandung polifenol, tannin, saponin, minyak atsiri, asam ursolat, asam psidolat, asam oleanolat, dan vitamin C (Alviani 2007). Jambu biji memiliki buah yang berwarna hijau dengan daging buah berwarna putih atau merah dan berasa asam-manis. Buah jambu biji dikenal mengandung banyak vitamin C yang berperan sebagai antioksidan. Daun jambu biji umumnya berkhasiatnya sebagai anti diare. Disamping itu, jambu biji mempunyai khasiat sebagai anti inflamasi, anti mutagenik, anti mikroba dan analgesik (Ojewole 2006). Minyak atsiri daun jambu biji memiliki khasiat anti kanker kuat secara in vitro (Chen et al. 2007). Beberepa senyawa kimia yang terkandung dalam jambu biji antara lain, polifenol, karoten, flavonoid dan tannin mempunyai aktivitas antioksidan yang berkhasiat dalam mengobati berbagai penyakit (Indariani 2006). Gambar 7 Daun Jambu Biji (Psidium guajava)