Kimia fisika I tc20062
advertisement

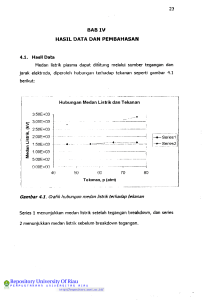
KIMIA FISIKA I TC20062 Dr. Ifa Puspasari Pokok Bahasan/Materi 1. Sifat-sifat gas ideal 2. Teori kinetik gas 3. Hukum termodinamika 4. Energi bebas dan potensial kimia 5. Kesetimbangan kimia 6. Kinetika reaksi fase gas 7. Mekanisme reaksi fase gas Aspek Penilaian • Ujian Akhir Semester: 40% • Ujian Tengah Semester: 35% • Tugas Mandiri: 20% • Keaktifan Mahasiswa: 5% __________ 100% Daftar Referensi • Sukardjo, 1989, Kimia Fisika, Ed. 2, PT Rineka Cipta, Jakarta • Atkins, P.W., 1999, Kimia Fisika, Ed. 2, Erlangga, Jakarta • dll Peraturan di Kelas SIFAT-SIFAT GAS IDEAL (1) Dr. Ifa Puspasari SIFAT-SIFAT GAS • Gas terdiri atas molekul-molekul yang bergerak ke segala arah dengan kecepatan tinggi. • Molekul-molekul gas ini bertumbukan dengan molekul yang lain atau dengan dinding bejana. • Tumbukan dengan dinding bejana ini menyebabkan adanya tekanan. • Volume dari molekul-molekul gas sangat kecil dibandingkan volume yang ditempati. • Banyak ruang kosong antara molekul-molekulnya. • Hal ini menyebabkan gas mempunyai densitas lebih kecil daripada cairan atau padatan. • Hal ini juga yang menyebabkan gas bersifat kompresibel atau mudah ditekan. • Karena molekul-molekul gas bergerak ke segala arah, maka gas yang satu mudah bercampur dengan gas lain (difusi), asal keduanya tidak bereaksi. Sifat-sifat Gas Ideal • Jenis-jenis gas: 1. Gas Ideal: • Gas yang mengikuti secara sempurna hukum-hukum gas (Boyle, Gay Lussac, dsb). 2. Gas Non Ideal atau Nyata: • Gas yang hanya mengikuti hukum-hukum gas pada tekanan rendah. • Sifat-sifat gas ideal: • Dianggap bahwa molekul-molekulnya tidak tarik-menarik • Volume molekulnya dapat diabaikan terhadap volume gas itu sendiri atau ruang yang ditempati. Persamaan Gas Ideal • PV = nRT • P : tekanan • V : volume • n : jumlah mol partikel gas • R : konstanta • T : suhu Tekanan • Tekanan = gaya per satuan luas • Hitunglah tekanan bagian bawah kolom cairan air raksa yang mempunyai ketinggian 76 cm. Densitas air raksa ialah 13,6 g/cm3 atau 13,6 x 103 kg/m3. • P = f/A = W/A = mg/A = ρVg/A = ρg(V/A) = ρgh • Jawaban: 1,01 x 105 Pa • Catatan: 1 Pa = 1 N/m 2 = 1 kg m s2 / m2 = 1 kg m -1 s-2 Tekanan: Satuan • International System of Units (Système international d'unités, SI) • 1 Pa = 1 N m-2 • Satuan lain untuk tekanan gas: atm, Torr, mm Hg, cm Hg • 1 atm = 1,01325 x 105 Pa • 1 atm = 760 Torr = 760 mm Hg = 76 cm Hg • Satuan yang lain: • 1 bar = 1000 mbar = 105 Pa Contoh • Hitunglah tekanan pada sebuah kolom air raksa dengan ketinggian 1 m. Satuan tekanan dalam Pa, atm, Torr, mm Hg. • 1 atm = 760 Torr = 760 mm Hg = 1,01 x 105 Pa • 1 bar = 1000 mbar = 105 Pa Pengukuran Tekanan Gas • Pengukuran tradisional: menggunakan sebuah kolom merkuri/air raksa. • Tekanan barometrik: ketinggian Hg yang diimbangi atmosfer • Pada ketinggian permukaan laut, biasanya 760 mm Hg. Maka, 1 atm = 760 mm Hg • Catatan: tekanan atmosfir bervariasi tergantung pada ketinggian dan kondisi cuaca Contoh • Hitunglah tekanan bawah laut pada kedalaman 50 m. Densitas air = 1 g/mL atau 1 x 103 kg/m3. • P → air = dgh = 4,905 x 105 Pa = 4,84 atm • P → atm = 1,00 atm • Total = 5,84 atm • 1 mm Hg = 13,6 mm H2O Pengukuran Tekanan • Manometer Tertutup Contoh • Gas dihubungkan dengan sebuah manometer tertutup. Jika perbedaan ketinggian Hg adalah 20 cm, berapakah tekanan gas dalam satuan Torr? Pengukuran Tekanan • Manometer Terbuka Contoh • Berapakah tekanan gas seperti digambarkan di bawah jika ujung kanan manometer terbuka ke atmosfir. Hukum Boyle • Volume dari sejumlah tertentu gas pada suhu tetap, berbanding terbalik dengan tekanannya. • Jika PV = nRT, maka untuk jumlah gas tertentu pada suhu tetap, PV = (tetapan)(tetapan)(tetapan) • Isoterm: sebuah kurva dimana setiap titik mewakili kondisi pada suhu yang sama: P1V1 = P2V2 = P3V3 • Pada n, T tetap: P berbanding terbalik dengan V. • Jika P↑, V↓ • Jika P↓, V↑ Contoh • 25 L gas mulanya pada tekanan 1 atm, mengembang menjadi 50 L pada suhu tetap. Hitunglah tekanan akhirnya. Contoh • Manakah di antara empat grafik berikut yang menggambarkan Hukum Boyle? Kuis 1. 2. 3. 4. 5. Berapakah tekanan (dalam satuan atm) pada sebuah kolom air vertikal dengan ketinggian 760 mm? Densitas air 1 g/mL, densitas air raksa (Hg) 13.6 g/mL. Berapakah tekanan (dalam satuan Torr) pada sebuah kolom air raksa vertikal dengan ketinggian 760 mm? Densitas air 1 g/mL, densitas air raksa (Hg) 13.6 g/mL. Gas terhubung dengan sebuah manometer raksa terbuka dan ketinggian cairan pada tabung yang terhubung dengan gas adalah 15 cm lebih rendah daripada tabung yang terbuka ke atmosfir. Tekanan barometrik yang berlaku adalah 755 mm Hg. Berapakah tekanan gas tersebut (dalam satuan Torr)? Gas terhubung dengan sebuah manometer raksa terbuka dan ketinggian cairan pada tabung yang terhubung dengan gas adalah 20 mm lebih tinggi daripada tabung yang terbuka ke atmosfir. Tekanan barometrik yang berlaku adalah 758 mm Hg. Berapakah tekanan gas tersebut (dalam satuan Torr)? Berapakah tekanan akhir suatu gas (dalam satuan Torr), awalnya pada 30 L dan 250 Torr, jika gas tersebut ditekan menjadi 15 L pada suhu tetap?