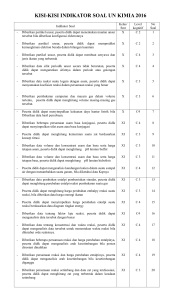
LEMBAR KERJA SISWA (LKS) TETAPAN KESETIMBANGAN Kelompok Anggota 1. 2. 3. : : K I M I A KOMPETENSI DASAR 3.8 Menjelaskan reaksi kesetimbangan di dalam hubungan antara pereaksi dan hasil reaksi 4.8 Menyajikan hasil pengolahan data untuk menentukan nilai tetapan kesetimbangan suatu reaksi INDIKATOR 1. Menuliskan persamaan tetapan kesetimbangan berdasarkan hukum kesetimbangan. 2. Menentukan harga tetapan kesetimbangan konsentrasi (Kc) berdasarkan reaksi-reaksi yang berkaitan. 3. Menentukan harga tetapan kesetimbangan tekanan (Kp) berdasarkan reaksireaksi yang berkaitan. 4. Mempresentasikan hasil diskusi mengenai Kc dan Kp. 5. Menyimpulkan hasil diskusi mengenai Kc dan Kp. Tujuan Pembelajaran 1. Menuliskan persamaan tetapan kesetimbangan berdasarkan hukum kesetimbangan. 2. Menentukan harga Kc berdasarkan konsentrasi zat dalam kesetimbangan. 3. Menentukan harga Kc berdasarkan reaksi-reaksi yang berkaitan. 4. Menentukan harga Kp berdasarkan reaksi-reaksi yang berkaitan. 5. Mempresentasikan hasil diskusi mengenai Kc dan Kp. 6. Menyimpulkan hasil diskusi mengenai Kc dan Kp K I M I A INSTRUKSI : Setiap siswa harus membaca LKS ini dengan sekasama Diskusikan setiap pertanyaan dan permasalahan yang ada dalam LKS ini melalui diskusi dengan sesama anggota kelompok Jika ada pertanyaan atau hal yang tidak dimengerti mintalah bantuan guru untuk menjelaskannya TETAPAN KESETIMBANGAN MENGAMATI Susunan komposisi suatu kesetimbangan dapat berubah bergantung pada kondisi reaksi. Pada percobaan berulang-ulang dengan suhu tetap akan dihasilkan perbandingan konsentrasi yang tetap pula. Pada tahun 1864 Cato Maximillian Gulberg dan Peter Wage menemukan adanya suatu hubungan yang tetap antara konsentrasi komponen dalam kesetimbangan, yang selanjutnya disebut Hukum Kesetimbangan atau Hukum Aksi Massa. Perhatikan tabel berikut dengan teliti! Tabel Susunan kesetimbangan reaksi pembentukan asam iodida pada suhu 445oC dalam volume ruangan 0,8 L berdasarkan reaksi berikut. H2(g) + I2(g) Percobaan 1 2 3 Jumlah mol × 103 (keadaan awal) H2 I2 HI 1,50 1,50 1,50 1,50 1,50 1,50 MENANYA 2HI(g) Jumlah mol × 103 (keadaan setimbang) H2 I2 HI 0,330 0,330 2,34 0,165 0,165 1,17 0,495 0,495 3,51 Konsentrasi M × 103 (keadaan setimbang) [H2] [I2] [HI] 0,412 0,412 2,92 0,206 0,206 1,46 0,619 0,619 4,39 K 50,2 50,2 50,2 Tuliskan hal-hal yang tidak kalian pahami berdasarkan pengamatan di atas (dalam bentuk pertanyaan)! ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ......................... MENGUMPULKAN DATA Tuliskan hipotesis atau jawaban sementara dari pertanyaan yang telah kalian buat! ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... .............................. ................................................................................................................... ........... TETAPAN KESETIMBANGAN Perbandingan tertentu [HI] terhadap [H2] dan [I2] akan memberikan hasil yang konstan untuk setiap percobaan, hal tersebut dapat dilihat dari harga K-nya. Berikut beberapa contoh perbandingan: Contoh : 𝑯𝑰 𝟐 𝑰𝟐 𝑯𝟐 Berdasarkan informasi konsentrasi saat setimbang pada tabel 1, coba kalian rumuskan persamaan lain yang menunjukkan harga perbandingan dari konsentrasi-konsentrasi dalam kesetimbangan seperti contoh, sampai didapatkan harga K yang tetap. Percobaan Coba : 𝐻𝐼 2 Coba : 𝐼2 𝐻2 1. 2. 3. 4. 1. Apakah hasil perbandingan yang menunjukkan harga konstan dipengaruhi oleh koefisien reaksi?...........................Dalam perhitungan, koefisien reaksi digunakan sebagai...........................Persamaan inilah yang disebut dengan konstanta/tetapan kesetimbangan (K). Jadi, tetapan kesetimbangan adalah................................................................................................................... .............................................................................................................................. .............................................................................................................................. .............................................................................................................................. ........................... 2. Perhatikan reaksi berikut: aA + bB → ← cC + dD Tuliskan bagaimana tetapan kesetimbangannya! Jawab: K = _________ Persamaan inilah yang ditemukan oleh Cato Maximillian Gulberg dan Peter Wage pada tahun 1864 yang selanjutnya disebut Hukum Kesetimbangan atau Hukum Aksi Massa. Jadi, Hukum Kesetimbangan atau Hukum Aksi Massa berbunyi: .............................................................................................................................. .............................................................................................................................. .............................................................................................................................. ............................................................ Kc dan Kp Sebelum menentukan bagaimana persamaan Kc dan Kp pada Tabel 1. Jawablah pertanyaanpertanyaan berikut terlebih dahulu! aAB + bCD → ← cAC + dBD Kc =__________ Kc atau konstanta kesetimbangan konsentrasi dapat diartikan sebagai ......................................................................................................................................................... ......................................................................................................................................................... Bagaimana persamaan Kc berdasarkan Tabel 1 ? Kc = _______ Pada persamaan Kc hanya dapat digunakan pada pereaksi dan hasil reaksi yang berwujud gas dan larutan, tidak untuk padatan dan cairan murni mengapa hanya bisa untuk fase gas dan larutan ? ......................................................................................................................................................... ......................................................................................................................................................... Pada sistem kesetimbangan HI, tetapan kesetimbangan dinyatakan dalam perbandingan konsentrasi dalam satuan mol per liter atau disebut Kc. Konsentrasi dalam reaksi kesetimbangan gas juga dapat menimbulkan tekanan tertentu, sehingga tekanan total gas yang ditimbulkan merupakan sumbangan dari tekanan parsial masing-masing gas, yaitu gas HI, gas H2, dan gas I2 ( , dan ). Selain bisa dinyatakan dengan Kc, untuk reaksi kesetimbangan dengan fase gas dapat pula dinyatakan dengan Kp. Dengan demikian, untuk reaksi tersebut dapat dituliskan Kp-nya yaitu: Kp =_______ Konstanta kesetimbangan dapat dinyatakan dengan Kc atau Kp, bergantung pada keadaan atau kebutuhannya. PERTANYAAN! 1. Tentukan rumusan Kc dan Kp untuk reaksi berikut ini : a) 2SO2(g) + O2(g) → ← 2SO3(g) → b) CaCO3(s) ← CaO(s) + CO2(g) c) 2NO(g) + O2(g) → ← 2NO2(g) Jawab: ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ 2. Gas amoniak terurai menjadi gas hidrogen dan nitrogen dengan reaksi sebagai berikut 2NH3(g) → ← N2(g) + 3H2(g) Tekanan parsial gas NH3, N2, dan H2 masing-masing adalah 2,5 atm, 1 atm, dan 2 atm. Tentukan harga tetapan kesetimbangan gas tersebut. Jawab:.................................................................................................................................... ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ 3. Di dalam wadah dengan volume 2 liter dimasukkan 2,5 mol HCl dan dibiarkan mengalami kesetimbangan menurut reaksi: 2HCl(g) → ← H2(g) + Cl2(g) Jika dalam keadaan setimbang terdapat 0,5 mol Cl2, tentukan harga Kc pada reaksi tersebut! Jawab: ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ ................................................................................................................................................ MENGASOSIASI Tuliskan kesimpulan terkait tetapan kesetimbangan, Kc dan Kp yang telah kalian pelajari! ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................................................................................................................... ................ ................................................................................................................... ................ ................................................................................................................... ................ MENGKOMUNIKASIKAN ................................................................................................................... ................ Presentasikan hasil diskusi kelompok kalian di depan kelas! ................................................................................................................... ........... *~*Selamat Bekerja*~*