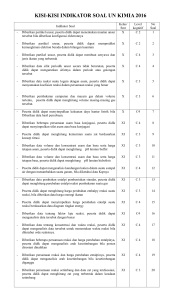
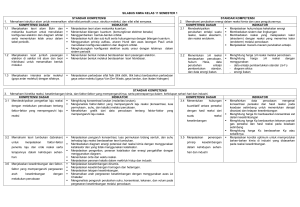
KISI-KISI SOAL UJIAN SEMESTER GANJIL KELAS XI TAHUN 2020 SOAL PILIHAN GANDA 1. Salah satu faktor yang menyebabkan senyawa karbon banyak jumlahnya adalah… 2. Pasangan zat di bawah ini yang merupakan golongan senyawa hidrokarbon adalah… 3. Rumus umum dari C4H6 adalah…. 4. Nama yang tepat dari senyawa ini adalah: 5. Nama yang tepat untuk senyawa ini adalah…. CH C-CH2-CH3 6. Alkana yang tidak mengandung lima atom karbon adalah…. 7. Berikut ini yang bukan merupakan zat yang mengandung senyawa hidrokarbon di dalamnya adalah….. 8. Perhatikan reaksi berikut : 1. CH2=CH2 + Cl2 → CH2ClCH2Cl 2. CH3CH2Cl → CH3CH=CH2 Kedua reaksi tersebut secara berurutan adalah reaksi … 9. Zat yang ditambahkan ke dalam bensin untuk menaikkan bilangan oktan adalah… 10. Yang paling tinggi titik didihnya adalah… 11. Jika Kristal NaOH dilarutkan dalam air maka gelas terasa hangat, reaksi tersebut merupakan…. 12. Entalpi pembentukan NH4Cl(s) pada keadaan standart adalah -314,4 kJ/mol. Persamaan termokimia di bawah ini yang menggambarkan data tersebut adalah…. 13. Perhatikan pernyataan berikut. Agar dihasilkan energi untuk beraktivitas, tubuh kita melakukan metabolisme. Proses tersebut melibatkan pemecahan molekul besar menjadi molekul kecil. Pernyataan yang benar berdasarkan pernyataan berikut adalah . . . . 14. Diketahui persamaan termokimia sebagai berikut: C (g) + 2H2(g) + ½ O2 (g) → CH3OH(g) ∆H= -284 kJ Perubahan entalpi untuk pembentukan 8 gram CH3OH(l) (Mr = 32) adalah…. 15. Peristiwa yang menunjukkan entalpi sistem lebih kecil daripada entalpi lingkungan ditunjukkan oleh nomor . . . . 16. Jika diketahui : ∆Hof H2O (l) = -285,85 kJ mol-1 ∆Hof CO2(g) = -393,5 kJ mol-1 ∆Hof CH4(g) = -74,8 kJ mol-1 maka pada pembakaran 1 mol gas metana (CH4) akan : 17. Diketahui reaksi sebagai berikut : C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) ∆H = -2820 kJ C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H20(l) ∆H = -1380 kJ maka ∆H reaksi pada fermentasi glukosa: C6H12O6(s) → 2C2H5OH(l) +2CO2(g) adalah… 18. Kenaikan suhu umumnya menaikkan reaksi. Alasan yang tepat untuk menjelaskan hal di atas adalah …. 19. Data percobaan untuk reaksi : A + B hasil : Untuk percobaan l dan 4 faktor yang mempengaruhi kecepatan reaksi adalah …. 20. Laju reaksi 2P + 3Q2 2 PQ3 dapat dinyatakan sebagai …. 21. Reaksi: CH3COOC2H5(aq) + H2O(l) CH3COOH(aq) + C2H5OH(aq) Ternyata reaksi ini berorde nol terhadap H2O, maka…. 22. Reaksi akan berlangsung 2 kali lebih cepat dari semula setiap kenaikan temperatur 10oC. Jika pada temperatur 25oC suatu reaksi berlangsung 32 detik maka waktu reaksi pada temperatur 55oC berturut-turut adalah…. 23. Dari percobaan reaksi 2A + B C + D diperoleh data sebagai berikut : No percobaan [A] (M) [B] (M) v (M/sekon) 1. 0,05 0,05 1,0 x 10-3 2. 0,10 0,05 2,0 x 10-3 3. 0,10 0,10 8,0 x 10-3 Persamaan laju reaksi dari percobaan di atas adalah…. 24. Berikut disajikan data percobaan untuk reaksi : mA + nB pC + qD No percobaan [A] (mol L-1) [B] (mol L-1) Laju reaksi (mol L-1.det -1) 1. 0,1 0,1 x 2. 0,2 0,2 8x 3. 0,1 0,3 9x Orde reaksi terhadap A adalah… 25. Diketahui berbagai pernyataan mengenai peran katalis dalam proses reaksi sebagai berikut : (1) Mengubah mekanisme dan hasil reaksi (2) Tidak ikut bereaksi dalam proses reaksi (3) Ikut bereaksi tetapi dapat diperoleh kembali pada akhir reaksi (4) Ikut bereaksi dan tidak diperoleh kembali pada akhir reaksi (5) Menurunkan energi aktifasi Pernyataan yang benar adalah…. 26. Suatu reaksi dikatakan mencapai keadaan setimbang jika…. 27. Di bawah ini yang termasuk kesetimbangan homogen adalah…. 28. Jika tetapan kesetimbangan untuk reaksi A+B ↔ C dan untuk reaksi 2A+D ↔ C berturut- turut adalah 4 dan 8. Maka tetapan kesetimbangan untuk reaksi C+D ↔ 2B adalah.... 29. Katalis adalah suatu zat yang dilibatkan dalam reaksi untuk meningkatkan laju reaksi tetapi pada akhir reaksi akan terbentuk kembali. Adanya katalis dalam kesetimbangan akan…. A. mempengaruhi harga K 30. Pada reaksi : 2NO(g)+ O2(g)↔2NO2(g) ∆H= +150 kJ Kesetimbangan akan bergeser ke kiri apabila…. 31. Reaksi kesetimbangan berikut tidak mengalami pergeseran jika volume diperbesar…. 32. Pada volume tertentu terdapat kesetimbangan 0,05 mol PCl5 dan 0,01 mol PCl3 berdasar reaksi: PCl5(g)↔PCl3(g)+Cl2(g). Maka harga derajat ionisasi PCl5 adalah…. 33. Tetapan kesetimbangan reaksi 2BaO2(s) ⇄ 2BaO(s) + O2(g), diberikan oleh . . . . 34. Tetapan kesetimbangan reaksi 35. Kesetimbangan gas PCl3(g) + Cl2(g) ⇄ PCl5(g) ∆H = + a kJ. Faktor yang dapat memperbesar hasil reaksi atau pembentukan PCl5 adalah . . . . SOAL URAIAN 1. Reaksi 2SO3(g) ↔ 2SO2(g) + O2(g) memiliki harga tetapan kesetimbangan (Kc) sebesar………, maka tentukanlah harga K untuk reaksi kesetimbangan berikut ini! 4SO3(g) ↔ 4SO2(g) + 2O2(g) 2. Tuliskan tetapan kesetimbangan dari reaksi kesetimbangan berikut: 3. Bagaimana pengaruh faktor-faktor berikut terhadap laju reaksi berdasarkan teori tumbukan: a. luas permukaan b. konsentrasi c. suhu d. katalis 4. Diketahui persamaan termokimia sebagai berikut : (1) N2 (g) + 2O2 (g) → 2NO (g) + O2 (g) ∆H = + 180 kJ (2) 2NO (g) + O2 (g) → 2NO2 (g) ∆H = -114 kJ Hitunglah perubahan entalpi untuk reaksi : 5. Diketahui energi ikatan rata-rata: Hitunglah entalpi yang terjadi pada reaksi berikut