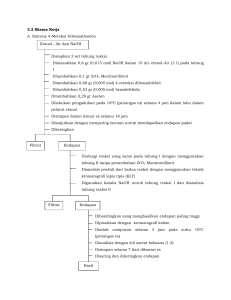
ANALISA GRAVIMETRI MACAM-MACAM DAN METODE ANALISA ANALISA GRAVIMETRI METODA GRAVIMETRI • Bagian dari analisa kuantitatif berdasar penimbangan penimbangan hasil reaksi. volumetri • Analisa kuantitatif konvensional gravimetri Gambaran Reaksi dalam Gravimetri A + bhn yg bereaksi B pereaksi ditimbang C hsl reaksi * sisa bahan * gas * endapan Perbedaan metoda berdasar hasil reaksi Penentuan ∑ gas 1.Cara evolusi *tdk langsung • A + B Gas • A ---- Gas • Dari pencarian gas berat bhn dpt diketahui *langsung gas diserap adsorben ditimbang.(W1) •Wo = brt adsorbn •W1 = Wo + gas yg diserap W = berat gas • 2.Cara pengendpan. *Gravimetri A + B C bhn per end reaksi hsl * End dibentuk secara elektro kimia Elektro Gravimetri • Gravimetri. aA + bB AbBa hasil reaksi * zat dg kelrt << * pengeringan/ pembakaran senyawa dengan susunan stabil & diketahui di tim timbang *Pereaksi B di(+) >> utk menekan kelarutan Syarat endapan gravimetri 1.Kesempurnaan pengendapan • Kelrt endapan << dg mengatur faktor (s) • Pe(+) pereaksi pengendap >>> • (s) f (t) (s) >>> dengan naiknya t • Kepolaran lrt (-) (s) <<, mdh me (s) = kelarutan 2. Kemurnian endapn • Endapan murni bersih dari pengotor (terkontaminasi) Kontaminasi krn adsorbsi, oklusi/terkurung 3. Susunan Endapan • Tertentu, • stabil dlm bentuk terakhir, • diketahui dg pasti. Perhitungan Anal Gravimetri Secara * Stokhiometri dengan * faktor gravimetri (fg) • Faktor gravimetri perbandingan Ar atau Mr (zat,mol) yang dicari terhadap Ar,Mr ( endapan ) akhir yang terbentuk secara stokhiometri. Contoh aplikasi • Pengendapan Cl sbg AgCl 1.NaCl + Ag+ 1.AgCl X = Cl yang kita cari Wo = berat NaCl awal W1 = berat endapan AgCl yang diperoleh 1. Ar (Cl) fg Cl thd endp akhir fg = ------------1. Mr (AgCl) Ar(Cl) Wx = fg x W1 WCl = ---------- x 1/1 x W1 Mr(AgCl) Cl2 + pereaksi 2.AgCl Diperoleh 2 mol AgCl setiap 1 mol Cl2 1. Mr.Cl2 fg Cl2 = ------------- -2. Mr.AgCl Mr.Cl2 fg,Cl2 = ----------- x a/b Mr.AgCl Secara umum Mr.Substan yang dicari fg = ----------------------------------------------- x a/b Mr.Substan yang diendapkan Faktor gravimetri beberapa spesies. spesies Faktor gravimetri SO3 Bentuk endapan BaSO4 Fe3O4 Fe2O3 Mr.Fe3O4/ Fe2O3 x 2/3 Fe Fe2O3 Mr.Fe / Mr.Fe2O3 x 2/3 MgO Mg2P2O7 Mr.MgO / Mr.Mg2P2O7 x 2/1 P2O5 Mg2P2O7 Mr.P2O5 / Mr.Mg2P2O7 Mr.SO3 / Mr.BaSO4 x 1/1 Perhitungan gravimetri Senyawa yang mengalami perubahan struktur 2. Analisa Fe secara gravimetri. Fe di ( )kan sbg Feri hidroksida anhidrid. Endp akhir yg stabil sbg oksidanya, diperoleh dg pe ----- an 1000oC Reaksi yang terjadi pada proses pemanasan • Fe + pereaksi Fe(OH)3nH2O -----100oC Fe(OH)3 + nH2O 900-1000oC • 2Fe(OH)3 ----------------- Fe2O3 + 3H2O stabil 2.Ar.Fe fg Fe = -------------1.Mr.Fe2O3 • Wo = g Fe(OH)3nH2O • W1 = g Fe2O3 fg.W1 • %Fe = ------------- x 100 % Wo Tahap tahap analisa gravimetri 1. 2. 3. 4. 5. 6. Melarutkan sampel Mengatur kondisi larutan (pH, t) Membentuk endapan *endapan Bulky Menumbuhkan kristal endapan Menyaring mencuci Me --- / memijarkan endp stabil, kering, bentuk pasti, spesifik, ber kristal besar. 7. Me ----, menimbang sampai konstant 8. perhitungan Tahap yang perlu diperhatikan Untuk memudahkan langkah (5) endp yg terbentuk diupayakan ber kristal besar/kasar, ? * mengatur (t) kontak endapan dg larutan nya,agar endp tdk terlalu cepat mengendap. Diagram alur analisa gavimetri • Pelarut Bahan *pereaksi pencuci lartn pH,s,t *spesifik endp kasar t endp murni di timbang Pengotoran endapan • Dibedakan dlm bentuk : *True *Co precipition *post ---- Ksp ---- Adsorb endp ---- pengendpn berlanjut contoh a) Fe, Al me sbg M(OH)n (Ksp kedua berdekatan). c) Ca2+, Mg2+ pada pengendapan dg oksalat Ca oksalat me ( ), disusul Mg oksalat b) Fe3+ terdapat ber sama Mg2+ (teradsorb dlm bhn) Mg(OH)2 ikut teren dapkan. Ca2+ + C2O4= lambat CaC2O4 Harga Ksp No 1 2 3 4 5 6 Senyawa Fe (OH)3 Al(OH)3 Mg(OH) 3 CaC2O4 MgC2O4 BaC2O4 KsP 4.10-38 2.10-32 10.10-11 2,6.10-9 9.10-5 2,8.10-8 Pencucian endapan *) (-) kotoran yang teradsobsi *) mendapatkan endapan murni Dlm pencucian sedikit banyak akan melarutkan larutan pencuci perlu pemikiran . Larutan pencuci • # untuk endapan yg sukar larut / sdkt larut dalam air panas pencuci dpt dipakai air panas. Keuntungan pencucian air panas. • Melarutkan kotoran • Me(-) adsorbsi • Memperlancar dlm penyaringan. • # larutan pencuci dingin, * (+) ion senama dari endapan untuk mengurangi pengionan endapan. * (+) bahan organik untuk me(-) kepolaran air pencuci * (+) larutan elektrolit mencegah peptisasi : peruraian kembali gumpalan koloid menjadi butiran koloid sulit dalam penyaringan. EFISIENSI PENCUCIAN ENDAPAN Porsi vol pencuci kecil, n x pencucian lebih efektif n>1 Vr Cn = ( ---------------- )n . Co V + Vr • Cn = kotoran tertinggal di endapan • Co = kotoran awal yang ada di endapan • n = jumlah kali pencucian • Vr = vol pencuci yang tertinggal di endapan setiap kali pencucian • Vo = vol pencuci tersedia untuk pencucian endapan. Contoh tersedia air pencuci 20 ml Mhs A mencuci 1 x pencucian , vol 20 ml/cuci Mhs B mencuci 4 x pencucian = vol 5 ml/cuci Vol pencuci tertinggal di endapan setiap kali pencucian adalah 0,5 ml. Misal kotoran awal 0,1 gr Berapa kotoran tertinggal di endapan setelah pencucian, mhs A : 0,5 Cr = ( ---------------) 20 + 0,5 1 x 0,1 = 2,4 x 10-3 gr kotoran sisa mhs B : 0,5 Cr = (--------------)4 x 0,1 = 6,6 x 10-6 gr 5 + 0,5 kotoran sisa Kelebihan / kekurangan Analisa Gravimetri *(+) tidak perlu standardisasi pereaksi total luama (awal kerja lprn *(-) 1.waktu kerja pendek 2. bahan sampel harus banyak, Contoh analisa gravimetri 1. 0,4825 gr Bijih besi dilarutkan dkm asam mineral sampai Fe teroks Fe3+ , di endapkan sbg Fe(OH)3xH2O endp disaring, cuci, pijarkan t= 1000oC sampai diperoleh endapan akhir yang konstant dalam bentuk oksidanya. diperoleh berat 0,2481 gr hitung % Fe dalam bijih besi. Penyelesaian soal Alur kerja : H+ Fe3+ (+) pereaksi Fe(OH)3xH2O Wo = 0,4852 gr t 1000 oC Fe2O3 Tulis perubahan kimia pada proses pemijaran 2x55,85 fg(Fe) = --------------- = 0,6983 159,96 %Fe = fg`x W1`/ Wo`x 100% 0,2481 0,6983 x ------------- x 100 % 0,4852 = 35,70 % Contoh.2 Berapa Fe3O4 harus anda siapkan untuk menghasilkan 0,5430 gr Fe2O3 pada nalisa Gravimetri. Penyelesaian soal : Perubahan reaksi yg terjadi: 2 Fe3O4 + ½ O2 3 Fe2O3 2 mol 3 mol 2.Mr Fe3O4 0,5430 x --------------------- = 0,5249 gr Fe3O4 3.Mr Fe2O3 Contoh 3 Berapa mL larutan Barium klorida yg mengandung 90 gr BaCl2.2H2O / liter dibutuhkan untuk mengendapkan sulfat BaSO4 dari 10 gr Na2SO410H2O murni Penyelesaian : 1 Ba 2+ + 1 SO4= 1 mol Ba ion dari 1 mol BaCl2.2H2O (244) bereaksi dg 1 mol SO4= dr Na2SO410H2O (322) Mr.BaCl2.2H2O (244) 10 x ----------------------------------------- = 10 x--------- = 7,58 Mr.Na2SO410H2O (322) Krn tiap mL reagen mengandung 0,09 gr mL yg diperlukan = 7,58/0,09 = 84,2 mL Pereaksi pengendap organik Peranan pereaksi organik : *Pereaksi org berstruktur ukrn besar (pereaksi yg mampu membentuk khelat) endapan bersifat spesifik *Selektiv (krn faktor sterik pereaksi) -) 8.hidroquinolin mengendapkan Al -) 2.metil / 3.metil hidroquinolin tdk mampu mengendapkan *Endapan ditimbang sbg oksida nya. Kriteria pemilihan pereaksi organik * bersifat selektif * Tidak mengandung pengotor kopresipitasi dan endapan ionik lain. * Endp Bulky terbentuk mikro/semimikro * Dapat dimodifikasi dengan penambahan rantai / gugus Cupferron dan Neocupferron Kendala pelarut organik: Kelarutan pereaksi dlm air kecil, sulit mendapat pelarut yang murni. PR : 1. Sampel batuan row material Pabrik Semen diperkirakan hanya mengandung Ca & Mg sebagai garam Carbonat Pada pemijaran diperoleh endapan akhir keduanya sebagai garam oksidanya dan beratnya tepat ½ berat bahan sampel mula mula. hitung berapa % Ca dan Mg di row material tersebut. Berapa perbandingan dua senyawa tersebut sbg garam carbonat. 2. Dari analisis mineral diperoleh % oksida Spt dalam tabel : Mineral oksida % CaO MgO 45,18 8,10 FeO SiO2 CO2 H2O 4.0 6,02 34,67 2,03 Total % = 100 % Pada pemanasan dg Oksigen bahan kehilangan air dan kadar CO2 tinggal 3,3 %, besi mengalami oksidasi menjadi besi (III). Hit : % mineral yang ada setelah pemanasan. mineral stlh -----, CaO,MgO,SiO2,Fe2O3,CO2 Thermogravimetri Perubahan berat berdasar rekasi kimia dalam pembakaran / pemijaran pada analisa gravimetri di kenal Thermogravimetri. Contoh pada pemijaran Ca Oksalat dari suhu 100 oC 800 oC sehingga diperoleh bentuk Senyawa stabil sebagai oksida Ca. Perubahan yg terjadi : t: 100 – 250 400-500 700 - 800 CaC2O4.Ha2O CaC2O4 CaCO3 CaO + + + H2O CO2 CO2 Penentuan komponen dalam suatu campuran dg thermogravimetri, harus dibandingkan terhadap thermogram komponen murninya dapat dibandingkan perubahan berat campuran dan yang murni berat komponen dalam campuran dapat diketahui. % perub W camprn %W komp A = ------------------------------------ x 100% % perub W komp murni 10 H2O 8 mg x10 6 TERMOGRAM.1 CaC2O4.x.H2O. co 4 2 CO2 CaC2O4 x Ha20 CaC2O4 + x H2O CaC2O4 CaCO3 + CO CaCO3 CaO + CO2 ToC x 100 2 4 6 8 10 10 A TERMOGRAM.2 camp MgCO3&CaCO3 8 B X 10 mg 5 CaCO3 murni C 4 campuran 3 MgCO3 murni 1 T oCx100 1 5 7 8 10 Dari thermogram 2, terlihat CaCO3 murni 800oC pada pe ----------- hilang berat 44 % 450oC Sedang MgCO3 murni pada ---------- hilang berat 52% Bila sampel C(limestone) berat awal 65 mg Diketahui terjadi penurunan berat pada 450oC 56 gr, dan pada pemanasan 900oC Kehilangan berat 36 gr Hitung : a)dari penjabaran reaksi berapa sampel yang hilang, b)% komposisi campuran Penyelesaian a): CaCO3 ----- CaO + CO2 BF = 100 (g) o 800 C Kehilangan berat pada ------- = 0,44 x 100 = 44 44 ini setara dg BF hasil reaksi (CO2) 450oC MgCO3 -------- MgO + CO2 (g) BF = 84,3 Kehilangan berat pada 450 oC = 0,52 x 84,3 = 44 44 setara dengan BF (CO2) hasil reaksi pemanasan baik CaCO3 maupun MgCO3 b). Kehilangan berat MgCO3 65 -56 = 9 mg % kehilangan berat = 9/65 x 100% = 14 % kehilangan berat CaCO3 56 – 36 = 20 mg % kehilangan berat = 20/65 x100% = 30,8 % komposisi limestone : % komp CaCO3 = 30,8/44 x 100% = 70 % % komp MgCO3 = 14/52 x 100% = 27 % % inert = 100 – (70 + 27) = 3%