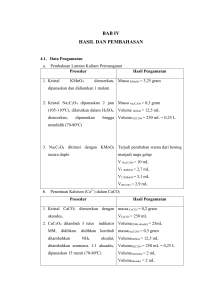
LAPORAN PRAKTIKUM IDENTIFIKASI DAN SINTESIS SENYAWA ORGANIK REAKSI ELIMINASI Nama : Tsania Ghany Dahlan NRM : 1303618059 Kelompok : 7 Dosen Pengampu : Dra. Zulmanelis, M.Si Asisten Dosen : 1. Rizkahana Syehfia (3315160639) 2. Nehemia Yudhi Saputra (3315162716) Tanggal Pengumpulan Nilai 9 Juni 2020 PENDIDIKAN KIMIA B 2018 FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI JAKARTA 2020 REAKSI ELIMINASI I. TUJUAN PERCOBAAN 1. Dapat memahami reaksi eliminasi sintesis sikloheksena dari sikloheksanol. 2. Dapat memahami prosedur pemurnian dari hasil sintesis. 3. Dapat mengidentifikasi senyawa ikatan rangkap dengan reaksi oksidasi KMnO4 II. DASAR TEORI Alkohol merupakan suatu kelompok senyawa yang mengandung satu atau lebih gugus fungsi hidroksil (-OH) pada senyawa alkana. Alkohol memiliki rumus umum R-OH yaitu alkil alifatik ataupun siklik yang mengikat gugus -OH. Alkohol dapat diubah dari dan ke banyak tipesenyawa lain. Reaksi dengan alkohol akan menghasilkan 2 macam senyawa. Reaksi tersebut dapat menghasilkan senyawa yang mengandung ikatan R-O atau menghasilkan senyawa yang mengandung ikatan O-H (Fessenden, 1998). Alkohol berdasarkan jenisnya dapat dibedakan menjadi tiga jenis yaitu alkohol primer, sekunder, dan tersier. Alkohol primer yaitu alkohol yang memiliki gugus -OH yang terletak padaatom C primer yang terikat langsung pada satu atom karbon yang lain. Contohnya adalah n-oktanol. Alkohol sekunder merupakan alkohol yang memiliki gugus -OH yang terletak pada atom C sekunder yang terikat pada 2 atom C yang lain. Contohnya adalah sikloheksanol Alkohol tersier adalah alkohol yang memiliki gugus -OH yang terletak pada atom C tersier yang terikat langsung pada 3 atom C yang lain. Contohnya adalah 2-metil-2-heksanol. (Suminar, 1990). Alkohol termasuk senyawa penting dalam kehidupan sehari-hari karena dapat digunakan sebagai zat pembunuh kuman, bahan bakar, maupun pelarut berbagai zat. Alkohol digunakan sebagai pelarut dan reagensia dalam dunia industri. Alkohol mempunyai titik didih yang lebih tinggi dibandingkan alkana dengan jumlah atom C yang sama, karena molekul alkohol dapat membentuk ikatan hidrogen. Kelarutan alkohol dipengaruhi oleh panjang pendeknya gugus alkil yang dimiliki, banyaknya cabang, dan banyaknya gugus hidroksil yang terikat pada atom karbon yang berkaitan dengan kekuatan ikatan hidrogen. Pengaruh banyaknya cabang pada kelarutan alkohol yaitu semakin banyak cabang, maka semakin rendah titik didihnya (Suminar, 1990). Alkena termasuk golongan hidrokarbon yang memiliki satu atau lebih ikatan rangkap dua antara dua atom C yang berdampingan. Alkena juga sering disebut sebagai hidrokarbon tak jenuh. Alkena mempunyai dua jenis ikatan yaitu ikatan sigma (σ) dan ikatan phi (π). Alkena merupakan senyawa yang dibandingkan relatif stabil, tetapi lebih reaktif jika dengan alkane karena pada alkena terdapat ikatan rangkap antar karbon- karbon (C=C). Ikatan rangkap pada alkena memiliki kekuatan yang lebih dari ikatan tunggal pada alkana. Reaksi pada alkena sebagian besar terjadi pada ikatan rangkap yang dimilikinya dan dua ikatan tunggal akandihasilkan (Wade, 2006). Alkohol dapat mengalami reaksi eliminasi membentuk alkena yaitu dengan hilangnya gugus -OH dari suatu karbon dan H dari karbon di dekatnya. Reaksi eliminasi alcohol melepaskan H2O yang disebut juga sebagai reaksi dehidrasi. Dehidrasi alkohol membutuhkan suatu katalis asam dan panas. Asam sulfat (H2SO4) dan Asam fosfat (H3PO4) adalah katalis asam yang umum digunakan. Katalis ini tidak hanya bersifat asam, tetapi juga merupakan agen pengoksidasi kuat. Katalis ini mengoksidasi beberapa alkohol menjadi karbon dioksida dandisaat yang sama tereduksi dengan sendirinya menjadi sulfur oksida. Contoh reaksi dehidrasi alkohol dengan katalis asam sulfat yaitu : Asam sulfat pekat merupakan sebuah katalis sehingga biasanya dituliskan diatas tanda panahbukan disebelah kanan atau kiri persamaan reaksi (Wade, 2006). Dehidrasi alkohol dimulai dengan asam yang melakukan protonasi, mengubah gugus pergi (leaving group) yang buruk yaitu -OH menjadi gugus pergi yang baik yaitu H2O. H2O akan pergi meninggalkan karbokation. Basa pada campuran (air adalah basa pada konsentrasi H2SO4 tertinggi), memindahkan satu proton dari karbon β (karbon yang berdekatan dengan karbokation) membentuk alkena dan katalis asam akan terbentuk kembali. Reaksi dehidrasi alkohol termasuk dalam reaksi E1. Ketika lebih dari 1 produk terbentuk, maka produk mayor adalah alkena yanglebih tersubtitusi karena alkena yang lebih tersubtitusi sifatnya lebih stabil(Bruice, 2001). Dehidrasi alkohol 2° dan alkohol 3° adalah reaksi E1 (eliminasi 1) yangmelibatkan pembentukan karbokation, sedangkan dehidrasi alkohol 1° adalah reaksi E2 (eliminasi 2). Reaksi E2 terjadi pada satu tahap, yaitu tahappertama asam akan memprotonasi oksigen dari alkohol, proton diambil olehbasa (H2SO4-) dan secara simultan membentuk ikatan rangkap karbon-karbon (C=C) melalui hilangnya molekul air (Hoffman, 2004). Hilangnya H2O diikuti dengan hilangnya proton akan menghasilkan alkena. Kesetimbangan diarahkan ke kanan dilakukan dengan destilasi produk darireaksi campuran atau penambahan suatu agen dehidrasi untuk menghilangkan air. Alkohol dicampurkan dengan asam sebagai agen dehidrasi, kemudian dididihkan. Alkena mendidih pada suhu yang lebih rendah daripada alkohol karena adanya ikatan hidrogen pada alkohol. Alkena adalah hasil dari destilasi (Wade, 2006). Contohnya yaitu etanol dipanaskan bersama dengan asam sulfat berlebihan pada suhu 170oC. Gas-gas yang dihasilkan dilewatkan kedalam larutan natrium hidroksida untuk menghilangkan karbondioksida dan sulfur dioksida yang dihasilkan dari reaksireaksisampingan. Etena yang dihasilkan terkumpul diatas air. Reaksi dehidrasi alkohol yang menghasilkan lebih dari satu produk, maka hasil utama dapat diramalkan berdasarkan kaidah Zaitsev yaitu alkena yang lebih tersubstitusi dihasilkan lebih banyak daripada alkena yang kurang tersubstitusi (Hoffman, 2004). Mekanisme Reaksi Mekanisme reaksi sintesis yang mungkin terjadi dalam percobaan ini adalah: Step 1 Step 2 Step 3 III. ALAT DAN BAHAN a. Alat: 1. Labu dasar bulat 100 ml 2. Kondensor 3. Temometer 4. Labu erlenmeyer 200 ml 5. Gelas piala 250 ml 6. Pemanas 7. Botol semprot 8. Corong 9. Kertas saring 10. Pipet 11. Neraca analitik 12. Gelas ukur 5 m b. Bahan: 1. 2. 3. 4. 5. 6. 7. Sikloheksanol 20 ml H2SO4 pekat 1 mL NaCl jenuh CaCl2 anhidrat secukupnya KMnO4 secukupnya Aquades Es batu secukupnya 1 buah 1 buah 1 buah 2 buah 3 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah 1 buah IV. PROSEDUR EKSPERIMEN Tujuan dari percobaan ini adalah mempelajari reaksi dehidrasi suatu alkohol untuk menghasilkan senyawa berikatan rangkap dan dapat mengidentifikasi ikatan rangkap (alkena) menggunakan reagen KMNO4. Reaksi dehidrasi didefinisikan sebagai reaksi yang melibatkan pelepasan air (H2O) atau molekul yang bereaksi. Reaksi dehidrasi merupakan bagian dari reaksi eliminasi karena gugus hidroksil adalah gugus pergi yang buruk oleh karena itu pemberian katalis asam bronsted sering kali membantu protonasi atau pengambilan proton oleh basa sehingga gugus hidroksil menjadi gugus pergi yang baik yaitu H2O. Dehidrasi dilakukan dengan cara memanaskan alkohol dalam asam dan katalis yang digunakan dalam percobaan ini yaitu asam sulfat, hasil reaksi dikeluarkan melalui proses destilasi. Campuran reaksi akan terdiri dari campuran azeotrop dari sikloheksena, air, dan sedikit bahan-bahan lain yang mempunyai titik didih tinggi. Berikut merupakan prosedur dari sintesis sikloheksena dari sikloheksanol : 1. Siklohekasanol sebanyak 20 ml dimasukkan ke dalam labu dasar bulat 100 mL serta batu didih. Sikloheksanol digunakan dalam percobaan ini karena sikloheksanol mengandung gugus hidroksil (-OH) yang termasuk golongan alkohol sehingga dapat dilakukan dehidrasi alkohol yang akan menghasilkan alkena. Penggunaan batu didih pada proses destilasi dimaksudkan untuk mempercepat proses pendidihan sampel dengan menahan tekanan atau menekan gelembung panas pada sampel serta menyebarkan panas yang ada ke seluruh bagian sampel. 2. 1 mL H2SO4 pekat ditambahkan secara perlahan melalui dinding labu kemudian diaduk hingga homogen. Penambahan asam sulfat dilakukan tetes demi tetes karena menghindari letupan atau ledakan yang dapat ditimbulkan dari reaksi antara asam sulfat pekat dengan sikloheksanol. Reaksi ini merupakan reaksi eksoterm karena pada saat pencampuran, sistem menghasikan panas. H2SO4 pekat pada suhu tersebut juga bersifat sebagai pengoksidasi kuat dan asam sulfat pekat ini digunakan untuk mengubah –OH menjadi gugus pergi yang baik dengan cara protonasi. Reaksi yang terjadi yaitu gugus hidroksil akan terlepas dan atom hidrogen dari karbon terdekatnya juga terlepas yaitu atom H pada atom C nomer 2 membentuk H2O. Zat yang terbentuk adalah alkena karena 2 ikatan kovalen dari 2 atom C yang bersebelahan telah putus,kemudian menjadi ikatan rangkap. Penarikan molekul air dari alkohol diperlukan suatu zat yangbersifat dehidrator misalnya asam sulfat pekat (H2SO4). Gugus –OH pada sikloheksanol menyerang H+ pada H2SO4. Serangan ini terjadi karena adanya transfer proton dari atom O. -OH merupakan gugus pergi yang buruk sehingga harus diubah menjadi gugus pergi yang baik. Penambahan asam dapat mengubah -OH menjadi H2O yang merupakan gugus pergi baik. Reaksi ini disebut dehidrasi alkohol karena alkohol yang bereaksi dengan asam akan berubah menjadi gugus alkena (sikloheksena). Penambahan H2SO4 menyebabkan larutan yang semula tidak berwarna berubah menjadi hijau kekuningan yang kemudian berubah menjadi hitam pekat. 3. Labu tersebut dipasang pada rangkaian alat distilasi dan campuran dipanaskan hingga mendidih. Metode pemisahan ini yaitu destilasi sederhana. Distilasi sederhana adalah teknik pemisahan berdasarkan perbedaan titik didih. Sikloheksena memiliki titik didih sebesar 83OC dan lebih rendah dari sikloheksanol (161OC), air (Td=100OC), dan sisa asam sulfat (337OC). Sehingga sikloheksena pertama kali menetes sebagai destilat. Campuran sikloheksanol dengan asam sulfat yang dipanaskan bertujuan untuk mempercepat dan menyempurnakan reaksi. 4. Erlenmeyer disiapkan yang telah disimpan dalam penangas es untuk menampung distilat. Destilat ditampung didalam Erlenmeyer yang telah ditempatkan di penagas es. Penggunaan penangas es untuk mendinginkan destilat agar tak terjadi penguapan. 5. Distilat yang keluar dari kondensor ditampung dan dihentikan pemanasan saat dalam labu terdapat sekitar 5 mL campuran reaksi. Proses destilasi berakhir saat diperoleh destilat sebanyak 5 ml. 6. Campuran dari produk dicuci dengan larutan NaCl jenuh dan fasa organik dipisahkan ke dalam Erlenmeyer NaCl untuk menetralkan sisa-sisa asam dari katalis H2SO4. NaCl merupakan larutan polar yang berfungsi untuk mencuci campuran sehingga senyawa selain sikloheksena yaitu air dan sedikit bahan-bahan lain akan terikat dengan NaCl. Sikloheksena bersifat non polar dan NaCl bersifat polar maka akan terbentuk dua fasa, dimana air memiliki berat jenis air (1000 kg/m3) lebih berat dibandingkan sikloheksena (82,143 kg/m3). Pemisahan fasa organik dengan mengambil sikloheksena yang berada di fasa atas. 7. Larutan dikeringkan dengan menambahkan CaCl2 dan didekantasi padatan CaCl2 Tujuan penambahan CaCI2 untuk menyerap air yang masih terkandung di dalam larutan sikloheksena sehingga setelah dilakukan penyaringan, filtrat yang diperoleh adalah murni larutan sikloheksena Dekantasi untuk memisahkan endapan CaCl2 ang mengandung air dengan sikloheksena murni. Dekantasi adalah proses pemisahan zat pada yang tidak ikut terlarut di dalam pelarutnya dengan cara dituangkan, sehingga cairan tersebut akan terpisah dari zat padat yang tercampur 8. Produk yang terbentuk ditimbang dan di ukur indeks biasnya. Simpan produk untuk digunakan pada eksperimen berikutnya! Cara untuk menguji kemurnian dari sikloheksena adalah dengan mencari indeks biasnya menggunakan alat refraktrometer. Refraktometer adalah sebuah alat yang biasa digunakan untuk mengukur kadar/konsentrasi bahan atau zat terlarut. Cara penggunaan refartrometer sebagai berikut: Pertama, day light plate dibuka menggunakan ibu jari. Kedua, refraktometer ditetesi dengan aquades atau larutan NaCl 5% pada bagian prisma dan day light plate. Ketiga, sampel cairan diteteskan pada prisma 1-3 tetes. Keempat, skala kemudian dilihat di tempat yang bercahaya dan dibaca skalanya. Kelima, setelah digunakan, prisma dan day light plate dibersihkan dengan aquades. Keenam, refraktometer disimpan kembali di dalam box atau wadah. (Mulyono, 1997). Kemudian, nilai indeks bias yang ditujukan pada refraktometer dibandingkan dengan indeks bias pada literatur Uji Kualitatif Alkena 1. Sikloheksena diambil sebanyak 5 tetes dan ditambahkan tetes demi tetes larutan KMnO4 1 % sambal digoyangkan. Sikloheksena yang dihasilkan dari destilat tersebut diidentifikasi ikatan rangkap dengan reaksi oksidasi menggunakan KMnO4. Penambahan KMnO4 merupakan uji ketidakjenuhan yang bertujuan untuk mengetahuiada tidaknya ikatan rangkap C=C 2. Hasil uji KMnO4 dibandingkan terhadap sikloheksanol, benzena, dan sikloheksana. Reaksi yang terjadi saat penambahan KMnO4 adalah reaksi oksidasi karena KMnO4 ditambahkan untuk mengoksidasi senyawa. KMnO4 digunakan karena KMnO4 merupakan agen pengoksidasi kuat yang mampu mengoksidasi ikatan rangkap. Hasil yang diperoleh ketika sikloheksena ditambahkan KMnO4 adalah sampel terbentuk endapan hitam dan larutan keruh. Berikut ini adalah mekanisme reaksinya: Hasil dari sikloheksena tersebut dibandingkan dengan sikloheksanol dan benzena. - Pencampuran sikloheksena dengan KMnO4 akan menghasilkan hilangnya warna ungu dari KMnO4 dan terbentuknya endapan coklat MnO2. . Hal ini menandakan sikloheksena (hidrokarbon tidak jenuh) telah teroksidasi menjadi sikloheksana1,2-diol dan terbukti bahwa hidrokarbon ini memiliki ikatan rangkap. OH + - KMnO4 + MnO2 + KOH OH Hasil yang diperoleh dari sikloheksanol menunjukkan hasil yang negatif yaitu tidak menghasilkan endapan coklat kehitaman atau warna tetap menjadi ungu saat ditambahkan KMnO4. Hal tersebut terjadi karena struktur dari sikloheksanol yang tidak memiliki ikatan rangkap sehingga tidak dapat bereaksi dengan KMnO4. Berikut ini adalah persamaan reaksinya: - Pencampuran benzene dengan KMnO4 akan menghasilkan larutan berwarna ungu, karena warna ungu dari KMnO4 masih terlihat yang menandakan bahwa tidak adanya reaksi oksidasi antara larutan KMnO4 dengan n-heksana. V. DAFTAR PUSTAKA Bruce, L Berg. 2001. Qualitative Research Methods For The Social Sciences. United State Of Amerika: California State University. Fessenden, J. Ralph. 1998. Dasar-dasar Kimia Organik. Jakarta : Binarupa Aksara. Hoffman, Robert, V. 2004. Organic Chemistry Second Edition. New Jersey : John Wiley & Sons.Suminar, A. 1987. Kimia Dasar Prinsip dan Terapan Modern Edisi keempat Jilid 2 Jakarta:Erlangga. Mulyono. 1997. Kamus Pintar Kimia. Jakarta: Erlangga Tim Penyusun Petunjuk Praktikum Sintesis Senyawa Organik. 2014. Petunjuk Praktikum Sintesis Senyawa Organik. Fmipa unej: Jember.Wade, L.G, Jr. 2006. Organic Chemistry Sixth Edition. California : Pearson Prentice Hall