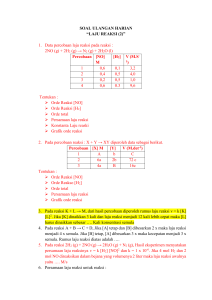
KUIS ENERGI IKATAN 1. Data energi ikatan : C = C = 611 kJ/mol C – H = 414 kJ/mol H – Cl = 431 kJ/mol C – Cl = 339 kJ/mol C – C = 347 kJ/mol Berdasarkan data energi ikatan, maka perubahan entalpi pada reaksi C2H4 + HCl → C2H5Cl adalah…kJ. a. +46 b. -46 c. -58 d. -138 e. -148 2. Jika energi ikatan rata-rata dari : C = C = 146 kkal/mol C – C = 83 kkal/mol C – H = 99 kkal/mol C – Cl = 79 kkal/mol H – Cl = 103 kkal/mol Maka perubahan entalpi pada adisi etena dengan asam klorida menurut persamaan a. 510 kkal b. -72,8 kkal c. -12 kkal d. 12 kkal e. 510 kkal adalah sebesar…. 3. Pada reaksi : Energi ikatan C=O, H=O, dan O=O berturut-turut adalah 243 kJ/mol, 432 kJ/mol, dan 335 kJ/mol. Energi ikatan rata-rata C – H adalah…. a. 194,75 kJ/mol b. 358,75 kJ/mol c. 804,5 kJ/mol d. 595,00 kJ/mol e. 599,50 kJ/mol 4. Diketahui data energi ikatan rata-rata sebagai berikut : H – H = 436 kJ/mol ; Cl – Cl = 242 kJ/mol ; dan H – Cl = 431 kJ/mol Kalor yang diperlukan untuk menguraikan 146 gram HCl menjadi unsur-unsurnya adalah… a. 92 kJ b. 184 kJ c. 247 kJ d. 368 kJ e. 494 kJ 5. Diketahui entalpi pembentukan H2O(g) = -242 kJ/mol, energi ikatan H –H = 436 kJ/mol dan energi ikatan dalam molekul oksigen adalah 495 kJ/mol. Energi ikatan O – H dalam air adalah…. a. 1173 kJ/mol b. 925,5 kJ/mol c. 804,5 kJ/mol d. 586,5 kJ/mol e. 402,25 kJ/mol 6. Perhatikan reaksi berikut : H2 + ½ O2 → H2O ΔH = -242 kJ Energi ikatan H – H dan O = O masing-masing 436 kJ/mol dan 500 kJ/mol, maka energi ikatan rata-rata H – O adalah…Kj a. 121 b. 222 c. 363 d. 464 e. 589 7. Diketahui energi ikatan : N – H = 351 kJ/mol N ≡ N = 945 kJ/mol H – H = 433 kJ/mol Kalor penguraian NH3 menjadi unsur-unsurnya menurut reaksi : 2NH3 → N2 + 3H2 adalah….kJ/mol a. -97 b. +97 c. -194 d. +194 e. -138 8. Nilai energi ikatan rata-rata untuk beberapa ikatan diberikan pada tabel berikut. Ikatan Energi Ikatan (kJ mol–1 ) C–H 410 C–Cl 330 Cl–Cl 243 H–Cl 432 CH3Cl(g) + Cl2(g) → CH2Cl2(g) + HCl(g) Nilai entalpi reaksi di atas adalah .... (A) –109 kJ mol–1 (B) +109 kJ mol–1 (C) –218 kJ mol–1 (D) +218 kJ mol–1 (E) +323 kJ mol–1 9. Gas metanol dapat terbentuk melalui reaksi reduksi gas formaldehid (HCHO) oleh gas hidrogen menurut reaksi berikut. HCHO(g) + H2(g) → CH3OH(g) Jika diketahui entalpi reaksi reduksi tersebut adalah 9 kJ mol–1 dan energi ikatan rata-rata C–H, C=O, O–H, dan H–H berturut-turut adalah 416, 799, 463, dan 432 kJ mol–1, nilai energi ikatan rata-rata C–O adalah .... (A) 143 kJ mol–1 (B) 243 kJ mol–1 (C) 253 kJ mol–1 (D) 343 kJ mol–1 (E) 361 kJ mol–1 10. Data nilai energi ikatan rata-rata diketahui sebagai berikut. Ikatan Energi Ikatan (kJ mol–1 ) C–H 410 C–F 485 F–F 159 H–F 565 Jika entalpi reaksi : CHF3 (g) + F2(g) → CF4 (g) + HF (g) Nilai entalpi reaksi di atas adalah .... (A) –481 kJ mol–1 (B) +481 kJ mol–1 (C) –962 kJ mol–1 (D) +962 kJ mol–1 (E) +1202 kJ mol–1 KUNCI 1. Pembahasan : Struktur ikatan : Maka : ΔH reaksi = energi pemutusan ikatan – energi pembentukan ikatan = ( 2.698 – 2.756) kJ/mol = -58 kJ/mol 2. Pembahasan : ΔH reaksi = energi pemutusan ikatan – energi pembentukan ikatan = ( 645 – 657) = -12 kkal Jawaban : C 3. Pembahasan : 4. Jawaban : D Pembahasan : HCl → ½ H2 + ½ Cl2 ΔH HCl = (1 x H – Cl) – (½ x 436 + ½ x 242) = 431 – (218 + 121) = 431 – 339 = 92 kJ untuk 1 mol HCl = = 4 mol Q = ΔH x mol = 92 x 4 = 368 kJ 5. Jawaban : E Pembahasan : 2H2 + O2 → 2H2O 2 (H – H) + O = O → 2 (H – O – H) Reaktan : 2 (H – H) = 2 x 436 = 872 O = O = 495 Total = 1.367 Produk : 4xO–H ΔH = Reaktan – Produk -242 = 1.367 – 4 (O – H) 4 (O – H) = 1.367 + 242 4 (O – H) = 1.609 O – H = 1.609/4 O – H = 402,25 kJ/mol 6. Jawaban : D Pembahasan : ΔH = (H – H + ½ O = O) – H – O – H -242 = (436 + 250) – H – O – H H – O – H = 686 + 242 H – O – H = 928 H – O = 464 7. Jawaban : E Pembahasan : 8. Entalpi reaksi (∆H) = total energi pemutusan ikatan (ruas kiri) – total energi pembentukan ikatan (ruas kanan) Jawaban yang tepat A. 9. Diketahui: C–H = 413 C=O = 799 O–H = 463 H–H = 436 Jawaban yang tepat D. 10. Pembahasan Soal Nomor 36 Kode: 403 Entalpi reaksi (∆H) = total energi pemutusan ikatan (ruas kiri) – total energi pembentukan ikatan (ruas kanan) Jawaban yang tepat A.