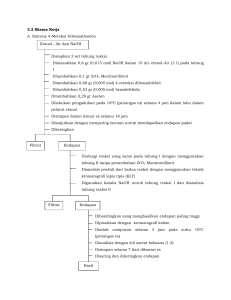
BAB I PENDAHULUAN 1.1 Latar Belakang Banyak sekali reaksi yang digunakan dalam analisis yang melibatkan pembentukkan endapan. Endapan adalah zat yang memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan mengkin berupa kristal (kristalin) atau koloid, dan dapat dikeluarkan dari larutan dengan penyaringan atau pemusingan (centrifuge). Endapan terbentuk jika larutan menjaditerlalu jenuh dengan zat yang bersangkutan. Kelarutan bergantung pada berbagaikondisi, seperti suhu, tekanan, konsentrasi bahan-bahan lain dalam larutan itu, dan pada komposisi pelarutnya.Garam dikromat mengandung anion dikromat, Cr2O72- Mereka adalah oksoanion dari kromium dengan tingkat oksidasi +6. Mereka adalah oksidator yang cukup kuat. Dalam larutan akuatik, ion kromat dan dikromat ion-ion yang dapat saling bertukar satu sama lain. Garam kromat adalah zat padat bewarna, yang menghasilkan larutan kuning ketika larut dalam air. Dalam asam, kromat berubah menjadi dikromat larutan yang berwarna orange. Sedangkan dalam basa alkali (oleh ion-ion hidroksil), dikromat berubah menjadi kromat Kromat dari logam alkali, kalium, dan ammonium dikromat dalam air. Untuk mempelajari reaksi kromat atau dikromat dapat dipakai larutan perak nitrat, endapan coklat kemerahan perak dikromat terbentuk bila direaksikan dengan larutan perak nitrat. kemudian akan berubah ketika dipanaskan dengan air, menjadi perak kromat yang sedikit larut Dalam percobaan kali ini menggunakan kalium dikromat. Kalium dikromat ini biasa digunakan sebagai agen pengoksidasi dalam berbagai aplikasi laboratorium dan industri. Garam jenis ini popular di laboratorium karena tidak meleleh, berbeda dengan garam yang lebi relevan secara industri natrium dikromat. Oleh karena itu untuk mengetahui bagaimana hasil pembuatan garam dikromat menggunakan senyawa kalium dikromat dan diuji kemurniannya dengan uji Cl- makaitulah dilakukan percobaan ini untuk mengetahuinya. 1.2 Rumusan Masalah Sesuai dengan latar belakang permasalahan yang di atas, maka dapat dirumuskan permasalahan yang akan dibahas sebagai berikut: 1. Bagaimana hasil dari pembuatan ammonium dikromat? 2. Berapa hasil rendemen yang dihasilkan pada ammonium dikromat? 3. Bagaimana kemurnian endapan kalium dikromat setelah dianalis? 1.3 Tujuan Percobaan Tujuan penulis membuat makalah yang berjudul “metabolism autotrof” adalah sebagai berikut: 1. Untuk mengetahui dan memahami hasil dari pembuatan ammonium dikromat 2. Untuk mengetahui dan memahami hasil rendemen yang dihasilkan pada ammonium dikromat. 3. Untuk mengetahui dan memahami kemurnian endapan kalium dikromat setelah dianalis BAB II METODE PERCOBAAN 2.1 Waktu dan Tempat Percobaan ini dilaksanakan pada hari jumat, 13 Maret 2020. Percobaan dilakukan di laboratorium kimia Fakultas Keguruan dan Ilmu Pendidikan Universitas Bengkulu. 2.2 Alat dan Bahan 2.2.1 Alat 1. Gelas Kimia 2. Erlenmeyer 3. Thermometer 4. Gelas Ukur 5. Batang Pengaduk 6. Kaki Tiga 7. Kawat Kasa 8. Pembakar Spritus 9. Corong 10. Kaca Arloji 11. Neraca Analitik 2.2.2 Bahan 1. Aquades 2. K2CrO7.2H2O 3. NH4Cl 4. Kertas Saring 5. Batu Es 6. AgNO3 5% 2.3 Prosedur Percobaan 2.3.1 Pembuatan Garam Dikromat K2CrO7.2H2O 1. Dilarutkan 10,5 g K2CrO7.2H2O dalam 25 ml air 2. Dilarutkan 4,25 g NH4Cl dalam 25 ml air 3. Dicampurkan kedua larutan tersebut (larutan K2Cr2O7) dan larutan NH4Cl), kemudian tambahakan 7,5 ml air dan panaskan hingga 600C. 4. Disaring larutan dan diinginkan dalam penangas es pada 020C 5. Saring Kristal (NH4)2Cr2O7 dengan mengunakan corong Buchner. 6. Dicuci produk (NH4)2Cr2O7 dengan 2x5 ml air es 7. Dikeringkan produk, (NH4)2Cr2O7 dalam oven pada suhu 1000C 8. Ditimbang produk yang dihasilkan dan hitung rendemennya. Adanya kesalahan sehingga tidak mendapatkan hasil 2.3.2 Analisa kemurnian Ammonium Dikromat (NH4)2Cr2O7 1. Dikeringkan 0,1 g (NH4)2Cr2O7 larutan dengan 2 ml air. 2. Ditambahkan beberapa tetes larutan AgNO3 5%, dan beberapa tetes HNO3. 3. Jika ion Cl ada dalam sampel, maka akan terlihat endapan putih AgCl dalam larutan yang berwarna kuning. Adanya kesalahan sehingga tidak mendapatkan hasil BAB III HASIL DAN PEMBAHASAN 3.1 Hasil Percobaan Prosedur Kerja Hasil Pengamatan Tidak ada endapan Pembuatan garam dikromat 1. Dilarutkan 10,5 g K2CrO7.2H2O dalam 25 ml air 2. Dilarutkan 4,25 g NH4Cl dalam 25 ml air 3. Dicampurkan kedua larutan tersebut (larutan K2Cr2O7) dan larutan NH4Cl), kemudian tambahakan 7,5 ml air dan panaskan hingga 600C. 4. Disaring larutan dan diinginkan dalam penangas es pada 0-20C 5. Saring Kristal (NH4)2Cr2O7 dengan mengunakan corong Buchner. 6. Dicuci produk (NH4)2Cr2O7 dengan 2x5 ml air es 7. Dikeringkan produk, (NH4)2Cr2O7 dalam oven pada suhu 1000C 8. Ditimbang produk yang dihasilkan dan hitung rendemennya Analisa kemurnian Ammonium Dikromat 1. Dikeringkan 0,1 g (NH4)2Cr2O7 larutan dengan 2 ml air. 2. Ditambahkan beberapa tetes larutan AgNO3 5%, dan beberapa tetes HNO3. 3. Jika ion Cl ada dalam sampel, maka akan terlihat endapan putih AgCl dalam larutan yang berwarna kuning. - 3.2 Pembahasan 3.2.1 Hasil dari pembuatan ammonium dikromat Pada percobaan kali ini dilakukan untuk membuat ammonium dikromat. Amonium kromat adalah senyawa anorganik dengan rumus (NH4)2Cr2O7. Dalam senyawa ini, seperti dalam seluruh kromat dan dikromat, kromium berada pada keadaan oksidasi +6, yang umum dikenal sebagai kromium heksavalen. Senyawa ini adalah suatu garam yang terdiri dari ion ammonium dan ion dikromat. Menurut (Topayung, 2015 : 98) Asam kromat adalah sebuah senyawa kromium (Cr). Senyawa ini memiliki rumus H2CrO4. Senyawa ini belum pernah disolasi dalam bentuk murninya Basa konjugat dari asam ini adalah ion kromat dan dikromat, yang dapat membentuk beberapa garam (misalnya kalium dikromat, K2Cr2O7). Dari literatur diatas dapat diketahui bahwa ion dikromat mengandung kromium yang mempunyai bilangan oksidasi +6 yang merupakan keadaan oksidasi tertinggi dan krom Pada reaksi kimia ion Pada kimia ion kromat dan dikromat akan mengalami suatu reaksi Reaksi ion krom reaksi reduksi. Reaksi reduksi ion kromat dan dikromat bergantung pada tingkat keasaman larutan. Larutan yang mengandung ion dikromat dibasakan da n ada yang pada larutan asam, pada basa maka ion Cr2O7 berubah menjadi ion CrO4, Sebagai berikut : Larutan sedikit basa : CrO42- + 4H2O + 3e- → Cr(OH)3 + 5OH Larutan basa pekat: CrO42- + 2H2O + 3e- → CrO2- + 4OH- Larutan asam : Cr2O7 + 14H+ + 6e- → 2Cr3+ + 7H2O Jika reaksi berlangsung dalam suasana asam yang bertindak sebagai oksidator adalah Cr2O7, ion kromat dan dikromat bertindak sebagai oksidator pada reaksi kimia bilangan oksidasi kromium turun menjadi +3 dan produk yang diperoleh bergantung pada keadaan keasaman larutan. Menurut Fatimah (2013 :95) Kalium dikromat merupakan pereaksi oksida cukup kuat, potensial standar dari reaksi : Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O Keuntungannya adalah tidak mahal sangat stabil dalam larutan dan dapat diperoleh dalam bentuk cukup murni untuk pembuatan larutan standar dengan menimbang langsung. Dapat diketahui bahwa pada ammonium dikromat banyak manfaatnya, seperti Senyawa ini juga digunakan sebagai mordan untuk pigmen pewarna, dalam pabrikasi alizarin, krom alum, penyamakan kulit dan pemurnian minyak. Contoh pemanfaatan ammonium dikromat adalah : Demonstrasi gunung berapi melibatkan penyulutan tumpukan garam, yang menginisiasi konversi eksotermal berikut: (NH4)2Cr2O7 (s) → Cr2O3 (s) + N2 (g) + 4 H2O (g) (ΔH=−429.1 ± 3 kcal/mol) Seperti amonium nitrat, termodinamikanya tidak stabil. Reaksi dekomposisinya akan berlangsung setelah dimulai, menghasilkan bubuk berwarna hijau tua yang tebal kromium(III) oksida. Tidak semua amonium dikromat terdekomposisi dalam reaksi ini. Ketika bubuk hijau dicelupkan ke dalam air, larutan kuning/jingga berasal dari amonium dikromat yang tertinggal. Amonium dikromat adalah oksidator kuat dan bereaksi (seringkali dengan hebat) dengan semua reduktor. Semakin kuat reduktornya, semakin hebat reaksinya.[9] Ia juga telah digunakan untuk mempromosi oksidasi alkohol dan tiol. Pada percobaan ini pembuatan ammonium dikromat pertama ditimbang K2CrO7.2H2O dengan menggunakan neraca analitik sebanyak 10.5 gram, lalu dilarutkan kedalam 25 ml air. Kemudian ditambahkan dengan NH4CI 4.25 gram fungsi dari ditambahkannya NH4CI supaya terbentuk ammonium dikromat. Setelah itu dipanaskan, fungsi pemanasan disini untuk mempercepat laju reaksi antara keduanya sehingga cepat bereaksi cepat larut dalam percobaan ini dilakukan pemanasan sampai 60oC. Sebagaimana dijelaskan oleh Ramadhani (2018 : 76), tentang pengaruh pemanasan adalah proses pemanasan dilakukan bertujuan agar membantu mempercepat proses pelarutan atau pemutusan ikatan organik. Hal ini dapat terjadi karena jika temperature dinaikkan, maka molekul memiliki tingkat energi yang meningkat. Kenaikan energy molekul menyebabkan semakin besar frekuensi tumbukan. Energy minimal yang di butuhkan untuk terjadinya reaksi akan semakin terlampaui dan tentunya laju reaksi akan semakin besar Kemudian tahap selanjutnya didinginkan produk yang terbentuk tadi ke dalam gelas kimia besar sampai suhu 0-2 °C, fungsi pendinginan ini agar ion-ion bebas yang terjadi pada saat pemanasan terendap secara sempurna. Dan pendinginan dilakukan untuk mendapatkan Kristal, disini kami menggunakan batu es dan garam dalam pendinginan. Menurut Setiawan (2017 : 16) sifat-sifat garam : mempunyai rasa asin, dapat menghantarkan arus listrik, tidak mengubah warna kertas lakmus merah maupun biru, memiliki pH7, terbentuk dari sisa asam dan sisa basa. Es yang digunakan dalam penelitian ini adalah es batu, es yang biasanya digunakan dalam kehidupan sehari-hari. Fungsi penambahan garam pada pendinginan untuk memperlambat proses pencairan es sehingga es tidak mudah mencair. Garam jug abersifat hygrokopis sehingga dapat menurunkan titik lebur suatu zat dan dapat membuat cairan didalam gelas kimia membeku ketika mencapai titik bekunya. Setelah mencapai suhu 0-2 °C endapan yang dihasilkan tadi disaring dengan menggunakan kertas saring. Teknik menyaring ini termasuk kedalam teknik pemisahan campuran, yaitu memisahkan komponen-komponen yang menyusun suatu campuran berdasarkan perbedaan sifat-sifat komponen komponen tersebut, bergantung atas jenis, wujud, dan sifat komponen yang terkandung di dalamnya ( Nyoman, 2009:51) Setelah disaring dan mendapatkan endapan maka endapan tersebut dikeringkan di dalam oven agar tidak ada lagi air yang terkandung di dalam endapan tersebut, setelah kering maka nantinya akan ditimbang. Namun pada percobaan kali ini terdapat beberapa kesalahan yang membuat tidak adanya endapan, sehingga praktikum kami hanya sampai pada proses penyaringan, karena tidak ada endapan sehingga tidak bisa dilanjutkan ke proses pengeringan dan penimbangan. Kesalahan yang terjadi mulai dari salah melihat atau tidak teliti melihat satuan dalam penimbangan yang seharusnya satuan gram tapi yang dibuat dalam satuan ct. kesalahan lain yang terjadi dalam pemanasan pengukuran suhu menggunakan termometer dengan mengangkat termometer dan mengganti ke kelompok lain yang mana kelompok lain sudah tahap pendinginan, jadi penurunan suhu yang sangat tinggi terjadi, dan pada saat mengukur suhu dalam pemanasan, sebelum konstan sudah diangka 60oC, yang menandakan telah lewat batas yang ditentukan, begitupula pada tahap pendinginan. Kesalahan lain, mungkin terdapat pengotor dalam sampel sehingga sampel tidak bisa mengkristal. 3.2.2 Hasil Rendemen yang Dihasilkan Untuk menghitung nilai rendemen dapat menggunakan rumus sebagai berikut: 𝑗𝑢𝑚𝑙𝑎ℎ 𝑝𝑟𝑜𝑑𝑢𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖ℎ𝑎𝑠𝑖𝑙𝑘𝑎𝑛 𝑅𝑒𝑛𝑑𝑒𝑚𝑒𝑛 = × 100% 𝑗𝑢𝑚𝑙𝑎ℎ 𝑏𝑎ℎ𝑎𝑛 𝑎𝑤𝑎𝑙 Karena terjadi banyak kesalahan yang membuat kami idak mendapatkan endapan, sehingga kami tidak bisa menghitung remendem yang dihasilkan pada percobaan kali ini. Rendemen adalah perbandingan jumlah (kuantitas) produk yang dihasilkan. Rendemen menggunakan satuan persen (%). Semakin tinggi nilai rendemen yang dihasilkan menandakan nilai ammonium dikromat yang dihasilkan semakin benyak. 3.2.3 Analisis Kemurnian Ammonium Dikromat Selanjutnya adalah tahap menganalisis kemurnian ammonium dikromat. Namun sangat disayangkan lagi bahwa kam tidak bisa mengetahui kemurnian ammonium dikromat Karena terjadi banyak kesalahan yang membuat kami idak mendapatkan endapan, sehingga kami tidak bisa menghitung remendem yang dihasilkan pada percobaan kali ini. proses pemurnian dikromat adalah Proses identifikasi larutan perklorat hasil pemurnian dapat dilakukan secara kualitatif dan secara kuantitatif. Identifikasi secara kualitatif dapat dilakukan pada proses pemurnian dengan pengendapan Craill). Fe(III) dan Fe(ll). Kation-kation tersebut termasuk ke dalam unsur logam transisi yang memiliki ciri khas. Dapat menghasilkan warna dengan adanya unsur tersebut. Sehingga ketiadaan kation-kation tersebut dalam larutan perklorat dapat diidentifikasi secara visual, larutan perklorat yang telah murni dari pengotor Crll), Fe(III) dan Fe(II) tidak akan memiliki warna (bening). Namun, untuk pengotor sulfat yang dihasilkan dari penambahan reagen besi sulfat harus diidentifikasi dengan cara kuantitatif. Karena sulfat ini memiliki sifat tidak berwarna (bening) secara visual. Pada penjabaran diatas dapat analisis kemurnian ammonium dikromat ini termasuk kedalam identifikasi secara kualitatif yaitu dengan pengendapan. Yang mana apabila endapan yang didapat berwarna putih berarti mengandunng Cl- .Pada percobaan dilakukan ketika telah didapatkan endapan, maka endapan kering dilarutkan dengan air, kemudian ditambahkan AgNO3 5% dan beberapa tetes HNO3 ternyata ketika terbentuk endapan berwarna putih yang berarti terdapat ion Cl- dalam sampel dan endapan tidak murni, karena dikatakan endapan itu murni apabila ia hanya mengandung senyawa ammonium dikromat saja. BAB IV PENUTUP 4.1 Kesimpulan Dari percobaan yang telah dilakukan dapat ditarik kesimpulan : 1. Kalium dikromat ini merupakan garam kalium tidak stabil dalam bentuk bebas dan juga merupakan oksidator kuat, khususnya dalam larutan asam. Hasil pembuatan ammonium dikromat seharusnya menghasilkan endapan/Kristal yang dapat ditimbang, namun karena adanya kesalahan sehingga tidak menemukanhasil. 2. Dalam percobaan dapat dicari remendemennya dengan rumus : 𝑗𝑢𝑚𝑙𝑎ℎ 𝑝𝑟𝑜𝑑𝑢𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖ℎ𝑎𝑠𝑖𝑙𝑘𝑎𝑛 𝑅𝑒𝑛𝑑𝑒𝑚𝑒𝑛 = × 100% 𝑗𝑢𝑚𝑙𝑎ℎ 𝑏𝑎ℎ𝑎𝑛 𝑎𝑤𝑎𝑙 3. Pada analisis kemurnian ammonium kromat seharusnya dapat diketahui denganmelakukan beberapa langkah, namun dikarenakan endapan tidak terbentuk jadi tidak bisa mencari kemuerniannya. 4.2 Saran 1. Sebelum melaksanakan praktikum, praktikan harus terlebih dahulu memahami langkah kerja, agar saat praktikum tidak salah melaksanakan langkahnya. 2. Saat melakukan proses menimbang harus memperhatikan satuan agar tidak salah dalam menimbang, dan harus tepat penimbangannya. 3. Dalam melakukan pemanasan harus diukur suhu secara tepat, dan saat mengukur tidak memainkan termometer seperti mengangkat dan memasukkan lagi sebentar sebelum konstan melihat suhusudah diangkat. DAFTAR PUSTAKA Candra,I. 2009. Kimia Dasar. Bengkulu: Unib Press Fatimah,Is.2013. Kinetika Kimia. Yogyakarta:Graha Ilmu Ramadhani, N., Yuliet, Y., & Khaerati, K.(2018). aktivitas ekstrak kulit batang langsat (lansium parasiticum (osbeck) sahni & bennet) terhadap kelarutan kalsium batu ginjal secara in vitro. Biocelebes, 12(2). 69-80. (diakses 15 Maret 2020) Setiawan, A., Faisal, F., & Sulaiman, A. (2017). Kaji eksperimental pengaruh lapisan dinding dengan material es dan garam pada dinding cold box terhadap laju perpindahan panas. Jurnal POLIMESIN, 15(1), 921.(diakses15 Maret 2020) Topayung, D. (2011). Pengaruh arus listrik dan waktu proses terhadap ketebalan dan massa lapisan yang terbentuk pada proses elektroplating pelat baja. Jurnal Ilmiah Sains, 11(1), 97-101. (diakses 15 Maret 2020)