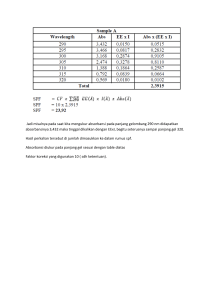
A. Lampiran a. Jawaban Pertanyaan 1. Tentukan kadar glukosa darah dalam mg glukosa/ 100 mL darah! y Jawaban : = 0,0012x + 0,3686 0,2212 = 0,0012x + 0,3686 0,0012x = 0,3686 - 0,2212 0,0012x = 0,1474 x = 122,83 𝑥 Kadar glukosa = 𝑚𝑎𝑠𝑠𝑎 𝑠𝑎𝑚𝑝𝑒𝑙 𝑥 100% = 122,83 100 𝑥 100% = 122,83 % 2. Apa fungsi proses pendidihan pada percobaan diatas? Jawaban: Fungsi pendidihan pada percobaan diatas adalah untuk mempercepat terjadinya reaksi pada Cu alkalis, Cu2+, dengan glukosa, dimana Cu akan di reduksi menjadi Cu+ oleh gugus aldehid glukosa yang rantai sikliknya telah terputus, ditandai dengan adanya endapan merah bata Cu2O. Kemudian glukosa mengalami oksidasi menjadi asam glukonat. Ketika Cu2O telah terbentuk dan telah direaksikan kembali dengan arsenomolibdat, nilai absorbansi glukosa dapat segera diukur. Karena jumlah pengurangan reaktan sama dengan jumlah pembentukan produk. 3. Jelaskan peranan hormon insulin dalam proses pengaturan kadar glukosa! Jawaban: Peranan insulin dalam pengaturan kadar gula darah adalah dengan menurunkan kadarnya saat mencapai kadar yang cukup tinggi dalam darah melalui reaksi glikolisis. Prosesnya, hormon insulin yang disekresi dari sel islet beta pada pankreas saat kadar gula darah yang tinggi, dialirkan dalam peredaran darah untuk melakukan reaksi glikolisis sehingga kadar gula darah menurun. b. Perhitungan 1. Perhitungan pengenceran bertingkat larutan standart glukosa Diketahui: Molaritas larutan induk = 2mg/mL (M1) Volume labu ukur = 10 mL Larutan standart glukosa konsentrasi 0,9 mg/mL M1 x V1 = M2 x V2 2 mg/mL x V1 = 0,9 mg/mL x 10 mL V1 = 4,5 mL Larutan standart glukosa konsentrasi 0,7 mg/mL M1 x V1 = M2 x V2 2 mg/mL x V1 = 0,9 mg/mL x 10 mL V1 = 7,8 mL Larutan standart glukosa konsentrasi 0,5 mg/mL M1 x V1 = M2 x V2 2 mg/mL x V1 = 0,9 mg/mL x 10 mL V1 = 7,1 mL Larutan standart glukosa konsentrasi 0,3 mg/mL M1 x V1 = M2 x V2 2 mg/mL x V1 = 0,9 mg/mL x 10 mL V1 = 6 mL Larutan standart glukosa konsentrasi 0,1 mg/mL M1 x V1 = M2 x V2 2 mg/mL x V1 = 0,9 mg/mL x 10 mL V1 = 3,33 mL 2. Perhitungan Cu alkalis Untuk membuat 21 mL Cu alkalis, dibutuhkan: 4 Nelson A = 5 x 21 = 16,8 mL 1 Nelson B = 5 x 21 = 4,2 mL 3. Perhitungan kadar glukosa y = 0,0012x + 0,3686 0,2212 = 0,0012x + 0,3686 0,0012x = 0,3686 - 0,2212 0,0012x = 0,1474 x = 122,83 𝑥 Kadar glukosa = 𝑚𝑎𝑠𝑠𝑎 𝑠𝑎𝑚𝑝𝑒𝑙 𝑥 100% = 122,83 100 𝑥 100% = 122,83 % 4. Dokumentasi Deproteinase Filtrat Darah No Gambar Alur 1 mL asam Keterangan Tidak berwarna oksalat 1. dimasukkan kedalam tabung sentrifunge 1 mL darah Berwarna merah dimasukkan pekat (++++) kedalam 2. tabung sentrifunge yang berisi asam oksalat Ditambah 3 Berwarna merah mL aquades pekat (+++) Ditambah 1 Berwarna merah mL Ba(OH)2 pekat (+++) 3. 0,3N 4. Ditambahkan Berwarna merah 2 mL pekat (++) ZnSO4.7H2O 4. Ditambahkan Berwarna merah 2mL pekat (+) (NH4)2SO4 5. 0,5N Didiamkan Berwarna merah selama 15 pekat (+) menit 6. 7. Disentrifunge Terbentuk residu selama 15 berwarna merah menit dan filtrat berwarna merah pekat 8. Ditambah 3 Menghasilkan tetes reagen larutan berwarna biuret merah kecoklatan Penentuan Kadar Glukosa Darah No. Gambar Alur Keterangan 1. 1 mL filtrat Berwarna merah darah bebas pekat protein dimaukkan kedalam tabung reaksi Ditambahkan 3 Berwarna erah mL Cu alkalis kecoklatan Dipanaskan Larutan berwarna selama 15 biru dan terbentuk menis dalam gumpalan air mendidih berwarna coklat Dimasukkan Larutan berwarna kedalam air biru dan terbentuk dingin selama gumpalan 10 menit berwarna coklat 2. 3. 6. Ditambahkan 3 Larutan berwarna tetes pereaksi biru dan terbentuk arsenomolibdat gumpalan 7. berwarna coklat Dibaca Diperoleh absorbansinya absorbansi sebesar 0,2212 8. Penentuan Larutan Standar 2. 1 mL larutan Larutan tidak standart berwarna glukosa (0,1; 0,3; 0,5; 0,7; dan 0,9) mg/mL Ditambah 3 Menghasilkan mL pereaksi larutan berwaena Cu alkalis biru Dipanaskan 0,1 = merah (+) selama 15 0,3 = merah (++) menit 0,5 = merah (+++) 3. 4. 0,7 = merah (+++) 0,9 = merah (++) Didinginkan 0,1 = merah (+) selama 10 0,3 = merah (++) menit 0,5 = merah (+++) 0,7 = merah (+++) 0,9 = merah (++) 5. Ditambah 3 0,1 = merah (+) tetes 0,3 = merah (++) arsenomolibdat 0,5 = merah (+++) 0,7 = merah (+++) 0,9 = merah (++) Diukur 0,1 = 0,335 absorbansinya 0,3 = 0,383 0,5 = 0,331 6. 0,7 = 0,571 0,9 = 0,253 Larutan Blanko 1. 1 mL aquades Larutan tidak dimasukka ke berwarna dalam tabung reaksi Ditambahkan 3 Larutan berwarna mL Cu alkalis 2. biru 3. Dipanaskan Larutan berwarna selama 15 biru (++) menit Dimasukkan Larutan berwarna kedalam air biru (+) dingin 4. Ditambahkan Larutan berwarna arsenomolibdat biru (+) 5. 6. Dibaca nilai Nilai absorbansi absorbansinya 0