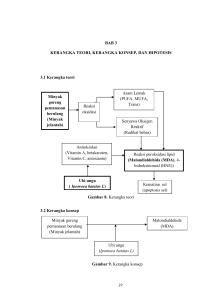
tesis serum darah tali pusat manusia dapat meningkatkan proliferasi
advertisement

TESIS SERUM DARAH TALI PUSAT MANUSIA DAPAT MENINGKATKAN PROLIFERASI FIBROBLAS PADA TIKUS (GALUR SEL NIH3T3) LEBIH BANYAK DARI PADA SERUM FETUS SAPI RITA LAHIRIN PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 TESIS iii SERUM DARAH TALI PUSAT MANUSIA DAPAT MENINGKATKAN PROLIFERASI FIBROBLAS PADA TIKUS (GALUR SEL NIH3T3) LEBIH BANYAK DARI PADA SERUM FETUS SAPI RITA LAHIRIN NIM : 0790761043 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 TESIS SERUM DARAH TALI PUSAT MANUSIA DAPAT MENINGKATKAN PROLIFERASI FIBROBLAS PADA iv TIKUS (GALUR SEL NIH3T3) LEBIH BANYAK DARI PADA SERUM FETUS SAPI Tesis untuk Memperoleh Gelar Magister Pada Program Magister Program Studi Ilmu Biomedik Kekhususan Anti Aging Medicine Program Pascasarjana Universitas Udayana RITA LAHIRIN NIM : 0790761043 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2011 v Lembar Pengesahan TESIS INI TELAH DISETUJUI PADA TANGGAL : 10 JANUARI 2011 Pembimbing I Pembimbing II Prof.Dr.dr.Wimpie Pangkahila,SpAnd,FAACS drg. Ferry Sandra,PhD,LFIBA,CIPM,MIPM NIP : 194612131971071001 NIP :130356070 Mengetahui Ketua Program Magister Direktur Ilmu Kedokteran Biomedik Progam Pascasarjana Program Pascasarjana Universitas Udayana Universitas Udayana Prof. Dr.dr. Wimpie I.Pangkahila, Sp.And.FAACS vi Prof.Dr.dr. AA Raka Sudewi,Sp.S(K) NIP : 194612131971071001 NIP : 195902151985102001 Tesis Ini Telah Diuji dan Dinilai Oleh Panitia Penguji pada Program Pascasarjana Universitas Udayana Pada Tanggal 10 Januari 2011 Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, No : 23/H14.4/HK/2011 Ketua : Prof. Dr. dr. Wimpie Pangkahila, Sp.And. FAACS Anggota: 1. Dr. drg. Ferry Sandra, PhD, LFIBA, CIPM, MIPM 2. Prof. Dr. dr Alex Pangkahila, Sp.And., PhD 3. Prof. Dr. dr Bagiada., MBiok, PhD 4. Dr. dr. Ida Sri Iswari, Sp.MK.M.Kes. vii UCAPAN TERIMA KASIH Pertama-tama perkenankanlah penulis memanjatkan puji syukur kehadirat Tuhan Yang Maha Esa, atas kasih karunia-Nya,sehingga penelitian dan penyusunan tesis yang berjudul “Serum Darah Tali Pusat Manusia Meningkatkan Proliferasi Fibroblas Pada Tikus (Galur Sel NIH3T3) Lebih Banyak dari pada Serum Fetus Sapi” dapat diselesaikan. Tesis ini disusun dalam rangka memenuhi persyaratan tugas akhir studi untukmeraihgelar Magister pada Program Magister Program Studi Ilmu Kedokteran Biomedik, Kekhususan Anti-Aging Medicine, Program Pasca Sarjana Universitas Udayana. Dengan selesainya laporan penelitian ini, penulis ingin menyampaikan rasa hormat, penghargaan dan terima kasih yang sebesar-besarnya kepada : 1. Prof. Dr. dr. Wimpie Pangkahila, Sp.And, FAACS selaku ketua Program Studi Ilmu Kedokteran Biomedik Universitas Udayana dan pembimbing I yang telah memberikan banyak sekali semangat, masukan dan bimbingan dan juga telah memacu penulis untuk segera menyelesaikan tesis ini untuk kemajuan ilmu yang baru berkembang yaitu Ilmu Kedokteran Anti Penuaan ( Anti Aging Medicine). 2. Dr drg. Ferry Sandra, PhD, LFIBA, CIPM, MIPM selaku pembimbing II, yang dengan sangat sabar memberikan pengarahan dan bimbingan yang sangat berharga dalam menyusun tesis ini. 3. Prof. Dr. dr. J Alex Pangkahila, M.Sc., Sp.And.selaku penguji yang telah banyak memberikan bimbingan dan masukan kepada penulis selama penyusunan tesis ini. 4. Prof. dr. N. Agus Bagiada, Sp. BIOK. selaku penasehat akademik dan penguji yang dengan sangat bersemangat membimbing dan banyak sekali memberi masukan yang kritis serta pengajaran yang sangat dirasakan manfaatnya pada penulis selama penyusunan tesis ini. viii 5. Dr. dr. Ida Sri Iswari, dr SpMK. Mkes. selaku penguji yang sangat sabar dalam membimbing, mengarahkan dan memberi masukan yang sangat berharga, dari awal penyusunan penelitian sampai selesainya tesis ini. 6. Drs. I. Ketut Tunas, Msi yang dengan tekun dan sabar memberikan bimbingan, pengarahan dan petunjuk dalam analisis statistik. 7. Para dosen pengajar Progam Studi Ilmu Biomedik Progam Pascasarjana Universitas Udayana, teman-teman sependidikan dan seluruh karyawan bagian Ilmu Biomedik, serta semua pihak yang telah membantu selama pendidikan, penelitian dan penulisan tesis yang tidak dapat penulis sebutkan satu persatu.. 8. Dr. I Made Oka Negara beserta staf bagian Andrologi dan Seksologi FK Universitas Udayana (dr. Pram, Ibu Eni dan Bapak Edi ) serta teman-teman mahasiswa Program Magister Biomedik kekhususan Anti Aging Medicine atas doa, semangat dan dorongannya. 9. Kolonel Ckm drg. Normadyanto, MARS, selaku Kepala RS. Tk. II Moh Ridwan Meuraksa periode tahun 2009 - saat ini yang memberikan ijin menyelesaikan pendidikan dan sangat membantu memperlancar pelaksanakan penelitian ini di RS. Tk. II Moh. Ridwan Meuraksa, Jakarta. 10. dr Herman Sasongko, SpO.G. dan dr Matius Simuluk G., SpO.G. yang telah memberikan ijin dan ikut membantu dalam pengumpulan darah tali pusat serta semua pihak yang namanya tidak dapat disebutkan satu persatu tapi telah membantu dalam pengumpulan darah tali pusat di RS.Tk.II.Moh. Ridwan Meuraksa. 11. Drs Dwi Agustina, M.Si, yang telah dengan tekun dan sabar memberi pengarahan, petunjuk dan bantuan dalam melaksanakan penelitian ini. 12. Drs Indra Bachtiar, M.Si, PhD, yang telah dengan tekun dan sabar memberi pengarahan dan petunjuk dalam penulisan tesis ini. 13. Oktasari Suryanti, A.Md serta para karyawan lainnya di Stem Cell And Cancer Institute (SCI), yang selalu memberikan semangat dan sudah banyak sekali membantu selama melakukan penelitian. ix 14. Keluarga terkasih, suami tercinta Timmy, terimakasih atas dukungan yang luar biasa. Serta kedua orang tua, saudara-saudara atas doa, dukungan dan pengertiannya selama penulis menempuh pendidikan. Penulis juga mengucapkan banyak terimakasih kepada semua pihak yang telah ikut membantu dalam pelaksanaan dan penyelesaian tesis ini. Semoga Tuhan Yang Maha Pengasih, senantiasa melimpahkan berkat dan rahmat-Nya kepada mereka semua. Denpasar, Januari 2011 Penulis. x ABSTRAK SERUM DARAH TALI PUSAT MANUSIA MENINGKATKAN PROLIFERASI FIBROBLAS PADA TIKUS (GALUR SEL NIH3T3) LEBIH BANYAK DARI PADA SERUM FETUS SAPI Menua (menjadi tua atau aging) adalah suatu proses kompleks yang dipengaruhi stimulasi lingkungan dan sistem dalam tubuh. Proses ini terjadi secara perlahan-lahan dengan hilangnya kemampuan jaringan untuk memperbaiki diri/mengganti diri dan mempertahankan struktur serta fungsi normalnya. Penyakit yang berhubungan dengan umur, kanker dan aterosklerosis, menunjukkan kegagalan dalam regulasi proliferasi sel. Penelitian kepada hUCB yang dikultur menjadi serum dapat menggantikan posisi serum fetus sapi (Fetus Bovine Serum, FBS) yang mudah terinfeksi oleh berbagai bakteri patogen dan selama ini digunakan dalam banyak pengembangbiakan sel. Serum darah tali pusat manusia (Human Umbilical Cord Blood Serum, hUCBS) merupakan sumber yang kaya berbagai sitokin dan berbagai macam faktor pertumbuhan yang diperlukan untuk pertumbuhan dan kelangsungan hidup dari berbagai jenis sel seperti sel punca, fibroblas, kerationosit,dll. Penuaan fibroblas berasal dari lapisan dermal kulit telah dilaporkan dalam beberapa penelitian dan fibroblas merupakan sel yang paling mudah dikultur. Fibroblas merupakan sel yang paling banyak terdapat di jaringan ikat, dapat membuat kolagen, glikosaminoglikan, retikuler, serat elastin dan glikoprotein yang merupakan bagian dari matriks ekstraselular sehingga peningkatan fibroblas mempengaruhi elastisitas kulit, kelenturan otot, kekuatan tulang, dan lain-lain dimana hal ini sangat penting dalam proses penuaan dini seseorang. Penelitian ini bertujuan untuk mengetahui bahwa hUCBS dapat meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3) dari pada FBS. Sampel dari penelitian ini adalah Fibroblas dari Galur sel NIH 3T3 berasal dari tikus putih Swiss (Mus musculus). Fibroblas dikultur dalam medium DMEM dengan ditambah berbagai konsentrasi FBS dan hUCBS. Penelitian ini merupakan penelitian eksperimental laboratorium, dengan menggunakan rancangan pre dan post test control group design yang dilakukan di Stem Cell and Cancer Institute, pada bulan Mei – Oktober 2010. Dalam penelitian ini dilakukan 45 pemeriksaan pada galur fibroblas NIH3T3 sebagai sampel, yang terbagi menjadi 5 (lima) kelompok, masing-masing kelompok berjumlah 9s ediaan, yaitu kelompok kontrol (DMEM), kelompok DMEM + FBS 10%, kelompok DMEM + hUCBS 5%, kelompok DMEM + hUCBS 10%, dan kelompok DMEM + hUCBS 20%. Hasil penelitian ini menyimpulkan bahwa hUCBS meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3) lebih banyak dibandingkan FBS secara bermakna dan konsentrasi serum menentukan proliferasi fibroblas yaitu semakin tinggi kosentrasi serum, semakin tinggi proliferasi fibroblas disamping itu terbukti total protein pada hUCBS lebih tinggi dibanding FBS dimana hal ini diduga berhubungan dengan peningkatan proliferasi fibroblas. Kata Kunci : Serum Darah Tali Pusat Manusia, Serum Fetus Sapi, NIH3T3, Proliferasi xi Abstract HUMAN UMBILLICAL CORD BLOOD SERUM ENHANCED PROLIFERATION HIGHER THAN FETAL BOVINE SERUM IN RAT FIBROBLASTS (NIH3T3 CELLS) Aging is a complex process influenced by environmental stimulation and body system.The process is caused by disappearance of the tissues capacity to improve or replace themselves and to maintain the structure and function normally. Aged-related diseases, cancer and atherosclerosis indicate failures of cell proliferation regulation. Until now, Human Umbilical Cord Blood (hUCB) has been used as a source for stem cell transplantation. Presumably there are many other benefits that need to be revealed from the hUCB, for example in increasing fibroblast proliferation. Research in hUCB reported that UCB Serum (hUCBS) can replace Fetal Bovine Serum (FBS). FBS has been used in many cell culture, however it is easily infected by various bacterial pathogens.Meanwhile, hUCBSis a rich source of cytokines and various growth factors,which is necessary for growth and survival of various cell types such as stem cells and fibroblast. Fibroblasts are the easiest cell to be cultured and the most numerous cells in the connective tissue. Fibroblastcan make collagen, glycosaminoglycan, reticular, elastin fibers and glycoproteins, which are part of the extracellular matrix. Fibroblasts influence the increase in skin elasticity and flexibility, muscle, bone strength, and others. This fibroblast is potential and very importance to avoid the process of premature aging. Objective of this study is to find out whether hUCBS can enhanced proliferation higher than FBS in rat of fibroblasts (NIH3T3 cells). The sample of this research is NIH3T3 cells derived from Swiss white mice (Musmusculus).NIH3T3 cells were culture in DMEM medium with or without various concentrations of hUCBS or FBS. This study was conducted in the scheme of laboratory experimental research, while the research design is pre- and post-test controlled group. The research was conducted in Stem Cell and Cancer Institute starting from May until October 2010. Populations of NIH3T3 cells were divided into 5 groups and 45 examination: control (DMEM), DMEM+FBS10%, DMEM+hUCBS 5%, DMEM+hUCBS 10%, DMEM + hUCBS 20% groups. Research results were analyzed for the normality and homogeneity tests, while significant of the research result was tested with SaphiroWilk, Levene’s, Kruskal Wallis and Mann Whitney tests. Research results concluded that hUCBS increased proliferation of fibroblast significantly higher than FBS in NIH3T3 cells. hUCBS contained higher protein concentration than FBS. Taken together higher protein concentration of hUCBS might be related to its potential in inducing proliferation of NIH3T3. Key words : human umbilical cord blood serum, fetal bovine serum, NIH3T3, proliferation xii DAFTAR ISI SAMPUL DALAM i PRASYARAT GELAR ii LEMBAR PERSETUJUAN iii PENETAPAN PANITIA PENGUJI iv UCAPAN TERIMA KASIH v ABSTRAK viii ABSTRACT ix DAFTAR ISI x DAFTAR GAMBAR xiv DAFTAR TABEL xv BAB I PENDAHULUAN 1 1.1. Latar Belakang 1 1.2. Rumusan Masalah 6 1.3 Tujuan Penelitian 6 1.3.1. Tujuan Umum 6 1.3.2. Tujuan Khusus 6 1.4. Manfaat Penelitian 7 1.4.1. Manfaat Ilmiah 71 1.4.2. Manfaat Praktis 7 BAB II TINJAUAN PUSTAKA 8 2.1. Penuaan Dini 8 2.3. Regenerasi 14 2.4. Galur Sel NIH/3T3 17 xiii 2.5. 2.6. 2.7. 2.8. Serum Fetus Sapi (Fetal Bovine Serum) 21 2.5.1. 23 Proses Terjadinya FBS Selaput Janin dan Plasenta 26 2.6.1. Peredaran Darah Plasenta 27 2.6.2. Fungsi Plasenta 28 Darah Tali Pusat (Human Umbilical Cord Blood / HUCB) 29 2.7.1. Serum darah tali pusat manusia (Human Umbilical Cord Blood Serum) 32 2.7.2. Proses Terjadinya Serum Darah Tali Pusat Protein 35 35 BAB III KERANGKA KONSEP DAN HIPOTESIS 40 3.1. Kerangka Konsep Penelitian 40 3.2. Hipotesis 42 BAB IV METODE PENELITIAN 43 4.1. Rancangan Penelitian 43 4.2. Lokasi dan Waktu Penelitian 44 4.2.1. Tempat Penelitian 44 4.2.2. Waktu Penelitian 44 4.2.3. Populasi dan Sampel 44 4.2.3.1. Penentuan Besar Sampel 45 4.3. Variabel Penelitian 46 4.4. Definisi Operasional 47 4.5. Prosedur-Prosedur dan Bahan-bahan Penelitian 49 4.5.1. Prosedur Pengumpulan HUCB 49 4.5.2. Prosedur Isolasi Serum dari HUCB 50 xiv 4.5.3. Metode Thawing dan Kultur NIH3T3 51 4.5.4. Prosedur Penelitian hUCBS pada Fibroblas 53 4.5.5. Prosedur 3-(4,5-dimethylthiazol-2-yl)-2,5diphenyltetrazolium bromide (MTT) assay 54 4.5.6. Prosedur pemeriksaan protein dengan nanodrop 54 4.6. Alur Penelitian 55 4.7. Analisis Data 56 BAB V HASIL PENELITIAN 58 5.1 Uji Normalitas Data 58 5.2 Uji Homogenitas Data antar Kelompok 59 5.3 Jumlah Fibroblas 60 5.3.1 Uji komparabilitas 60 5.3.2 Analisis efek perlakuan antar Serum 60 5.3.3 Analisis Efek Perlakuan antar Dosis HUCBS 67 BAB VI PEMBAHASAN HASIL PENELITIAN 71 6.1. Subyek Penelitian 71 6.2 Serum Darah Tali Pusat Manusia Meningkatkan Jumlah Sel 71 6.2.1 hUCBS10% Meningkatkan Proliferasi Fibroblas Lebih Baik Dibanding FBS 10% 71 6.2.2 Peningkatan Kosentrasi hUCBS Menyebabkan Peningkatan Proliferasi Fibroblas 75 BAB VII SIMPULAN DAN SARAN 78 7.1 Simpulan 78 7.2 Saran 78 xv DAFTAR PUSTAKA 80 LAMPIRAN 88 Lampiran 1 Uji Normalitas Data Jumlah Sel 88 Lampiran 2 Uji Kruskal-Wallis Jumlah Sel antara Kelompok Kontrol, FBS, dan Serum Tali Pusat 88 Uji Mann-Whitney antara Kontrol dengan Kelompok FBS 89 Uji Mann-Whitney antara Kontrol dengan Kelompok Serum Tali Pusat Manusia 90 Uji Mann-Whitney antara Kelompok FBS dengan Kelompok Serum Tali Pusat Manusia 91 Uji Kruskal-Wallis Jumlah Sel antara Kelompok Serum Tali Pusat dosis 5%, 10%, dan 20% 91 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 5% dengan 10% 92 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 5% dengan 20% 93 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 10% dengan 20% 94 Lampiran 10 Analisis Regresi Linier 94 Lampiran 11 Analisis Total Protein 95 Lampiran 12 Foto-foto Penelitian 97 Lampiran 3 Lampiran 4 Lampiran 5 Lampiran 6 Lampiran 7 Lampiran 8 Lampiran 9 Persetujuan Ethical Clearance 102 Persetujuan Penelitian Rs.Ridwan Meuraksa 104 xvi DAFTAR GAMBAR Gambar 2. 1 Fibroblas (Alberts, dkk, 2002) 11 Gambar 2. 2 Galur Sel NIH/3T3 17 Gambar 2. 2.1 Albino Swiss Mouse Embryo Fibroblast 21 Gambar 2. 3 Fetus Sapi 23 Gambar 2. 4 Normal Placenta (Grunebaum, 2008) 26 Gambar 2. 5 Peredaran Darah Plasenta (King, 2003) 27 Gambar 2. 6 Peredaran Darah Plasenta (Vorvick, dkk, 2010) 28 Gambar 2. 7 Bayi dan Tali Pusat 38 Gambar 2. 8 Tali Pusat dan Vena Umbilikalis 39 Gambar 2. 9 Pengambilan HUCB 39 Gambar 2. 10 Plasenta dan Tali Pusat 39 Gambar 3. 1 Kerangka Konsep Penelitian 42 Gambar 4. 1 Bagan Rancangan Penelitian 43 Gambar 4. 2 Alur Penelitian 55 Gambar 5. 1 Grafik Peningkatan Jumlah Fibroblas setelah Diberikan Perlakuan dengan Berbagai Medium 62 Grafik Peningkatan Jumlah Fibroblas Setelah DiberikanPerlakuan dalam Dosis HUCBS yang Berbeda 65 Gambar 5. 3 Grafik Perbandingan Total Protein FBS dengan HUCBS 68 Gambar 5.4 Foto sel NIH3T3 dengan beberapa perlakuan 69 Gambar 5. 2 xvii DAFTAR TABEL Tabel 2. 1 Profil dari Serum Fetus Sapi GIBCO 25 Tabel 4. 1 Formulasi DMEM 47 Tabel 5.1 Hasil Uji Normalitas Jumlah Sel Fibroblas Sesudah Perlakuan 59 Tabel 5.2 Uji Homogenitas Jumlah Sel antara Kelompok Kontrol,FBS, dan HUCBS 60 Tabel 5.3 Uji Homogenitas Jumlah Sel antara Kelompok HUCBS Dosis 5%, 10%, dan 20%. 60 Tabel 5.4 Rerata Jumlah sel fibroblas antar Kelompok sesudah diberikan Perlakuan 61 Tabel 5.5 Analisis Perbedaan Jumlah Sel Fibroblas Sesudah Perlakuan antar Kelompok 63 Tabel 5.6 Rerata Jumlah Sel Fibroblas Sesudah Diberikan Perlakuan 64 Tabel 5.7 Analisis Perbedaan Jumlah Sel Fibroblas Sesudah PerlakuanAntar Kelompok 66 Rerata Total Protein antar Kelompok FBS DAN HUCBS 67 Tabel 5.8 1 2 BAB I PENDAHULUAN 1.1. Latar Belakang Setelah mencapai usia dewasa, secara alamiah seluruh komponen tubuh, tidak dapat berkembang lagi, tetapi karena proses penuaan justru terjadi penurunan fungsi berbagai organ tubuh. Penurunan secara progresif ini akan membuat manusia kehilangan daya tahan terhadap infeksi dan akan terjadi penumpukan distorsi metabolisme struktural yang dapat menimbulkan penyakit degeneratif (seperti hipertensi, diabetes melitus, kanker, dan lain-lain) dan akan menyebabkan kita menghadapi akhir hidup dengan episode terminal yang dramatik. Menua (menjadi tua atau aging) adalah suatu proses kompleks yang dapat disebabkan oleh stimulasi lingkungan dan sistem dalam tubuh dimana terjadi proses menghilangnya secara perlahan-perlahan kemampuan jaringan untuk memperbaiki diri/mengganti diri dan mempertahankan struktur dan fungsi normalnya. Hal ini perlu dicatat bahwa penyakit yang berhubungan dengan umur, kanker dan aterosklerosis, menunjukkan kegagalan dalam regulasi proliferasi sel (Phipps, dkk 2007). Teori tentang penuaan pun banyak bermunculan yang pada pokoknya dibagi menjadi 4 teori seperti teori wear and tear, teori neuroendokrin, teori kontrol genetik dan teori radikal bebas (Goldman dan Klatz, 2007). Berbagai upaya menghambat proses penuaan (anti aging) diusahakan dengan harapan dilakukan dengan cara yang sehat dan benar, yaitu yang mempunyai dasar dan bukti ilmiah (Pangkahila, 2007). 2 3 Penuaan fibroblas yang berasal dari lapisan dermal kulit telah dilaporkan dalam beberapa penelitian. Meskipun, data-data tersebut tidak sangat meyakinkan, tetapi pada umumnya, dermal fibroblast mempunyai potensi replikatif sehingga dari donor yang lebih tua kurang mengalami penuaan lebih awal dibandingkan dengan fibroblas yang berasal dari lapisan dermal donor yang muda (Dimri dan Dellambra, 2008). Fibroblas adalah tipe sel yang dapat mensintesa matriks ekstraselular dan kolagen yang memegang peranan penting dalam proses penyembuhan luka. Fibroblas adalah sel yang paling banyak terdapat dalam jaringan ikat. Fibroblas membuat kolagen, glycosaminoglycan, retikuler, serat elastin, dan glikoprotein yang merupakan bagian dari matriks ekstraselular sehingga peningkatan fibroblas mempengaruhi elastisitas kulit, kelenturan otot, kekuatan tulang, dan lain lain dimana hal ini sangat penting dalam mencegah proses penuaan dini (antiaging) seseorang (Koller, dkk, 2002). Faktor pertumbuhan merupakan salah satu protein yang secara alami mampu merangsang pertumbuhan sel, proliferasi dan differensiasi sel. Pertumbuhan dan differensiasi sel diatur oleh protein faktor pertumbuhan. Misalnya faktor pertumbuhan saraf (Nerve Growth Factor, NGF) akan merangsang pertumbuhan jaringan saraf, faktor pertumbuhan fibroblas (Fibroblast growth factor, FGF) akan merangsang pertumbuhan fibroblas (Stryer, 2000). Protein adalah biomolekul yang sesungguhnya, karena senyawa ini yang menjalankan berbagai fungsi dasar kehidupan, antara lain protein berkontraksi melakukan gerak, menjalankan berbagai proses metabolisme dalam bentuk enzim, pertumbuhan sel (Sadikin, 2001). 3 4 Fibroblas adalah sel yang paling mudah dikultur dari vertebrata dan telah digunakan sangat luas dalam banyak penelitian kultur jaringan. Kultur yang paling awal diadakan pada awal abad 20, sehingga sampai saat ini sudah hampir mempunyai pengalaman 100 tahun dengan jenis sel ini. Medium yang dipakai pun bermacam-macam diantaranya serum fetus sapi (Carrel, 1912). Serum fetus sapi / Fetus Bovine Serum (FBS) merupakan bagian dari plasma yang tersisa setelah pembekuan darah dan yang paling banyak digunakan karena mengandung lebih banyak antibodi dan faktor pertumbuhan, yang memungkinkan fleksibilitas dalam berbagai aplikasi. FBS digunakan dalam kultur sel eukariotik (FDA, 1991). FBS ini mudah terinfeksi oleh berbagai bakteri patogen. Bahkan dalam jumlah tertentu FBS yang digunakan ini, walaupun telah dibersihkan dengan baik, tetap dapat menyebabkan toksisitas pada manusia (Yamaguchi, 2002; Stute, 2004; Mizuno, 2006). Risiko penularan dari bakteri patogen dan zoonosis dari penggunaan FBS dianggap kecil (Doerr, dkk, 2003). Namun, hewan merupakan potensi sumber kontaminan mikrobiologi, khususnya mikoplasma, virus sapi, dan patogen lainnya, dan bakteri yang dapat menyebabkan ensefalopati spongiform sapi atau penyakit Creutzfeldt-Jakob (Klein dan Dumbledore, 1993). Berbagai peneliti menggunakan serangkaian teknik, termasuk filtrasi, dan / atau radiasi, untuk mengurangi kontaminasi mikroba apapun. Sebagai akibat dari masalah ini, sel dan organ transplantasi program tidak merekomendasikan penggunaan suplemen FBS (Koivisto dkk, 2004). Selain itu, penggunaan klinis FBS juga melibatkan peradangan lokal, produksi antibodi terhadap xenoproteins, 4 5 dan non engraftment karena respon imun xenogenic (Stute, dkk, 2004). Semua faktor-faktor ini meningkatkan pertanyaan tentang biosafety yang terlibat dalam penggunaan FBS dalam sistem sel yang membawa potensi terapeutik. Untuk mengatasi keterbatasan fungsi dari FBS ini, telah dilakukan penelitian dengan menggunakan berbagai hal termasuk penggunaan serum kambing (Paranjape, 2004), cairan mata sapi dalam kombinasi dengan plasma defibrinated domba, dan serum autologus darah manusia ([ABS]; Filipic, dkk, 2002. ). Sebelumnya upaya untuk menggantikan FBS oleh serum kambing pada kultur sel, terutama sel-sel hibridoma, menghasilkan sukses kecil karena mengatasi sifat racun dari serum kambing. Penambahan campuran kedelai untuk serum kambing diusulkan agar kompatibel dengan FBS, namun kultur jangka panjang menunjukkan angka kematian yang lebih tinggi dengan serum kambing (Deshpande, dkk, 2000). Dilakukan pula penelitian dengan menggunakan stroma sumsum tulang yaitu penggunaan serum darah perifer manusia (Yamaguchi, 2002; Stute, 2004; Mizuno, 2006). Serum darah perifer manusia dewasa tidak memiliki banyak faktor pertumbuhan yang dibutuhkan untuk kelangsungan hidup maupun perluasan pertumbuhan suatu sel. Selain membutuhkan darah segar dalam volume besar untuk pengerjaannya, darah perifer manusia bukan merupakan bahan buangan (seperti darah tali pusat manusia / Umbilical Cord Blood (UCB), yang akan dibuang segera setelah bayi dilahirkan) sehingga akhirnya tidak digunakan untuk kultur sel, kultur jaringan maupun organ invitro. Selain itu, dibandingkan dengan serum darah perifer, serum darah tali pusat manusia / Human Umbilical Cord Blood Serum, (hUCBS) merupakan 5 6 sumber yang lebih kaya berbagai sitokin dan berbagai macam faktor pertumbuhan yang diperlukan untuk pertumbuhan dan kelangsungan hidup dari berbagai jenis sel seperti sel punca, jaringan maupun organ (Savarese, dkk, 2007). Saat manusia baru yang tumbuh dan berkembang dalam rahim ibu, terbentuklah plasenta yang berisi darah untuk memberi nutrisi bagi semua organorgan vital janin dan untuk membawa produk limbah kembali ke ibu. Darah janin di dalam plasenta yang berisi produk-produk limbah dari janin ditukar dengan produk nutrisi dan oksigen dari ibu melalui vena umbilikalis. Sekitar 30% - 40% darah dari janin, beredar di dalam plasenta setiap saat untuk mengalir dari dan kembali ke ibu. Kehamilan menimbulkan perubahan molekul dan biokimia dimana terdapat penyatuan antara dua genom yang terpisah atau berbeda yaitu janin dan ibu, beroperasi di dalam satu tubuh yaitu tubuh ibu. Ada interaksi langsung dan tidak langsung antara ibu, embrio atau janin, plasenta, membran ekstra amnion dan cairan ketuban. Dan darah tali pusat membawa semua nutrisi yang dibutuhkan untuk memenuhi persyaratan pertumbuhan dari organisme sesuai dengan usia kehamilan (Bhattacharya, 2009). Keuntungan penggunaan hUCB adalah kemudahan pengadaan, pengolahan, dan penyimpanan, tidak ada risiko donor, memiliki sifat imunogenisitas yang lebih rendah, isolasinya tidak membutuhkan prosedur yang invasif, penerimaannya tidak membutuhkan ketepatan 100% Human Leucocyte Antigen (HLA) (Ryan, 2005). Selama ini hUCB dipakai sebagai salah satu sumber transplantasi sel punca (stem cell). Diduga masih banyak manfaat lain yang perlu diungkap dari hUCB tersebut. Pada kesempatan ini, saya mencoba meneliti bahwa hUCB yang dikultur 6 7 menjadi serum dapat menggantikan posisi FBS yang selama ini digunakan dalam banyak pengembangbiakan sel serta berapa total protein yang terkandung dalam hUCB dimana kita telah mengetahui bahwa salah satu yang memegang peranan dalam proses pertumbuhan adalah protein . Studi yang menguji tentang kemampuan hUCBS yang lebih baik dibanding FBS dalam peningkatan proliferasi fibroblas pada galur NIH3T3 memang belum pernah dilakukan, sehingga hasil penelitian ini diharapkan dapat menjadi alternatif pengganti FBS dalam mengembangkan cara klinis yang cocok untuk manusia. 1.2. Rumusan Masalah Berdasarkan hal tersebut diatas maka dapat dirumuskan masalahnya sebagai berikut : Apakah serum darah tali pusat manusia dapat meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3)lebih banyak daripada Serum darah sapi? 1.3 Tujuan Penelitian 1.3.1. Tujuan Umum Mencari bahan untuk meningkatkan proliferasi fibroblas manusia secara bermakna baik secara kualitas maupun kuantitas sehingga dapat memperbaiki kualitas hidup manusia. 1.3.2. Tujuan Khusus Penelitian ini bertujuan untuk mengetahui bahwa serum darah tali pusat manusia dapat meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3) lebih banyak dari pada serum darah sapi. 7 8 1.4. Manfaat Penelitian 1.4.1. Manfaat Ilmiah Untuk mendapatkan data ilmiah yang dapat digunakan sebagai bahan acuan untuk memberikan informasi yang tepat, sekaligus membuktikan bahwa serum darah tali pusat manusia dapat meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3) lebih banyak dari pada serum darah sapi. 1.4.2. Manfaat Praktis 1. Pemanfaatan serum darah tali pusat (yang biasanya dibuang) untuk penelitian maupun untuk aplikasi klinis yang menunjang kesehatan manusia khususnya perlambatan penuaan dini (antiaging) dengan merangsang proliferasi fibroblas. 2. Dapat bermanfaat dalam pemilihan sumber serum yang baik untuk penelitian ataupun sebagau landasan aplikasi klinis pada manusia misalnya untuk memperbaiki kolagen kulit, menjadi media kultur sel punca, dll. 8 BAB II TINJAUAN PUSTAKA 2.1. Penuaan Dini Penuaan merupakan bagian integral kehidupan, berawal pada konsepsi, terjadi tataran kromosom, sel, organ, tumbuh dan berkembang, yang kemudian berakhir pada kematian. Mengapa orang dan hewan menua, merupakan suatu pertanyaan dan mengapa berbagai usia manusia dipengaruhi dengan laju yang berbeda. Akan tetapi umur menurut penanggalan (chronological age) tidak selalu sama dengan umur biologis (biological age). Di dalam kehidupan sehari-hari perbedaan antara kedua jenis umur tersebut juga dapat ditemukan, misalnya orangorang tertentu tampak cepat menjadi tua sedangkan orang-orang lain yang seusia memberi kesan lebih muda, dimana hal ini dapt dilihat dari penampilan tubuh, fungsi mental, penampilan seksual sampai kekuatan fisiknya (Pangkahila, 2007, Goldman dan Klatz, 2007). Alasan ini menyebabkan usia menurut penanggalan saja tidak cukup untuk menilai usia biologis seorang individu. Proses penuaan ini juga dapat terjadi lebih cepat atau lebih lambat tergantung pula dari kesehatan masing-masing individu (Fowler, 2003). Perubahan-perubahan yang disebabkan oleh waktu ditemukan didalam makromolekul lain yang banyak terdapat dialam, seperti pada karet. Persamaan ini menyebabkan proses yang terjadi pada usia lanjut dianggap sebagai proses menjadi tuanya makromolekul (macromolecular aging), sebagai sesuatu proses yang wajar. Mekanisme kontrol secara keseluruhan yang menentukan usia suatu individu dan pengawetan sistem organnya tidak diketahui, namun jelas melibatkan 9 10 faktor yang keturunan/genetik dan pengaruh lingkungan. Kajian biologis terhadap penuaan telah dipusatkan pada penuaan dalam tatanan sel, dan khususnya penentu kelangsungan hidup sel dalam biakan jaringan invitro. Terdapat dua hipotesis utama penuaan sel, yaitu yang pertama, penuaan adalah progam dimana hal ini berdasarkan pemikiran bahwa sejak konsepsi hingga kematian, perkembangan manusia diperintah oleh jam biologis yang mengatur waktu yang tepat untuk sejumlah perubahan. Yang kedua, penuaan adalah suatu kebetulan menyatakan organisme menjadi tua oleh sejumlah kejadian acak, seperti kerusakan DNA oleh radikal bebas, atau hanya wear and tear dari kehidupan sehari-hari. Teori tentang penuaan pun banyak bermunculan tetapi pada pokoknya dibagi menjadi 4 teori yaitu teori wear and tear, teori neuroendokrin, teori kontrol genetik dan teori radikal bebas (Goldman dan Klatz, 2007). Beberapa peneliti percaya bahwa mereka telah mengindentifikasi senyawa yang dapat berdifusi, yang dapat menghambat sintesis DNA, sehingga dengan demikian membuat sel menjadi berstatus pratua yang membuatnya tidak lagi mampu membelah. Selanjutnya, sindrom yang diturunkan pada penuaan prematur berhubungan dengan abnormalitas reparasi DNA (DNA repair) (Spector dan Spector, 2002). Dasar penuaan sel didukung oleh terbatasnya usia sel dalam biakan fibroblas manusia dimana dalam kondisi ideal mempunyai kemampuan membelah 50 kali. Fibiroblas dalam kasus Sindrom Werner, yaitu suatu penyakit penuaan prematur yang berhubungan dengan aberasi kromosom, memiliki umur pembelahan lebih pendek dalam biakan sel (Spector dan Spector, 2002). 11 Perubahan jaringan pengikat pada orang tua terjadi pada kita semua. Kulit menjadi kering, berkeriput dan tidak elastis, ini berkaitan dengan turunnya kandungan air pada kulit dari 86% pada bayi yang baru lahir menjadi 60% pada usia lanjut. Perubahan-perubahan juga terjadi pada jaringan antar sel yaitu fibroblas yang berkaitan dengan kolagen, elastin dan proteoglikan. Proteoglikan berkurang pada usia lanjut dan kandungan asam hialuronatnya menurun karena molekul ini mengikat air dengan mudah, dapat membantu menerangkan keringnya kulit orang-orang berusia lanjut. Juga serat elastin yang berkurang, menyebabkan hilangnya kelenturan kulit. Panjangnya usia sel pada lapisan kulit juga menurun, usia rata-rata sel epidermis turun dari 100 hari pada bayi yang baru lahir menjadi 46 hari pada usia lanjut. Situasinya menjadi lebih jelek karena disertai menurunnya mitosis epidermis. Perubahan-perubahan pada kulit lansia (Norman, 2003), bisa bersifat histologik, fisiologik maupun klinik, dan terjadi karena proses penuaan, baik bersifat intrinsik, maupun ekstrinsik (photoaging). Perubahan-perubahan tersebut antara lain bentuk dan ukuran sel, menurunnya melanosit, penurunan jumlah sel langerhans. Dermis relatif mengalami penurunan jumlah sel, vaskularisasi berkurang, hilangnya fungsi elastisitas, yang berakibat banyak terjadi kerutan (wrinkle). Demikian pula saraf, mikrosirkulasi serta kelenjar keringat mengalami penurunan secara garis besar, yang merupakan predisposisi untuk terjadinya penurunan termoregulasi, sensitivitas terhadap rasa panas. Kuku mengalami penurunan kecepatan pertumbuhan, dengan terjadinya penipisan pada lempeng kuku, serta terjadinya kerapuhan dan keretakan kelenjar lemak subkutan 12 mengalami atrofi, misalnya pada pipi, ekstremitas bagian distal, tetapi terjadi hipertrofi pada paha (perempuan) dan perut (pria) (Norman, 2003). Kolagen merupakan sejenis protein yang terbanyak terdapat didalam tubuh binatang dan manusia. Zat ini merupakan bagian fibrus (fibreous) utama didalam jaringan-jaringan kulit, tendo, ligamen, tulang rawan, tulang dan lensa mata. Dengan menetapkan usia biologis serat kolagen dari seorang individu maka usia biologis individu tersebut juga akan diketahui. Satu sifat kolagen yang telah diketahui sejak dahulu ialah bahwa serat kolagen (yang misalnya terdapat didalam jaringan tendon) mengkerut (kontraksi) bila serat tersebut dimasukkan didalam air panas (Alberts, dkk, 2002). 2.2. Fibroblas Fibroblast Gambar 2. 1 Fibroblas (Alberts, dkk, 2002) Jaringan ikat dibawah epithelial cell sheet yang sebagian besar disekresi oleh fibroblas 13 Setiap sel saling berhubungan satu dengan lainnya melalui berbagai cara. Waktu mereka bersatu membentuk jaringan atau organ. Beberapa jaringan, seperti epitel pembatas atau epitel penutup terdiri dari kelompok sel yang rapat dan saling melekat erat secara langsung dengan sedikit sekali ruang antara. Kelompok jenis ini adalah lunak dan lentur dan tidak dapat mempertahankan bentuk organ ataupun memperkuat seluruh tubuh. Sebenarnya jaringan penyambunglah yang mempersatukan sel-sel tersebut menjadi tubuh karena jaringan ini memiliki substansi interselular, secara harafiah jaringan penyambung merupakan zat antara sel. Zat ini merupakan kolagen yang adalah suatu protein yang dihasilkan dalam bentuk serabut yang amat kuat (seperti tendo dan ligamentum dan elastin) yang juga dibentuk menjadi serabut, serta mempunyai sifat-sifat kenyal. Diantara serabut-serabut elastik ini terdapat matriks atau zat dasar seperti agar-agar. Kombinasi serabut kuat dan serat elastik serta matriks memberikan kekuatan, bentuk dan gaya pegas pada tubuh. Pada rangka, zat antar sel ini diisi dengan garam-garam kalsium, menghasilkan tulang penyokong tubuh yang kuat (Mescher, 2010). Fibroblas adalah sel yang paling banyak terdapat dalam jaringan ikat. Fibroblas adalah sel memanjang yang dibedakan terutama oleh banyaknya anyaman retikulum endoplasma kasar yang melapisi rongga lebar dalam sitoplasmanya. Mikrokop eletron biasanya mengungkapkan, berkas-berkas kolagen dengan pita-pita transversal teratur yang khas, yang berhubungan erat dengan bagian luar sel. Ia berfungsi membuat serat dan substansi interselular amorf. Fibroblas aktif mempunyai banyak sitoplasma yang bercabang-cabang tidak teratur, Intinya lonjong, besar dan berwarna pucat, dengan kromatin halus 14 dan suatu anak inti yang jelas. Sitoplasmanya penuh dengan retikulum endoplasma kasar tetapi aparatus golginya berkembang dengan baik. Dua tahap aktivitas (yaitu aktif dan diam) diamati dalam sel ini. Sel dengan aktifitas sintetik besar secara morfologis berbeda dari fibroblas tenang yang tersebar di dalam matriks yang telah dibuatnya. Beberapa ahli histologi memakai istilah fibroblas untuk menyebut sel aktif dan sel diam disebut fibrosit (Mescher, 2010). Fibrosit adalah sel yang lebih kecil daripada fibroblas. Ia cenderung berbentuk gelendong, dengan lebih sedikit cabang-cabangnya daripada fibroblas. Ia memiliki inti yang panjang, lebih gelap, lebih kecil dan sitoplasmanya bersifat asidofil serta mengandung sedikit retikulum endoplasma kasar. Bila cukup dirangsang, fibrosit dapat berubah menjadi fibroblas dan aktivitas sintetiknya diaktifkan kembali. Hal ini terjadi pada penyembuhan luka dan dalam keadaan demikian sel-sel mengambil bentuk dan tampak seperti fibroblas muda. Miofibroblas, suatu sel dengan gambaran fibroblas dan otot polos, juga diamati selama penyembuhan luka. Sel ini mempunyai sifat morfologis sebagai suatu fibroblas tetapi mengandung banyak mikrofilamen aktin dan miosin. Aktivitas selsel tersebut berperan pada penutupan luka akibat cedera jaringan, suatu proses yang disebut kontraksi luka (Mescher, 2010). Fibroblas membuat serat-serat kolagen, retikulin, elastin, glikosaminoglikan dan glikoprotein dari substansi intersellular amorf. Serat kolagen adalah serat yang paling banyak dijumpai dalam jaringan penyambung. Serat-serat kolagen segar merupakan benang-benang tanpa warna, namun bila terdapat dalam jumlah besar akan menyebabkan jaringan tempat beradanya tampak putih, misalnya pada tendon dan aponeurosis (Mescher, 2010). 15 Serat kolagen bersifat tidak elastis dan karena konfigurasi molekulnya, memiliki daya rentang lebih besar dari baja. Akibatnya kolagen memberi gabungan fleksibilitas dan kekuatan unik pada jaringan yang menampungnya. Serat kolagen terdiri atas serabut tebal berhimpit padat, dengan garis tengah rata-rata 75 nm pada mamalia. Garis tengah serat bergantung pada jumlah fibril/serabut yang dikandungnya. Pada banyak bagian tubuh, serat kolagen tersusun dalam deretan pararel, membentuk berkas kolagen (Alberts, dkk, 2002) Fibroblas mensekresi molekul prokolagen ke dalam matriks intersel, dan polismerisasi mereka menjadi mikrofibril terjadi diluar sitoplasma tersebut.Pada orang dewasa, fibroblas dalam jaringan ikat jarang mengalami pembelahan. Mitosis hanya tampak bila organisme memerlukan fibroblas tambahan, yaitu bila jaringan ikat cedera (Spector dan Spector, 2002). 2.3. Regenerasi Kesembuhan merupakan prasyarat bagi regenerasi jaringan lain dan suatu bentuk regenerasi bagi dirinya sendiri, di sini terdapat pertumbuhan kembali epitel yang menutupinya dan jaringan pengikat yang melandasinya. Setiap jaringan yang beregenerasi jelas harus mengembangkan pembuluh darah, limfa, dan saraf yang baru. Ciri khusus jaringan pengikat yang mengalami rekonstitusi adalah aktivitas fibroblasnya. Fibroblas adalah sel mesenkim dasar jaringan dewasa yang sifat utamanya adalah sintesis komponen-komponen jaringan pengikat, yakni kolagen dan mukopolisakarida. Osteoblas dan kondrosit yang masing-masing membentuk tulang dan kartilogo barangkali merupakan keluarga dekat. Sesungguhnya fibroblas di tepi luka dapat terlihat membelah dan bermigrasi ke dalam luka pada saat yang sama dengan timbulnya kuncup-kuncup 16 pembuluh dan dengan laju kira-kira 0,2 mm per hari. Di dalam luka mereka terus membelah dan kira-kira enam hari sesudah datangnya fibroblas, fibril kolagen pertama dapat dikenali, dengan garis-garis melintang pada interval 64nm (Spector dan Spector, 2002). Komponen utama lain jaringan pengikat adalah matriks mukopolisakarida (glikosaminoglikan) dan ini juga disintesis oleh fibroblas. Komposisi kimianya sangat bervariasi dan tergantung pada tipe jaringan pengikatnya. Penting untuk dicatat bahwa hubungan antara stroma dan epitel yang menutupinya kompleks dan dinamis. Stroma sering dilukiskan sebagai substansi dasar atau fondasi, namun sesungguhnya tidak hanya demikian. Terdapat bukti yang meyakinkan bahwa sifat stroma, sel yang dikandungnya dan perilakunya sangat mempengaruhi sifat, diferensiasi dan proliferasi epitel yang menutupinya. Dengan lewatnya waktu terdapat orientasi dan perbaikan jaringan pengikat baru yang secara berangsur-angsur menjadi lebih padat, meskipun kebanyakan luka yang sedang sembuh mencapai kekuatan optimal penyatuannya dalam beberapa minggu kecuali jika jaringan yang hilang sangat banyak. Wilayah jaringan pengikat yang baru dan padat dikenal sebagai jejas/parut (Spector dan Spector, 2002). Fibroblas mempunyai sifat lain, yakni kontraktilitas. Untuk lebih tepatnya, ini merupakan fungsi miofibroblas, yakni suatu sel dengan ciri ultrastruktur dan fungsi fibroblas dan sel-sel otot polos. Kemampuan luka kulit untuk berkontraksi mengurangi ukurannya dalam kira-kira minggu pertama. Sel-sel berkontraksi dalam menanggapi rangsangan yang sampai sekarang belum diketahui namun tentu saja dengan pertolongan fibril-fibril sitoplasmanya, yakni aktomiosin. 17 Sementara mereka menarik tepi-tepi luka sehingga mengurangi ukuran daerah yang telanjang (Spector dan Spector, 2002). Fibroblas adalah sel yang paling mudah dikultur dari vertebrata dan telah digunakan sangat luas dalam banyak penelitian kultur jaringan. Kultur yang paling awal diadakan pada awal abad 20 (Carrel, 1912), maka sampai saat ini sudah hampir punya pengalaman 100 tahun dengan jenis sel ini. Banyak teknik kultur jaringan paling awal menggunakan sel yang bertumbuh pada darah beku. Dalam pengamatan, alasan terbesar keberhasilan dengan kultur fibroblas adalah fibroblas berperan penting dalam penyembuhan luka, dan respon ke faktor pertumbuhan selama pembekuan darah sebagai bagian dari fungsi fisiologis normalnya. Fibroblas dapat dikultur dari organ apapun sebagaimana sumber yang paling selalu tersedia untuk primary cell. Dalam penelitian perubahan mutasi, fibroblas lebih unggul dari lymphocytes, dimana genomenya tidak mengalami penataan ulang (no rearrangements) dan fibroblas telah digunakan untuk menggandakan (clone) hewan (Schnieke, dkk., 1997). Sebagai sumber yang mudah dari adherent, primary cell, fibroblas telah digunakan untuk berbagai kegunaan termasuk fisiologi sel, analisa siklus sel, diferensiasi dan penuaan, carcinogenesis, identifikasi onkogen, penelitian transfection dan protein recombinant. Adapun macam-macam growth faktor yang sangat mendukung proliferasi fibroblas, seperti untuk suatu penyembuhan luka yang melibatkan reepithelialisasi, pembentukan jaringan granulasi, proses inflamasi, terdeteksi interleukin IL-1, IL6, GM-CSF (Granulocyte Macrophage Colony Stimulating Factor), TGF (Transforming Growth Factor TGF (Transforming Growth Factor ), 18 NGF (Nerve Growth Factor), PDGF (Platelet Derived Growth Factor) dan FGF (Fibroblast Growth Factor) (Luger dan Schwarz, 2000). 2.4. Galur Sel NIH/3T3 Gambar 2. 2 Galur Sel NIH/3T3 Salah satu karakteristik hewan yang paling utama adalah bahwa mereka multiselular dengan kata lain, mereka terdiri dari banyak sel. Multiseluler ini terdiri dari sel–sel dengan spesialisasi berbeda-beda. Istilah kultur sel digunakan untuk berbagai kultur yang berasal dari sel-sel yang terdispersi yang diambil dari jaringan asalnya, dari kultur primer, atau dari galur sel atau cell strain secara enzimatik, mekanik, atau disagregasi kimiawi. Banyak sel-sel hewan, dengan perawatan khusus, dapat diinduksi untuk tumbuh di luar organ atau jaringan asal. Sel, jaringan atau organ yang terisolasi dapat tumbuh di cawan plastik ketika mereka disimpan pada suhu yang ditetapkan 19 dengan menggunakan inkubator dan dilengkapi dengan media yang mengandung nutrisi sel dan faktor pertumbuhan. Sebagian jenis sel yang berbeda, dapat tumbuh dalam kultur termasuk elemen jaringan ikat yaitu fibroblas, jaringan tulang (tulang dan tulang rawan), tulang, jantung dan otot polos, jaringan epitel (hati, paru-paru, payudara, kulit, kandung kemih dan ginjal), sel saraf (neuron dan sel glial), meskipun neuron tidak berkembang biak in vitro), sel endokrin (adrenal, hipofisis, sel-sel islet pankreas), melanosit dan banyak berbagai jenis sel tumor. Perkembangan teknik-teknik kultur jaringan dibagi dalam dua cabang utama penelitian medis: kanker dan penelitian virologi. Sejak dikembangkannya Laboratorium Kultur Sel dan Jaringan di Unit Penelitian Kesehatan Fakultas Kedokteran Universitas Padjadjaran pada tahun 1997, hingga kini beberapa jenis kultur sel telah berhasil dikembangkan, antara lain kultur fibroblas yang diisolasi baik dari preputium maupun chick / mouse embryo, sel endotel yang diisolasi dari porcine aorta, sel otot jantung yang diisolasi dari mouse embryo, dan sel tiroid yang diisolasi dari jaringan tumor tiroid. Isolasi berbagai sel di atas dilakukan dengan menggunakan teknik dispersi enzimatik maupun mekanik. Pemanfaatan teknologi ini banyak membantu penyelesaian penelitian para peserta program pasca sarjana maupun para peneliti yang memperoleh hibah penelitian dari berbagai sumber. 3T3 sel berasal dari sebuah galur sel yang dibuat tahun 1962 oleh dua ilmuwan kemudian di Departemen Patologi di New York University School of Medicine, George Todaro dan Howard Green. Galur sel 3T3 telah menjadi standar galur fibroblas yang dapat diperoleh dari jaringan embrio tikus Swiss (Todaro dan Green, 1963) 20 The '3-T3 adalah singkatan dari "3-hari transfer, inokulum 3 x 105 sel." Galur sel ini berasal dari sel-fibroblas embrio tikus primer yang dikultur sesuai dengan aturan atau protokol, yang disebut '3T3 protokol '. Sel-fibroblas embrio tikus primer ditransfer ( "T") setiap 3 hari (yang pertama "3"), dan diinokulasi pada kepadatan dari 3 x 10 5 sel-sel per 20-cm ² piringan ("3" yang kedua) terusmenerus. Sel-sel yang secara spontan diabadikan dengan tingkat pertumbuhan stabil setelah dikultur dalm 20-30 generasi, dan kemudian bernama '3T3 'sel. Galur sel (Cell line) terus menerus dibentuk dari kultur NIH mouse embrio Swiss (Todaro dan Green, 1963). Galur sel NIH13T3 rentan terhadap pembentukan fokus sarkoma virus dan virus leukemia serta berharga untuk studi transfection DNA. Telah digunakan untuk ekspresi rekombinan protein, termasuk antigen hepatitis B, hidroksilase fenilalanin, hormon pertumbuhan tikus, rekombinan fibronektin, human class antigen I1 MHC n, insulin reseptor manusia dan faktor pertumbuhan seperti insulin. Sel-sel dikultur dengan mengunakan DMEM + 10% FBS. Sel – sel sangat mudah dihambat dan sangat sensitif terhadap kumpulan serum. Sel tumbuh dan dipelihara pada temperatur dan campuran gas yang sesuai (biasanya, 37ºC, 5% CO2 untuk sel mamalia) dalam inkubator sel. Kondisi kultur berbeda-beda untuk setiap jenis sel dan variasi kondisi untuk tipe sel tertentu dapat menghasilkan phenotype yang berbeda yang sedang diekspresikan. Selain suhu dan campuran gas, faktor yang paling sering bervariasi dalam sistem kultur adalah media pertumbuhan. Kondisi yang mempengaruhi media pertumbuhan dapat bervariasi seperti pH, konsentrasi glukosa, faktor pertumbuhan, dan adanya zat 21 gizi lain. Faktor-faktor pertumbuhan yang digunakan untuk melengkapi media sering berasal dari darah binatang, seperti FBS (Selborne, 2006) Galur sel NIH3T3 yang dipakai untuk penelitian ini diambil dari pabrik American Type Culture Collection (ATCC) dengan data sebagai berikut : NIH/3T3 (ATCC) Jenis Sel Fibroblast (Connective Tissue Cells, Galur sels) Deskripsi Swiss NIH embryonic fibroblast Karakteristik Adherent Spesies Tikus Pemasok American Type Culture Collection (ATCC) Klon CCL-92 Asal Jaringan Embryo Tahap Pengembangan Embryonic Jaringan Protokol yang Nucleofector (PDF, 98 KB) 96-well Shuttle Dioptimalkan (PDF, 129 KB) Related Citations Nucleofection of NIH/3T3 22 Gambar 2.2.1. Albino Swiss Mouse Embryo Fibroblast 2.5. Serum Fetus Sapi (Fetal Bovine Serum) Dalam sistem kultur in vitro tersedia berbagai jenis sel yang merupakan model ideal untuk substitusi dari percobaan hewan di sebagian besar kasus (Sasse, dkk, 2000). Dalam sebagian besar sistem kultur, serum fetus sapi (Fetal Bovine Serum, FBS) adalah komponen penting untuk pertumbuhan dan pemeliharaan sel. Ini adalah campuran kompleks rendah dan tinggi berat molekul biomolekul dengan berbagai pemicu pertumbuhan (growth promoting) dan sifat-penghambat pertumbuhan. Toksisitas rendah dan pemicu pertumbuhan dari FBS, membuat FBS menjadi suplemen yang populer dalam kultur in vitro pada sel mamalia. Namun, hewan tetap berpotensi sebagai sumber kontaminan mikrobiologi, khususnya Mycoplasma, virus sapi, dan patogen-patogen lainnya, dan agen yang dapat menyebabkan ensefalopati spongiform sapi atau penyakit Creutzfeldt-Jakob (Klein dan Dumbledore, 1993) 23 Pemasok menggunakan serangkaian teknik, termasuk filtrasi dan/atau radiasi, untuk mengurangi kontaminasi mikroba apapun. Sebagai akibat dari masalah ini, sel dan organ transplantasi program tidak merekomendasikan penggunaan suplemen FBS (Koivisto, dkk, 2004). Selain itu, penggunaan klinis FBS juga melibatkan peradangan lokal, produksi antibodi terhadap xenoproteins, dan non engraftment karena respon imun xenogenic (Stute, dkk, 2004). Semua faktor-faktor ini meningkatkan pertanyaan tentang biosafety yang terlibat dalam penggunaan FBS dalam sistem sel yang membawa potensi terapeutik. Alternatif untuk FBS termasuk penggunaan serum kambing (Paranjape, 2004), cairan mata sapi dalam kombinasi dengan plasma defibrinated domba, dan serum autologus darah manusia ([ABS]; Filipic, dkk, 2002 ). Sebelumnya upaya untuk menggantikan FBS oleh serum kambing pada kultur sel, terutama sel-sel hibridoma, menghasilkan sukses kecil karena mengatasi sifat racun dari serum kambing. Penambahan campuran kedelai untuk serum kambing diusulkan agar kompatibel dengan FBS, namun kultur jangka panjang menunjukkan angka kematian yang lebih tinggi dengan serum kambing (Deshpande, dkk, 2000). Daya tahan hidup sel monosit-koloni-membentuk granulosit dari pasien dengan leukemia granulositik kronis dalam kultur cairan telah terbukti tergantung pada tambahan faktor yang terdapat dalam serum autologus darah manusia atau hUCBS (Human Umbilical Cord Blood Serum (hUCBS)), tetapi tidak dalam FBS (Frassoni, dkk, 1987). Meskipun penggunaan alternatif serum kambing atau sapi yang diberikan dapat menyebabkan pertumbuhan yang memuaskan untuk jenis sel tertentu (Paranjape, 2004), mereka tetap mempunyai keterbatasan yang sama dalam 24 membatasi penggunaan serum tersebut seperti dalam kultur sel untuk transplantasi manusia. Gambar 2. 3 Fetus Sapi 2.5.1. Proses Terjadinya FBS FBS (atau Serum Janin Anak Sapi) adalah bagian dari plasma yang tersisa setelah dikeluarkannya faktor-faktor pembekuan darah, dimana selama proses fibrinogen, protein plasma diubah menjadi fibrin dan tetap berada di belakang proses pembekuan darah. FBS berasal dari darah yang diambil dari fetus sapi yang belum lahir melalui venapuncture sistem tertutup di rumah potong hewan. Protein globular, bovine serum albumin (BSA), adalah komponen utama dari FBS. Variasi kaya protein dalam FBS dalam memelihara sel dikultur dalam media di mana mereka dapat bertahan hidup, tumbuh, dan membelah. FBS dikumpulkan dari darah hewan anak sapi yang diambil di Rumah Pemotongan Hewan. Darah diisi kedalam botol plastik yang telah disterilkan atau kantong darah dan disimpan dalam freezer untuk memungkinkan pembekuan. Kemudian darah akan dikirim ke laboratorium untuk pemrosesan. Darah disentrifugasi untuk memisahkan komponen cair dan padat. Serum adalah bagian 25 dari plasma yang tersisa setelah faktor-faktor pembekuan darah, fibrinogen, protein plasma diubah menjadi fibrin yang merupakan faktor yang berperan dalam proses pembekuan. Serum adalah bagian yang bewarna kekuningan dari seluruh darah. Bekuan serum ini disimpan dalam freezer kemudian dikirim laboratorium untuk di filtrasi dan disteril. Setelah penyaringan, serum siap dijual dan digunakan. Serum membutuhkan pengujian dan Sertifikat Analisis data untuk validitas dan verifikasi. Pengujian meliputi sebagai berikut: pernyataan Filtrasi, negara asal, pengujian sterilitas untuk bakteri, bakteriofag, mycoplasma, endotoksin, hemoglobin, virus, IgG, total protein, besi, jejak logam, dan hormon. ISIA yang didirikan Juni 2006 mempromosikan dan menjamin kualitas dan standar industri yang sebelumnya unstandardized. Sebelum filtrasi dan steril, dua uji diperlukan untuk menentukan kualitas serum, tingkat endotoksin dan hemoglobin. FBS secara komersial telah tersedia dan dibuat oleh banyak produsen. Adapun salah satu produsen yang membuat FBS adalah Gibco Invitrogen yang profil FBSnya dapat dilihat pada tabel 2.1. FBS harus disimpan beku sebelum ditambahkan ke media dalam rangka untuk mencegah kontaminasi. Ketika pencairan FBS, meskipun itu akan memakan waktu lebih lama, maksimal serum tersebut harus dipanaskan pada suhu kamar dan tidak dengan air bersuhu 37 derajat. Ketika melakukan kultur sel, botol serum janin sapi harus dibuka dan ditutup dalam tudung biosafety, dan orang yang menggunakan serum tersebut harus telah dilatih untuk melakukan manipulasi steril (FDA, 1991). 26 Tabel 2. 1 Profil dari FBS GIBCO Description Average Range N Endotoxin 0.356 ng/ml 0.008–10.0 39 pH 7.4* 7.20–7.60 40 Calcium (Ca2+) 13.6/100ml 12.6–14.3 43 Chloride (Cl-) 103 meq/L 98–108 43 Inorganic Phosphorous 9.8 mg/100*ml 4.3–11.4 43 Potassium (K+) 11.2 meq/L 10.0–14.0 43 Selenium 0.026 µg/ml 0.014–0.038 25 Sodium (Na+) 137meq/L 125–143 43 Alkaline Phosphatase 255 mU/ml 111–352 43 Blood Urea Nitrogen 16 mg/100 ml 14–20 43 Creatine 3.1 mg/100 ml 1.6–4.3 43 Direct Bilirubin 0.2 mg/100 ml 0.0–0.5 43 Glucose 125 mg/100 ml 85–247 43 Hemoglobin 11.3 mg/100 ml 2.4–18.1 17 Lactate Dehydrogenase 864 mU/ml 260–1,215 43 Transaminase 130 mU/ml 20–201 43 Total Bilirubin 0.4 mg/100 ml 0.3–1.1 43 Uric Acid 2.9 mg/100 ml 1.3–4.1 43 Cholesterol 31 mg/100 ml 12–63 43 Cortisol 0.5 µg/ml <0.1–2.3 43 Follicle Stimulating Hormone 9.5 ng/ml <2–33.8 34 Growth Hormone 39 ng/ml 18.7–51.6 40 Leutinizing Hormone 0.79 ng/ml 0.12–1.8 38 Parathyroid Hormone 1718 pg/ml 85–6,180 41 Progesterone 8 ng/100 ml <0.3–36 42 Inorganic Salts Other Components Serum Glutamate Oxalacetate Steroids and Hormones 27 Prolactin 17.6 ng/ml 2.00–49.55 40 Prostaglandin E 5.91 ng/ml 0.5–30.48 37 Prostaglandin F 12.33 ng/ml 3.77–42.00 38 T3 119b ng/100 ml 56–233 41 T4 12.1 ng/100 ml 7.8–15.6 42 Testosterone 40 ng/100 ml 21–99 42 Thyroid Stimulating Hormone 1.22 ng/ml <0.2–4.5 40 Total Protein 3.8 g/100 ml 3.2–7.0 43 Albumin 2.3 g/100 ml 2.0–3.6 43 Insulin 10 mU/ml 6–14 40 Protein N = SAMPEL 2.6. Selaput Janin dan Plasenta Gambar 2. 4 Normal Placenta (Grunebaum, 2008) 28 Tali pusat janin diliputi oleh amnion dan mengandung: 1. Dua arteri umbilikalis. 2. Satu pembuluh balik atau vena umbilikalis. 3. Agar-agar wharton yang berperan sebagai bantal pelindung bagi pembuluh- pembuluh. 2.6.1. Peredaran Darah Plasenta Kotiledon menerima darahnya melalui 80-100 arteria spiralis yang menembus lempeng desidua dan memasuki ruang antar jonjot dengan jarak yang kurang lebih teratur. Rongga arteria spiralis adalah sempit, yang mengakibatkan peningkatan tekanan darah sewaktu memasuki ruang antar jonjot dan memandikan sejumlah besar jonjot kecil dari cabang-cabang jonjot dengan darah yang kaya oksigen (Sadler, 2010). Pada waktu tekanan menurun darah mengalir kembali dari lempeng korion ke desidua, dimana daerah yang berasal dari danau-danau antar jonjot mengalir kembali ke dalam peredaran ibu melalui pembuluh balik endometrium. Gambar 2. 5 Peredaran Darah Plasenta (King, 2003) 29 Gambar 2. 6 Peredaran Darah Plasenta (Vorvick, dkk, 2010) Sejak bulan keempat dan seterusnya sawar plasenta menjadi jauh lebih tipis, sehingga endotel yang membatasi pembuluh kemudian melekat erat pada selaput sinsitium dengan demikian sangat meningkatkan kecepatan pertukaran zat. Oleh karena darah ibu dalam ruang antar jonjot dipisahkan dari anak oleh sawar plasenta, yang dibentuk oleh unsur-unsur korion, plasenta manusia dianggap dari jenis hemokorialis. (Sadler, 2010). Trophoblast plasenta membuat berbagai macam faktor-faktor pertumbuhan seperti insulin like growth factor ( IGF ), transforming growth factor-b ( TGF-b), dan vascular endothelial growth factor (VEGF). Telah diuji pula sejumlah co stimulating faktor yang berada pada plasma hUCB. (Savarese,dkk, 2007) 2.6.2. Fungsi Plasenta Fungsi utama plasenta (Sadler, 2010) : 1. Pertukaran gas. 2. Pertukaran zat gizi dan dan elektrolit. 3. Penyaluran antibodi ibu yang dipersiapkan bagi kekebalan pasif janin. 4. Pembentukan hormon. 5. Detoksifikasi beberapa obat. 30 2.7. Darah Tali Pusat Manusia / Human Umbilical Cord Blood (hUCB) Sejak tahun 1989, kesadaran manusia akan kegunaan plasenta makin meningkat, bahkan bukan hanya pada penggunaan plasenta saja, melainkan juga pada penggunaan hUCB dimana terdapat sel-sel induk muda yang tersedia sebagai sumber sel batang hematopoetic transplantasi sumsum tulang. Keberhasilan dalam melakukan transplantasi allogenic hUCB manusia (human umbilical cord blood atau birth cord atau funiculus umbilicalis) ke seorang anak penderita anemia Fanconi di Paris (Gluckman, 1989) semakin membuka lembar baru dalam pemanfaatan hUCB yang sebelumnya dianggap tidak berguna sehingga mulai berkembanglah minat dunia sains untuk meneliti lebih dalam tentang potensi yang terkandung dalam hUCB. Saat ini hUCB termasuk salah satu topik yang paling banyak diminati di dunia riset. Sebagai manusia baru yang tumbuh dan berkembang dalam ibunya, terbentuklah plasenta yang berisi darah untuk memberi nutrisi bagi semua organorgan vital janin dan untuk membawa produk limbah kembali ke ibu. Darah janin di dalam plasenta yang berisi produk-produk limbah dari janin ditukar dengan produk nutrisi dan oksigen dari ibu melalui vena umbilikalis. Sekitar 30% - 40% darah dari janin, beredar didalam plasenta setiap saat untuk mengalir dari dan kembali ke ibu. Kehamilan merupakan hal yang dramatis bagi perubahan molekul dan biokimia dimana terdapat penyatuan antara dua genom yang terpisah atau berbeda yaitu janin dan ibu, beroperasi di dalam satu tubuh yaitu tubuh ibu. Ada interaksi langsung dan tidak langsung antara ibu, embrio atau janin, plasenta, membran ekstraamnion dan cairan ketuban. Dan hUCB membawa semua nutrisi 31 yang dibutuhkan untuk memenuhi persyaratan pertumbuhan dari organisme sesuai dengan usia kehamilan (Bhattacharya, 2009). Keuntungan penggunaan hUCB sebagai sumber transplantasi sel induk adalah: (Ryan, 2005) 1. Kemudahan pengadaan, pengolahan, dan penyimpanan. 2. Tidak ada risiko donor. 3. Memiliki immunogenicity yang lebih rendah 4. Isolasinya tidak membutuhkan prosedur yang invasif 5. Penerimaannya tidak membutuhkan ketepatan 100% HLA (human leucocyte antigen) Kerugian penggunaan sel induk yang berasal dari hUCB sebagai sumber batang sel untuk transplantasi adalah: 1. Terbatasnya jumlah sel-sel batang hematopoetic dalam unit hUCB yang mungkin mengakibatkan gagal atau tertunda atau dibatasinya hematopoetic yang akan digunakan pada orang dewasa. 2. Kemungkinan kelainan sel-sel induk dari hUCB, misalnya, keganasan, mutasi, yang mungkin berpengaruh pada penerima. 3. Tidak mungkin untuk mengumpulkan sel-sel induk donor tambahan, atau limfosit donor bagi penerima yang telah melakukan transplantasi sel induk hUCB. Proses pengambilan hUCB berlangsung singkat, begitu lahir, tali pusat diikat dan diambil sebanyak empat tabung dengan menggunakan suntikan. hUCB dikirim ke bank hUCB dan disimpan untuk diproses. 32 Menurut penelitian metode pengambilan darah dengan kantong darah lebih aman dari resiko pencemaran dibandingkan dengan metode jarum suntik, caranya tali pusat dibersihkan dengan iodine dan jarum dari kantong darah dan ditusukkan ke vena tali pusat. Darah akan mengalir ke kantong darah. Proses ini tidak menyakitkan, tidak invasif, tidak beresiko dan tidak menyakiti ibu dan bayi. Pengambilan ini memerlukan waktu kurang dari lima menit. Lebih mudah diambil sewaktu plasenta belum lahir. hUCB dapat diisolasi dengan dua cara, yaitu secara in utero (saat plasenta masih di dalam rahim) dan ex utero (saat plasenta sudah di luar rahim). Literatur menunjukkan bahwa dengan isolasi secara in utero, bisa didapatkan 100ml darah sedangkan dengan isolasi secara ex utero hanya bisa didapatkan 80ml (Craven dan Ward, 2000). Pada mulanya, transplantasi dilakukan dengan whole blood yang berarti bahwa hUCB ditransplantasikan secara utuh, tanpa dipisahkan komponennya terlebih dahulu. Penggunaan whole blood untuk transplantasi memiliki risiko timbulnya reaksi graft vs host disease (GVHD) yang lebih tinggi, antara lain karena adanya inkompatibilitas yang disebabkan oleh antigen permukaan sel darah merah yang ikut tertransplantasi (antigen ABO), namun ada juga literatur yang menyatakan bahwa inkompatibilitas ABO tidak menimbulkan reaksi GVHD yang berat (Wagner, dkk, 1995). Saat ini penggunaan hUCB dalam terapi lebih banyak dilakukan untuk pasien kanker yaitu dengan transplantasi hematopoetik sel punca (stem cell), sementara untuk penggunaan yang lain relatif masih sangat sedikit. 33 2.7.1. Serum darah tali pusat manusia / Human Umbilical Cord Blood Serum (hUCBS). Sebagai alternatif penggunaan serum sebagai media untuk kultur, serum autologus darah manusia telah digunakan di beberapa laboratorium. Namun, 10% serum autologus darah manusia saja tidak dapat mendukung pertumbuhan dan proliferasi sel mesenkimal invitro kecuali dilengkapi dengan faktor-faktor pertumbuhan seperti Epidermal Growth Factor (EGF), Fibroblast Growth Factor (FGF2), dan Bone morfogenetik Protein-4 (BMP4) (Phadnis, dkk, 2008) Karenanya serum tali pusat manusia (Umblical Cord Blood Serum, hUCBS) dilihat lebih baik dalam mendukung proliferasi sel karena mengandung konsentrasi yang lebih tinggi dari pertumbuhan dan faktor diferensiasi dibandingkan dengan yang ada di darah perifer dewasa. Disamping itu, darah perifer manusia bukanlah bahan buangan seperti halnya darah tali pusat manusia yang akan dibuang/tidak terpakai segera setalah bayi dilahirkan. hUCBS merupakan sumber yang lebih kaya berbagai sitokin dan berbagai macam faktor pertumbuhan yang diperlukan untuk pertumbuhan dan kelangsungan hidup dari berbagai jenis sel seperti sel punca, jaringan maupun organ. (Savarese, dkk, 2007). Sitokin menggambarkan berbagai kelompok protein yang memodulasi aktivitas fungsional sel. Faktor pertumbuhan ( atau istilah yang sering dipakai growth factor) menggambarkan substansi yang mendorong pertumbuhan sel, tetapi dalam penelitian selanjutnya tidak ada pemisahan yang jelas atara sitokin dan faktor pertumbuhan tersebut sehingga istilah tersebut sering digunakan sinonim walaupun tidak semua sitokin berperan sebagai faktor pertumbuhan.(COPE, 2010). Sitokin bertanggung jawab untuk stimulasi atau 34 inhibisi produksi, differntiation, atau pergantian ataupun prekursor sel darah dewasa.(Bagby dan Heinrich, 2000) Lam, 2001, telah menggunakan autologous plasma UCB manusia untuk pengembangkan sel induk manusia. Autologous plasma hUCB juga telah digunakan untuk kultur T sel untuk mengadopsi immunotherapy ( Kim, 2005). Kandungan hUCBS menurut beberapa penelitian di antaranya 0,48 ng/mL Epidermal Growth Factor (EGF), 230,85 ng/mL Vitamin A, 57.15ng/mL Transforming Growth Factor-β (TGF-β) (Yoon, dkk, 2005), 245,3 pg/mL Substance P, 239 pg/mL Insuline Growth Factor-I (IGF-I), 729,7 pg/mL Nerve Growh Factor (NGF) (Yoon,dkk., 2007), 7.95 pg/mL basic Fibroblast Growth Factor (bFGF), 504,51 pg/mL Vascular Endothelial Growth Factor (VEGF), 9,32 pg/mL Placental Growth Factor (PGF), 121,38 soluble Fms-like Tyrosine Kinase1 (sFlt-1), 6804,66 pg/mL soluble Kinase Domain Receptor (sKDR) (Wallner, dkk., 2007), 27,0 Transforming Growth Factor-α (TGF-α) (Wagner, dkk., 2001), 8,4 ng/mL Leptin (Pighetti, dkk., 2003). Yang dimaksud dengan darah adalah plasma (cairan darah) beserta butirbutir (a) eritrosit (darah merah), (b) lekosit, limfosit, monosit ( darah putih), dan (c) trombosit. Serum adalah cairan yang didapat jika darah dibiarkan membeku, merupakan plasma yang telah kehilangan fibrinogen (unsur pembeku darah). Serum juga merupakan bagian darah yang mengandung zat anti (antibody) terhadap macam-macam racun (toxin) yang dikeluarkan bakteri atau virus. Oleh karena itu, imunisasi melalui suntikan biasanya dilakukan dengan penyuntikan suatu zat yang dinamakan 'antiserum'. Antiserum ini sebenarnya adalah serum yang diambil dari makhluk lain yang sengaja disuntikkan suatu bakteri atau virus 35 sehingga memproduksi zat anti yang tersimpan di dalam serumnya. Dengan kemajuan teknologi antiserum ini dapat diganti dengan materi lain melalui rekayasa genetik. (Williams, 2001) Aliran darah bayi dalam kandungan berbeda dengan manusia yang sudah dilahirkan. Selama dalam kandungan ibu, sebagian darah bayi dialirkan melalui pembuluh nadi di tali ari (umbilicus) menuju plasenta. Di sana darah akan melepas sisa pembakaran melalui proses penyerapan oleh darah ibu dan mengambil oksigen serta makanan yang berasal dari darah ibu. Dari plasenta darah dialirkan melalui pembuluh balik tali ari (vena umbilicalis) ke hati untuk diolah, tetapi karena hati belum berfungsi dan kandungan makanan sudah selesai diolah oleh hati ibu, darah langsung dialirkan ke serambi kanan jantung. Sebagian besar darah dialirkan ke serambi kiri melalui sebuah lubang yang disebut foramen ovale yang akan segera menutup segera setelah dilahirkan (Sadler, 2010). Jadi umumnya, serum darah adalah cairan yang berwarna bening bila darah diendapkan. Beberapa ciri-cirinya: Bewarna jernih putih kekuningan. Mengandung antibodi, antigen, hormon, cairan elektrolit, semua substansi exogenous. Macam antibodi : Presipitin, berperanan dalam menggumpalka antigen. Lisin, berperanan dalam menguraikan kuman. Antitoksin, berperanan dalam menawarkan racun. 36 2.7.2. Proses Terjadinya Serum Darah Tali Pusat Manusia (hUCBS) hUCB membeku untuk 8 sampai 16 jam pada suhu kamar. hUCB diproses sebelum 2x24jam sejak pengambilan dari plasenta. hUCB dapat diambil dari vena umbilikalis plasenta baik in utero maupun ekstrautero. Setelah diambil dengan menggunakan spuit, darah di masukan ke 10-ml tabung – tabung vacutainer tanpa anticoagulants. Darah lalu disentrifugasi pada 4000 rpm selama 10 menit pada 4 o C , kemudian serum yang terbentuk dikumpulkan ke dalam wadah / tabung steril. Seluruh serum dithawing dan dikumpulkan dalam becker glass serta dihomogenkan. Serum dikumpulkan menjadi satu untuk menghilangkan variasi / karakteristik dari masing-masing donor hUCB. Serum donor disterilkan dengan cara disaring melalui filter membran 0,45 m Sarstedt, Numbrecht, Germany. Kemudian diinakitvasi dengan menaikan suhu sebesar 56oC selama 30 menit. Setelah diinaktivasi, serum disimpan dalam suhu -40°C. 2.8. Protein Protein merupakan unsur molekular utama dari membran (>50%, w/w), dapat dibagi dalam dua kelompok. Protein integral adalah segolongan protein yang secara langsung terikat pada lapis ganda lipid sedangkan protein perifer tampak tidak begitu erat tergabung pada permukaan membran (Koolman dan Rohm, 2001). Protein dapat dibagi secara kasar menjadi lima kelompok, yaitu albumin, dan 1 globulin, 2 globulin, globulin dan -globulin. Pembagian menjadi albumin dan globulin dahulu dianggap berdasarkan kelarutannya. Protein apapun dan berasal dari makhluk apapun juga ternyata hanya tersusun dari 20 macam 37 asam amino saja. Protein adalah biomolekul yang sesungguhnya, karena senyawa ini yang menjalankan berbagai fungsi dasar kehidupan, antara lain protein berkontraksi melakukan gerak, pengendali pertumbuhan dengan adanya faktorfaktor pertumbuhan, menjalankan berbagai proses metabolisme dalam bentuk enzim (Sadikin, 2001). Adapun fungsi dari protein adalah (Koolman dan Rohm, 2001) 1. Membentuk dan mempertahankan struktur dimana protein bertanggung jawab terhadap stabilitas mekanik dari organ dan jaringan. 2. Transpor, yang terkenal adalah hemoglobin dari eritrosit, transferin untuk ferro, ceruloplasmin untuk Cu, dll. 3. Perlindungan dan pertahanan, dengan pembentukan sistim imun seperti immunoglobulin dan fibrinogen. 4. Pengendali dan pengatur pertumbuhan, seperti faktor-faktor pertumbuhan. 5. Katalisator yaitu enzim. 6. Penyimpanan, sebagai cadangan energi yang dimobilisasi dalam keadaan darurat. 7. Koordinasi Gerak. Protein merupakan komponen utama dalam otot, dimana kontraksi otot berlangsung akibat pergeseran 2 jenis filamen protein, aktin dan miosin. 8. Penunjang mekanis. Ketegangan kulit dan tulang disebabkan oleh adanya kolagen yang merupakan protein fibrosa. 9. Membangkitkan dan menghantar impuls saraf. Respon sel saraf terhadap rangsang spesifik diperantarai oleh protein reseptor, misalnya rodopsin. 38 Faktor pertumbuhan merupakan salah satu protein yang secara alami mampu merangsang pertumbuhan sel, proliferasi dan differensiasi sel. Beberapa macam faktor pertumbuhan yang kita kenal adalah Nerve Growth Factor (NGF), Platelet Derived Growth Factor (PDGF), Thrombopoietin (TPO), Transforming Growth Factor Alpha (TGF- ), Transforming Growth Factor Beta (TGF- ), Tumour Necrosis Factor Alpha (TNF- ), Vascular Endothelial Growth Factror (VEGF), Fibroblast Growth Factor (FGF), Interleukin 1 (IL-1), dll. Faktor-faktor tersebut memiliki peranan penting dalam penyembuhan luka sertadalam pemeliharaan dan pertumbuhan jaringan normal (Rogers, 2011). Banyak faktor pertumbuhan diketahui bertindak pada membran eksternal sel dan berinteraksi dengan reseptor protein khusus, serta memicu perubahan sel selanjutnya, termasuk peningkatan kadar kalsium yang membuat sel lebih alkali dan penambahan gugus fosfat dalam asam amino tirosin. Respon kompleks dari sel untuk faktor pertumbuhan ini merupakan dasar yang penting untuk mengontrol proliferasi sel. Jika faktor pengendali dari faktor pertumbuhan ini gagal, maka memungkinkan sel terus membagi sehingga mendorong pembentukan tumor atau kanker (Rogers, 2011). Pengaturan urutan ekspresi informasi genetik sangat penting bagi pertumbuhan yang beraturan serta differensiasi sel. Hanya bagian kecil genom dalam sel yang akan diekspresikan untuk meredam segmen spesifik suatu DNA dalam suatu sel. Pertumbuhan dan differensiasi sel diatur oleh protein faktor pertumbuhan. Misalnya faktor pertumbuhan saraf (Nerve Growth Factor, NGF) akan merangsang pertumbuhan jaringan saraf, faktor pertumbuhan fibroblas (Fibroblast growth factor, FGF) akan merangsang pertumbuhan fibroblas. Aktifitas sel-sel 39 yang berbeda pada organisme multisel dikoordinasi oleh hormon dan banyak hormon seperti insulin dan TSH (Thyroid Stimulating Hormone) merupakan protein (Stryer, 2000). Peningkatan proliferasi fibroblas disebabkan oleh faktor-faktor pertumbuhan yang terdapat pada protein sehingga diharapkan pada hUCBS akan mengandung protein lebih banyak disbanding FBS. Gambar 2. 7 Bayi dan Tali Pusat 40 Gambar 2. 8 Tali Pusat dan Vena Umbilikalis Gambar 2. 9 Pengambilan HUCB Gambar 2. 10 Plasenta dan Tali Pusat BAB III KERANGKA KONSEP DAN HIPOTESIS 3.1. Kerangka Konsep Penelitian Berdasarkan rumusan masalah dan tinjauan pustaka, maka dapat disusun kerangka konsep sebagai berikut : Galur sel NIH3T3 yang ditumbuhkan di berbagai laboratorium dengan berbagai teknik memiliki sifat yaitu: tumbuh di kultur sebagai sel yang melekat dengan lama hidup tertentu. Fibroblas memiliki kemampuan untuk membuat kolagen, glycosaminoglycan, retikuler, elastin serat, dan glikoprotein yang ditemukan dalam matriks ekstraselular sehingga peningkatan fibroblas mempengaruhi elastisitas kulit, kelenturan otot, kekuatan tulang, dll dimana hal ini sangat penting dalam menunda proses penuaan dini. Penggunaan FBS dalam berbagai kultur sel mempunyai beberapa kelemahan seperti mudah terinfeksi oleh bakteri patogen seperti prion, walau dalam jumlah sedikit dapat menimbulkan toksisitas pada manusia dan reaksi imunogenisitas dari xenogeneic protein dari FBS. Baru-baru ini, ditunjukkan bahwa satu persiapan dari 108 sel punca (stem cell) mesenkimal manusia yang tumbuh di dalam media dengan FBS, akan membawa sekitar 7-30 mg protein FBS. Serum darah tali pusat manusia adalah sumber yang kaya berbagai sitokin yang diperlukan untuk pertumbuhan dan kelangsungan hidup dari berbagai jenis sel seperti sel punca, jaringan maupun organ.Trofoblas plasenta membuat berbagai macam faktor-faktor pertumbuhan seperti insulin like growth factor (IGF), 41 42 transforming growth factor- (TGF-), dan vascular endothelial growth factor (VEGF). Dengan pertambahan usia, karena proses penuaan, secara alamiah sebagian besar komponen tubuh akan mengalami penurunan berbagai fungsi organ tubuh dan terjadi perubahan fisik baik dari tingkat seluler, organ maupun sistem tubuh. Demikian pula dengan fibroblas manusia. Banyak faktor yang menyebabkan terjadinya proses aging ini, dan pada dasarnya dibagi menjadi faktor internal dan faktor eksternal. Adapun faktor-faktor internal tersebut adalah penyakit degeneratif, genetik, penyakit autoimmune, radikal bebas, stress, kelainan hormonal sedangkan faktor eksternal adalah kanker, radiasi, mengkomsumsi obatobatan yang bersifat sitotoksik, hepatotoksik, immunosupressan, gaya hidup seperti rokok, alkohol, olahraga, serta penyakit infeksi seperti HIV, H5N1. Kerangka konsep penelitian ini didasarkan pada teori bahwa dengan adanya penuaan (aging) membuat pembentukan fibroblas menjadi berkurang sehingga perlu dirangsang kemampuan pertumbuhannya, maka dicari sumbersumber lain yang memiliki kemampuan besar dalam merangsang pertumbuhan. 43 Serum Darah Serum darah tali pusat manusia Serum darah janin sapi FAKTOR INTERNAL FAKTOR EKSTERNAL Pnyk.Degeneratif Radiasi Pnyk Autoimmune Obat-obatan (yg bersifat sitotoksik, hepatotoksik, immunosupressan) Hormonal Gaya hidup, Stress Radikal bebas Penyakit HIV,H5N1,kanker Kelainan genetik Penyakit Infeksi (ex : HIV, H5N1) Proliferasi Fibroblas AGING Penuaan Fibroblas Proliferasi Fibroblas meningkat ANTI AGING Gambar 3. 1 Kerangka Konsep Penelitian 3.2. Hipotesis Berdasarkan kerangka konsep, maka hipotesis yang dapat diajukan adalah: Kemampuan serum darah tali pusat manusia dalam meningkatkan proliferasi fibroblas pada tikus (galur sel NIH3T3) lebih banyak dibandingkan serum fetus sapi. BAB IV METODE PENELITIAN 4.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental laboratorium, dengan menggunakan rancangan pre dan post test control group design (Pocock, 2008). Pada penelitian ini terdapat tiga kelompok yaitu kelompok kontrol, kelompok hUCBS dan kelompok FBS. Penelitian ini terdiri dari dua tahap yaitu pertama adalah membandingkan antara hUCBS dan FBS, tahap kedua yaitu membandingkan kosentrasi hUCBS. Secara singkat digambarkan dalam bagan di bawah ini. P0 01 P 02 P1 S 03 04 P2 05 Gambar 4. 1 Bagan rancangan penelitian Keterangan : P = Populasi S = Sampel O1, O3, O5 = Pengukuran sebelum perlakuan (Pre test) P0 = Pemberian DMEM (Kontrol) 44 06 45 P1 = Pemberian DMEM dan FBS 10% P2 = Pemberian DMEM dan hUCBS 10% O2 = Pengukuran setelah perlakuan dengan pemberian DMEM O4 = Pengukuran setelah perlakuan dengan pemberian DMEM dan FBS10% O6 = Pengukuran setelah perlakuan dengan pemberian DMEM dan hUCBS10% 4.2. Lokasi dan Waktu Penelitian 4.2.1. Tempat Penelitian Rs. Ridwan Meuraksa, Jl. Kramat Raya no 174, Jakarta Pusat Stem Cell and Cancer Institute, Jalan Ahmad Yani no 2, PuloMas, Jakarta 4.2.2. Waktu Penelitian Penelitian dilaksanakan dalam waktu 24 (dua puluh empat) minggu, mulai tanggal 1 Mei 2010 sampai 4 Oktober 2010, dengan rincian sebagai berikut : 1) 12 (duabelas) minggu untuk pengumpulan darah melakukan isolasi hUCBS 2) 6 (enam) minggu untuk proses kultur dan perhitungan sel, 3) 6 (enam) minggu untuk analisa hasil dan penyusunan usulan kelayakan 4.2.3. Populasi dan Sampel Populasi penelitian Galur sel NIH 3T3 dari tikus putih Swiss (Mus musculus) Sampel 46 Galur NIH 3T3 fibroblas Sampel dalam penelitian ini adalah dengan kriteria sebagai berikut : Kriteria Inklusi: hUCB yang berasal dari manusia. Minimal jumlah serum 3 ml dari setiap hUCB Kriteria Ekslusi hUCB beku Sediaan terkontaminasi bakteri/jamur hUCB lebih dari 48 jam 4.2.3.1. Penentuan Besar Sampel Besar Sampel Besar sampel dihitung dengan menggunakan rumus Pocock (2008) n 2 2 2 1 2 x f ( , ) Keterangan : n = Besar sampel µ2 = Rerata hasil pada kelompok perlakuan µ1 = Rerata hasil pada kelompok kontrol = simpang baku = tingkat kesalahan I ( =0,05) = tingkat kesalahan II ( = 0,1) 47 Sehingga f ( ,) = 10,5 (Tabel 9.1) (Pocock, 2008) Berdasarkan penelitian pendahuluan (Lahirin, 2010) diketahui rerata kelompok kontrol = 1000, dengan simpang baku (SB) = 3423,21, rerata kelompok perlakuan = 6889. Dengan menggunakan rumus di atas maka hasilnya adalah : 2 x (3423,21)2 n = x 10,5 (6889-1000)2 23436733 = x 10,5 34680321 = 7,09 Untuk mengantisipasi terjadinya drop out pada sampel maka ditambahkan 20% sehingga jumlah sampel minimal adalah 8,5 dan dibulatkan menjadi 9. Besar sampel tiap kelompok adalah 9. Sehingga jumlah sampel seluruhnya adalah 45. 4.3. Variabel Penelitian Klasifikasi Variabel : 1. Variable bebas. 2. Variable tergantung. 3. Variabel kendali. 48 Variabel bebas adalah perlakuan dengan pemberian hUCBS dan FBS. Variabel tergantung adalah fibroblas NIH3T3. Variabel kendali adalah Mesin centrifuge, refigerator, lingkungan (suhu kering, suhu basah, kelembaban relatif), voltase/ketegangan. 4.4. Definisi Operasional 1. hUCB : darah yang diambil dari vena umbilikalis dari plasenta secara ekstrautero, segera setelah ibu melahirkan baik secara alami, tanpa suatu komplikasi yang membahayakan ibu ataupun janin. 2. Serum darah tali pusat manusia : Serum yang didapat dari suatu proses kultur yang berasal dari hUCB dengan jumlah minimal 3 ml dari tiap hUCB, yang pemrosesannya paling lama 48 jam setelah darah dikeluarkan dari vena umbilikalis. Pengambilan hUCB dilakukan pada kelahiran normal walaupn dapat pula diambil dari kelahiran dengan section cesarea selama tidak membahayakan jiwa ibu dan bayi. 3. Dulbecco’s Modified Eagle’s Medium (DMEM) dengan formulasi : Tabel 4. 1 Formulasi DMEM Inorganic Salts (g/liter) Inorganic Salts (g/liter) CaCl2 (anhydrous) 0.20000 Choline Chloride 0.00400 Fe(NO3)3·9H2O 0.00010 Folic Acid 0.00400 MgSO4 (anhydrous) 0.09770 myo-Inositol 0.00720 KCl 0.40000 Nicotinamide 0.00400 NaHCO3 1.50000 D-Pantothenic Acid 0.00400 NaCl 6.40000 (hemic alcium) 49 NaH2PO4·H2O 0.12500 Amino Acids (g/liter) Pyridoxine·HCl 0.00400 Riboflavin 0.00040 Thiamine·HCl 0.00400 L-Arginine·HCl 0.08400 L-Cystine·2HCl 0.06260 Other (g/liter) L-Glutamine 0.58400 D-Glucose 4.50000 Glycine 0.03000 Phenol Red, Sodium Salt 0.01500 L-Histidine·HCl·H2O 0.04200 Sodium Pyruvate 0.11000 L-Isoleucine 0.10500 L-Leucine 0.10500 L-Lysine·HCl 0.14600 L-Methionine 0.03000 L-Phenylalanine 0.06600 L-Serine 0.04200 L-Threonine 0.09500 L-Tryptophan 0.01600 L-Tyrosine·2Na·2H2O 0.10379 L-Valine 0.09400 4. FBS : Menggunakan 10% FBS pada tiap mediumnya yang jumlahnya sekitar 15 ml dan diproduksi Biopharmaceutical Industry dengan merk GIBCO INVITROGEN yang berasal dari darah fetus sapi yang dikumpulkan dari Rumah Pemotongan Hewan United States Department of Agriculture (USDA) yang terletak di Amerika Serikat, melalui 3 kali penyaringan melalui filter 0,1-mm, dan sudah mempunyai sertifikat kualitas sistem regulasi Current Good Manufacturing practice (cGMP)dari Food and Drug Administration’s (FDA) serta ISO-9001 certified facility in Grand Island, New York. 50 5. Galur sel NIH3T3 Fibroblas : 1000 sel/well. Sel yang diambil dari embryo tikus putih dengan strain Swiss Mus Musculus dengan tipe fibroblas dan disediakan oleh American Type Culture Collection (ATCC). 6. Penisilin-Streptomisin : Antibiotika dimana menggunakan 1% Penisillin 10.000 units /mL, Streptomisin 10 mg/mL. 4.5. Prosedur-Prosedur dan Bahan-bahan Penelitian 4.5.1. Prosedur Pengumpulan hUCB Alat yang dibutuhkan: 1. 10 Vaccutainers 5 ml. Bahan yang dibutuhkan: 2. Syringe 50 ml + needle. 3. Povidone Iodine Swab Stick. Prosedur Kerja: 1. Pengambilan hUCB dilakukan oleh dokter, bidan atau perawat di ruang bersalin setelah bayi dilahirkan. Pengambilan hUCB hanya dilakukan pada kelahiran tanpa komplikasi (eklampsia, bayi lahir prematur, bayi lahir mati, Intra Uterine Fetal Death ( IUFD), atau sesuai dengan kriteria yang ditetapkan oleh rumah sakit setempat). 2. hUCB diambil setelah plasenta dilahirkan (ex-utero). hUCB diambil sebanyak 50 ml dengan menggunakan spuit 50cc kemudian darah yang didapat dimasukan ke dalam vaccutainer 10x5ml. 51 3. V.umbilicalis diidentifikasi melalui warnanya yang kebiruan dan letaknya yang superfisial. Pada bagian yang akan ditusuk, dilakukan swab terlebih dahulu dengan menggunakan larutan antiseptik povidone iodine. 4. hUCB harus telah selesai diproses sebelum 48 jam kemudian serum yang dihasilkan dikumpulkan untuk sementara dan disimpan pada suhu ruang (dalam ruangan di Rumah Sakit), hindari paparan sinar matahari. 4.5.2. Prosedur Isolasi Serum dari hUCB Alat yang dibutuhkan: 1. Centrifuge 2. Biosafety cabinet 3. Mikropipet 4. Rak Falcon 5. Becker glass 6. Waterbath Bahan yang dibutuhkan: 1. Alkohol 70% 2. Steril tips 1000 μl 3. Filter 0.45 μm 4. Falcon 50 ml dan 15 ml 5. Syringe 50 ml + needle Prosedur Kerja: 1. Vaccutainers yang berisi hUCB disentrifugasi 4000 rotasi per menit (rpm), selama 10 menit pada suhu 4 oC. 52 2. Serum diisolasi di dalam biosefaty cabinet yang telah terlebih dahulu dibersihkan dengan alkohol 70%. Serum yang didapatkan dari hasil sentrifugasi dipindahkan ke dalam falcon 50 ml dan disimpan dalam suhu -400C. 3. Setelah terkumpul jumlah serum yang diinginkan sekitar 27 ml, seluruh serum di thawing kemudian dikumpulkan dalam becker glass dan dihomogenkan. 4. Dengan menggunakan syringe, serum diambil lalu difilter dengan filter 0.45 μm. Serum yang sudah difilter disimpan dalam falcon 15 ml. 5. Seluruh serum kemudian diinaktivasi dengan menyimpannya dalam waterbath selama 30 menit, pada suhu 560C. 6. Setelah diinaktivasi, serum disimpan dalam suhu -400C. 4.5.3. Metode Thawing dan Kultur NIH3T3 Medium kultur: Dulbecco’s Modified Eagle’s Medium (DMEM) high glucose + 10% FBS (FBS) + 1% Penisillin-Streptomisin Prosedur Kerja: 1. Cryotube NIH3T3 dari cryotank disimpan dalam icepack untuk menghindari penurunan suhu yang drastis. Cryotube tersebut kemudian dihangatkan dalam waterbath dengan suhu 37 0C selama + 2 menit, lalu dimasukkan kembali ke dalam icepack dan dibawa ke biosafety cabinet. 2. Seluruh isi sel dikeluarkan dari cryotube dan dimasukkan ke dalam falcon 15 ml yang telah berisi medium kultur sebanyak 7 ml. Suspensi 53 dihomogenkan lalu disentrifugasi dengan kecepatan 150 g selama 5 menit, pada suhu ruang. 3. Supernatan dibuang dan suspensi pellet dengan 1 ml medium kultur. 4. Dilakukan penghitungan viabilitas dan jumlah sel. Mula-mula dilakukan pengenceran sesuai perkiraan untuk dihitung dengan hemasitometer. Siapkan 1 tabung eppendorf steril, isi dengan 10 µl trypan blue, lalu tambahkan 10 µl suspensi sel yang telah diencerkan, resuspensi dan diamkan 3 menit. Setelah 3 menit, pipet 10 µl suspensi sel yang telah dicampur trypan blue ke dalam kaca hemasitometer. Hitung viabilitas sel dan jumlah sel dengan menggunakan cell counter di bawah mikroskop. 5. Sebanyak 7x105 sel ditanam dalam plate 10 cm dengan medium kultur sebanyak 7 ml. Kultur dilakukan dalam inkubator suhu 370C dan 5% CO2 selama 2-3 hari. Setelah sel telah 80% confluent, maka dilakukan subculture. 6. Mula-mula medium dikeluarkan dari plate dan plate dicuci dengan hati- hati menggunakan PBS-KCl (untuk menghilangkan sisa medium dari kultur sel). Setelah itu PBS-KCl dikeluarkan, tambahkan 2 ml trypsinEDTA dan diinkubasi selama 3 menit dalam inkubator 370C. 7. Periksa apakah sel sudah lepas dari plate dengan menggunakan mikroskop. 8. Tambahkan 4 ml medium kultur dalam plate (untuk menghentikan kerja trypsin). 9. Pindahkan seluruh suspensi dalam falcon 15 ml kemudian disentrifugasi dengan kecepatan 150 g selama 5 menit, pada suhu ruang. 10. Supernatan dibuang dan suspensi pellet dengan 1 ml medium kultur. 54 11. Dilakukan penghitungan viabilitas dan jumlah sel (seperti nomor 4). 12. Sebelum sel siap digunakan untuk penelitian (untuk diberi perlakuan), maka terlebih dahulu harus disub-culture minimal 1x. Sel siap digunakan sesuai dengan kebutuhan. 4.5.4. Prosedur Penelitian hUCBS pada Fibroblas Perlakuan: 1. Sel + medium kultur DMEM+P/S tanpa serum 2. Sel + medium kultur DMEM+P/S + 10% FBS 3. Sel + medium kultur DMEM+P?S + 5% hUCBS 4. Sel + medium kultur DMEM+P/S + 10% hUCBS 5. Sel + medium kultur DMEM+P/S + 20% hUCBS Prosedur Kerja: 1. Tanam sel sebanyak 9x10 3 sel/cm2 dalam tiap-tiap well pada 6-well plate yang sudah diberi medium kultur sebanyak 2 ml. Kultur dalam inkubator 37 0C, 5% CO2, selama 24 jam. 2. Setelah 24 jam, medium dikeluarkan dan plate dicuci dengan hati-hati menggunakan PBS-KCl (untuk menghilangkan sisa medium, terutama serumnya). 3. Sel dari tiap well pun diberi medium perlakuan sebanyak 2 ml (2 well/perlakuan), kemudian sel kembali dikultur hingga 80% confluent (+ 48 jam). 4. Setelah confluent dilakukan penghitungan viabilitas dan jumlah sel yang menunjukkan tingkat proliferasi dari sel tersebut dilakukan dengan metode MTT assay. 55 4.5.5. Prosedur 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay Prosedur kerja : 1. Tambahkan 10 l MTT solution pada tiap well yang berisi sampel dalam 100 ml medium kultur. 2. Inkubasi selama 4 jam dalam suhu 370. 3. Keluarkan 100 l solution dari medium kultur tersebut. 4. Tambahkan 100 l acidic isopropanol. 5. Inkubasi selama 2 jam, dalam 70-80 rpm ( pada orbital shaker). 6. Baca dengan microplate reader = 570 m. 7. Preparat difoto dengan kamera digital Canon tipe powershot A620 melalui mikroskop inverted Zeiss tipe axiovert 40 CFL. 4.5.6. Prosedur pemeriksaan protein dengan nanodrop : 1. Pilih menu dengan panjang gelombang 280 2. Teteskan PBD sebanyak 4 l (sebagai blanko), tekan blank. 3. Bersihkan tempat drop tersebut dengan kimwaips. 4. Teteskan 4 l sampel yang akan diperiksa. 5. Baca hasil dengan menekan tombol measure. 56 4.6. Alur Penelitian FIBROBLAS (GALUR SEL NIH3T3) DMEM DMEM + 10% SERUM FETUS SAPI PROLIFERASI FIBROBLAS GALUR SEL NIH 3T3 ANALISIS DATA LAPORAN DMEM + 10% SERUM DARAH TALI PUSAT MANUSIA 57 FIBROBLAS DMEM DMEM + 5% DARAH TALI PUSAT MANUSIA DMEM + 10% DARAH TALI PUSAT MANUSIA DMEM + 20% DARAH TALI PUSAT MANUSIA PROLIFERASI FIBROBLAS GALUR SEL NIH 3T3 ANALISIS DATA LAPORAN Gambar 4. 2 Alur Penelitian 4.7. Analisis Data Data yang diperoleh akan dianalisis dengan langkah-langkah sebagai berikut (Nazir, 1999) : Analisis deskriptif jumlah sel (persentase) Analisis normalitas dengan Uji Saphiro-Wilk didapatkan data berdistribusi normal dan Uji homogenitas dengan Uji Levene’s test dan didapatkan data yang tidak homogen. 58 Analisis komparasi. Karena data yang didapat normal tetapi tidak homogen maka digunakan Uji Kruskal-Wallis (Gomez dan Gomez, 1995 ., Steel dan Torrie, 1980). Data diolah dengan Program Statistic Base SPSS 16,0 for Windows (Trihendadi, 2005) BAB V HASIL PENELITIAN Dalam penelitian ini dilakukan 45 pemeriksaan pada galur fibroblas NIH3T3 sebagai sampel, yang terbagi menjadi 5 (lima) kelompok, masing-masing kelompok berjumlah 9 sediaan, yaitu kelompok kontrol (DMEM), kelompok DMEM + FBS 10%, kelompok DMEM + hUCBS 5%, kelompok DMEM + hUCBS 10%, dan kelompok DMEM + hUCBS 20%. Pada hasil pemeriksaan dilakukan uji normalitas data, uji homogenitas data dan uji efek perlakuan. 5.1 Uji Normalitas Data Data jumlah fibroblas sesudah perlakuan pada masing-masing kelompok diuji normalitasnya dengan menggunakan uji Shapiro-Wilk. Hasilnya menunjukkan data berdistribusi normal (p > 0,05). Hasil disajikan pada Tabel 5.1. 59 60 Tabel 5.1 Hasil Uji Normalitas Jumlah Fibroblas Sesudah Perlakuan Kelompok Subjek n P Keterangan Kontrol (DMEM) 9 0,133 Normal DMEM + FBS 10% 9 0,245 Normal DMEM + hUCBS 5% 9 0,600 Normal DMEM + hUCBS 10% 9 0,370 Normal DMEM + hUCBS 20% 9 0,953 Normal 5.2 Uji Homogenitas Data antar Kelompok Data jumlah fibroblas antar kelompok sesudah perlakuan diuji homogenitasnya dengan menggunakan uji Levene’s test. Hasilnya menunjukkan data sesudah perlakuan tidak homogen (p<0,05), hasil analisis disajikan pada Tabel 5.2 dan Tabel 5.3 berikut. 61 Tabel 5.2 Uji Homogenitas Jumlah Sel antara Kelompok Kontrol, FBS, dan hUCBS Variabel Jumlah Sel antara Kelompok Kontrol, FBS, dan hUCBS F p 27,78 0,000 Keterangan Tidak Homogen Tabel 5.3 Uji Homogenitas Jumlah Sel antara Kelompok hUCBS Dosis 5%, 10%, dan 20% Variabel Jumlah Sel antara Kelompok hUCBS 5%, 10%, dan 20% F p 5,16 0,014 Keterangan Tidak Homogen 5.3 Jumlah Fibroblas 5.3.1 Uji komparabilitas Mengingat jumlah sel awal yang ditanam pada masing-masing kelompok sama, yaitu 1000 sel, maka uji komparabilitas sebelum perlakuan tidak perlu dilakukan. 5.3.2 Analisis efek perlakuan antar Serum Analisis efek perlakuan diuji berdasarkan rerata jumlah fibroblas antar kelompok sesudah diberikan perlakuan berupa FBS dan hUCBS. Hasil analisis kemaknaan dengan uji Kruskal-Wallis disajikan pada Tabel 5.4 berikut. 62 Tabel 5.4 Rerata Jumlah fibroblas antar Kelompok sesudah diberikan Perlakuan n Rerata fibroblas SB Kontrol (DMEM) 9 328.11 25.79 DMEM + FBS 10% 9 6185.11 1242.80 DMEM + hUCBS 10% 9 9685.11 313.24 Kelompok Subjek ChiKuadrat (2) P 23,16 0,000 Tabel 5.4 di atas, menunjukkan bahwa rerata jumlah fibroblas kelompok kontrol (DMEM) adalah 328,11 ± 25,79, rerata jumlah fibroblas kelompok DMEM + FBS 10% adalah 6185,11 ± 1242,80, jumlah fibroblas kelompok DMEM + hUCBS 10% adalah 9685,11 ± 313,24. Analisis kemaknaan dengan uji Kruskal-Wallis menunjukkan bahwa nilai Chi-Kuadrat (2) = 23,16 dan nilai p = 0,000. Hal ini berarti bahwa ketiga kelompok sesudah diberikan perlakuan, rerata jumlah fibroblasnya berbeda secara bermakna (p < 0,05). 63 12000 9685 Jumlah Fibroblas 10000 8000 6185 6000 4000 2000 H0 1000 328 1000 1000 FBS 10% FBS10% HUCBS10% UCBS10% H3 0 Tanpa Serum Non serum Jenis Perlakuan Gambar 5.1 Grafik Peningkatan Jumlah Fibroblas Setelah Diberikan Perlakuan dengan Berbagai Medium. Perhitungan table 5.4 dituangkan dalam bentuk grafik. Gambar 5.1 Di atas menggambarkan bahwa pemberian FBS 10% dan hUCBS 10% dapat meningkatkan jumlah fibroblas dibandingkan dengan kontrol. Untuk mengetahui kelompok-kelompok yang berbeda digunakan uji MannWhitney sebagai uji lanjut. Hasil uji disajikan di bawah ini. 64 Tabel 5.5 Analisis Perbedaan Jumlah Fibroblas Sesudah Perlakuan antar Kelompok Kelompok Kontrol (DMEM) dan kelompok DMEM + FBS 10% Kontrol (DMEM) dan kelompok DMEM + hUCBS 10% Beda Rerata P Interpretasi 5857,00 0,000 Berbeda Bermakna 9357,00 0,000 Berbeda Bermakna 3500,00 0,000 Berbeda Bermakna Kelompok FBS 10% dan Kelompok DMEM + hUCBS 10% Hasil uji lanjutan di atas menunjukan bahwa: 1. Rerata jumlah fibroblas Kelompok Kontrol (DMEM) berbeda bermakna dengan kelompok DMEM + FBS 10% (rerata kelompok Kontrol lebih rendah daripada kelompok DMEM + FBS 10%). 2. Rerata jumlah fibroblas Kelompok Kontrol (DMEM) berbeda bermakna dengan kelompok DMEM + Serum darah tali pusat manusia 10% (rerata kelompok Kontrol lebih rendah daripada kelompok DMEM + Serum tali pusat 10%). 3. Rerata jumlah fibroblas kelompok DMEM + FBS 10% berbeda bermakna dengan kelompok DMEM + Serum darah tali pusat manusia 10% (rerata kelompok DMEM + FBS 10% lebih rendah daripada kelompok DMEM + Serum darah tali pusat manusia 10%). 65 5.3.3 Analisis Efek Perlakuan antar Dosis hUCBS Analisis efek perlakuan diuji berdasarkan rerata jumlah fibroblas antar kelompok dosis sesudah diberikan perlakuan berupa serum tali pusat manusia. Hasil analisis kemaknaan dengan uji Kruskal-Wallis disajikan pada Tabel 5.6. Tabel 5.6 Rerata Jumlah fibroblas sesudah diberikan Perlakuan DMEM + hUCBS 5% 9 Rerata fibroblas 8.125,89 DMEM + hUCBS 10% 9 9.685,11 313,24 DMEM + hUCBS 20% 9 12.200,00 304,11 Kelompok Subjek n SB 628,01 2 p 199,19 0,000 Tabel 5.6 di atas, menunjukkan bahwa rerata jumlah fibroblas kelompok kontrol (DMEM) + hUCBS 5% adalah 8.125,89 ± 628,01, rerata jumlah fibroblas kelompok DMEM + hUCBS 10% adalah 9.685,11 ± 313,24, jumlah fibroblas kelompok DMEM + hUCBS 20% adalah 12200,00 ± 304,11. Analisis kemaknaan dengan uji Kruskal-Wallis menunjukkan bahwa nilai 2 = 23,15 dan nilai p = 0,000. Hal ini berarti bahwa ketiga kelompok sesudah diberikan perlakuan, rerata jumlah fibroblasnya berbeda secara bermakna (p < 0,05). 66 14000 12241 Jumlah Fibroblas 12000 9685 10000 8126 8000 6000 H0 4000 H3 2000 1000 1000 1000 0 HUCBS 5% UCBS5% HUCBS 10% UCBS10% HUCBS 20% UCBS20% Jenis Perlakuan Gambar 5.2 Grafik Peningkatan Jumlah Fibroblas Setelah Diberikan. Perlakuan dalam Dosis hUCBS yang Berbeda. Perhitungan table 5.6 dituangkan dalam bentuk grafik. Gambar 5.2 di atas menggambarkan bahwa pemberian hUCBS baik dosis 5%, 10%, maupun 20% dapat meningkatkan jumlah fibroblas dibandingkan dengan awal yang ditanam. Untuk mengetahui kelompok-kelompok yang berbeda digunakan uji MannWhitney sebagai uji lanjut. Hasil uji disajikan berikut ini. 67 Tabel 5.7 Analisis Perbedaan Jumlah Fibroblas Sesudah Perlakuan antar Kelompok Kelompok Beda Rerata P Interpretasi Kelompok DMEM + Serum darah tali pusat manusia 5% dan Kelompok DMEM + hUCBS 10% 1559,22 0,000 Berbeda Bermakna Kelompok DMEM + hUCBS 5% dan Kelompok DMEM + hUCBS 20% 4114,89 0,000 Berbeda Bermakna Kelompok DMEM + hUCBS 10% dan Kelompok DMEM + hUCBS 20% 2555,67 0,000 Berbeda Bermakna Hasil uji lanjutan di atas menunjukan bahwa: 1. Rerata jumlah fibroblas Kelompok DMEM + hUCBS 5% berbeda bermakna dengan kelompok Kelompok DMEM + hUCBS 10% (rerata kelompok Kelompok DMEM + hUCBS 5% lebih rendah daripada kelompok Kelompok DMEM + hUCBS 5%). 2. Rerata jumlah fibroblas Kelompok DMEM + hUCBS 5% berbeda bermakna dengan Kelompok DMEM + hUCBS 20% (rerata Kelompok DMEM + hUCBS 5% lebih rendah daripada kelompok DMEM + Serum darah tali pusat manusia 20% ). 3. Rerata jumlah fibroblas Kelompok DMEM + hUCBS 10% berbeda bermakna dengan kelompok DMEM + Serum darah tali pusat manusia 20% (rerata Kelompok DMEM + hUCBS 10% lebih rendah daripada kelompok DMEM + Serum darah tali pusat manusia 20%). 68 5.4 Analisis Perbedaan antara Total Protein FBS dan hUCBS Analisis perbedaan diuji berdasarkan rerata jumlah fibroblas antara kelompok Serum Protein FBS dengan kelompok serum Protein UCBS. Hasil analisis kemaknaan dengan uji Mann-Whitney disajikan pada Tabel 5.8. Tabel 5.8 Rerata Total Protein antar Kelompok FBS dan hUCBS Kelompok Subjek n Total Protein FBS 9 Total Protein hUCBS 9 Rerata fibroblas SB 3,23 0,54 5,04 0,41 U p 0,000 0,000 Tabel 5.8 di atas, menunjukkan bahwa rerata jumlah fibroblas kelompok total protein FBS adalah 3,23 ± 0,54, rerata jumlah fibroblas kelompok total protein hUCBS adalah 5,04 ± 0,41. Analisis kemaknaan dengan uji Mann-Whitney menunjukkan bahwa nilai U = 0,000 dan nilai p = 0,000. Hal ini berarti bahwa kedua kelompok total protein, rerata jumlah fibroblasnya berbeda secara bermakna (p < 0,05). 69 6 5.04 Jumlah Protein (gr/dL) 5 4 3.23 3 Protein FBS Protein HUCBS 2 1 0 Protein FBS 1 Protein HUCBS Gambar 5.3 Grafik Perbandingan Total Protein FBS dengan hUCBS. Perhitungan pada tabel 5.8 dituangkan dalam bentuk grafik. A. DMEM B. FBS 10% C. hUCBS 5% D. hUCBS 10 % E. hUCBS 20 % Gambar 5.4. Foto sel NIH3T3 dengan beberapa perlakuan. Sel NIH3T3 dibiakkan dalam medium DMEM mengandung FBS 10% selama 24 jam. Kemudian medium diganti dengan medium perlakuan sebagai berikut : Medium DMEM saja (A) atau dengan penambahan FBS 10% (B), hUCBS 5% (C), hUCBS 10% (D), hUCBS 20% (E) selama 48 jam. Morfologi sel difoto dengan menggunakan mikrokop cahaya. Skala balok hitam: 100m. 70 71 Foto diatas menunjukan proliferasi yang semakin meningkat dengan pemberian hUCBS dibanding medium DMEM saja ataupun FBS dan semakin meningkat lagi dengan bertambahnya kosentrasi hUCBS. BAB VI PEMBAHASAN HASIL PENELITIAN 6.1. Subyek Penelitian Untuk menguji pemberian FBS dan hUCBS terhadap peningkatan jumlah sel, maka dilakukan penelitian pada galur fibroblas NIH3T3. Sebagai model percobaan digunakan galur fibroblas, model bahan yang dipergunakan dalam penelitian ini berjumlah 45 sediaan, dibagi menjadi 5 kelompok yaitu kelompok kontrol (DMEM), kelompok DMEM + FBS 10%, kelompok DMEM + hUCBS 5%, kelompok DMEM + hUCBS 10%, dan kelompok DMEM + hUCBS 20%. Serum darah tali pusat manusia dalam penelitian ini, sengaja dikumpulkan dari 9 donor untuk menghilangkan kespesifikan dalam hUCBS tersebut dan hUCB diisolasi secara ex utero untuk meniadakan inform concern. 6.2 Serum Darah Tali Pusat Manusia Meningkatkan Jumlah Fibroblas 6.2.1. hUCBS 10% Meningkatkan Proliferasi Fibroblas Lebih Baik Dibanding FBS 10%. Sebelum dilakukan uji inferensial terhadap data jumlah sel antar kelompok perlakuan, terlebih dahulu data diuji normalitasnya dengan Uji Shapiro Wilk dan homogenitas antar kelompok dengan uji Levene test. Berdasarkan hasil analisis yang disajikan pada Tabel 5.1 (uji normalitas data), Tabel 5.2 dan Tabel 5.3 (uji homogenitas antar kelompok), didapatkan bahwa data berdistribusi normal tetapi tidak homogen (p < 0,05). Analisis komparabilitas (perbandingan) sebelum diberikan perlakuan (pre test) antara kelima kelompok tidak dilakukan, mengingat jumlah sel awal yang ditanam adalah sama yaitu 1000. 72 73 Analisis efek perlakuan sesudah diberikan perlakuan (post test) dengan FBS dan hUCBS terhadap peningkatan jumlah sel antar kelompok dianalisis dengan uji Kruskal-Wallis. Berdasarkan hasil analisis diketahui bahwa rerata jumlah fibroblas kelompok kontrol (DMEM) adalah 328,11 ± 25,79, rerata jumlah fibroblas kelompok DMEM + FBS 10% adalah 6185,11 ± 1242,80, jumlah fibroblas kelompok DMEM + hUCBS 10% adalah 9685,11 ± 313,24. Analisis kemaknaan dengan uji Kruskal-Wallis menunjukkan bahwa ketiga kelompok sesudah diberikan perlakuan, rerata jumlah fibroblasnya berbeda secara bermakna (p < 0,05). Berdasarkan hasil tersebut didapatkan bahwa jumlah fibroblas pada kelompok FBS lebih banyak dibandingkan jumlah fibroblas pada kelompok kontrol, oleh karena itu dalam sebagian besar sistem kultur, FBS sering digunakan. Hal ini disebabkan karena FBS merupakan komponen penting untuk pertumbuhan dan pemeliharaan sel (Sasse, dkk, 2000). Serum ini merupakan campuran kompleks rendah dan tinggi berat molekul biomolekul dengan berbagai pemicu pertumbuhan (growth promoting) dan sifat penghambat pertumbuhan. Hasil penelitian ini didukung oleh penelitian, yang menyatakan bahwa FBS merupakan pemicu pertumbuhan yang memiliki toksisitas rendah, sehingga FBS menjadi suplemen yang populer dalam kultur in vitro pada sel mamalia (Yamaguchi, 2002, Stute, 2004, Mizino, 2006). Meskipun penggunaan FBS memberikan kondisi pertumbuhan yang cukup memuaskan (Paranjape, 2004), tetapi FBS mempunyai keterbatasan dalam penggunaan khususnya sebagai suplemen dalam kultur sel untuk transplantasi manusia sebab berpotensi sebagai sumber kontaminan mikrobiologi, khususnya Mycoplasma, virus sapi, dan 74 patogen-patogen lainnya, dan agen yang dapat menyebabkan ensefalopati spongiform sapi atau penyakit Creutzfeldt-Jakob (Klein and Dumbledore, 1993). Sebelumnya upaya menggantikan FBS dengan serum kambing dengan ditambahkan campuran kacang kedelai menunjukan hasil yang baik tatapi penggunaan jangka panjang menunjukkan angka kematian yang tinggi (Deshpande, dkk, 2000). Jumlah fibroblas yang diberi hUCBS berproliferasi lebih banyak dibandingkan kelompok FBS maupun kelompok kontrol, hal ini disebabkan karena hUCB mempunyai semua nutrisi yang dibutuhkan untuk memenuhi persyaratan pertumbuhan dari organisme (Bhattacharya, 2009).hUCB memiliki sifat imunogenisitas yang lebih rendah, isolasinya tidak membutuhkan prosedur yang invasif, penerimaannya tidak membutuhkan ketepatan 100% Human Leucocyte Antigen (HLA) (Ryan, 2005). Dalam penelitianya Lam, dkk, 2001 menggunakan plasma hUCB autologous untuk pengembangan sel punca karena hUCB merupakan sumber yang kaya akan sitokin yang berbeda sehingga diperlukan untuk pertumbuhan dan kelangsungan hidup berbagai jenis sel. Alasan yang sama digunakan oleh Kim, dkk dalam penelitiannya untuk kultur T cells pada adoptive immunotherapy ( Kim, dkk, 2005). Pengumpulan hUCBS dapat diperoleh tanpa suatu prosedur invasif yaitu dari tali pusat plasenta sesaat setelah bayi dipisahkan dari ibu yang tidak menderita riwayat suatu penyakit apapun, melalui persalinan normal maupun persalinan dengan sectio Caesar yang terjadi tanpa komplikasi ataupun kesulitan dalam melahirkan. Untuk penelitian ini, saya mengambil dari ibu-ibu yang melahirkan 75 dengan persalinan normal. Pengumpulan atau pengisolasian hUCBS juga tidak mempunyai masalah etika, legal dan sosial. Kandungan hUCBS menurut beberapa penelitian diantaranya 0,48 ng/mL Epidermal Growth Factor (EGF), 230,85 ng/mL Vitamin A, 57.15ng/mL Transforming Growth Factor-β (TGF-β) (Yoon, dkk, 2005), 245,3 pg/mL Substance P, 239 pg/mL Insuline Growth Factor-I (IGF-I), 729,7 pg/mL Nerve Growh Factor (NGF) (Yoon,dkk., 2007), 7.95 pg/mL basic Fibroblast Growth Factor (bFGF), 504,51 pg/mL Vascular Endothelial Growth Factor (VEGF), 9,32 pg/mL Placental Growth Factor (PGF), 121,38 soluble Fms-like Tyrosine Kinase1 (sFlt-1), 6804,66 pg/mL soluble Kinase Domain Receptor (sKDR) (Wallner, dkk., 2007), 27,0 Transforming Growth Factor-α (TGF-α) (Wagner, dkk., 2001), 8,4 ng/mL Leptin (Pighetti, dkk., 2003). Walaupun kandungan yang lebih terperinci dalam hUCBS seperti hormonhormon perlu diteliti lebih jauh, tetapi macam-macam faktor pertumbuhan tersebut juga sudah sangat mendukung proliferasi fibroblas, seperti untuk suatu penyembuhan luka yang melibatkan reepithelialization, pembentukan jaringan granulasi, proses inflamasi, terdeteksi interleukin IL-1, IL-6, GM-CSF (Granulocyte Macrophage Colony Stimulating Factor), TGF (Transforming Growth Factor TGF (Transforming Growth Factor ), NGF (Nerve Growth Factor), PDGF (Platelet Derived Growth Factor) dan FGF (Fibroblast Growth Factor) (Luger dan Schwarz, 2000). Serum darah perifer manusia dewasa tidak memiliki banyak faktor pertumbuhan yang dibutuhkan untuk kelangsungan hidup maupun perluasan pertumbuhan suatu sel. Hal ini dibuktikan pada penelitian tentang human 76 mesenchymal stem cell yang menggunakan serum darah perifer manusia dengan hasil tidak terlihat perubahan yang baik dalam proliferasi maupun differensiasi sel yang dilakukan baik secara invitro maupun invitro ( Yamaguchi, 2002, Kassem, 2004). Sebagai alternatif penggunaan 10% serum darah perifer manusia saja tidak mendukung pertumbuhan dan proliferasi sel kecuali ditambahkan faktor-faktor pertumbuhan seperti epidermal growth factor, fibroblast growth factor (FGF2), dan Bone Morphogenetic Protein 4 (BMP4), (Phadnis, dkk, 2008). Untuk suatu penelitian ataupun therapi dengan menggunakan darah perifer manusia, dibutuhkan darah segar dalam volume tertentu untuk pengerjaannya sedangkan darah perifer manusia bukan merupakan bahan buangan (seperti halnya hUCB, yang akan dibuang segera setelah bayi dilahirkan) sehingga akhirnya tidak digunakan untuk kultur sel, kultur jaringan maupun organ invitro. 6.2.2. Peningkatan Kosentrasi hUCBS Menyebabkan Peningkatan Proliferasi Fibroblas. Pada penelitian ini juga didapatkan bahwa kecenderungan efek dosis hUCBS membentuk regresi linear dengan nilai R2 = 0,925. Dosis 20% dapat menumbuhkan fibroblas lebih banyak dibandingkan dengan dosis 10% dan 5%. Demikian juga dosis 10% dapat menumbuhkan fibroblas lebih banyak dibandingkan dengan 5%. hUCBS juga mempunyai kandungan total protein yang lebih besar dibanding dengan serum darah sapi. Hal ini dibuktikan dengan melakukan test yang menggunakan alat Nanodrop. Protein apapun dan berasal dari makhluk apapun juga ternyata hanya tersusun dari 20 macam asam amino saja. Protein adalah biomolekul yang 77 sesungguhnya, karena senyawa ini yang menjalankan berbagai fungsi dasar kehidupan, antara lain protein berkontraksi melakukan gerak, pengendali pertumbuhan dengan adanya faktor-faktor pertumbuhan, menjalankan berbagai proses metabolisme dalam bentuk enzim (Sadikin, 2001). Pertumbuhan dan differensiasi sel diatur oleh protein faktor pertumbuhan. Misalnya faktor pertumbuhan saraf (Nerve Growth Factor, NGF) akan merangsang pertumbuhan jaringan saraf, faktor pertumbuhan fibroblas (Fibroblast growth factor, FGF) akan merangsang pertumbuhan fibroblas. Aktifitas sel-sel yang berbeda pada organisme multisel dikoordinasi oleh hormon dan banyak hormon seperti insulin dan TSH (Thyroid Stimulating Hormone) merupakan protein (Stryer, 2000). Peningkatan proliferasi fibroblas yang berbeda bermakna antara serum hUCB dengan FBS, dimungkinkan karena kandungan protein yang lebih tinggi pada serum hUCB dibanding FBS, tetapi tidak dapat disingkirkan bahwa peranan growth factor dalam hUCBS walau untuk hal ini perlu penelitian lebih lanjut. Hasil penelitian ini didukung oleh beberapa penelitian antara lain berjudul human umbilical cord blood serum promotes growth, proliferation as well as differentiation of human bone marrow derived progenitor cells (Phadnis, dkk, 2006), yang mengatakan hUCBS merupakan media yang baik dalam mendukung proliferasi hBMCs (human bone marrow derived mesenchymal like cells) dan differensiasi hBMCs ke adiposit, effects of human umbilical cord serum on proliferation and insulin content of human fetal islet like cell clusters (Xia, dkk, 2005), yang mengatakan bahwa hUCBS dapat meningkatkan islet like cell clusters (ICCs) empat kali lipat dibandingkan dengan FBS, Human umbilical cord blood 78 serum can replace fetal bovine serum in culture of mesenchymal stem cells (Shetty, dkk, 2007), yang mengatakan proliferasi human mesechymal stem cell lebih besar dengan menggunakan hUCBS dibanding dengan FBS, sehingga dapat sebagai pengganti untuk mengembangkan protokol klinis kultur MSC, human umbilical cord blood serum in culture medium on oocyte maturation in vitro (Zhang,dkk, 2007), yang mengatakan tingkat kematangan akhir oosit pada media yang ditambahkan serum darah tali pusat manusia secara signifikan lebih tinggi daripada media yang ditambahkan cairan folikel manusia saja, Use of Umbilical Cord Serum in Chromosomal Studies (Victor, dkk, 2007) yang menemukan metafase dengan jumlah yang cukup dan merata untuk ikatan kromosom dengan menggunakan medium hUCBS. 79 BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Berdasarkan hasil penelitian pemberian FBS dan hUCBS didapatkan simpulan sebagai berikut: 1. hUCBS lebih meningkatkan proliferasi fibroblast pada tikus (galur sel NIH3T3) dibandingkan FBS secara bermakna. 2. Konsentrasi hUCBS 20% meningkatkan proliferasi fibroblast lebih tinggi dibandingkan konsentrasi hUCBS 5% maupun hUCBS 10%. Dengan meningkatnya konsentrasi hUCBS, maka jumlah protein yang dikandungnya termasuk growth factor juga akan semakin banyak, sehingga dapat meningkatkan pertumbuhan fibroblas. 7.2 Saran Sebagai saran dalam penelitian ini adalah: 1. Perlu melakukan penelitian lebih lanjut untuk mengetahui konsentrasi optimal hUCBS terhadap peningkatan proliferasi fibroblas. 2. Perlu melakukan penelitian lebih lanjut tentang growth factor yang paling dominan dalam hUCBS terhadap peningkatan proliferasi fibroblas. 3. Perlu melakukan penelitian lebih lanjut tentang komponen dari hUCBS secara lengkap dan terperinci, misalnya hormon, jenis protein, dll. DAFTAR PUSTAKA Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. 2002. Molecular Biology of the Cell, 4th Ed.Garland Science.p.1090-1106. Bagby G.C., Heinrich M.C., 2000. Growth Factors, Cytokines and the role of Hematopoiesis. In Hoffman R., Benz E.J., Shattil S.J., dkk (eds): Hematology Basic Principles and Practice 3rd ed, New York, Churchill Livingstone ; 154-189. Bhattacharya, N. 2009. Advanced Medical Research Institute, Frontiers of Cord Blood Science, Springer-Verlag London.p.xx. Carrel, A. 1912. On The Permanent Life of Tissues Outside of the Organism. J. Exp. Med;15(5):516. Craven, C.M., Ward, K. 2000. Transfusion of Fetal Cord Blood Cells: An Improved Method of Hematopoietic Stem Cells Transplantation? J Repro Immunol ; 42: 59-77. COPE: Cytokines Online Pathfinder Encyclopaedia, Horst Ibelfault’s Hypertext Information Universe of Cytokines, version 24.7 (August 2010). Available at www.copewithcytokines.de/. (Accessed 10 September 2010). Deshpande, M., Katdare, M., Parab, P. 2000. Supplementation with Soybean Lipids Reduces Goat Serum–Induced Apoptosis in the B-cell Hybridoma CC9C10. In Vitro Cell. Dev. Biol. Anim. (Letter to the Editor). 36:1–3. Dimri, G.P., Dellambra, E. 2008. Cellular Senescence and Skin Aging. In: Dayan N. (Editor). Skin Aging Handbook.p.129-148. 80 81 Doerr, H.W., Cinatl, J., Stürmer, M., Rabenau H.F.,2003: Prions and Orthopedic Surgery Infection. William Andrew. 31:163–171. Filipic, B., Shehata, M., Toth, S., Schwarzmeier, J., Koren, S. 2002. Novel Serum Replacement Based on Bovine Ocular Fluid: a Useful Tool for Cultivation of Different Animal Cells in Vitro. ALTEX. 19(1):15–20. Fowler, B., 2003. Functional and Biological Markers of Aging. In : Klatz, R., 2003. Anti-Aging Medical Therapeutics volume 5. Chicago : The A4M Publications : p. 43. Frassoni, F., Repetto, M., Piaggio, G., Podesta, M., Marmont, A. M., 1987; Human Serum–Dependent Survival of GM-CFCs in vitro from Patients with Chronic Granulocytic Leukemia. Leuk. Res. 11(1):3–6. Gerald D.A., 2001: Cedera dan Kematian sel; Patofisilogi: Konsep Klinis Proses-proses Penyakit. Edisi 5, Sylvia A.P., Lorraine MW (Pentj.), EGC:23-24. Gluckman, E., Broxmeyer, H.E., Auerbach, A.D., dkk, 1989: Hematopoietic Reconstitution in a Patient with Fanconi’s Anemia by Means of Umbilical-cord Blood from an HLA-Identical Sibling. N Engl J Med. ; .321:1174–8. Goldman, R., dan Klatz. R., 2007. The New Anti-Aging Revolution. Malaysia : Printmate Sdn, Bhd. P: 19-25. Grunebaum, Amos. 2005. Placenta Previa Basics . Available from http://www.horizon-bcbsnj.com/myhealthyhorizon/ webmd/Encyclopedia/articles/PlacentaPrevia/placenta_basics.asp. Access : 23-07-2010. 82 Invitrogen. 2003. Perspectives in Cell Culture. Available at: http://www.invitrogen.com. Access : 07-08-2010 Klein, R., Dumbledore L. J. 1993. Transmission of Creutzfeldt-Jakob Disease by Blood Transfusion. Lancet. 341:768. Kim, Y.M., Jung, M.H., Song, H.Y., Hyun, O.Y., Lee, S.T., Kim, J.H., dkk., 2005: Ex Vivo Expansion of Human Umbilical Cord Blood Derived T Lymphocytes with Homologous Cord Blood Plasma. Tohoku J Exp Med; 205:115-122. King, D., 2003: Placenta and Umbilical Cord. Available from: http://www.siumed.edu/~dking2/erg/placenta.htm. Access: 23-07-2010. Koller, M.R.,Palsson, B.O.,Masters, J.R.W,2002,Human Cell Culture, Volume V:Primary Mesenchymal Cells, Kluwer Academic Publishers. Koolman, Jan, Rohm,Klaus-Heinrich, 2001, Atlas Berwarna dan Teks Biokimia, Penerbit Hipokrates, p. 62,146, 246. Kountur, R. 2006. Statistik Praktis. PPM. Koivisto, H., Hyvarinen M., Stromberg A. M., Inzunza, J., Matilainen, E., Mikkola, M., Hovatta, O., Teerijoki, H. 2004. Cultures of human Embryonic Stem Cells: Serum Replacement Medium or SerumContaining Media and the Effect of Basic Fibroblast Growth Factor. Reprod. Biomed. Online. 9(3):330–337. 83 Lahirin R., 2010. Serum Darah Tali Pusat Manusia Meningkatkan Proliferasi Fibroblas Pada Tikus NIH3T3 Lebih Banyak Dibandingkan Dengan Serum Fetus Sapi. Unpublished. Lam, A.C., Li, K., Zang, Z.B., Li, C.K., Fok T.F., Chang A.M. 2001. Preclinical ex vivo Expansion of Cord Blood Hematopoietic Stem and Progenitor Cells: Duration of Culture; the Media, Serum Supplements, and Growth Factors Used; and Engraftment in NOD/SCID Mice. Transfusion; 41:1567. Lichtman, M.A., Williams, W.J., 2001: Hematology in the Aged. In: Beutler, E.,Coller, B., Lichtman, M.A., Seligsohn, U.,Williams Hematology 6th Ed.,p93-100. Luger, T.A., Schwarz, T., 2000: The role of cytokines and neuroendocrine hormones in cutaneous immunity and inflammation, Allergi, 50; 292302. Mescher, A. L., 2010, Junqueira's Basic Histology, Twelfth Edition, The McGraw-Hill Companies, Inc.. Mizuno, N., Shiba, H., Ozeki, Y., Mouri, Y., Niitani M., Inui M., dkk., 2006: Human Autologous Serum Obtained using a Completely Closed Bag System as a Substitute for Fetal Calf Serum in Human Mesenchimal Stem Cell Cultures. Cell Biol Int ;30:521-524. Nazir. 1995. Metodologi Penelitian. Jakarta. Cetakan ke -4. Galia Indonesia. Norman, R.A. 2003. Geriatric Dermatology. Dermatologic Therapy vol 16: 260-268. . 84 Pangkahila, A., 2005. Buku Ajar Pedoman Praktis Analisi Statistik Dengan SPSS. Denpasar : Fakultas Kedokteran Universitas Udayana, hal : 9-19. Pangkahila, W., 2007. Memperlambat Penuaan, Meningkatkan Kualitas Hidup. Anti-Aging Medicine. Cetakan ke-1. Jakarta : Penerbit Buku Kompas, hal : 133-144. Paranjape ,S. 2004. Goat Serum: An Alternative to Fetal Bovine Serum in Biomedical Research. Indian J. Exp. Biol. 42(1):26–35. Phipps, S.M.O., Berletch, J.B., Andrews, L.G., Tollesfsbol, T.O., 2007. Aging Cell Culture. In: Tollesfsbol, T.O. (editor): Biological Aging: Methods and Protocols. Totowa: Humana Press. Pocock, S., 2008: The Size of Clinical Trials, In : Clinical Trial, A Practical Approach. A Wiley & Sons Medical Publication. P. 123-127. Rogers, K., 2011,The Cell, Britannica Educational Publishing, p.144-145,147. Ryan, J.M., Barry, F.P., Murphy J.M., Mahon, B.P. 2005. Mesenchimal Stem Cells Avoid Allogeneic Rejection. J. Inflammation ; 2: 8-18. Sadikin M., 2001. Isolasi dan Pemisahan Protein. Biokimia Eksperimen Laboratorium, FKUI, Jakarta, p.13. Santoso, S., 2008: Panduan Lengkap Menguasai SPSS 16. PT. Elex Media Komputindo. Sasse, M., Lengwinat, T., Henklein, P., Hlina, A., Schade, R. 2000. Replacement of Fetal Calf Serum in Cell Cultures by an Egg Yolk Factor with Cholecystokinin/ Gastric-like Immunoreactivity. Altern. Lab. Anim. 28(6):815–831. 85 Sastroasmoro, S., Ismael, S. 2002. Dasar-dasar Metodologi Penelitian Klinis. Edisi ke-2. Sagung Seto. Savarese, T., Strohsnitter C.W., Low H.P., Liu Q., Baik I., Okulick W., Chelmow D.P., Lagiou P., Quesenberry P.J., Noller K.L., Hsieh C.H., 2007. Correlation of Umbilical Cord Blood Hormones and Growth Factors with Stem Cell Potensial ; Implications for the Prenatal Origin of Breast Cancer Hypothesis. Breast Cancer Research. BioMed Central Ltd. USA. Schnieke, A.E, Kind, A.J., Ritchie, W,A., Mycock, K., Scott, A.R., Ritchie, M., Wilmut, I., Colman, A., Campbell, K.H. 1997. Human Factor IX Transgenic Sheep Produced by Transfer of Nuclei from Transfected Fetal Fibroblasts. Science, 278:2130-2133. Wiley-Liss. New York. 15:516-528 Selborne Biological Services. 2006. LipiMAX purified lipoprotein solution from bovine serum. Available from: http://www.selbornebiological.com/ products/lipimax.htm. Access: 02-02-2010 . Segel, G.B., Palis J., 2001: Hematology of The Newborn. Williams. Hematology, 6 ed, New York, McGraw Hill Medical Publishing Division ; chap 7 : 77-92. Segel, G.B., Palis J., 2001. Hematology of The Newborn. Williams Hematology, 6 ed, New York, McGraw Hill Medical Publishing Division ; chap 7 : 77-92. 86 Shetty, P.,Bharucha, K., Tanavde, V., 2006. Human Umbilical Cord Blood Serum can Replace Fetal Bovine Serum in the Culture of Mesenchymal Stem Cells. Cell Biology Internasional, 31:293-298. Spector, W.G., Spector, T.D. 2002. Pengantar Patologi Umum, edisi ketiga, Gadjah Mada University Press; 136-140,230-233. Spees, J. L., Gregory, C. A., Singh, H., Tucker H. A., Piester, A., Lynch, P. J., Smith, J. and Prockop, D. J. 2004. Internalized Antigens must be Removed to Prepare Hypoimmunogenic Mesechymal Stem Cells for Cell and Gene Therapy. Mol Ther; 9:747–756. Stryer L., 2000. Biokimia. Penerbit Buku Kedokteran EGC, Jakarta. p17-18 Stute N., Holtz K., Bubenheim M., Lange C., Blake F., Zander, A.R., 2004. Autologous Serum for Isolation and Expansion of Human Mesenkimal Stem Cells for Clinical Use. Exp Hematol; 32: 1212-1225. The U.S. Food and Drug Administration (FDA), 1991. Profil Fetal Bovine Serum. Available from : http://about.qkport.com/f/fetal_bovine_serum. Access: 23-07-2010. Todaro, G. J., Green, H.,1963. Quantitative Studies of the Growth of Mouse Embryo Cells in Culture and Their Development into Established Lines, New York, Department of Pathology, New York University School of Medicine. Trihendadi, C. 2005. Step by Step SPSS 17 Analisis Data Statistik. Yogyakarta: Andi Offset. United Nations Department of Economic and Social Affairs, Population Division. 2006. http://www.un.org/esa/population/unpop.htm. 87 Vorvick, L., Storck, S., Zieve, D., 2010. Placenta. Available from: http://www.nlm.nih.gov/medlineplus/ency/imagepages/19505.htm. Access: 23-07-2010. Wagner, J.E., Kernan. N,A., Steinbuch, M., Broxmeyer, H.E., Gluckman, E. 1995. Allogeneic Sibling Umbilical Cord Blood Transplantation in Children with Malignant and Non-Malignant Disease. Lancet ; 346: 2149. Walner W, Sengenberger R, Strick R, Pamela L. Strissel PL, Meurer B, 2007. Beckmann MW, Schlembach D, Angiogenic growth factors in maternal and fetal serum in pregnancies complicated by intrauterine growth restriction ;112, 51-57. Yamaguchi, M., Hirayama, F., Wakamoto, S., Fujihara, M., Murahashi, H., Sato, N., Ikebuchi, K., Sawada, K., Koike, T., Kuwabara, M., Azuma, H., Ikeda, H. 2002. Bone Marrow Stromal Cells Prepared using AB Serum and bFGF For Hematopoietic Stem Cells Expansion. Transfusion; 42:921e7. Yoon, K.C., You, I.C.,Im, S.K., Jeong, T.S., Park, Y.G., Choi, J., 2007. Application of Umbilical Cord Serum Eyedrops for the Treatment of Neurotrophic Keratitis, Ophthalmology; 114, 9, 1637-1642. Yoon, K.C., Song, B.Y., Seo, M.S., Park, Y.G.. 2006. Analysis of Tear Components in Umbilical Cord Serum and Its Application for the Treatment of Ocular Surface Diseases. Cornea; 25:268–72. 88 LAMPIRAN Lampiran 1 Uji Normalitas Data Jumlah Sel Tests of Normality Kolmogorov-Smirnova Kelompok Statistic df Shapiro-Wilk Sig. Statistic df Sig. .203 9 .200* .873 9 .133 DMEM + FBS 10% .228 9 .194 .899 9 .245 DMEM + Serum darah tali pusat manusia 5% .169 9 .200* .942 9 .600 DMEM + Serum darah tali pusat manusia 10% .171 9 .200* .917 9 .370 9 .200* .978 9 .953 Post Kontrol (DMEM) DMEM + Serum darah tali pusat .156 manusia 20% a. Lilliefors Significance Correction *. This is a lower bound of the true significance. Lampiran 2 Uji Kruskal-Wallis Jumlah Sel antara Kelompok Kontrol, FBS, dan Serum Tali Pusat Post 95% Confidence Interval for Mean N Kontrol (DMEM) DMEM + FBS 10% DMEM + Serum darah tali pusat manusia 10% Mean 9 328.11 6185.1 9 1 9 9685.1 1 Std. Deviation 25.790 Std. Error Lower Bound Upper Bound 8.597 308.29 347.93 1242.802 414.267 5229.81 7140.41 313.237 104.412 9444.34 9925.89 89 Post 95% Confidence Interval for Mean N Kontrol (DMEM) DMEM + FBS 10% Std. Deviation Mean 9 328.11 6185.1 9 1 DMEM + Serum darah tali pusat manusia 10% Total Std. Error 25.790 308.29 347.93 1242.802 414.267 5229.81 7140.41 9 9685.1 1 313.237 104.412 9444.34 9925.89 27 5399.4 4 3997.453 769.310 3818.10 6980.78 Post df1 27.779 df2 2 Sig. 24 .000 Ranks Kelompok Post N Mean Rank Kontrol (DMEM) 9 5.00 DMEM + FBS 10% 9 14.00 DMEM + Serum darah tali pusat manusia 10% 9 23.00 Total 27 Test Statisticsa,b Post Chi-Square 23.164 df 2 Asymp. .000 Sig. a. Kruskal Wallis Test Upper Bound 8.597 Test of Homogeneity of Variances Levene Statistic Lower Bound 90 Test Statisticsa,b Post Chi-Square 23.164 df 2 Asymp. .000 Sig. a. Kruskal Wallis Test b. Grouping Variable: Kelompok Lampiran 3 Uji Mann-Whitney antara Kontrol dengan Kelompok FBS Ranks Kelompok Post N Mean Rank Sum of Ranks Kontrol (DMEM) 9 5.00 45.00 DMEM + FBS 10% 9 14.00 126.00 Total 18 91 Test Statisticsb Post Mann-Whitney U .000 Wilcoxon W 45.000 Z -3.582 Asymp. Sig. (2-tailed) .000 Exact Sig. [2*(1-tailed .000a Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok Lampiran 4 Uji Mann-Whitney antara Kontrol dengan Kelompok Serum Tali Pusat Manusia Ranks Kelompok Post N Mean Rank Sum of Ranks Kontrol (DMEM) 9 5.00 45.00 DMEM + Serum darah tali pusat manusia 10% 9 14.00 126.00 Total 18 Test Statisticsb Post Mann-Whitney U .000 Wilcoxon W 45.000 Z -3.582 Asymp. Sig. (2-tailed) .000 Exact Sig. [2*(1-tailed .000a Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok 92 Lampiran 5 Uji Mann-Whitney antara Kelompok FBS dengan Kelompok Serum Tali Pusat Manusia Ranks Kelompok Post N Mean Rank Sum of Ranks DMEM + FBS 10% 9 5.00 45.00 DMEM + Serum darah tali pusat manusia 10% 9 14.00 126.00 Total 18 Test Statisticsb Post Mann-Whitney U .000 Wilcoxon W 45.000 Z -3.576 Asymp. Sig. (2-tailed) .000 Exact Sig. [2*(1-tailed .000a Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok Lampiran 6 Uji Kruskal-Wallis Jumlah Sel antara Kelompok Serum Tali Pusat dosis 5%, 10%, dan 20% Post 95% Confidence Interval for Mean N DMEM + Serum darah tali pusat manusia 5% DMEM + Serum darah tali pusat manusia 10% Mean Std. Deviation Std. Error Lower Bound Upper Bound 9 8125.8 9 628.012 209.337 7643.16 8608.62 9 9685.1 1 313.237 104.412 9444.34 9925.89 93 DMEM + Serum darah tali pusat manusia 20% Total 9 1.22E4 304.109 101.370 12007.02 12474.54 27 1.00E4 1779.852 342.533 9313.17 10721.35 Test of Homogeneity of Variances Post Levene Statistic df1 5.163 df2 2 Sig. 24 .014 Ranks Kelompok Post N Mean Rank DMEM + Serum darah tali pusat manusia 5% 9 5.00 DMEM + Serum darah tali pusat manusia 10% 9 14.00 DMEM + Serum darah tali pusat manusia 20% 9 23.00 Total 27 Test Statisticsa,b Post Chi-Square 23.150 Df 2 Asymp. .000 Sig. a. Kruskal Wallis Test b. Grouping Variable: Kelompok Lampiran 7 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 5% dengan 10% Ranks Kelompok N Mean Rank Sum of Ranks 94 Post DMEM + Serum darah tali pusat manusia 5% 9 5.00 45.00 DMEM + Serum darah tali pusat manusia 10% 9 14.00 126.00 Total Test Statisticsb 18 Post Mann-Whitney U .000 Wilcoxon W 45.000 Z -3.576 Asymp. Sig. (2-tailed) .000 Exact Sig. [2*(1-tailed .000a Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok Lampiran 8 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 5% dengan 20% Ranks Kelompok Post N Mean Rank Sum of Ranks DMEM + Serum darah tali pusat manusia 5% 9 5.00 45.00 DMEM + Serum darah tali pusat manusia 20% 9 14.00 126.00 Total 18 Test Statisticsb Post Mann-Whitney U Wilcoxon W Z Asymp. Sig. (2-tailed) .000 45.000 -3.578 .000 95 Exact Sig. [2*(1-tailed Sig.)] .000a a. Not corrected for ties. b. Grouping Variable: Kelompok Lampiran 9 Uji Mann-Whitney antara Kelompok Serum Tali Pusat Manusia dosis 10% dengan 20% Ranks Kelompok Post N Mean Rank Sum of Ranks DMEM + Serum darah tali pusat manusia 10% 9 5.00 45.00 DMEM + Serum darah tali pusat manusia 20% 9 14.00 126.00 Total 18 Test Statisticsb Post Mann-Whitney U .000 Wilcoxon W 45.000 Z -3.578 Asymp. Sig. (2-tailed) .000 Exact Sig. [2*(1-tailed .000a Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok Lampiran 10 Analisis Regresi Linier Model Summary Model R R Square Adjusted R Square Std. Error of the Estimate 96 1 .962a .925 a. Predictors: (Constant), Kelompok .922 496.763 UJI LINEARITAS Sum of Squares Model 1 Regression Residual Df Mean Square 7.620E7 1 6169339.630 25 Total 8.236E7 a. Predictors: (Constant), Kelompok b. Dependent Variable: Post F Sig. 7.620E7 308.766 .000a 246773.585 26 Coefficientsa Unstandardized Coefficients Model 1 B (Constant) Standardized Coefficients Std. Error 1787.481 478.011 Kelompok 2057.444 a. Dependent Variable: Post 117.088 Beta t .962 Sig. 3.739 .001 17.572 .000 Lampiran 11 Analisis Total Protein Tests of Normality Kolmogorov-Smirnova Kelompok Total_Protein FBS Statistic df Shapiro-Wilk Sig. Statistic df Sig. .292 9 .026 .764 9 .008 hUCBS .194 a. Lilliefors Significance Correction 9 .200* .904 9 .275 97 Tests of Normality Kolmogorov-Smirnova Kelompok Statistic Total_Protein FBS df Shapiro-Wilk Sig. .292 hUCBS .194 a. Lilliefors Significance Correction *. This is a lower bound of the true significance. Statistic df 9 .026 .764 9 .008 9 * .904 9 .275 .200 Group Statistics Kelompok N Mean Total_Protein FBS hUCBS Std. Deviation 32.2894 5.41955 1.80652 9 50.3667 4.07398 1.35799 N Total_Protein FBS hUCBS Total Mean Rank Sum of Ranks 9 5.00 45.00 9 14.00 126.00 18 Test Statisticsb Total_Protein Mann-Whitney U Wilcoxon W Z Asymp. Sig. (2-tailed) Exact Sig. [2*(1-tailed Sig.)] a. Not corrected for ties. b. Grouping Variable: Kelompok Std. Error Mean 9 Ranks Kelompok .000 45.000 -3.576 .000 .000a Sig. 98 FOTO PENELITIAN Darah tali pusat manusia (UCB) UCB dicentrifuge 4000 g selama 10 menit Serum darah tali pusat (hUCBS) 99 SERUM FETUS SAPI ( FOETAL BOVINE SERUM, FBS) DMEM Persiapan Thawing Bahan operasional: DMEM, FBS, PanStrep Medium dimasukan sekitar 7 ml, kemudian masukan sel 100 Pengambilan sel dari cryotube Inaktivasi medium Pemasukan sel ke medium Medium optimum 101 Pengamatan sel dengan mikroskop inverted Pelet hasil centrifugasi Pembuangan supernatant Penanaman sel Penghomogenan sel Pengamatan sebelum incubator 102 Inkubator dengan suhu 370C MTT assay Pembacaan hasil sel titer dengan microplate reader Nanodrop 103 Hemasitometer Perhitungan sel Pembacaan hemasitometer