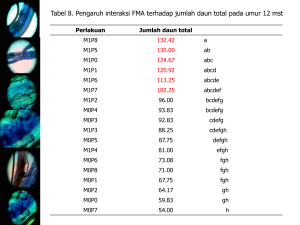
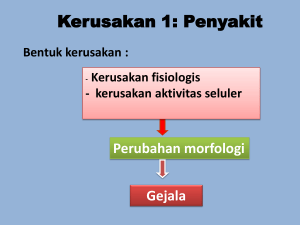
bab ii tinjauan pustaka
advertisement

1 BAB I PENDAHULUAN 1.1 Latar Belakang Pertanian merupakan suatu sektor penting yang berkaitan erat dengan usaha memenuhi kebutuhan pangan manusia. Namun masalah yang timbul ialah kebutuhan pangan terus meningkat, tetapi dilain pihak penyediaan pangan sulit ditingkatkan. Tanah merupakan salah satu faktor pembatas dalam pertanian, luas tanah tidak dapat ditingkatkan namun yang dapat ditingkatkan ialah cara meningkatkan produktivitas di lahan yang sama (Margarettha dan Itang , 2008). Usaha meningkatkan produksi pertanian untuk memenuhi kebutuhan pangan dapat dilakukan melalui berbagai cara, salah satunya yaitu dengan melalui pemupukan. Pupuk kimia anorganik dapat meningkatkan produktivitas tanaman, namun apabila pemakaiannya secara terus-menerus dan berlebihan akan menyebabkan penurunan kualitas tanah pertanian yang dicirikan oleh berkurangnya daya serap air dan rendahnya kandungan bahan organik (C-organik < 2 %), P2O5 tersedia (< 10 ppm), N total (< 0,2%), dan reaksi tanah masam (pH H2O < 6) (Sofyan et al., 2005) . Ketidakseimbangan penggunaan pupuk kimia dari tahun ke tahun menyebabkan tanah menjadi tidak subur, hal ini berpengaruh terhadap produktivitas tanaman meskipun telah dilakukan penambahan unsur hara makro, mikro, dan zat pengatur tumbuh, namun produksi yang dihasilkan tetap tidak seimbang (Sofyan et al., 2005). Hal tersebut merupakan indikasi bahwa kualitas tanah menurun produktivitasnya, tidak lagi mampu menyokong pertumbuhan dan produksi tanaman secara optimal, dan untuk mendapatkan produksi yang baik, maka diperlukan teknologi dan informasi yang baik tidak lagi terjadi pemupukan yang tidak efisien, selain itu masalah lain yang dihadapi yaitu tanaman menjadi sangat rawan terhadap hama dan penyakit, meskipun produktivitasnya terbilang cukup tinggi. Berkaitan dengan hal tersebut, terdapat fakta bahwa hampir 90% produk pertanian Indonesia diproduksi dengan menggunakan bahan anorganik seperti pupuk kimia dan pestisida, sehingga besar kemungkinan produk pertanian 2 Indonesia tidak memenuhi standar Internasional dan tidak diminati oleh pasar Internasional (Bayu, 2010). Salah satu upaya yang dapat ditempuh untuk meningkatkan daya dukung tanah terhadap pertumbuhan tanaman adalah dengan pemanfaatan fungi mikoriza arbuskular (FMA). FMA dapat diaplikasikan pada lahan marjinal, lahan kering, yang pada pembudidayaan tanamannya memiliki beberapa kendala, antara lain rendahnya ketersediaan air dan hara, pH tanah rendah, dan tingginya laju pencucian hara. Pemanfaatan FMA bertujuan untuk memperbaiki tingkat serapan hara dan air terutama unsur fosfat, dan meningkatkan ketahanan tanaman terhadap serangan patogen tanah melalui simbiosis antara FMA dengan akar tanaman. Secara tidak langsung FMA dapat meningkatkan pembentukan dan penyebaran akar tanaman melalui hifa eksternal yang mengakibatkan meningkatnya serapan unsur hara lain oleh tanaman. FMA mempunyai korelasi positif terhadap beberapa aspek fisiologi tanaman inang diantaranya dalam hal menurunkan serangan penyakit. MVA (Mikoriza Vesicular Arbuscular) G. fasciculatus telah terbukti dapat menurunkan atau mengahalangi penyakit yang disebabkan oleh patogen tular tanah. MVA Glomus sp mampu menurunkan serangan Pseudomaonas solanacearum bakteri patogen layu pada tomat (Nurhayati, 2010). Menurut Aldeman et al, (2006) infeksi mikoriza dapat meningkatkan pertumbuhan tanaman dan kemampuannya memanfaatkan nutrisi yang ada dalam tanah, terutama unsur P, Ca, N, Cu, Mn, K, dan Mg. Kolonisasi mikoriza pada akar tanaman dapat memperluas bidang serapan akar dengan adanya hifa eksternal yang tumbuh dan berkembang melalui bulu akar (Mosse,2001). FMA selain berpotensi sebagai biopestisida atau pengendali hayati yang aktif terhadap serangan patogen akar. FMA mempunyai kemampuan ganda yaitu sebagai biopestisida yang ramah lingkungan dan mampu meningkatkan pertumbuhan tanaman karena dpat meningkatkan pengambilan P melalui akar yang terinfeksi hifa FMA. Menurut Santosa (2009) Hifa eksternal dari FMA dapat meningkatkan kemampuan tanaman dalam membantu penyerapan hara P dan mendapatkan air. 3 Selain itu infeksi cendawan mikoriza dapat meningkatkan penyerapan unsur hara oleh hifa eksternal dengan memperluas permukaan penyerapan akar atau melalui hasil senyawa kimia yang menyebabkan lepasnya ikatan hara dalam tanah. Tisdall (2001) melaporkan bahwa hifa ekstra radikal di dalam tanah sekitar akar menghasilkan material yang mendorong agregasi tanah sehingga dapat meningkatkan aerasi, penyerapan air dan stabilitas tanah. Infeksi mikoriza pada akar, memungkinkan mineral dapat dialirkan langsung dari satu tanaman ke tanaman lain, atau dari bahan organik mati ke akar tanaman. Juga membentuk lingkungan mikrorisosfer yang dapat mengubah komposisi dan aktivitas mikroba. Hal ini terjadi karena perubahan fisiologi akar dan produksi sekresi oleh mikoriza (Haris dan Adnan, 2005). Penggunaan inokulan FMA dan pupuk organik yang dapat diproduksi sendiri merupakan alternatif yang lebih baik dibandingkan pupuk kimia buatan untuk mengatasi hambatan pertumbuhan pada tanaman. Cameron (2010) Telah melaporkan bahwa tanaman yang diberi inokulan FMA mempunyai produktivitas yang lebih tinggi dibandingkan tanaman yang tumbuh tanpa diberi inokulan FMA. Oleh sebab itu dibutuhkan penelitian untuk mengetahui efektivitas teknik perbanyakan Fungi mikoriza yang nantinya dapat diaplikasikan pada tanaman pertanian maupun kehutanan. 1.2 Tujuan Penelitian Penelitian ini bertujuan untuk mendapatkan kombinasi media tanam dan tanaman inang terbaik untuk perbanyakan FMA yang optimal. 1.3 Manfaat Penelitian Penelitian ini diharapkan dapat memberikan manfaat bagi peneliti dan pengguna FMA, khususnya petani tanaman hortikultura atau tanaman lain yang bernilai ekonomi tinggi. Rincian manfaat penelitian ini ialah sebagai berikut: 1. Memberikan pemahaman mengenai faktor-faktor yang berpengaruh terhadap indikator keberhasilan prosedur teknik perbanyakan FMA. 4 2. Menghasilkan prosedur perbanyakan FMA yang lebih sederhana berdasarkan sterilisasi substrat, karakteristik sumber hara, dan jenis tanaman inang. 3. Memberikan informasi ilmiah mengenai teknik perbanyakan FMA. 4. Sebagai acuan data dalam penelitian selanjutnya. 1.4 Hipotesis 1. Adanya perbedaan populasi dan persentase akar terinfeksi FMA pada berbagai kombinasi jenis media dan tanaman inang. 2. Perbedaan jenis media dan tanaman inang mempengaruhi produksi spora dan hifa FMA. 3. Besarnya persentase infeksi FMA diikuti oleh pertumbuhan tanaman inang. 5 BAB II TINJAUAN PUSTAKA 2.1 Fungi Mikoriza Arbuskular (FMA) Fungi Mikoriza Arbuskular adalah simbiosis mutualisme (asosiasi non patogen) antara fungi dengan akar tanaman tingkat tinggi (Orlando, 2003). Merupakan simbiosis yang paling sering ditemui di muka bumi, ditelaah, dan dimanfaatkan untuk meningkatkan produktivitas tanaman. Fitobion yang terlibat dalam simbiosis FMA ialah sekitar 80 – 90% tanaman darat (Brundrett, 2009). Mikobion yang terlibat ialah fungi obligat warga filum Glomeromycota (Schüβler et al., 2001) yang memiliki empat bangsa (ordo) (Glomerales, Diversisporales, Paraglomerales, dan Archaeosporales), 11 suku (famili), 18 marga (genus) dan sekitar 300 jenis yang berhasil dikenali (Schüßler dan Walker, 2010). FMA hidup bersama dengan komunitas jasad hidup lainnya yang ada di rizosfer. Agar mampu hidup di rizosfer, sebuah habitat yang kompetitif dan dinamis, FMA harus mampu memproduksi banyak propagul dalam bentuk hifa ekstraradikal dan spora. Mikoriza memerlukan akar tumbuhan untuk melengkapi daur hidupnya. Sebaliknya, beberapa tumbuhan bahkan ada yang tergantung pertumbuhannya dengan mikoriza. Beberapa jenis tumbuhan tidak tumbuh atau terhambat pertumbuhannya tanpa kehadiran mikoriza di akarnya. Sebagai contoh, semaian pinus akan gagal tumbuh setelah pemindahan apabila tidak terbentuk jaringan mikoriza di sekitar akarnya. Hanya sedikit kelompok tumbuhan yang tidak menjadi simbion, seperti dari Brassicaceae, Commelinaceae, Juncaceae, Proteaceae, Capparaceae, Cyperaceae, Polygonaceae, Resedaceae, Urticaceae, dan Caryophyllales. Fungi Mikoriza terbagi ke dalam dua jenis, yaitu endomikoriza dan ektomikoriza. Pada umumnya ektomikoriza termasuk dalam Basidiomycota (Siti, 1994). 6 Gambar 1 Sebuah Arbuskular pada Fungi Mikoriza Arbuskular (Foto oleh: Brundrett dalam Nathan et al., 2008) Ektomikoriza menginfeksi permukaan luar tanaman dan di antara sel-sel ujung akar. Akibat serangannya, terlihat jalinan miselium berwarna putih pada bagian rambut-rambut akar, dikenal sebagai hartig net. Serangan ini dapat menyebabkan perubahan morfologi akar. Akar-akar memendek, membengkak, bercabang dikotom, dan dapat membentuk pigmen. Tumbuhan inangnya biasanya tumbuhan tahunan atau pohon. Beberapa di antaranya merupakan komoditi kehutanan dan pertanian seperti sengon, jati, serta beberapa tanaman buah seperti mangga, rambutan, dan jeruk. Selain itu pohon-pohon anggota Betulaceae, Fagaceae, dan Pinaceae juga menjadi inangnya. Gambar 2 Fungi Endomikoriza yang Menembus Sel Akar (Foto oleh: Native Plant Production, University of Washington, Juni 2006) 7 Endomikoriza menginfeksi bagian dalam akar, di dalam dan di antara selsel ujung akar (root tip). Pada Hifa masuk ke dalam sel atau mengisi ruang-ruang antarsel (Gambar 1). Jenis mikoriza ini banyak ditemukan pada tumbuhan semusim yang merupakan komoditi pertanian penting, yaitu kacang-kacangan, padi, jagung, beberapa jenis sayuran dan tanaman hias. Infeksi ini tidak menyebabkan perubahan morfologi akar, tetapi mengubah penampilan sel dan jaringan akar. Berdasarkan tipe infeksinya, dikenal tiga kelompok endomikoriza: ericaceous (Ericales dengan sejumlah Ascomycota), orchidaceous (Orchidaceae dengan sekelompok Basidiomycota), dan vesikular arbuskular (sejumlah tumbuhan berpembuluh dengan Endogonales, membentuk struktur vesikula dan arbuskula dalam korteks akar) (Siti, 1994). Gambar 3 Perpindahan Nutrisi Melalui Hifa Mikoriza (Foto oleh: Native Plant Production, University of Washington, Juni 2006) Manfaat dari FMA dapat dikelompokkan menjadi tiga, yaitu manfaat dalam ekosistem, manfaat bagi tanaman, dan manfaatnya bagi manusia. Manfaat mikoriza FMA dalam ekosistem sangat penting, yaitu berperan dalam siklus hara, memperbaiki struktur tanah dan menyalurkan nutrisi yang dibutuhkan organisme tanah dari akar tanaman (Ana Feronika, 2003). Sedangkan manfaat bagi tanaman yaitu dapat meningkatkan penyerapan unsur hara, terutama P (Sinwin et al., 2006), karena FMA dapat mengeluarkan enzim fosfatase dan asam-asam organik, khususnya oksalat yang dapat membantu membebaskan P. 8 FMA dapat membantu mengatasi masalah ketersediaan fosfat melalui dua cara, pengaruh langsung melalui jalinan hifa eksternal yang diproduksinya secara intensif sehingga tanaman bermikoriza akan mampu meningkatkan kapasitasnya dalam menyerap unsur hara dan air (Sinwin et al., 2006) dan pengaruh tidak langsung, yaitu mikoriza dapat memodifikasi fisiologis akar sehingga dapat mengeksresikan asam-asam organik dan fosfatase asam ke dalam tanah (Read et al., 2000). Menurut Marschner dan Dell, (1994), dalam Sinwin et al., (2006) fosfatase asam merupakan suatu enzim yang dapat memacu proses mineralisasi P organik dengan mengkatalisis pelepasan P dari kompleks organik menjadi kompleks anorganik. 2.2 Media FMA Metode yang paling umum dan diandalkan untuk memproduksi inokulum FMA adalah metode kultur pot. Akar atau tanah dari lapangan dapat digunakan langsung sebagai sumber inokulum untuk kultur. Akan tetapi kultur yang langsung dari lapangan biasanya mengandung banyak mikroorganisme yang tidak diinginkan. Oleh karena itu dianjurkan untuk memulai produksi inokulum dengan kultur spora tunggal yang bebas dari semua organisme lain. Kultur FMA yang berasal dari kultur spora tunggal lebih disukai karena kultur dihasilkan dari satu spora sehingga kemurnian kultur sangat terjamin (Raschen dan Von Alten, 2002). Pemilihan media tumbuh dalam produksi inokulum FMA merupakan aspek paling penting (Menge, 2004). Dianjurkan menggunakan media yang sedikit mengandung unsur hara dengan kapasitas tukar kation yang tinggi dan ketersediaan unsur P yang rendah serta bebas patogen. Media tanam dengan kandungan P tersedia yang tinggi akan menghambat kolonisasi dan produksi spora FMA (Delvian, 2006). Selanjutnya dikatakan bahwa tanah adalah faktor yang kritis sebagai media tumbuh karena tanah merupakan sumber P dan unsur mikro dan juga berfungsi sebagai penahan alami bagi ketersediaan unsur hara Oleh karena itu dapat digunakan media berupa tanah, zeolit, pupuk kandang, pupuk kompos, dan media campuran dari beberapa media tersebut. 9 2.2.1 Media Tanah Tanah secara umum tersusun atas senyawa organik, senyawa anorganik, udara, dan air serta mengandung bagian yang berbentuk jasad hidup yang secara umum terdiri dari mikroba. Mikroba tanah sebagian besar terdiri dari bakteri, fungi dan mikroalgae. Jumlah mikroba tanah sangat tinggi, yakni berkisar 320.000–200.000.000 setiap gram tanah. Kehadirannya dalam tanah ada yang menguntungkan dan ada pula yang merugikan (Ludwaluyo, 2007). Tanah sebagai tempat tumbuh tanaman, merupakan subsistem yang cukup kompleks. Salah satunya adalah komponen biotik yaitu jasad makro dan mikro, yang secara bersama dengan komponen abiotik membentuk tempat tumbuh bagi kelangsungan hidup tanaman diatasnya secara berimbang. Seperti halnya mikoriza yang hidup dan tumbuh di dalam tanah di antara daerah perakaran tanaman. Untuk menjamin kestabilan ini, maka pengelolaan sumber daya alam harus dilakukan secara seimbang, tanpa harus terjadi perubahan besar atau mendadak. Itulah sebabnya perlunya menjaga keberadaan serta fungsi komponen sistem dan individu dalam komponen tersebut. Kemajuan ilmu pengetahuan dan teknologi telah diketahui banyak jasad atau mikroorganisme yang berguna bagi tanaman, bahkan ada yang dapat membantu tanaman dalam hal penyerapan unsur hara dan menjaga kondisi tanah dengan menghasilkan sekresi ekstraselular, vitamin, dan zat tumbuh (Haris dan Adnan, 2005). 2.2.2 Pupuk Kandang Pupuk kandang (pukan) didefinisikan sebagai semua produk buangan dari binatang peliharaan yang dapat digunakan untuk menambah hara, memperbaiki sifat fisik, dan biologi tanah. Apabila dalam memelihara ternak tersebut diberi alas seperti sekam pada ayam, jerami pada sapi, kerbau dan kuda, maka alas tersebut akan dicampur menjadi satu kesatuan dan disebut sebagai pukan pula. Beberapa petani di beberapa daerah memisahkan antara pukan padat dan cair. 10 Pupuk kandang merupakan hasil samping yang cukup penting, terdiri dari kotoran padat dan cair dari hewan ternak yang bercampur sisa makanan, dapat menambah unsur hara dalam tanah (Sarief, 2009). Pemberian pupuk kandang selain dapat menambah tersedianya unsur hara, juga dapat memperbaiki sifat fisik tanah. Beberapa sifat fisik tanah yang dapat dipengaruhi pupuk kandang antara lain kemantapan agregat, bobot volume, total ruang pori, plastisitas dan daya pegang air (Nyoman, 2007). Pemakaian pupuk kandang perlu dipertimbangkan, karena pupuk kandang dapat menyebabkan berkembangnya gulma pada lahan yang diusahakan. Diketahui bahwa keberadaan gulma yang dibiarkan tumbuh pada suatu pertanaman dapat menurunkan hasil 20 % sampai 80 % (Moenandir et al., 2003). Salah satu usaha yang dapat dilakukan untuk menekan hal tersebut adalah dengan penggunaan jenis pupuk kandang yang tepat. Terdapatnya gulma pada pupuk kandang sangat dipengaruhi oleh kebijaksanaan petani saat menggembalakan ternaknya. Oleh karena lingkungan penggembalaan yang berbeda, maka gulma yang dimakan ternak juga berbeda (Nyoman, 2007). Gambar 4 Kotoran sapi yang ditambah sekam jerami (Foto oleh: Widowati et al., 2004) 11 2.2.3 Pupuk Kompos Kompos merupakan sisa-sisa organik yang telah mengalami dekomposisi sehingga dapat dipakai sebagai pupuk. Kompos dibuat dari bahan organik yang berasal dari bermacam-macam sumber. Dengan demikian, kompos merupakan sumber bahan organik dan nutrisi tanaman. Kompos Leaf Pka (kompos plus) memiliki spesifikasi kandungan N 2,08 %, P2O5 1,15%, K2O 0,39%, c/n ratio 7,32, Bahan organik 26,31%, pH 7,67 dan kadar air 15,56% (Analisis Laboratorium Ilmu Tanah Universitas Pembangunan Nasional ”Veteran” Yogyakarta, 2010 dalam Candra, 2011). Kompos merupakan sumber hara makro dan mikromineral secara lengkap meskipun dalam jumlah yang relatif kecil (N, P, K, Ca, Mg, Zn, Cu, B, Zn, Mo, dan Si). Dalam jangka panjang, pemberian kompos dapat memperbaiki pH dan meningkatkan hasil tanaman pertanian pada tanahtanah masam. Pada tanah-tanah yang kandungan P-tersedia rendah, bentuk fosfat organik mempunyai peranan penting dalam penyediaan hara tanaman karena hampir sebagian besar P yang diperlukan tanaman terdapat pada senyawa P-organik. Sebagian besar Porganik dalam organ tanaman terdapat sebagai fitin, fosfolipid, dan asam nukleat. Kedua yang terakhir hanya terdapat sedikit dalam bahan organik tanah karena senyawa tersebut mudah digunakan oleh jasad renik tanah. Turunan senyawasenyawa tersebut sangat penting dalam tanah (karena kemampuannya membentuk senyawa dengan kation polivalen), terdapat dalam jumlah relatif tinggi, tetapi yang dekomposisinya lambat ialah inositol. Pada tanah alkalin, terbentuk inositol fosfat dengan Ca atau Mg, sedangkan pada tanah masam dengan Al atau Fe. Panorganik dalam bentuk Al-Fe; Ca-P yang tidak tersedia bagi tanaman, akan dirombak oleh organisme pelarut P menjadi P- anorganik yang larut atau tersedia bagi tanaman. (Setyorini et al., 2007). Selain itu, kompos juga mengandung humus (bunga tanah) yang sangat dibutuhkan untuk peningkatan hara makro dan mikro dan sangat dibutuhkan tanaman. Misel humus mempunyai kapasitas tukar kation (KTK) yang lebih besar daripada misel lempung (3-10 kali) sehingga penyediaan hara makro dan mikromineral lebih lama. Kapasitas tukar kation (KTK) asam-asam organik dari 12 kompos lebih tinggi dibandingkan mineral liat, namun lebih peka terhadap perubahan pH karena mempunyai sumber muatan tergantung pH (pH dependent charge). Kompos banyak mengandung mikroorganisme (fungi, aktinomisetes, bakteri, dan alga). Dengan ditambahkannya kompos ke dalam tanah tidak hanya jutaan mikroorganisme yang ditambahkan, akan tetapi mikroorganisme yang ada dalam tanah juga terpacu untuk berkembang (Candra, 2011) . Proses dekomposisi lanjut oleh mikroorganisme akan tetap terus berlangsung tetapi tidak mengganggu tanaman. Gas CO yang dihasilkan mikroorganisme tanah akan dipergunakan untuk fotosintesis tanaman, sehingga pertumbuhan tanaman akan lebih cepat. Amonifiksi, nitrifikasi, dan fiksasi nitrogen juga meningkat karena pemberian bahan organic sebagai sumber karbon yang terkandung di dalam kompos. Aktivitas berbagai mikroorganisme di dalam kompos menghasilkan hormon-hormon pertumbuhan, misalnya auksin, giberelin, dan sitokinin yang memacu pertumbuhan dan perkembangan akar-akar rambut sehingga daerah pencarian makanan lebih luas (Candra, 2011). 2.2.4 Zeolit Mineral zeolit sudah diketahui sejak tahun 1755 oleh seorang ahli mineralogi bernama F.A.F. Cronstedt. Meskipun demikian penggunaan mineral zeolit untuk industri baru dimulai tahun 1940 dan 1973. Tahun 1940 adalah penggunaan mineral zeolit sintetis, sedangkan tahun 1973 adalah permulaan penggunaan mineral zeolit alam. Dikarenakan mineral zeolit alam sulit dipisahkan dari batuan induknya maka ini menjadi alasan dibuatnya zeolit sintesis. Mineral zeolit sintetis yang dibuat tidak dapat persis sama dengan mineral zeolit alam, walaupun zeolit sintetis mempunyai sifat fisik yang jauh lebih baik. Pada tahun tersebut merupakan titik awal penggunaan nyata bagi mineral zeolit alam untuk keperluan berbagai industri. Diharapkan dengan adanya berbagai penelitian mengenai zeolit alam diharapkan dapat meningkatkan nilai tambah (Dwikarsa et al., 2007). 13 Gambar 5 Batuan Zeolit Mineral zeolit bukan merupakan mineral tunggal, melainkan sekelompok mineral yang terdiri dari beberapa jenis unsur. Secara umum mineral zeolit adalah senyawa alumino silikat hidrat dengan logam alkali tanah serta mempunyai rumus kimia sebagai berikut : M 2 x/n Si Al O .yH O 1-x x 2 2 Dengan M = e.g Na, K, Li, Ag, NH, H, Ca, Ba, Ikatan ion Al-Si-O adalah pembentuk struktur kristal, sedangkan logam alkali adalah kation yang mudah tertukar (exchangeable cation). Jumlah molekul air menunjukkan jumlah pori-pori atau volume ruang hampa yang akan terbentuk bila unit sel kristal zeolit tersebut dipanaskan (Dwikarsa et al., 2007). Gambar 6 Rangka zeolit yang terbentuk dari ikatan 4 atom O dengan 1 atom Si ( Foto oleh: Bell, 2001) 14 Sekarang ini lebih dari 40 zeolit alam maupun 150 tipe yang artificial telah digunakan dalam berbagai bidang berdasarkan publikasi International Zeolit Association. Pada struktur zeolit, semua atom Al dalam bentuk tertahedra sehingga atom Al akan bermuatan negatif karena berkoordinasi dengan 4 atom oksigen dan selalu dinetralkan oleh kation alkali atau alkali tanah untuk mencapai senyawa yang stabil. Lain halnya dengan batuan lempung (clay materials) dengan struktur lapisan, dimana sifat pertukaran ionnya disebabkan oleh 1) brokend bonds yaitu makin kecil partikel penyerapan makin besar, 2) gugus hidroksid yang mana atom hidrogen dapat digantikan dengan kation lain atau 3) substitusi isomorf Al pada tertrahedra Si menyebabkan ikatan Al-Si cukup kuat dan mengurangi swelling (Dwikarsa et al., 2007). Kemampuan zeolit sebagai ion exchanger telah lama diketahui dan digunakan sebagai penghilang polutan kimia10 (Abdurahman, 2004). Dalam air zeolit mampu mengikat bakteri E. coli11, kemampuan ini bergantung pada laju penyaringan dan perbandingan volume air dengan massa zeolit. Tetapi, untuk logam variabel-variabel yang mempengaruhi efektivitas penukaran kation belum diketahui. Sehingga zeolit mampu mengatasi mikroba-mikroba patogen yang berada dalam daerah perakaran. 2.3 Tanaman Inang Kegiatan produksi FMA harus memperhatikan beberapa faktor yang dapat mempengaruhi kualitas inokulum yang dihasilkan. Faktor tersebut menurut Menge (2004) antara lain adalah tanaman inang, media tumbuh, pemupukan, aerasi, pH, cahaya dan fotoperiode, suhu, dan pemakaian bahan kimia. Tanaman inang yang akan digunakan harus mempunyai daya adaptasi yang baik, berasosiasi dengan FMA, cepat tumbuh dengan perakaran yang ekstensif, dan tidak rentan terhadap patogen. Karena sebagian besar tanaman berasosiasi dengan FMA maka berbagai jenis tanaman dapat digunakan sebagai inang FMA. Menurut Vilarino et al., (2002) umumnya kesehatan tanaman adalah lebih penting daripada jenis tanamannya. 15 2.3.1 Sorgum (Sorghum bicolor (L.) Moench). Tanaman sorgum merupakan tanaman yang termasuk ke dalam famili graminae yang mampu tumbuh tinggi hingga 6 meter. Bunga sorgum termasuk bunga sempurna dimana kedua alat kelaminnya berada di dalam satu bunga. Bunga sorgum merupakan bunga tipe panicle (susunan bunga di tangkai). Rangkaian bunga sorgum berada di bagian ujung tanaman. Bentuk tanaman ini secara umum hampir mirip dengan jagung, yang membedakan adalah tipe bunga dimana jagung memiliki bunga tidak sempurna, sedangkan sorgum bunga sempurna (Candra, 2011). Tanaman sorgum memiliki system perakara serabut. Rismunandar, (2006) menyatakan bahwa sorgum merupakan tanaman biji berkeping satu tidak membentuk akar tunggang dan hanya akar lateral. Sistem perakarannya terdiri atas akar-akar seminal (akar-akar primer) pada dasar buku pertama pangkal batang, akarakar koronal (akar-akar pada pangkal batang yang tumbuh ke arah atas) dan akar udara (akar-akar yang tumbuh dipermukaan tanah). Tanaman sorgum membentuk perakaran sekunder 2 kali lipat dari jagung. Pada penelitian Candra (2011) tanaman sorgum yang diinokulasi dengan 10 gram FMA memberikan hasil yang lebih baik dalam hal bobot biomassa, bobot kering tanaman, tinggi tanaman, serta jumlah daun dibanding dengan tanaman kontrol, hal ini dikarenakan FMA secara efektif dapat meningkatkan penyerapan unsur hara baik unsur hara makro maupun mikro. Selain daripada itu akar sorgum yang bermikoriza dapat menyerap unsur hara dalam bentuk terikat dan yang tidak tersedia bagi tanaman. Penggunaan inokulum yang tepat dapat menggantikan sebagian kebutuhan pupuk. Tanaman sorgum yang terinfeksi FMA dapat menyerap pupuk P lebih tinggi (10-27%) dibandingkan dengan tanaman yang tidak bermikoriza (0.4-13%). 2.3.2 Jagung (Zea mays) Jagung merupakan tanaman semusim (annual). Satu siklus hidupnya diselesaikan dalam 80-150 hari. Tahap pertama dari siklus hidupnya merupakan tahap pertumbuhan vegetatif dan tahap kedua untuk tahap pertumbuhan generatif. 16 Tinggi tanaman jagung sangat bervariasi. Tanaman jagung umumnya berketinggian antara 1m sampai 3m. Akar jagung tergolong akar serabut yang dapat mencapai kedalaman 8 m meskipun sebagian besar berada pada kisaran 2 m. Pada tanaman yang sudah cukup dewasa muncul akar adventif dari buku-buku batang bagian bawah yang membantu menyangga tegaknya tanaman. Salah satu masalah yang dihadapi dalam upaya peningkatan produktivitas jagung adalah penanaman yang sering tertunda. Pada lahan kering beriklim kering seperti di Nusa Tenggara Timur dengan curah hujan terbatas dan eratik, penanaman jagung harus tepat waktu agar tanaman tidak mengalami kekeringan. Pada lahan sawah tadah hujan pada musim kemarau, jagung sebaiknya ditanam segera setelah panen padi pada saat kondisi tanah masih lembab, dan sumur sebaiknya dibuat untuk menjamin ketersedian air bagitanaman. Pada lahan sawah irigasi dengan air terbatas, pola tanam padi - jagung - jagung dapat disarankan (Bahtiar et al. 2005). Jagung dapat ditanam di daerah dataran rendah sampai dataran tinggi (pegunungan). Umumnya tanaman jagung yang di tanam di ketinggian 800 m dpl akan mendapatkan hasil yang tinggi. Tanaman jagung tidak membutuhkan persyaratan tanah yang khusus, hampir semua jenis tanah dapat ditanami tanaman jagung. Tetapi jagung yang ditanam pada tanah yang gembur, subur, dan kaya humus akan memberikan hasil dengan baik. Untuk pertumbuhan optimal pada tanaman jagung membutuhkan pH antara 5,5-6,5 (Eva, 2008). Tanaman jagung membutuhkan unsur hara yang besar untuk mendukung pertumbuhannya. Pada penelitian Eva (2008) FMA mampu memberikan pengaruh nyata terhadap pertumbuhan tanaman jagung. Tanaman jagung yang terinfeksi FMA memperlihatkan peningkatan bobot biomassa, bobot kering serta tinggi tanaman. Hal ini karena FMA mampu meningkatkan penyerapan unsur hara pada tanaman inangnya melalui infeksi hifa FMA pada akar. 17 2.3.3 Serai Dapur (Cymbopogon citratus) Habitus serai dapur (Cymbopogon citratus) berupa tanaman tahunan (parennial) yang hidup secara meliar dan stolonifera (berbatang semu) yang membentuk rumpun tebal dengan tinggi hingga mencapai 1 – 2 meter, serta mempunyai aroma yang kuat dan wangi. Sistem perakaran tanaman sereh memiliki akar yang besar. Morfologi akarnya merupakan jenis akar serabut yang berimpang pendek dan akarnya berwarna coklat muda (Scot, 2008). Batang tanaman sereh bergerombol dan berumbi, serta lunak dan berongga. Isi batangnya merupakan pelepah umbi untuk pucuk dan berwarna putih kekuningan. Tanaman sereh memiliki batang yang berwarna putih, namun ada juga yang berwarna putih keunguan atau kemerahan. Selain itu, batang tanaman sereh juga bersifat kaku dan mudah patah. Batang tanaman ini tumbuh tegak lurus di atas tanah atau condong, membentuk rumpun, pendek, masif, dan bulat (silindris) (Scot, 2008). Morfologi daun tanaman serai berwarna hijau dan tidak bertangkai. Daunnya kesat, panjang, dan runcing, hampir menyerupai daun ilalang. Selain itu, daun tanaman ini memiliki bentuk seperti pita yang makin ke ujung makin runcing, berbau jeruk limau ketika daunnya diremas, berwarna hijau kebirubiruan. Daunnya juga memiliki tepi yang kasar dan tajam dan lokos, namun halus pada kedua permukaannya. Berdaun tunggal, lengkap, berpelepah daun silindris, gundul, seringkali bagian permukaan dalam berwarna merah, ujung berlidah (ligula). Tulang daun tanaman sereh tersusun sejajar. Letak daun pada batang tersebar. Panjang daunnya sekitar 50-100 cm, sedangkan lebarnya kira-kira 2 cm. Daging daun tipis, serta pada permukaan dan bagian bawah daunnya berbulu halus. Helainnya lebih dari separuh menggantung (Koba, 2009). Susunan bunganya malai atau bulir majemuk, bertangkai atau duduk, memiliki daun pelindung yang nyata, biasanya berwarna sama, umumnya putih. Daun pelindung dapat bermetamorfosis menjadi gluma steril dan fertil (pendukung bunga). Kelopak dapat bermetamorfosis menjadi bagian palea (2 unit) dan lemma atau sekam (1 unit). Sedangkan untuk mahkota dapat bermetamorfosis menjadi 2 kelenjar lodicula, berfungsi untuk membuka bunga di pagi hari. Benang 18 sari sereh dapur berjumlah 3-6, membuka secara memanjang. Putik serai dapur kepala putik sepasang berbentuk bulu, dengan percabangan berbentuk jambul. Buahnya berbentuk buah padi, memanjang, pipih dorso ventral, embrio separo bagian biji. Waktu berbunga Januari – Desember. Namun, tanaman serai jenis ini jarang sekali memiliki bunga. Cymbopogon citratus sangat jarang berbunga sehingga juga sangat jarang menghasilkan buah, bahkan biji. Karena sangat jarang berbunga dan menghasilkan biji maka tanaman ini pada umumnya bereproduksi dengan akar, tidak dengan biji (Koba, 2009). Habitat tumbuh pada daerah dengan ketinggian 50 – 2700 m dpl. Tanam pada berbagai kondisi tanah di daerah tropika yang lembab, cukup sinar matahari dan dengan curah hujan yang relatif tinggi. Wilayah Indonesia banyak terdapat di Jawa, ditepi jalan atau dipersawahan. Serai dapur memerlukan iklim yang panas degan cahaya matahari yang banyak dan curah hujan yang cukup. Tidak memerlukan tanah yang subur. Tanah yang berat dan subur, hasil daunnya tinggi, tetapi kadar minyaknya agak rendah (Dalimartha, 1999). 2.3.4 Serai Wangi (Cymbopogon nardus) Serai wangi merupakan salah satu jenis tanaman minyak atsiri, yang tergolong sudah berkembang. Hasil penyulingan daunnya, diperoleh minyak serai wangi yang dalam dunia perdagangan dikenal dengan nama Citronella oil. Minyak serai wangi Indonesia di pasar dunia dikenal dengan nama Java citronella oil. Komponen minyak serai wangi serai wangi terdiri dari senyawa sitronellal, geranio, geraniol asetat, sitronella asetat, seskuiterpen serta senyawa lain (Emmyzar dan Herry, 2002). Tanaman serai wangi diduga berasal dari rumput “mana” (Cymbopogon confertiflorus Stapt) yang tumbuh liar di Ceylon (Poerwanto, 2010). Tanaman ini merupakan famili dari rumput-rumputan (Graminae). Tanaman serai wangi akan tumbuh optimal pada tanah yang subur, gembur dan kaya akan humus serta tidak tergenang. Tanah subur di daerah pegunungan di mana curah hujan turun secara teratur, merupakan tanah yang paling cocok untuk tumbuhnya. Ketersediaan bahan organik terutama yang 19 mengandung banyak hara N dan K serta penggunaan jarak tanam optimum diperkirakan dapat menghasilkan daun dan minyak dalam jumlah yang tinggi (Emmyzar dan Herry, 2002). Untuk mendapatkan pertumbuhan yang baik diperlukan tempat yang lembab serta intensitas cahaya yang cukup karena akan berpengaruh terhadap kandungan minyak. Tanaman serai wangi sangat cocok ditanam di tempat terbuka (terlindung) dengan kisaran intensitas cahaya antara 75 - 100%. Curah hujan yang turun secara teratur selama pertumbuhan merupakan keharusan dalam pertumbuhan tanaman serai wangi, diperlukan rata-rata antara 2.500 – 4.000 mm per tahun dengan penyebaran 100 – 200 mm/bulan dengan suhu optimum 24 – 28oC, serta kelembaban di atas 75% (Emmyzar dan Herry, 2002). 2.3.5 Bawang Daun (Allium fistulosum) Bawang daun (Alium fistulosum) adalah salah satu jenis tanaman yang digolongkan ke dalam jenis sayuran daun karena berbentuk rumput dengan struktur tubuh yang terdiri dari akar, batang semu dan daun. Tanaman ini termasuk tanaman setahun atau semusim dengan bagian yang terpenting adalah daun-daun yang masih muda berwarna hijau dan batang semu yang berwarna putih (Dewi, 2000). Bawang daun mempunyai sifat yang mudah rusak, mudah layu, tidak tahan panas bahkan bisa mengalami pembusukan (Dewi, 2000). Bawang daun dapat ditanam baik di dataran rendah mapun dataran tinggi dengan ketinggian antara 250-1500 dpl, curah hujan yang tepat untuk perkembangan bawang daun yaitu berkisar antara 1.200-2000 mm/tahun dengan pH tanah yang netral (6,5-7,5), bawang daun akan terhambat apabila pH tanah terlalu asam atau terlalu basa. Oleh karena itu penanganan dengan cara tepat dengan pemberian FMA akan menghasilkan produk yang lebih baik dari tanaman sebelumnya. 20 BAB III BAHAN DAN METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Maret – September 2012 di Balai Penelitian Tanaman Rempah dan Obat (BALITTRO), Bogor. Penelitian teknik perbanyakan mikoriza dilakukan di rumah kaca, sedangkan untuk analisis populasi spora FMA dan persentase infeksi FMA pada akar tanaman inang dilakukan di Laboratorium Ekofisiologi. 3.2 Bahan dan Alat Bahan yang digunakan dalam penelitian ini antara lain: Inokulan tunggal FMA Gigaspora margarita yang didapat dari koleksi FMA BALITTRO, tanah, zeolit, pupuk kandang, pupuk kompos, benih tanaman sorgum, jagung, serai dapur, serai wangi, bawang daun, Hyponex rendah P, KOH 10%, HCl 1%, dan Lactofenol tryfan blue. Alat yang digunakan dalam penelitian ini antara lain: tong kompos, sekop, polybag ukuran 25x30 cm, penggaris, gunting, oven/aouto clave, kertas label, timbangan analitik, tabung reaksi, kertas saring, saringan bertingka, dan mikroskop binokuler. 3.3 Metode Penelitian 3.3.1 Pelaksanaan Penelitian A. Pesiapan Media Media tanam yang digunakan yaitu campuran tanah, pupuk kompos, pupuk kandang, dan zeolit sesuai dengan perlakuan, kemudian dimasukkan ke dalam polybag ukuran 30 x 25 cm dengan berat per polybag 3 kg. B. Pembibitan Sebelum ditanam pada media perlakuan, terlebih dahulu dilakukan pembibitan tanaman sorhum dan jagung agar diperoleh hasil yang lebih baik. Pembibitan dilakukan di wadah plastik dengan media tanah yang dicampur pupuk dan pasir dengan perbandingan 3:1:1 dengan berat masing-masing wadah adalah 21 100 gr. Setelah media tanam siap benih yang sudah dipilih ditaburkan ke dalam media tersebut bersamaan dengan inokulasi mikoriza dengan cara memasukan 40 gr inokulan FMA Gigaspora sp yang berjumlah ± 200 gr spora ke dalam lubang tanam. Gambar 11 Spora Tunggal Gigaspora margarita Foto oleh: Denis Prasetia (Perbesaran 400 x) Pada tanaman sorgum dan jagung, proses inokulasi FMA dilakukan dengan cara benih tanaman berupa biji tidak langsung diinokulasi pada media yang telah diberi FMA, tetapi benih disemai terlebih dahulu dalam wadah kecil selama 5 hari, setelah muncul akar barulah tanaman dipindahkan pada media yang telah diberi inokulan FMA. Perlakuan ini dilakukan untuk menyelaraskan dengan tanaman lainnya, mengingat ketiga tanaman lain yaitu serai dapur, serai wangi dan bawang daun diinokulasi pada masa benih telah muncul akar serabut. C. Pemindahan Tanaman Benih tanaman yang sudah tumbuh dipindahkan dari media pembibitan dan ditanam pada polybag perlakuan, kemudian dipilih dua tanaman yang sehat, pemilihan tanaman di pastikan benar-benar tanaman yang baik dan sehat. D. Pemeliharaan 1. Penyiraman Penyiraman dilakukan rutin tiga hari dalam seminggu (sore/pagi), terutama pada fase awal pertumbuhan dan keadaan cuacanya kering, disiram dengan menggunakan alat bantu gembor atau selang air. 22 2. Pemupukan Pemberian pupuk dilakukan seminggu sekali setelah tanaman berumur 2 minggu. Pupuk yang digunakan ialah pupuk Hyponex rendah P dengan konsentrasi 20 gr/10 L air. 3. Penyiangan Penyiangan dilakukan setiap 1 minggu sekali, dengan cara mencabuti gulma yang ada di dalam polibag. E. Panen Pemanenan dilakukan pada saat seluruh tanaman inang telah berumur ± 3 bulan, dengan melakukan pemotongan batang, perhitungan jumlah daun, pengukuran panjang akar, pengovenan tanaman, dll. 3.3.2 Parameter Penelitian A. Persentase Infeksi Akar (%) Penghitungan presentase infeksi akar dilakukan setelah panen. Akar di amati untuk mengetahui seberapa besar akar tanaman inang terinfeksi oleh FMA. Persentase infeksi mikoriza dihitung berdasarkan metode (Giovannetti et al, 1980 dalam Ana, 2003) dengan cara pengecatan (staining) dengan cara sebagai berikut: Tahap pertama Clearing (Penjernihan) yaitu dengan mencuci perakaran sampai bersih secara perlahan, kemudian akar dimasukkan ke dalam larutan KOH 10% lalu didihkan selama 10 menit dan dicuci dalam KOH 10% dingin, kemudian merendamnya dengan larutan HCl 1% selama 1 menit. Tahap kedua Staining (Pengecatan) adalah merendam potongan akar yang telah melalui tahap I dalam lactofenol trypan blue 0,05% selama 1-2 hari. Akar yang telah dicat diletakkan dipotong sepanjang 2 cm dan ditaruh pada gelas preparat kemudian diamati dengan menggunakan mikroskop binokular. Rumus jumlah derajat infeksi FMA adalah: Jumlah Akar yang Terinfeksi % Derajat Infeksi Mikoriza = x 100 % Jumlah Total Akar Tanaman 23 Kriteria kolonisasi menurut (Setiadi, 1992) No Jumlah Persentase (%) Kriteria 1 0–5 Sangat rendah 2 6 – 26 Rendah 3 26 – 50 Sedang 4 51- 75 Tinggi 5 75 - 100 Sangat tinggi B. Jumlah Spora Mikoriza per 50 gr Media Penghitungan jumlah spora diamati di akhir penelitian. Metode penghitungan yang dipakai adalah Metode Persimpangan Garis (The Gridline Intersection Method). Penyaringan spora dilakukan dengan menggunakan metode penyaringan basah yaitu dengan cara sampel diambil dari daerah perakaran kemudian dimasukkan ke dalam wadah baskom dan diberi air. Baskom yang telah berisi tanah sampel dan air diaduk dan disaring dengan saringan bertahap (Tahap I berukuan 0,45 mm, Tahap II 0,090 mm, dan Tahap ketiga 250 µm) kemudian hasil saringan disaring kembali dengan kertas saring yang diletakkan mengkerucut di mulut gelas ukur − hal ini bertujuan agar spora jamur menempel pada kertas saring. Setelah terbentuk lingkaran dan sampel telah selesai disaring maka spora siap untuk diamati di bawah mikroskop binokular. Metode ini dapat digunakan untuk penghitungan jamur FMA maupun ektomikoriza, perhitungan spora dihitung berdasarkan metode dan cara kerja (Brundrett, 1996 dalam Ana, 2003), perhitungan sebagai berikut: Jumlah Spora = Objek I + II + III + IV I IV II III C. Tinggi Tanaman (cm) Tinggi tanaman diukur dari pangkal batang sampai daun tertinggi pada tanaman inang dengan menggunakan penggaris. Pengukuran dilakukan stelah 24 tanaman berumur 1 bulan dan diukur 1 bulan sekali sampai panen. D. Jumlah Daun (helai) Jumlah daun dihitung pada setiap tanaman inang. Perhitungan dilakukan stelah tanaman berumur 3 bulan atau setelah masa panen. E. Bobot Segar Tanaman (kg) Pangamatan bobot segar tanaman (daun, batang dan akar) dilakukan dengan cara menimbang seluruh tanaman pada saat panen. F. Bobot Kering Tanaman (kg) Pengamatan bobot kering tanaman dilakukan pada saat panen dengan cara menimbang bobot kering tanaman sampel yang telah dikeringkan dalam oven dengan suhu 40°C selama 5 hari sampai berat tanaman konstan. G. Panjang Akar (cm) Pengukuran panjang akar akan dilakukan pada saat panen, akar diukur panjangnya dengan menggunakan penggaris dari bagian pangkal sampai ujung akar yang terdalam. H. Bobot Segar Akar (kg) Pengukuran berat segar akar dilakukan pada saat pemanenan. Pangkal akar dipotong kemudian ditimbang menggunakan timbangan (Sitompul et al, 1995). 3.3.3 Analisis Data Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) Pola Faktorial yang terdiri dari 2 faktor perlakuan dan 3 ulangan, yaitu: Faktor I: Media Steril (M) dengan 4 taraf perlakuan, yaitu: Ma: Media steril tanah : Pupuk Kandang (3:1) Mb: Media steril tanah : Pupuk kompos (3:1) Mc: Media steril tanah : Zeolit (3:1) Md: Zeolit saja 25 Faktor II: Tanaman Inang (T) dengan 5 taraf perlakuan, yaitu: T1: Tanaman Sorgum T2: Tanaman Jagung T3: Tanaman Serai dapur T4: Tanaman Serai wangi T5: Tanaman Bawang daun Sehingga diperoleh kombinasi perlakuan sebanyak 20 kombinasi, yaitu: MaT1 MbT1 McT1 MdT1 MaT2 MbT2 McT2 MdT2 MaT3 MbT3 McT3 MdT3 MaT4 MbT4 McT4 MdT4 MaT5 MbT5 McT5 MdT5 Jumlah ulangan: 3 Jumlah plot: 60 Jumlah tanaman/plot: 5 Jumlah seluruh tanaman: 300 Luas plot: 120 m2 Jarak antar plot: 0,5 m Data hasil penelitian dianalisis dengan sidik ragam dengan model linier sebagai berikut: Yijk =µ +i +j +k + () jk + Σijk Yijk = Hasil pengamatan blok ke-i, dengan perlakuan media steril pada taraf ke-j dan tanaman inang pada taraf ke-k. µ = Nilai tengah perlakuan I = Pengaruh blok ke-i j = Pengaruh media steril pada taraf ke-j k = Pengaruh tanaman inang pada taraf ke-k 26 () jk = Pengaruh interaksi antara media steril pada taraf ke-j dan tanaman inang pada taraf ke-k Σijk = Pengaruh galat percobaan blok ke-i yang mendapat perlakuan media steril ke-j dengan tanaman inang pada taraf ke-k Data hasil penelitian pada perlakuan yang berpengaruh nyata dilanjutkan dengan uji beda rataan yaitu uji Duncan dengan taraf uji 5 %. Menurut Gomez (1995) apabila terdapat salah satu faktor yang lebih dominan daripada faktor lain, maka tidak terdapat interaksi diantara keduanya. 27 BAB IV HASIL DAN PEMBAHASAN 4.1 Persentase Infeksi Akar (%) Agar mampu hidup di rizosfer, habitat yang kompetitif dan dinamis, FMA harus mampu memproduksi banyak propagul dalam bentuk hifa ekstraradikal dan spora. Spora berkecambah dengan membentuk apressoria sebagai alat infeksi, dan infeksi biasanya terjadi pada zona elongasi. Proses ini dipengaruhi oleh anatomi akar monokotil yang tidak memiliki cambium, sehingga akar mudah ditembus oleh hifa FMA dan umur tanaman yang terinfeksi (Haris dan Adnan, 2005). Dari ke-5 tanaman inang yang diamati FMA mampu menginfeksi akar tanaman pada 3 hari setelah inokulasi (HSI), hal ini dapat dilihat dari hasil pengamatan yang tercantum pada tabel 1: Tabel 1 Persentase Infeksi FMA pada Akar 5 Tanaman Inang Lama Inokulasi Persentase Infeksi Sampel Tanaman (Hari) (%) 3 6,30 5 25,34 Sorgum* 6 56,80 9 63,93 3 7,00 5 34,78 Jagung* 6 62,22 9 72,80 3 2,00 5 4,00 Serai Dapur 6 24,00 9 33,60 3 5,00 5 8,73 Serai Wangi 6 24,27 9 34,73 3 11,00 5 37,00 Bawang Daun 6 47,82 9 62,33 Ket: * Tanaman disemai terlebih dahulu selama 5 hari 28 Hasil pada tabel di atas menunjukkan bahwa seluruh tanaman inang pada umumnya telah terinfeksi oleh hifa FMA pada umur 3 hari, pada hari ke-5 jumlah infeksi FMA pada setiap tanaman inang mengalami peningkatan seiring bertambahnya waktu, tanaman jagung dan sorgum peningkatan infeksi FMA ditandai dengan terbentuknya arbuskular FMA. Sedangkan pada tanaman bawang daun arbuskular terbentuk setelah tanaman berumur 6 hari. Jumlah infeksi FMA pada tanaman jagung dan sorgum di hari ke-6 dapat dikatakan tinggi karena ketiga tanaman tersebut mempunyai jumlah persentase infeksi FMA lebih dari 50%, sedangkan serai dapur, serai wangi dan bawang daun tergolong sedang karena jumlah persentase infeksi FMA diantara 26-50%. Pada hari ke-9 organ vesikel mulai terbentuk pada tanaman sorgum, jagung, serai wangi, dan bawang daun, namun tidak terbentuk pada tanaman serai dapur. 80 Persentase Infeksi (%) 70 60 50 40 Sorgum 30 Jagung 20 Serai Dapur 10 Serai Wangi Bawang Daun 0 3 HSMI 5 HSMI 6 HSMI 9 HSMI Lama Hari Setelah Masa Inokulasi (HSMI) Gambar 7 Grafik Persentase Infeksi Akar 5 Tanaman Inang Gambar 7 menunjukkan bahwa seluruh sampel tanaman mengalami peningkatan jumlah persentase infeksi FMA setiap harinya dengan selisih yang berbeda-beda. Tanaman jagung merupakan tanaman inang yang baik bagi perkembangan hifa FMA dibanding dengan sampel tanaman lainnya. Hal ini terlihat dari meningkatnya grafik yang cukup tajam setelah tanaman terinfeksi hifa FMA pada umur 3 sampai 9 HSI, kemudian diikuti oleh tanaman sorgum, bawang 29 daun dan serai wangi, sedangkan serai dapur merupakan tanaman yang paling rendah peningkatan persentasi infeksi dibandingkan dengan tanaman lainnya. Gambar 8 Hifa FMA Umur 3 HSI (A) Sorgum,( B) Jagung, (C) Serai Dapur, (D) Serai Wangi, (E) Bawang Daun Foto oleh: Denis Prasetia Tanaman serai dapur dan serai wangi membutuhkan waktu yang lebih panjang untuk perkembangan hifa FMA hal ini terlihat pada grafik dan nilai infeksi FMA kurang dari 50%, karena persentase infeksi FMA dapat dikatakan baik apabila nilai persentase lebih dari 50%. Selain itu, pada tanaman serai dapur vesikel FMA masih belum terbentuk walaupun tanaman sudah berumur 9 HSI, hal ini mengindikasikan bahwa tanaman serai dapur kurang sesuai terhadap simbiosis FMA. Proses infeksi FMA pada akar tanaman biasanya diawali dengan perkecambahan spora di dalam tanah. Hifa yang tumbuh melakukan penetrasi ke dalam akar atau melalui celah antar sel epidermis dan berkembang di dalam korteks. Pada akar yang terinfeksi akan terbentuk arbuskul, vesikel intraseluler, 30 dan hifa internal di antara sel-sel korteks. Penetrasi hifa dan perkembangnnya biasanya terjadi pada bagian yang masih mengalami proses diferensiasi dan proses pertumbuhan tanpa merusak sel itu sendiri. Tingkat infeksi akar oleh mikoriza dikategorikan cukup tinggi apabila mencapai nilai rata-rata lebih dari 50 % (Prihastuti et al., 2010). Data pengamatan persentase infeksi setelah tanaman berumur 3 bulan setelah inokulasi dapat dilihat pada tebel lampiran 1, sedangkan daftar sidik ragam persentase infeksi akar dapat dilihat pada tabel lampiran 2. Sidik ragam menunjukkan hasil bahwa untuk perlakuan media tidak berpengaruh nyata terhadap persentase infeksi akar, sedangkan perlakuan jenis tanaman inang berpengaruh nyata terhadap persentase infeksi akar, interaksi antara keduanya berpengaruh tidak nyata terhadap persentase infeksi FMA di akar. Interaksi kedua perlakuan antara media tanam dan tanaman inang diperoleh hasil persentase infeksi terbesar terdapat pada kombinasi perlakuan tanaman jagung pada media zeolityaitu dengan taraf infeksi sebesar 96,92%, dan yang terendah terdapat pada kombinasi perlakuan serai dapur pada media Persentase Infeksi (%) campuran Tanah-Pukan sebesar 51,33%. 86 84 82 80 78 76 74 72 70 68 66 84.49 (b) 82 (b) 77.58 (ab) 73.31 (a) Tanah-pukan Tanah-kompos Tanah-zeolit Zeolit 100% Media Gambar 9 Histogram Persentase Infeksi FMA Akar Tanaman Inang pada Berbagai Perlakuan Media 31 Pada gambar 9 tampak bahwa persentase infeksi FMA tertinggi dihasilkan dari media Tanah-Zeolit sebesar 84,49%, diikuti oleh Zeolit 82,00%, dan Tanah-kompos 77,58%, dan persentase infeksi FMA terendah terdapat pada perlakuan Tanah-Pukan sebesar 73,31%. Perbedaan jumlah persentase infeksi diduga karena masing-masing media mempunyai kadar, struktur, dan karakteristik hara yang berbeda untuk mendukung perkembangan spora dan hifa FMA, sehingga didapat jumlah persentase infeksi FMA yang berbeda pula. Pada media tanah yang dicampur zeolit dengan perbandingan 3:1 menunjukkan jumlah infeksi FMA pada akar tanaman yang tertinggi dibandingkan dengan media lainnya. Hal ini diduga karena batuan zeolit dapat mengikat unsure hara yang berada pada tanah, sehingga ketersediaannya lebih baik. Secara umum batuan zeolit mempunyai kemampuan untuk menyerap dan menukar ion sehingga hara mikro ataupun makro terutama P yang terkandung di dalam tanah terserap ke dalam pori-pori zeolit dan mengakibatkan media yang didominasi oleh tanah mempunyai kandungan unsur P yang lebih rendah, sehingga keadaan ini dapat menyebabkan meningkatnya perkembangan hifa FMA, seperti yang dikemukakan Yadi (2012) yang menyatakan bahwa mikoriza Persentase Infeksi (%) akan berkembang dengan baik apabila dalam kondisi kurangnya unsur P. 100 90 80 70 60 50 40 30 20 10 0 95.23 (b) 70.91 (a) Sorgum Jagung 89.33 (b) 70.01 (a) 71.15 (a) S. dapur S. wangi Bawang daun Tanaman Gambar 10 Histogram Persentase Infeksi FMA Akar Tanaman Inang pada Berbagai Perlakuan Tanaman Inang 32 Pada gambar 10 tampak bahwa jumlah infeksi FMA tertinggi terdapat pada perakaran Jagung yaitu dengan rataan persentase sebesar 95,23%, diikuti oleh Bawang daun 89,33%, Serai wangi 71,15%, dan Sorgum 70,91%, dan yang terendah ditunjukkan perlakuan Serai dapur yaitu dengan persentase infeksi sebesar 70,01%. Tanaman jagung merupakan inang yang cukup baik untuk perkembangan hifa mikoriza, karena jagung mempunyai pertumbuhan yang relatif lebih cepat, daya adaptasi tinggi terutama di lahan kering, serta sistem perakaran yang banyak (Sofyan, 2005. Hal ini dapat dilihat dari hasil pengamatan pada gambar 10 yang menunjukkan bahwa tanaman jagung lebih dominan dibanding tanaman lainnya, hal ini dikarenakan tanaman jagung mempunyai perakaran yang cocok untuk berlangsungnya pertumbuhan mikoriza, selain itu pada area perakaran tanaman jagung memiliki keragaman jenis mikroba tanah yang melimpah dibanding tanaman lainnya, sehingga dalam kondisi ini mikoriza dapat bahu membahu dan saling bersimbiosis dalam melangsungkan kehidupannya, oleh karena itu pada perakaran tanaman jagung FMA dapat hidup dengan optimal. 4.2 Populasi Spora (per 50 gr media) Jumlah spora FMA akan berbeda tergantung dari substrat dan kepekan tanaman inang sebagai tempat hidupnya. FMA dapat membentuk resting spore dalam tanah, baik secara tunggal maupun dalam bentuk sporokarp. Spora mikoriza dapat terbentuk pada ujung hifa eksternal dengan ukuran bervariasi antara 100-600 µm tergantung pada jenisnya (Prihastuti et al., 2010). Dalam bentuk spora, mikoriza dapat mempertahankan kehidupannya untuk waktu yang cukup lama dan spora dapat berkecambah setelah kondisi lingkungan memungkinkan yang diawali dengan proses infeksi akar. Dalam penelitiannya Prihastuti et al., (2010) menyatakan bahwa FMA Gigaspora margarita dapat hidup dengan baik pada tanah ultisol dengan rentang pH antara 4,35 – 6,00. 33 Data pengamatan populasi spora setelah tanaman berumur 3 bulan, atau 3 bulan setelah inokulasi dapat dilihat pada tebel lampiran 4, sedangkan daftar sidik ragam populasi spora dapat dilihat pada tabel lampiran 5. Sidik ragam menunjukkan bahwa perlakuan beberapa jenis media tidak berpengaruh nyata terhadap populasi spora FMA, sedangkan faktor perlakuan beberapa jenis tanaman inang berpengaruh nyata terhadap populasi spora FMA, dan interaksi antara keduanya tidak berpengaruh nyata terhadap perkembangan populasi spora FMA. Data yang dihasilkan dengan pengujian uji berjarak Duncan mendapatkan populasi spora yang tidak berbeda nyata pada media Tanah-zeolit dengan media Tanah-Pukan dan Tanah-kompos, tetapi berbeda nyata dengan perlakuan Zeolit 100%. Pada perlakuan ketiga media tanam yaitu Tanah-Pukan, Tanah-kompos, dan Zeolit 100% menunjukkan jumlah spora yang tidak berbeda nyata satu sama lain. Perlakuan faktor tanaman inang menunjukkan bahwa jumlah spora pada tanaman jagung tidak berbeda nyata dengan bawang daun, akan tetapi berbeda nyata dengan tanaman sorgum, serai dapur, dan serai wangi. Pada perlakuan tanaman inang bawang daun menghasilkan jumlah spora yang berbeda nyata dengan perlakuan tanaman inang sorgum, serai dapur, dan serai wangi. Perlakuan tanamn inang sorgum tidak berbeda nyata dengan serai wangi tetapi berbeda nyata dengan serai dapur. Sedangkan jumlah spora perlakuan tanaman inang serai dapur tidak berbeda nyata dengan serai wangi. Tingkat infeksi akar oleh mikoriza yang terjadi tidak ditentukan oleh jumlah spora yang ada, tetapi lebih ditentukan oleh kemampuan mikoriza dan tanggap perakaran tanaman untuk berlangsungnya proses infeksi. Donahoe, et al. (1983) dalam Prihastuti et al., (2010) melaporkan bahwa tingkat infeksi akar oleh mikoriza ditentukan oleh tingkat kepekaan inang, iklim dan tanah. Dari kenyataan yang ada, dapat diambil kesimpulan, bahwa untuk mengaplikasikan formula mikoriza ke dalam tanah perlu dipertimbangkan kompatibelitas spesies mikoriza dengan tanaman inang pada proses infeksi akar, bukan hanya sekadar pertimbangan jumlah spora mikoriza yang diberikan. 34 1400 1165.33ab Jumlah Populasi 1200 1309.8b 1229.67ab 1090.13a 1000 800 600 400 200 0 Tanah-pukan Tanah-kompos Tanah-zeolit Zeolit 100% Media Gambar 11 Histogram Populasi Spora pada Berbagai Perlakuan Media Data yang ditunjukkan oleh Gambar 11 diketahui bahwa media tanam Tanah-zeolit adalah media yang paling banyak mengandung populasi spora FMA tertinggi dengan jumlah rata-rata sebesar 1.309,80 spora, diikuti oleh Tanahkompos 1.229,67 spora, Tanah-Pukan 1165,33 spora, dan yang terendah adalah media Zeolit 100% dengan jumlah populasi spora sebesar 1.090,13 spora. Sebaran keberadaan mikoriza sangat luas namun perbedaan jenis substrat dan tanaman inang akan mempengaruhi dan menentukan tingkat kemelimpahannya, pemikiran ini didukung dari hasil pengamatan yang ditunjukkan oleh histogram di atas, bahwa tiap substrat memiliki tingkat populasi spora yang berbeda. Pada hasil pengamatan tersebut menunjukkan jumlah spora akan meningkat apabila spora FMA diinokulasi dengan media Tanah-zeolit, dan akan menurun tingkat populasinya apabila diinokulasi dengan media Tanah-kompo, Tanah-Pukan, dan Zeolit 100%. Kadar pH dalam media pun akan menentukan tingkat sporulasi FMA, FMA jenis Gigaspora akan hidup dengan baik pada rentang pH netral sampai sedikit asam, walaupun ada sebagian jenis mikoriza yang dapat bertahan hidup dalam kondisi sedikit basa dikarenakan tanah terlalu banyak mengandung logam alkali akibat dari aktivitas pertambangan. 35 1800 1599.33c 1600 1430.83c Jumlah Populasi 1400 1200 1132.42b 1087.5b 1000 743.58a 800 600 400 200 0 Sorgum Jagung Serai dapur Serai wangi Bawang daun Tanaman Inang Gambar 12 Histogram Populasi Spora pada Berbagai Perlakuan Tanaman Inang Histogram di atas menunjukkan bahwa populasi spora FMA tertinggi terdapat pada tanaman inang jagung yaitu dengan rataan jumlah populasi sebesar 1.599,33 spora, diikuti oleh bawang daun 1.430,83 spora, sorgum 1.132,42 spora, dan serai wangi 1.087,50 spora, dan yang terendah ditunjukkan oleh serai dapur yaitu dengan jumlah populasi spora sebesar 743,58 spora. Tanaman inang jagung selalu menunjukkan hasil yang positif baik itu persentase infeksi maupun pada tingkat jumlah populasi spora FMA. Hal ini dapat disebabkan karena kadar karbohidrat akar yang umumnya relatif tinggi sehingga jumlah eksudat akar berupa gula tereduksi dan asam-asam amino meningkat, hal ini sesuai dengan pernyataan Hetrick (1984) dalam Yuni (1995) yang menyatakan bahwa eksudat akar sebagai pemicu perkecambahan spora terutama senyawa flavonoid dari jenis flavonol yang berfungsi memicu pertumbuhan hifa FMA. Perbedaan jenis eksudat akar yang diekskresikan oleh masing-masing tanaman diduga dapat mempengaruhi jumlah spora. Bawang daun menunjukkan hasil yang cukup baik setelah jagung, hal ini menunjukkan bahwa tanaman bawang daun merupakan tanaman yang cukup kompatibel untuk inang FMA. Tanaman inang sorgum berada pada tingkat ketiga dalam hal perkembangan jumlah spora hal ini berbanding negatif bila dilihat dari tingkat 36 infeksi akar oleh hifa FMA, tingkat infeksi FMA pada perakaran tanaman sorgum masih dapat dikatakan rendah bila dibandingkan dengan perakaran tanaman jagung, bawang daun dan serai wangi. Kondisi ini mungkin dikarenakan kurang tepatnya antara tanaman inang dengan jenis FMA yang diinokulasikan, sedangkan pada penelitian Candra, (2011) menyatakan bahwa tanaman sorgum sangat cocok untuk perkembangan mikoriza jenis Glomus sp. Untuk tanaman serai wangi dan serai dapur sebagai tanaman inang menunjukkan hasil perkembangan jumlah spora yang terendah bila dibandingkan dengan ketiga tanaman sampel lainnya. Kemungkinan karena kurang cocoknya antara tanaman dengan jenis FMA, sehingga menyebabkan tingkat infeksi dan jumlah spora menjadi relatif rendah. Tanaman inang sorgum. agung, serai dapur, dan serai wangi yang ditumbuhkan pada media Tanah-zeolit menghasilkan jumlah populasi spora yang optimum, dan jumlah populasi spora menurun bila ditanam pada media zeolit 100%. Sedanghkan tanaman inang bawang daun bermikoriza yang tunbuh pada media zeolit 100%menghasilkan jumlah spora FMA yang optimum, dan jumlah populasi spora menurun bila ditanam pada media Tanah-Zeolit. Hal ini mengindikasikan bahwa tidak semua tanaman akan menunjukkan jumlah spora yang optimum bila dikombinasikan dengan media Tanah-zeolit, dalam kondisi ini dapat dikatakan bahwa setiap FMA mempunyai sifat spesifik dalam hal pemilihan antara media dengan tanaman inangnya. 4.3 Tinggi Tanaman dan Pertambahan Tinggi Tanaman (cm) A. Tinggi Tanaman 1 Bulan Setelah Inokulasi (BSI) Data pengamatan tinggi tanaman 1 BSI dapat dilihat pada tabel lampiran 7, sedangkan daftar sidik ragamtinggi tanaman 1 BSI dapat dilihat pada tabel lampiran 8. Sidik ragam menunjukkan bahwa perlakuan jenis tanaman inang dengan inokulasi FMA 40 gram tidak berpengaruh nyata terhadap tinggi tanaman, sedangkan perlakuan jenis tanaman inang dan interaksi antara jenis media tanam dengan tanaman inang menunjukkan pengaruh yang nyata terhadap tinggi tanaman. 37 Pengaruh media yang mengandung 40 gram FMA terhadap tinggi tanaman 1 BSI bila dilihat dari uji berjarak Duncan didapat hasil bahwa media tanam Tanah-kompos tidak berbeda nyata dengan Tanah-Pukan dan Tanah-zeolit, namun berbeda nyata terhadap Zeolit 100%. Pengaruh interaksi antara ketiga perlakuan media Tanah-Pukan, Tanah-kompos dan Zeolit 100% terhadap tinggi tanaman 1 BSI tidak berbeda nyata. Perlakuan media tanam bermikoriza yang menghasilkan tinggi tanaman tertinggi terdapat pada media Tanah-kompos, yaitu dengan rata-rata tinggi tinggi tanaman sebesar 66,67 cm, diikuti oleh Tanah-zeolit 64,49 cm, Tanah-Pukan64,29 cm, dan terendah pada media Zeolit 100% sebesar Tinggi Tanaman (cm) 61,35 cm. 68 67 66 65 64 63 62 61 60 59 58 66.67b 64.49ab 64.29ab 61.35a Tanah-pukan Tanah-kompos Tanah-zeolit Zeolit 100% Media Gambar 13 Histogram Tinggi Tanaman 1 Bulan Setelah Inokulasi B. Pertambahan Tinggi Tanaman 2 Bulan Setelah Inokulasi (BSI) Data pengamatan tinggi tanaman 2 BSI dapat dilihat pada tabel lampiran 10, sedangkan daftar sidik ragamtinggi tanaman 2 BSI dapat dilihat pada tabel lampiran 11. Sidik ragam menunjukkan bahwa perlakuan jenis tanaman inang dengan inokulasi FMA 40 gram tidak berpengaruh nyata terhadap tinggi tanaman, sedangkan perlakuan jenis tanaman inang berpengaruh nyata, dan interaksi antara jenis media tanam dengan tanaman inang menunjukkan ptidak berpengaruh nyata terhadap tinggi tanaman. 38 30 Tinggi Tanaman (cm) 25.46a 25 22.67a 20.52a 21.16a 20 15 10 5 0 Tanah-pukan Tanah-kompos Tanah-zeolit Media Zeolit 100% Gambar 14 Histogram Tinggi Tanaman 2 BSI Dilihat dari Uji berjarak Duncan, pengaruh faktor media terhadap pertambahan tinggi tnaman umur 2 BSI yang diinokulasi dengan 40 gram FMA, bahwa semua perlakuan menunjukkan hasil tidak berbeda nyata antar tiap perlakuan. Perlakuan media tanam bermikoriza yang menghasilkan tinggi tanaman tertinggi terdapat pada media Tanah-Pukan sebesar 89,75 cm, diikuti oleh Tanahkompos 87,19 cm, Tanah-zeolit 87,16 cm, dan terendah terdapat pada media Zeolit 100% sebesar 82,51 cm. C. Pertambahan Tinggi Tanaman 3 Bulan Setelah Inokulasi (BSI) Data pengamatan pertambahan tinggi tanaman 3 BSI dapat dilihat pada tabel lampiran 13, sedangkan daftar sidik ragam tinggi tanaman 3 BSI dapat dilihat pada tabel lampiran 14. Sidik ragam pada lampiran 14 menunjukkan bahwa perlakuan jenis tanaman inang dengan inokulasi FMA 40 gram tidak berpengaruh nyata terhadap tinggi tanaman, sedangkan perlakuan jenis tanaman inang berpengaruh nyata, dan interaksi antara jenis media tanam dengan tanaman inang menunjukkan tidak berpengaruh nyata terhadap tinggi tanaman. Jika dilihat perbandingan antara Gambar 9 dengan Gambar 15 begitu pula Gambar 11 dengan Gambar 15 bahwa tidak semua perlakuan yang memiliki persentase infeksi yang tinggi dan jumlah populasi spora FMA yang melimpah 39 menunjukkan hasil yang lebih tinggi pada tinggi tanaman 3 BSI dibanding dengan perlakuan yang memiliki persentase infeksi dan jumlah populasi spora yang lebih sedikit. Kondisi ini menurut Irdika (2012) bahwa kolonisasi FMA yang tinggi tidak selalu diikuti dengan pertumbuhan tanaman inang yang lebih baik. Hal ini dapat terjadi karena kolonisasi hanyalah indikator keberadaan FMA dalam akar saja. Organ FMA yang berfungsi untuk menyerap air dan unsur hara adalah Tinggi Tanaman (cm) hifa eksternal. 37 36 35 34 33 32 31 30 29 28 35.77a 32.37a 32.34a 31.01a Tanah-pukan Tanah-kompos Tanah-zeolit Media Zeolit 100% Gambar 15 Histogram Pertambahan Tinggi Tanaman 3 Bulan Setelah Inokulasi Perlakuan media tanam bermikoriza yang menghasilkan tinggi tanaman tertinggi terdapat pada media Tanah-Pukan sebesar 100,06 cm diikutui Tanahkompos 97,68 cm, Tanah-zeolit 96,86 cm dan terendah terdapat pada media Zeolit 100% sebesar 82,51 cm, dan tidak terdapat interaksi anatar semua perlakuan. Data yang ditunjukkan oleh Gambar 13, 14, dan 15 menunjukkan bahwa media yang memiliki bahan organik cukup tinggi Tanah-Pukan dan Tanahkompos menghasilkan tinggi tanaman yang baik, sedangkan media Zeolit 100% selalu menunjukkan hasil terendah. Hal ini dikarenakan hifa eksternal FMA tumbuh baik pada media yang memiliki kadar bahan organik yang cukup tinggi akan membantu penyerapan hara P untuk disalurkan ke jaringan tumbuhan. FMA mampu meningkatkan tinggi tanaman karena tanaman yang terinfeksi FMA mengalami peningkatan dalam kemampuanya menyerap unsur hara yang dibutuhkan, sehingga metabolisme untuk pertumbuhan dapat berjalan 40 dengan baik dan tanaman tidak mengalami hambatan pada fase vegetatif menuju fase generetif. Mengacu pada beberapa literatur seperti Jakobsen (1992) dalam Hapsoh (2008) yang mengatakan bahwa FMA membantu meningkatkan penyerapan air dan unsur hara terutama P, pembentukan vitamin dan beberapa zat pengatur tumbuh seperti sitokinin dan giberelin (Khairul, 2001), meningkatkan produksi hormon auksin (Shubasini dan Natarajan, 1997 dalam Hapsoh, 2008), berperan sinergis dengan keberadaan bakteri penambat N (Azcon dan Al-Atrash, 1997) dan pelarut fosfat, menjamin terselanggaranya proses biogeokemis (Nuhamara, 1994 dalam Musfal, 2010), serta dapat mengeluarkan enzim fosfatase yang mampu melepaskan P dari ikatan-ikatan spesifik sehingga tersedia bagi tanaman. FMA mampu meningkatkan penyerapan P pada tanaman sehingga mengakibatkan tanaman yang terinfeksi FMA mampu menyerap P dengan sangat baik dan akibatnya pertumbuhan tanaman menjadi meningkat, menurut Rosmarkam dan Yuwono (2006) fungsi penting P pada tanaman yaitu membantu proses fotosintesis, respirasi, transfer unsur hara, penyimpanan energi, pembelahan dan perbesaran sel, sehingga tumbuhan yang mempunyai suplai P lebih tinggi akan mengakibatkan tanaman tersebut tumbuh lebih baik. 4.4 Jumlah Daun Umur 3 Bulan Setelah Inokulasi (helai) Data pengamatan jumlah daun umur 3 BSI dapat dilihat pada tabel lampiran 16, sedangkan daftar sidik ragam jumlah daun umur 3 BSMI dapat dilihat pada tabel lampiran 17. Sidik ragam pada lampiran 17 menunjukkan perlakuan media dengan inokulasi mikoriza 40 gram tidak berpengaruh nyata terhadap jumlah daun, sedangkan faktor tanaman berpengaruh nyata, serta interaksi antara media dengan tanaman menunjukkan tidak berpengaruh terhadap jumlah daun. Pengujian berjarak Duncan dengan taraf uji 5% faktor media dengan pemberian FMA 40 gr terhadap jumlah daun antara media Tanah-Pukan, Tanahkompos, Tanah-zeolit, dan Zeolit 100% menunjukkan hasil tidak berbeda nyata antar semua perlakuan. 41 Jumlah Daun (Helai) 15.8a 15.68a 16 15.5 15 14.5 14.08a 14 13.48a 13.5 13 12.5 12 Tanah-pukan Tanah-kompos Tanah-zeolit Zeolit 100% Media Gambar 16 Histogram Jumlah Daun Umur 3 BSI Perlakuan media tanam bermikoriza yang menghasilkan jumlah daun terbanyak yaitu pada media Zeolit 100% yaitu 15,8 helai daun, diikuti Tanahkompos 15,68 helai daun, Tanah-Pukan 14,08 helai daun, dan yang terendah terdapat pada media Tanah-zeolit sejumlah 13,48 helai daun. Hal ini berbanding terbalik dengan tingkat persentase infeksi akar dan jumlah populasi spora FMA yang menunjukkan bahwa media Tanah-zeolit adalah media terbaik dalam hal tersebut, hal ini menguatkan pernyataan Irdika, (2012) yang menyatakan bahwa besarnya jumlah koloni dan populasi spora FMA tidak menjamin akan mempengaruhi besarnya kualitas tanaman, karena hifa eksternal lah yang sesungguhnya membantu penyerapan hara ke dalam jaringan tanaman. 4.5 Bobot Segar Tanaman (gram) Data pengamatan bobot segar tanaman dapat dilihat pada tabel lampiran 19, sedangkan daftar sidik ragam bobot segar tanaman dapat dilihat pada tabel lampiran 20. Sidik ragam menunjukkan bahwa untuk perlakuan media bermikoriza tidak berpengaruh nyata terhadap bobot segar tanaman, sedangkan faktor tanaman berpengaruh nyata, serta interaksi antara media dengan tanaman menunjukkan berpengaruh tidak nyata terhadap bobot segar tanaman. Pengujian berjarak Duncan dengan taraf uji 5% factor beberapa jenis media bermikoriza terhadap bobot segar tanaman antara media Tanah-Pukan, 42 Tanah-kompos, Tanah-zeolit, dan Zeolit 100% menunjukkan hasil tidak berbeda nyata antar sesama perlakuan. Bobot basah tanaman (gr) 76 74.28a 74.05a 74 71.91a 72 70 68 67.13a 66 64 62 Tanah-pukan Tanah-kompos Tanah-zeolit Zeolit Media Gambar 17 Histogram Bobot Segar Tanaman Perlakuan media tanam bermikoriza yang menghasilkan bobot segar tertinggi yaitu pada media Tanah-kompos yaitu 74,28 gr, diikuti Zeolit 100% yaitu 74,05 gr, Tanah-zeolit 71,91 gr, dan yang terendah terdapat pada media Tanah-Pukan yaitu 67,13 gr. Tanaman memberikan respon yang tinggi terhadap berat basah tanaman apabila dikombinasikan dengan media pupuk kompos, hal ini terjadi karena pada media yang diberi pupuk kompos telah tersedia bahan-bahan organic yang telah diuraikan oleh mikroba dan telah tersedia bagi tanaman. Hal ini diduga karena tanaman yang terinfeksi oleh FMA memiliki kemampuan mengambil P dan nutrien lain seperti N, K, dan Mg pada zona penipisan nutrien disekitar akar, selain itu adanya asosiasi mikoriza ini dapat membantu tanaman dalam pengambilan air dan hara lain untuk proses pertumbuhan dan perkembangan (Candra, 2011). Infeksi mikoriza diketahui dapat meningkatkan pertumbuhan dan bobot tanaman karena adanya peningkatan dalam pengambilan nutrien. Sitrianingsih, (2010) melaporkan bahwa pengambilan nitrogen, fospor, dan potasium dibatasi oleh tingkat difusi dari masing-masing nutrien di dalam tanah. Namun dengan adanya FMA dapat meningkatkan pengambilan nutrien melalui difusi nutrien dari dalam tanah ke akar karena bidang penyerapan oleh hifa FMA yang lebih luas, 43 sehingga pertumbuhan tanaman yang diinokulasi FMA akan lebih baik daripada tanaman yang tidak diinokulasi FMA. 4.6 Bobot Kering Tanaman (gram) Data pengamatan bobot kering tanaman dapat dilihat pada tabel lampiran 22, sedangkan daftar sidik ragam bobot segar tanaman dapat dilihat pada tabel lampiran 23. Sidik ragam pada lampiran 23menunjukkan bahwa untuk perlakuan media bermikoriza tidak berpengaruh nyata terhadap bobot kering tanaman, sedangkan faktor tanaman berpengaruh nyata, serta interaksi antara media dengan tanaman menunjukkan berpengaruh tidak nyata terhadap bobot kering tanaman. Pengujian berjarak Duncan dengan taraf uji 5% faktor beberapa jenis media bermikoriza terhadap bobot kering tanaman antara media Tanah-kompos dengan Tanah-Pukan, Tanah-zeolit, menunjukkan tidak berbeda nyata, namun dengan Zeolit 100% berbeda nyata. Sedangkan ketiga media antara Tanah-Pukan, Tanah-zeolit, dan Zeolit 100% menunjukkan tidak berbeda nyata. Bobot Kering (gr) 25 20 22.67b 19.02ab 18.91ab 17.23a 15 10 5 0 Tanah-pukan Tanah-kompos Tanah-zeolit Media Zeolit 100% Gambar 18 Histogram Bobot Kering Tanaman Perlakuan media tanam bermikoriza yang menghasilkan bobot kering tanaman tertinggi yaitu pada media Tanah-kompos yaitu 22,67 gr, diikuti TanahPukan yaitu 19,02 gr, Tanah-zeolit 18,91 gr, dan yang terendah terdapat pada media Zeolit 100% yaitu 17,23 gr. Bobot kering brangkasan yang tinggi dapat diperoleh bila tanaman tumbuh dan berkembang dengan normal dan optimal. Dwidjoseputro, (1994) 44 dalam Candra, (2011) berpendapat bahwa pertumbuhan tanaman ditunjukkan oleh bertambahnya ukuran dan bobot kering tanaman yang dicerminkan dengan bertambahnya protoplasma yang terjadi karena bertambahnya ukuran sel. 4.7 Bobot Segar Akar (gram) Data pengamatan bobot segar akar dapat dilihat pada tabel lampiran 25, sedangkan daftar sidik ragam bobot segar tanaman dapat dilihat pada tabel lampiran 26. Sidik ragam pada lampiran 26 menunjukkan bahwa untuk perlakuan media bermikoriza tidak berpengaruh nyata terhadap bobot segar akar, sedangkan faktor tanaman berpengaruh nyata, serta interaksi antara media dengan tanaman menunjukkan berpengaruh tidak nyata terhadap bobot segar akar tanaman. Pengujian berjarak Duncan dengan taraf uji 5% faktor beberapa jenis media bermikoriza terhadap bobot segar akar tanaman inang antara media Tanahkompos dengan Tanah-Pukan berbeda nyata, namun tidak berbeda nyata dengan Tanah-zeolit dan Zeolit 100% . Sedangkan ketiga media antara Tanah-Pukan, Tanah-zeolit, dan Zeolit 100% menunjukkan tidak berbeda nyata. Respon tanaman sorgum, jagung, dan serai wangi sangat baik terhadap bobot segar akar pada media Mb yaitu media tanah yanag dicampur dengan pupuk kompos dengan perbandingan 3:1, hal ini dikarenakn pada saat kompos ditambahkan ke dalam tanah maka tidak hanya jutaan mikroorganisme yang ditambahkan, akan tetapi mikroorganisme yang ada di dalam tanah pun ikut terpacu untuk berkembnag, proses dekomposisi lanjut oleh mikroorganisme akan tetap terus berlangsung, tetapi tidak akan mengganggu perakaran tanaman. Gas CO2 yang dihasilkan pada proses dekomposisi akan dipergunakan tanaman untuk fotosintesis sehingga pertumbuhan tanaman akan lebih cepat sehingga FMA terpacu dalam penyerapan hara yang melimpah dan mengakibatkan bertambahnya suplai nutrisi pada tanaman sehingga menyebabkan bobot perakaran pun menjadi lebih besar (Setyorini et al., 2007). 45 9 8,00b Bobot Segar akar (gr) 8 6.80ab 6.65ab Tanah-zeolit Zeolit 100% 7 6 5.62a 5 4 3 2 1 0 Tanah-pukan Tanah-kompos Media Gambar 19 Histogram Bobot Segar Akar Perlakuan media tanam bermikoriza yang menghasilkan bobot segar akar tertinggi pada media Tanah-kompos yaitu 8,00 gr, diikuti Tanah-zeolit yaitu 6,80 gr gr, Zeolit 100% yaitu 6,65 gr, dan yang terendah terdapat pada media TanahPukan yaitu 5,62 gr. Semakin tinggi biomassa akar maka semakin berat pula berat segar akar (Kung’u, 2008). Selama penelitian Kung’u (2008) tentang hubungan antara pertumbuhan tanaman dengan peningkatan densitas inokulum FMA, dilaporkan bahwa peningkatan kolonisasi FMA menyebabkan peningkatan berat segar akar. Hal ini dikarenakan karena tanaman yang berasosiasi dengan FMA dapat mentranslokasikan karbon ke dalam akar lebih tinggi dibandingkan dengan tanaman yang tidak bermikoriza. 4.8 Panjang Akar (cm) Data pengamatan panjang akar tertera pada tabel lampiran 28, sedangkan daftar sidik ragam panjang tanaman dapat dilihat pada tabel lampiran 29. Sidik ragam pada lampiran 29 menunjukkan bahwa untuk perlakuan media bermikoriza tidak berpengaruh nyata terhadap panjang akar, sedangkan faktor tanaman berpengaruh nyata, serta interaksi antara media dengan tanaman menunjukkan berpengaruh tidak nyata terhadap panjang akar tanaman. Pengujian berjarak Duncan dengan taraf uji 5% faktor beberapa jenis media bermikoriza terhadap bobot segar akar tanaman inang antara media Tanahkompos dengan Tanah-Pukan berbeda nyata, namun tidak berbeda nyata dengan 46 Tanah-zeolit dan Zeolit 100% . Sedangkan ketiga media antara Tanah-Pukan, Panjang akar (cm0 Tanah-zeolit, dan Zeolit 100% menunjukkan tidak berbeda nyata. 50 45 40 35 30 25 20 15 10 5 0 43.69b 35.85a Tanah-pukan 39.30ab Tanah-kompos Tanah-zeolit 39.89ab Zeolit 100% Media Gambar 20 Histogram Panjang Akar Perlakuan media tanam bermikoriza yang menghasilkan panjang akar tertinggi pada media Tanah-zeolit yaitu 43,69 cm, diikuti Zeolit 100% yaitu 39,89 cm, Tanah-kompos yaitu 39,30 cm, dan yang terendah terdapat pada media Tanah-Pukan yaitu 35,85 cm. Jika dilihat perbandingan histogram pada Gambar 20 dan Gambar 9 dapat disimpulkan bahwa panjang akar pada perlakuan media berbanding lurus dengan jumlah persentase akar dan populasi spora FMA. Semakin tinggi persentase infeksi dan jumlah populasi FMA maka semakin tinggi pula panjang akar. Hal ini diduga Kolonisasi FMA dapat mengubah morfologi akar sedemikian rupa, misalnya dengan menginduksi hipertrofi akar, sehingga mengakibatkan rangsangan tumbuhnya rambut-rambut akar menjadi lebih cepat, diduga pula bahwa akar tanaman yang memiliki persentase infeksi akar yang tinggi akan lebih lebih banyak mensekresikan hormone rizokalin dibanding dengan yang tidak terinfeksi FMA sama sekali sehingga dengan demikian luas dan volume permukaan akar menjadi lebih besar. 47 BAB V SIMPULAN DAN SARAN 5.1 Simpulan Persentase infeksi FMA pada akar tertinggi terdapat pada perlakuan media Tanah-zeolit sebesar 84.49%. Perlakaun tanaman inang terdapat pada tanaman jagung sebesar 95.23%, dan kombinasi perlakuan tertinggi yaitu tanaman inang jagung yang ditanam pada media Zeolit 100% sebesar 96.92%. Perlakuan tanaman inang berpengaruh nyata terhadap persentase infeksi dan populasi spora FMA, sedangkan perlakuan media bermikoriza tidak berpengaruh nyata terhadap persentase dan populasi spora FMA. Tingginya tingkat infeksi dan jumlah populasi spora FMA tidak selalu diikuti dengan tingginya parameter pertumbuhan tanaman, namun berpengaruh terhadap parameter panjang akar. FMA Gigaspora sp mempunyai sifat spesifik terhadap media dan tanaman inangnya. 5.2 Saran Untuk mendapatkan hasil yang optimal dalam hal perbanyakan FMA, dianjurkan menggunakan tanaman jagung sebagai inangnya, hal ini dikarenakan tanaman jagung mempunyai nilai persentase infeksi dan jumlah populasi spora yang selalu tinggi dalam berbagai media tanam. 48 DAFTAR PUSTAKA __________. 2006. The Use of Mycorrhizae in Native Plant Production. University of Washington. USA. Abdurahman dan Budi Hartono. 2004. Penyaringan Air Tanah dengan Zeolit Alami untuk Menurunkan Kadar Besi dan Mangan. Jurnal Kesehatan Lingkungan. Vol. 8. No. 1. Akil M. dan Hadjah A. Dahlan. 2011. Budidaya Jagung dan Diseminasi. Teknologi. Balai Penelitian Tanaman Serelia. Maros. Aldeman, J. M., and J. B. Morton. 2006. Infectivity of Vesicular Arbuscular Mychorrizal Fungi Influence Host Soil Diluent Combination on MPN Estimates and Percentage Colonization. Journal of Soil Biolchen. 8(1) : 77-83. Ana Feronika. 2003. Mikoriza: Peran, Prospek dan Kendalanya. Fitopatologi Program Pasca Sarjana Fakultas Pertanian. Universitas Gadjah Mada. Yogyakarta. Azcon, R. and F. El-Atrash, 2007. Influence of arbuscular mycorrhizae and phosphorus fertilization on growth, nodulation an N2 fixation (15N) in Medicago sativa at four salinity level. Biol. Fertil. Soils 24: 81-86. Bahtiar, A.F. Fadhly, M. Rauf, A. Njamuddin, Margaretha, dkk., 2005. Studi karakterisasi sistem produksi serta persepsi dan sikap pengguna teknologi se/realia. Laporan Akhir. Balai Penelitian Tanaman Serealia. Maros. Bayu Widayasa. 2010. Teknologi Pupuk dan Pemupukan Pupuk Hayati Mikoriza. Universitas Brawijaya. Malang. Bell, R. G., 2001, What are zeolites? URL: http://www.bza.org/zeolites.html. Brundrett MC. 2009. Mycorrhizal Associations and Other Means of Nutrition of Vascular Plants: Understanding the Global Diversity of Host Plants by Resolving Conflicting Information and Developing Reliable Means of Diagnosis. Journal Plant Soil. 320. Hal. 37–77. Cameron DD. 2010. Arbuscular Mycorrhizal Fungi as (Agro) Ecosystem Engineers. Journal Plant Soil 333:1–5. Candra Maranata J. 2011. Pengaruh Pemberian Mikoriza Vesikular Arbuskular (VMA) dan Berbagai Dosis Pupuk Kompos Terhadap Pertumbuhan dan Hasil Tanaman Sorgum (Sorghum bicolor (L) Moench). Tesis. Universitas Pembangunan Nasional “Veteran”. Yogyakarta. 49 Dalimartha, Setiawan. 1999. Atlas Tumbuhan Obat Indonesia. Ungaran : Trubus Agriwidya. Delvian. 2006. Koleksi Isolat Cendawan Mikoriza Arbuskula Asal Hutan Pantai. Jurnal Pertanian. Universitas Sumatra Utara. Medan Dewi Nuruliana Hidayati. 2000. Analisis Pemasaran Bawang Daun (Alium fistulosum) Studi Kasus Desa Suka Mulya, Kecamatan Cibadak, Kabupaten Sukabumi, Profinsi Jawa Barat. Tesis. IPB. Bogor. Dwikarsa A.R, Gitandra Wiradani, dan Nugraha Pratomo A. 2007. Pembuatan Absorben dari Zeolit Alamdengan Karakteristik ‘Arbsorption Properties’ untuk Kemurnian Bioetanol. ITB. Bandung. Elmyzar dan Herry Muhammad. 2002. Budidaya Tanaman Serai Wangi. Balai Penelitian Tanaman Obat dan Aromatik (BALITTRO). Bogor. Eva Handayani. 2008. Respon Pertumbuhan dan Produksi Jagung (Zea mays) Terhadap Pemberian Fungi Mikoriza Arbuskular (FMA) dan Perbedaan Waktu Tanam. Tesis. Universitas Sumatra Utara. Medan Gomes, K.A dan A.A Gomes. 1995. Prosedur Statistik untuk Penelitian Pertanian. Edisi Ke-2. UI-Press. Jakarta. Hapsoh. 2008. Pemanfaatan Fungi Mikoriza Arbuskula Pada Budidaya Kedelai Di Lahan Kering. Pidato Pengukuhan Jabatan Guru Besar Tetap dalam Bidang Ilmu Budidaya Pertanian. Fakultas Pertanian Universitas Sumatera Utara Haris Talanca, A, dan A.M Adnan. 2005. Mikoriza dan Manfaatnya pada Tanaman. Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI&PFI. Sulawesi Selatan. Harran, S. Dan Ansori, N. 2003. Bioteknologi Pertanian 2. Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Bogor. Irdika Mansur. 2012. Penguasaan Teknik-teknik Bekerja dengan Mikoriza untuk Menghasilkan Penelitian dan Produk Mikoriza yang Berkualitas. Departemen Silvikultur Fakultas Kehutanan IPB. Bogor. Khairul, U., 2001. Pemanfaatan Bioteknologi Untuk Meningkatkan Produksi Pertanian. Http://tumotow. Net/s_send1_012?u_khairul.htm (Diakses September 2012) 50 Koba Koffi, Sanda Comla, Guyon Catherine, dkk., 2009. In Vitro Cytotoxic Activity of Cymbopogon citrates L. and Cymbopogon nardus L. essential oils from Togo. Journal of Bangladesh Pharmacological Society (BDPS). Bangladesh. Kung'u, J. B. 2008. Effect of vesicular-Arbuscular Mycorrizha (VAM) Innoculation on Growth Performance of Senna spectabilis. School of Pure and Apllied Sciences, Kenyatta University. Lud Waluyo. 2007. Mikrobiologi Lingkungan. UMM Press. Malang. 263-266 Margarettha dan Itang Ahmad Mahbub. 2008. Aplikasi Teknologi Cendawan Mikoriza sebagai Pupuk Hayati pada Usaha Tani Jagung di Desa Solok Kecamatan Kepuh Ulu Kabupaten Muaro, Jambi. Jurnal Pengabdian Masyarakat. No. 46. Menge, J.A. 2004. Inoculum Production VA Mycorrhiza. Florida. CRC Press. Hal. 187-203. Moenandir, H.J., Widaryanto, E., & Poejantoro. 2008. Periode Kritis Tanaman Kedelai karena Ada Persaingan dengan Gulma. Jurnal Agrivita 11 (3) 24-29. Mosse, B. 2001. Vesicular-arbuscular Mycorrhizal Research for Tropical. Journal Agriculture. Res. Bull. 82p. Musfal. 2010. Potensi Cendawan Mikoriza Arbuskula Untuk Meningkatkan Hasil Tanaman Jagung. Jurnal Litbang Pertanian. Hlm 29(4). Nathan M. Kleczewski, Dennis Lewandowski, and Pierluigi (Enrico) Bonello. 2008 Mycorrhizae in Urban Landscapes. Department of Plant Pathology. The Ohio State University. USA. Nurhayati. 2010. Pengaruh Waktu Pemberian Mikoriza Vesikular Arbuskular Pertumbuhan Tomat. Jurnal. Agrivigor. Vol 9(3): 280-284. Nyoman, Ni A.M. 2007. Pengaruh Jenis Pupuk Kandang dan Jarak Tanam Terhadap Pertumbuhan Gulma dan Hasil Jagung Manis. Jurnal Agritrop. 26 (4). Hal. 153-159. Orlando Antonio Quilambo. 2003. The Vesicular-arbuscular Mycorrhizal Symbiosis. African Journal of Biotechnologi. Vol. 2 (12). Poerwanto. 2010. Budidaya Serai Wangi. Balai Penelitian Tanaman Obat dan Aromatik (BALITTRO). Bogor. 51 Prihastuti, Sudaryono, dan E. Handayanto. 2010. Keanekaragaman jenis mikoriza vesikular arbuskular dan potensinya dalam pengelolaan kesuburan lahan ultisol. Prosiding Seminar Nasional Biologi. Universitas Brawijaya. Malang. Raschen, I. dan Von Alten H. 2002. Examination of Single Spore Culture of VA Fungi by Isoenzyme Ptterns After Polyacrylamide Gel Electrophoresis (PAGE). Cambridge. England. Read D.J, Duckett J.G, Francis R, Ligrone R, Russell A. 2000. Symbiotic fungal associations in ‘lower’ land plants. Phil Transact Royal Soc London (B), Journal Biol Sci 355:815–830. Rianto, F., S. Hadi., M. Machmud dan Y. Fakuara. 2005. Application of Glomus sp. For the control bacterial on tomato. Biotrop special publication. Rosmarkam A., dan Yuwono N.W. 2006. Ilmu Kesuburan Tanah. Kanisius. Yogyakarta. Santoso, A. D. 1989. Teknik dan Metode Penelitian Mikoriza Vesikula Arbuskula. Jurusan Tanah Fakultas Pertanian IPB. Bogor. Sarief, E. S. 1989. Kesuburan dan Pemupukan Tanah Pertanian. Pustaka Buana. Bandung.Hal. 197. Schot Nelson. 2008. Rust of Lemongrass. Plant Disease. Department of Plant and Enviromental Protection Sciences. University of Hawai’i. Manoa Schüßler A, Schwarzott D, dan Walker C. 2001. A new fungal phylum, the Glomero–mycota: phylogeny and evolution. Mycol Res105:1413–1421. Schüßler A dan Walker C. 2010. The Glomeromycota. A Species List with New Families and New Genera. Kew: The Royal Botanic Garden Kew. Setyorini,D, Rasti. S, dan E. Kosman .A, 2007. Pupuk Organik dan Pupuk Hayati. Kompos. Hal. 30. Simanungkalit, M. D. R. 2004. Potensi Mikoriza Vesikular Arbuskular dalam Meningkatkan Produktivitas Tanaman Pangan. Laporan Program Pelatihan Biologi dan Bioteknologi. Bogor. Sinwin,R.M, Mulyati, dan Lolita, E.S. 2006. Peraanan Kascing Dan Inokulasi Jamur Mikoriza Terhadap Serapan Hara Tanaman Jagung. Jurnal Jurusan Ilmu Tanah Fakultas Pertanian Universitas Mataram. Hal. 1-8. Sofyan Abdullah, Yunus Musa, Feranita H. 2005. Perbanyakan Cendawan Mikoriza Arbuskular (CMA) pada Berbagai Varietas Jagung (Zea mays L) dan 52 Pemanfaatannya pada Dua Varietas Tebu (Saccharum officinarum L). Jurnasl Sains dan Teknologi. Vol. 5 No.1 Hal. 12-20. Siti Kabirun 1994. Diktat Perkuliahan Mikorisa. Universitas Gajah Mada. Yogyakarta. Sitompul S.N dan B. Guritno. 2005. Analisis Pertumbuhan Tanaman. Universitas Gajahmada Press. Yogyakarta. Sitrianingsih. 2010. Pengaruh Inokulasi Mikoriza Vesikula Arbuskula (Mva) Terhadap Pertumbuhan Bibit Pule Pandak (Rauvolfia verticillata Lour.). Naskah Publikasi. Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret. Surakarta. Tisdall, J.M.2001. Fungal hyphae and structural stability of soil. Aust. Journal Soil. Res. 29:729-743. Widowati L.R, Sri Widawati, U. Junaedin dan D. Setyorini. 2004. Karakterisasi Pupuk Organik dan Pupuk Hayati yang Efektif untuk Budidaya Sayuran Organik. Balai Penelitian Tanah. Bogor. Vilarino A., Arines J., dan Shoepp H,. 2002. Propagule Production by VA Fungi in Red Clover Plants Subjected to Periodict Removal of the Aerial Parts. Cambridge. Hal. 406. Yadi Setiadi. 2012. Mengenal Fungsi Mikoriza Sebagai Penyokong Kehidupan Tanaman Pada Lahan Lahan Marginal. IPB. Bogor. Yuni Sri Rahayu dan Santosa. 1995. Pembentukan Mikoriza Vesikular-Arbuskular pada Capsicum annumL. Dan Solanum Tuberosum L. yang Ditumbuhkan pada Tanah Asam Ultisol. Jurnal Biologi Vol (1). No. 9. Hlm 371-379. 53 LAMPIRAN Lampiran 1: Tabel Persentase Infeksi (%) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan FK I 85,39 95,57 59,75 74,81 79,28 52,52 95,38 81,18 53,21 97,27 50,49 97,14 85,88 91,36 92,16 79,89 95,55 83,29 54,10 98,00 1.602,21 80,11 Ulangan II 48,97 98,75 24,79 63,86 69,09 81,51 93,05 41,64 34,40 98,89 66,17 96,38 70,11 68,13 98,75 80,27 95,22 61,77 67,44 85,07 1.444,26 72,21 III 66,84 84,41 69,46 81,33 97,32 85,01 97,88 78,75 86,55 86,40 81,87 93,44 100,00 86,55 88,88 71,93 100,00 84,49 92,09 80,88 1.714,08 85,70 Total Rataan 201,20 278,73 154,00 220,00 245,69 219,03 286,31 201,57 174,16 282,56 198,53 286,96 255,99 246,04 279,79 232,09 290,77 229,55 213,63 263,95 4.760,55 67,07 92,91 51,33 73,33 81,90 73,01 95,44 67,19 58,05 94,19 66,18 95,65 85,33 82,01 93,26 77,36 96,92 76,52 71,21 87,98 1.586,85 79,34 = (4.760,55)2 (4x5x3) = 377.713,94 JK Total = (85,392 + 48,972 + 66,842 + …..+ 80,882) – FK = 396.123,67 – 377.713,94 = 18.409,73 JK Blok Ulangan = (1.602,212 +1.444,262 +1.714,082 = 1.837,76 4 ×5 − 𝐹𝐾 54 JK Perlakuan = (201,202 + 278,732 + ……. +263,952 3 − 𝐹𝐾 = 10.260,75 = JK Total – JK Perlakuan JK Galat = 18..409,73 – 10.260,75 = 8.148,98 Tabel Penolong Perlakuan T1 T2 T3 T4 T5 Total Rataan Ma 201,20 278,73 154,00 220,00 245,69 1.099,62 219,92 Mb 219,03 286,31 201,57 174,16 282,56 1.163,63 232,73 Mc 198,53 286,96 255,99 246,04 279,79 1.267,31 253,46 Md 232,09 290,77 229,55 213,63 263,95 1.229,99 246,00 Total 850,85 1.142,77 841,11 853,83 1.071,99 Rataan 212,71 285,69 210,28 213,46 268,00 JK M = 1.099,622 + 1.163,632 + 1.267,312 + 1.229,992 5 ×3 − 𝐹𝐾 = 378.809,93 – 377.713,94 = 1.095,99 JK T = 850,852 + 1.142,772 + 841,112 + 853,832 + 1.071,992 4×3 = 384.626,94 – 377.713,94 = 6.913 JK M X T = JK Perlakuan – JK M – JK T = 10.260,75 – 1.095,99 – 6.913 = 2.251,76 − 𝐹𝐾 55 Lampiran 2: Tabel Annova Persentase Infeksi (%) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 1.837,76 918,88 Perlakuan 19 10.260,75 540,04 Fk 1 377.713,94 377.713,94 M 3 1,095,99 365,33 1,79tn 2,84 T 4 8.913,00 1.728,25 8,48n 2,61 MXT 12 2.251,76 187,65 0,92tn 2,00 Galat 40 8.148,98 203,72 60 396.123,67 Total Uji Lanjut LSR LSR = (SSR) (SX) LSR = (SSR 5% : 40) x (SX) SX = √𝐾𝑇. 𝐺𝑎𝑙𝑎𝑡/𝑟 = 3,30 x 8,24 = √203,72/3 = 27,19 = √67,91 = 8,24 Tabel Berjarak Duncan Perlakuan T Rataan T3(a) T1(a) T4(a) T5(b) T2(b) 210,28 212,71 213,46 268,00 285,69 Rataan T3 T1 2,43tn 3,18tn 57,72n 75,41n 0,75tn 55,29n 72,98n Tabel Berjarak Duncan Perlakuan M Rataan Rataan Mb Ma (a) Ma 219,92 (ab) Mb 232,73 12,81tn (ab) Md 246,00 26,08tn 13,27tn (b) Mc 253,46 33,54n 20,73tn Ket : tn = tidak nyata n = nyata T4 T5 LSR 5% 27,19 n 54,54 72,23n Md 17,69tn LSR 5% 27,19 7,46tn 56 Lampiran 3 Tabel Hasil Rataan Persentase Infeksi (%) Tanaman Inang Media Serai Serai Bawang Jagung Sorgum Tanam Dapur Wangi Daun % Tanah 67,07 92,91 51,33 73,33 81,90 Pukan Tanah73,01 95,44 67,19 58,05 94,19 Kompos Rataan 73,31a 77,58ab 84,49b Tanah-Zeolit 66,18 95,65 85,33 82,01 93,26 Zeolit 77,36 96,92 76,52 71,21 87,98 82,00ab Rataan 70,91a 95,23b 70,01a 71,15a 89,33b (-) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjdi interaksi antara kedua perlakuan Lampiran 4: Tabel Populasi Spora (per 50 gr media) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan I 1.133 1.432 868 1.001 1.374 1.524 1.756 624 964 1.403 1.068 1.876 860 868 1.343 1.007 1.492 789 584 1.534 23.500 1.175 Ulangan II 1.045 1.188 743 976 1.460 880 1.168 843 1.119 1.408 1.736 1.947 936 1.273 1.208 1.220 1.452 412 1.188 1.176 23.378 1.168,9 III 1.172 2.052 416 1.136 1.484 1.276 1.880 920 1.256 1.424 924 1.476 668 1.972 1.492 604 1.473 844 713 1.864 25.046 1.252.3 Total 3.350 4.672 2.027 3.113 4.318 3.680 4.804 2.387 3.339 4.235 3.728 5.299 2.464 4.113 4.043 2.831 4.417 2.045 2.485 4.574 71.924 Rataan 1.116,67 1.557,33 675,67 1.037,67 1.439,33 1.226,67 1.601,33 795,67 1.113,00 1.411,67 1.242,67 1.766,33 821,33 1.371,00 1.347,67 943,67 1.472,33 681,67 828,33 1.524,67 23.974,67 1.198,73 57 Lampiran 5: Tabel Annova Populasi Spora (per 50 gr media) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 86.453.7 43.226,85 Perlakuan 19 6.119.607,73 322.084,62 Fk 1 M 3 393.032,93 131.010,98 1,70tn 2,84 T 4 5.259.396,57 1.314.849,14 17,08n 2,61 MXT 12 467.178,23 38.931,52 0,51tn 2,00 Galat 40 3.079.230,00 76.980,75 60 95.416.534,00 Total Ket 86.217.696,30 86.217.696,30 : tn = tidak nyata n = nyata Lampiran 6 Tabel Rataan Populasi Spora (per 50 gr media) Tanaman Inang Media Tanam Sorgum Jagung S. dapur S. wangi Bawang daun Rataan Per 50 gram media Tanah1.116,67 1.557,33 675,67 1.037,67 1.439,33 1.165,33ab Pukan Tanah1.226,67 1.601,33 795,67 1.113,00 1.411,67 1.229,67ab kompos Tanah1.242,67 1.766,33 821,33 1.371,00 1.347,67 1.309,80a zeolit Zeolit 943,67 1.472,33 681,67 828,33 1.524,67 1.090,13b 100% Rataan 1.132,42b 1.599,33a 743,58c 1,087,50b 1.430,83a (-) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjdi interaksi antara kedua perlakuan 58 Lampiran 7: Tabel Tinggi Tanaman Umur 1 Bulan Setelah Inokulasi (cm) Ulangan No Perlakuan Total Rataan I II III 1 MaT1 71,86 65,63 64,24 201,73 67,24 2 MaT2 80,62 86,33 92,81 259,76 86,59 3 MaT3 93,25 99,34 69,33 261,92 87,31 4 MaT4 57,86 62,24 39,83 159,93 53,31 5 MaT5 21,88 34,82 24,37 81,07 27,02 6 MbT1 60,43 60,42 64,44 185,29 61,76 7 MbT2 87,34 84,26 84,46 256,06 85,35 8 MbT3 94,62 88,48 95,62 278,72 92,91 9 MbT4 47,64 74,46 74,63 196,73 65,58 10 MbT5 27,22 29,54 26,50 83,26 27,75 11 McT1 45,24 54,84 57,82 157,90 52,63 12 McT2 77,48 75,81 80,44 233,73 77,91 13 McT3 102,26 105,65 106,22 314,13 104,71 14 McT4 69,64 49,63 52,44 171,71 57,24 15 McT5 24,48 34,87 30,52 89,87 29,96 16 MdT1 45,11 52,41 45,66 143,18 47,73 17 MdT2 63,83 74,11 74,82 212,76 70,92 18 MdT3 96,65 86,66 97,84 281,15 93,72 19 MdT4 78,42 61,24 55,81 195,47 65,16 20 MdT5 29,82 31,18 26,66 87,66 29,22 1.275,65 1.311,92 1.264,46 3.852,03 1.284,01 Total 63,78 65,59 63,22 64,20 Rataan Lampiran 8: Tabel Annova Tinggi Tanaman Umur 1 Bulan Setelah Inokulasi (cm) Sumber DB JK KT FH F 0,05 Variasi Blok ulangan 2 61.55 30.77 Perlakuan 19 32.246,86 1.697,20 Fk 1 247.302,25 247.302,25 M 3 214,96 71,65 T 4 30.251,83 MXT 12 1.780,06 148,34 Galat 40 2.390,53 59,76 60 281.939,63 Total Ket : tn = tidak nyata n = nyata 1,20tn 2,84 7.562,96 126,55n 2,61 2,48n 2,00 59 Lampiran 9: Tabel Rataan Tinggi Tanaman Umur 1 Bulan Setalah Inokulasi (cm) Tanaman Inang Media Serai Serai Bawang Sorgum Jagung Rataan Tanam dapur wangi daun cm Tanah-Pukan 67,24 86,59 87,31 53,31 27,02 64,29ab Tanahkompos Tanah-zeolit 61,76 85,35 92,91 65,58 27,75 66,67a 52,63 77,91 104,71 57,24 29,96 64,49ab Zeolit 47,73 70,92 93,72 65,16 29,22 61,35b Rataan 57,34 80,19 94,66 60,32 28,49 (+) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (+) Tidak terjdi interaksi antara kedua perlakuan Lampiran 10: Tabel Pertambahan Tinggi Tanaman Umur 2 Bulan Setelah Inokulasi (cm) Ulangan No Perlakuan Total Rataan I II III 1 MaT1 17.49 25.59 24.12 70.20 23.40 2 MaT2 32.60 25.77 17.81 75.58 25.19 3 MaT3 12.57 10.68 41.33 64.58 21.53 4 MaT4 19.44 65.19 54.77 139.40 46.46 5 MaT5 14.28 4.23 13.68 32.19 10.73 6 MbT1 31.89 0.64 2.86 35.39 11.80 7 MbT2 4.36 9.32 29.80 43.48 14.49 8 MbT3 24.40 16.74 17.74 58.88 19.63 9 MbT4 80.36 41.62 18.01 139.99 46.66 10 MbT5 12.19 10.68 7.20 38.07 10.02 11 McT1 49.04 10.92 22.32 82.28 27.43 12 McT2 22.40 8.01 10.34 40.75 13.58 13 McT3 18.18 4.91 8.98 32.07 10.69 14 McT4 2.46 99.44 59.11 161.01 53.67 15 McT5 8.00 9.83 6.18 24.01 8.00 16 MdT1 21.07 19.71 22.30 63.08 21.03 17 MdT2 23.27 8.83 11.48 43.58 14.53 18 MdT3 13.41 15.18 16.20 44.79 14.97 19 MdT4 17.98 86.66 18.29 122.93 40.98 20 MdT5 14.49 15.08 13.44 43.01 14.34 439.88 489.03 415.96 1352.87 448.30 Total 21.99 24.45 20.80 22.41 Rataan 60 Lampiran 11: Tabel Annova Pertambahan Tinggi Tanaman Umur 2 Bulan Setelah Inokulasi (cm) Sumber Variasi Perlakuan DB JK KT FH F 0,05 19 10816.65 569.30 Fk 1 30279.23 30279.23 M 3 221.41 73.80 0.21 2,84 T 4 9618.27 2404.57 6.88n 2,61 MXT 12 976.97 81.41 0.23tn 2,00 Galat 40 13965.47 349.14 60 55061.34 Total Ket : tn = tidak nyata n = nyata Lampiran 12: Tabel Rataan Pertambahan Tinggi Tanaman Umur 2 Bulan Setelah Inokulasi (cm) Media Tanam Sorgum Tanah-Pukan 90,64 Tanaman Inang Serai Serai Jagung dapur wangi cm 111,78 108,83 99,76 73,56 99,85 112,53 80,06 91,49 68,75 78,25 Tanahkompos Tanah-zeolit Zeolit Rataan Bawang daun Rataan 37,75 89,75a 112,24 37,78 87,19a 115,40 110,91 37,96 87,16a 85,45 108,65 106,13 43,57 82,51a 97,14 111,35 107,26 39,26 (-) Ket: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan 61 Lampiran 13: Tabel Pertambahan Tinggi Tanaman Umur 3 Bulan Setelah Inokulasi (cm) Ulangan No Perlakuan Total Rataan I II III 1 MaT1 25.87 36.47 30.38 92.72 30.91 2 MaT2 38.83 37.05 20.62 96.50 32.17 3 MaT3 32.53 19.89 54.23 106.65 35.55 4 MaT4 41.70 90.29 64.75 196.74 65.58 5 MaT5 15.62 9.68 18.58 43.88 14.63 6 MbT1 37.00 13.18 13.40 63.58 21.19 7 MbT2 12.12 11.82 34.85 58.79 19.60 8 MbT3 36.59 27.42 25.84 89.85 29.95 9 MbT4 92.91 78.76 37.49 209.16 69.72 10 MbT5 15.31 13.87 14.58 43.76 14.59 11 McT1 53.32 16.66 28.90 98.88 32.96 12 McT2 27.26 18.19 17.90 63.35 21.12 13 McT3 33.56 9.31 17.04 59.91 19.97 14 McT4 32.13 118.11 75.02 225.26 75.09 15 McT5 12.82 14.67 10.68 38.17 12.72 16 MdT1 24.99 34.79 27.08 86.86 28.95 17 MdT2 29.33 16.81 18.94 65.08 21.69 18 MdT3 37.91 35.10 25.42 98.43 32.81 19 MdT4 25.84 91.62 58.53 175.99 58.66 20 MdT5 18.28 17.15 23.36 58.79 19.60 643.92 710.84 617.59 1972.35 657.46 Total 32.20 35.54 30.88 32.87 Rataan Lampiran 14: Tabel Annova Tinggi Tanaman Umur 3 Bulan Setelah Inokulasi (cm) Sumber DB JK KT FH F 0,05 Variasi Perlakuan 19 20705.95 1089.78 Fk 1 64836.07 64836.07 M 3 185.62 61.87 0.21tn T 4 19244.60 4811.15 16.42n 2,84 MXT 12 1275.73 106.31 0.36tn 2,61 Galat 40 11713.45 292.84 60 97255.47 Total Ket : tn = tidak nyata n = nyata 2,00 62 Lampiran 15: Tabel Rataan Pertambahan Tinggi Tanaman Umur 3 Bulan Setelah Inokulasi (cm) Tanaman Inang Media Serai Serai Bawang Rataan Tanam Sorgum Jagung dapur wangi daun cm Tanah-Pukan 98,15 118,75 122,86 118,89 41,65 100,06a Tanah82,96 104,95 122,86 135,30 42,34 97,68a kompos Tanah-zeolit 85,60 99,03 124,68 132,32 42,68 96,86a Zeolit 76,68 92,61 126,53 123,82 48,82 93,69a Rataan 85,85 103,83 124,23 127,58 43,87 (-) Ket: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan Lampiran 16: Tabel Jumlah Daun Umur 3 Bulan Setelah Inokulasi (cm) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan I 10,80 9,00 20,20 13,20 6,80 9,80 11,44 29,40 16,80 4,00 8,40 10,40 31,20 15,80 6,40 8,00 8,40 52,40 23,80 12,20 308,44 15,42 Ulangan II 11,80 14,80 28,20 18,60 5,50 17,20 14,20 23,80 21,60 10,80 13,40 11,40 19,80 9,00 9,60 15,60 9,00 26,40 10,20 7,00 297,90 14,89 III 9,20 13,40 28,60 13,60 7,50 10,40 10,20 30,00 16,20 9,33 7,60 11,60 21,80 16,60 9,00 10,60 8,40 23,20 8,40 13,40 279,03 13,95 Total 31,80 37,20 77,00 45,40 19,80 37,40 35,84 83,20 54,60 24,13 29,40 33.40 72,80 41,40 25,00 34,20 25,80 102,00 42,40 32,60 885,37 Rataan 10,60 12,40 25,67 15,13 6,60 12,46 11,95 27,73 18,20 8,04 9,80 11,13 24,26 13,80 8,33 11,40 8,60 34,00 14,13 10,87 295,12 14,76 63 Lampiran 17: Tabel Annova Jumlah Daun Umur 3 Bulan Setelah Inokulasi (cm) Sumber DB JK KT FH F 0,05 Variasi Blok ulangan 2 22,20 11,10 Perlakuan 19 3.156,91 166,15 Fk 1 13.064,67 13.064,67 M 3 60,89 20,30 0,78tn 2,84 T 4 2.888,59 722,15 27,83n 2,61 MXT 12 207,43 17,28 0,66tn 2,00 Galat 40 1.037,93 25,95 60 17.259,51 Total Ket : tn = tidak nyata n = nyata Lampiran 18: Tabel Rataan Jumlah Daun Umur 3 Bulan Setelah (cm) Tanaman Inang Media Serai Serai Bawang Sorgum Jagung Tanam dapur wangi daun cm Tanah-Pukan 98,15 118,75 122,86 118,89 41,65 Tanah82,96 104,95 122,86 135,30 42,34 kompos Tanah-zeolit 85,60 99,03 124,68 132,32 42,68 Zeolit 76,68 92,61 126,53 123,82 48,82 Rataan 85,85 103,83 124,23 127,58 43,87 Inokulasi Rataan 100,06a 97,68a 96,86a 93,69a (-) Ket: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan 64 Lampiran 19: Bobot Segar Tanaman (gr) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan I 87,50 111,31 87,34 40,50 19,71 91,41 84,32 94,33 66,42 18,42 85,42 74,82 116,17 61,04 21,11 47,13 64,74 179,50 53,02 58,11 1.462,32 73,12 MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan Ulangan II 68,02 82,95 115,51 80,00 32,01 63,52 83,41 81,56 105,55 51,17 38,54 81,34 88,50 139,55 51,26 55,52 71,54 107,56 72,43 77,96 1.547,90 77,39 III 61,50 93,41 56,50 40,70 29,94 97,82 93,54 87,41 76,50 18,79 85,50 79,55 81,34 47,21 27,32 83,52 68,41 104,03 19,56 47,74 1.300,29 65,01 Total Rataan 217,02 287,67 259,35 161,20 81,66 252,75 261,27 263,30 248,47 88,38 209,46 235,71 286,01 247,80 99,69 186,17 204,69 391,09 145,01 183,81 4.310,51 72,34 95,89 86,45 53,73 27,22 84,25 87,09 87,77 82,82 29,46 69,82 78,57 95,34 82,60 33,23 62,06 68,23 130,36 48,34 61,27 1.436,84 71,84 Lampiran 20: Tabel Annova Bobot Segar Tanaman (gr) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 1.581,47 790,73 Perlakuan 19 36.220,98 1.906,37 Fk 1 309.674,94 309.674,94 M 3 495,82 165,27 0,33tn 2,84 T 4 25.057,02 6.264,25 12,59n 2,61 MXT 12 10.668,15 889,01 1,79tn 2,00 Galat 40 19.897,48 497,44 60 365.793,41 Total Ket : tn = tidak nyata n = nyata 65 Tabel 21: Tabel Rataan Bobot Segar Tanaman (gr) Media Tanam Sorgum Tanah-Pukan 72,34 Tanaman Inang Serai Serai Jagung dapur wangi Gram (gr) 95,89 86,45 53,73 84,25 87,09 87,77 69,82 78,57 Zeolit 62,06 Rataan 72,12 Tanahkompos Tanah-zeolit Bawang daun Rataan 27,22 67,13a 82,82 29,46 74,28a 95,34 82,60 33,23 71,91a 68,23 130,36 48,34 61,27 74,05a 82,45 99,98 66,87 37,80 (-) Ket: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan Lampiran 22: Bobot Kering Tanaman (gr) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan I 16,18 10,36 26,93 15,19 2,66 20,14 21,37 41,39 21,25 2,33 19,57 17,69 39,16 14,90 2,96 11,53 14,52 46,35 16,93 6,98 368,39 18,42 Ulangan II 21,78 22,42 41,52 32,38 3,62 17,18 22,41 38,66 30,94 5,99 10,61 10,95 28,02 53,94 6,58 13,15 7,71 23,55 20,53 6,79 418,73 20,93 III 24,24 24,12 21,21 19,29 3,43 23,02 16,74 37,93 37,92 2,76 21,57 11,95 32,25 9,82 3,69 14,72 23,48 35,77 12,11 4,42 380,44 19,02 Total 62,20 56,90 89,66 66,86 9,71 60,34 60,52 117,98 90,11 11,08 51,75 40,59 99,43 78,66 13,23 39,40 45,71 105,67 49,57 18,19 1.167,56 Rataan 20,73 18,97 29,89 22,28 3,24 20,11 20,17 39,33 30,04 3,69 17,25 13,53 33,14 26,22 4,41 13,13 15,24 35,22 16,52 6,06 389,19 19,46 66 Lampiran 23: Tabel Annova Berat Kering Tanaman (gr) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 69,09 34,54 Perlakuan 19 6.395,29 336,59 Fk 1 22.719,94 22.719,94 M 3 236,03 78,68 1,30tn 2,84 T 4 5.837,71 1.459,43 24,10n 2,61 MXT 12 321,55 26,79 0,44tn 2,00 Galat 40 2.422,17 60,55 60 31.537,40 Total Ket : tn = tidak nyata n = nyata Tabel 24: Tabel Rataan Bobot Kering Tanaman (gr) Tanaman Inang Media Serai Serai Tanam Sorgum Jagung dapur wangi Gram (gr) Tanah-Pukan 20,73 18,97 29,89 22,28 Tanahkompos Tanah-zeolit Bawang daun Rataan 3,24 19,02ab 20,11 20,17 39,33 30,04 3,69 22,67a 17,25 13,53 33,14 26,22 4,41 18,91ab Zeolit 13,13 15,24 35,22 16,52 6,06 17,23b Rataan 17,81 16,98 34,40 23,77 4,35 (-) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan 67 Lampiran 25: Bobot Segar Akar (gr) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan I 5,54 4,96 4,69 10,34 1,40 5,59 8,47 6,07 8,28 1,00 9,68 7,42 4,05 10,66 1,80 7,24 11,92 6,82 7,78 1,57 125,28 6,26 MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan Ulangan II 4,29 3,50 8,80 7,70 1,49 14,16 12,50 5,67 10,05 2,76 12,63 3,50 6,74 11,11 3,90 5,68 3,40 4,50 9,91 2,65 134,94 6,75 III 11.19 8,59 4,16 5,82 1,86 8,37 11,11 11,30 13,53 1,22 4,53 9,90 8,86 5,73 1,44 13,13 3,58 14,64 4,40 2,61 145,97 7,30 Total Rataan 21,02 17,05 17,65 23,86 4,75 28,12 32,08 23,04 31,86 4,98 26,84 20,82 19,65 27,50 7,14 26,05 18,90 25,96 22,09 6,83 406,19 Lampiran 26: Tabel Annova Bobot Segar Akar (gr) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 10,28 5,14 Perlakuan 19 456,18 24,01 Fk 1 2.749,84 2.749,84 M 3 42,87 14,29 1,48tn 2,84 T 4 367,16 91,79 9,54n 2,61 MXT 12 46,15 3,84 0,40tn 2,00 Galat 40 384,88 9,62 60 3.590,89 Total Ket : tn = tidak nyata n = nyata 7,01 5,68 5,88 7,95 1,58 9,37 10,69 7,68 10,62 1,66 8,95 6,94 6,55 9,17 2,38 8,68 6,30 8,65 7,36 2,28 135,40 6,77 68 Lampiran 27: Tabel Rataan Bobot Segar Tanaman (gr) Media Tanam Sorgum Tanah-Pukan 7,01 Tanaman Inang Serai Serai Jagung dapur wangi Gram (gr) 5,68 5,88 7,95 Tanahkompos Tanah-zeolit 9,37 8,95 10,69 6,94 7,68 6,55 Zeolit 8,68 6,30 Rataan 8,50 7,40 Bawang daun Rataan 1,58 5,62b 10,62 9,17 1,66 2,38 8,00a 6,80ab 8,65 7,36 2,28 6,65ab 7,19 8,78 1,98 (-) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan Lampiran 28: Panjang Akar (cm) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Perlakuan MaT1 MaT2 MaT3 MaT4 MaT5 MbT1 MbT2 MbT3 MbT4 MbT5 McT1 McT2 McT3 McT4 McT5 MdT1 MdT2 MdT3 MdT4 MdT5 Total Rataan I 35,56 19,90 40,62 40,05 10,36 43,08 31,45 38,18 65,63 15,57 39,42 31,07 45,16 58,93 15,60 47,52 22,06 41,78 45,55 13,22 700,71 35,03 Ulangan II 42,60 19,76 60,20 53,47 29,60 44,84 26,86 53,60 57,30 20,46 37,76 11,67 78,36 68,95 18,77 49,54 37,50 63,58 45,90 28,54 849,26 42,46 III 49,88 35,76 42,60 35,25 21,82 49,80 40,58 33,46 57,82 10,87 52,76 36,56 46,90 95,35 18,12 60,22 33,34 40,54 47,90 21,12 830,65 41,53 Total 128,04 75,42 143,42 128,77 61,78 137,72 98,89 125,24 180,75 46,90 129,94 79,30 170,42 223,23 52,49 157,28 92,90 145,90 139,35 62,88 2.380,62 Rataan 42,68 25.14 47,81 42,92 20,59 45,91 32,96 41,75 60,25 15,63 43,31 26,43 56,81 74,41 17,50 52,43 30,97 48,63 46,45 20,96 793,54 39,68 69 Lampiran 29: Tabel Annova Panjang Akar (cm) Sumber Variasi Blok ulangan DB JK KT FH F 0,05 2 734,30 367,15 Perlakuan 19 13.964,51 734,97 Fk 1 94.376,52 94.376,52 M 3 458,76 152,92 1,59tn 2,84 T 4 11.397,01 2.849,25 29,60n 2,61 MXT 12 2.108,73 175,73 1,83tn 2,00 Galat 40 3.849,85 96,25 60 112.190,89 Total Ket : tn = tidak nyata n = nyata Lampiran 30: Tabel Rataan Panjang Akar (cm) Tanaman Inang Media Serai Serai Sorgum Jagung Tanam dapur wangi (cm) Tanah-Pukan 42,80 25,14 47,81 42,92 Tanahkompos Tanah-zeolit Bawang daun Rataan 20,59 35,85b 45,91 32,96 41,75 60,25 15,63 39,30ab 43,31 26,43 56,81 74,41 17,50 43,69a Zeolit 52,43 30,97 48,63 46,45 20,96 39,89ab Rataan 46,11 28,88 48,75 56,01 18,67 (-) Ket: Angka-angka yang diikuti huruf kecil yang tidak sama pada kolom yang sama menunjukkan berbeda nyata menurut uji Duncan pada taraf uji 5% (-) Tidak terjadi interaksi antara kedua perlakuan 70 Lampiran 21 Gambar Spora Fungi Mikoriza Arbuskular (Spora FMA pada media Jagung, Perbesaran: 400x) (Pewarnaan Spora pada media Jagung Perbesaran: 400x) (Spora FMA padamedia Sorgum, Perbesaran: 400x) (Pewarnaan Spora FMA pada media B. daun, Perbesaran: 400x) Lampiran 22 Gambar Arbuskula FMA (Arbuskular pada media Serai wangi, Perbesaran: 400x) 71 Lampiran 23 Gambar Vesikular FMA (Vesikular FMA pada media jagung Perbesaran: 400x) (Vesikular FMA pada media jagung Perbesaran:400x) (Vesikular FMA pada B. Daun) (Spora FMA pada media B. Daun, Perbesaran: 400x) (Vesikular FMA pada media B. Daun perbesaran: 400x) (Vesikular FMA pada Serai wangi) 72 Lampiran 24 Gambar Hifa FMA (Hifa FMA pada Serai Jagung) (Hifa FMA pada sorgum) (Hifa FMA pada jgung) (Hifa FMA pada B. Daun) 73 (Hifa FMA pada Serai wangi) (Hifa FMA pada Serai dapur) Lampiran 25 Media Tumbuh dan Tanaman Inang (Media Tanam telah diberi 40 gr FMA) (Tanaman B. dun 1 BSI) (Tanaman Sorgum & Jagung 1 BSI) (Tinggi Tanaman S. wangi saat panen) (Akar tanaman Inang saat panen) 74 Lampiran 36 Gambar Alat dan Bahan (Saringan bertahap) (Auto clave) (Kertas saring untuk spora) (Mikroskop binocular) (Timbangan analitik) (Pupuk Hyponex dan Basamid) 75 Lampiran 37 Bagan Plot Penelitian Ulangan I 1,5 m III 1,5 m II 1,5 m MaT1 MaT4 MbT4 McT1 McT4 MbT3 MdT3 McT1 MdT5 McT4 MaT2 McT5 MdT2 MdT1 MdT3 MaT4 MaT1 McT3 MbT1 MdT5 MaT4 MaT5 MaT5 MaT1 McT2 McT5 MbT5 MdT3 MbT2 MdT2 MbT3 MbT1 MbT1 McT5 MdT2 MbT2 MbT2 McT3 MaT5 MdT1 MdT3 McT2 MbT5 MbT4 MdT4 MdT4 MbT5 MaT3 McT3 MbT3 MaT2 MbT4 MaT3 McT4 MdT5 MdT4 McT1 MaT3 McT2 MdT1 6m U B T S 20 m 76