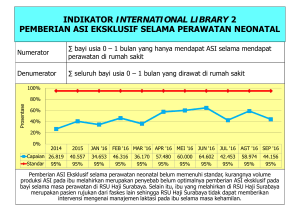
BAB I - PPS Unud
advertisement

1 BAB I PENDAHULUAN 1.1. Latar Belakang Upaya pencegahan penyakit merupakan hal yang sangat penting dalam mewujudkan suatu tingkat kesehatan pada individu dan masyarakat. Ini juga berkaitan dengan tercapainya “The Millennium Development Goals on Health”, salah satunya menurunkan angka kematian anak < 5 tahun menjadi 2/3 pada tahun 2015 dari kematian pada tahun 1990 (WHO,2003). Kekurangan gizi masih merupakan salah satu isu sentral yang melatarbelakangi kematian anak yang disebabkan oleh penyakit infeksi (Black dkk, 2003). Pemberian air susu ibu (ASI) merupakan salah satu strategi utama untuk memenuhi kecukupan gizi, mencegah penyakit dan kematian akibat penyakit infeksi (diare) pada tahun-tahun awal kehidupan. Hal ini berhubungan dengan kandungan nutrisi ASI termasuk, adanya faktor imunitas pada ASI baik imunitas nonspesifik (inat) maupun imunitas spesifik (adaptif) (Morrow & Rangel, 2004). ASI merupakan makanan alamiah utama bayi baru lahir hingga berusia 6 bulan. Kandungan nutrisinya cukup lengkap untuk tumbuh kembang bayi pada usia tersebut (American Academy of Pediatrics and Work Group on Breastfeeding, 1997). Di negara berkembang pemberian ASI secara eksklusif (hanya memberi ASI sebagai makanan bayi) telah terbukti melindungi bayi dari kematian maupun kesakitan akibat penyakit berat (WHO, 2000). Di negara maju, 1 2 pemberian ASI-eksklusif dapat menurunkan risiko anak dirawat karena penyakit infeksi pada usia di bawah 1 tahun (Talayero dkk, 2006). Dalam kaitannya dengan penyakit infeksi yang perlu perawatan, pemberian ASI-eksklusif terbukti menurunkan angka kejadian rawat inap sebesar 53 % per bulan. Sedangkan pada pemberian ASI non-eksklusif kejadian rawat inap akibat penyakit infeksi hanya menurun sebanyak 31 %. Efek pencegahan tersebut terlihat lebih nyata pada bayi-bayi yang tinggal di tempat yang penduduknya padat dan tidak terurus (Quigley dkk, 2006). Khususnya terhadap penyakit diare yang disebabkan oleh infeksi, terlihat adanya hubungan langsung antara pola pemberian ASI dengan menurunnya insiden diare, persentase hari sakit dan lamanya episode diare (Lopez-Alarcon dkk,1997). Suatu studi kohort yang berkaitan dengan pemberian ASI-eksklusif, memperlihatkan adanya hubungan antara penurunan insiden penyakit infeksi pada traktus gastrointestinalis dan traktus respiratorius dengan meningkatnya pemberian ASI-eksklusif di masyarakat (Wright dkk, 1998). Penyakit diare masih menjadi masalah kesehatan masyarakat di negara berkembang termasuk Indonesia dan merupakan salah satu penyebab kematian dan kesakitan tertinggi pada anak yang berusia kurang dari 5 tahun (Lukacik dkk, 2007). Badan Kesehatan Dunia (World Health Organization = WHO) mengestimasikan bahwa terdapat lebih dari 1,8 milyard kasus diare di dunia dan 3 juta di antaranya berakhir fatal (WHO, 2001). Dari seluruh kasus diare pada anak, terdapat 125 juta kasus diare infantil yang menyebabkan kematian sebesar 440.000 anak pertahun, dengan tingkat kematian 1205 perhari, 82 % terjadi di 3 negara berkembang, dan sebagian besar disebabkan oleh infeksi rotavirus (Parashar dkk, 2003). Rotavirus merupakan penyebab terbanyak (40 %) dari seluruh penyakit diare pada anak yang disebabkan oleh infeksi, yang menyebar melalui makanan dan atau air yang terkontaminasi maupun dengan cara kontak langsung dengan orang yang sedang terinfeksi rotavirus (Heesemann & Hacker , 2002). Hasil surveillance di beberapa rumah sakit di Vietnam, 56 % dari penyakit diare pada anak di bawah usia 5 tahun yang dirawat disebabkan oleh rotavirus (Mann kk, 2001), sementara di Thailand besar kejadiannya adalah 48 %, meningkat dibandingkan dengan sebelumnya (Intusuma dkk, 2008). Di negara maju, walaupun terdapat perbaikan sanitasi, penyediaan air bersih, dan perawatan pada anak, infeksi rotavirus masih memberi kontribusi terhadap morbiditas dan besarnya biaya pengobatan yang memerlukan perhatian khusus (Parashar dkk, 1999; Parashar dkk, 2006). Pemberian ASI-eksklusif telah dicanangkan oleh WHO sebagai upaya menurunkan kejadian penyakit infeksi di masyarakat. Suatu pertemuan Konsultasi pemberian ASI pada bulan Maret 2001 di Jenewa-Swiss, menghasilkan kesepakatan tentang pemberian ASI secara eksklusif pada bayi sejak usia 0-6 bulan sebagai upaya untuk menurunkan kejadian infeksi pada traktus gastrointestinalis. Hal ini terutama ditujukan terhadap bayi-bayi yang dibesarkan di dalam masyarakat di mana prevalensi ibu yang menderita kurang gizi maupun bayi yang mengalami gangguan pertumbuhan intra uterin masih tinggi. Di dunia khususnya di negara berkembang , pemberian ASI-eksklusif sampai bayi berusia 6 4 bulan dapat mengurangi paparan terhadap mikroba patogen, karena terbukti angka morbiditas dan mortalitas penyakit diare akibat infeksi meningkat setelah bayi mendapat makanan tambahan (WHO, 2001). Efek proteksi ASI merupakan hasil interaksi dari berbagai elemen imun ASI, baik yang bersifat antigenik spesifik maupun yang berperan dalam respon imun yang bersifat general (Harsono, 1995). Beberapa dari hasil penelitian sebelumnya menunjukkan bahwa ASI dapat berfungsi sebagai pembawa kekebalan pasif pada saluran cerna bayi sementara sistem imun lokal maupun sistemik pada bayi masih imatur. Selain itu ASI dapat beradaptasi dengan baik dan tetap utuh hingga tiba di usus halus bayi. Kandungan protein ASI memiliki berbagai aktivitas biologis diantaranya sebagai antimikrobial, imunomodulator dan terdapat asam amino esensial dalam jumlah yang adekuat untuk pertumbuhan bayi (Lonnerdal, 2003). Di awal masa kehidupan bayi, imunoglobulin A sekretorik (sIgA) yang dihasilkan oleh mukosa usus bayi belum dapat berperan secara optimal di dalam sistem pertahanan mukosa usus. Pada bayi yang menyusu, pertahanan imun pada jaringan usus bayi dibantu oleh komponen imun ASI. Salah satunya adalah antibodi sIgA yang merupakan komponen imun utama, yang dapat mengikat mikroba patogen, mencegah perlekatannya pada sel enterosit di usus dan mencegah reaksi imun yang bersifat inflamasi (Jackson & Nazar , 2006; Hanson, 2007). ASI mengandung pula zat-zat yang berfungsi sebagai antiviral dan memiliki sifat bakteriostatik yang diduga ikut berperan menurunkan insiden dan lamanya penyakit infeksi pada bayi yang sedang mendapat ASI. Demikian pula 5 efek-efek komponen ASI lainnya yang secara keseluruhan dapat menghambat pertumbuhan mikroba patogen selama ASI tetap diberikan (Dewey dkk, 1995 ; Hanson dkk, 2002). Keunggulan ASI lainnya adalah perannya di dalam menstimulasi respon imun inat lokal di dalam jaringan usus halus bayi dan sebagai imunomodulator sehingga kerusakan yang diakibatkan oleh reaksi inflamasi akibat infeksi dapat dibatasi (LeBouder dkk,2006). Kelenjar mammaria ibu merupakan bagian integral dari kelenjar getah bening mukosa. Bila pada masa laktasi terjadi stimulasi sel limfosit di dalam kelenjar getah bening mukosa jaringan usus halus dan saluran nafas ibu oleh suatu antigen, maka sel-sel limfosit yang telah tersensitisasi akan bermigrasi dan masuk ke dalam kelenjar mammaria. Selanjutnya berubah menjadi sel plasma yang dapat menghasilkan antibodi sIgA yang disekresi ke dalam ASI. Antibodi sIgA ASI akan memiliki sifat spesifik terhadap mikroba patogen yang menyerang usus halus bayi (Telemo & Hanson, 1996; Brandtzaeg, 2003; Lawrence dan Pane 2007). Hasil penelitian terdahulu menunjukkan adanya kertekaitan tersebut, di mana hampir 30 % wanita yang melahirkan di salah satu rumah sakit Umum di New York pernah terinfeksi rotavirus grup C dan kekebalan ini dipindahkan kepada bayinya. Dibuktikan dengan ditemukannya IgG-antirotavirus pada darah talipusat bayi yang dilahirkan (Riepenhoff-Talty dkk, 1997). Peneliti lainnya melaporkan bahwa 40 % kolostrum wanita yang melahirkan di suatu rumah sakit di Jerman mengandung antibodi sIgA-antirotavirus (Brussow dkk, 1991). Dari uraian tersebut di atas, baik berupa temuan para peneliti maupun laporan dari Badan Kesehatan Dunia (WHO) terbukti bahwa ASI beserta zat imun 6 yang dikandungnya dapat berperan dalam menurunkan kejadian infeksi pada anak yang menyusu. Khususnya pemberian ASI-eksklusif menurunkan insiden penyakit diare akibat infeksi dan memperpendek lamanya episode diare (WHO, 2000; Wright dkk, 1998; Lopez-Alarcon dkk, 1997). Terdapat berbagai pola pemberian ASI, yaitu ASI-eksklusif, dominan ASI, pemberian ASI berimbang dengan makanan bukan ASI, dan lebih sedikit ASI dibandingkan makanan bukan ASI pada bayi yang berusia di bawah 6 bulan. Temuan di beberapa negara berkembang, pemberian ASI-eksklusif maupun yang ”dominan ASI” memiliki tingkat proteksi yang paling baik terhadap penyakit infeksi, dibandingkan pemberian ASI berimbang dan lebih sedikit ASI (Raisler dkk, 1999). Pada penyakit diare yang disebabkan oleh infeksi bakteri di antaranya kholera, pemberian ASI khususnya yang mengandung antibodi sIgA antikholera dapat mencegah terjadinya penyakit diare (Jason dkk, 2008). Sebaliknya buktibukti proteksi ASI terhadap infeksi virus masih kurang bahkan sering kontroversial, kecuali pemberian ASI-eksklusif sampai usia 4 bulan atau lebih dapat mencegah infeksi oleh rotavirus (Lawrence dan Pane, 2007). ASI-eksklusif Pemberian maupun yang dominan ASI dapat menurunkan rasio Odds penyakit diare rotavirus di tahun pertama kehidupan, akan tetapi pada usia di atas 1 tahun di mana jumlah pemberian ASI mulai berkurang, diare rotavirus justru lebih sering terjadi pada bayi yang masih mendapat ASI (Clemens dkk, 1993). Pola pemberian ASI berhubungan dengan volume ASI dan jumlah zat imun yang diterima bayi. Adanya fakta bahwa tingkat proteksi paling tinggi pada 7 pemberian ASI-eksklusif maupun dominan ASI dalam pencegahan penyakit infeksi, kemungkinan terdapat peran antibodi sIgA yang spesifik terhadap jenis mikroba tertentu. Untuk dapat menghasilkan antibodi sIgA yang mengandung antirotavirus, seorang ibu laktasi harus pernah terpapar oleh rotavirus. Akibat dari paparan tersebut, selain sIgA yang bersifat spesifik juga terdapat zat imun non spesifik dan aktivitas imun seluler terhadap rotavirus (Riordan dan Auerbach, 1999). Faktor yang juga berperan adalah jenis antibodi sIgA antirotavirus dengan serotipe tertentu, yang sesuai dengan serotipe yang menginfeksi bayi. Belum jelas apakah ada reaksi silang antara jenis antibodi antirotavirus serotipe tertentu dengan antigen rotavirus tipe lainnya (Ray dan Kelkar, 2004). Masalahnya adalah di Indonesia belum ada data mengenai tingkat paparan para ibu laktasi terhadap rotavirus. Belum ada penelitian yang mengungkap hal serupa di tempat lain yang situasi geografisnya maupun demografinya sesuai dengan tempat penelitian dilakukan (Gianyar dan sekitarnya). Tingkat pemberian ASI-eksklusif di Indonesia pada bayi masih rendah, mencapai 13,9 % untuk bayi yang berusia 4-5 bulan berdasarkan hasil survei Demografi Kesehatan Indonesia (SDKI, 2002). Dengan demikian tingkat proteksi ASI untuk melindungi anak dari penyakit diare khususnya diare akibat infeksi rotavirus masih perlu dipertanyakan. 8 1.2. Rumusan Masalah Berdasarkan fakta-fakta yang telah terungkap di dalam latar belakang, dapat dirumuskan masalah sebagai berikut : a. Apakah pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif terjadinya risiko penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif? b. Apakah pada bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus risiko terjadinya penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus? c. Apakah pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif rerata lamanya penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif ? d. Apakah pada bayi 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus rerata lamanya penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus? 9 1.3. Tujuan Penelitian 1.3.1.Tujuan umum : mengetahui hubungan antara pemberian ASI dengan penyakit diare akut rotavirus pada bayi usia 1- 6 bulan 1.3.2.Tujuan khusus : a. Mengetahui apakah pada bayi 1-6 bulan yang mendapat ASI-eksklusif risiko terjadinya penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif b. Mengetahui apakah pada bayi 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus risiko terjadinya penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus c. Mengetahui apakah pada bayi usia 1-6 bulan yang mendapat ASIeksklusif rerata lama diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif d. Mengetahui apakah pada bayi 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus rerata lama diare akut rotavirus lebih rendah daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus 1.4. Manfaat Penelitian a. Jika penelitian ini berhasil mengungkap adanya hubungan antara risiko terjadinya penyakit diare akut rotavirus dan lama diare akut rotavirus pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif dan ASI yang 10 mengandung antibodi sIgA antirotavirus, akan memberi kontribusi keilmuan dalam hal peran imunologi terhadap pencegahan penyakit diare akut rotavirus pada bayi 1-6 bulan. b. Dengan adanya pemahaman akan peran ASI dalam hubungannya dengan risiko terjadinya penyakit diare dan lama diare yang disebabkan oleh infeksi rotavirus,diharapkan berguna bagi pengambil kebijakan dalam rangka meningkatkan pemberian ASI- eksklusif di masyarakat. 11 BAB II KAJIAN PUSTAKA 2.1. Pendahuluan Di negara yang sedang berkembang, penyakit infeksi pada anak masih merupakan masalah akibat pajanan mikroorganisme patogen yang masih tinggi. Pada masa bayi (0-1 tahun) terdapat kepekaan yang tinggi terhadap infeksi sebagai akibat dari fungsi imunologis yang masih imatur dan klirens patogen intraseluler yang kurang. Pada masa intra uterin, terdapat imunoglobulin G (IgG) transplacental yang memiliki peran penting untuk melindungi bayi hingga usia 612 bulan (Chirico dkk, 2008). Imunoglobulin M (IgM) dapat memberi proteksi bayi di usia awal, terhadap invasi mikroba patogen di daerah mukosa sebagai respon nonspesifik (Hanson dkk, 1985). Pada bayi yang menyusu, ASI merupakan perlindungan yang ketiga, identik dengan ”transplacental blood” yaitu sebagai alat transport nutrien, pengaruhnya pada sistim biokemikal, meningkatkan imunitas dan merusak patogen (Riordan dan Auerbach, 1999). Antibodi sIgA yang merupakan salah satu komponen utama ASI, beserta elemen imun lainnya dapat berfungsi sebagai pembawa kekebalan pasif baik yang bersifat inat maupun adaptif (Telemo & Hanson, 1996). Air susu ibu merupakan sumber nutrisi utama yang dapat memenuhi seluruh kebutuhan bayi untuk tumbuh dan berkembang hingga usia 6 bulan. Di negara berkembang ASI sangat berperan dalam mencegah terjadinya infeksi maupun penyakit diare. Berdasarkan laporan WHO pada tahun 2001, tingkat mortalitas akibat penyakit infeksi menurun secara mencolok pada bayi yang mendapat ASI 11 12 dibandingkan dengan yang mendapat susu formula. Khususnya bayi yang mendapat ASI-eksklusif sampai dengan usia 6 bulan, memperlihatkan adanya penurunan insiden dan incidence density penyakit infeksi. Terbukti pula bahwa walaupun pemberian ASI-eksklusif hanya sampai usia 3 bulan, ada hubungannya dengan episode diare yang lebih pendek (Baker dkk, 1998) Diare adalah suatu penyakit yang ditandai dengan bertambahnya frekuensi defikasi lebih dari biasa (3 kali atau lebih) pada anak yang sebelumnya sehat, konsistensi tinja lebih cair dari biasanya disertai dengan atau tanpa darah dan atau lendir (Suraatmaja dan Soetjiningsih, 2000). Sebagian besar kasus diare terjadi pada anak di bawah 5 tahun, dan sebagai penyebab terbanyak adalah infeksi rotavirus (Parashar dkk, 2003). Di daerah yang penduduknya memiliki pendapatan perkapita rendah, infeksi primer rotavirus yang menimpa anak pada usia di bawah 1 tahun menunjukkan gejala diare yang lebih berat (Mann dkk, 2005). Berdasarkan laporan surveillance rotavirus di rumah sakit Sanglah pada tahun 2007, terdapat peningkatan persentase rawat inap penderita diare pada anak akibat infeksi rotavirus, sejalan dengan menurunnya tingkat pemberian ASI (Surveillance Rotavirus, 2007). Penyakit diare pada anak sebagian besar bersifat akut dan pada sebagian kasus membawa beberapa akibat yaitu dehidrasi, gangguan keseimbangan asam basa, dan renjatan hipovolemik manakala asupan cairan tidak memadai. Dapat pula terjadi gangguan gizi akibat menurunnya nafsu makan selama anak sakit (Suraatmaja & Soetjiningsih ,2000 ; Pusponegoro dkk, 2004). 13 2.2. Epidemiologi Badan Kesehatan Dunia memperkirakan lebih dari 1,8 milyard kasus diare terdapat di dunia, dan 3 juta diantaranya berakhir dengan kematian. Di negara berkembang diare akut masih merupakan masalah kesehatan masyarakat, dengan tingkat kejadian lebih dari 12 episode diare pertahun pada anak yang berusia di bawah 5 tahun. Diare akut pada anak juga menimbulkan kematian sebesar 4,6 juta dan 25-30% dari padanya terjadi pada anak di bawah 5 tahun (Glass dkk, 1991; Lundgren dkk, 2001). Berdasarkan hasil ”Riskesdas 2007, diare dapat menyebabkan kematian sebesar 42% pada bayi (Juffrie & Mulyani, 2009). Di Indonesia, terdapat 60 juta kejadian diare pertahun di mana pada setiap anak mengalami lebih dari satu kejadian diare (Suraatmaja, 2002). Rotavirus adalah mikroba penyebab infeksi pada sebagian besar penyakit diare akut pada anak. Di daerah tropis infeksi rotavirus terjadi sepanjang tahun dan kebanyakan menyebar melalui jalur fecal-oral dan sebagian melalui saluran nafas maupun kontak langsung dengan penderita diare. Umumnya menyerang anak berusia di bawah 2 tahun, dan mencapai puncaknya pada usia 6-24 bulan (Elliott, 2007). Dari laporan surveillance di beberapa rumah sakit di Vietnam, prevalensi diare akibat rotavirus pada anak yang berusia di bawah 5 tahun yang dirawat, angkanya tertinggi pada anak di bawah 2 tahun. Dari penelitian tersebut terungkap, infeksi rotavirus menimpa 46,3 % anak usia di bawah 1 tahun dan 34,28 % dari padanya terdiri dari anak yang berusia kurang dari 3 bulan. Ini berarti infeksi rotavirus dapat mengenai anak pada usia dini (Nguyen dkk, 2004). 14 Penyakit diare akut rotavirus yang dilaporkan oleh peneliti lainnya adalah 56 % dari seluruh kasus diare pada anak yang dirawat. Kejadian diare pada anak laki lebih besar dari pada anak perempuan dengan perbandingan dua banding satu, dan sebanyak 12- 14 % terdapat pada anak di bawah 6 bulan (Mann dkk, 2001). Hasil Surveillance Rotavirus di rumah sakit sanglah pada tahun 2007, menunjukkan sebaran usia penderita diare rotavirus yang dirawat sebagai berikut, kejadian tertinggi terdapat pada anak usia12-23 bulan (41 %), sedangkan yang mengenai bayi kurang dari 6 bulan adalah 15 %. Sebanyak 3% terjadi pada bayi usia 0-2 bulan (Surveillance Rotavirus, 2007). Ini memperlihatkan adanya peningkatan kejadian penyakit diare rotavirus sejalan dengan menurunnya tingkat pemberian ASI. Sedangkan data dari beberapa rumah sakit besar di Indonesia menunjukkan 60 % diare akut pada balita yang dirawat dan 41 % dari yang tidak dirawat disebabkan oleh rotavirus. Hal ini tak banyak dipengaruhi oleh keadaan sanitasi (Soenarto dkk, 2009). Gejala klinis diare akut yang berhubungan dengan infeksi rotavirus adalah diare dengan tinja cair, disertai dengan panas yang tidak begitu tinggi atau tanpa panas, muntah dan dehidrasi. Pada kasus diare yang pada tinjanya ditemukan rotavirus sebagian besar menampakkan gejala diare cair (81,1 %), muntah (66,4 %), dehidrasi (89 %), dan panas (59,1 %). Gambaran ini sangat berbeda dengan kasus diare yang tidak berhubungan dengan infeksi rotavirus. Pada beberapa kasus diare rotavirus menunjukkan adanya infeksi simultan dengan jenis mikroba lain terutama bakteri, tetapi tidak memberi pengaruh kolaboratif terhadap gejala klinis diare rotavirus (Bardhan dkk, 1992; Nguyen dkk, 2004). Tingkat kejadian 15 penyakit diare rotavirus kaitannya dengan anak dirawat dibandingkan dengan penyakit infeksi lainnya dapat dilihat pada gambar di bawah ini : Gamb.2.1. Tingkat Kejadian Anak usia < 5 th dirawat akibat infeksi rotavirus (dikutip dari Noah & Henderson , 2002). Keterangan gambar : Tingkat kejadian anak usia < 5 th dirawat karena penyakit diare sebagai akibat infeksi rotavirus sebelas kali lebih tinggi dibandingkan oleh karena meningitis yang disebabkan oleh berbagai penyebab. Penyakit diare rotavirus juga membawa berbagai masalah pada anak usia < 5 th seperti terlihat pada gambar di bawah ini : 16 Gambar.2.2. Gambaran infeksi rotavirus pada anak usia < 5 th (dikutip dari Parashar dkk, 2003 ; Verstraeten dkk, 2005). Keterangan gambar : Infeksi rotavirus yang terjadi pada anak usia < 5 th dapat menimbulkan penyakit yang menyebabkan anak dirawat di rumah sakit dan memiliki risiko mengalami kematian. Risiko tertinggi terjadi pada anak-anak yang berasal dari negara yang berpenghasilan rendah. Pemberian ASI sebagai upaya untuk melindungi bayi dari penyakit infeksi telah direkomendasi oleh WHO pada tahun 2001. Para ahli WHO menyatakan untuk memberi ASI –eksklusif pada bayi sejak lahir sampai usia 6 bulan, untuk menurunkan angka morbiditas maupun mortalitas akibat diare pada bayi-bayi di negara berkembang. Selain itu juga tidak berpengaruh terhadap pertumbuhan bayi pada usia tersebut (WHO,2001 ; Heesemann & Hacker , 2002). Penelitian ekologis yang menekankan pada efek ASI-eksklusif yang dilakukan di Amerika 17 Latin memperlihatkan bahwa pemberian ASI-eksklusif walaupun hanya berlangsung 3 bulan dan kemudian dilanjutkan dengan pemberian ASI bukan eksklusif mempunyai dampak pada penurunan angka kematian bayi (Betran dkk, 2001). Peneltian di Navayo juga menunjukkan hasil yang serupa yaitu menurunnya kejadian infeksi pada saluran nafas maupun saluran cerna setelah terjadi peningkatan pemberian ASI-eksklusif di masyarakat (Wright dkk, 1998). Tingkat proteksi ASI lebih berhubungan dengan dosis harian (eksklusivitas) pemberian ASI daripada lamanya masa pemberian ASI. Hal ini berkaitan dengan jumlah kandungan zat imun ASI yang ditelan bayi.Tingkat morbiditas paling rendah terdapat pada bayi-bayi yang mendapat ASI-eksklusif, dan ini terjadi pada semua tingkat sosial ekonomi di masyarakat (Sadeharju dkk, 2007; Raisler dkk, 1999). Efek proteksi ASI lebih nyata pada bayi-bayi yang tinggal di permukiman yang padat penduduknya dan berhubungan dengan banyaknya ASI yang diminum. Terbukti setelah pemberian ASI terhenti, tingkat kejadian diare tidak berbeda antara bayi yang pernah mendapat ASI dengan bayi yang tidak pernah mendapat ASI (Quigley dkk, 2006). Kaitan antara tingkat kejadian diare dengan pemberian ASI-eksklusif telah dilaporkan oleh beberapa peneliti. Kejadian diare pada bayi yang berusia di bawah 4 bulan yang mendapat susu formula, 4 kali lebih besar dari pada bayi yang mendapat ASI-eksklusif. Kasus diare yang perlu dirawat setiap bulannya dapat dicegah sebanyak 53 % bila seluruh bayi mendapat ASI-eksklusif, dan 31% bila seluruh bayi mendapat ASI non-eksklusif (ASI disertai pemberian makanan lain) (Quigley dkk, 2007). Hal serupa juga ditemukan oleh Talayero dkk (2006), di 18 mana kasus diare yang perlu dirawat dapat dihindari sebanyak 30 % pada setiap penambahan bulan ASI-eksklusif dan dapat dicegah sebanyak 56 % bila seluruh bayi ditempat tersebut mendapat ASI-eksklusif. Tingkat survival kumulatif menurun tajam pada kelompok bayi yang tidak mendapat ASI-eksklusif, dibandingkan dengan kelompok bayi yang mendapat ASI-eksklusif walaupun hanya berlangsung kurang dari 4 bulan. Tingkat survival kumulatif tertinggi terdapat pada kelompok bayi yang mendapat ASI-eksklusif sampai usia 4-6 bulan (Talayero dkk, 2006). Untuk lebih jelasnya hubungan antara pemberian ASI dengan kejadian infeksi pada usia 0-1 tahun dapat di lihat pada grafik di bawah ini: Gambar 2.3. Kurva cumulative survival bayi dirawat karena infeksi berdasarkan pola pemberian ASI ( Talayero dkk, 2006). 19 Keterangan gambar : Terlihat perbedaan tingkat survival kumulatif antara kelompok bayi yang tidak mendapat ASI-eksklusif dengan yang mendapat ASI-eksklusif (FB= full breastfeeding). Penurunan kurva lebih tajam pada bayi yang tidak mendapat ASIeksklusif, menunjukkan adanya peningkatan risiko anak dirawat dengan masa menyusu yang lebih lebih singkat. Efek protektif ASI pada anak yang berusia < 1 tahun, kaitannya dengan penyakit infeksi yang memerlukan perawatan dan faktor lainnya adalah jumlah saudara yang lebih banyak yang tinggal serumah, serta memiliki berat lahir kurang dari 3 kilogram. Demikian pula dengan lamanya pemberian ASI-eksklusif, terdapat efek protektif sebesar 4,91 kali lebih besar pada anak yang mendapat ASI-eksklusif dari usia 0 bulan hingga 4-6 bulan, dibandingkan dengan anak yang tak mendapat ASI-eksklusif, dan sebesar 2,45 kali lebih besar dari anak yang mendapat ASI-eksklusif kurang dari 4 bulan (Talayero dkk, 2006). Tingkat pendidikan ibu yang relatif rendah, membawa dampak pada keterkaitan antara kekerapan pemberian ASI dengan tingkat kematian bayi akibat penyakit diare, seperti umumnya terjadi negara yang kurang berkembang (WHO, 2000). Pemberian ASI kaitannya dengan diare akut rotavirus telah dilaporkan oleh beberapa peneliti. Kejadian diare rotavirus pada bayi yang mendapat ASIeksklusif tidak jauh berbeda dengan yang mendapat ASI non-eksklusif yaitu 21,4 % pada bayi ASI-eksklusif, dan 20,4 % pada bayi yang masih mendapat ASI disertai makanan padat. Kemungkinan ASI yang didapat tidak memberi proteksi terhadap diare rotavirus, dan jumlah pemberian ASI yang sangat menurun ketika 20 pemberian makanan padat dimulai (de Wit dkk, 2003; Bucher dan Abei, 2006, Dennehy, 2008). Peneliti lain melaporkan, pemberian ASI-eksklusif dapat melindungi bayi dari penyakit diare rotavirus yang berat, tetapi pada usia di atas 1 tahun ketika pemberian ASI sangat menurun justru diare rotavirus labih banyak terjadi pada bayi yang masih mendapat ASI (Clemens dkk, 1993). 2.3. Mekanisme Terjadinya Diare Akibat Infeksi Rotavirus Rotavirus merupakan salah satu mikroba patogen penyebab infeksi pada traktus gastrointestinalis, dan merupakan penyebab utama penyakit gastroenteritis di dunia (Elliott , 2007). Virus memiliki sifat sebagai parasit yang obligat, di mana virus memerlukan sel inang untuk memproduksi protein, memodifikasi genom dalam proses replikasinya dan dalam propagasi virion agar memiliki sifat infeksius. Akibat dari propagasi tersebut adalah kerusakan sel inang yang menyebabkan terjadinya penyakit. Dalam proses replikasinya beberapa virus dapat menyebabkan infeksi laten sebagai hasil dari interaksi genom virus ke dalam sel inang, dan beberapa jenis virus dapat menimbulkan transformasi pada sel inang ( Heesemann & Hacker ,2002). Rotavirus termasuk dalam anggota keluarga virus Reoviridae, memiliki kapsid yang berbentuk icosahedral, berukuran 70 nm, dan tidak memiliki envelope. Tiga kapsid terluar terbagi menjadi sub unit kapsid yang membentuk gambaran seperti roda (rota= wheel). Kapsid tersebut berbentuk konsentris yang mengitari suatu genom dan terdiri atas 11 segmen RNA untai ganda di dalam lapisan inti. Masing-masing segmen mengkode satu jenis polipeptida untuk 21 membentuk 6 struktur protein dan 5 struktur nonprotein (Ludert dkk, 1986). Secara skematis bentuk rotavirus dapat dilihat pada gambar di bawah ini : Gambar 2.4. Susunan virion dan partikel rotavirus (dikutip dari Cunliffe dkk, 2002 dalam Rotarix, 2006 ; Alan Philips dikutip oleh Elliot, 2007). Rotavirus grup A yang merupakan golongan rotavirus yang paling banyak menginfeksi manusia, dapat dibagi menjadi dua berdasarkan jenis kapsid protein VP7 (viral protein-7) yang disebut sebagai tipe G, dan kapsid protein VP4 (viral protein-4) yang disebut sebagai tipe P. Jadi terdapat 15 tipe G dan 21 tipe P yang secara bersama-sama membentuk suatu kombinasi dan pada manusia yang terbanyak adalah tipe G1P(8), G4P(8) G2P(4), dan G3P(8) (Rahman dkk, 2003). 22 Tipe G2P (4) dan subgrup I berhubungan dengan penyakit diare yang lebih berat dan terjadi pada umur yang lebih tua dibandingkan dengan tipe G1P(8) / G4P(8) dan subgrup II (Cascio dkk, 2001). Distribusi serotipe rotavirus yang berhubungan dengan penyakit diare pada anak dapat dilihat pada gambar di bawah ini : Gambar 2.5. Distribusi serotipe rotavirus sebagai penyebab diare pada anak (dikutip dari Parashar dkk,1996). Keterangan : Berdasarkan serotipe virus, tipe G1P(8), merupakan penyebab terbanyak penyakit diare pada anak. Disusul berikutnya secara berturut-turut yakni tipe G2P(4), G4P(8), dan yang berada diurutan terendah adalah tipe G3P(8). VP4 (viral protein-4) dan VP7 (viral protein-7) adalah bagian dari struktur protein terluar dari rotavirus. VP4 membentuk tonjolan yang menyerupai spike (paku), merupakan bagian dari virus yang nantinya melekat pada sel inang, 23 dipecah oleh ensim tripsin menjadi VP8 (viral protein-8) dan VP5 (viral protein5).VP7 adalah suatu glikoprotein yang membentuk bagian terbesar kapsid luar dari rotavirus. Baik VP4 maupun VP7 dapat menginduksi terbentuknya antibodi yang bersifat neutralizing maupun protective. Antibodi neutralizing yang diinduksi oleh VP8 berfungsi menghambat perlekatan virus terhadap sel inang, sedangkan antibodi neutralizing terhadap VP7 menghambat virus melalui proses decapsidation (Ludert dkk, 2002). Masuknya rotavirus ke dalam sel epitel melalui suatu proses yang kompleks dan bertahap. Terjadi interaksi antara berbagai molekul protein yang berbeda dibagian permukaan partikel virus dengan berbagai macam molekul yang ada dipermukaan sel inang, yang bekerja sebagai reseptor. Molekul reseptor terdiri dari integrin dan protein heat shock yang berhubungan dengan domain mikro membran lemak dari sel (Lopez & Arias, 2004). Berbagai strain rotavirus bergantung pada adanya asam sialik pada permukaan sel, akan tetapi ini bukan suatu yang esensial. Strain yang lain memerlukan integrin alfa-2 beta-1. Dua interaksi awal dimediasi oleh bagian spike dari VP4, setelah melekat pada sel terdapat interaksi ketiga dengan integrin alfa-5 beta-3 dan protein heat shock 70. Interaksi ini barangkali penting bagi rotavirus untuk dapat menembus ke bagian dalam sel. Molekul dari sel inang yang berfungsi sebagai reseptor fungsionil terdiri atas kolesterol dan glikospingolipid yang kaya dengan domain mikro dari lemak. Pada keadaan di mana terjadi kekacauan dari struktur tersebut akan berpengaruh besar terhadap tingkat infektifitas dari rotavirus, menyebabkan penurunan tingkat infektifitas rotavirus (Arias dkk, 2002). 24 Integrin yang berfungsi sebagai reseptor memiliki beberapa jenis, salah satunya adalah integrin alfa-2 beta-2 menjadi media untuk melekatnya rotavirus strain variant nar3 yang resisten terhadap neuraminidase. Integrin VLA-2 tidak begitu responsible pada proses perlekatan maupun masuknya virus ke dalam sel, tetapi mungkin berperan pada tingkat pasca perlekatan virus pada sel (Zarate dkk, 2000; Ciarlet dkk, 2002). Konsentrasi ion kalsium berpengaruh terhadap keutuhan sruktur rotavirus pada tahap virus memasuki sel inang maupun pada saat replikasi virus di dalam lingkungan mikronya. Dengan menggunakan biakan sel, peningkatan kadar ion kalsium di dalam media biakan yang mencapai limakali lipat menyebabkan peningkatan titer dari semua strain virus yang ditest. Terjadi perubahan lingkungan residu triptofan ketika kadar ion kalsium meningkat, hal ini menyebabkan perubahan konformasi dari partikel virus yang mengindikasikan adanya efek ion kalsium terhadap infektifitas virus (Pando dkk, 2002). Infeksi terjadi bila kapsid bagian luar dari rotavirus mengalami proses destabilisasi dan terurai di dalam sitoplasma. Ludert dan kawan-kawan melaporkan proses ”destabilisasi” justru terjadi pada konsentrasi ion kalsium yang rendah. Demikian pula dengan melekatkan antibodi monoklonal pada kapsid VP7, proses decapsidation dapat dicegah sehingga infeksi tidak terjadi (Ludert dkk, 2002). Temuan dari beberapa peneliti lainnya menunjukkan bahwa melekatnya suatu antibodi monoklonal pada capsid VP7 secara tidak langsung dapat mencegah membran menjadi permeabel melalui inhibisi terlarutnya VP7. Seperti 25 diketahui VP7 adalah kapsid yang paling luar dari rotavirus, yang membentuk bangunan dasar dari virus yang berbentuk trimer. Infeksi dapat dihambat bila kapsid tersebut tetap utuh. Dengan meningkatnya afinitas ion Ca2+, proses disosiasi dari VP7 akan terhambat sehingga struktur kapsid tetap stabil (Dormitzer dkk, 2000; Ludert dkk, 2002). Almela dan kawan-kawan (1991) berdasarkan hasil penelitiannya terhadap virus polio membuktikan bahwa, suatu partikel virus dapat membentuk suatu susunan yang dapat menghambat terjadinya uncoating block yang membuat membran menjadi permeabel terhadap toksin yang dihasilkan virus. Kedua data itu menguatkan dugaan bahwa disassembly dari virion merupakan tahap yang diperlukan oleh virus yang tidak memiliki envelop seperti rotavirus untuk mencapai membran yang permeabel agar dapat melakukan penetrasi ke dalam sel inang (Cuadras dkk,1997 ; Liprandi dkk, 1997). VP5 yang merupakan salah satu kapsid rotavirus lainya, diduga secara langsung merusak membran sel inang yang di dahului dengan proses uncoating virion, dan karenanya virion dapat masuk ke dalam sitoplasma. Kemungkinan VP5 mengawali efflux ion Ca2+ dari pori endosom awal yang tidak permanen. VP5 memiliki 2 domain yaitu domain hidrophobic, yang diperlukan untuk pembentukan pori pada membran sel agar menjadi permeabel dan berhubungan dengan membran sel di bagian dalam. Sedangkan domain VP5 lainnya adalah Nterminal yang berfungsi sebagai media dalam hubungannya dengan membran sel dibagian ferifer. Jadi 2 domain dari VP5 memilki tempat melekat yang terpisah pada membran sel, yang berfungsi sebagai media, agar endosom (awal) permeabel 26 untuk memfasilitasi pelepasan bungkus virion dan masuknya virus ke dalam sel inang (Golantsova dkk, 2004). Penyakit diare sebagai akibat infeksi rotavirus dapat terjadi melalui berbagai mekanisme. Rotavirus melakukan replikasi pada epitel vilus usus halus, yang menyebabkan hilangnya sel-sel absorptif yang masih viabel. Keadaan ini menyebabkan terjadinya ketidakseimbangan antara fungsi penyerapan dan fungsi sekresi di daerah usus halus. Akan tetapi pada pemeriksaan invitro dengan menggunakan jaringan sel hewan coba menunjukkan, bahwa beratnya gejala diare akibat rotavirus tidak sebanding dengan tingkat replikasi virus dan perubahan histologi jaringan sel yang terinfeksi. Ini menunjukkan bahwa perlekatan virus saja pada sel tanpa adanya replikasi sudah cukup menginduksi timbulnya gejala diare. Penelitian lain yang serupa menunjukkan bahwa bila partikel virus sudah menembus membran sel, akan terjadi aktivasi jalur signal di dalam sel yang menyebabkan sekresi dari beberapa kemokin seperti interferon dan faktor kemotaktik tanpa adanya replikasi virus. Hal ini disebabkan oleh adanya zat yang menyerupai toksin yang diekskresi ketika terjadi kontak antara rotavirus dengan sel inang (Rollo dkk, 1999; Shaw dkk, 1995). Hasil penelitian ini didukung pula oleh hasil peneliti terdahulu, yang memperlihatkan bahwa rotavirus menghasilkan enterotoksin yang dapat merangsang sistem saraf enterik sehingga terjadi peningkatan sekresi air dan garam secara berlebihan ke dalam lumen usus (Mavromichalis dkk, 1977). Mekanisme terjadinya diare rotavirus (secara rinci) dimulai dengan, pertama rusaknya sel epitel yang melapisi permukaan dinding usus halus yang 27 fungsinya sebagai penyerap garam dan air yang berasal dari makanan. Hal ini berakibat buang air besar yang lebih sering atau diare cair tanpa adanya darah dan panas yang tidak begitu tinggi (Elliott , 2007). Sel enterosit yang rusak digantikan oleh sel sekretorik yang berasal dari kripte vilus usus halus yang kemudian mensekresi garam maupun air secara berlebihan ke dalam lumen usus (Mavromichalis dkk, 1977). Secara histologi perubahan pada jaringan sel akibat infeksi rotavirus ditandai dengan adanya akumulasi sel-sel enterosit yang mengalami vakuolisasi, apoptosis dan terjadinya proliferasi yang meningkat pada hari kesatu sampai hari ketujuh pasca infeksi. Semua proses tersebut menyebabkan vilus atrofi, disamping itu juga banyak sel yang hilang akibat proses apoptosis. Terjadi juga percepatan masa penggantian antar sel yang berakibat terbentuknya sel-sel epitel yang kurang terdeferensiasi yang kesemuanya berakibat pada penurunan fungsi absorpsi dari sel epitel intestinal (Boshuizaen dkk, 2003). Sebagian dari sel epitel yang melapisi permukaan dinding usus halus juga bersifat sebagai sel endokrin penghasil ensim disakharidase. Rusaknya sel epitel akibat invasi virus, menyebabkan kadar ensim disakharidase usus juga menurun dan pencernaan disakharida terganggu. Disakharida yang tidak tercerna akan menarik lebih banyak air sehingga terbentuk bolus ketika tiba di kolon dengan akibat diare osmotik (Kerzner dkk, 1977). Lundgren dkk (2000) menyimpulkan bahwa rotavirus menghasilkan enterotoksin yang dapat merangsang sistem saraf 28 enterik sehingga kadar kalsium di dalam sel meningkat dan keadaan ini akan menginduksi terjadinya diare sekretorik . 2.4. Sistem Kekebalan Mukosa Traktus Gastrointestinal Sistem pertahanan tubuh dibentuk, salah satunya adalah untuk melindungi diri dari serangan mikroorganisme patogen. Manusia yang tergolong sebagai organisme multiseluler memiliki sistem pertahanan tubuh yang bersifat nonspesifik yang muncul lebih awal, disebut juga innate immune system (sistem imun inat). Bila paparan mikroorganisme berlanjut, maka berkembang sistem pertahanan tubuh yang bersifat spesifik yang dikenal sebagai adaptive immune system (sistem imun adaptif). Kedua sistem imun tersebut bekerja dengan melibatkan berbagai komponen seluler maupun zat terlarut, komunikasi melalui jaringan kerja suatu substansi pengaturan zat terlarut yaitu sitokin, kemokin dan faktor komplemen serta berhubungan dengan reseptor yang ada pada sel (Heesemann , 2002). Sistem pertahanan mukosa usus menyangkut peran komponen seluler yang terdiri atas sel-sel limfoid maupun mieloid, yang muncul sebagai akibat paparan yang terus menerus oleh mikroba patogen di dalam lumen usus halus dan usus besar. Salah satu di antaranya adalah sel limfoid yang terkumpul di dalam jaringan limfoid mukosa yang disebut MALT (mucosa associated lymphoid tissue), merupakan bagian dari kompartemen sistem imun yang paling tinggi di dalam tubuh dan fungsinya tidak tergantung pada sistem imun sistemik. Secara anatomis MALT terdiri atas kompartemen mikro yaitu Peyer’s patches, kelenjar getah 29 bening mesenterikum, appendik, tonsil, adenoid dan kelenjar getah bening lainnya (Holmgren & Czekinsky , 2005). Kompartemen sistem imun lainnya adalah yang bersifat alamiah, terdiri atas cairan asam lambung, ensim protease, asam empedu, asam lemak rantai pendek dan laktoferin yang memiliki efek microbicidal. Terdapat pula lapisan musin yang tebal di permukaan membran mukosa epitel usus yang dapat membuat virus terperangkap di dalamnya, dan kemudian dihalau keluar oleh adanya gerakan peristaltik usus yang disebut sebagai proses immune exclusion. Musin juga mengandung zat-zat yang berguna untuk pertumbuhan jaringan usus yaitu pada pergantian sel epitel dan deferensiasi sel epitel usus (Levine-LeMoal & Servin, 2006). Di dalam lumen usus terdapat bakteri komensal (flora normal) yang dapat menghambat kolonisasi maupun invasi berbagai mikroorganisme patogen maupun toksin yang dihasilkannya. Flora normal tersebut memiliki fungsi microbicidal yaitu secara kompetitif mengambil nutrien yang juga dibutuhkan untuk pertumbuhan mikroba patogen yang masuk ke dalam saluran cerna. Flora normal usus juga memegang peran utama dalam menstimulasi perkembangan dan diferensiasi organ limfatik yang membentuk sistem pertahanan spesifik di mukosa traktus gastrointestinal. Khususnya flora normal yang berada di kolon mempunyai fungsi prebiotik yaitu sebagai penghasil vitamin K dan vitamin B-kompleks, dan beberapa sel lemak rantai pendek yang merupakan sumber energi bagi epitel kolon (Heesemann , 2002). 30 2.4.1. Sistem Imun Non-spesifik Antivirus di Mukosa Usus Secara pilogenetik sistem pertahanan tubuh yang paling purba adalah sistem imun nonspesifik, yang memiliki kemampuan mengenal dan merespon serangan mikroorganisme melalui suatu reseptor (Medzhitov, 2001). Pada mamalia ditemukan 10 anggota reseptor yang disebut sebagai toll like receptors (TLRs), yang dapat mengenal komponen mikroorganisme secara spesifik. Bila terjadi infeksi oleh mikroba patogen, akan terjadi aktivasi terhadap TLRs yang akan menginduksi respon inflamasi dan memicu berkembangnya sistem imun adaptif yang bersifat spesifik (Takeda & Akira , 2003). Jaringan usus adalah salah satu bagian dari saluran cerna yang selalu berhadapan dengan enteromikroflora yang bersifat patogen. Enteromikroflora patogen memiliki PAMPs (pathogen associated molecule patterns), yang merupakan ligand dari mikroba yang dikenal secara spesifik oleh reseptor dari sel inang. Proses pengenalan ini merupakan signal bagi sel-sel di usus yang terlibat dalam sistem kekebalan non spesifik (innate immunity) yaitu sel epitel, sel dendritik maupun sel M (microfold) yang mengekspresi suatu jenis reseptor yang merupakan bagian dari TLRs (Toll-like receptors). TLRs tersebut akan berikatan dengan PAMPs yang merupakan petanda dari suatu jenis patogen dan hal ini merupakan upaya dari sel inang dalam memelihara homeostasis di usus untuk mencegah terjadinya proses inflamasi (Abreu dkk , 2005). ASI merupakan media transmisi imunokompeten dari ibu ke bayi sebagai wujud adanya garis hubungan imunologis antara ibu dan bayi (Chirico dkk, 2008). TLRs dalam bentuk terlarut (soluble TLRs) terdapat di dalam ASI, plasma dan 31 sel monosit. TLRs ASI merupakan protein yang terdiri atas 83 dan 70 k DA sTLR2 yang diduga berasal dari sel epitel kelenjar mammaria yakni sel adiposit yang mengelilingi duktus mammarius maupun alveoli. Sedangkan yang ada di dalam plasma lebih banyak dalam bentuk 66-k DA sTLR2 yang boleh jadi berasal dari sel monosit dan dalam jumlah yang relatif kecil diproduksi oleh sel neutrofil (Kurt-Jones dkk, 2002). Produksi sTLR2 melibatkan beberapa proses yaitu endositosis reseptor pada permukaan sel, proses compartemen asam internal, pelepasan sTLR2 melalui eksositosis dan yang terakhir terkumpulnya sTLR2 di dalam pool intrasel. STLR2 dapat menghambat produksi sitokin oleh monosit yang distimulasi oleh lipopeptida, dan terbukti bahwa sensitifitas terhadap lipopeptida meningkat bila terjadi penurunan kadar sTLR2 . Hal ini menunjukkan bahwa sTLR2 memiliki kontribusi dalam pengaturan efesiensi respon imun alamiah terhadap mikroba patogen. Aktivitas inhibisi ini mungkin terjadi melalui interaksi antara sCD14 (molekul koreseptor) ataupun dengan CD14 yang terikat pada membran sel. Kemungkinan yang lain adalah sTLR2 mengalami hemodimerisasi dengan TLR2 di permukaan sel atau melalui terbentuknya decoy receptor yang akhirnya menurunkan efesiensi signal TLR2. Jadi ASI selain mengandung koreseptor sTLR2 tetapi juga sCD14 yang dapat mengatur signal TLR, dengan cara ini inflamasi lokal yang excessive pada usus neonatus akibat kolonisasi bakteri dapat dihindari (LeBouder dkk, 2003). Sistem imun nonspesifik menghambat infeksi virus dengan mencegah berlanjutnya replikasi virus. Pertama-tama virus diidentifikasi sebagai struktur 32 benda asing melalui petanda komponen dinding sel, sitoplasma maupun petanda yang ada di bagian genom dari virus tersebut, kemudian virus dilokalisir. Berbagai zat kemotaktik akan ditarik menuju tempat infeksi yang menyebabkan sel mast terdegranulasi sehingga terjadi pelepasan faktor vasoaktif. Salah satu diantaranya adalah histamin, mengakibatkan permeabilitas vaskular meningkat dan timbulnya reaksi inflamasi ditempat masuknya mikroba tersebut. Sekelompok protein didalam serum yang disebut sebagai komplemen juga berperan di dalam sistem imun nonspesifik, yang terdiri atas 20 macam protein yang bekerja sebagai sebuah cascade. Fungsinya adalah mengenali mikroba patogen pada tahap dini, mengeliminasi mikroba serta meregulasi respon imun selanjutnya yaitu respon imun spesifik (Heesemann , 2002). Antigen virus yang dapat bertahan dari perangkap musin maupun gerakan peristaltik usus, akan ditangkap oleh sel epitel khusus disebut sel microfold (sel M) yang terdapat di bagian lekukan tajam dari vili usus halus. Antigen virus diangkut menyebrangi barier mukosa, kemudian diproses dan dipresentasikan kepada sel dendritik yang ada di jaringan limfoid mukosa (Van Ginkel dkk, 2000). Partikel virus atau virion masuk ke dalam sel M melalui proses endositosis dan diproses di dalam vesikel sel M, setelah itu diambil oleh sel dendritik atau dikeluarkan lagi ke permukaan basolateral dari sel M. Dari sini virion tersebut menginvasi sel epitel usus halus lainnya atau difagositosis oleh makrofag serta dapat pula sampai di daerah saraf otonom usus halus (Nathanson , 2002). Antigen 33 virus dapat langsung diambil oleh sel dendritik melalui tight junctions (celah) antar sel epitel yang terbuka (Rescigno dkk , 2001). Sel dendritik merupakan sel antigen presenting cells (APCs) yang paling poten di dalam tubuh manusia, terdapat terutama di tempat yang potensial terpapar patogen yaitu mukosa. Terdapat beberapa subpopulasi sel dendritik, salah satunya CD11 b+ dapat menyajikan antigen virus pada sel T-CD4+, dan proses ini merupakan hal yang paling penting di dalam menghasilkan respon imun yang diperani oleh sel T-helper 1(Zhao dkk, 2003). Sel dendritik interstitial (sel dendritik yang masih imatur) mengambil antigen di jaringan nonlimfoid melalui reseptor imunoglobulin yaitu Ig-FcR atau reseptor scavenger. Reseptor Fc-alfa (CD89) bagian dari Ig-FcR, akan mengikat antigen secara selektif. Selanjutnya terjadi stimulasi molekul kostimulator CD86 maupun MHC-II (major histocompatibility complex II) di dalam plasma membran dan terjadi peningkatan produksi IL-10. Sel dendritik melalui reseptor Fc-alfa dapat pula mengikat IgA1 dan IgA2, seperti telah diketahui IgA merupakan imunoglobulin utama di dalam mukosa di mana sel dendritik banyak terdapat. Selanjutnya terbentuk IgA polimer kompleks yang mengalami internalisasi ke dalam sel dendritik dan mengaktivasi sel dendritik. Oleh karenanya diduga sel dendritik interstitial menggunakan reseptor Fc-alfa untuk menangkap antigen di daerah subepitel maupun mengikat imunoglobulin A (Geissmann dkk, 2001). Aktivasi sel dendritik juga terjadi dengan mengenal molekul mikroba melalui TLRs. Sel dendritik plasmacytoid (p-DC) memiliki kemampuan menskresi interferon (INF) tipe 1 sebagai respon terhadap infeksi virus pada saat 34 awal infeksi. Untuk mengaktivasi sel dendritik dibutuhkan lebih dari satu signal, yaitu signal yang dapat menstimulasi molekul TLRs, dan juga signal yang berasal dari molekul MYD88. Molekul MYD88 yang merupakan protein adaptor hasil interaksi dengan Toll/ IL-1 receptor (TIR) akan merekrut serin/threonin kinase domain death, IL-1R –associated kinase (IRAK) (Medzhitov, 2001 ; Asselin-Pasturel dkk, 2001). TLRs adalah reseptor yang terlibat di dalam sistem imun nonspesifik, dapat berasal dari protein humoral yang beredar di dalam plasma, reseptor endositik yang diekspresikan pada permukaan sel, dan reseptor-reseptor signal yang diekspresikan baik dipermukaan sel maupun di dalam sel. TLRs merupakan protein transmembran tipe 1 yang diberi nama berdasarkan atas pola ekspresi sel terhadap rangsangan mikroba tertentu, TLR3 sebagai salah satunya secara spesifik mengenal RNA virus untai ganda, terdapat pada sel dendritik Struktur TLRs terdiri atas domain ekstrasel dan domain sitoplasma yang berhubungan dengan reseptor IL-1(interleukin1) yang kemudian membentuk komplek signal dengan molekul MYD88, serin/Threonin –kinase yang selanjutnya menyebabkan aktivasi faktor transkripsi di antaranya nuclear factor-Kb (NF-Kb) dan c-Jun/ATF2/TCF. Setelah itu akan terjadi transkripsi beberapa gen sitokin dalam waktu yang cepat (Muzio dkk, 2000; Muzio dkk, 1997; Wesche dkk, 1997 ; Cao dkk, 1996). TLRs merupakan alat bagi sel inang untuk mencegah terbentuknya mutan dari mikroba patogen, sebagai sensor terhadap keberadaan patogen dengan memproduksi sitokin yang kemudian mengaktivasi cascade signal yang menghasilkan sintesa berbagai molekul proinflamasi (Medzhitov & Janaway , 35 1999). Pertautan TLRs dengan ligand yang dimiliki mikroba juga memicu sintesa sitokin imunoregulator, kemokin dan molekul stimulator. Salah satunya adalah TLR3, dapat mengenal virus yang memiliki RNA untai ganda melalui struktur poly I:C yang dimiliki oleh virus. TLR3 kemudian berikatan dengan molekul MYD88 untuk selanjutnya menginduksi sintesis IFN (interferon) tipe 1. Jadi yang berperan pada infeksi virus adalah TLR3 selain TLR9 (Lund dkk, 2003). Dalam rangkaian pengenalan ligand melalui TLRs yang dimiliki oleh sel dendritik akan dihasilkan interferon tipe 1 yang akan mengaktivasi sel NK (natural killer), untuk mencegah infeksi virus meluas sebelum respon imun adaptif terjadi. Sel NK mengenali patogen virus melalui suatu interaksi kompleks molekul yang spesifik yang dapat menghambat maupun mengaktivasi reseptor (Lee dkk,2001; Daniels dkk, 2001). Selama infeksi berlangsung, terjadi komunikasi dua arah antara sel dendritik dan sel NK, di mana sel dendritik menghasilkan sitokin (interferon) dan mengenal langsung patogen yang sangat diperlukan agar sel NK teraktivasi. Sel NK sebaliknya berpartisipasi mempertahankan populasi sel dendritik (Andrews dkk, 2003). Sel NK merupakan bagian dari sel limfosit di dalam pembuluh darah perifer. Jumlahnya mencapai 15 % dari seluruh sel limfosit, konsentrasinya terus meningkat dan mencapai kadar tertinggi di tempat masuknya antigen. Telah dibuktikan bahwa pada awal proses infeksi virus, ada subpopulasi sel NK yang dapat memproduksi IFN-gama yang kadarnya meningkat sampai lebih dari 80% dari biasa. Untuk dapat memusnahkan antigen, sel NK harus mampu mengenal secara selektif sel yang terinfeksi melalui NK-cel receptor disamping adanya 36 stimulasi dari sel yang tidak terinfeksi. Selain itu sel NK juga berfungsi sebagai surveillance terhadap sel asing yang tidak mengekspresi reseptor, mengaktivasi reseptor lainnya seperti integrin dan menjadi media bagi fungsi efektor dari sel limfosit melalui pelepasan sitokin (Daniels dkk, 2001). Reseptor sel NK yang disebut sebagai molekul LY49H, merupakan suatu membran protein yang terdiri atas C-type lectin yang mengandung immunoreceptor tirosin associated motif (ITAM). Telah dibuktikan bahwa molekul LY49H dapat mengikat ligand virus sitomegali (MCMV) yang menyebabkan sel NK teraktivasi dengan melepaskan IFN-gama dan perforin. Untuk mengaktivasi sel NK juga diperlukan signal ekstrinsik berupa pelepasan IFN tipe 1 dan IL-12 oleh sel dendritik. Jadi untuk mengaktivasi sel NK dibutuhkan sitokin yang dihasilkan oleh sel dendritik maupun pengenalan PAMPs melalui TLRs yang diekspresi oleh sel imun lainnya (Tabeta dkk, 2004). Sel NK yang telah teraktivasi melalui interferon ( INF ) gama yang dihasilkannya akan mengaktivasi kembali sel dendritik dan sel limfosit T. Pada tahap awal infeksi di mana respon imun spesifik belum terbentuk, sel NK akan membunuh sel yang terinfeksi atau memecah sel yang mengandung patogen, yang telah ditandai oleh antibodi alamiah yang disebut sebagai antibody-dependent cell-mediated cytotoxicity (ADCC) (Heesemann , 2002). Sel yang terinfeksi virus (sel dendritik) akan mensekresi interferon tipe 1 (INF-1), yang terdiri atas interferon alfa dan beta. Keduanya akan menghambat replikasi virus pada fase awal infeksi dan menimbulkan keadaan antiviral pada sel yang tidak terinfeksi. INF-1 juga meningkatkan ekspresi molekul MHC-I pada sel 37 yang terinfeksi sehingga mudah dikenal oleh sel limfosit tertentu untuk kemudian dihancurkan. INF–beta (dari sel dendritik) bersama INF-gama (dari sel NK) akan memacu sel untuk mengekspresikan molekul MHC-II untuk mencegah berlangsungnya pembelahan sel. Sedangkan INF- alfa (dari sel dendritik) menstimulasi aktivitas sel T dan sel NK-sitotoksik yang akan menghambat terbentuknya antibodi pada awal-awal infeksi (Nathanson , 2002). Pada infeksi virus, antibodi terbentuk setelah infeksi berlangsung lama, di mana sel NK yang telah teraktivasi melalui INF-gama yang telah dihasilkan akan merangsang terbentuknya antibodi. Proses tersebut diawali dengan sel NK mengenali sel yang terinfeksi oleh virus yang sedang mengekspresikan molekul MHC-I. Secara rinci bagaimana sel yang terinfeksi menghasilkan interferon dan mekanisme kerja sistem interferon dapat dilihat pada gambar dibawah ini : Gambar 2.6. Sistem Kerja Interferon (dikutip dari Nathanson , 2002). 38 Secara rinci produksi interferon oleh sel yang terinfeksi dapat digambarkan sebagai berikut : Gambar 2.7. Produksi Interferon oleh Sel yang Terinfeksi (bhn kuliah ”Imunologi klinik” S3 tahun 2007, 2004 New Science Press Ltd). 2.4.2. Sistem Imun Spesifik Antivirus di Mukosa Usus. Sistem imun spesifik akan mulai bekerja setelah respon imun nonspesifik tidak mampu memusnahkan semua antigen yang telah menginfeksi sel. Dikhawatirkan bila proses berlanjut maka gejala penyakit maupun kerusakan yang diakibatkan lebih berat dan dapat menimbulkan kematian. Hal ini terjadi bila jumlah sel yang terinfeksi cukup banyak sebelum respon imun yang spesifik terjadi. Oleh karena itu semua komponen imun bergerak yang dimulai oleh sistem imun nonspesifik, dilanjutkan oleh bekerjanya sistem imun spesifik (Nathanson , 2002). Ketika tubuh manusia terinfeksi oleh virus maka respon pertama yang timbul adalah terbentuknya keadaan antiviral pada sel yang terinfeksi, yang bertujuan mencegah replikasi virus dan memberi signal untuk mengatur respon 39 imun adaptif melalui terbentuknya interferon tipe1 (IFN-1) (Levy & GraciaSastre, 2001). Sistem imun adaptif terdiri atas sistem imun humoral dan sistem imun seluler, masing-masing diperankan oleh sel limfosit B dan sel limfosit T. Sistem imun humoral di dalam sistem pertahanan mukosa diperani oleh imunoglobulin A tipe sekretorik (sIgA) dan bekerja lebih awal saat virus masih berada di luar sel. Bila virus berhasil masuk ke dalam sel, komponen imunitas seluler dalam hal ini sel limfosit T dengan dua subpopulasi sel yang dimiliki yaitu sel T-CD4+ dan sel T-CD8+ mulai bekerja. Keduanya dibedakan berdasarkan atas jenis molekul MHC (major histocompatibility complex) yang diekspresikan pada permukaan selnya. Sel T-CD4+ mengekspresikan molekul MHC-II di mana dalam menjalankan fungsinya akan berinteraksi dengan sel limfosit B naïve maupun sel T-CD8+. Interaksi ini menimbulkan signal yang menginduksi sel limfosit B dan sel T-CD8+ berploriferasi sebagai respon terhadap antigen yang dipresentasikan oleh sel antigen presenting cells (APCs) (Nathanson, 2002). Sistem pertahanan imun seluler mukosa di jaringan usus halus diperani oleh sel T-CD8+ yang terdapat di jaringan limfoid intraepitel usus halus yang memiliki sifat spesifisitas terbatas. Sel imun yang lainnya berada di daerah lamina propria yang terdiri atas campuran dari berbagai jenis sel imun, tetapi yang terbanyak adalah sel T-CD4+ yang memiliki fenotif sebagai sel yang aktif. Disamping itu terdapat sejumlah besar sel limfosit B yang aktif, sel plasma, makrofag, sel dendritik, eosinofil dan sel mast (Abbas & Lichtman, 2005). 40 Seperti telah diuraikan sebelumnya, antigen virus yang telah berhasil menginfeksi sel-sel di jaringan usus halus akan diproses oleh sel M dan kemudian diambil oleh sel dendritik, dan selanjutnya diolah lagi sebelum akhirnya dipresentasikan kepada sel B. Agar dapat merangsang sistem imun, antigen akan terikat pada reseptor yang ada pada sel limfosit B, yang menyebabkan sel B mengalami maturasi menjadi sel plasma dan akan memproduksi antibodi yang bersifat spesifik. Antigen juga dapat menempel pada reseptor yang dimiliki bersama oleh sel T dan sel antigen-presenting cells (APCs) dalam hal ini sel dendritik yang merupakan rangkaian awal dari reaksi imun seluler. Sel limfosit B dan T yang telah teraktivasi akan memacu ekspansi klonal dari kedua sel tersebut yang sebagian terjadi di tempat masuknya mikroba dan sebagian lagi di jaringan limfatik yang berperan sebagai immunological memory. Sel-sel imun yang dihasilkan oleh kedua sel limfosit tersebut akan bergerak ke lokasi infeksi jika diperlukan (Heesemann, 2002). Sel limfosit B yang sudah berubah menjadi sel plasma akan menghasilkan antibodi yang bersifat neutralizing maupun opsonizing, yang hanya efektif untuk mengeliminasi virus selama berada di luar sel inang. Sifat netralisasi dari antibodi dimaksudkan untuk menetralisir antigen virus yang memiliki sifat merusak sel (efek sitopatik), sedangkan fungsi opsonisasi adalah agar partikel virus mudah dibersihkan oleh sel fagosit. Telah diketahui bahwa proses fagositosis juga didukung oleh sistem komplemen yang mungkin secara langsung berperan dalam memecah envelope yang dimiliki oleh virus (Abbas & Lichtman, 2005). 41 Antibodi sIgA yang dihasilkan oleh sel limfosit merupakan antibodi utama yang berperan di dalam sistem imun lokal di jaringan usus halus. Memiliki kemampuan mengaglutinasi agen infeksi dan memfasilitasi proses klirens mikroba tersebut melalui gerakan peristaltik dan gerakan mukosilier usus halus (Mestecky dkk,1999). Selain itu sIgA juga melekat secara selektif pada sel M, ikut terangkut bersama antigen yang dibawa oleh sel M dan selanjutnya masuk ke dalam sel dendritik (Corthesy, 2007). Sel M adalah sel epitel yang memiliki bentuk berbeda yang melapisi bagian permukaan dari kelejar Peyer’s patches (PP), fungsinya membawa antigen yang ada di lumen usus ataupun yang melekat pada sel M, terangkut pula sIgA bersamanya yang kemudian mengalami internalisasi ke dalam sel dendritik (DC) yang dimediasi oleh IgA moiety. S-IgA yang terbawa bersama sel M maupun sel DC akan memudahkan pengambilan antigen berikutnya oleh sel M, dan memicu migrasi sel DC ke dalam PP yang kaya akan sel limfosit T.Selanjutnya akan terjadi pengaturan ekspresi sel T-CD80 dan T-CD86 di dalam PP, kelenjar getah bening mesenterikum dan limpa. Ini memperlihatkan fungsi sIgA di dalam penyebaran antigen di dalam jalur efektor dari kompartemen mukosa usus (Rey dkk, 2004 ; Favre dkk, 2005). Untuk lebih jelasnya bagaimana sistem imun di mukosa usus bekerja, dapat dilihat pada gambar di bawah ini : 42 Gambar.2.8. Proses Antigen menginduksi respon imun di usus halus (dikutif dari Corthesy, 2007). Keterangan : 1. Di jaringan GALT (gut associated lymphoid tissue), mikroorganisme ditangkap oleh sel M, disajikan kepada sel DC yang masih imatur di regio sub-epitel dome (SED). 2. Dengan membesarkan ukurannya sel DC langsung menangkap antigen (Ags) yang ada di dalam sel epitel dan selanjutnya antigen tersebut disajikan ke pada sel T yang masih naïve di dalam saluran kelenjar getah bening bagian proksimal. 3. Terjadi aktivasi dan migrasi dari sel DC, yang dipengaruhi oleh signal yang berasal dari antigen (makanan, bakteri patogen / komensal, virus, toksin). 43 4. Sel plasma yang berada di dalam lamina propria (LP), akan memproduksi IgA-polimer yang kemudian di sekresi sebagai sIgA. Antibodi antiviral yang paling berperan di mukosa usus adalah IgA. Hal ini terlihat jelas pada penelitian yang menggunakan backpack tumor, di mana IgA (bukan IgG) efektif mencegah diare rotavirus pada hewan coba tikus. IgA yang telah dihasilkan di jaringan mukosa usus akan tersimpan di domain basolateral dari sel epitel, melalui proses transitosis selanjutnya masuk ke domain apical sel epitel usus (Ruggeri dkk, 1991). IgA adalah antibodi yang berbentuk dimer tersimpan di dalam sel basal, diubah menjadi s-IgA melalui penambahan komponen sekretorik yang kemudian disekresi ke dalam lumen usus atau ke bagian apeks dari epitel mukosa usus. S-IgA memiliki sifat resisten terhadap ensim pencernaan sehingga dapat mengikat agen infeksi maupun toksin yang menginvasi lumen maupun mukosa usus. Fungsi sIgA secara keseluruhan dapat digambarkan sebagai berikut : 44 FUNGSI IgA PADA SISTIM IMUN MUKOSA USUS (Kaetzel CS, dalam Proc.Natl.Sci. USA, 1991; 88: 8796-8800) IgA IgA-monomer oleh Limfosit dlm sumsum tulang disekresi ke sirkulasi darah IgA polimer oleh Sel epitel kelenjar Mammaria sIgA IgA polimer oleh sel plasma di Lam.propria mukosa usus + rantai J + pIgR di epitel mukosa Kapiler Villi usus halus Difusi ke lamina propria mukosa usus halus tak dapat masuk ke Peyer‟s Patches. Lumen Usus halus Lumen Usus sIgA + Ag Excresi ke dlm feses Epitel mukosa sIgA+Sel M+Ag Kompleks imun intraseluler Sel APC dlm PP Sel B, sel T Gambar.2.9 Fungsi IgA pada imun lokal di mukosa usus halus (Kaetzel, 1991). 2.5. Mekanisme Kerja ASI Sebagai Pembawa Kekebalan Pasif Sistem pertahanan imun pada fetus dan neonatus masih imatur sehingga mudah terserang infeksi. Terdapat IgG maternal yang ditransfer lewat plasenta yang bekerja di jaringan (Hanson dkk, 1985). Pemberian ASI merupakan sarana untuk mempertahankan link imunologis antara ibu dengan bayi sesaat setelah bayi lahir (Chirico dkk, 2008). Kelenjar mamaria yang merupakan bagian yang terintegrasi dalam sistem imun mukosa, akan menghasilkan antibodi terutama imunoglobulin sekretorik A(sIgA) sebagai hasil dari stimulasi antigen terhadap jaringan limfoid mukosa 45 pada saluran nafas dan saluran cerna ibu. S-IgA yang dihasilkan memiliki sifat spesifik terhadap patogen yang menginvasi saluran cerna bayi (Telemo & Hanson, 1986). Jadi sIgA bersama komponen imun ASI lainnya ditargetkan untuk mencegah infeksi terutama pada saluran cerna bayi. S-IgA ASI bekerja sebagai immune exclusion, dan membatasi kerusakan jaringan akibat inflamasi yang menguras energi(Kaetzel 1991, LeBouder dkk, 2003). Laktoferin dan oligosakharida yang ada di dalam ASI, berfungsi sebagai reseptor analog terhadap mikroba dan mencegah perlekatannya pada mukosa yang merupakan tahap awal dari proses infeksi (Hanson dkk, 2002; Brandtzaeg, 2003). Terdapat pula zat yang memiliki efek prebiotik yang dapat mendukung kolonisasi flora normal di dalam usus dan oleh karenanya dapat mengurangi koloni bakteri patogen pada jaringan usus (Newburg, 2000). ASI dapat berfungsi sebagai imunomodulator, ini terbukti dari ukuran kelenjar timus bayi yang mendapat ASI (eksklusif) lebih besar dibandingkan dengan yang mendapat ASI (non-eksklusif) maupun yang tidak mendapat ASI (Hasselbach dkk, 1996). Sejumlah protein di dalam ASI memiliki aktivitas sebagai antimikroba dan sebagai imunostimulator, di antaranya dalam bentuk sitokin berpengaruh terhadap menurunnya insiden infeksi pada masa bayi khususnya pada masa neonatus (Chirico dkk, 2008). Juga terdapat “miRNA” yang dapat meregulasi molekul di dalam sel maupun komunikasi antar sel dan jumlahnya mencapai 1,3 kali 10 pangkat 7 copi/liter ASI pada masa 6 bulan pertama laktasi (Kosaka dkk, 2010). Terdapat berbagai vitamin yang larut dalam lemak maupun asam lemak esensial yang memiliki aktivitas biologis kuat untuk 46 mengatur berbagai proses di dalam sel dan jaringan (Koletzko & RodriguezPalmero, 1999). Antibodi sIgA merupakan elemen imun utama ASI bekerja di garis terdepan dalam sistem pertahanan di mukosa usus, dengan menghambat kolonisasi dan ataupun pertumbuhan patogen (Newburg, 2000). Pada bayi baru lahir produksi antibodi sIgA oleh sel Paneth di daerah kripte usus halus belum optimal, demikian pula IgA yang berasal dari serum baru dapat diukur pada minggu ke 2-3 setelah lahir. Bila terjadi infeksi pada jaringan mukosa terdapat aliran IgMsekretorik dari kelenjar eksokrin membran mukosa (Kesarwala dkk, 1988). S-IgA ASI diproduksi oleh sel sekretorik yang ada di kelenjar mammaria ibu pada masa laktasi. Selama hamil dan masa laktasi, sel limfosit B yang telah tersensitisasi (IgA+B-lymphocyte) akibat paparan antigen sebelumnya mengumpul di kelenjar mammaria dan memproduksi IgA spesifik (Goldman dkk, 1998). Struktur molekulnya berbentuk dimer yang tersusun dari 2 pasang rantai ringan dan rantai berat yang diikat oleh rantai J. Sensitisasi sel limfosit B terutama terjadi di jaringan saluran nafas maupun saluran cerna ibu yang selanjutnya bermigrasi melewati aliran getah bening dan masuk ke dalam sirkulasi darah, dan akhirnya tiba di kelenjar mammaria. Kedua jalur migrasi sel limfosit B disebut sebagai jalur bronchomammaria dan enteromammaria. Sel limfosit B kemudian berdeferensiasi menjadi sel plasma dan siap memproduksi sIgA yang selanjutnya di skresi ke dalam ASI (Telemo & Hanson, 1996; Hanson dkk, 2002). Antibodi jenis lain yang juga dikandung ASI adalah IgM, IgG dan jenis antibodi lainnya, akan tetapi jumlahnya sangat sedikit dibandingkan sIgA yang mencapai 47 >90 % dari jumlah seluruh imunoglobulin ASI (Rojas & Apodea, 2002).Adanya jalur migrasi IgA+B-lymphocyte seperti tersebut di atas, diduga hal ini sebagai alat transfer zat protektif yang bersifat spesifik dari ibu ke bayi (Goldman dkk, 1998). Kolostrum adalah ASI yang keluar pada saat bayi baru lahir hingga berusia 7-9 hari. Dibandingkan dengan ASI yang keluar sesudah itu (ASI matur), kolostrum memiliki kandungan sIgA paling tinggi dan pada manusia mencapai >1 g/l ASI (Wold & Hanson, 1994). Kadar sIgA ASI berkisar antara 5,0-7,5 mg/dl, dan ibu yang menyusui secara eksklusif maka pada 4 bulan pertama bayi akan mendapat sIgA sebanyak 0,5 g sIgA/hari atau sekitar 75-100 mg/kgBB/hari. Konsentrasi sIgA yang tinggi dipertahankan sampai tahun kedua masa laktasi (Akib dkk, 2008). Terdapat pula sel limfosit B dalam jumlah > 10 % dari jumlah sel lekosit yang telah termedikasi di dalam ASI (Wold & Adlerberth, 1998). Musin yang terkandung di dalam ASI-kolostrum dapat menjadi perangkap bagi virus dan karenanya memberi kontribusi dalam memperpendek masa infeksi maupun menurunkan insiden infeksi (Yolken dkk, 1992; Ikeda dkk, 1998). Salah satu jenis musin yaitu laktaderin merupakan suatu glikoprotein dengan berat molekul 46 kDa, akan menempel pada reseptor rotavirus di jaringan usus halus bayi, dapat mengikat dan menghambat replikasi rotavirus dan bersifat dose dependent (Newburg dkk, 1998; Yolken dkk, 1992). Komponen ASI-kolostrum yang juga penting adalah sel neutrofil dengan bentuk molekul CD15+ mengekspresi reseptor IgA-Fc (Fc-alfa R, CD89) yang 48 dapat mengikat sIgA, tetapi tidak memiliki rantai gama sehingga aktivitas mikrobisidalnya lemah. Namun 70% dari sel neutrofil ASI menahan sIgA baik dipermukaan sel maupun di dalam selnya. Terhadap kekurangan ini diduga fungsi neutrofil ASI berperan pada proses non inflamasi dengan berfungsi sebagai alat transport sIgA (Honorio-Franca dkk, 2001). Telah diuraikan di atas bahwa sIgA dari ASI merupakan elemen imun ASI yang paling berperan di dalam garis pertahanan terdepan di saluran cerna pada bayi yang menyusu, karena memiliki efek protektif yang paling kuat. Telah dibuktikan pula bahwa sIgA ASI bersifat efektif dalam sistem pertahanan mukosa baik terhadap bakteri, virus antara lain rotavirus dan respiratory syncitial virus (RSV) (Goldman, 1993). S-IgA dapat menetralisir agen infeksi dan pada waktu yang sama membatasi kerusakan jaringan akibat proses inflamasi (Schandler, 2000 ; Labbok dkk, 2004). Elemen antiinfeksi lainnya pada ASI adalah berbagai jenis protein, di antaranya adalah laktoferin, lisosim, laktaderin, anti protease, dan komplemen. Laktoferin disebut juga iron glycoprotein, dapat megikat zat besi sehingga ketersediaan zat besi untuk pertumbuhan bakteri menjadi berkurang. Dalam bentuk lactoferricin yang merupakan hasil enzymatic cleavage dari laktoferin, dapat meningkatkan permeabilitas membran sel sehingga dapat mengikat bagian lipid dari lipopolisakharida yang dimilki bakteri. Efek serupa juga ditunjukkan terhadap virus, jamur dan protozoa. Efek antiviral dari laktoferin adalah pada infeksi fase awal yaitu sebagai reseptor virus sehingga perlekatan virus pada sel inang terhalang (Orsi, 2004). 49 Terdapat beberapa faktor yang berpengaruh terhadap produksi ASI, di antaranya adalah usia ibu, paritas, dan status gizi ibu. Seorang ibu yang berusia lebih tua dan atau jumlah paritas yang lebih banyak, memiliki ASI dengan berat jenis yang lebih rendah. Kadar sIgA dipengaruhi oleh berat jenis ASI dan konsentrasi sIgA tetap stabil saat bayi berusia 8-52 minggu. Kondisi lingkungan juga berpengaruh terhadap kadar sIgA-ASI. Pada saat makanan berlimpah kandungan sIgA lebih tinggi dibandingkan ketika musim paceklik. Keadaan ini ditemukan pada ibu-ibu yang tinggal di Gambia (Weaver dkk, 1998). Hal yang berbeda ditemukan pada penelitian sebelumnya, di mana kadar sIgA ASI para ibu di Gambia lebih tinggi pada ibu yang berusia lebih muda dan atau dengan jumlah kehamilan yang lebih sedikit (Prentice dkk, 1983). Henart dan kawan-kawan menyimpulkan bahwa perbedaan tersebut mungkin dipengaruhi oleh lingkungan setempat. Dilaporkan pula bahwa kadar sIgA-antimikrobial ASI ibu-ibu yang tinggal di Zaire lebih tinggi pada ibu multipara, diduga ini sebagai hasil dari pengalaman kehamilan sebelumnya (Henart dkk, 1991). Tentang produksi ASI yang berkaitan dengan status gizi ibu, akan ada pengaruhnya apabila seorang ibu menderita malnutrisi berat dan berkepanjangan yang dapat mempengaruhi kandungan beberapa zat yang terdapat dalam ASI (Diunduh dari http://familiedyka.multiply.com/journal/item/89/Tulisan Seputar Gizi Ibu Menyusui dan Pe…5/13/2008). Perbedaan status gizi antara ibu-ibu di Zaire yang tinggal di perkotaan dengan yang tinggal di pedesaan tidak berpengaruh langsung terhadap kandungan sIgA-antimikrobial di dalam ASI-nya. Kekerapan menyusui pada ibu-ibu yang tinggal di perkotaan lebih tinggi 50 dibandingkan dengan yang tinggal di pedesaan, karena ibu di pedesaan lebih lama bekerja di luar rumah. Ini berakibat terhadap perbedaan jumlah antibodi sIgA-ASI yang ditelan oleh bayi (Hennart dkk, 1991). 2.6. Pemberian ASI, ASI-eksklusif hubungannya dengan diare akut rotavirus. Seperti telah banyak disinggung sebelumnya bahwa, ASI yang merupakan makanan alamiah utama pada bayi yang berusia 0-6 bulan, juga memberi proteksi terhadap penyakit infeksi utamanya penyakit diare yang masih merupakan masalah kesehatan pada anak di negara berkembang. Pada ASI terdapat elemen imun baik yang bersifat antigenik spesifik maupun perannya pada respon umum secara general (Harsono, 1995; Morrow & Rangel, 2004). Pemberian ASI-eksklusif sejak lahir sampai usia 6 bulan seperti dianjurkan oleh WHO, terbukti dapat menurunkan angka mortalitas dan morbiditas penyakit infeksi terutama pada anak yang berasal dari negara berkembang dan tinggal di permukiman padat (WHO, 2001; Quigley dkk, 2006). Demikian pula kaitannya dengan tingkat survival kumulatif pada penyakit infeksi pada usia < 1 tahun, tertinggi pada bayi yang mendapat ASI-eksklusif sejak berusia 0-4/6 bulan dibandingkan dengan bayi yang tidak mendapat ASI-eksklusif maupun menerima ASI-eksklusif sampai usia kurang dari 4 bulan. Jadi bayi yang masa menyusu eksklusif lebih pendek lebih tinggi risikonya menderita penyakit infeksi (Talayero dkk, 2006). 51 Rotavirus merupakan mikroba penyebab dari 20-80 % penyakit diare pada anak di dunia (Breese dkk, 2004), sedangkan data dari 6 rumah sakit besar di Indonesia menunjukkan 55 % kasus diare akut pada balita disebabkan oleh rotavirus (Soenarto dkk, 2009). Di rumah sakit Sanglah dari laporan surveillance rotavirus memperlihatkan bahwa sebaran penyakit diare pada bayi meningkat yang sejalan dengan menurunnya tingkat pemberian ASI (Surveillance Rotavirus, 2007). Diare akut rotavirus memberi dampak berupa kematian yang tinggi pada anak usia <5 tahun yaitu 1 dari 500 anak dari negara berpenghasilan rendah (Parashar dkk, 2003). Diare rotavirus dapat menyerang anak usia dini, selain menyebabkan kematian juga komplikasi berupa dehidrasi dan gangguan gizi, lebih berat dari pada penyakit diare yang disebabkan oleh bukan rotavirus (Nguyen dkk, 2004). Di daerah tropis infeksi rotavirus terjadi sepanjang tahun, terutama menyebar melalui jalur fecal-oral, selain melalui saluran nafas maupun kontak langsung (Elliot, 2007). Bagian dari rotavirus yang pertama melekat pada sel inang adalah viral protein (VP) 4 yang memiliki tonjolan menyerupai paku (spike), sebagai proses awal untuk terjadinya infeksi. Terdapat pula VP-7 yang merupakan bagian terbesar dari bangunan luar kapsid rotavirus. VP-4 dan VP-7 dapat menginduksi terbentuknya antibodi yang bersifat neutralizing dan protective. Hasil percobaan secara invitro menmperlihatkan bahwa antibodi monoklonal yang dilekatkan pada VP4 dan VP7 dapat mencegah partikel rotavirus terurai dan dengan demikian infeksi tak akan terjadi (Ludert dkk, 2002). 52 Komponen imun yang ada di dalam ASI merupakan respon terhadap invasi mikroba pada saluran nafas dan saluran cerna ibu pada masa laktasi (Telemo & Hanson, 1996), memiliki sifat spesifik terhadap mikroba yang menyerang saluran nafas maupun saluran cerna bayi (Hanson dkk, 2002; Chirico dkk, 2008). Hasil penelitian terdahulu menunjukkan bahwa hampir 30 % wanita yang melahirkan di salah satu rumah sakit Umum di New York pernah terinfeksi rotavirus grup C dan kekebalan ini dipindahkan kepada bayinya yang dibuktikan dengan terdapatnya IgG-antirotavirus pada darah talipusat bayi yang dilahirkan (Riepenhoff-Talty dkk, 1997). Penelitian terhadap wanita pada masa post partum di suatu rumah sakit di Jerman menunjukkan, 40 % dari kolostrumnya mengandung antibodi sIgA-antirotavirus (Brussow dkk, 1991). Suatu penelitian yang diadakan di rumah sakit di Melbourne terhadap ibu postpartum bersama bayi pasangannya menunjukkan adanya peningkatan kadar IgG dan IgA serum yang spesifik terhadap rotavirus sejalan dengan bertambahnya usia dan paritas. Keadaan ini memiliki korelasi positif dengan titer IgGantirotavirus pada serum darah talipusat bayi yang dilahirkan. Sedangkan pada kolostrum maupun ASI matur ditemukan sIgA yang spesifik terhadap rotavirus hampir pada semua ibu yang diteliti dan ini juga ditemukan pada feses bayi yang mendapat ASI walaupun kadar sIgA yang spesifik terhadap rotavirus ASI rendah (McLean & Holmes, 1980). Pada bayi usia dini (<6 bulan ) sistem imun endogen belum bekerja secara optimal. S-IgA yang berasal dari produksi lokal di jaringan usus halus belum berfungsi secara optimal untuk melindungi bayi dari infeksi (Kesarwala dkk, 1988 53 ). IgA yang dihasilkan oleh sumsum tulang masuk ke dalam sirkulasi darah villi usus halus tetapi tidak bisa menembus kelenjar getah bening usus tempat antigen di proses. S-IgA yang berasal dari ASI masuk kedalam usus halus akan mengikat antigen (rotavirus) yang masih berada di lumen usus halus. Bila beban virus melebihi kemampuan mengikat dari sIgA yang ada di lumen usus halus, maka antigen virus yang bebas akan menempel pada sel enterosit usus (Kaetzel, 1991). Sebagian dari sIgA-ASI akan berikatan secara selektif dengan sel M yang melapisi permukaan kelenjar Peyer patches di mukosa usus halus, bersama pula antigen virus yang telah ditangkap oleh sel M untuk kemudian membentuk kompleks imun intraseluler (Kaetzel, 1991). Komplek imun yang terbentuk selanjutnya masuk ke dalam sel dendritik, diolah dan disajikan kepada sel lmfosit T dan B yang ada di dalam kelenjar Peyer patches (Mestecky, 1999; Corthesy, 2007). Hasil percobaan dengan menggunakan jaringan backpack tumor yang berasal dari tikus, memperlihatkan bahwa yang dapat mencegah penyakit diare rotavirus adalah imunoglobulin s-IgA (bukan IgG) (Ruggeri dkk, 1991). Secara skematis tergambar seperti di bawah ini : 54 Bagan: Peran sIgA – ASI kaitannya dengan infeksi rotavirus IgA polimer oleh sel epitel kel.mamaria ibu Rotavirus Ab.sIgA antirotavirus ASI Lumen Usus Ab.sIgA antirotavirus ASI berikatan dgn Ag rotavirus Proses Immune exclusion Faeces Sel enterosit usus halus, Sel M + sIgA antirotavirus ASI + Ag rotavirus Kompleks imun intra seluler Sel DC Sel T, Sel B dalam PP & KGB lainnya 55 BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN 3.1. Kerangka Berpikir Diare masih merupakan penyakit yang banyak diderita oleh anak yang berusia < 1 th dan salah satu penyebabnya adalah adanya imaturitas pada sistim imun. Adanya imaturitas pada sistim imun mukosa, menyebabkan bayi mudah terinfeksi oleh mikroba patogen yang menyerang jaringan usus halus. Data yang dilaporkan oleh WHO dan beberapa peneliti lainnya menunjukkan bahwa, diare akut yang disebabkan oleh infeksi rotavirus merupakan kasus terbanyak pada anak di bawah 2 tahun, dan 46,3 % dari kasus tersebut terdapat pada anak yang berusia di bawah 1 tahun. Pemberian ASI-eksklusif, telah terbukti sangat berhubungan dengan menurunnya kejadian diare yang disebabkan infeksi pada bayi. Keterkaitannya lebih jelas terhadap penyakit diare yang disebabkan oleh bakteri seperti kholera dan E.coli, walaupun tak dapat mencegah infeksi asimtomatis. Sedangkan hubungannya dengan kejadian diare yang disebabkan oleh rotavirus, berdasarkan beberapa laporan dari para peneliti hasilnya masih kontroversial. Salah satu laporan menunjukkan bahwa pemberian ASI-eksklusif dapat mencegah terjadinya penyakit diare rotavirus yang berat, namun tidak berpengaruh ketika pemberian ASI menurun. Peneliti lain menyimpulkan bahwa tingkat proteksi ASI berhubungan dengan dosis harian (eksklusivitas) pemberian ASI. 55 56 Antibodi antiviral yang paling berperan di mukosa usus adalah IgA sekretorik, dan s-IgA yang ada di dalam ASI merupakan antibodi sebagai respon terhadap paparan mikroba patogen pada saluran cerna dan saluaran nafas ibu pada masa laktasi. S-IgA ASI bersifat spesifik terhadap mikroba patogen yang masuk ke dalam saluran cerna bayi. 3.2. Kerangka Konsep Penelitian Berdasarkan kajian pustaka dan permasalahan yang dihadapi, maka disusun suatu kerangka konsep penelitian seperti gambar di bawah ini: Ibu : Faktor Internal : Usia Paritas Status gizi Faktor Eksternal : Tk.Pendidikan Jenis Pekerjaan Higiene perorangan AIR SUSU IBU : ASI eksklusif ASI non eksklusif Mengandung Ab.sIgA antiRV Tidak mengandung Ab.sIgA antiRV antirotavirus TERPAPAR ROTAVIRUS Faktor Internal : Usia Jenis kelamin Status gizi Faktor Eksternal : Jumlah saudara BAYI : 1-6 bln, menyusu Diare Akut Rotavirus : Risiko diare Lama diare Gambar 3.1. Kerangka Konsep Penelitian 57 Keterangan : - Garis tebal menunjukkan alur variabel dependen dan independen yang akan dibuktikan berdasarkan hipotesis yang ditetapkan yaitu risiko terjadinya diare akut rotavirus, lama diare akut rotavirus dan hubungannya dengan pola pemberian ASI (eksklusif dan non-eksksklusif), serta ASI yang mengandung antibodi sIgA antirotavirus - Garis tipis dan garis putus-putus merupakan variabel-variabel yang dikendalikan . 3.3. Hipotesis Penelitian Berdasarkan hasil kajian pustaka maupun dari kerangka konsep penelitian seperti yang telah diuraikan di atas, maka dapat disusun suatu hipotesis penelitian sebagai berikut : 1. Pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif risiko terjadinya diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif 2. Pada bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA-antirotavirus risiko terjadinya diare akut rotavirus lebih rendah daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus 3. Pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif rerata lama penyakit diare akut rotavirus lebih rendah daripada yang mendapat ASI non-eksklusif 4. Pada bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA-antirotavirus rerata lama penyakit diare akut rotavirus lebih rendah 58 daripada yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus 59 BAB IV METODE PENELITIAN 4.1. Rancangan Penelitian Penelitian ini merupakan penelitian observasional dengan studi kasus kontrol dan studi potong lintang 4.1.1.Rancangan Studi Kasus Kontrol (case control study) Rancangan ini bertujuan, pertama untuk mengetahui hubungan antara risiko terjadinya penyakit diare akut rotavirus pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif. Tujuan yang kedua adalah mengetahui hubungan antara risiko terjadinya penyakit diare akut rotavirus pada bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus. 4.1.2.Rancangan Studi Potong Lintang (Cross sectional study) Rancangan ini bertujuan untuk mengetahui, pertama hubungan antara rerata lama diare akut rotavirus pada bayi usia 1-6 bulan yang mendapat ASI-eksklusif. Tujuan yang kedua adalah untuk mengetahui hubungan antara rerata lama diare akut rotavirus pada bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus. Kasus ditetapkan berdasarkan adanya antigen rotavirus pada spesimen feses. Sampel feses dikumpulkan dan disimpan di dalam freezer hingga jumlahnya mencapai 96, untuk satu kali pemeriksaan. Akhirnya jumlah sampel yang terkumpul 161, tetapi hanya 148 sampel yang memenuhi syarat, selanjutnya 59 60 diperiksa untuk menemukan adanya antigen rotavirus. Sampel yang mengandung antigen rotavirus dikelompokkan menjadi kasus, dan sampel yang tidak mengandung antigen rotavirus dikelompokkan menjadi kontrol. Jadi terdapat dua kelompok yaitu subyek diare akut rotavirus dan diare akut bukan rotavirus. Selanjutnya diidentifikasi karakteristik dari masing-masing kelompok, dilakukan analisis terhadap faktor-faktor yang berhubungan dengan risiko terjadinya diare akut rotavirus maupun lamanya diare akibat infeksi rotavirus. 4.2. Penentuan Sumber Data 4.2.1 Populasi Penelitian Populasi target adalah semua bayi yang sedang menderita diare akut, mendapat ASI dan berusia 1-6 bulan. Populasi terjangkau dipilih dari populasi target dan didapatkan 161 sampel. Sampel (intended sample) adalah sampel yang dipilih dari populasi terjangkau secara berurutan (consecutive) setelah memenuhi kriteria inklusi dan eksklusi. Subyek yang benar-benar diteliti (actual study subjects) adalah subyek yang benar-benar mau ikut dalam penelitian setelah mengisi formulir Persetujuan Setelah Penjelasan ( PSP = informed consent), dan yang bisa dianalisis jumlahnya mencapai 148 sampel (13 sampel rusak). Sampel yang dipilih, dikelompokkan menjadi diare rotavirus dan diare bukan rotavirus dan disusun dalam bentuk tabel sampel berdasarkan urutan kelompok usia. Terhadap masing-masing kelompok dilakukan identifikikasi terhadap karakteristik subyek dan analisis terhadap faktor-faktor yang memengaruhi risiko terjadinya diare rotavirus termasuk disini pola pemberian (ASI-eksklusif dan ASI bukan eksklusif), pemberian ASI yang mengandung 61 antibodi sIgA-antirotavirus dan tidak mengandung antibodi sIgA-antirotavirus. Demikian pula terhadap faktor-faktor yang berhubungan dengan lama diare akut rotavirus. Untuk lebih jelasnya seperti terlihat pada bagan di bawah ini : 1. Pada studi kasus kontrol, kelompok subyek yang menderita diare akut rotavirus ditetapkan sebagai kasus dan yang menderita diare akut bukan rotavirus sebagai kontrol. Kasus dan kontrol dipasangkan berdasarkan kesamaan usia dengan perbandingan 1:3 dipilih dari kontrol yang telah disusun secara berurutan dalam bentuk tabel. Pemilihan ini berdasarkan jumlah pasangan yang didapat dari masing-masing kasus setelah disesuaikan dengan usia (Sastroasmoro & Ismael, 2002). Secara skematis digambarkan pada bagan di bawah ini: Studi Kasus Kontrol ASI –eksklusif Ab-sIgA-antirotavirus positif Diare akut rotavirus Matching Usia ASI – non eksklusif Ab-sIgA-antirotavirus negatif Diare akut non rotavirus Gambar 4.1. Bagan Studi Kasus Kontrol 62 2. Studi potong lintang Pada studi potong lintang, kelompok subyek diare akut rotavirus dan subyek diare akut bukan rotavirus dibedakan menjadi subyek yang mendapat ASI-eksklusif, ASI non-eksklusif, mendapat ASI yang mengandung antibodi sIgA antirotavirus dan tidak mengandung antibodi sIgA antirotavirus. Demikian pula terhadap rerata lama diare pada masingmasing kelompok. Untuk lebih jelasnya dapat dilihat pada bagan di bawah ini. Studi Potong Lintang (Cross sectional study) ASI-eksklusif Lama Diare Akut Rotavirus ASI non-eksklusif Ab-sIgA-antirotavirus ASI positif Lama Diare Akut Rotavirus Ab-sIgA-antirotavirus ASI negatif Gambar 4.2.Bagan Penelitian Studi Potong Lintang (Cross sectional study). 63 4.2.2.Kriteria inklusi : Kriteria inklusi : - Bayi berusia 1-6 bulan menderita diare akut, mendapat ASI - Lahir tunggal - Lahir cukup bulan - Berat lahir di atas atau sama dengan 2500 gr - Status gizi baik - Tidak menderita kelainan kongenital mayor 4.2.3.Kriteria eksklusi : Subyek (bayi) yang diteliti akan dikeluarkan dari penelitian bila ibunya : - Menderita malnutrisi berat 4.2.4. Teknik pengambilan sampel Sampel adalah bayi yang sedang menderita diare berusia 1-6 bulan, masih mendapat ASI, berkunjung ke poliklinik maupun di ruang praktek swasta dan atau dirawat di ruang rawat inap di rumah sakit. Sampel dipilih secara berurutan berdasarkan kriteria inklusi, dan tidak diikutkan dalam penelitian bila terdapat keadaan yang termasuk di dalam kriteria eksklusi.Dari sampel yang telah dipilih dilakukan uji skrining ELISA Capture test (diunduh dari: www.rapidtest.com 250 13485-203) untuk mengetahui adanya antigen rotavirus di dalam feses. Bila hasil test positif (ditemukan antigen rotavirus), subyek dimasukkan dalam kelompok diare rotavirus. Sedangkan pada kelompok yang hasil testnya negatif (tidak 64 ditemukan antigen rotavirus dalam feses) menjadi kelompok diare bukan rotavirus. Pada kedua kelompok ditelusuri tentang pola pemberian ASI dan diperiksa titer antibodi sIgA-antirotavirus ASI dengan teknik ELISA (Bishop dkk, 1984), serta karakteristik subyek (bayi dan ibu). Lama diare akan dihitung dari subyek yang menderita diare akut rotavirus, kemudian dibagi menjadi kelompok bayi yang mendapat ASI-eksklusif, mendapat ASI bukan eksklusif, mendapat ASI yang mengandung antibodi sIgA antirotavirus dan kelompok yang mendapat ASI yang tidak mengandung antibodi sIgA-antirotavirus. 4.2.5.Besar sampel Pada penelitian ini sampel yang berhasil dikumpulkan adalah 161 dan sebanyak 13 sampel tidak memenuhi syarat (spesimen ASI dan atau feses rusak). Besar sampel dihitung berdasarkan rumus studi Kasus Kontrol Berpasangan dengan jumlah kontrol lebih dari satu untuk mengetahui risiko terjadinya penyakit diare akut rotavirus. Untuk mengetahui rerata lamanya penyakit diare akut rotavirus, dihitung berdasarkan rumus untuk studi Potong Lintang (uji hipotesis terhadap rerata dua populasi, dua kelompok independen). Berdasarkan penghitungan tersebut diperoleh ukuran besar sampel yang berbeda dan yang dipakai adalah yang angkanya lebih besar. Penghitungan besar sampel berdasarkan : 1. Besar sampel untuk mengetahui risiko terjadinya diare akut rotavirus Rumus Studi kasus kontrol berpasangan dan Studi kasus kontrol dengan rasio kasus dibandingkan adalah 1:3 (Sastroasmoro & Ismael, 2002). 65 2 z / 2 z PQ P 1/ 2 n R P 1 R Berdasarkan rumus di atas, besar sampel pada studi kasus kontrol berpasangan uji 1 arah, bergantung pada OR, z-alfa, dan z-beta. Pada penelitian ini ditetapkan alfa = 0,05; beta = 0,20, di mana z-alfa = 1,645; zbeta = 0,842, OR = 2,5. Penghitungan besar sampel berdasarkan dengan rasio kasus dan kontrol 1:1: Bila OR = 2,5, P = 2,5/(1+2,5) = O,71; Q = 1-P = 0,29 2 n (1,645 / 2 0,842 0,71x 0,29) 0,71 0,5 n 0,823 0,842 0,2059 0,21 n (1,1447) 0,29 2 2 n1=n2= 32,89= 33 Untuk menghitung besar sampel bila rasio kasus dibanding kontrol adalah 1:3, maka penghitungan besar sampel adalah sebagai berikut: n‟= (c + 1)n / 2c n‟= (3 + 1)33 / 2x3 = 22 66 Jumlah kasus minimal adalah 22, pada penelitian jumlah kasus adalah 23 sedangkan jumlah kontrol adalah 3 x 23 (= 69) dan pada penelitian ini kasus dan kontrol dipasangkan berdasarkan kesamaan usia. 2. Untuk menghitung besar sampel rerata lama penyakit diare akut, digunakan rumus uji hipotesis rerata dua populasi (Sastroasmoro & Ismael, 2002) : 2 (z z )s n1 n 2 2 ( x1 x 2) Lama penyakit diare akut yang mendapat ASI-ekskslusif (3,8 + 2,2 hari) sebagai “x1) dan rata-rata simpang baku 3,4 hari (dikutip dari LopezAlarcon dkk, 1997). Rerata lama diare yang mendapat ASI non-eksklusif adalah 4,56 hari (“x1” ditambah 20 %), z-alfa= 1,645, z-beta= 0,842, maka: n1 n2 (1,645 0,842) s 2 (6,2 3,8) 2 2,487 3,4 2 2,4 2 2 (8,456) n1 n2 2 2 (3,52) 2 2 12,39 24,8 (2,4) n1 = n2 = 55; berarti jumlah sampel adalah 55 x 2= 110 Berdasarkan hasil penghitungan di atas maka besar sampel yang dipakai adalah yang angkanya lebih besar yaitu 110 (pada penelitian yang dianalisis 148 sampel) 4.3. Variabel Penelitian 4.3.1.Identifikasi variabel Variabel dalam penelitian ini adalah : 67 1. Risiko penyakit diare akut (diare rotavirus, diare bukan rotavirus) dan lamanya penyakit diare akut (rotavirus, bukan rotavirus) 2. Antibodi sIgA-antirotavirus ASI (positif, negatif) 3. Pola pemberian ASI (ASI eksklusif, ASI non-eksklusif ) 4. Karakteristik bayi (usia, jenis kelamin, status gizi, jumlah saudara) 5. Karakteristik ibu (usia, paritas, status gizi, tingkat pendidikan, jenis pekerjaan, higiene perorangan) 4.3.2.Klasifikasi Variabel a. Variabel tergantung adalah risiko terjadinya diare akut rotavirus dan lamanya penyakit diare akut rotavirus. b. Variabel bebas adalah : Antibodi sIgA-antirotavirus ASI (positif, negatif) Pola pemberian ASI (eksklusif, non-eksklusif) c. Variabel kendali adalah karakteristik bayi (usia, jenis kelamin, status gizi, jumlah saudara), karakteristik ibu (usia, status gizi,paritas, tingkat pendidikan, jenis pekerjaan, higiene perorangan) 4.3.3.Hubungan antar variabel Hubungan variabel dalam penelitian ini dapat digambarkan dalam bentuk diagram. 68 Variabel bebas Antibodi sIgA-antirotavirus ASI (positif, negatif) Pola pemberian ASI( ASI – eksklusif, ASI non- eksklusif ) Variabel tergantung 1.Risiko diare akut rotavirus 2.Lama penyakit diare akut rotavirus Variabel kendali 1. Karakteristik bayi: umur, jenis kelamin,status gizi, jumlah saudara. 2. Karakteristik ibu: usia, paritas, status gizi, tingkat pendidikan, jenis pekerjaan, higiene perorangan. Gambar 4.3. Hubungan antar variabel 4.3.4.Definisi operasional variabel 1. Penyakit diare akut : a. Diare akut adalah penyakit yang terjadi mendadak pada anak yang sebelumnya sehat dan berlangsung kurang dari 14 hari. Penyakitnya ditandai dengan buang air besar 3 kali atau lebih per hari, feses yang lebih cair dari pada biasanya, dengan atau tanpa disertai darah dan atau lendir. 69 b. Diare akut yang disertai dehidrasi dinilai berdasarkan pedoman yang sesuai yang tertera pada Tabel Penilaian Dehidrasi, WHO (terlampir). Disebut sebagai penyakit diare akut rotavirus bila ditemukan antigen rotavirus pada pemeriksaan feses (WHO, 1984; Nguyen, 2004). Hasil pemeriksaan dinyatakan sebagai diare akut rotavirus dan diare akut bukan rotavirus c. Risiko terjadinya diare akut rotavirus adalah besarnya risiko terjadinya diare akut rotavirus pada subyek yang terpapar dibandingkan dengan yang tidak terpapar oleh faktor risiko. Hasil penghitungan dinyatakan dalam satuan rasio odds (RO) d. Lamanya penyakit diare akut rotavirus adalah lamanya penyakit diare berlangsung yang dihitung sejak feses mulai cair pada hari pertama dinyatakan sebagai penderita penyakit diare sampai saat terakhir buang air besar dengan feses cair sebelum feses menjadi seperti sebelum menderita penyakit. Hasil pengukuran dinyatakan dalam satuan jam 2. Pola pemberian ASI: a. Pemberian ASI-eksklusif adalah pemberian makanan bayi yang hanya memberi ASI, tanpa makanan/minuman lain termasuk air putih kecuali sirup vitamin dan cairan pelarut obat b. Pemberian ASI non-eksklusif adalah pemberian makanan pada bayi selain ASI, disertai dengan susu formula, buah, bubur susu dan jenis makanan cair/ lembek lainnya (dikutip dari Bland dkk, 2003) 70 Data didapat dari laporan ibu 3. Antibodi sIgA-antirotavirus ASI adalah adanya antibodi sIgA-antirotavirus di dalam ASI berdasarkan hasil pemeriksaan ELISA. Hasil pemeriksaan dinyatakan positif bila titer ELISA mencapai 28 unit atau lebih, dan disebut negatif bila titer ELISA mencapai di bawah 28 unit (Bishop dkk, 1984) 4. Faktor karakteristik bayi adalah umur, jenis kelamin, status gizi, dan jumlah saudara yang diukur dengan teknik yang sesuai dan hasil penghitungan dinyatakan dalam satuan tertentu: a. Umur : dihitung berdasarkan tanggal lahir yang tercantum di KMS (kartu menuju sehat ) atau berdasarkan laporan, dinyatakan dalam satuan bulan b. Jenis kelamin ditetapkan berdasarkan bentuk fenotif organ genital yang didapat dari pemeriksaan fisik, dinyatakan sebagai laki-laki dan perempuan c. Status gizi: didapat dengan mengukur berat badan bayi memakai timbangan bayi, saat diukur bayi dalam posisi terlentang, telanjang atau memakai pakaian seminimal mungkin. Hasil pengukuran berat badan dinyatakan dalam gram. Panjang badan bayi diukur menggunakan meteran kayu, saat diukur bayi dalam posisi terlentang, dan hasil pengukuran dinyatakan dalam satuan sentimeter. Status gizi bayi didapat dengan mencantumkan berat badan (BB) bayi dan panjang badan (PB) bayi pada garis yang sesuai pada grafik Standards (2006) The WHO Child Growth (Diunduh dari 71 http://www.who.int/chidgrowth/standrds/Growth_standar.pdf Bayi dikatakan mempunyai gizi baik bila perpotongan garis yang ditarik dari titik BB/PB pada grafik terletak di antara nilai persentil 15-85 d. Jumlah saudara adalah jumlah anak yang tinggal dalam satu rumah, dinyatakan dalam satuan orang e. Kelainan kongenital mayor adalah kelainan organ yang dapat memengaruhi proses penyusuan, dan sudah ada sejak lahir antara lain bibir sumbing maupun kelainan pada bibir dan atau hidung lainnya (Indrasanto, 2008) 5. A. Karakteristik ibu (internal) adalah usia, paritas, dan status gizi. Diukur memakai teknik yang sesuai dan dinyatakan dalam satuan tertentu : a. Usia ibu dihitung berdasarkan tanggal lahir, dinyatakan dalam satuan tahun b. Paritas adalah jumlah kehamilan yang pernah dialami ibu, didapat melalui anamnesis dan dinyatakan dalam satuan kali c. Status gizi ibu adalah keadaan gizi yang didapat dengan mengukur berat badan ibu memakai timbangan orang dewasa, hasil pengukuran dinyatakan dalam satuan kilogram. Tinggi badan ibu diukur memakai meteran yang disebut sebagai microtoise atau stadiometer dalam posisi berdiri. Hasil pengukuran dinyatakan dalam sentimeter. Status gizi ditetapkan berdasarkan hasil penghitungan Indeks Masa Tubuh yaitu : IMT = BB (kg)/ TB (meter) x TB (meter) berdasarkan rumus Pedoman Perhitungan gizi orang dewasa. Jika hasil 72 penghitungan adalah 18,5-25,0 disebut normal, dan bila hasilnya dibawah 17,0 disebut sebagai kurang energi kronis (KEK) berat (diunduh dari: www.gizi.net/pedomangizi/download/Pedoman%20Praktis%20IMT. doc. 1/1/2001) B. Karakteristik eksternal ibu adalah tingkat pendidikan, jenis pekerjaan, dan higiene perorangan Didapat dari hasil wawancara dan data yang didapat dinyatakan dalam ukuran tertentu : a. Tingkat pendidikan adalah pendidikan terakhir yang pernah dijalani ibu, digolongkan menjadi : tamat SD, SLTP, SLTA, atau tamat Perguruan Tinggi b. Jenis pekerjaan : adalah pekerjaan yang dilakukan ibu pada saat bayi berusia 1-6 bulan. Yang dimaksud dengan pekerjaan yang dilakukan di rumah adalah pekerjaan mengurus rumah tangga, wiraswasta dan lainnya dan ibu tetap dapat menyusui bayi. Pekerjaan yang dilakukan di luar rumah adalah pekerjaan yang menyebabkan ibu berada di luar rumah lebih dari 3 jam sehingga tidak dapat menyusui bayi selama melakukan pekerjaan c. Higiene perorangan adalah kebiasaan ibu mencuci tangan dengan air dan sabun sebelum memegang bayi. Dinyatakan sebagai selalu mencuci tangan bila setiap akan memegang bayi ibu mencuci tengan memakai sabun. Kadang-kadang mencuci tangan bila akan 73 memegang bayi sesekali mencuci tangan dengan sabun dan tidak pernah mencuci tangan setiap akan memegang bayi 4.4. Bahan Penelitian 1. ASI, diperiksa kandungan antibodi IgA- antirotavirus dalam ASI 2. Feses bayi, untuk menemukan adanya antigen rotavirus 3. Kuesioner dan rekaman medik 4.5. Instrumen dan Prosedur Pengambilan Bahan Penelitian 4.5.1.Instrumen: Kit ELISA untuk pemeriksaan ASI dan feses 4.5.2.Prosedur Pelaksanaan Penelitian dan Pemeriksaan Bahan Penelitian dimulai setelah didapat: 1.Persetujuan dari tim Komisi Etik 2.Izin dari rumah sakit tempat penelitian dilakukan Sosialisasi dilakukan terhadap para dokter yang bertugas di tempat perawatan pasien, poliklinik, tempat praktek swasta, serta paramedis maupun petugas administrasi dan petugas laboratorium yang ditunjuk. Penelitian diawali dengan anamnesis dan pemeriksaan terhadap pasien diare yang berusia 1-6 bulan dan masih mendapat ASI. Berdasarkan anamnesis dan pemeriksaan fisik, bila bayi lahir spontan, tunggal dan cukup bulan dan berat lahir lebih besar atau sama dengan 2500 gram, status gizi baik dan tidak menderita kelainan bawaan yang memengaruhi proses penyusuan, bayi tersebut ditetapkan 74 sebagai subyek penelitian. Bila ternyata ibu bayi setelah diperiksa menderita malnutrisi berat, bayi dikeluarkan sebagai subyek penelitian. Orang tua yang bayinya dipilih sebagai subyek penelitian, diberikan penjelasan perihal keadaan bayinya dan ditawarkan untuk disertakan dalam penelitian. Apabila orang tua setuju, kepada mereka diminta untuk menandatangani formulir Persetujuan Setelah Penjelasan (PSP). Selanjutnya spesimen ASI diambil dengan memeras ASI dari kedua payudara ibu, sedangkan spesimen feses diambil dari feses yang keluar bila sedang buang air besar atau melalui hapusan di daerah rektum memakai lidi kapas (cotton bud). ASI diambil sebanyak 2 ml ditampung dalam botol steril dan segera di simpan di Freezer. Demikian pula feses yang telah diambil dimasukan ke dalam tabung steril dan segera disimpan ditempat yang sama dengan tempat penyimpanan ASI. Sampel yang telah terkumpul akan dikirim secara berkala ke laboratorium Virologi Fakultas Kedokteran Hewan, Universitas Udayana di Denpasar. Saat pengiriman, sampel ditempatkan di dalam termos berpendingin. Pemeriksaan terhadap sampel dilakukan sekaligus bila jumlahnya telah mencapai 96 (1 kit). Sampel feses diperiksa dengan menggunakan metode ELISA Capture Test (diunduh dari: www.rapidtest.com 250 13485-203). Sampel feses diperiksa oleh peneliti di laboratorium Virologi Fakultas Kedokteran Hewan universitas Udayana di Denpasar. Untuk mengukur titer antibodi IgA-antirotavirus pada ASI digunakan teknik ELISA Test . Sampel yang telah diperiksa ditetapkan sebagai penderita diare akut rotavirus dan diare akut bukan rotavirus. Yang menderita diare akut rotavirus 75 berjumlah 23 orang, ditetapkan sebagai kasus. Untuk kontrol dipilih pasangannya berdasarkan kelompok usia 1-2 bulan, > 2 bulan-4 bulan, dan >4 bulan-6 bulan. Untuk sampel pada studi potong lintang dipilih dari kasus yang memiliki data lama diare, dibedakan menjadi yang mendapat ASI-eksklusif, ASI non-eksklusif, mendapat ASI yang mengandung antibodi sIgA antirotavirus, dan mendapat ASI tidak mengandung antibodi sIgA antirotavirus. Tata cara pemeriksaan pasien. 1. Pasien ditetapkan sebagai subyek penelitian setelah sebelumnya diperoleh persetujuan setelah penjelasan (PSP) dari orang tua, pasien dibaringkan telanjang/ memakai pakaian seminimal mungkin, kemudian ditimbang dan diukur panjang badan. Untuk menimbang badan dipakai timbangan digital untuk bayi merek MISAKI, sedangkan panjang badan diukur memakai meteran kayu. Hasil pengukuran dicatat dalam kuesioner dan dicocokan dengan grafik BB/PB (WHO, 2006) untuk mendapatkan status gizi pasien 2. Dilakukan anamnesis oleh paramedis untuk mendapatkan data riwayat penyakit maupun pola pemberian makanan bayi serta data karakteristik lainnya 3. Dilanjutkan dengan pemeriksaan fisik untuk menetapkan diagnosis diare dan klarifikasi klinis lainnya 4. Dokter mengisi formulir permintaan laboratorium rutin maupun khusus yang berkaitan dengan penelitian yaitu pemeriksaan feses untuk rotavirus dan ASI 76 Teknik Pemeriksaan Feses : Pemeriksaan antigen rotavirus menggunakan Capture ELISA. 1. Antibodi –antirotavirus di coat dalam sumuran plat mikro ELISA selama 2 jam pada suhu kamar 2. Sumuran yang berisi antibodi-antirotavirus dicuci sebanyak tiga kali dengan PBS, kemudian dari setiap sumuran diblok dengan BSA 1% dalam PBS selama 1 jam pada suhu kamar 3. Plat dicuci dengan PBS, selanjutnya ditambahkan sampel feses ke dalam setiap sumuran. Sebagai standar untuk menentukan adanya antigen rotavirus sampel, dipakai antibodi-antirotavirus standar dan diencerkan berkelipatan dua (BMS 603 Viena Austria) 4. Plat mikro diinkubasikan dua jam pada suhu kamar dan dicuci dengan PBS. Ditambahkan antibodi-antirotavirus ke dalam setiap sumuran yang dilabel dengan Biotin lalu diinkubasikan pada suhu kamar selama 2 jam 5. Plat mikro dicuci dengan PBS , kemudian ditambahkan Avidin HRP dan diinkubasi selama 20 menit. Ditambahkan substrat TMB dan dibaca kepekatan warna yang dihasilkan 6. Dilakukan pembacaan dengan memakai ELISA DA X 80 (Diagnostic Automatic, USA) menggunakan filter dengan panjang gelombang 450 nm 7. Adanya antigen rotavirus pada feses ditentukan berdasarkan perbandingan nilai optical density (OD) setiap sampel tinja dengan nilai OD antigen rotavirus standar menggunakan regresi parameter logistik 77 Pemeriksaan kadar antibodi sIgA-antirotavirus pada ASI : Uji ELISA dengan menggunakan antihuman IgA sebagai konjugat Prosedur Pemeriksaan ASI : 1. Mikroplate ELISA dilapisi dengan Ag-rotavirus selama 1 malam dalam larutan Karbonat-Bikarbonat Buffer pada suhu 4 derajat celcius 2. Setelah itu dicuci dengan PBS ( Phosphorus Buffered Saline ) sebanyak 3 kali, selanjutnya ke dalam setiap sumuran mikroplate ditambahkan sampel ASI dengan berbagai pengenceran. Mikroplate tersebut kembali diinkubasi pada suhu 37 derajat celcius selama 1 jam 3. Mikroplate dicuci kembali dengan larutan PBS dan kedalam setiap sumuran ditambahkan antihuman IgA yang dilabel dengan ensim peroksidase . Setelah itu mikroplate kembali diinkubasi pada suhu 37 derajat celcius selama 1 jam 4. Mikroplate dicuci kembali dengan PBS sebanyak 3 kali dan ke dalam setiap sumuran ditambahkan substrat TMB kemudian dibiarkan pada suhu kamar selama 20 menit 5. Kepekatan warna substrat dibaca dengan Multiscan Spektrofotometer dengan filter 405 nm, kemudian konsentrasi IgA ditentukan dengan membandingkan pada kontrol IgA yang konsentrasinya telah diketahui sebelumnya 78 4.5.3.Alur Penelitian Pasien bayi 0 – 6 bulan yang berkunjung ke poliklinik, praktek swasta dan atau dirawat di rumah sakit POPULASI TERJANGKAU Diare akut Mendapat ASI Status gizi baik Lahir tunggal Berat lahir > 2500 gr / lebih Tidak menderita kelainan kongenital mayor KRITERIA INKLUSI Ibu menderita malnutrisi berat KRITERIA EKSKLUSI Demografi Data pemberian ASI Status nutrisi Data penyakit Obat - obatan Data higiene perorangan INTENDED SAMPLES Pengisian PSP Anamnesis, pemeriksaan fisik Hasil pemeriksaan fisik, diagnosis klinis Pengambilan spesimen tinja dan ASI ASI Feses Hasil pemeriksaan laboratorium : ELISA TEST : ELISA Capture Test Antigen rotavirus feses, antibodi sIgA – antirotavirus ASI Pemberian ASI (eksklusif, non eksklusif) Kasus Risiko Diare Kontrol Lama Diare Diare RV Diare non RV Analisis Deskriptip TABULASI DATA, ANALISIS DATA KESIMPULAN Mantel- Haenzel Uji Chi Square Uji T tak berpasangan Risiko diare akut rotavirus Lama diare akut rotavirus Gambar 4.4 Alur Penelitian 79 4.6. Lokasi dan Waktu Penelitian Penelitian dilakukan di Ruang Rawat Inap Penyakit Anak dan Poliklinik Anak RSUD Sanjiwani Gianyar dan di tempat praktek swasta. Pemeriksaan spesimen feses dan ASI dilakukan di Laboratorium Virologi Fakultas Kedokteran Hewan universitas Udayana Denpasar. 4.7 Analisis Data 1. Statistik Deskriptif. Teknik statistik deskriptif digunakan untuk mengetahui karakteristik data penelitian. Dari penelitian ini didapat data berskala pengukuran katagorik yang terdiri atas skala pengukuran nominal dan skala pengukuran ordinal. Yang termasuk data berskala nominal adalah jenis kelamin bayi, jenis pekerjaan ibu, pola pemberian ASI (eksklusif, non eksklusif). Data yang berukuran skala ordinal adalah tingkat pendidikan ibu, status higiene perorangan (selalu cuci tangan, kadang-kadang cuci tangan, tak pernah cuci tangan), dan adanya antibodi sIgAantirotavirus di dalam ASI (positif, negatif).Dari data yang berskala katagorik dihitung frekuensi tiap katagori (n) dan persentase tiap katagori (%) disajikan dalam bentuk tabel distribusi frekuensi. Berkaitan dengan gambaran karakteristik data dengan skala pengukuran numerik yang terdiri atas skala rasio dan interval, pada penelitian ini didapat data yang berskala rasio yaitu usia bayi, usia ibu, berat badan bayi, dan lama diare.Yang berskala interval adalah jumlah saudara bayi dan paritas. Dari data yang berskala numerik dan berdistribusi normal dilakukan pengukuran terhadap mean,standar deviasi. Data variabel dengan skala 80 pengukuran numerik disajikan dalam bentuk tabel. Untuk mengetahui karakteristik sebaran data disajikan berdasarkan hasil analisis uji KolmogorovSmirnov untuk sampel yang jumlahnya >50 (Kountur, 2005; Dahlan, 2009). 2. Statistik analitik. Uji hipotesis merupakan bagian dari penghitungan dalam statistik analitik, yang dipilih berdasarkan sebaran data. Pada data yang memiliki sebaran normal dilakukan uji hipotesis parametrik, sedangkan pada data yang sebarannya tidak normal, dilakukan transformasi data terlebih dahulu. Jika tetap menghasilkan data dengan sebaran tidak normal dilakukan uji hipotesis non-parametrik (Dahlan, 2004). Untuk dua kelompok data yang berskala numerik tidak berpasangan dan memenuhi syarat sebaran datanya normal, uji hipotesis yang digunakan adalah uji hipotesis komparatif t tidak berpasangan. Pada data yang berskala pengukuran katagorik dan berpasangan, digunakan Mantel-Haenszael dan penghitungan Chi-Square (Dahlan, 2004). Uji hipotesis analisis bivariat bertujuan untuk mencari hubungan antara satu variabel tergantung yang berskala dikotom dengan satu variabel bebas. Pada penelitian ini dicari hubungan antara: a. Risiko terjadinya diare akut rotavirus yang merupakan variabel tergantung berskala katagorik dan variabel pola pemberian ASI (ASI- eksklusif, ASI non-eksklusif) merupakan variabel bebas berskala katagorik (nominal). Uji statistik yang digunakan adalah uji komparatif Mantel-Haenszel 81 b. c. Risiko terjadinya diare akut rotavirus dan pemberian ASI yang mengandung antibodi sIgA-antirotavirus yang bersakala katagorik, digunakan uji Mantel-Haenszel Rerata lama diare akut rotavirus merupakan variabel tergantung yang berskala numerik dan pola pemberian ASI sebagai variabel bebas yang berskala nominal, termasuk data dari dua kelompok yang tidak berpasangan. Uji hipotesis komparatif t tidak berpasangan dipakai karena memenuhi syarat uji parametrik d. Rerata lama diare akut rotavirus dan pemberian ASI yang mengandung antibodi sIgA-antirotavirus sebagai variabel bebas berskala nominal, termasuk data dari dua kelompok tidak berpasangan. Uji hipotesis yang digunakan adalah uji t tak berpasangan Unalisis multivariat digunakan untuk studi kasus kontrol untuk menemukan hubungan antara variabel “outcome” (terikat) dengan faktor-faktor yang memengaruhi (variabel bebas maupun variabel perancu). Berdasarkan jenis variabel terikatnya dalam hal ini risiko diare akut rotavirus yang merupakan variabel katagorik, yang digunakan adalah analisis regresi logistik. Untuk variabel terikatnya yang merupakan variabel numerik dalam hal ini lama diare, digunakan analisis regresi linier (Dahlan, 2009). Pada penelitian ini, dari hasil analisis bivariat tidak ditemukan hubungan yang bermakna antara berbagai faktor yang berhubungan dengan risiko dan lama diare akut rotavirus, sehingga tidak memenuhi syarat untuk analisis multivariat. 82 3. Nilai Probabilitas (P) dan Interval Kepercayaan Nilai p dan interval kepercayaan (IK) digunakan untuk inferensi (penarikan kesimpulan). Interpretasi terhadap nilai p adalah untuk menyatakan besarnya kemungkinan hasil yang diperoleh atau hasil yang lebih ekstrim diperoleh karena faktor peluang, bila hipotesis nol benar. Interval kepercayaan (IK) menunjukkan taksiran rentang nilai pada populasi yang dihitung dengan nilai yang diperoleh pada sampel (Dahlan, 2009; Sastroasmoro & Ismael, 2002) Tingkat kemaknaan (alfa) penelitian ini detetapkan pada nilai probabilitas (p) kurang dari 0,05. Nilai variabel utama (main endpoint) dinyatakan dengan interval kepercayaan 95 % (IK 95%), sesuai dengan alfa <0,05. Interval kepercayaan ini penting, karena dapat dipakai untuk : a. Mengestimasi nilai di populasi b. Melihat variansi data dengan demikian dapat melihat besarnya sampel dan homogenitas data c. Secara tidak langsung dapat dipakai untuk uji hipotesis 4.8 Interpretasi hasil Uji Hipotesis Statistik Uji hipotesis bertujuan untuk menentukan apakah perbedaan variabel yang dijumpai pada sampel tidak terjadi secara kebetulan, dengan asumsi variabel tersebut di populasi dari mana sampel itu diambil tidak berbeda. Dari hipotesis penelitian ini dapat diuraikan sebagai berikut : 83 U1 = U2, artinya risiko terjadinya penyakit diare akut rotavirus pada bayi 1-6 bulan yang mendapat ASI-eksklusif tidak berbeda dengan bayi yang mendapat ASI bukan eksklusif. Demikian pula risiko terjadinya penyakit diare akut rotavirus tidak berbeda antara bayi yang mendapat ASI yang mengandung antibodi sIgA-antirotavirus dengan bayi yang mendapat ASI yang tidak mengandung antibodi sIgA-antirotavirus. Rerata lamanya penyakit diare akut rotavirus pada bayi 1- 6 bulan tidak berbeda antara bayi yang mendapat ASI-eksklusif dengan bayi yang mendapat ASI bukan eksklusif. Demikian pula rerata lama diare akut rotavirus tidak berbeda antara bayi usia 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA-antirotavirus dengan yang mendapat ASI yang tidak mengandung antibodi sIgA-antirotavirus. Pada penelitian studi kasus kontrol, dengan menggunakan tabel 2x2 didapat rasio odds. Rasio prevalens pada studi potong lintang didapat dengan membandingkan rerata lama diare akut rotavirus pada subyek yang mendapat ASI-eksklusif dan atau ASI yang mengandung antibodi dengan subyek yang sIgA-antirotavirus mendapat ASI non-eksklusif dan atau ASI yang tidak mengandung antibodi sIgA-antirotavirus. Interpretasi hasil penghitungan rasio odds (RO) ditetapkan sesuai dengan interval kepercayaan yang telah dipilih, pada penelitian ini : RO= 1 atau mencakup angka 1 berarti faktor yang diteliti bukan merupakan faktor risiko 84 Hasil penghitungan rasio prevalen (RP) pada penelitian ini: RP =1 (menyangkut angka 1), artinya rerata lama diare akut rotavirus pada subyek yang terpapar sama dengan rerata lama penyakit diare akut rotavirus pada subyek yang tidak terpapar 85 BAB V HASIL PENELITIAN 5.1. Karakteristik Subyek Penelitian 5.1.1. Karakteristik bayi POPULASI TERJANGKAU KRITERIA INKLUSI KRITERIA EKSKLUSI INTENDED SAMPLES 161 Orang 148 Bisa dianalisis Rotavirus 23 Resiko Diare Kasus 23 Non Rotavirus 125 Kontrol 69 ASI-eksklusif / Non eksklusif Ab.sIgA antirotavirus positif/negatif Lama Diare 17 rotavirus a. Usia bayi Pada penelitian ini terdapat 161 sampel yang diambil sebagai subyek penelitian, terdapat 148 orang yang memenuhi syarat penelitian. Berdasarkan pemeriksaan ditemukannya antigen rotavirus pada feses, terdapat dua kelompok subyek bayi yaitu kelompok diare rotavirus dan diare bukan rotavirus. Kelompok diare rotavirus berjumlah 23 orang (15,5 %) dan 125 orang (84,5 %) termasuk dalam kelompok diare bukan rotavirus. Berdasarkan sebaran umur (Tabel 1), besaran kejadian diare rotavirus tertinggi pada kelompok usia 56 bulan hampir sama pada kedua kelompok. Kejadian diare akut baik pada diare 85 86 rotavirus maupun diare bukan rotavirus, cendrung meningkat pada usia yang lebih besar. b. Jenis kelamin Subyek yang menderita diare rotavirus, terdiri atas 11orang ( 47,8 %) lelaki dan 12 orang (47,8 %) perempuan. Sedangkan pada subyek yang menderita diare bukan rotavirus adalah 62 orang (49,6 %) lelaki dan sebanyak 63 orang (50,4 %) perempuan. Berdasarkan jenis kelamin (tabel 1), tingkat kejadian diare rotavirus hampir sama antara anak lelaki dan perempuan (1:1). Perbandingan yang serupa juga terdapat pada kelompok diare bukan rotavirus. c. Berat badan Rerata berat badan dinyatakan dalam gram. Pada kelompok yang menderita diare rotavirus memiliki rerata berat badan 6,582 + 1,295 gram, dan rerata berat badan pada kelompok diare bukan rotavirus adalah 6,634 + 1,225 gram. Dari data tersebut tidak ada perbedaan yang nyata rerata berat badan antara subyek yang menderita diare rotavirus dengan subyek yang menderita diare yang bukan rotavirus (Tabel 1). d. Jumlah saudara Berdasarkan jumlah saudara yang tinggal dalam satu rumah, subyek penelitian dibagi menjadi 3 kelompok, yaitu kelompok yang tidak memiliki saudara (merupakan anak pertama/anak tunggal), memiliki satu saudara, dan memiliki dua saudara atau lebih. Pada kelompok diare rotavirus sebanyak 12 orang (52,2 %) tidak memiliki saudara, yang memiliki satu saudara adalah 8 orang (34,8 %), dan yang memiliki dua saudara atau lebih adalah 3 orang (13,%). 87 Proporsi jumlah saudara pada kelompok diare bukan rotavirus hampir serupa, yaitu sebanyak 61 orang (48,8 %) tidak memiliki saudara, sebanyak 40 orang (32 %) memiliki satu saudara, dan sebanyak 24 orang (19,2 %) yang memiliki dua saudara atau lebih (Tabel1). 5.1.2. Karakteristik Ibu a. Usia ibu. Rerata usia ibu pada subyek yang menderita diare rotavirus adalah 28 ,22 tahun + 6,48 bulan, dan pada kelompok diare bukan rotavirus adalah 28,51 tahun + 5,17 bulan . Berdasarkan data tersebut di atas, rerata usia ibu antara kelompok subyek yang menderita diare rotavirus tidak berbeda dengan kelompok subyek yang menderita diare bukan rotavirus (Tabel 1). b. Paritas Tingkat paritas (jumlah kehamilan yang dialami ibu) pada kelompok subyek yang menderita diare rotavirus terdiri atas 12 orang (52,2 %) hamil pertama kali, 8 orang (34,8 %) merupakan kehamilan yang kedua, 3 orang (13 %) hamil yang ketiga kali. Pada kelompok subyek yang menderita diare bukan rotavirus tingkat paritas terdistribusi sebagai berikut, yaitu 61 orang (48,8 %) merupakan kehamilan yang pertama, 40 orang (32 %) merupakan kehamilan yang kedua, dan 24 orang (19,2 %) merupakan kehamilan yang ketiga. Berdasarkan tingkat paritas, sebagian besar subyek yang menderita diare rotavirus lahir dari ibu yang mengalami kehamilan pertama kali, demikian pula pada 88 kelompok subyek yang menderita diare bukan rotavirus. Tampak tidak ada perbedaan yang nyata dalam hal tingkat paritas pada kedua kelompok (Tabel 1). c. Tingkat pendidikan Tingkat pendidikan ibu pada kelompok diare rotavirus, sebagian besar adalah SLTA yaitu 12 orang (52,2 %). Pada kelompok diare bukan rotavirus, sebanyak 65 orang (52,0 %) berpendidikan setingkat SLTA. Jadi berdasarkan tingkat pendidikan ibu (Tabel 1), proporsinya tidak berbeda antara kelompok subyek yang menderita diare rotavirus dengan yang menderita diare bukan rotavirus. d. Pekerjaan ibu. Para ibu dari kelompok diare rotavirus sebagian besar bekerja di luar rumah yaitu 16 orang (69,6 %), dan yang bekerja di dalam rumah sebanyak 7 orang (30,4 %). Pada kelompok subyek diare bukan rotavirus, sebanyak 69 orang (55,2 %) para ibunya bekerja di luar rumah dan sebanyak 56 orang (44,8 %) bekerja di dalam rumah. Jadi duapertiga para ibu dari kelompok diare rotavirus bekerja di luar rumah, sedangkan pada kelompok diare bukan rotavirus tidak ada perbedaan antara jumlah ibu yang bekerja di luar rumah dan di dalam rumah. Perbedaan proporsi dalam hal jenis pekerjaan pada kedua kelompok terlihat pada tabel 1. e. Higiene Perorangan Dari seluruh subyek yang memenuhi syarat penelitian, sebagian besar higiene perorangan para ibu kelompok diare rotavirus termasuk katagori kadangkadang mencuci tangan yaitu 12 orang (52,2 %). Sedangkan pada kelompok 89 diare bukan diare rotavirus terdapat perbandingan yang seimbang antara jumlah yang kadang-kadang mencuci tangan yaitu 54 orang (43,2 %) dengan yang termasuk tidak/jarang mencuci tangan yaitu 51 orang (40,8 %). Persamaan dari kedua kelompok subyek adalah kecilnya tingkat higiene perorangan yang termasuk katagori selalu mencuci tangan, masing-masing sebanyak 3 orang (13,0 %) pada kelompok diare rotavirus dan sebanyak 20 orang (16,0%) pada kelompok diare bukan rotavirus (Tabel 1). 90 Tabel 1. Karakteristik Bayi dan Ibu yang berkaitan dengan penyakit diare akut rotavirus Karakteristik Subyek Diare Akut RV n = 23 Usia Bayi (bulan) 1–2 2–3 3–4 4–5 5–6 Jenis kelamin Laki – laki Perempuan Berat bayi (kg) Mean SD Jumlah saudara Tidak memiliki saudara Satu saudara Dua saudara atau lebih Usia ibu Mean SD Paritas 1 2 3 Tingkat pendidikan SD tamat SLTP SMU PT Jenis pekerjaan Di rumah Di luar rumah Higiene perorangan Selalu mencuci tangan Kadang – kadang mencuci tangan Tidak / jarang sekali mencuci tangan Keterangan: RV = rotavirus Diare Akut Non RV n = 125 3 (13,0%) 3 (13,0%) 6 (26,1%) 4 (17,4%) 7 (30,4%) 13 (10,4%) 16 (12,8%) 28 (22,4%) 26 (20,8%) 42 (33,6%) 11 (47,8%) 12 (52,2%) 62 (49,6%) 63 (50,4%) 6,58 1,30 6,63 1,23 12 (52,2%) 8 (34,8%) 3 (13,0%) 61 (48,8%) 40 (32,0%) 24 (19,2%) 28,22 6,48 28,47 5,14 12 (52,2%) 8 (34,8%) 3 (13,%) 61 (48,8%) 40 (32,0%) 24 (19,2%) 2 (8,7%) 5 (21,7%) 12 (52,2%) 4 (17,4%) 8 (6,4%) 22 (17,6%) 65 (52,0%) 30 (24,0%) 7 (30,4%) 16 (69,5%) 56 (44,8%) 69 (55,2%) 3 (13,0%) 12 (52,2%) 8 (34,8%) 20 (16,0%) 54 (43,2%) 51 (40,8%) 91 5.2. Karakteristik Pemberian ASI. Pemberian ASI dibedakan berdasarkan tingkat eksklusivitas pemberian ASI, frekuensi pemberian ASI dan lama menyusu, lama menyusu eksklusif 5.2.1. Eksklusivitas Pemberian ASI Subyek (bayi) yang mendapat ASI-eksklusif pada kelompok diare rotavirus adalah 8 orang (34,8 %) dan yang mendapat ASI non-eksklusif adalah sebanyak 15 orang (65,2%). Pada kelompok diare bukan rotavirus, sebanyak 43 orang (34,4%) mendapat ASI- eksklusif dan yang mendapat ASI non-eksklusif adalah 82 orang (65,6 %). Proporsi penderita diare rotavirus yang mendapat ASI non-eksklusif adalah dua kali lebih besar bila dibandingkan dengan yang mendapat ASI-eksklusif, demikian pula pada kelompok subyek diare bukan rotavirus (Tabel 2). 5.2.2. Frekuensi Menyusu. Frekuensi menyusu pada bayi dihitung berdasarkan jumlah menyusu selama 24 jam. Rerata jumlah menyusu pada kelompok diare rotavirus adalah 8,65 +2,82 kali, sedangkan pada kelompok diare bukan rotavirus adalah 8,61 + 2,95 kali. Tidak terdapat perbedaan rerata frekuensi menyusu antara kedua kelompok diare ( Tabel 2). 92 5.2.3. Lama Menyusu Lama bayi menyusu diperoleh dari anamnesa pada ibu, dihitung berdasarkan penghitungan waktu yang dibutuhkan sejak bayi mulai menyusu hingga berhenti sendiri menyusu/tertidur, dari satu payudara maupun kedua payudara. Rerata lama menyusu pada bayi yang menderita diare rotavirus adalah 15,65 + 7,73 menit , sedangkan pada bayi yang menderita diare bukan rotavirus adalah 16,22 + 8,79 menit. Dari data yang didapat, lama menyusu antara kedua kelompok tidak jauh berbeda (Tabel 2). 5.2.4. Lama menyusu ASI-eksklusif Pada kelompok diare akut rotavirus yang mendapat ASI-eksklusif adalah 8 orang dengan rerata lama menyusu eksklusif adalah 116,63+/- 48,27 hari. Pada kelompok diare akut bukan rotavirus terdapat 43 orang yang mendapat ASIeksklusif dengan rerata lama menyusu eksklusif adalah 104,60 +/- 45,45 hari. Tidak terdapat perbedaan lama menyusu eksklusif antara kedua subyek penelitian (Tabel 2). 5.2.5. Kandungan antibodi s-IgA antirotavirus ASI Pemeriksaan ASI dilakukan dengan teknik ELISA, hasil pemeriksaan dinyatakan sebagai titer ELISA dalam ukuran unit. Hasil dinyatakan positif bila titer mencapai 28 unit atau lebih, dinyatakan hasil negatif bila titer ELISA di bawah 28 unit (Bishop dkk, 1984). Dari seluruh sampel yang diperiksa, terdapat 4 (17,39 %) sampel yang mengandung antibodi sIgA antirotavirus (> 28 unit) pada 93 kelompok diare rotavirus, sedangkan pada kelompok diare bukan rotavirus yang hasilnya positif adalah 29 (23,2 %) sampel. Sampel pada kelompok diare rotavirus yang tidak mengandung antibodi sIgA antirotavirus adalah 19 (82,61 %), dan pada kelompok diare bukan rotavirus yang mencapai hasil negatif adalah 96 (76,8 %) sampel. Rerata titer antibodi sIgA antirotavirus pada ASI yang diberikan secara eksklusif adalah 30,64 + 12,88 unit, sedangkan pada ASI non-eksklusif adalah 21,00 + 15,45 unit. Proporsi kandungan antibodi sIgA antirotavirus pada ASI antara kedua kelompok subyek yang diteliti tidak berbeda bermakna (Tabel 2). Tabel 2. Karakteristik pemberian ASI dan antibodi sIgA antirotavirus dalam ASI pada penderita diare akut Diare akut rotavirus (n=23) Diare akut nonrotavirus (n=125) Eksklusivitas pemberian ASI: ASI Eksklusif 8 (34,8%) 43 (34,4%) ASI Non – eksklusif 15 (65,2%) 82 (65,6%) Frekuensi menyusu 8,65 + 2,82 8,61 + 2,95 Lama menyusu (menit) 15,65 + 7,73 16,22 + 8,79 Lama menyusu eksklusif (hari) 116,63+48,27 104,60+45,45 Positif 4 (17,39 %) 29 (23,2 %) Negatif 19 (82,61 %) 96 (76,8 %) Ab – sIgA antirotavirus ASI: 94 5.3. Karakteristik penyakit diare 5.3.1. Frekuensi diare Rerata frekuensi diare pada kelompok rotavirus adalah 5,43 + 2,25 kali, dan pada kelompok diare bukan rotavirus memiliki rerata frekuensi diare sebanyak 5,29+/- 2,25 kali dalam 24 jam. Berdasarkan data tersebut di atas, rerata frekuensi diare pada diare yang disebabkan oleh rotavirus hampir sama dengan diare yang disebabkan oleh bukan rotavirus (Tabel 3). 5.3.2. Darah dan lendir pada feses. Pada kelompok diare rotavirus, darah dan atau lendir ditemukan pada 7 (30,4 %) sampel, sedangkan pada kelompok diare bukan rotavirus terdapat sebanyak 36 (28,8 %) sampel mengandung darah dan atau lendir. Terdapat darah dan atau lendir pada 16 (69,6 %) sampel dari kelompok diare rotavirus, dan sebanyak 89 sampel (71,2 %) pada kelompok diare bukan rotavirus. Jadi sebagian besar feses dari subyek penelitian tidak ditemukan adanya darah dan atau lendir (Tabel 3). 5.3.3. Pemberian obat anti diare. Pada kelompok diare rotavirus hanya 1 orang (4,34 %) yang mendapat obat antidiare, dan sebagian besar lainnya yaitu 22 orang (95,65 %) tidak mendapat obat antidiare. Pada kelompok diare bukan rotavirus, terdapat 15 orang (12 %) yang telah mendapat obat antidiare, dan yang tidak mendapat obat antidiare adalah sebanyak 110 orang (88 %). Jadi baik dari kelompok diare 95 rotavirus maupun diare bukan rotavirus hanya sebagian kecil yang telah mendapat obat antidiare sebelum diambil sebagai subyek penelitian (Tabel 3). 5.3.4. Gejala penyerta diare. Penyebaran rotavirus sebagian besar melalui jalur fecal oral, dan sebagian kecil melalui udara/jalur respiratorik maupun kontak langsung terhadap penderita diare rotavirus. Oleh karenanya sering didapatkan gejala lain yang menyertai diare. Pada penelitian ini gejala penyerta diare yang ditemukan adalah panas, muntah, panas disertai muntah; panas, muntah disertai batuk pilek, dan ada beberapa kasus yang tanpa gejala penyerta. Dari 23 kasus diare rotavirus, hanya 11 kasus (47,83 %) yang disertai gejala penyerta. Pada kelompok diare bukan rotavirus terdapat 74 kasus (59,20 %) dengan gejala penyerta. Terdapat perbandingan yang hampir sama jumlah kasus yang disertai gejala penyerta pada kedua kelompok (Tabel 3). 5.3.5. Beratnya penyakit diare. Beratnya penyakit diare dapat dinilai dengan menggunakan sistem skor sesuai dengan kriteria Ruuska dan Vesikari (1990), terdiri atas adanya diare, muntah, dehidrasi, panas yang memerlukan perawatan medis. Digolongan sebagai penyakit diare derajat ringan bila jumlah skor 1-10, dan bila jumlah skor 11 atau lebih digolongkan sebagai penyakit diare derajat berat. Pada penelitian ini dari seluruh subyek yang terpilih (148 orang), hanya 2 orang (1,35 %) yang disertai gejala dehidrasi ringan dan tidak ditemukan adanya komplikasi. Sebagian besar 96 adalah pasien rawat jalan dan selama penelitian berlangsung hanya 2 pasien rawat inap (Tabel 3). 5.3.6. Lama diare Lama diare didapat dari laporan hasil pengamatan orang tua yang dihitung sejak feses mulai cair sampai feses cair yang terakhir kali sebelum feses yang keluar padat. Diukur memakai satuan ukuran jam, dikelompokkan menjadi lama diare kurang dari 24 jam, antara 24 jam s/d 72 jam, lebih dari 72 jam s/d 120 jam, dan lebih dari 120 jam s/d 168 jam adalah lebih dari 168 jam adalah. Dari data yang dapat dianalisa, pada kelompok diare rotavirus terdapat 17 kasus (73,91 %) yang dapat dianalisis, dengan rerata lama diare 143,76 + 72,06 jam. Sedangkan pada kelompok diare bukan rotavirus terdapat 85 kasus (68 %) dengan rerata lama diare 136,62 + 85,8 jam. Hasilnya tidak berbeda antara kelompok diare rotavirus dan diare bukan rotavirus (Tabel 3). 5.3.7. Hasil pemeriksaan feses Feses diperiksa dengan teknik ELISA capture test, hasil pemeriksaan dinyatakan sebagai unit Positive Ratio dengan rumus = ((Ave,Sampel O.D. – Ave.Neg. O.D.) dibagi (Ave.Positive O.D. – Ave.Neg. O.D)) X 100. Yang diamaksud dengan “ave= average” rata-rata kepekatan optik (OD=optical density). Pada kedua kelompok kasus yaitu yang mendapat ASI-eksklusif, rerata rasio titer ELISA feses adalah 0,10 + 0,14. Sedangkan pada kelompok penderita diare akut yang mendapat ASI non-eksklusif adalah 0,12 + 0,15. Tampak disini 97 rasio titer ELISA feses (viral load) pada kelompok yang mendapat ASI-eksklusif lebih rendah dari kelompok yang mendapat ASI non-eksklusif. Sebagai catatan penilaian terhadap ada tidaknya rotavirus pada feses, dapat pula dinilai berdasarkan adanya perubahan warna absorben (menjadi biru) yang bisa dilihat dengan penglihatan kasat mata. Hasil pemeriksaan dinyatakan sebagai positif dan negatif (Tabel 3). Tabel 3.Karakteristik penyakit diare akut dan rasio antigen rotavirus feses Diare Akut Rotavirus (n=23) Non-rotavirus (n=125) 1. Frekuensi diare (mean + SD 5,43 + 2,25 5,29 + 2,25 2. Darah dan atau lendir dalam feses Ya. Tidak 7 (30,1 %) 16 (69,9 %) 36 (28,8 %) 89 (71,2 %) 3. Pemberian obat diare Ya Tidak 1 (4,5 %) 22 (95,5 %) 4. Gejala penyerta diare Panas Muntah Panas dan muntah Batuk, pilek, panas dan muntah 4 (36,4 %) 0 2 (18,2 %) 5 (45,5 %) 5. Lama diare (jam) (mean + SD) 143,76 + 72,06 6. Rasio antigen rotavirus feses ASI-eksklusif ASI non-eksklusif 0,10 + 0,14 0,12 + 0,15 15 (12,3 %) 110 (87,7 %) 15 (12,3 %) 1 (1,4 %) 3 (4,1%) 55 (74,3 %) 136,62 + 85,8 98 5.4. Hubungan antara faktor karakteristik subyek dengan risiko dan lama diare akut rotavirus Analisis terhadap faktor karakteristik subyek yang berhubungan dengan risiko dan lama diare akut rotavirus menunjukkan, bahwa faktor usia bayi, jenis kelamin , jumlah saudara, tingkat pendidikan ibu, jenis pekerjaan ibu, dan higiene perorangan ibu, tidak terbukti memengaruhi kejadian diare akut rotavirus. Semua nilai RO tidak menunjukkan perbedaan yang signifikan dengan nilai p> 0,05 (Tabel 4). Tabel 4.Hubungan antara faktor-faktor karakteristik subyek dengan risiko dan lama diare akut rotavirus Karakteristik Subyek Usia Bayi 5 – 6 bulan Jenis kelamin Laki – laki Jumlah saudara 1* Tingkat pendidikan SMU Jenis pekerjaan Didalam rumah Higiene perorangan Kadang – kadang mencuci tangan Diare Akut RV n = 23 Diare Akut Non RV n = 125 OR (95% Cl) Nilai P Lama Diare Akut < Median > Median 7 (30,4%) 42 (33,6%) 1,39(0,31-6,14) 0,98 1(12,5%) 5(55,6%) 11 (47,8%) 62 (49,6%) 1,07(0,44-2,62) 0,88 5(62,5%) 2(22,2%) 20 (87,0%) 101 (80,8%) 0,63(0,15-2,62) 0,51 8(100%) 8(88,9%) 12 (52,2%) 65 (52,0%) 1,35(0,2607,18) 0,72 2(25,0%) 2(22,2%) 7 (30,4%) 56 (44,8%) 0,54(0,21-1,4) 0,2 5(62,5%) 5(55,6%) 12 (52,2%) 54 (43,2%) 0,68(0,17-2,64) 0,57 3(37,5%) 7(77,8%) Catatan: dari hasil analisis bivariat, semua variabel menunjukkan nilai p> 0,25 , oleh karenanya uji analisis multivariat tidak dilakukan karena tidak ada nilai p variabel yang bernilai < 0,25 sebagai syarat uji analisis multivariat. 99 5.5. Hubungan antara pola pemberian ASI dengan risiko terjadinya diare akut rotavirus Proporsi penderita diare akut rotavirus yang mendapat ASI-eksklusif lebih kecil dari pada yang mendapat ASI non-eksklusif, demikian pula pada penderita diare akut bukan rotavirus perbandingan proporsinya hampir sama. Dari 23 kasus diare akut rotavirus sebanyak 8 orang (34,8 %) mendapat ASI-eksklusif dan 15 orang (65,2 %) mendapat ASI non-eksklusif. Risiko terjadinya penyakit diare akut rotavirus pada yang mendapat ASIeksklusif dan ASI non-eksklusif tidak berbeda bermakna. Berdasarkan hasil analisis statistik didapatkan nilai RO 1,21 (CI 95 %: 0,45-3,28), dan nilai P = 0,28 (Tabel 5). Tabel 5. Hubungan antara pemberian ASI- eksklusif dan risiko terjadinya diare akut rotavirus (analisis Mantel-Haenszel) Pasangan Ks pos,jum.pos kr=0 Ks pos,jum.pos kr=1 Ks pos,jum.pos kr=2 Ks pos,jum.pos kr=3 Ks neg,jum.pos kr=0 Ks neg,jum. pos kr=1 Ks neg,jum. pos kr=2 Ks neg,jum. pos kr=3 Total Frek.(N) 2 4 3 1 3 7 2 1 23 Persent.(%) 8,7 17,4 13,0 4,3 13,0 30,4 8,7 4,3 100 Keterangan Ks pos: diare rotavirus + ASI Eksklusif Ks neg : diare rotavirus + ASI non eksklusif Kr pos: diare non rotavirus + ASI eksklusif Kr neg : diare non rotavirus + ASI non eksklusif Nilai X2-Square Mantel-Haenszel adalah RO 1,21 (CI 95 %: 0,45-3,28) ,p= 0,28 100 5.6. Hubungan antara pemberian ASI yang mengandung antibodi sIgA antirotavirus dengan risiko terjadinya diare akut rotavirus Kelompok subyek yang mendapat ASI yang mengandung antibodi sIgA antirotavirus 4 orang (17,39 %), dan yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus adalah 19 orang (82,61 %), proporsinya adalah satu dibanding empat. Pada kelompok diare akut bukan rotavirus, sebanyak 29 orang (23,29 %) mendapat ASI yang mengandung antibodi sIgA antirotavirus dan 96 orang (76,71 %) mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus. Perbandingannya adalah satu banding tiga. Risiko terjadinya diare akut rotavirus yang mendapat ASI yang mengandung antibodi sIgA antirotavirus, nilai RO adalah 1,12 (CI 95 %: 0,29 – 4,29) dengan nilai p = 0,203 (Tabel 6). Tabel 6. Hubungan antara Ab-sIgA antirotavirus ASI dengan risiko diare akut rotavirus (analisis Mantel-Haenszel) Pasangan Ks pos,jum.pos kr=0 Ks pos,jum.pos kr=1 Ks neg,jum.pos kr=0 Ks neg,jum.pos kr=1 Ks neg,jum.pos kr=2 Total Frek.(N) Persent.(%) 1 3 13 4 2 23 4,2 12,9 56,4 17,4 8,7 100 Keterangan Ks pos: diare rotavirus + Ab-sIgA positif Ks neg : diare rotavirus + Ab-sIgA negatif 101 Kr pos: diare nonrotavirus + Ab-sIgA positif Kr neg: diare nonrotavirus + Ab-sIgA negatif Nilai X2-Square Mantel-Haenszel adalah RO 1,12 (CI 95 %: 0,29-4,29), p= 0,203 5.7 Hubungan antara faktor-faktor yang memengaruhi lama diare akut rotavirus. Pada penelitian ini faktor yang berhubungan dengan lama diare akut rotavirus adalah pola pemberian ASI, kandungan antibodi sIgA antirotavirus di dalam ASI. Dari 8 kasus diare akut rotavirus yang mendapat ASI-eksklusif, terdapat 4 kasus yang ada data mengenai lama diare. Rerata antibodi sIgA antirotavirus pada kasus yang mendapat ASI-eksklusif 30,46 (+ 12,87) unit, dan pada kelompok ASI non-eksklusif adalah 20,99 (+15,44) unit. Perbedaan rerata kadar sIgA antirotavirus antara kelompok diare rotavirus yang mendapat ASIeksklusif dan yang mendapat ASI non-ekklusif tidak signifikan di mana nilai p = 0,20 (p> 0,05). Sebagai tambahan, hasil pemeriksaan antigen rotavirus feses berdasarkan rasio, didapat rerata rasio antigen rotavirus pada feses (viral load) yang mendapat ASI-eksklusif adalah 0,098 (+ 0,185), dan yang mendapat ASI non-eksklusif adalah 0,119 (+ 0,145) dengan nilai p = 0,76 (p> 0,05). Rerata lama diare pada kelompok dengan ASI-eksklusif 150,75 (+ 99) jam, dan pada kelompok noneksklusif adalah 141,62 (+ 66,71) jam dengan nilai p = 0,83 (p> 0,05). 102 Tabel 7. Hubungan antara pemberian ASI eksklusif dengan lama diare akut rotavirus. Lama Diare akut rotavirus (jam) ASI – eksklusif ASI non eksklusif 150,75 + 99,06 141,62 + 66,71 Nilai P 0,83 Lama diare akut rotavirus hubungannya dengan pemberian ASI yang mengandung antibodi sIgA antirotavirus, dibedakan menjadi yang mendapat ASI yang mengandung antibodi sIgA antirotavirus dan tidak mengandung antibodi sIgA antirotavirus. Dari 23 kasus diare akut rotavirus, sebanyak 17 kasus yang dapat dianalisis data lama diarenya. Dari jumlah tersebut 4 orang (26,1 %) mendapat ASI yang mengandung antibodi sIgA antirotavirus (> 28 unit), dan 13 orang (73,9 %) mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus (< 28 unit). Hasil analisis menunjukkan bahwa, rerata lama diare pada kelompok yang mendapat ASI mengandung antibodi sIgA antirotavirus 135,62 (+ 84,74) jam dan kelompok yang mendapat ASI tidak mengandung antibodi sIgA antirotavirus sebesar 138,53 (+ 83,48) jam. Perbedaan tersebut tidak signifikan, di mana nilai p= 0,88 (Tabel 8). Tabel 8. Hubungan antara antibodi sIgA antirotavirus ASI dengan Lama Diare Akut Rotavirus s-IgA antirotavirus positif (>28) n=6 Lama diare akut Rotavirus 135,62 + 84,74 sIgA antirotavirus negatif (< 28) n = 11 Nilai p 138,53 + 83,48 0,88 103 BAB VI PEMBAHASAN 6.1. Karakteristik Subyek Penelitian 6.1.1. Karakteristik Bayi a. Usia bayi Dari 161 sampel yang didapat (sejak bulan November 2008 s/d Januari 2011), terdapat 148 orang bayi yang memenuhi syarat penelitian. Subyek yang menderita diare rotavirus adalah 23 orang (15,5 %). Berdasarkan sebaran umur, proporsi diare rotavirus terbanyak pada kelompok usia 5-6 bulan, tidak berbeda dengan proporsi pada kelompok diare bukan rotavirus. Berdasarkan sebaran umur, hasil pada penelitian ini tidak berbeda dengan yang dilaporkan oleh beberapa peneliti terdahulu. Kejadian diare akut rotavirus pada anak yang berusia < 6 bulan yang dirawat karena penyakit berkisar antara 12-17 % (Mann dkk,2001; Lawrence dan Pane, 2007). Demikian pula hasil Surveilance Rotavirus di rumah sakit Sanglah Denpasar (Surv.RV, 2007), kejadian diare akut rotavirus sebesar 15 % pada anak yang berusia < 6 bulan yang dirawat dan proporsi diare akut rotavirus meningkat dengan bertambahnya usia. Temuan yang berbeda dilaporkan oleh Grace dan Jerald (2010) di Zaire, kejadian diare rotavirus pada anak usia 1-6 bulan mencapai 25,3 % yang dirawat dan proporsinya tertinggi dibandingkan kelompok umur lainnya. Kejadian diare akut rotavirus di negara Amerika Latin bervariasi antara masing-masing daerah yang berbeda dalam hal geografis, demografis dan situasi sosial lainya. Pada anak 103 104 berusia < 6 bulan proporsi diare akut rotavirus 20-60 % dan kejadiannya tertinggi pada usia 6-11 bulan (Kane dkk, 2004). Berdasarkan sebaran usia, terdapat kecendrungan meningkatnya kejadian diare rotavirus pada usia yang lebih tua. b. Jenis kelamin. Hasil dari penelitian ini menunjukkan, tingkat kejadian diare rotavirus tidak berbeda antara pada anak lelaki dengan anak perempuan. Temuan ini hampir sama dengan yang dilaporkan oleh Wobudeya dkk (2011). Kejadian diare rotavirus pada usia di bawah 6 bulan yang dirawat antara anak laki dan perempuan adalah 45,1 % : 54,9 %. Pada anak yang berusia > 6 bulan, terdapat perbedaan kejadian diare akut rotavirus antara anak laki dengan anak perempuan. Nakawesi dkk (2010), melaporkan kejadian diare rotavirus pada anak berusia < 24 bulan lebih tinggi pada anak laki daripada anak perempuan dengan perbandingan 3:1. Sedangkan Mann dkk (2001) menemukan kejadian diare akut rotavirus pada anak yang berusia < 5 tahun pada anak laki dua kali lebih besar daripada anak perempuan. Berdasarkan temuan Intusuma dkk (2008), perbandingan kejadian diare akut rotavirus antara anak laki dan perempuan adalah 1,7:1. Hal ini menunjukkan bahwa terdapat perbedaan kejadian penyakit diare akut rotavirus antara anak laki dengan perempuan dengan meningkatnya usia. Sebagai salah satu penyebabnya adalah ketika anak mulai aktif mengeksplorasi 105 lingkungan anak laki lebih aktif daripada anak perempuan sehingga kemungkinan kontak dengan mikroba patogen lebih besar. c. Berat badan. Rerata berat badan pada kelompok diare rotavirus adalah 6.582 gram dan 6.634 gram pada kelompok diare bukan rotavirus. Tidak ditemukan perbedaan rerata berat badan antara kedua kelompok subyek. Subyek pada penelitian ini adalah memiliki status gizi baik dan sedang mendapat ASI, seperti telah diketahui ASI merupakan sumber nutrisi utama pada bayi yang berusia < 6 bulan. Pemberian ASI-eksklusif pada bayi usia 0-6 bulan, cukup untuk memenuhi kebutuhan bayi untuk tumbuh kembang pada usia tersebut (WHO,2001). Perbandingan bayi yang mendapat ASI-eksklusif maupun ASI bukan eksklusif pada kedua kelompok hampir sama. Selain itu kelompok yang mendapat ASI yang proporsinya lebih sedikit dari pada makanan bukan ASI sangat kecil sehingga tidak berpengaruh terhadap rerata berat badan bayi secara keseluruhan. d. Jumlah saudara dalam satu rumah. Adanya saudara dalam satu rumah berhubungan dengan sumber penularan penyakit, dan merupakan salah satu faktor risiko diare akut rotavirus (Grace dan Jerald, 2010). Pada penelitian ini, sebagian besar subyek termasuk anak tunggal atau tidak memiliki saudara. Ini terjadi pada kedua kelompok subyek, secara statistik tidak berbeda bermakna (p= 0,51). 106 Tingkat paparan terhadap mikroba pada anak sampai berusia 6 bulan berhubungan dengan kontak dengan anggota keluarga termasuk orang tua/pengasuh yang berfungsi sebagai pembawa virus, selain malalui makanan yang terkontaminasi. Di Indonesia belum ada data mengenai tingkat paparan anak atau orang dewasa terhadap rotavirus. Suatu penelitian yang berkaitan dengan tingkat paparan terhadap rotavirus pada anak sehat yang berusia 6 bulan sampai usia 3 tahun, yang pernah di rawat di ruang rawat sehari, rotavirus ditemukan pada 5,58 % anak yang diperiksa fesesnya (Tasic dkk, 2006). Pemeriksaan terhadap ibu laktasi yang dirawat di rumah sakit Umum di New York (Riepenhoff-Talty dkk, 1997), dan ibu postpartum di Jerman (Brussow dkk, 1991) menunjukkan, tingkat paparan terhadap rotavirus masing-masing sebesar 30 % dan 40 %. Ini menunjukkan tingkat paparan meningkat pada usia yang lebih tua. Tingkat paparan ibu laktasi terhadap rotavirus pada penelitian ini relatif rendah, mencapai 22 % (berdasarkan kandungan antibodi sIgA antirotavirus di dalam ASI).Temuan ini berbeda dengan hasil penelitian terdahulu. Perbedaan tersebut disebabkan pada kriteria sampel yang dipakai. Pada penelitian Riepenhoff-Talty dkk (1997) sampel yang diperiksa adalah kadar antibodi IgG serum darah ibu, sedangkan pada penelitian Brussow dkk (1991) adalah ASIkolostrum yang kandungan antibodi sIgA-nya lebih tinggi daripada ASI matur. Walaupun demikian hasil penelitian ini belum mencerminkan tinggkat paparan ibu laktasi terhadap rotavirus di masyarakat, karena sampel yang terpilih berasal dari penderita diare yang berobat ke rumah sakit maupun tempat pelayanan kesehatan swasta. 107 6.1.2. Karakteristik Ibu a. Usia Ibu Rerata usia ibu pada kelompok diare rotavirus adalah 28,22 tahun, dan pada kelompok diare bukan rotavirus adalah 28,47 tahun. Berdasarkan data yang ada, usia ibu tidak berpengaruh terhadap kejadian diare yang disebabkan rotavirus. Hasil penelitian Sethi dkk (2001) menunjukkan bahwa usia ibu dibawah 20 tahun merupakan salah satu faktor yang dapat meningkatkan risiko terjadinya diare rotavirus pada bayi. Dari penelitian ini, ibu yang berusia di bawah 20 tahun proporsinya sangat kecil sehingga tidak memengaruhi hasil secara keseluruhan. b. Paritas Rerata jumlah kehamilan (paritas) ibu pada kedua kelompok subyek tidak berbeda. Sebagian besar ibu mengalami kehamilan yang pertama kali, proporsinya adalah 52,2 % kelompok diare rotavirus, dan 48,8 % pada ibu dari kelompok diare bukan rotavirus, keduanya tak berbeda secara bermakna (p= 0,51). Tingkat paritas berhubungan dengan kualitas ASI yang dihasilkan, termasuk pula komponen imun ASI yang berkaitan dengan pengalaman ibu terpapar mikroba pada masa laktasi. Prentice dkk (1983) melaporkan bahwa para ibu Gambia, yang berusia lebih muda dengan tingkat paritas yang lebih kecil memiliki ASI dengan kadar antibodi sIgA yang lebih tinggi. Weaver dkk (1998) menemukan bahwa, jumlah paritas yang lebih besar dan pada usia yang lebih tua memiliki ASI dengan berat jenis lebih rendah yang memengaruhi kadar antibodi sIgA ASI. 108 Hasil-hasil dari penelitian di atas tidak secara khusus berkaitan dengan tingkat paparan ibu terhadap mikroba tertentu. Pada penelitian ini yang dikaitkan dengan tingkat paparan ibu terhadap rotavirus menunjukkan bahwa sekitar limapuluh persen ibu mengalami hamil yang pertama kali dan kandungan antibodi sIgA antirotavirus ASI yang diperiksa hanya terdapat pada 22 % sampel. Hasil penelitian ini menunjukkan bahwa, terdapat perbedaan kandungan antibodi sIgA antirotavirus yang rendah pada tingkat paritas yang rendah. Penyebabnya adalah antibodi yang diukur hanya berhubungan dengan sIgA antirotavirus. c. Tingkat Pendidikan Ibu Tingkat pendidikan ibu pada kedua kelompok subyek diare hampir sama, sebagian besar berpendidikan setingkat SLTA masing-masing 52,2 % pada kelompok diare rotavirus, dan 52 % pada kelompok diare bukan rotavirus. Secara statistik tidak berbeda bermakna. Ini menunjukkan bahwa tingkat pendidikan ibu tidak berpengaruh terhadap kejadian diare akut rotavirus. Tingkat pendidikan ibu berhubungan dengan pemahaman ibu terhadap cara merawat anak, termasuk memberi makan dan menjaga kebersihan diri. Seperti yang tertuang dalam laporan WHO (2000), tingkat pendidikan ibu yang relatif rendah berkaitan dengan kekerapan pemberian ASI dan tingkat kematian bayi yang disebabkan oleh penyakit diare. Nakawesi dkk (2010) menemukan bahwa, pendidikan ibu pada tingkat menengah ke atas pada anak < 2 tahun yang dirawat karena diare, secara bermakna berhubungan dengan kejadian diare rotavirus. Sedangkan Dennehy dkk (2006), tingkat pendidikan ibu yang rendah 109 berpengaruh terhadap kejadian diare akut rotavirus pada anak yang dirawat karena diare di Amerika Serikat. Perbedaan hasil penelitian ini dengan penelitian terdahulu disebabkan oleh perbedaan dalam hal usia subyek dan derajat berat diare yang diteliti. Pada penelitian ini subyek berusia 1-6 bulan, dengan diare derajat ringan. d. Jenis Pekerjaan ibu Pekerjaan ibu dibedakan menjadi, ibu yang bekerja di dalam rumah dan di luar rumah. Ibu yang bekerja di luar rumah kemungkinan lebih jarang memberi ASI dan lebih mungkin anaknya tertular mikroba melalui makanan pendamping ASI yang tercemar. Terdapat perbedaan proporsi ibu yang bekerja di luar rumah dan yang bekerja di dalam rumah, tetapi secara statistik tidak menunjukkan perbedaan yang bermakna. Ini berarti, jenis pekerjaan ibu tidak berhubungan dengan kejadian diare akut rotavirus. Sebagai perbandingan, pada penyakit diare akut rotavirus yang memerlukan perawatan, faktor pekerjaan ibu tidak memengaruhi prevalensi diare akut rotavirus, hal ini tampak dari hasil penelitian pada para ibu di Uganda (Nakawesi dkk, 2010). Jadi berdasarkan hasil temuan Nakawesi dkk (2010) maupun berdasarkan hasil yang ditemukan pada penelitian ini, faktor pekerjaan ibu tidak berhubungan dengan kejadian diare akut rotavirus. e. Higiene perorangan. Yang dimaksud dengan higiene perorangan pada penelitian ini adalah kekerapan ibu mencuci tangan dengan cara yang benar ketika akan memegang 110 bayinya. Para ibu dari kelompok diare rotavirus, 52,2 % termasuk pada katagori kadang-kadang mencuci tangan, sedangkan para ibu dari kelompok diare bukan rotavirus adalah 43,2 %. Demikian pula para ibu yang termasuk jarang sekali mencuci tangan juga serupa (34,8 % VS 40,8 %). Perbedaan proporsi ini tidak bermakna berdasarkan penghitungan statistik (nilai p= 0,57). Dalam beberapa kepustakaan yang memuat kaitan antara kejadian diare akut rotavirus pada anak berusia < 5 tahun dengan higiene dan sanitasi, kejadian diare akut rotavirus tidak berbeda antara tempat-tempat yang dengan status higiene dan sanitasi yang berbeda-beda. Salah satu laporan menyatakan bahwa kejadian diare akut rotavirus tetap tinggi dan tidak berbeda anara negara industri dan negara berkembang. Ini menunjukkan bahwa, faktor sanitasi tidak begitu berperan dalam menurunkan penyebaran rotavirus (WHO, 2001). Parashar dkk (2006) menyimpulkan bahwa, terjadi peningkatan proporsi diare akut rotavirus di masyarakat sebagai akibat menurunnya kejadian diare yang disebabkan bakteri maupun parasit. Ini merupakan dampak dari perbaikan sanitasi, penyediaan air bersih dan perawatan pada anak. Jadi status higiene perorangan tidak berhubungan dengan kejadian diare akut rotavirus. 6.2 Karakteristik Pemberian ASI 6.2.1. Eksklusivitas pemberian ASI Pada penelitian ini, proporsi yang mendapat ASI-eksklusif tidak berbeda antara kelompok diare rotavirus dan diare bukan rotavirus, dengan nilai p= 0,28. Hubungan antara pemberian ASI dengan penyakit diare dibedakan menjadi: 111 a.Hubungan antara pemberian ASI-eksklusif dengan kejadian diare Pemberian ASI dan ASI-eksklusif berhubungan dengan kejadian diare yang lebih rendah. Studi kasus kontrol yang berbasis komunitas pada anak usia di bawah satu tahun menunjukkan, adanya asosiasi antara pemberian ASI (eksklusif, non-eksklusif) dengan menurunnya kejadian penyakit diare dibandingkan pada anak yang tidak mendapat ASI. Efek proteksi ini terlihat lebih kuat pada anakanak yang tinggal di rumah sewaan dan tempat hunian yang lebih padat (Quigley dkk, 2006). Penelitian kohort mengenai kejadian diare pada anak yang dirawat menunjukkan, bahwa pemberian ASI-eksklusif dapat mencegah anak dirawat karena penyakit diare dan efek pencegahannya lebih besar daripada pemberian ASI non-eksklusif (Quigley dkk, 2007; Talayero dkk, 2006). Jadi pemberian ASI (eksklusif maupun non-eksklusif), dapat memberi proteksi terhadap penyakit diare terutama pada anak yang tinggal di lingkungan padat hunian. Pemberian ASIeksklusif dapat mengurangi paparan terhadap mikroba yang berasal dari lingkungan yang terkontaminasi. Hasil dari penelitian ini menunjukkan perbedaan dengan penelitian terdahulu, beberapa faktor dapat menjadi penyebab. Pertama dalam hal kepadatan hunian, lebih dari limapuluh persen subyek tidak memiliki saudara di dalam satu rumah. Jadi bukan tempat hunian yang padat. Kedua, efek proteksi ASI pada penelitian ini hanya ditujukan terhadap diare akut rotavirus, berbeda dengan penelitian tersebut di atas yang menilai efek proteksi ASI tarhadap penyakit diare secara keseluruhan. Penelitian Quigley dkk (2006), dilakukan diberbagai tempat di Inggris yang mewakili daerah kota yang padat maupun pedesaan dengan 112 memakai “skor Jarman”. Berdasarkan adanya perbedaan tersebut hasil dari penelitian ini tidak dapat dibandingkan. Tingkat proteksi ASI terhadap penyakit infeksi, paling baik pada pemberian ASI-eksklusif dan dominan ASI. Hal ini tidak berhubungan dengan status sosial dan meliputi semua lapisan masyarakat (Sadeharjau dkk, 2007; Raisler dkk, 1999). Pada penelitian ini pemberian ASI dikelompokkan menjadi ASI-eksklusif dan non-eksklusif. Pemberian ASI secara eksklusif berhubungan dengan kekerapan mendapat ASI yang lebih tinggi dan kemungkinan yang lebih kecil untuk terpapar mikroba patogen melalui makanan yang dikonsumsi. Pada penelitian ini proporsi yang mendapat ASI-eksklusif jauh lebih kecil daripada yang mendapat ASI non-eksklusif dengan lama menyusu ASI-eksklusif rata-rata kurang dari empat bulan. Hal ini memberi efek terhadap kejadian diare akut (rotavirus, bukan rotavirus) yang lebih tinggi pada kelompok usia 4 bulan ke atas. b. Hubungan antara pemberian ASI-eksklusif dengan kejadian diare akut rotavirus Suatu studi kasus kontrol pada anak berusia < 6 bulan yang dirawat karena diare dibandingkan dengan anak diare yang tidak dirawat, menunjukkan adanya asosiasi antara pemberian ASI-eksklusif dengan risiko diare akut rotavirus berat (Clemens dkk,1993). Kurugol dkk (2003) dengan metodologi yang sama membandingkan dengan penderita yang dirawat bukan karena penyakit diare, menemukan adanya asosiasi antara pemberian ASI-eksklusif dan risiko diare akut rotavirus. Hasil yang berbeda dilaporkan oleh Wobudeya dkk (2011), di mana pemberian ASI-eksklusif maupun dominan ASI tidak berhubungan dengan 113 kejadian diare rotavirus. Penelitian yang dilakukan secara prospektif pada anak sampai usia < 24 bulan, menunjukkan insiden diare rotavirus yang lebih rendah pada anak yang mendapat ASI-eksklusif. Namun proporsi anak yang mendapat ASI-eksklusif sangat rendah, tidak cukup representatif untuk dinilai kekuatan proteksinya (Naficy dkk, 1999). Misra dkk (2007) pada penelitian longitudinal terhadap anak usia < 1 tahun, menemukan bahwa tidak terdapat perbedaan insiden diare akut rotavirus antara anak yang mendapat ASI-eksklusif dan ASI noneksklusif. Jadi berdasarkan temuan dari beberapa peneliti terdahulu terdapat hasil yang berbeda-beda dalam hal tingkat proteksi ASI-eksklusif terhadap kejadian diare akut rotavirus. Penelitian ini bersifat retrospektif, subyek adalah penderita diare derajat ringan dengan rentang usia 1-6 bulan dan pembandingnya adalah penderita diare bukan rotavirus. Pada penelitian retrospektif memungkinkan terjadinya bias “recall”, yang dalam penelitian ini dapat berasal dari data mengenai pemberian ASI. Faktor pembanding dapat pula menjebabkan hasil yang berbeda. Dengan memakai pembanding penderita diare, perbedaan tingkat proteksi ASI-eksklusif di antara penyakit diare dengan berbagai etiologi amat kecil karena ASI-eksklusif memberi proteksi terhadap kejadian diare secara keseluruhan (diare rotavirus dan diare bukan rotavirus). 6.2.2. Frekuensi Menyusu Yang dimaksud dengan frekuensi menyusu pada penelitian ini adalah jumlah menyusu yang dilakukan bayi dalam 24 jam. Dari penelitian ini kekerapan 114 menyusu pada kelompok diare rotavirus tidak berbeda dengan kelompok diare bukan rotavirus, frekuensi masing-masing adalah 8,65 kali dan 8,61 kali. Sebagai perbandingan pada penelitian pendahuluan yang dilakukan di rumah sakit Sanjiwani Gianyar pada bayi sehat yang berusia 0-6 bulan, frekuensi menyusu eksklusif 11,6 kali dalam 24 jam. Pengamatan terhadap hal-hal yang berhubungan dengan kekerapan menyusui dilakukan oleh Cohen dkk (1995). Pengamatan dilakukan dalam 12 jam perhari, menunjukkan bahwa rerata frekuensi menyusu pada bayi yang mendapat ASI-eksklusif adalah 6,7-8,9 kali, dan yang mendapat ASI non-eksklusif adalah 5,4-8,1 kali. Ibu multipara lebih banyak menggunakan waktu untuk menyusui dibandingkan dengan ibu primipara. Jadi bila dibandingkan dengan penelitian yang dilakukan Cohen dkk (1995), penelitian ini yang menggunakan metode retrospektif hasilnya tidak begitu berbeda. 6.2.3. Lama Menyusu Pada bayi yang menderita diare akut rotavirus rerata lama menyusu adalah 15,65 menit, hampir sama dengan kelompok diare bukan rotavirus yaitu 16,22 menit, dengan nilai p = 0,77. Lama menyusu dan frekuensi menyusu berkaitan dengan kapasitas bayi mengatur kebutuhannya akan ASI. Menurut Nevile dkk (1988 Dalam : Riordan dan Auerbach, 1999). Volume ASI meningkat pelan-pelan dan mencapai 750 ml perhari pada bulan ketiga sampai bulan kelima pada bayi ASI-eksklusif dan ratarata masukan ASI pada bulan keenam adalah 800 ml/hari. “Intake” menurun ketika bayi mulai mendapat makanan padat. Jadi perolehan ASI dari menyusu 115 meningkat sejalan dengan meningkatnya kebutuhan untuk pertumbuhan, yang pada penelitian ini tidak dibedakan lama menyusu antar kelompok usia. Walaupun demikian kapasitas kelenjar mammaria untuk memproduksi ASI tidak melebihi yang dibutuhkan bayi (Daly dkk, 1993 ; Dalam: Riordan dan Auerbach, 1999). Jadi lama dan frekuensi menyusu tampaknya sangat spesifik bagi setiap bayi, belum ada penjelasan kenapa terjadi hal demikian, dan pada penelitian ini tidak memengaruhi kejadian diare akut rotavirus. Tingkat proteksi ASI tidak berhubungan dengan lamanya bayi mendapat ASI/ASI-eksklusif, terbukti setelah bayi tidak lagi mendapat ASI kejadian diare tidak berbeda antara yang pernah mendapat ASI dan tidak pernah mendapat ASI (Quigley dkk, 2006). 6.2.4. Titer antibodi sIgA antirotavirus ASI Pada penelitian ini subyek pada kelompok diare rotavirus yang mendapat ASI yang mengandung antibodi sIgA antirotavirus adalah 17,39 %, sedangkan pada kelompok diare bukan rotavirus adalah 23,2 %. Secara statistik perbedaan tersebut tidak bermakna dengan nilai RO 1,12 (CI 95 %: 0,29-4,29), nilai p= 0,203. Pada pemeriksaan didapatkan rerata titer ELISA untuk antibodi sIgA yang berhubungan dengan rotavirus pada ASI yang diberikan eksklusif adalah 30,46 unit. Hal-hal yang berhubungan dengan ASI dan kandungan zat imun pada ASI, telah dilaporkan oleh beberapa peneliti menyangkut: a. Hubungan antara usia dan paritas dengan kandungan antibodi sIgA Pada ibu yang berusia lebih muda dengan jumlah paritas yang lebih kecil memiliki ASI yang mengandung antibodi sIgA yang lebih tinggi (Prentice 116 dkk, 1983). Tetapi pada penelitian Henart dkk (1991), justru kadar antibodi sIgA yang lebih tinggi ditemukan pada ibu yang lebih tua dengan jumlah paritas yang lebih tinggi. Pada penelitian ini yang diperiksa adalah kandungan antibodi sIgA yang berhubungan dengan rotavirus. Usia dan paritas dari ibu yang diperiksa ASInya sebagian besar berusia < 30 tahun dengan tingkat paritas rendah (kehamilan pertama kali). Jadi adanya perbedaan hasil dengan penelitian sebelumnya disebabkan oleh perbedaan jenis antibodi yang diperiksa, di mana pada penelitian ini terdapat titer antibodi sIgA antirotavirus yang rendah pada ibu yang berusia lebih muda dengan jumlah paritas satu. b.Hubungan antibodi sIgA antirotavirus ASI dengan kejadian diare akut rotavirus Pemberian ASI yang mengandung antibodi sIgA antimikroba tertentu dapat berfungsi sebagai pemberian imunisasi pasif untuk mencegah timbulnya penyakit diare yang disebabkan oleh jenis mikroba tertentu. Antibodi sIgA ASI termasuk antibodi yang bersifat “neutralizing” yang bekerja di dalam lumen usus halus bayi. Apabila mengandung antirotavirus, antibodi tersebut akan mengikat dan menetralisir antigen rotavirus yang ada di dalam lumen usus halus (Kaetzel, 1991; Pareno dkk, 1999). Hubungan antara pemberian antibodi sIgA antirotavirus dengan pencegahan terhadap diare akut rotavirus dilaporkan oleh Corthesy dkk (2006). Dengan memakai “hewan coba”, antibodi sekretorik IgA monoklonal melalui pemberian secara pasif per oral, tidak dapat mencegah replikasi rotavirus yang ada di dalam sel inang. Feng dkk (2002), yang juga memakai “hewan coba” memerlukan kadar 117 antibodi yang tinggi (3 mg perhari selama 9 hari) untuk mencapai tingkat proteksi yang tinggi. Pada pemberian antibodi dengan dosis yang lebih rendah, diperoleh proteksi yang terbatas. Ini menunjukkan bahwa dosis dan cara pemberian antibodi memengaruhi tingkat proteksi. Peneliti lainnya menemukan bahwa pada pemberian antibodi IgA yang memiliki spektrum luas ataupun yang bersifat spesifik terhada capsid rotavirus VP4 dan VP7, merupakan antibodi yang paling baik tingkat proteksinya pada pemberian secara oral (Corthesy dkk, 2006; Ludert dkk, 2002). Ray dan Kelkar (2004), menunjukkan bahwa rendahnya kadar antibodi “neutralizing”maternal terhadap serotipe rotavirus tertentu, dapat merupakan penyebab infeksi rotavirus pada anak dengan serotipe tersebut. Penelitian lain yang pernah dilakukan adalah pemberian konsentrat susu yang mengandung antibodi antirotavirus pada anak yang dirawat oleh karena diare akut rotavirus. Konsentrat susu tersebut diperoleh dari air susu sapi pada sapi yang sebelumnya diberi vaksin rotavirus yang bersifat “hiperimmunized”. Pada anak-anak yang diberi konsetrat susu yang mengandung antibodi “neutralizing” antirotavirus tinggi, menunjukkan penurunan yang signifikan terhadap durasi ekskresi rotavirus pada feses dibandingkan dengan yang mendapat susu konsentrat yang mengandung antibodi “neutralizing” antirotavirus rendah (Hilpert dkk, 1987). Jadi pada pemberian air susu untuk tujuan pencegahan terjadinya penyakit diare akut rotavirus pada anak, dibutuhkan air susu yang mengandung antibodi sIgA antirotavirus dengan titer tinggi, dan atau memiliki sifat spektrum luas maupun bersifat spesifik terhadap protein rotavirus VP4 dan VP7. 118 Sejak ratusan tahun yang lalu, telah diketahui ASI adalah living tissue yang mengandung imunoglobulin. Telah terbukti bahwa pemberian ASI dapat mencegah diare infantil (Riordan dan auerbach, 1999). Antibodi sekretorik IgA merupakan hasil dari sensitisasi limfosit oleh antigen yang spesifik pada mukosa usus halus maupun mukosa saluran nafas. Sel limfosit tersebut kemudian bermigrasi ke kelenjar mamaria, berubah menjadi sel plasma dan menghasilkan antibodi sIgA yang bersifat spesifik (Telemo dan Hanson, 1996; Goldman dkk, 1983; Hanson, 2007). S-IgA ASI yang mencapai lumen usus halus bayi akan mengikat antigen mikroba yang bersifat spesifik, kemudian dinetralisir dan dikeluarkan melalui proses immune exclusion. Pada penelitian ini rerata titer antibodi sIgA antirotavirus ASI pada bayi yang mendapat ASI-eksklusif amat rendah. Ini merupakan salah satu penyebab pemberian ASI-ekskusif pada penelitian ini tidak berpengaruh terhadap risiko diare akut rotavirus. Faktor lain yang mungkin berpengaruh adalah tingkat spesifisifitas antibodi “neutralizing” pada ASI yang tidak diteliti pada penelitian ini. 6.3. Karateristik penyakit diare. 6.3.1. Frekuensi Diare Diare yang disebabkan oleh infeksi rotavirus menimbulkan gejala klinis berupa diare cair, diare bersifat “profuse” sehingga sering menimbulkan komplikasi dehidrasi maupun lainnya. Gejala ini sebagai akibat kerusakan pada sel enterosit yang fungsinya menyerap garam dan air (Elliot, 2007). 119 Dari penelitian ini rerata frekuensi buang air besar pada diare rotavirus hampir sama dengan diare bukan rotavirus, yaitu kurang lebih lima kali dalam 24 jam. 6.3.2. Darah dan lendir dalam feses. Pada penelitian ini ditemukan gejala klinis berupa diare cair, beberapa kasus disertai lendir dan atau darah pada kedua kelompok diare, dengan perbandingan yang hampir sama. Berdasarkan hasil penelitian terdahulu, dapat terjadi infeksi simultan antara rotavirus dengan mikroba yang lain terutama bakteri, akan tetapi tidak memberi pengaruh kolaboratif terhadap gejala klinis diare rotavirus (Nguyen dkk, 2004; Bardhan dkk, 1992). Diare cair merupakan gejala yang predominan pada infeksi rotavirus dan juga pada anak yang usianya lebih besar. Feses berdarah dan lendir hanya ditemukan pada diare rotavirus bayi prematur (Bass dkk, 2007). Pada penelitian ini adanya gejala klinis berupa adanya darah dan lendir pada feses pada beberapa kasus, boleh jadi merupakan hasil kolaborasi antara infeksi rotavirus dengan jenis mikroba patogen lainnya. 6.3.3. Pemberian obat antidiare. Belakangan terdapat berbagai macam obat yang diduga dapat memengaruhi perjalanan diare antara lain probiotik, prebitotik dikombinasi dengan preobiotik dan obat pengental feses yang mengandung kaolin dan pectin. Dari penelitian ini hampir 95 % subyek tidak mendapat obat antidiare. Dalam 120 kepustakaan disebutkan bahwa obat antidiare yang mengandung adsorben seperti kaolin dan pectin tidak terbukti memberikan efek terhadap perjalanan penyakit diare (Zaid dkk, 1995; Dalam Bass dkk, 2007). Mengenai obat yang tergolong probiotik spesies lactobacillus dan bifidobacterium, berfungsi sebagai barier terhadap spesies enterik yang lebih patogen dan mengatur imunitas humoral terhadap infeksi rotavirus (Van Niel dkk, 2002; Dalam: Bass dkk, 2007). Dalam beberapa penelitian lainnya, tidak cukup bukti efek dari probiotik untuk terapi penyakit diare kecuali terhadap diare yang disebabkan oleh infeksi nosokomial maupun pada kasus antibiotic-associated diarrhea (de Vrese dan Marteau, 2007). 6.3.4. Gejala penyerta diare. Gejala klinis yang timbul pada penyakit diare rotavirus diakibatkan oleh adanya hipersekresi dan menurunnya penyerapan oleh keadaan postiskemik, hiperemi yang diinduksi oleh perubahan mekanisme counter current osmotik lokal (Osborne dkk, 1991; Dalam Bass dkk, 2007). Terdapat beberapa gejala yang menyertai diare di antaranya panas (1-2 hari), muntah (1-3 hari), gejala ekstraintestinal berupa otitis media, pneumonia dan ensefalitis, yang sangat jarang terjadi. Naficy dkk (1999) menemukan, gejala penyerta diare yang lebih ringan pada bayi yang mendapat ASI. Pada diare yang disebabkan oleh infeksi rotavirus gejala klinisnya lebih berat daripada diare bukan rotavirus (Kurugol dkk, 2003). Dari penelitian ini ditemukan gejala penyerta diare seperti panas, muntah, panas dan muntah, panas dan muntah disertai gejala lain seperti batuk dan pilek. Pada sebagian kasus (45%) diare rotavirus tanpa gejala penyerta. Pada diare 121 rotavirus gejala panas disertai muntah proporsinya lebih tinggi daripada diare bukan rotavirus. Hal ini sesuai dengan hasil penelitian sebelumnya di mana muntah merupakan gejala yang menonjol pada diare rotavirus ( Dennehy dkk, 2000). 6.3.5. Beratnya penyakit diare. Beratnya penyakit diare dinilai dengan menggunakan sistem skor berdasarkan kriteria adanya gejala diare, muntah, dehidrasi, gangguan kaseimbangan elektrolit maupun lainnya sehingga memerlukan perawatan di rumah sakit (Ruuska dan Vesikari, 1990). Pada kasus dengan jumlah skor 1-10 dikatagorikan sebagai diare ringan, dan jumlah skor > 10 sebagai diare berat. Pada penelitian ini sebagian besar penderita diare adalah penderita rawat jalan, tidak ditemukan komplikasi, dan hanya 2 kasus diare bukan rotavirus yang mengalami dehidrasi ringan. Kurugol dkk (2003), pada anak yang berusia < 1 tahun yang dirawat gejala dehidrasi pada diare rotavirus lebih banyak daripada pada diare bukan rotavirus (45 % : 19 %), sebanyak 69,1 % tergolong diare berat. Demikian pula dengan lama perawatan, diare rotavirus memerlukan perawatan yang lebih lama daripada diare bukan rotavirus. Jadi perbedaan hasil dalam hal beratnya diare pada penelitian ini disebabkan oleh perbedaan populasi subyek yang diteliti dan kontrol yang dipakai. 122 6.3.6. Lama diare akut rotavirus Terdapat beberapa faktor yang berhubungan dengan lama diare akut rotavirus, satu di antaranya tingkat kerusakan villi usus halus sebagai tempat replikasi rotavirus dan ada tidaknya kerusakan sel epitel di daerah kripte (Little dan Shadduck, 1982). Di dalam sel villus terdapat reseptor dan ensim tempat melekatnya rotavirus yang telah mengalami proses „uncoating”. Pada hewan coba yang mendapat ASI yang mengandung antibodi sIgA antirotavirus, antigen rotavirus ditemukan dalam jumlah kecil di jaringan usus halus dan segera menghilang, namun tidak berpengaruh terhadap lama gejala diare (Holmes dkk, 1976). Pada infeksi yang disebabkan oleh rotavirus, kerusakan yang terjadi pada villi usus halus akan diganti oleh sel kripte dalam waktu kurang dari 4 hari yang belum terdeferensiasi (Boshuizaen dkk, 2003; Mavromichalis dkk, 1977). Bila kerusakan juga terjadi pada sel kripte, pergantian sel didaerah villi akan terhambat dan gangguan fungsi penyerapan akan terus berlangsung (Moon dkk, 1973; Dalam: Little dan Shadduck, 1982). Gejala diare dapat juga timbul oleh adanya rangsangan saraf di jaringan usus halus akibat toksin yang dikeluarkan oleh rotavirus setelah melekat pada sel enterosit. Selanjutnya akan terjadi sekresi interferon maupun zat kemotaktik lainya yang mempengaruhi lama diare (Rollo dkk, 1999; Shaw dkk, 1995). Jadi lama diare akibat infeksi rotavirus dipengaruhi oleh banyak faktor yang berhubungan dengan sistem pertahanan lokal di jaringan usus halus bayi. Faktor tersebut dapat berasal dari ASI yang berfungsi sebagai imunitas pasif , 123 maupun yang berasal dari sistem pertahanan imun lokal di usus halus yang pada usia < 6 bulan belum berfungsi secara optimal. Pada penelitian ini pemberian ASI-eksklusif maupun ASI yang mengandung antibodi sIgA antirotavirus tidak berpengaruh terhadap lama diare akut rotavirus. Sebagai penyebab adalah titer antibodi sIgA antirotavirus yang rendah sehingga tidak cukup kuat untuk mencegah perlekatan antigen rotavirus pada sel enterosit maupun menghambat replikasi rotavirus di dalam sel villus. Selain itu jumlah sampel yang kecil tidak cukup kuat untuk menilai hubungan antara antibodi sIgA antirotavirus dengan lama diare akut rotavirus pada penelitian ini. Faktor yang berasal dari rotavirus antara lain jenis serotipe, beban virus maupun toksisitas toksin yang disekresi oleh rotavirus. Beberapa jenis serotipe rotavirus (G2P4 dan subgrup 1) memberikan gejala diare yang lebih berat dibandingkan serotipe lainnya (Cascio dkk, 2001). Pada penelitian ini tidak dilakukan analisis terhadap serotipe rotavirus yang mungkin berhubungan dengan lama diare akut rotavirus pada subyek yang diteliti. 6.3.7. Hasil pemeriksaan feses Rasio (viral load) feses yang mengandung antigen rotavirus tidak berbeda antara kelompok yang mendapat ASI-eksklusif dan yang mendapat ASI noneksklusif, dengan nilai p= 0,760. Dari data di atas tampaknya ASI-eksklusif tidak berhubungan menurunnya viral load pada feses. Beberapa faktor mungkin dapat sebagai penyebab, dari serotipe antibodi sIgA ASI maupun serotipe rotavirus yang menginfeksi bayi. Seperti yang dilaporkan oleh Ray dan Kelkar (2004), bahwa 124 bayi dapat terinfeksi oleh serotipe rotavirus tertentu yang tidak pernah menginfeksi ibu pada masa laktasi. Jadi berdasarkan semua temuan peneliti terdahulu, terdapat perbedaan hasil dengan penelitian ini desebabkan oleh beberapa hal. Pertama, yang dibandingkan pada penelitian terdahulu adalah antara pemberian ASI-eksklusif dan susu formula, sedangkan pada penelitian ini adalah dengan ASI non-eksklusif. Kedua dalam hal kasus, pada penelitian terdahulu adalah kasus diare akut rotavirus yang di rawat (diare derajat berat) dibandingkan dengan penderita yang dirawat bukan karena diare. Pada penelitian ini kasus adalah diare akut rotavirus (sebagian besar diare derajat ringan) dibandingkan dengan diare bukan rotavirus yang tidak dirawat (diare derajat ringan). Jadi ada perbedaan pada kasus maupun kontrol. 6.4. Temuan Baru Manfaat pemberian ASI-eksklusif pada bayi 1-6 bulan yang mengandung antibodi sIgA antirotavirus, selain dapat mengurangi paparan terhadap mikroba patogen penyebab diare, juga mencegah terjadinya diare akut yang disebabkan oleh rotavirus. Pada penelitian ini antibodi sIgA antirotavirus ASI tidak dapat melindungi bayi dari diare akut rotavirus disebabkan oleh titer yang rendah. Sebagai telah diketahui bahwa, antara antibodi dan antigen berlaku penomena “gembok dan kunci”, artinya “jumlah tangan-tangan” antibodi sIgA antirotavirus yang ada di lumen usus halus bayi harus cukup seimbang agar dapat mengikat seluruh antigen 125 rotavirus yang ada. Selain itu juga harus cocok (bersifat spesifik) sehingga ikatan tersebut dapat terjadi. Demikian pula terhadap antigen rotavirus yang telah melekat pada sel enterosit, diperlukan antibodi IgA yang memiliki spesifisitas terhadap protein rotavirus VP5 dan VP7 agar dapat menetralisir rotavirus sehingga replikasi tidak berlanjut (Ruggeri dan Greenberg, 1991). Berdasarkan fakta tersebut di atas dapat dihasilkan suatu teori bahwa untuk mencegah bayi usia 0-6 bulan dari penyakit diare akut rotavirus melalui pemberian ASI-eksklusif, diperlukan ASI yang mengandung antibodi sIgA antirotavirus yang titernya tinggi. Ini mungkin dapat dicapai melalui pemberian imunisasi rotavirus pada ibu yang memasuki fase laktasi. 6.5 Keterbatasan Penelitian 1. Keterwakilan populasi pada sampel. Sampel pada penelitian ini sebagian besar berasal dari pasien rawat jalan yang tergolong penyakit diare derajat ringan. 2. Penentuan kasus diare rotavirus dan diare bukan rotavirus tidak bisa dilakukan pada awal penelitian, baru ditetapkan setelah terdapat hasil pemeriksaan laboratorium. 3. Adanya keterbatasan jumlah kasus diare rotavirus dan jumlah ASI yang mengandung sIgA antirotavirus, menyebabkan jumlah kontrol yang dipakai adalah satu banding tiga, tentu memiliki keterbatasan dibandingkan bila rasio kasus kontrol satu banding satu 126 3. Data yang didapat secara retrospektif dapat menimbulkan bias “recall” termasuk disini data mengenai lama diare, dan frekuensi menyusu 127 BAB VII SIMPULAN DAN SARAN 7.1. Simpulan 1. Pada bayi 1-6 bulan yang mendapat ASI-eksklusif risiko diare akut rotavirus tidak berbeda dengan yang mendapat ASI non-eksklusif 2. Pada bayi 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus risiko diare akut rotavirus tidak berbeda dengan yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus 3. Pada bayi 1-6 bulan yang mendapat ASI-eksklusif rerata lama diare akut rotavirus tidak berbeda dengan yang mendapat ASI non-eksklusif 4. Pada bayi 1-6 bulan yang mendapat ASI yang mengandung antibodi sIgA antirotavirus rerata lama diare tidak berbeda dengan yang mendapat ASI yang tidak mengandung antibodi sIgA antirotavirus 7.2 Saran Berdasarkan hasil dan pembahasan yang diperoleh pada penelitian ini dapat disarankan sebagai berikut : 1. Perlu diteliti lebih lanjut tingkat paparan ibu laktasi terhadap rotavirus melalui pemeriksaan serotipe antibodi rotavirus di dalam ASI 2. Penelitian multisenter untuk mendapat kasus yang lebih bervariasi sehingga memungkinkan untuk merekrut kasus yang tergolong berat agar dapat mengungkap tentang peran ASI-eksklusif dan kandungan antibodi sIgA antirotavirus ASI terhadap penyakit diare akut rotavirus 127 128 DAFTAR PUSTAKA Abreu MT, Fukata M and Arditi M, dkk. TLR Signaling in The gut in Health and disease. J Immunol, 2005 ; 174 : 4453 – 4460. Abbas AK, Lichtman AH. Celluler and Moleculer Immunology. Fifth Ed. Elsevier Saunders, Philadelphia, 2005 ; 33, 321 : 355 – 357. Akib AP. Imunologi ASI. Dalam: Bedah ASI, Kajian dari Berbagai Sudut Pandang Ilmiah halm.64-70. Hegar B dkk. Penyunting. IDAI cabang DKI, Jakarta 2008. Almela MJ, Gonzales ME and Carrasco I. Inhibition of poliovirus unconting efficiently block the early membrane permeabilization injduced by virus particles. J. Viral, 1991 ; 65 : 2572 – 2577. American Academy of Pediatrics & Work Group on Breasfeeding. Breastfeeding and the use of human milk. Pediatrics.1997;100:1035-1039. Andrews DM, Sealzo AA, Yokoham WM, dkk. Functional interactions between dendritic cells and NK cells during viral infections. Nat.Immunol, 2003 ; 4 : 175 – 181. Arias CF, Isa P, Guerrero CA, dkk. Molecular biology of rotavirus cell entry. Arch Med Res 2002; 33:356-361. Asselin – Pasturel CA, Boostira M, Dalod I, dkk. Mouse type 1 IFN – producing cells are immature APCs with plasmacy toid morphology. Nat.Immunol 2001, 2 : 114 – 115. Bahan Kulias, Immunologi Klinik, Program S – 3 Ilmu Kedokteran Program Pasca Sarjana UNUD, th 2006 – 2007, dikutip dari New Sciene Press Ltd. 2004. Baker D, Taylor H, dan Henderson J. Inequality in infant morbidity : Causes and Consequences in England in the 1990s. ALPAC Study Team. Avon Longitudinal Study of Pregnancy and Childhood. J Epidemiol Community Health 1998;52:451-458. Bardhan PK, Salam MA, and Molla AM. Gastric emptying of liquid in children suffering from acutegastroentristis. Gut. 1992 ; 33 : 26 – 29. Bass ES, Pappano DA, Humiston SG. Rotavirus. Pediatrics in Review 2007; 5: 183-191. 128 129 Betran AP, Mercedes de Onis, Lauer JA, Villar J. Ecological study of effect of breastfeeding on Infant mortality in Latin America. BMJ 2001; 323: 1-5. Bishop RF, Cipriani E, Lund JS, dkk. Estimation of Immunoglobulin G Antibodies in Human Serum Samples by Enzyme – Linked Immunosorbent Assay : Expression of Results as Units Derived from a Standard Curve. J Clin Microbiol 1984; 19: 447 – 452. Black RE, Morris SS, dan Bryce J. Where and why are 10 million children dying every year? Lancet, 2003; 361: 2265-2234. Bland RM, Collins NC, Solarsh G, dkk. Maternal recall of exclusive breast feeding duration. Arch Dis Child 2003; 88: 778-783. Boshuizen JA, Reismerink JHJ, Korteland-van Male AM, dkk. Changes in Small Intestinal Homeostasis, Morphology, and Gene Expression during Rotavirus Infection of Infant Mice. J Virol 2003; 77:13005-13016. Brandtzaeg P. Mucosal immunity: integration between mother and the breast-fed infant. Vaccine 2003; 21: 3382-3388. Bresee JS, Hummelman E, Nelson EA, Glass RI, dkk. Rotavirus in Asia : the Value of Surveilance for informing decisions about the Introduction of new Vaccine. J. Infect Dis. 2005 ; 192 (supli) : S1 – 5. Brussow dkk. Antibodies to seven RV Serotypes in Cord Sera, Maternal Sera, and Colostrum of German Women. J Clin Microbial, 1991; 24 : 2856 – 2859. Cao Z, Hunzel W, Gao X. IRAK : a kinase associated with the interleukin 1 receptor. Sciene, 1996 ; 21 : 1128 – 1131. Ciarlet M, Crawford SE, Chery E, dkk.VLA-2 (alf-2 beta-1) Integrin Promotes Rotavirus Entry into Cells but Is Not Necessary for Rotavirus Attachment. J Virol 2002; 76: 1109-1123. Clemens J, Rao M, Ahmed F, dkk. Breastfeeding and the Risk of Life-Treatening Rotavirus Diarrhea: Prevention or Postponement ?. Pediatrics 1993; 92: 680-685. Cohen RJ, Haddix K, Hurtado E, dan Dewey KG. Maternal activity budgets: feasibility of exclusive breastfeeding for six months among urban women in Honduras. Soc Sci Med 1995; 41 (4): 527-36. Cuadras MA, Areas CF and Lopez S. Rotavirus induce an early membrane permeabilization of MA 104 cells and do not require a low intracelluler Ca 130 – Ca concentration to initiate their replication cycle. J. Virol, 1997 ; 71 : 9065 – 9074. Corthesy B. Round Trip Ticket for Secretary IgA : Role in Mucosal Homeostasis? J Immunol, 2007, 178 : 27 – 32. Corthesy B, Benureau Y, Perrier C, dkk. Rotavirus Anti-VP6 Secretory Immunoglbuline A Contributes to Protection via Intraceller Neutralization but Not via Immune Exclusion J Virol 2006; 80 (21): 10692-10699. Coste A, Sirard JC, Johansen K, dkk. Nasal immunization of mice with virus-like particles protecs offspring against rotavirus diarrhea. J Virol 2000; 74: 8966-8971. Dahlan MS. Statistik untuk Kedokteran dan Kesehatan. Seri Evidence Based Medicine 1.Ed.4. Salemba Medika, Jakarta 2009. Dahlan MS. Statistik Diskriptif dan Uji Hipotesis. Dalam: Statistik Untuk Kedokteran Dan Kesehatan. Cetakan kesatu, halm.61-142. Jakarta, Arkansas, 2004. Dahlan MS. Besar Sampel dalam Penelitian Kedokteran dan Kesehatan. Seri 2, halm.1-50. Jakarta, Arkansas 2005. Daniels KA, Devora G, Lai WC, O‟Donnell CL, dkk. Murine Cytomegalovirus Is Regulated by a Discrete Subset of Reactive with Monoclonal Antibody to Ly49H. J.Exp.Med. 2001 ; 194 : 29 – 44. Dewey KG, Heimig MJ, Nommsen – River LA. Differences in moebidity between breastfed and formula – fed infants. J. Pediatric, 1995 ; 126 : 696 – 702. De Vrese M dan Marteau PR. Probiotics and Prebiotics: Effects on Diarrhea. J Nutr.2007; 137: 803S-811S. Dennehy PH. Transmission of rotavirus and other enteric pathogens in the home. Pediatr Infect Dis J 2000; 19: S103-S105. Dennehy PH, Cortese MM, Begue RE, dkk. A case-control study to determine risk factors for hospitalization for rotavirus gastroenteritis in U.S,children. Pediatr Infect Dis J 2006; 25 (12): 1123-1131. Diagnostic Automation, INC. Rotavirus (Fecal) Antigen Detection ELISA.Web site: www.rapidtest.com ISO 13485-203. 131 Dormitzer PR, Greenberg HB, dan Harrison SC. Purified recombinant rotavirus VP7 forms soluble, calcium-dependent trimers. Virology 2000; 277: 420428. Duffy LC, Byers TE, Riepenhoff-Talty M, La Scolea LJ, dkk. The Effects of Infant Feeding on Rotavirus-Induced Gastroenteritis: A Prospective Study. Am J Public Health 1986; 76: 259-263. Elliott EJ. Acute gastroenteritis in children. BMJ 2007;334:35-40. Favre L, dkk. Secretory IgA Prossesses Intrinsic Modulatory Properties Stimulating Mucosal and Systemic Immune Responses. J of Immunology. 2005, 175 : 2793 – 2800. Feachem RG, dan Koblinsky MA. Interventions for the control of diarrhoeal diseases among young children: promotion of breast-feeding. Bull World Health Organ 1984; 62 (2): 271-291. Feng N, Lawton JA, Gilbert J, dkk. Inhibition of rotavirus replication by a nonneutralizing rotavirus VP6-specific IgA mAb. J Clin.Investig.2002; 109: 1203-1213. Geissmann F, Launay Pasquler B, Lepellfier Y, dkk. A Subset of Human Dendritic Cells Expresses IgA Fc Receptor (CD 89), which Mediates Interalization and Activation upon Cross – Linking by IgA Complexes. J. of Immunology , 2001 ; 166 : 346 – 352. Glass RI, Lew JF, Gangorosa RO, Le Baron CW and HOMS. Estimates of morbidity and mortality rates for diarrheal dissease in American Children. J.Pediatric, 1991 ; 118 : S 27 – S 23. Golantsova NE, dkk. Discrete Domains Within the Rotavirus VP 5 Direct Peripheral Membrane Association and Membrane Permeability. J. of Virology. 2004 ; 78 : 2037 – 2044. Grace P, dan Jerald U. The Prevalence of Group A Rotavirus Infection and Some Risk Factors in Pediatric Diarrhea in Zaren, North Central Nigeria. African J Microbiol Research 2010 ; 4 (14) : 1532 - 1536 Hanson LA, Ahlstedt S, Andersson B, dkk. Protective Factors in Milk and the Development of the Immune System. Pediatrics 1985; 75(suppl): 172-176. Hanson LA, Hahn ZM, Berdes M, dkk. Breasfeeding overview and breast milk immunology. Acta Pediatr JPN, 1994 ; 36 : 557 – 561. 132 Hanson LA. Symposium on ‘Nutrition in early life: new horizon in a new century’. Sesion 1: Feeding and infant development, Breast-feeding and immune function. Proceeding of the Nutrition Society 2007; 66: 384-396. Harsono A. Immunologic Defense Mechanism in Human Milk. Paediatr Indones 1995; 35: 53-64. Hasselbalch H, Engelmann MDM, Ersball AK, dkk. Breast-feeding influences thymic size in late infancy. Eur J Pediatr 1999; 158: 964-967. Heesemann J, Host. Defense against microorganisme : nonspecific defense. Dalam Molecular infection biology interactions between microorganisme and cells. Wiley – Liss USA, 2002 ; 7 – 26. Heesemann J dan Hacker J. Medically Significant Pathogens, Dalam : Molecular Infection Biology Interactions Between Microorganism and Cell’s. English Ed. USA ; Willey – Liss, 2002 : 29 – 23. Henart PF, Bressean DJ, Decologne – Desnoech JB, dkk. Lysozyme, Lactoferin, and secretary immunoglobulin A content in breasr milk influence of duration of lactotion. Am.J.Clin Nutr, 1991 ; 53 : 32 – 39. Hilpert H, Brussow H, Mieteus C, dkk. Use of Bovine Milk Concentrate Containing Antibody to Rotavirus to Treat Rotavirus Gastroenteritis in Infants. J Infect Dis 1987; 156 (1): 158- 161. Holmes LH, Kodger SM, Schnagi RD, dan Ruck BJ. Is lactase the receptor and uncoating enzyme for infantile enteritis (rota) virusis ? Lancet 1976; 1: 1387-1389. Holmgren J dan Czerkinsky C. Mucosal immunity and vaccines. Nat Med.Supply, 2005 ; 11 : S 45 – S 51. Honorio – Franca AC, Launary P, Carneiro – Samhaio MMS, and Monteiro RC, dkk. Colostrol neutrophils express Fc α receptors (CD89) lacking γ chain association and mediate noninflamantary properties of secretory IgA. J. Leukoc.Biol. 2001; 69 : 289 – 296. Ikeda M, Sugiyama K, Tanaka T, Tanaka K, dkk. Lactoferin markedly inhibits hepatitic virus infection in cultured human hepatocytes. Biochem Biophys Res Common, 1998 ; 245 (s) : 549 – 553. Indrasanto E. Kelainan Kongenital/Bawaan. Buletin Perinasia 2008; 3: 1-8. 133 Intusuma U, Sornsrivichai V, Jiraphongsa C, dan Varavithaya W. Epidemiology, Clinical Presentations and Burden of Rotavirus Diarrhea in Children under Five Seen at Ramathibodi Hospital, Thailand. J Med Assoc Thai 2008; 91 (9): 1350-1355. Jason JM, Nieburg P, dan Marks JS. Mortality and Infectious Disease Associated with Infant-Feeding Practices in Developing Countries. Disitirisasi dari: www.pediatrics.org at Indonesia :AAP Sponsored on June 27, 2008. Jackson KM and Naza AM. Breastfeeding, the immune response, and long – term health. J. Am Osteopath Assoc, 2006 ; 106 : 203 – 207. Jensen RG, 1995. Handbook of Milk Composition. Dalam: Marquis GS, Penny ME, Zimmer JP, dkk. An Overlap of Breastfeeding during Late Pregnancy Is Associated with Subsequent Changes in Colostrum Composition and Morbidity Rates Among Peruvian Infants and Their Mothers . J Nutr. 2003;133:2585-2591. Joneja JMV. Breast Milk A vital defense against infection. Can Fam Physician 1992; 38: 1849-1855. Juffrie M dan Mulayani NS. Diare (Modul Pelatihan). UKK Gastro-Hepatologi IDAI. Edisi Pertama, 2009. Kaetzel CS, Robinson JK, Chintalacharuna KR, dkk. The Polymeric Immnunoglobulin Receptor (Secretory Component) Mediates Transport of Immunoe Complexcs Across Epithelial Cells : A Local Defense Function for IgA. Proc. Natl. Acad. Sci USA, 1991, 88 : 8796 – 8800. Kane EM, Turcios RM, Arvay ML. The epidemiology of rotavirus diarrhea in Latin America. Anticipating rotavirus vaccines. Rev Panam Salud Pan Am J Public Health 2004; 16 (6): 371-377. Kerzner B. Kelly MH, Gall DG, Butler DG, dkk. Transmissible Gastroenteritis : Sodium transport and the intestinal epithelium during the course of viral enteritis. Gastroenterology, 1977 Kesarwala HH, Fischer TJ. Introduction to the immune system. Dalam : Joneja JMV. Breast Milk A vital defense against infection. Can Fam Physician 1992; 38: 1849-1855. Koletzko B dan Rodriguez-Palmero M. Polyunsaturated fatty acids in human milk and their role in early infant development. J Mammary Gland Biol Neoplasia 1999; 4: 269-284. 134 Kountur R. Statistik Praktis. Pengolahan Data Untuk Penyusunan Skripsi dan Tesis. Yuwono Y penyunting. PPM Jakarta, 2005. Kurt – Jones EA, Mandell L, Whitney C, dkk. Role of Toll – like Receptors 2 (TLR2) in neutrophil activation : G M – CSF enhances TLR 2 expression and TLR 2 – mediated interleukin responses in neutrophil. Blood, 2002 ; 100 : 1860 – 1868. Kurugol Z, Geylani S, Karaca Y, dkk. Rotavirus gastroenteritis among children under five years of age in Izmir, Turkey. The Turkish J Pediatr 2003; 45: 290-294. Labbok MH, Clark DC, dan Goldman AS. Breastfeeding : maintaining an irreplaceable immunological reasonce. Nat.Rev.Immunol,2004;4:565-571. Lawwrence RM dan Pane CA. Human Breast Milk: Current Concepts of Immunology and Infectious Diseases. Curr Probiol Pediatr Adolesc Health Care 2007; 37: 7-36. LeBouder E, Rey – Nores JE, Raby AC, Affolter M, dkk. Modulation of Neonatal Microbial Recognitim TLR – Mediated Innate Immune Responses are Specifically and Differentially Modulated by Human Milk. J Immunol, 2006 ; 176 : 3742 – 3752. LeBouder R, Rey-Nores JE, Rushmere NK, dkk. Soluble forms of Toll – like Receptors (TLR)2 capable of Modulating TLR 2 signaling are present in human and breast milk. J Immunol, 2003 ; 171 : 6680 – 6689. Lee SH, Girard S, Macinn D, dkk . Susceptibility to mouse cytomegalovirus is associated with deletion of an activating natural killer cells receptor of the C-type lectin superfamily. Nat.Genet. 2001 ; 28 : 42 – 45. Levine – L Moal dan Servin AL. The front line of enteric host defense against unwelcome intrusion of harmful microorganism : mucins, antimcrobial peptide and microbiota. Clin Microbiol Rev. 2006 ; 19 : 315 – 337. Levy DE dan Gracia – Sastre A. The virus battles: IFN induction of the antiviral state and mechanism of viral evasion.Cytokine Growth Factor Rev. 2001;12:143-156. Liprandi F, Moros Z, Gerder M, dkk. Productive penetration of rotavirus in cultured cells induces coentry of the translation inhibitor α – sarcin. Virology, 1997 ; 237 : 430 – 438. Little LM dan Shadduck JA. Pathogenesis of Rotavirus Infection in Mice. Infection and Immunity 1982; 38: 755-763. 135 Lonnerdal B. Nutritional and physiologic significance of human milk proteins. Am J. Clin Nutr, 2003 ; 77 (suppl) : 1537 S – 1543 S. Lonnerdal B. Biochemistry an physiological function of human milk proteins. Am. J. Clin Nutr, 1985 ; 42 : 1299 – 1317. Lopez-Alarcon M, Villalpando S dan Fajardo A. Breast-feeding Lowers the Frequency and Duration of Acute Respiratory Infection and Diarrhea in Infants Under Six Month of Age. J Nutr 1997;127:436-443. Lopez S dan Arias CF. Multistep entry of rotavirus into cells : a Versailles que dance. Trends Microbiol 2004; 12: 271-278. Ludert JE, Gil F, Liprandi F, Esparza J. The structure of the rotavirus inner capsid studies by electron microscopy of chemically disrupted particles. J.Gen Virol, 1986 ; 67 : 1721 – 1725. Ludert JE, Ruiz MC, dan Hidalgo C. Antibodies to Rotavirus outer Capsid Glycoprotein VP7 Neutralize Infectivity by inhibiting virion Decapsidatiaon. J Virol, 2002;76:6643-6651. Lukacik M, Thomas RL, Aranda JV. 2007. A Meta-Analysis of the effect of Oral Zinc in the Treatment of Acute and Persistent Diarrhea. Disitirisasi dari http://www.pediatrics.org/cgi/content/full/121/2/326. Lund J, Sato A, Akira S, dkk. Toll – like receptor g – mediated recognition of herpes simplex virus – 2 by plasma cytoid Dendritic cells. J. Exp.Med. 2003 ; 198 : 513 – 520. Lundgreen O and Suensson . Pathogenesis of rotavirus diarrhea. Microbes Infect, 2002 ; 3 : 1145 – 1156. Lundgren O, Peregrin AT, Persson K, Kordasti S, Uhnoo I, Svensson L, Role of the enteric nervous system in the fluid and electrolyte scretion of rotavirus diarrhea. Science, 2000 ; 287 : 491 – 495. Madiono B, Moeslichan S, Sastroasmoro S, dkk. Perkiraan Besar Sampel. Dalam : Dasar-Dasar Metodologi Penelitian Klinis. Sastroasmoro S dan Ismael S, editor. Edisi ke-2 hal.259-287. CV SAGUNG SETO Jakarta 2002 Man NV, Trang NV, Lien HP dkk. The epidemiology and Disease Burden of Rotavirus in Vietnam: Sentinal Surveillance at 6 Hospital. J Infect Dis 2001;192:S127- 132. 136 Mavromichalis J, Evans N, Mc Neish AS, Bryden AS, Davies HA, Flewett TH. Intestinal damage in rotavirus and adenovirus gastroenteirits assesd by dxylose malabsorption. Arch Dis Child, 1977 ; 52 : 589 – 591. Medzhitov R dan Janaway CA. Innate Immunity : the virtues of monoclonal system for recognition. Cell, 1997; 91 : 295 – 298 Medzhitov R. Toll – like Receptors and Innate Immunity. Nat. Rev. Immunol, 2001 ; 1 : 135 – 145. Mestecky J, Russel MW, and Elson CO. Intestinal IgA ; novel views on its intestinal in the defence of the largest mucosal surface. Gut, 1999 ; 44 : 2 – 5. Misra S, Sabui T, Basu S, dan Pal NM. A Prospective Study of Rotavirus Diarrhea in Children under 1 year of Age. Clin Pediatr (Phila) 2007; 46 (8): 683-688. Moon H W. Mechanism in the patogenesis of diarrhea: a review. J.Am.Vet.Med.Assoc.1978; 172: 443-448. Morrow AL dan Rangel JM. Human milk protection against infectious diarrhea: implications for prevention and clinical care. Semin Pediatr Infect Dis 2004; 15: 221-228. Muzio M, Bosisio D, Polentarutti N, D‟amico G, dkk. Differential Expression and Regulation of Toll – Like Receptor (TLR) in Human Leukocytes : Selective Expression of TLR 3 in Dendritic Cells. J Immunol, 2000 ; 164 : 5998 – 6004 Muzio M, Ni J, Feng P, Dixit UM. IRAK (Pelle) family member IRAK – 2 and my D88 as proximal mediators od IL – 1 signaling. Sciene, 1997 ; 278 : 1612 – 1615. Naficy AB, Abu-Elyazeed R, Holmes JL, dkk. Epidemiology of Rotavirus Diarrhea in Egyptian Children and Implication for Disease Control. American J Epidemiol 1999; 150 (7): 770-777. Nakawesi JS, Wobudeya E, Ndeezi G, dkk. Prevalence and factors associated with rotavirus infection among children admitted with acute diarrhea in Uganda. BMC Pediatrics 2010; 10: 69 http://www.biomedcentral.com/1471-2431/10/69/. Nathanson N. Immune response to viral infection. Dalam : Viral pathogenesis and immunity. Lippincott Williams & Walkins, Philadelphia, 2002: 53-59. 137 Newburg DS, Peterson JA, Ruiz-Palacios GM, dkk. Role of human-milk lactadherin in protection against symptomatic rotavirus infection. Lancet 1998; 351: 1160-1164. Nguyen TV. Diarrhea caused by rotavirus in children less than 5 years of Age in Hanoi, Vietnam. J. of Clin. Microbiol. 2004 ; 42 : 5745 – 5750. Noah N. and Henderson B. Rotavirus : Leading of Hospitalization for Diarhea in Children Under 5. Proc 23rd Ann Meeting Eur Soc Paediatric Infect Dis (E581D). Spain, May 18 – 21, 2005. Orsi N. The antimicrobial activity of lactoferrin: current status and perspectives. Biometals 2004; 17: 189-196. Pando V, Isa P, Arias CF, dan Lopez S. Influence of calcium on the early steps of rotavirus infection. Virology 2002; 295: 190-200. Parashar UD, Chung MA, Holman RC, Ryder RW dkk. Use of state hospital discharge data to asses the morbidity from rotavirus diarrhea and to monitor the impact of a rotavirus immunize from program : a pilot study in connecticut. Pediatric, 1999 ; 104 : 484 – 489. Parashar UD, Hummelman FG, Bresee JS, Miller MA, Glass RI. Global illness and death caused by rotavirus desease in children. Emerg. Infect Dis, 2003 ; 9 : 565 – 572. Parashar UD, Gibson CJ, Bresee JS, dan Glass RI. Rotavirus and Severe Childhood Diarrhea. Emerg.Infect.Dis.2006; 12: 204-206. Parreno V, Hodgins DC, de Arriba L, dkk. Serum and intestinal isotype antibody responses to Wa human rotavirus in gnotobiotic pigs are modulated by maternal antibodies. J General Virology 1999; 80: 1417-1428. Pedoman Praktis Memantau Status Gizi Orang Dewasa. Diunduh dari http: //www.gizi.net/pedoman-gizi/download/Pedoman%20Praktis%20IMT.doc. Halaman sejenis 1/1/2001. Pertemuan Hasil Penelitian ( belum dipublikasi ) : Extension for Hospital Based Surveillance and Strain Characterization of Rotavirus Diarrhoea in Indonesia. Yogyakarta, 7 Mei 2007. Prentice A, Prentice AM, Cole TJ, dkk. Determination of variations in breast milk protective factor concentration of Gambrain mothers. Arch.Dis.Child, 1983 ; 58 : 518 – 522. 138 Pusponegoro, dkk. Standar Pelayanan Medis Kesehatan Anak. Ikatan Dokter Anak Indonesia, Jakarta, 2004. Quigley MA, Kelly Y, Sacker A. Breastfeeding and Hospitalization for Diarrheal and Resporatory infection in the United Kingdom Millenium Cohors Study. Pediatric. 2007 ; 119 : e 837 – e 842. Quigley MA, Curberland P, Cowden JM, Rodrigue‟s LC, dkk. How protective is breasfeeding against dearrheal desease in infants in 1990’s England ? A Case Control Study. Arch Dis Child, 2006 ; 91 : 245 – 250. Rahman M, dkk. Genetic Characterization of a Novel, Naturally Occuring Recombinant Human G6P[6] Rotavirus. J. of clin. Microbiol. 2003 ; 41 : 2088 – 2095. Ranoldi M. Chieppa M, Salucci V, Avogadri F, dkk. Intestinal immune homeostosin in regulated by the crosstalk between epithelial cells and denditric cells. Nat Immunol, 2005 ; 6 : 507 – 514. Ray PB dan Kelkar SD. Prevalence of Neutralizing Antibodies against Different Rotavirus Serotypes in Children with Severe Rotavirus-Induced Diarrhea and Their Mothers. Clinical and Diagnostic Laboratory Immunology 2004; 11: 186-194. Referensi Kesehatan. Produksi ASI dan Faktor yang Mempengaruhinya. (Diunduh dari http://creasoft.wordpress.com/2008/05/08/produksi-asi-danfaktor-yang-mempengaruhinya/ 1/1/2001. Rescigno M, Urbano M, Valzasina B, dkk. Dendritic Cells express fight junction proteins and penetrate gut epithelia monolayer to sample bacteria. Nat.Immunol, 2001 ; 2 : 361 – 367. Rey J, Garin N, Spertini F, dan Corthesy R. Targeting of secretory IgA to Peyer’s Patch Dendritic and T cells After Transport by Intestional M Cells. J. Immunology, 2004 ; 172 : 3026 – 3033. Reipenhoff – Talty M, dkk. Epidemiology of ofGroup C RV Infection in Women Childbearing Age. J Clin Microbiol, 1997; 35 : 486 – 488. Riordan J. The Biological Specificity of Breastmilk. Dalam: Breastfeeding and Human Lactation. Edisi kedua, halm.121-143. Riordan J dan Auerbach K editor. Jones and Bartlett Publisher, Boston 1999. Rojas R dan Apodea G. Immunoglobulin transfort across polarized epithelial cells. Nat.Rev.Mol.Cell.Biol 2002; 31: 944-955. 139 Rollo EE, Kumar KP, Reich NC, dkk. The Epithelial Cell Response to Rotavirus Infection. J Immunol 1999; 163: 4442-4452. Rotavirus Vaccine Monograph. The Global Burden of Rotavirus Disease : Responding to the Challenge. Glaxo Smith Klime, 2006. Ruggeri FM dan Greenberg HB. Antibody to the Trypsin Cleavage Peptide VP8 Neutralize Rotavirus by inhibiting Binding of virion to Target cells in Culture. J Virol 1991; 65: 2211-2259. Ruggeri FM, Johansen K, Basile G, dkk. Antirotavirus Immunoglobulin A Neutralizes Virus In Vitro after Trancytosis through Epithelial Cells and Protect Infant Mice from Diarrhea. J Virol 1991; 65: 2211-2219. Ruuska T dan Vesikari T. Rotavirus disease in Finnish children: use of numerical scors for clinical severity of diarrhoeal episodes. Scand J Infect Dis 1990; 22(3): 259-267. Sadeharju K, Knip M, Virtranen SM, dkk. Maternal Antibodies in Breast Milk Protect the Child From Enterovirus Infections. Pediatrics 2007; 119: 941946. Schandler RJ. Overview : the clinical prospective. J. Nutr, 2000 ; 130 : 417 S – 419 S. Schlesselman JJ. Matched Analysis with Three or More Controls per Case. Dalam Case – Control Studies Design, Conduct, Analysis. New York, Oxford University Press 1982 Seputar Gizi Ibu Menyusui.Available at: http://familiedyka.multiplay.com/journal/item/89/TulisanSeputarGiziIbuMe nyusuidanPe....5/13/2008. Sethi D, Cumberland P, Hudson MJ. A study of infectious intestinal disease in England: risk factors associated with group A rotavirus in children. Epidemiol Infect 2001; 126 (1): 63-70. Shaw RD, Hempson SJ, Mackow ER. Rotavirus Diarrhea Is Caused by Nonreplicating Viral Particles. J Virol 1995; 69: 5946-5940. Soenarto Y, Aman AB, Bakri A, dkk Burden of Severe Rotavirus Diarrhea in Indonesia. JID 2009; 200 (Suppl 1): S188 – S194. Suraatmaja S & Soetjiningsih. Diare Akut : Pedoman Diagnosa dan Terapi Ilmu Kesehatan Anak. Lab / SMF Ilmu Kesehatan Anak / RS Sanglah, Edisi Kedua, Denpasar. 2000 : Hal 26 – 36. 140 Suraatmaja S. Buku Ajar Gastroenterologi. Lab/SMF Ilmu Kesehatan Anak FK UNUD / RSUP Sanglah, Denpasar, 2002 : 1 – 3. Talayero JMP, Lizan – Garcin M, Puime AO, Muncharaz MJB. Full breastfeeding and hospitalization as a result of infection in the first year. Pediatric, 2006 ; 118 : 3 92 – e 99. Tabeta K, Georgel P, Jansen E, Dux, dkk. Toll – like receptors 9 and 3 as assential components of innate immune defense against mouse cytomegalovirus infection. PNAS, 2004 ; 101 : 3516-3521. Takeda K, Kaishu T, and Akira S. Toll – like Receptors. Annu Rev.Immunol, 2003 ; 21 : 335 – 376. Tasic G, Stankovic-Djordjevic D, Dinic M, dkk. Rotavirus Infection in Infants and young Children. Biotechnol & Biotechnol.Eq.20/2006/2.halm.:141-145. Telemo E, Hanson LA. Antibodies in milk. J Mammary Gland Biol Neopl 1996; 1: 243-249. Van Ginkel FW, Wahl SM, kearney JF, Kweon M, dkk. Partial IgA – Deficiency with Increased Th2 – type Cytokines in TGF – B1, Knockout Mice. J Immunol, 1999 ; 163 : 1951 – 1957. Verstraeten Ter al. Paediatric Infect Dis (ESPID). Proc 23rd Ann Meeting Eur Soc. May 18 – 21, 2005. Spain. Weaver LT, Arthur HML, Bunn JEG and Thomas JE. Human milk IgA concentrations during the first year of lactation. Arch.Dis.Child, 1998 ; 78 : 225 – 239. Wesche H, Hensel WJ, Shillinglaw W, Lis, Cao Z. My D88 an adaptor that recruits IRAK to the IL – 1 receptor complexs. Immunity. 1997 ; 7 : 837 – 847. Wold AE dan Adlerberth I. Does breasfeeding affect’s immune responsiveness ? Acta Pediatr, 1998 ; 87 : 19 – 22. Wold AE dan Adlerberth I. Does breastfeeding affect’s immune responsiveness? Acta Pediatr 1998; 87: 19-22. Wold AE, Hanson LA. Defense factors I human milk. Curr. Opin. Gastroenteral, 1994 ; 10 : 652 – 658. 141 World Health Organization. Indicators for assessing breastfeeding practices. Report of an informal meeting. Division of Child Health and Development. WHO/CDD/SER/91. In Geneva : World Health Organizatian.June 1991. World Health Organization. Collaborative study team on the role of breastfeeding on the prevention of infant mortality. Effect of breastfeeding and child mortality due to infection disesases in less developed countries : apooled analysis. Lancet, 2000 ; 355 : 451 – 5. World Health Organization. The Optimal Duration of Exclusive Breastfeeding, WHO, Geneva, Swaitzerland, 2001 World Health Organization. En-gendering’ the Millennium Development Goals (MDGs) on Healt. Departemen of Gender and Women‟s Health, 2003. Wright AL, Bauer M, Naylor A, Sutcliffec, Clark L. Increasing breastfeeding rates to reduce infant illness at the community level. Pediatric, 1998 ; 101 : 837 – 844. Yolken RH, Peterson JA, Vonderfechr SL, Fonts, dkk. Human milk mucin inhibits rotavirus replication and prevents experimental gastroenternis. J.Clin Invest, 1992 ; 90 (s) : 1984 – 1991. Zarate S, Espinosa R, Romero P, dkk. Integrin alpha2beta1 mediates the cell attachment of the rotavirus neuraminidase-resistant variant nar3. Virology 2000; 278: 50-54. Zhao XY, Deak E, Soderberg M, dkk. Vaginal Submucosal dendritic cells but not Lengerhans cells, induce protective th 1 responses to herpes simplex virus – 2. J Exp Med. 2003;197:153-162.