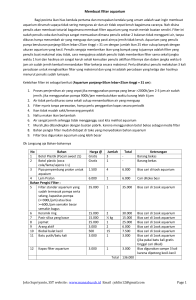
PENGARUH FILTER CAHAYA DAN MEDIA TANAM
advertisement

PENGARUH FILTER CAHAYA DAN MEDIA TANAM TERHADAP PERTUMBUHAN DAN KUALITAS PENAMPILAN TANAMAN Sansevieria trifasciata ’Lime Streaker’ Oleh Armita Fibriyanti A.34303018 DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2008 PENGARUH FILTER CAHAYA DAN MEDIA TANAM TERHADAP PERTUMBUHAN DAN KUALITAS PENAMPILAN TANAMAN Sansevieria trifasciata ’Lime Streaker’ Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor Oleh Armita Fibriyanti A34303018 DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2008 RINGKASAN ARMITA FIBRIYANTI. Pengaruh Filter Cahaya dan Media Tanam terhadap Pertumbuhan dan Kualitas Penampilan Tanaman Sansevieria trifasciata ’Lime Streaker’. Dibimbing oleh NURUL KHUMAIDA Saat ini Sansevieria merupakan salah satu tanaman hias yang sedang populer. Hal ini dikarenakan Sansevieria dapat menyerap polutan dan membersihkan udara. Masalah yang sering dihadapi dalam membudidayakan Sansevieria adalah kualitas penampilan tanaman yang kurang menarik dan kompak. Kualitas penampilan tanaman dapat diukur dari kekontrasan warna tanaman dan kekompakan tanaman yang dapat diukur dari pertumbuhan vegetatif tanaman. Tanaman yang memiliki pertumbuhan dan kualitas penampilan yang baik dapat diperoleh dengan cara mengatur kualitas cahaya dengan menggunakan filter cahaya dan pengaturan komposisi media tanam. Penelitian ini bertujuan untuk mengetahui pengaruh filter cahaya, komposisi media tanam dan interaksinya terhadap pertumbuhan dan kualitas penampilan tanaman S. trifasciata ’Lime Streaker’. Penelitian ini dilaksanakan di rumah kaca PT. ASABI, Sentul Rest Area Jalan Tol Jagorawi Km 35 Bogor, Laboratorium Ekofisiologi Tanaman, Departemen Agronomi dan Hortikultura, dan Laboratorium Analisis Kimia dan Kesuburan Tanah Departemen Ilmu Tanah dan Sumber Daya Lahan, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Februari 2007 – Mei 2007. Penelitian ini menggunakan rancangan petak terbagi (split plot) dengan rancangan lingkungan Rancangan Kelompok Lengkap Teracak (RKLT) yang terdiri atas dua faktor yaitu petak utama dan anak petak. Petak utama (P) merupakan perlakuan bangunan filter yang terdiri dari berbagai penutup (covering) yaitu menggunakan plastik selektif film (P1), paranet 55% (P2), plastik transparan (P3), dan filter CuSO4 2.5% (P4). Perlakuan berbagai komposisi media tanam (A) sebagai anak petak dengan 3 taraf perlakuan, yaitu limbah tembakau : pasir = 1:3 (A1), pasir : arang sekam : pakis = 2 : 1 : 1 (A2), pasir = 1 (A3). Penelitian terdiri dari empat petak utama dan tiga anak petak sehingga terdapat 12 kombinasi. Setiap kombinasi diulang sebanyak lima kali dan setiap ulangan terdiri dari satu pot sehingga terdapat 60 satuan percobaan. Filter cahaya berpengaruh nyata pada peubah pertambahan tinggi tanaman induk (2 MSA) dan jumlah daun tanaman induk (1-3 MSA) dan berpengaruh sangat nyata terhadap jumlah daun tanaman induk (4-14 MSA) dan tidak berpengaruh terhadap lebar daun tanaman induk baik daun bagian atas, tengah, maupun bawah.. Tanaman S.trifasciata ’Lime Streaker’ yang ditanam di bawah filter CuSO4 2.5 % paling pendek (0.77cm) sedangkan yang tertinggi adalah S.trifasciata ’Lime Streaker’ yang di tanam di bawah filter plastik selektif film (0.98 cm). Pada 12 Minggu Setelah Aplikasi, tanaman induk S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter cahaya plastik selektif film memiliki jumlah daun paling banyak (4.87 lembar). Perlakuan media tanam yang diberikan tidak berpengaruh pada semua peubah yang diamati. Interaksi antara filter cahaya dan media tanam hanya berpengaruh terhadap jumlah daun tanaman induk. Pengaruh nyata terhadap jumlah daun tanaman induk terlihat pada 9-12 MSA dan sangat nyata pada 13 – 14 MSA. Kombinasi antara plastik selektif film dan media tanam dengan komposisi pasir : arang sekam : pakis = 2 : 1 : 1 menghasilkan jumlah daun baru paling banyak (5.6 lembar daun). Tanaman S.trifasciata ‘Lime Streaker’ yang ditanam di bawah bangunan plastik menghasilkan tunas baru paling banyak (9 tunas baru) dan media limbah tembakau : pasir = 1:3 merupakan media yang menghasilkan tunas baru tanaman S.trifasciata ‘Lime Streaker’ terbanyak pada akhir penelitian ini (11 tunas baru). S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film memiliki jumlah stomata paling banyak (20.87/mm2). Namun tanaman yang diletakkan di bawah paranet 55% memiliki persentase jumlah stomata yang membuka lebih besar (59.06%). Stomata tanaman Sansevieria membuka pada sore hari. Hal ini menunjukkan bahwa Sansevieria merupakan tanaman Crassulacean Acid Metabolism (CAM). S. trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film dan larutan CuSO4 2.5% daunnya terlihat lebih cerah dibandingkan dengan perlakuan lainnya. Tanaman yang kompak diperoleh pada paranet 55% dan media tanam pasir : tembakau = 3 : 1. Judul : PENGARUH FILTER CAHAYA DAN MEDIA TANAM TERHADAP PERTUMBUHAN DAN KUALITAS PENAMPILAN TANAMAN Sansevieria trifasciata ’Lime Streaker’ Nama : Armita Fibriyanti NRP : A.34303018 Menyetujui, Dosen Pembimbing Dr. Ir. Nurul Khumaida, MSi NIP : 132 133 964 Mengetahui. Dekan Fakultas Pertanian Prof. Dr. Ir. Didy Sopandie, M.Agr NIP : 131 124 019 Tanggal lulus :................................. RIWAYAT HIDUP Penulis dilahirkan di kota Purworejo, Jawa Tengah pada tanggal 20 Februari 1986. Penulis merupakan anak pertama dari dua bersaudara pasangan Bapak Ngadiman dan Ibu Rubingati Pada umur 4.5 tahun, penulis memasuki jenjang Taman Kanak-kanak Pertiwi, Purworejo. Tahun 1997 penulis lulus dari SDN Botodaleman, Bayan, Purworejo kemudian pada tahun 2000 penulis lulus dari SLTPN 2 Purworejo. Di kota yang sama, selanjutnya penulis melanjutkan studi di SMUN 1 Purworejo dan lulus tahun 2003. Tahun 2003 penulis diterima sebagai mahasiswa di Program Studi Hortikultura Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Mahasiswa IPB (USMI). Tahun 2003-2004 penulis bergabung sebagai Staf Divisi Media Forum for Scientific Studies (FORCES). Pada tahun 2004-2005 penulis aktif sebagai bendahara Himpunan Mahasiswa Agronomi (HIMAGRON), Organisasi Mahasiswa Daerah Keluarga Mahasiswa Purworejo (GAMAPURI). Tahun 20052006 penulis merupakan Kepala Departemen Penyelenggara Internal HIMAGRON. Selain itu penulis juga aktif pada berbagai kegiatan dan kepanitiaan yang diselenggarakan oleh berbagai organisasi di IPB. Penulis juga tercatat sebagai penerima beasiswa Student Equity yang diberikan oleh Direktorat Perguruan Tinggi (DIKTI) selama 8 semester. Pada tahun 2007 penulis menjadi Asisten Praktikum Mata Kuliah Dasar Hortikultura. Selanjutnya penulis mengikuti kegiatan magang kerja Belajar Bekerja Terpadu Cooperative-Education Program) di Taman Sringanis yang diselenggarakan oleh Kantor Jasa Ketenagakerjaan IPB bekerja sama dengan DIKTI, Kementrian Negara Koperasi dan Usaha Kecil Menengah. Bulan September – Desember 2007, penulis berkesempatan untuk mengikuti training di University of California Davis, Amerika Serikat melalui program Beasiswa Unggulan dari Kedutaan Besar Negara Indonesia di Washington D.C. Selama menuntut ilmu di IPB, penulis banyak berkarya di bidang keilmiahan mahasiswa. Pada tahun 2006 penulis meraih penghargaan sebagai Juara III Kompetisi Bola Voli Ekspresi Muslimah, Juara I Lomba Karya Tulis Mahasiswa (LKTM) Bidang IPA Tingkat IPB, Juara II LKTM Bidang IPA Tingkat Wilayah B, Finalis LKTM Bidang IPA pada PIMNAS XIX di Universitas Muhamadiyah Malang Jawa Timur, Juara Harapan I Lomba Inovasi Iptek Mahasiswa (LIIM) UGM. Tahun 2006 dan 2007 penulis mendapatkan Juara II Lomba Inovasi Teknologi Lingkungan (LITL) yang diselenggarakan oleh Himpunan Mahasiswa Teknik Lingkungan ITS, dan lolos Program Kreatifitas Mahasiswa bidang Penelitian (PKMP) dibiayai oleh DIKTI. Tahun 2007 penulis meraih penghargaan sebagai finalis LKTM Bidang IPA tingkat IPB, finalis Innovative Entrepreneurship Challenges 2 (IEC 2) ITB, finalis National Inovation Contest (NIC) ITB, penerima penghargaan rektor pada hari pendidikan 2 Mei 2007 sebagai Mahasiswa Berprestasi, juara 1 Lomba Pameran Ilmiah Mahasiswa pada PIMNAS XX di Universitas Lampung dan lolos Program Kreatifitas Mahasiswa bidang Ilmiah (PKMI) dibiayai oleh DIKTI . KATA PENGANTAR Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmatNya sehingga penelitian ini dapat terselesaikan dengan baik. Penelitian ini berjudul Pengaruh Filter Cahaya dan Media Tanam terhadap Pertumbuhan dan Kualitas Penampilan Tanaman Sansevieria trifasciata ’Lime Streaker’. Hasil penelitian ini sebagian telah dipublikasikan pada Seminar Hasil Penelitian Purna Bakti Prof. Jajah Koswara pada bulan Agustus 2007. Penyelesaian penelitian dan penulisan skripsi ini tidak lepas dari dukungan dan bantuan banyak pihak. Penulis ucapkan terimakasih kepada kedua orang tua, Bapak Ngadiman dan Ibu Rubingati serta adikku, Akhmad Fuadi, yang telah memberikan dukungan baik moril maupun materiil. Selain itu penulis mengucapkan terimakasih kepada: 1. Dr. Ir. Nurul Khumaida, MSi selaku dosen pembimbing yang telah memberikan bimbingan dan pengarahan kepada penulis. 2. Due Like Batch III, yang telah membantu membiayai penelitian. 3. Prof. Dr. Ir. Bambang S. Purwoko, MSc. sebagai pembimbing akademik. 4. Ani Kurniawati, SP, MSi dan Ir. Ketty Suketi, MS sebagai dosen penguji 5. PT. ASABI, yang telah mengijinkan penulis untuk melaksanakan kegiatan penelitian ditempatnya dan PT Sampoerna yang telah membantu menyediakan limbah pabrik tembakau. 6. Direktorat Jendral Perguruan Tinggi yang telah memberikan beasiswa Student Equity dan kesempatan untuk mengikuti berbagai kompetisi keilmiahan mahasiswa 7. Seluruh staf pengajar Departemen Agronomi dan Hortikultura 8. Teman seperjuanganku, Peni, Yani dan Wage. Teman-teman lain di Hortikultura 40, Polkadot, Pondok Risqy, dan GAMAPURI serta temanteman lain yang telah banyak membantu, mendoakan dan memotivasi dalam menyelesaikan skripsi ini. Penulis berharap semoga tulisan ini dapat bermanfaat di kemudian hari bagi pihak-pihak yang membutuhkan. Bogor, Januari 2008 Penulis DAFTAR ISI Halaman PENDAHULUAN.......................................................................................... Latar Belakang .................................................................................... Tujuan ................................................................................................ Hipotesis.............................................................................................. 1 1 2 2 TINJAUAN PUSTAKA................................................................................... Sansevieria trifasciata .......................................................................... Cahaya.................................................................................................. Filter Cahaya ........................................................................................ Media Tanam ....................................................................................... Penambatan CO2 pada Spesies Sukulen (Metabolisme Asam Crassulaceae)......................................................................................... Stomata.................................................................................................. 3 3 4 5 9 11 13 BAHAN DAN METODE................................................................................ Tempat dan Waktu ................................................................................ Bahan dan Alat...................................................................................... Metode Penelitian ................................................................................. Pelaksanaan .......................................................................................... Pengamatan ........................................................................................... 15 15 15 15 16 19 HASIL DAN PEMBAHASAN........................................................................ Kondisi Umum Penelitian .................................................................... Pertambahan Tinggi Tanaman Induk ................................................... Jumlah Daun Tanaman Induk ............................................................... Lebar Daun Tanaman Induk................................................................ Jumlah Tunas Baru ............................................................................... Jumlah Stomata ..................................................................................... Perilaku Stomata ................................................................................... Warna Daun ......................................................................................... Kekompakan Tanaman ......................................................................... Pembahasan Umum............................................................................... 23 23 28 32 35 37 39 41 42 44 46 KESIMPULAN DAN SARAN........................................................................ Kesimpulan .......................................................................................... Saran...................................................................................................... 49 49 49 DAFTAR PUSTAKA....................................................................................... 50 LAMPIRAN..................................................................................................... 53 DAFTAR TABEL Nomor Halaman Teks 1. Perbandingan Rasio R/FR yang Dihasilkan CuSO4 Dengan Beberapa Filter Cahaya Cair (Mortensen and Stromme, 1987).............................. 7 2. Iklim Makro di Wilayah Bogor Selama Penelitian Berlangsung............. 23 3. Suhu dan Kelembaban Tiap Bangunan Filter Cahaya Selama Penelitian Berlangsung.............................................................................................. 24 4. Intensitas Cahaya pada Berbagai Filter Cahaya Selama Penelitian Berlangsung.............................................................................................. 25 5. Rekapitulasi Sidik Ragam Pengaruh Filter Cahaya, Media Tanam dan Interaksinya terhadap Pertambahan Tinggi Tanaman, Jumlah Daun dan Lebar Daun Tanaman Induk Bagian Atas................................................ 27 6. Rekapitulasi Sidik Ragam Pengaruh Filter Cahaya, Media Tanam dan Interaksinya terhadap Lebar Daun Tanaman Induk Bagian Tengah dan Bawah....................................................................................................... 28 7. Pengaruh Media Tanam terhadap Pertambahan Tinggi Tanaman Induk S.trifasciata ’Lime Streaker’ pada 1, 4, 8 dan 12 MSA.......................... 30 8. Kandungan Nitrogen, Fosfor, dan Kalium pada Berbagai Kombinasi Perlakuan Media Tanam di Awal dan Akhir Penelitian.......................... 31 9. Interaksi Filter Cahaya dan Media Tanam terhadap Jumlah Daun Tanaman Induk S trifasciata ‘Lime Streaker’ pada 9 MSA.................... 33 10. Interaksi Filter Cahaya dan Media Tanam terhadap Jumlah Daun Tanaman Induk S trifasciata ‘Lime Streaker’ pada 14 MSA.................. 34 11. Pengaruh Filter Cahaya terhadap Lebar Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ Bagian Atas, Tengah, dan Bawah............. 36 12. Pengaruh Media Tanam terhadap Lebar Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ Bagian Atas, Tengah, dan Bawah............. 37 13. Persentase Stomata yang Membuka pada Sore Hari............................... 42 14. Rekapitulasi Pengaruh Faktor Filter Cahaya dan Media Tanam terhadap Kekompakan Tanaman S. trifasciata ‘Lime Streaker’.............. 45 DAFTAR GAMBAR Nomor Halaman Teks 1. Rentang Panjang Gelombang Cahaya Tampak ........................................ 5 2. Greenhouse dengan Plastik Selektif Film sebagai Cover.......................... 6 3. Kristal CuSO4............................................................................................ 7 4. Outline Tanaman Crassulacean Acid Metabolism (CAM)....................... 12 5. Berbagai Bangunan Filter Cahaya yang Digunakan dalam Penelitian...... 17 6. Berbagai Komposisi Media Tanam yang Digunakan dalam Penelitian ... 18 7. Kriteria Kekompakan Tanaman S. trifasciata ‘Lime Streaker’................. 21 8. Pertambahan Tinggi Tanaman Induk S. trifasciata ’Lime Streaker’ pada Perlakuan Pengaruh Filter Cahaya pada 2 MSA....................................... 29 9. Pengaruh Filter Cahaya terhadap Jumlah Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ pada 1, 4, 8, 12 MSA.................................. 32 10. Pengaruh Filter Cahaya terhadap Jumlah Tunas Baru Tanaman S. trifasciata ‘Lime Streaker’ pada Akhir Pengamatan............................ 37 11. Pengaruh Media Tanam terhadap Jumlah Tunas Baru Tanaman S. trifasciata ‘Lime Streaker’ pada Akhir Pengamatan .......................... 38 12. Perbandingan Jumlah Stomata S.trifasciata ‘Lime Streaker’ pada Setiap Perlakuan Filter Cahaya........................................................................... 39 13. Kondisi stomata Sansevieria trifasciata ’Lime Streaker’......................... 41 14. Warna Daun S. trifasciata ‘Lime Streaker’ pada Berbagai Perlakuan Filter Cahaya............................................................................................ 43 15. Kekompakan Tanaman S. trifasciata ‘Lime Streaker’ pada Berbagai Perlakuan Filter Cahaya pada Akhir Pengamatan.................................... 45 Lampiran 1. Denah Tata Letak Percobaan................................................................... 54 PENDAHULUAN Latar Belakang Saat ini Sansevieria merupakan salah satu tanaman hias yang sedang populer. Hal ini dikarenakan Sansevieria dapat menyerap polutan dan membersihkan udara. Badan Penerbangan Antariksa Amerika Serikat (NASA) dan Associated Landscape Contractors of Amerika (ALCA) telah menemukan bahwa Sansevieria merupakan salah satu tanaman yang dapat menyerap polutan (formaldehid, bensen, trikloroetilen) (Peart, 2003). Sansevieria memiliki keindahan pada warna dan bentuk daun, tergantung varietasnya. Tanaman Sansevieria yang paling umum dijumpai adalah Sansevieria trifasciata. Masalah yang sering dihadapi dalam membudidayakan Sansevieria adalah kualitas penampilan tanaman yang kurang menarik dan kompak. Kualitas penampilan tanaman dapat diukur dari kekontrasan warna tanaman sedangkan kekompakan tanaman diukur dari pertumbuhan vegetatif tanaman. Tanaman yang kontras dan kompak ini dapat diperoleh dengan cara mengatur kualitas cahaya yang masuk atau mengenai tanaman misalnya dengan penggunaan filter cahaya (Rajapakse dan Wilson, 2001). Kualitas cahaya ditentukan berdasarkan rasio panjang gelombang cahaya yang diterima oleh tanaman. Filter cahaya yang dapat digunakan adalah plastik selektif film dan larutan filter CuSO4. Plastik selektif film dan larutan filter CuSO4 diketahui dapat meningkatkan rasio penerimaan cahaya merah (R) berbanding merah jauh (FR). Aplikasi penggunaan plastik selektif film dan larutan filter CuSO4 ini sebagai penutup (covering) bangunan tumbuh. Penggunaan plastik selektif film dan larutan filter CuSO4 ini diketahui dapat membentuk tajuk tanaman yang lebih kompak dan berpenampilan menarik (McMahon dan Kelly (1993); Rajapakse dan Wilson (2001)). Budidaya tanaman Sansevieria memerlukan media tanam yang cocok sehingga dapat memberikan pertumbuhan yang baik. Lingga (2005) menyatakan bahwa media tanam yang baik bagi Sansevieria yaitu media yang bersifat porous, sedikit kandungan bahan organik dan tidak cepat melapuk. Penggunaan media 2 tanam yang tepat bagi Sansevieria perlu diteliti sehingga dapat menghasilkan tanaman yang memiliki penampilan menarik dan pertumbuhan baik. TUJUAN Tujuan dari penelitian ini adalah untuk mempelajari pengaruh filter cahaya, media tanam dan interaksi keduanya terhadap pertumbuhan dan kualitas penampilan tanaman S. trifasciata ’Lime Streaker’ HIPOTESIS Hipotesis dalam penelitian ini yaitu: 1. Perlakuan filter cahaya akan berpengaruh terhadap pertumbuhan dan kualitas penampilan tanaman S. trifasciata ’Lime Streaker’. 2. Perlakuan media tanam akan berpengaruh terhadap pertumbuhan dan kualitas penampilan tanaman S. trifasciata ’Lime Streaker’. 3. Terdapat interaksi antara filter cahaya dan media tanam dalam menghasilkan tanaman S. trifasciata ’Lime Streaker’ yang memiliki pertumbuhan dan kualitas penampilan yang baik TINJAUAN PUSTAKA Sansevieria trifasciata Di Indonesia Sansevieria dikenal dengan sebutan tanaman lidah mertua (motherlaw in tongue’s) (Bonar, 1994). Menurut Henley, Chase, dan Osborne (2006) Sansevieria merupakan anggota famili Agavaceae yang terdiri dari 60 spesies dan tersebar di Afrika, Arabia dan India. Spesies yang paling umum dijumpai adalah Sansevieria trifasciata. Lingga (2005) menyatakan habitat asli Sansevieria adalah daerah tropis kering dan mempunyai iklim gurun yang panas. Sansevieria dapat tumbuh pada rentang suhu yang luas dan dapat bertahan hidup di daerah panas seperti gurun. Pertumbuhan optimal dicapai pada siang hari bertemperatur 24-29ºC dan malam hari 18-21ºC. Tanaman ini juga dapat beradaptasi pada ruangan dengan suhu dan kelembaban yang rendah seperti pada ruangan berpendingin (AC). Oleh karena itu Sansevieria dapat digunakan sebagai tanaman dalam ruangan (Henley et al., 2006). Ballare, Scopel, Casal, dan Sánchez (2002) menyatakan bahwa pertumbuhan S.trifasciata yang ternaungi menjadi lambat, lemah, dan warna daun menjadi lebih hijau dengan dengan garis-garis putih pada tengah daun menghilang. Henley et al. (2006) menyatakan bahwa Sansevieria dapat tumbuh dengan baik pada kondisi dengan pencahayaan penuh maupun pencahayaan yang kurang. Kebutuhan cahaya Sansevieria berkisar antara 1000-10.000 footcandle (fc), tetapi masih dapat tumbuh di lingkungan yang memiliki pencahayaan beberapa ratus footcandle saja. Sansevieria lebih menyenangi kondisi sinar matahari langsung untuk pertumbuhannya. Peart (2003) menyatakan bahwa Sansevieria dapat menyerap gas beracun (polutan) seperti formaldehid, bensen, dan trikloroetilen dari udara. Mekanisme penyerapan polutan terjadi melalui stomata. Polutan ini masuk dalam jaringan tumbuhan dan terlibat dalam metabolisme asam organik, gula dan asam amino (Giese, Bauer-Doranth, Langebartels, dan Sandermann,1994). Menurut Lingga (2005), satu tanaman Sansevieria efektif menyerap polutan dalam ruangan dengan luas 10m2. Peart (2003) menyatakan keefektifan penggunaan tanaman Clorophytum sebagai tanaman dalam ruang (indoor plant) untuk menyerap 4 polutan dapat mencapai 96% CO, 99% NO2 sedangkan tanaman Epripenum dapat menyerap 75% CO. Keefektifan tanaman Sansevieria sebagai penyerap polutan belum diketahui namun diperkirakan keefektifannya tidak jauh dari nilai tersebut. Chamberline (1986) menyatakan penyerapan gas-gas beracun ini dipengaruhi oleh resistensi dan mekanisme membuka dan menutupnya stomata yang sangat dipengaruhi oleh sifat masing-masing gas. Dariana (2005) menyatakan manfaat lain dari tanaman Sansevieria, yaitu sebagai tanaman obat untuk menyembuhkan penyakit diare, tekanan darah tinggi, influensa, batuk dan lain-lain. Manfaat lainnya dari tanaman Sansevieria sebagai elemen taman dan dekorasi, bahan alternatif serat tekstil. Cahaya Cahaya berperan utama dalam proses fotosintesis dan fotomorfogenis melalui fitokrom (Rajapakse dan Wilson, 2001). Fitokrom merupakan penerima cahaya yang paling efektif dalam mengendalikan proses morfogenesis tanaman dibandingkan dengan yang lain. Fitokrom ini dapat mendeteksi gelombang cahaya dari 300-800 nm dengan sensitifitas maksimum pada cahaya merah (R, 600-700 nm dengan puncak penyerapan pada 660 nm) dan merah jauh (FR, 700-800 nm dengan puncak penyerapan pada 730 nm). Cahaya tampak (380-750 nm) tersusun atas beberapa spektrum warna dengan panjang gelombang yang berbeda-beda. Setiap panjang gelombang tersebut memiliki energi yang besarnya berbanding terbalik dengan panjang gelombang (Bidwell, 1974). Pada Gambar 1 ditunjukkan rentang panjang gelombang cahaya tampak. Ballare et al. (2002) menyatakan bahwa tanaman melakukan fotosintesis yang efektif pada gelombang cahaya biru (410 - 500 nm) dan merah (610 - 700 nm). Penyerapan cahaya hijau kuning (510 – 600 nm) dan merah jauh (700 - 800 nm) terjadi dengan lemah dan banyak foton dari gelombang cahaya ini yang berpendar. Oleh karena itu daun terlihat berwarna hijau. Namun radiasi cahaya merah jauh (FR) tidak terlihat oleh mata karena bukan merupakan cahaya tampak. 5 Gambar 1. Rentang Panjang Gelombang Cahaya Tampak Sumber : Campbell et al. (1999) Fotoreseptor fitokrom sangat respon terhadap perubahan panjang gelombang merah (R) dan merah jauh (FR) dari spektrum cahaya tersebut. Fitokrom berada pada dua bentuk cahaya yang dapat berubah yaitu FR aktif dan R yang tidak aktif. Sinar merah jauh (FR) tidak efisien untuk fotosintesis, sehingga membutuhkan penambahan cahaya dengan panjang gelombang yang lebih rendah agar lebih efisien. Ballare et. al. (2002) menyatakan bila tanaman menerima cahaya dengan rasio R/FR kecil, tanaman akan mengalami etiolasi. Sementara bila rasio R/FR besar, maka tanaman akan membentuk tajuk yang kompak. Penelitian Khattak, Pearson, dan Johnson (1999) bahwa cahaya merah (R) dapat menyebabkan tanaman krisan menjadi lebih pendek 10% dibandingkan dengan kontrol. Filter Cahaya Plastik Selektif Film Plastik selektif film (PSF) merupakan salah satu jenis bahan sintetis yang dapat digunakan di rumah kaca sebagai penutup (covering). Penggunaan plastik ini sebagai penutup dapat menghasilkan tanaman yang memiliki bentuk tajuk yang lebih kompak bila dibandingkan dengan penutup (covering) sejenis, seperti paranet. Hal ini dikarenakan PSF dapat meningkatkan rasio panjang gelombang cahaya merah (R) yang diterima tanaman, sehingga rasio R/FR lebih besar. PSF akan mengabsorbsi atau merefleksikan Photosynthetically Active Radiation (PAR) pada rentang panjang gelombang 400 - 700 nm dan mentransmisikan radiasi sinar 6 matahari merah jauh (FR) pada 700 - 3000 nm dari spektrum sinar matahari (Rajapakse dan Wilson, 2001). Gambar konstruksi bangunan rumah kaca yang menggunakan PSF sebagai penutup (covering) ditunjukkan pada Gambar 2 Gambar 2. Greenhouse dengan Plastik Selektif Film sebagai Cover. Keterangan : cover plastik selektif film Penggunaan PSF sebagai bahan penutup atap rumah kaca memiliki kelemahan yaitu plastik tidak dapat digunakan dalam jangka waktu lama. Plastik mulai terdegradasi satu tahun sejak mulai pemakaian. Selain pada tanaman hias, PSF dapat diterapkan pada industri buah dan sayur namun penggunaan PSF pada budidaya sayuran sebagai mulsa (Rajapakse dan Wilson, 2001). Rajapakse dan Wilson (2001) menggunakan filter cahaya merah (R) dan merah jauh (FR) dan AR untuk mengontrol pertumbuhan tiga tanaman perenial Salvia dan terbukti bahwa filter cahaya merah (R) dan merah jauh (FR) dapat mempengaruhi kekompakan tanaman Salvia. Tembaga Sulfat (CuSO4) Tembaga sulfat (CuSO4) atau vitriol biru merupakan garam. Gambar kristal CuSO4 disajikan pada Gambar 3. Berdasarkan penelitian Rajapakse, McMahon dan Kelly (1993) diperoleh bahwa penggunaan filter cahaya CuSO4 6% pada tanaman krisan dapat meningkatkan rasio cahaya R/FR yang diterima oleh tanaman. Penambahan jumlah cahaya merah (R) mengakibatkan penurunan tinggi tanaman krisan dan panjang internode, meningkatkan sintesis klorofil daun dan membuat tanaman lebih kompak seperti pada penggunaan retardan (zat pengatur tumbuh) contohnya retardan yang dapat menghambat produksi giberilin. 7 Gambar 3. Kristal CuSO4 Sumber : www.wikipedia.org (26 Januari 2008) Mortensen dan Stromme (1987) dan Mc Mahon (1991) dalam Young, Margaret, Nihal, Dennis (1994) meneliti bahwa filter cahaya CuSO4 dengan konsentrasi 2.5% meningkatkan rasio panjang gelombang R/FR 4.1 kali lipat lebih tinggi dibandingkan dengan filter cahaya cair yang lain (air, pewarna biru, hijau dan kuning). Filter cahaya CuSO4 dengan konsentrasi 16% meningkatkan rasio panjang gelombang R/FR 7.2 kali lipat lebih tinggi. Secara lebih jelas hal ini terangkum pada Tabel 1. Tabel 1. Perbandingan Rasio R/FR yang Dihasilkan CuSO4 dengan Beberapa Filter Cahaya Cair (Mortensen and Stromme, 1987) Universitas Norway Clemson Filter Air CuSO4 (2.5%) Cairan Merah Cairan Hijau Cairan Kuning Air Udara CuSO4 (16%) Cairan Merah Cairan Biru Rasio R/FR Kisaran Luas** Kisaran Sempit*** 1.00 -4.10 -0.99 -0.82 -1.00 -1.05 1.16 1.05 1.16 7.20 3.30 1.03 1.16 0.70 0.99 Keterangan : ** R = 600-700 nm; FR = 700-800 nm *** R = 655-665 nm; FR = 725-735 nm Mekanisme penghambatan tinggi pada tanaman yang ditumbuhkan dibawah bangunan filter yang terbuat dari lapisan CuSO4 adalah sebagai berikut. Cahaya merah (R) pada bangunan filter ini menurut Rajapakse et al. (1993) lebih banyak dibandingkan cahaya merah jauh (FR). Fitokrom, sebuah pigmen yang mempengaruhi tingkah laku tanaman, memiliki dua bentuk struktur kimia yang 8 berbeda yang dapat saling berganti. Bentuk ini dinamakan sesuai dengan warna cahaya yang diserap secara maksimal : Pr adalah fitokrom yang menyerap cahaya merah (660 nm) dan Pfr fitokrom yang menyerap cahaya merah jauh (730 nm). Ketika Pr menyerap cahaya merah (R) maka akan dikonversi ke bentuk Pfr. Bentuk Pfr aktif ini selanjutnya akan menginisiasi respon biologis termasuk salah satunya fotomorfogenesis, contohnya perpanjangan daun, pembukaan stomata dan perkembangan kloroplas. Penggunaan filter cahaya CuSO4 di rumah kaca memiliki beberapa kelemahan. Masalah yang sering dihadapi yaitu kesulitan dalam penerapan cairan di lapisan kaca, pengaruh tekanan dan gravitasi dan harus melakukan pergantian larutan (Rajapakse et al. 1993). Naungan (Paranet) Lingga (2005) menyatakan bahwa tanaman Sansevieria yang ditempatkan dalam ruang dengan pencahayaan 150 footcandle mengalami pertumbuhan yang melambat dan akhirnya melemah. Bahkan S.trifasciata ’Laurentii’ mengalami kematian fisiologis ketika ditempatkan pada ruangan dengan pencahayaan kurang dari 150fc dalam waktu lebih dari satu minggu. Terhambatnya pertumbuhan ini disebabkan karena jaringan tanaman mengalami etiolasi dan melemah. Penelitian yang dilakukan oleh Mulyana (2006) pada tanaman kedelai bahwa naungan paranet 55% meningkatkan tinggi tanaman kedelai sebesar 109.13% pada 7 MSA tetapi menurunkan jumlah daun sebesar 38.99 % pada 8 MSA Ada tiga cara yang dilakukan tanaman untuk beradaptasi di bawah naungan permanen agar dapat mempertahankan keseimbangan karbon yang positif yaitu dengan pengurangan kecepatan respirasi untuk menurunkan titik kompensasi, peningkatan luas daun agar dapat mengabsorbsi cahaya, dan peningkatan kecepatan fotosintesis setiap unit energi cahaya dan luas daun. Etiolasi merupakan strategi paling umum yang dilakukan tanaman untuk mendapatkan cahaya (Ballaré et. al., 2002). 9 Media Tanam Media tanam merupakan faktor penting dalam produksi tanaman hias sebagai tempat tanaman tumbuh, berakar dan berkembang. Pemilihan media tanam harus sesuai dengan tujuannya, sebagai media semai dan perbanyakan atau tempat tumbuh sampai produksi (Surkati, 1987). Media tanam yang baik mempunyai sifat mudah ditangani, mengandung unsur yang cukup untuk mendukung pertumbuhan tanaman, aerasi yang baik, mampu mengikat air, murah, dan mudah didapat, bebas penyakit, hama dan gulma (Ellis dan Swaney,1947). Media pengakaran harus memberikan kelembaban dan oksigen yang cukup. Media tanam pasir atau air saja cukup memuaskan untuk media stek tanaman yang mudah berakar (Harjadi, 1989). Jenis media tanam yang digunakan terdiri atas dua macam yaitu, campuran tanah (Soil mixes) yang mengandung tanah alami dan campuran bukan tanah (Soilles mixes) yang tidak mengandung tanah alami. Media tanam dengan campuran tanah, pasir, gambut, dan bahan-bahan anorganik buatan seperti vermikulit (mika yang mengembang) dan perlit (lava volkan yang mengembang) telah banyak digunakan. Jenis media soilles mixes sering digunakan untuk produksi bibit tanaman hias karena sifatnya yang lebih ringan (Harjadi, 1989). Sansevieria membutuhkan media tanam yang sama dengan jenis tanaman sukulen lainnya. Hal ini diungkapkan dalam Lingga (2005). Media tersebut yaitu berupa media yang porous, sedikit kandungan bahan organik, dan tidak cepat melapuk. Media tanam yang terdiri dari pasir : arang sekam: serbuk batang pakis dengan perbandingan 2 : 1 : 1 merupakan media tanam Sansevieria yang dapat digunakan pada Sansevieria yang ditanam di dalam ruangan atau ditempat dengan pencahayaan yang rendah. Limbah Tembakau Wikipedia Indonesia (2006) menjelaskan bahwa Tembakau (Nicotiana spp., L.) adalah genus tanaman yang berdaun lebar yang berasal dari daerah Amerika Utara dan Amerika Selatan. Daun dari pohon ini sering digunakan sebagai bahan baku rokok. 10 PT Sampoerna merupakan salah satu produsen rokok di Indonesia. Pabrik rokok ini menghasilkan limbah produksi tembakau 180 000 metric ton/musim. PT Sampoerna menghadapi kendala dalam memanfaatkan limbah tembakau ini karena volumenya terus bertambah namun pemanfaatan terhadap limbah ini belum optimal (Sampoerna, 2007). Terdapat empat jenis limbah pabrik yaitu sludge (limbah cair/padatan setelah treatment di pengolahan limbah, seperti Lumpur), beat (potongan tangkai, cabang, daun), furnish ash (abu, sisa bakaran limbah rokok (kertas, cengkeh, tembakau, saos dan lain-lain) yang memiliki kandungan aluminium tinggi), dust (debu) (Sampoerna, 2007). Pada penelitian ini, limbah tembakau yang digunakan adalah jenis beat. Berdasarkan analisis unsur makro dan mikro yang dilakukan oleh Balai Penelitian Tanah tahun 2007 (Sampoerna, 2007) limbah jenis beat mengandung unsur makro: N-organik sebesar 1.63%, NH4 (0.26%), NO3 (0.74%), P2O5 (0.56%), K2O (12.17%), Na (0.12%), Ca (1.48%), Mg (0.42%). Unsur mikro yang terkandung dalam limbah beat sebagai berikut; S (0.26%), Fe (130 ppm), Al (164 ppm), Mn (90 ppm), Cu (11 ppm), Zn (14 ppm). Kadar air dalam limbah beat ini sebesar 5.37% dengan pH 5.1, kandungan C organik sebesar 39.11%. Aplikasi pemanfaatan limbah tembakau sebagai pupuk kompos pada lahan pisang, jagung dan padi di Kebun Raya Purwodadi Pasuruan Jawa Timur. Lembaga Ilmu Pengetahuan Indonesia (2006) menyampaikan bahwa di Kebun Raya tersebut pemanfaatan limbah tembakau 100% dapat meningkatkan pertumbuhan tanaman pisang, jagung dan padi. Namun untuk tanaman lain, limbah tembakau 25 % sebaiknya dicampur dengan media tanam yang lain. Pasir Pasir memiliki sifat lepas dan tidak lekat. Pasir berbentuk bulat, bersudut (angular) atau pipih. Pasir memiliki ukuran partikel yang lebih besar dari partikel tanah yang lain yaitu 0.5 – 0.25 mm dan ruang pori yang berkisar antara 35-50% sehingga pasir memiliki drainasi yang baik dan porositas yang besar. Oleh karena itu media ini dapat meneruskan infiltrasi air yang cepat. Infiltrasi adalah proses masuknya air hujan atau air irigasi ke dalam tanah (Soepardi, 1983). Pasir 11 memiliki kecepatan infiltrasi sebesar 10-3 cm/s lebih tinggi dibandingkan tanah liat sebesar 10-5 cm/s (Flegman dan George, 1975). Pasir merupakan salah satu media tanam yang penting seperti diungkapkan oleh Rubatzky dan Yamaguchi (1998). Hal ini dikarenakan pasir dapat meningkatkan ruang pori dan memperbaiki aerasi tanah. Arang sekam Arang sekam merupakan media tanam yang memiliki porositas yang tinggi sehingga dapat memperbaiki aerasi dan drainase namun dapat menurunkan kapasitas menahan air. Kemampuan menyimpan air pada sekam padi sebesar 12.3%. Nilai ini jauh lebih rendah apabila dibandingkan dengan pasir yang memiliki kapasitas menahan air sebesar 33.7 % (Nelson, 1981). Arang sekam berasal dari sekam yang dibakar secara tidak sempurna dan banyak digunakan sebagai media atau campuran media tanam untuk mengurangi bobot media dan memberikan lingkungan tumbuh yang lebih baik. Arang sekam ini berwarna hitam akibat adanya proses pembakaran sehingga daya serap terhadap panas tinggi dan dapat menaikkan suhu dan mempercepat perkecambahan (Murbandono, 1993) Penambatan CO2 pada Spesies Sukulen (Metabolisme Asam Crassulaceae) Salisbury dan Ross (1995) menyatakan bahwa tanaman sukulen adalah berbagai spesies tanaman yang hidup di iklim kering, mempunyai daun tebal, kutikula tebal, dan disertai laju transpirasi rendah. Tanaman ini biasanya tidak memiliki lapisan sel palisade yang berkembang sempurna dan sebagian besar sel fotosintesis daun atau batang adalah mesofil bunga karang. Sel-selnya memiliki vakuola yang cukup besar dibandingkan dengan lapisan tipis sitoplasmanya. Pada Gambar 4 diperlihatkan transpirasi dan penambatan CO2 sepanjang hari selama 24 jam. Pada Gambar 4 di atas menggambarkan pembukaan stomata, pengambilan CO2, dan perubahan asam malat selama 24 jam. Stomata membuka pada malam hari untuk mengambil CO2 dan menjaga kadar air. Gambar 4 bagian kanan menunjukkan bahwa stomata tertutup pada siang hari, CO2 disimpan untuk dilibatkan dalam siklus Calvin. 12 Gambar 4. Outline Tanaman Crassulacean Acid Metabolism (CAM). Sumber: www.rhode.phsscience.org (10 September 2007) Metabolisme CO2 pada tumbuhan sukulen tidak seperti pada tanaman lazimnya. Metabolisme ini dikenal dengan nama Crassulacean Acid Metabolism (CAM). Berbagai tanaman yang termasuk dalam jenis tanaman CAM yaitu famili Orchidaceae, Bromeliaceae, Liliaceae, Euphorbiaceae, Cactaceae. Tanaman ini biasa hidup di daerah kering, semi-kering, dan daerah epifit. Pada habitat ini, tanaman CAM harus mengefisienkan penggunakan CO2 dan H2O. Tanaman ini membuka stomata dan menambat CO2 menjadi asam malat pada malam hari ketika suhu lebih sejuk dan kelembaban nisbi tinggi (Salisbury dan Ross, 1995). Kemampuan tumbuhan untuk menjalankan CAM selain ditentukan oleh genetik juga dipengaruhi oleh lingkungan yaitu cekaman air, ketersediaan CO2 perubahan suhu siang-malam seperti disebutkan dalam Salisbury dan Ross (1995). Saat kondisi lingkungan sekitar sangat kering, tanaman ini bahkan tidak membuka stomatanya baik pada malam maupun siang hari. Oksigen yang dihasilkan pada fotosintesis digunakan untuk respirasi, begitu pula dengan CO2. Tanaman ini memiliki kemampuan recovery yang sangat cepat bila air di lingkungan tersedia lagi (Ransom S. L. dan Thomas M, 1960). Apabila tingkat CO2 pada malam hari lebih rendah dibandingkan siang hari karena adanya fotosintesis maka tanaman akan berubah ke sistem metabolit CAM. Kelembaban yang cukup, suhu yang mendekati titik beku diikuti tingkat cahaya yang tinggi pada tengah hari menyebabkan perubahan suhu daun sangat besar sehingga berlangsunglah CAM (Salisbury dan Ross, 1995). 13 Ransom S. L. dan Thomas M (1960) menyatakan bahwa tipe fotosintesis C4 dan CAM merupakan bentuk adaptasi tanaman terhadap kondisi lingkungan yang kering karena mereka harus lebih mengefisienkan penggunaan air. Namun antara tanaman C4 dan CAM berbeda (Salisbury dan Ross, 1995; Hopkins dan Huner, 2004). Perbedaan ini terletak bahwa pada tumbuhan C4, pemisahan ruang antar mesofil dan sel seludang berkas membantu pembentukan malat dan dekarboksilasi dan keduanya terjadi pada siang hari. Namun pada tumbuhan CAM, kedua proses ini terjadi pada malam hari sedangkan yang lainnya terjadi pada siang hari. Stomata Epidermis daun memiliki sebuah pori yang berguna untuk pertukaran gas antara ruang antar sel dan lingkungan sekitar. Pori ini sering disebut dengan stomata. Stomata ini dikelilingi oleh sel epidermis khusus yang disebut sel penjaga (guard cell). Stomata banyak ditemukan pada bagian daun tanaman, namun terdapat juga di bunga, batang, akar. Fungsi utama stomata untuk mengambil CO2 dari udara untuk proses fotosintesis dan mengendalikan proses transpirasi. Fungsi lain dari stomata adalah untuk mengenali kandungan polutan pada udara misalnya sulfur dioksida (SO2) (Hopkins dan Huner, 2004) Jumlah dan distribusi stomata bervariasi pada setiap tanaman tergantung pada spesies tanaman, posisi daun, kromosom set, dan lingkungan pertumbuhan. Jumlah stomata berkisar antara 20 – 400 stomata/mm2. Pada tanaman herba monokotil sebagai contoh yaitu rumput, stomata juga terdapat pada bagian bawah (abaxial) dan juga bagian atas (adaxial) sedangkan pada tanaman dikotil, stomata banyak terdapat pada bagian bawah daun. Pada tanaman dikotil berkayu, stomata hanya terdapat pada bagian bawah daun sedangkan tanaman yang mengapung diatas air (contoh : lili air) memiliki stomata hanya pada bagian atas daun (Hopkins dan Huner, 2004). Pembukaan stomata dipengaruhi oleh tekanan turgor sel penjaga. Apabila tekanan turgor sel penjaga meningkat maka stomata akan membuka dan jika tekanan turgor menurun stomata akan menutup. Pada umumnya stomata tanaman 14 akan membuka pada siang hari untuk proses fotosintesis namun pada tanaman CAM stomata membuka pada sore atau malam hari (Salisbury dan Ross, 1995). Stomata menutup bila selisih kandungan uap air di udara dan di ruang antar sel melebihi titik kritis. Hal ini diduga disebabkan gradien uap yang tajam mendorong penutupan stomata. Suhu tinggi (30 – 350C) biasanya menyebabkan stomata menutup. Hal ini diduga sebagai respon tak langsung tumbuhan terhadap keadaan rawan air atau disebabkan laju respirasi naik sehingga kadar CO2 dalam daun juga naik (Salisbury dan Ross, 1995). BAHAN DAN METODE Tempat dan Waktu Penelitian ini dilaksanakan di rumah kaca PT. ASABI, Sentul Rest Area Jalan Tol Jagorawi Km 35 Desa Kedungmangu Kecamatan Babakan Madang Kabupaten Bogor. Analisis stomata dilakukan di Laboratorium Ekofisiologi Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Analisis media tanam dilakukan di Laboratorium Analisis Kimia dan Kesuburan Tanah Departemen Ilmu Tanah dan Sumber Daya Lahan, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan pada bulan Februari – Mei 2007. Bahan dan Alat Bahan tanaman yang digunakan adalah tanaman S.trifasciata ’Lime Streaker’ tinggi 25-30 cm dan memiliki 3-5 daun. Filter cahaya yang digunakan adalah plastik selektif film, paranet 55%, plastik transparan biasa dan larutan CuSO4 2.5%. Media tanam yang digunakan adalah pasir, arang sekam, pakis, dan limbah tembakau. Alat yang digunakan luxmeter, hygro-termometer, pot plastik diameter 15 cm, gelas preparat, alat-alat pertanian, dan alat penunjang lainnya. Metode Penelitian Penelitian ini menggunakan rancangan petak terbagi (split plot) dengan rancangan lingkungan Rancangan Kelompok Lengkap Teracak (RKLT) yang terdiri atas dua faktor yaitu petak utama dan anak petak. Petak utama (P) merupakan perlakuan bangunan filter yang terdiri dari berbagai penutup (covering) yaitu menggunakan plastik selektif film (P1), paranet 55% (P2), plastik transparan (P3), dan filter CuSO4 2.5% (P4). Perlakuan berbagai komposisi media tanam (A) sebagai anak petak dengan 3 taraf perlakuan, yaitu limbah tembakau : pasir = 1:3 (A1), pasir : arang sekam : pakis = 2 : 1 : 1 (A2), pasir = 1 (A3). Pada penelitian ini, perlakuan yang lebih diutamakan yaitu pengaruh filter cahaya. Namun, penulis mengalami kesulitan untuk menempatkan filter cahaya sebagai anak petak. Kondisi di lapangan tidak memungkinkan untuk membangun 16 berbagai filter cahaya dengan ukuran kecil dan dalam jumlah banyak (3 buah bangunan untuk setiap perlakuan filter cahaya). Oleh karena itu, penulis memodifikasi rancangan dengan cara menempatkan filter cahaya sebagai petak utama dan komposisi media tanam sebagai anak petak. Penelitian terdiri dari empat petak utama dan tiga anak petak sehingga terdapat 12 kombinasi. Setiap kombinasi diulang sebanyak lima kali dan setiap ulangan terdiri dari satu pot sehingga terdapat 60 satuan percobaan. Tata Letak Percobaan disajikan pada Tabel Lampiran 1. Data dianalisis dengan uji F. Jika hasil uji F berpengaruh nyata, maka akan dilakukan uji lanjut menggunakan uji Beda Nyata Jujur (BNJ) atau Tukey pada taraf 5%. Model aditif linier percobaan adalah sebagai berikut: Yijk = µ + τi + βj + γk + αik + (τβ)ij + εijk Yijk : Nilai pengamatan pada perlakuan filter cahaya ke i, komposisi media tanam ke j dan ulangan ke k µ : Nilai rataan umum τi : Pengaruh utama perlakuan filter cahaya ke i βj : Pengaruh γk : Pengaruh ulangan ke k αik : Komponen komposisi media ke j acak dari petak utama yang menyebar normal. (τβ)ij : Pengaruh interaksi dari filter cahaya dan komposisi media εijk : Pengaruh galat percobaan filter cahaya ke i, komposisi media tanam ke j pada ulangan ke k i = 1, 2, 3, 4 j = 1, 2, 3 k= 1, 2, 3, 4, 5 Pelaksanaan Penelitian dilakukan melalui beberapa tahap, yaitu: Persiapan bangunan filter cahaya Persiapan filter cahaya yang dilakukan meliputi pembuatan dan penataan. Bangunan filter cahaya terdiri dari empat buah untuk masing-masing perlakuan, yaitu bangunan dengan atap (covering) plastik selektif film, paranet 55%, plastik 17 transparan biasa, dan bangunan yang beratap aquarium kaca yang berisi larutan CuSO4 2.5%. Tinggi larutan CuSO4 2.5% pada aquarium kaca adalah 0.8 cm. Di atas aquarium kaca tersebut ditutupi oleh selembar kaca dengan tujuan untuk menghindari terjadinya penguapan dan masuknya air hujan. Keempat bangunan filter cahaya tersebut diletakkan berdekatan dalam satu area. Gambar berbagai filter cahaya dalam penelitian ini ditunjukkan pada Gambar 5. Gambar 5. Berbagai Bangunan Filter Cahaya yang Digunakan dalam Penelitian Keterangan: Tanda menunjukkan filter cahaya digunakan sebagai penutup (covering) Pemilihan penggunaan plastik selektif film dan larutan CuSO4 sebagai filter cahaya didasarkan pada kemampuannya untuk meningkatkan rasio penerimaan cahaya R/FR sedangkan paranet 55% dan plastik transparan digunakan sebagai pembanding. Persiapan bahan tanaman dan media tanam Tanaman S.trifasciata ’Lime Streaker’ yang memiliki kondisi seragam diperoleh dengan cara membelinya dari nurseri tanaman hias di wilayah Bogor. Kondisi seragam ini meliputi umur, tinggi, dan jumlah daun tanaman yang sama. 18 Media tanam limbah tembakau diperoleh dari pabrik rokok PT. Sampoerna di Jawa Timur, sedangkan pasir, pakis dan arang sekam diperoleh dari toko pertanian ‘Tani Jaya’ Bogor. Limbah tembakau yang digunakan merupakan limbah yang berasal dari pabrik rokok PT Sampoerna yang berupa selats. Sebelum penelitian dimulai, limbah tembakau ini dikomposkan terlebih dahulu menggunakan EM4 selama satu bulan. Namun sebelumnya limbah tembakau ini telah dikomposkan terlebih dahulu di PT Sampoerna sebelum dikirimkan ke penulis. Media tanam dipersiapkan sesuai dengan perlakuan yang telah ditentukan sebelumnya. Gambar berbagai komposisi media tanam yang digunakan dalam penelitian ini disajikan dalam Gambar 6. A1: Limbah tembakau : pasir = 1: 3 A2: pasir : arang sekam : pakis = 2 : 1 : 1 A3: pasir = 1 Gambar 6. Berbagai Komposisi Media Tanam yang Digunakan dalam Penelitian Pemilihan penggunaan limbah tembakau sebagai komponen media tanam dalam penelitian ini didasarkan karena adanya kerjasama dari tim penulis dengan PT Sampoerna untuk membantu mengurangi volume limbah tembakau di PT Sampoerna. Harapan selanjutnya, limbah tembakau ini dapat digunakan sebagai kompos dan dapat diaplikasikan pada tanaman. Komposisi media tanam yang digunakan dalam penelitian ini adalah limbah tembakau : pasir = 1 : 3, pasir : arang sekam : pakis = 2 : 1 : 1, pasir = 1. Sebelum menggunakan media tanam limbah tembakau : pasir = 1 : 3, penulis telah menggunakan media tanam limbah tembakau : pasir = 1 : 1. Namun tanaman S.trifasciata ’Lime Streaker’ yang ditanam pada media limbah tembakau : pasir = 1 : 1 mengalami kebusukan sehingga penulis akhirnya menggunakan media tanam limbah tembakau : pasir = 1 : 3. Pemilihan penggunaan media tanam pasir : arang sekam : pakis = 2 : 1 : 1 didasarkan pada Lingga (2005). Pemilihan penggunaan 19 media tanam pasir = 1 didasarkan pada habitat asli Sansevieria yang berasal dari gurun (Henley et al., 2006). Penanaman bahan tanaman dan pemeliharaan Setelah semua bahan tanaman dan media telah siap, maka selanjutnya tanaman ditanam sesuai dengan perlakuan yang telah ditentukan. Kemudian tanaman dipindah ke setiap bangunan filter cahaya. Pemeliharaan yang dilakukan meliputi penyiraman, penyiangan, pemupukan dan pengendalian hama dan penyakit. Penyiraman dilakukan sesuai kebutuhan dengan volume 250ml/tanaman. Pengendalian gulma dilakukan secara manual menggunakan sabit. Pemupukan menggunakan pupuk daun Growmore (NPK 20:20:20) dosis 2.5g/L dengan volume 7 ml/tanaman. Pemupukan ini dilakukan pada sore hari pada saat stomata S.trifasciata ’Lime Streaker’ membuka dan dilakukan setiap minggu. Pemupukan dilakukan dengan cara menyemprotkan pupuk langsung ke daun tanaman. Pengamatan Data di peroleh dari pengamatan dan pengukuran baik yang dilakukan di laboratorium maupun lapangan menggunakan metode-metode yang telah ditentukan. Berikut ini adalah peubah yang diamati pada penelitian ini yaitu : 1. Tinggi tanaman induk Pengamatan terhadap tinggi tanaman dilakukan setiap minggu dari 1-14 Minggu Setelah Aplikasi (MSA). Peubah ini diukur dari satu centimeter di atas permukaan media tanam hingga ujung daun terpanjang. Pada pengolahan data tinggi tanaman induk digunakan pertambahan tinggi tanaman. 2. Lebar daun tanaman induk Pengamatan lebar daun dilakukan setiap minggu dari 1-14 MSA. Lebar daun yang dihitung merupakan lebar daun tanaman S.trifasciata ’Lime Streaker’ pada bagian atas, tengah, dan bawah. Setiap bagian lebar daun pada atas, tengah, dan bawah yang diamati diberi tanda garis. 20 3. Jumlah daun per roset tanaman induk Pengamatan terhadap jumlah daun per roset dilakukan setiap minggu selama 14 MSA. Jumlah daun per roset diperoleh dengan menghitung semua daun yang sudah terbuka penuh. 4. Jumlah tunas baru Jumlah tunas baru diperoleh dengan menghitung semua tunas baru yang sudah muncul di atas permukaan media tanam. Pengamatan terhadap peubah ini dilakukan setiap minggu sejak munculnya tunas baru. Waktu muncul tunas baru pada setiap tanaman induk berbeda-beda. 5. Jumlah stomata dan perilaku stomata. Pengamatan stomata dilakukan satu kali pengamatan selama penelitian yaitu pada 3 MSA. Perilaku stomata diamati pada pukul 09.00 WIB dan pukul 17.00 WIB. Tanaman penelitian berada di Sentul, Bogor namun Laboratorium Ekofisiologi yang merupakan tempat untuk meneliti jumlah dan perilaku stomata berada di Darmaga Bogor. Oleh karena itu diperlukan metode tertentu untuk mengamati stomata ini sehingga data yang diperoleh lebih akurat. Secara lebih jelas, metode pengamatan jumlah dan perilaku stomata disajikan pada Lampiran 2. Pengamatan jumlah dan perilaku stomata diamati keesokan harinya setelah dilakukan pengambilan contoh. Pengamatan jumlah dan perilaku stomata dilakukan dengan menggunakan mikroskop perbesaran 20 kali dengan luas bidang pandang 0.6174 mm2. 6. Warna Daun Peubah warna daun diukar secara visual dengan cara melihat kecerahan dan kekontrasan warna daun S. trifasciata ’Lime Streaker’. Tanaman difoto pada akhir pengamatan dengan intensitas cahaya, hari dan kamera yang sama. 7. Kekompakan Tanaman Kekompakan tanaman S.trifasciata ’Lime Streaker’ diamati dengan cara menyusun kriteria kekompakan tanaman terlebih dahulu seperti ditunjukkan pada Gambar 7. Kekompakan di tentukan pada akhir pengamatan (14 MSA). Berdasarkan kriteria tersebut dapat ditentukan kekompakan tanaman S.trifasciata ’Lime Streaker’ yang diteliti. Tanaman kompak yang 21 dikehendaki adalah tanaman yang pendek, berdaun lebar, memiliki jumlah daun dan tunas baru yang banyak. Tinggi tanaman harus sesuai dengan lebar pot. Kriteria ini didasarkan pada survei di nurseri tanaman hias dan komunikasi pribadi antara penulis, penjual tanaman hias, maupun para konsumen. 4 3 2 1 Gambar 7. Kriteria Kekompakan Tanaman S.trifasciata ‘Lime Streaker’ Keterangan: 4 = Sangat kompak. Tanaman memiliki tinggi 1.5-2 kali diameter pot atau 22.530 cm, tanaman padat dan memiliki tajuk rapi, tertata dan tidak menyebar, memiliki jumlah daun minimal 5 lembar, lebar daun 5-6 cm 3 = Kompak. Tanaman memiliki tinggi kurang 1.5-2 kali diameter pot atau 22.530 cm, tanaman padat dan memiliki tajuk rapi, tertata dan tidak menyebar, memiliki jumlah daun 4-5 lembar, lebar daun 4-5 cm 2 = Agak kompak. Tanaman memiliki tinggi kurang atau lebih dari 1.5-2 kali diameter pot atau kurang atau lebih dari 22.5-30 cm, tanaman kurang padat dan memiliki tajuk agak rapi, tertata dan sedikit menyebar, memiliki jumlah daun minimal 4-5 lembar, lebar daun 3-4 cm 1 = Kurang kompak. Tanaman memiliki tinggi kurang atau lebih dari 1.5-2 kali diameter pot atau kurang atau lebih dari 22.5-30 cm, tanaman kurang padat dan memiliki tajuk kurang rapi, kurang tertata dan menyebar, memiliki jumlah daun kurang dari 3 lembar, lebar daun 4 cm Selama penelitian berlangsung, kelembaban relatif, suhu dan intensitas cahaya matahari yang diterima di dalam bangunan filter cahaya diukur. 22 Kelembaban relatif dan suhu diukur dengan menggunakan hygro-termometer setiap hari selama penelitian berlangsung. Kelembapan relatif dan suhu diukur diukur satu kali dalam sehari yaitu pada rentang pukul 12.00-13.00 di setiap bangunan filter. Intensitas cahaya matahari diukur dengan luxmeter. Pengukuran intensitas cahaya matahari dilakukan satu kali selama penelitian berlangsung yaitu pada saat hari cerah (siang hari) di setiap bangunan filter dan ruangan terbuka. HASIL DAN PEMBAHASAN Kondisi Umum Penelitian Penelitian dilaksanakan pada bulan Februari – Mei 2007 pada waktu musim penghujan dengan suhu rata-rata selama penelitian sekitar 25.6oC (Tabel 2) dan termasuk suhu yang sesuai untuk pertumbuhan Sansevieria, seperti yang dikemukakan oleh Henley et al. (2006) bahwa Sansevieria dapat tumbuh pada rentang suhu yang luas dan mampu bertahan hidup di daerah panas seperti gurun. Pertumbuhan optimal tanaman Sansevieria dicapai pada siang hari dengan suhu 24-29ºC dan malam hari 18-21ºC. Suhu mikro di dalam bangunan filter rata-rata sebesar 35.77 ºC (Tabel 3). Intensitas cahaya rata-rata selama penelitian berdasarkan data dari Stasiun Klimatologi sebesar 251.3 kal/cm2/hari (Tabel 2). Menurut Henley et al. (2006) intensitas cahaya optimum untuk fotosintesis tanaman Sansevieria pada lahan terbuka 71 664 – 89 850 kal/cm2/hari (fc) sedangkan pada naungan (shade house) antara 8 958 – 53 748 kal/cm2/hari. Data iklim yang diperoleh adalah data iklim lokasi penelitian secara makro dan mikro. Data iklim makro (Tabel 2) diperoleh dari Stasiun Klimatologi Darmaga Bogor untuk wilayah Bogor sedangkan data iklim mikro merupakan data iklim yang diteliti di lokasi penelitian. Tabel 2. Iklim Makro di Wilayah Bogor Selama Penelitian Berlangsung Bulan Februari Maret April Mei Rata-rata Suhu (°C) 25.1 25.7 25.8 26.0 25.6 Kelembaban Nisbi (%) 87 86 85 86 86.2 Intensitas (kal/cm2/hari) 254 240 257 254 251.3 Hari Hujan 18 24 29 19 22.5 Curah Hujan (mm/bulan) 611 276 473 198 389.6 Sumber: Stasiun Klimatologi, Darmaga (2007) Data merupakan rataan dari pengukuran setiap hari Data iklim mikro yang diamati selama penelitian meliputi suhu, kelembaban dan intensitas cahaya. Suhu dan kelembaban udara diukur setiap hari selama penelitian berlangsung sedangkan intensitas cahaya diukur satu kali selama penelitian pada saat hari cerah. Pada Tabel 3 disajikan mengenai data suhu dan kelembaban di lokasi penelitian selama penelitian berlangsung. 24 Tabel 3. Suhu dan Kelembaban Tiap Bangunan Filter Cahaya Selama Penelitian Berlangsung Filter Cahaya Rata-rata Plastik Paranet 55% Plastik CuSO4 Selektif Film Suhu RH Suhu RH Suhu RH Suhu RH Suhu RH (°C) (%) (°C) (%) (°C) (%) (°C) (%) (°C) (%) Februari 35.61 54.73 34.69 51.88 38.44 62.02 36.22 51.85 36.24 55.12 Maret 35.04 55.20 33.85 51.82 36.56 66.16 33.19 49.52 34.66 55.68 April 37.17 54.08 34.59 50.28 38.73 63.19 36.55 49.58 36.76 54.28 Mei 33.00 54.67 34.67 51.33 42.33 63.79 31.67 50.32 35.42 55.03 Rata-rata 35.21 54.67 34.45 51.33 34.41 50.32 35.77 55.03 39.02 63.79 Keterangan: Pengamatan dilakukan setiap hari selama penelitian pada rentang pukul 12.00-13.00 Data primer merupakan rataan dari pengukuran setiap hari Bulan Suhu tertinggi (39.02ºC) selama penelitian diperoleh pada bangunan plastik sedangkan yang terendah (34.45ºC) pada bangunan paranet 55%. Rasio R/FR yang besar pada filter larutan CuSO4 2.5% dan plastik selektif film menyebabkan suhu lebih rendah. Panjang gelombang inframerah diketahui sebagai elemen panas dari matahari sehingga dengan meningkatnya rasio R/FR dapat mengurangi panas yang berada dalam filter tersebut. Pada bangunan dengan penutup (covering) plastik, energi yang masuk ke dalam bangunan tidak dapat keluar lagi karena terhalang plastik sehingga energi yang ada di dalamnya terus bertambah. Akibatnya, suhu yang ada di dalam bangunan plastik pun lebih tinggi dibanding dengan bangunan lainnya. Dilihat dari konstruksi bangunannya, bangunan dengan penutup (covering) plastik tidak memiliki ruang pertukaran udara yang baik. Berbeda dengan konstruksi bangunan pada ketiga filter cahaya lainnya yang lain. Pada ketiga bangunan yang lain, semua sisi bangunan dipasang kawat kasa sehingga terjadi pertukaran udara dengan lancar dan suhu mejadi lebih rendah. Kelembaban rata-rata tertinggi (63.79%) diperoleh pada bangunan filter plastik sedangkan yang terendah pada filter larutan CuSO4 2.5%. Dilihat dari konstruksi bangunannya, bangunan dengan penutup (covering) plastik selektif film merupakan bangunan yang paling tinggi. Hal ini memungkinkan terjadinya pertukaran udara yang lebih baik dibandingkan ketiga bangunan yang lain. Bangunan dengan penutup (covering) larutan CuSO4 2.5% merupakan bangunan 25 yang paling pendek sehingga pertukaran udara tidak lancar dan kelembaban relatifnya paling rendah. Pada Tabel 4 disajikan data pengukuran intensitas cahaya. Intensitas cahaya terendah terdapat pada bangunan yang beratap (covering) plastik selektif film (30 386.30 kal/cm2/hari) diikuti oleh filter CuSO4 2.5%, paranet 55%, dan plastik. Intensitas cahaya yang rendah pada bangunan rumah kaca dengan penutup (covering) plastik selektif film diduga disebabkan oleh adanya beberapa pohon durian yang mengelilingi bangunan filter tersebut. Selain itu, filter cahaya plastik selektif film yang digunakan juga sudah tidak bagus (ditumbuhi oleh lumut) sehingga tidak dapat meneruskan seluruh cahaya. Tabel 4. Intensitas Cahaya pada Berbagai Filter Cahaya Selama Penelitian Berlangsung Filter Cahaya Plastik Selektif Film Paranet Plastik CuSO4 2.5% Tanpa filter Intensitas cahaya (kal/cm2/hari) 30 386.3 133 360.7 150 721.5 105 109.9 271 250.4 Keterangan: Pengamatan dilakukan satu kali selama penelitian pada saat hari cerah (siang hari). Data merupakan rataan dari empat kali pengukuran Beberapa kendala yang dihadapi selama penelitian ini adalah robohnya salah satu bangunan filter cahaya karena angin kencang sehingga tim peneliti harus membangunnya kembali. Selain itu juga ditemui hama dan penyakit yang ditemui pada tanaman antara lain busuk rimpang (Aspergilus niger), busuk basah (Erwinia carotovora), bercak kering (Sclerotium rolfsii), thrips (Herciothrips feronalis), kutu daun (Aphis glycine), belalang, siput. Pengendalian hama dan penyakit dilakukan secara kimiawi dengan insektisida Decis 2.5 EC dengan konsentrasi 2 ml/l dan fungisida Dhitane konsentrasi 2 ml/l. Pengendalian dilakukan pada 2 dan 3 MSA. Gulma yang ditemui di lahan penelitian adalah babadotan (Ageratum conizoides), jarong lalaki (Stachitarpheta indica), meniran (Phyllanthus niruri), putri malu (Mimosa pudica), patikan (Euphorbia hirta), papahitan (Axonophus compresus), Cyperus spp.. Pengendalian gulma dilakukan seminggu sekali dengan cara manual. 26 Kendala lain yang dihadapi yaitu mahalnya harga bahan dan alat penelitian. Harga serbuk CuSO4 yang mahal (Rp 400 000.00/250 gram) menyebabkan perlakuan larutan CuSO4 hanya diberikan pada bagian atas (atap) bangunan saja. Akibatnya pada pagi dan sore hari cahaya matahari yang masuk ke dalam bangunan filter tidak tersaring dengan baik. Oleh karena itu, tanaman diletakkan di bagian tengah bangunan sehingga diharapkan tanaman mendapat rasio cahaya R/FR yang sama. Selain itu, aquarium kaca dengan ukuran 240cmx180cmx0.8cm diperoleh dengan harga Rp. 1 500 000.00. Rak untuk menyangga aquarium kaca tersebut dengan ukuran 240 cm x 180 cm x 180 cm diperoleh dengan harga Rp 1 200 000.00 Pengukuran kualitas cahaya yaitu besarnya nilai R/FR pada penelitian ini hanya didasarkan pada hasil penelitian Clemson dan Norway University (Mortensen dan Stromme (1987) dan Mc Mahon (1991) dalam Young et al. (1994). Oleh karena itu dibutuhkan alat pengukur kualitas cahaya yang khusus (spektroradiometer) sehingga hasil penelitian ini lebih akurat. Setiap tanaman penelitian disiram dengan volume yang seragam. Bangunan paranet 55% merupakan satu-satunya bangunan yang tidak berpenutup rapat. Pada bagian atas terdapat celah-celah yang memungkinkan masuknya air hujan. Akibatnya jumlah air yang diterima oleh S.trifasciata ‘Lime Streaker’ yang ditumbuhkan di paranet 55% lebih besar dari perlakuan yang lain. Secara umum, kondisi per tanaman selama penelitian cukup baik. Rekapitulasi sidik ragam terhadap seluruh peubah yang diamati disajikan pada Tabel 4 dan 5. Filter cahaya berpengaruh nyata pada peubah pertambahan tinggi tanaman induk (2 MSA) dan jumlah daun tanaman induk (1-3 MSA) dan berpengaruh sangat nyata terhadap jumlah daun tanaman induk (4-14 MSA). Filter cahaya tidak berpengaruh terhadap lebar daun tanaman induk bagian atas, tengah maupun bawah. Peubah tinggi, lebar dan jumlah daun tunas baru yang dihasilkan tidak dapat diolah karena tidak semua tanaman S.trifasciata ‘Lime Streaker’ menghasilkan tunas baru. Oleh karena itu pengamatan terhadap ketiga peubah ini tidak dapat disajikan. Namun pengamatan terhadap jumlah tunas baru yang muncul pada setiap perlakuan dapat disajikan dengan cara menghitung jumlah total tunas baru yang muncul pada akhir pengamatan (14 MSA). 27 Tabel 5. Rekapitulasi Sidik Ragam Pengaruh Filter Cahaya, Media Tanam dan Interaksinya terhadap Pertambahan Tinggi Tanaman Induk, Jumlah Daun dan Lebar Daun Tanaman Induk Bagian Atas. Peubah Pertambahan Tinggi Tanaman Induk Jumlah Daun Tanaman Induk Lebar Daun Tanaman Induk Bagian Atas Keterangan: KK: Koefisien Keragaman a) : Hasil Transformasi √x+0.5 MSA : Minggu Setelah Aplikasi MSA 1 2 3 4 5 6 7 8 9 10 11 12 13 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Filter (P) tn * tn tn tn tn tn tn tn tn tn tn tn * * * ** ** ** ** ** ** ** ** ** ** ** tn tn tn tn tn tn tn tn tn tn tn tn tn tn Media (A) tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn P*A tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn * * * * ** ** tn tn tn tn tn tn tn tn tn tn tn tn tn tn KK 24.37 a) 21.06 a) 20.97 a) 25.04 a) 18.25 a) 22.39 a) 17.93 a) 21.19 a) 13.92 a) 6.52 a) 12 a) 12.13 a) 9.86 a) 34.71 32.64 31.97 30.70 29.43 30.02 29.26 28.31 26.33 25 24.46 25.86 26.32 25.22 22.43 22.50 22.30 21.62 21.74 21.64 21.45 21.19 21.41 21.40 21.35 21.37 21.37 21.25 tn : tidak berbeda nyata pada uji Tukey 5% * : berbeda nyata pada α= 5 % ** : berbeda nyata pada α= 1 % 28 Tabel 6. Rekapitulasi Sidik Ragam Pengaruh Filter Cahaya, Media Tanam dan Interaksinya terhadap Lebar Daun Tanaman Induk Bagian Tengah dan Bawah. Peubah Lebar Daun Tanaman Induk Bagian Tengah Lebar Daun Tanaman Induk Bagian Bawah Keterangan: KK: Koefisien Keragaman a) : Hasil Transformasi √x+0.5 MSA : Minggu Setelah Aplikasi MSA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Filter (P) tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn Media (A) tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn P*A tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn KK 22.12 21.75 21.59 21.71 21.81 21.80 21.64 21.80 21.60 21.70 21.67 21.44 21.45 21.20 27.57 25.65 25.66 25.33 25.10 25.19 26.55 26.77 26.10 26.23 25.88 25.96 25.59 25.43 tn : tidak berbeda nyata pada uji Tukey 5% * : berbeda nyata pada α= 5 % ** : berbeda nyata pada α= 1 % Pertambahan Tinggi Tanaman Induk Berdasarkan rekapitulasi sidik ragam pada Tabel 4, filter cahaya tidak berpengaruh nyata pada pertambahan tinggi tanaman induk S.trifasciata ‘Lime Streaker’ sejak awal sampai akhir pengamatan kecuali pada 2 MSA. Media tanam juga tidak berpengaruh pada pertambahan tinggi tanaman induk S.trifasciata ‘Lime Streaker’. Interaksi antara filter cahaya dan media tanam tidak berpengaruh terhadap tinggi tanaman induk S. trifasciata ‘Lime Streaker’. 29 Pada 2 MSA, perlakuan filter cahaya berpengaruh nyata pada peubah pertambahan tinggi tanaman. Berikut disajikan hasil uji lanjut pengaruh filter Pertambahan Tinggi Tanaman (cm cahaya pada peubah pertambahan tinggi tanaman induk pada 2 MSA (Gambar 8). 1 0,95 0,9 0,85 0,8 0,75 0,7 Plastik Selektif Film Paranet Plastik CuSO4 Filter Cahaya Gambar 8. Pertambahan Tinggi Tanaman Induk S. trifasciata ’Lime Streaker’ pada Perlakuan Pengaruh Filter Cahaya pada 2 MSA Tanaman S.trifasciata ’Lime Streaker’ yang ditumbuhkan di bawah bangunan filter plastik selektif film lebih tinggi dibandingkan dengan tanaman yang ditumbuhkan di bawah bangunan filter cahaya yang lain. Hasil penelitian ini berbeda dengan hasil penelitian sebelumnya yang disampaikan oleh Wilson dan Rajapakse (2001) bahwa tinggi tanaman Salvia longispicata, Salvia splendens, dan Salvia leucantha Cav yang ditumbuhkan pada bangunan dengan penutup plastik selektif film lebih rendah 17-36 % dibandingkan dengan Salvia yang ditumbuhkan pada bangunan dengan penutup plastik biasa. Tanaman S.trifasciata ’Lime Streaker’ yang paling pendek diperoleh pada tanaman yang ditumbuhkan di bawah bangunan filter larutan CuSO4 2.5%. Penelitian lain yang dilakukan Mc Mahon dan Kelly (2006) bahwa tanaman poinsettia (Euphorbia pulcherrima 'Glory') yang ditumbuhkan di bawah bangunan filter CuSO4 lebih rendah 32% dibandingkan tanaman kontrol. Pada penelitian ini, seharusnya tanaman yang ditumbuhkan pada bangunan filter dengan penutup plastik selektif film dan larutan CuSO4 2.5% memiliki pertambahan tinggi tanaman yang rendah. Namun pada tanaman yang 30 ditumbuhkan dibawah filter plastik selektif film, tanaman S.trifasciata ’Lime Streaker’ justru memiliki pertambahan tinggi yang paling besar. Hal ini diduga karena intensitas cahaya pada plastik selektif film yang rendah (30 386.30 kal/cm / hari) sehingga tanaman mengalami etiolasi. Pada bangunan filter dengan penutup larutan CuSO4 2.5% memiliki pertambahan tinggi yang paling rendah meskipun intensitas cahaya yang diterima besar (105 109.9 kal/cm /hari). Selain itu, diduga tanaman S.trifasciata ’Lime Streaker’ tidak sensitif terhadap perlakuan perubahan rasio R/FR yang diterimanya melalui filter selektif film dan CuSO4 2.5%. Hasil penelitian ini sama dengan penelitian yang telah dilakukan oleh Lestari (2007) bahwa tanaman Sansevieria trifasciata ‘Laurentii’ yang ditumbuhkan di bawah perlakuan filter selektif film memiliki pertambahan tinggi terbesar setiap minggunya. Media tanam tidak berpengaruh pada pertambahan tinggi tanaman induk S.trifasciata ’Lime Streaker’ sampai akhir pengamatan. Pada Tabel 7 disajikan hasil pengamatan pengaruh media tanam terhadap pertambahan tinggi tanaman induk S.trifasciata ’Lime Streaker’ pada 1, 4, 8 dan 12 MSA. Tabel 7. Pengaruh Media Tanam terhadap Pertambahan Tinggi Tanaman Induk S.trifasciata ’Lime Streaker’ pada 1, 4, 8 dan 12 MSA Perlakuan Media Tanam 1 Limbah tembakau : pasir = 1:3 Pasir : arang sekam : pakis = 2 : 1 : 1 Pasir = 1 1.19 1.07 1.00 Umur (MSA) 4 8 12 ............cm............ 0.88 0.87 0.77 0.81 0.76 0.72 0.80 0.76 0.71 Berdasarkan Tabel 7, terlihat bahwa media tanam dapat menurunkan pertambahan tinggi tanaman induk S.trifasciata ‘Lime Streaker’ hingga akhir pengamatan. Media tanam pasir : arang sekam : pakis = 2 : 1 : 1 dan media pasir = 1 memiliki pertambahan tinggi tanaman induk S.trifasciata ‘Lime Streaker’ terendah yaitu 0.72 cm dan 0.71 cm pada 12 MSA. Media tanam pasir : arang sekam : pakis = 2 : 1 : 1 dan media pasir = 1 mengandung kombinasi unsur-unsur makro seperti ditampilkan pada Tabel 8. Pada kedua media tanam ini, unsur nitrogen yang terkandung tidak sebanyak pada media tanam pasir : tembakau = 3 : 1 yaitu 1.30 %. Hal inilah yang diduga 31 menyebabkan tanaman S.trifasciata ‘Lime Streaker’ yang ditanam pada media pasir : arang sekam : pakis = 2 : 1 : 1 dan media pasir = 1 lebih rendah dari media tanam pasir : tembakau = 3 : 1. Pernyataan ini dikuatkan oleh Sampoerna (2007) bahwa limbah pabrik jenis beat mengandung unsur N-organik sebesar 1.63% Tabel 8. Kandungan Nitrogen, Fosfor, dan Kalium pada Berbagai Kombinasi Perlakuan Media Tanam di Awal dan Akhir Penelitian Filter Cahaya Plastik Selektif Film Paranet 55% Plastik CuSO4 2.5% Jenis Media Nitrogen (%) Fosfor (%) Awal Penelitian Tembakau 1.30 0.04 Arang Sekam 0.65 0.09 Pasir 0.12 0.02 Pakis 0.50 0.03 Akhir Penelitian (14 MSA) a1 0.08 0.04 a2 0.32 0.05 a3 0.04 0.05 a1 0.08 0.04 a2 0.19 0.04 a3 0.10 0.05 a1 0.09 0.06 a2 0.24 0.05 a3 0.06 0.06 a1 0.06 0.05 a2 0.22 0.08 a3 0.06 0.06 Kalium (%) 3.75 2.54 1.27 1.05 0.83 0.27 0.20 0.27 0.18 0.16 0.28 0.19 0.18 0.40 0.18 0.13 Keterangan: a1= Pasir : tembakau = 3:1 a2= Pasir:arang sekam:pakis = 2:1:1 a3= Pasir = 1 Sumber : Data primer diperoleh dari analisis media tanam yang dilakukan di Laboratorium Kimia dan Kesuburan Tanah Departemen Ilmu Tanah dan Sumber Daya Lahan, Institut Pertanian Bogor. Lingga (2005) merekomendasikan kebutuhan kebutuhan nitrat (NO3), fosfor (P) dan kalium (K) untuk Sansevieria secara berturut-turut sebesar 30-39, 4-7, 120-199 ppm. Henley et al. (2006) menyebutkan bahwa nitrogen merupakan unsur yang paling penting dalam budidaya Sansevieria. Unsur nitrogen berperan dalam vase pertumbuhan vegetatif. Tanaman Sansevieria merupakan tanaman hias daun sehingga pertumbuhan vegetatifnya lebih penting daripada pertumbuhan generatifnya. 32 Jumlah Daun Tanaman Induk Filter cahaya berpengaruh nyata pada 1, 2, dan 3 MSA dan berpengaruh sangat nyata pada 4 – 14 MSA pada jumlah daun tanaman induk S.trifasciata ‘Lime Streaker’ yang diamati. Pada Gambar 9, ditunjukkan mengenai pengaruh filter cahaya terhadap jumlah daun tanaman induk. 6 Jumlah Daun 5 4 3 2 1 0 1 2 3 Minggu S etelah Aplikasi plastik selektif film paranet 55 % plastik 4 larutan CuSO4 Gambar 9. Pengaruh Filter Cahaya terhadap Jumlah Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ pada 1, 4, 8, 12 MSA Pada 12 MSA, tanaman induk S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter cahaya plastik selektif film memiliki jumlah daun terbanyak (4.87 lembar) dan sangat berbeda nyata dengan tanaman yang ditanam dibawah filter plastik (3.27 lembar). S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter cahaya plastik selektif film menerima intensitas cahaya yang paling sesuai dengan kebutuhannya yaitu sebesar 30 386.30 kal/cm2/hari. Sesuai dengan pernyataan Henley et al. (2006) bahwa intensitas cahaya optimum untuk fotosintesis tanaman Sansevieria pada lahan terbuka 71 664 – 89 850 kal/cm2/hari (fc). Oleh karena itu S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter cahaya plastik selektif film berfotosintesis dengan baik sehingga dapat memproduksi daun lebih banyak dibandingkan dengan S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter plastik yang menerima intensitas cahaya sebesar 150 721.5 kal/cm2/hari. Tanaman yang ditanam di dalam bangunan dengan penutup (covering) plastik selektif film dan larutan CuSO4 memiliki jumlah daun yang lebih banyak (Gambar 10) dibandingkan dengan dua perlakuan yang lainnya. Penggunaan filter cahaya CuSO4 dan plastik selektif film memiliki fungsi yang sama yaitu 33 meningkatkan rasio penerimaan cahaya merah : merah jauh oleh tanaman. Menurut Wilson dalam www.clemson.edu bahwa cahaya merah dapat meningkatkan konsentrasi sitokinin pada tanaman. Besarnya konsentrasi sitokinin pada tanaman akan mempengaruhi proses organogenesis tanaman yaitu kemampuan tanaman untuk beregenerasi atau berdeferensiasi membentuk sejumlah morfogenik dari organ. Seperti diungkapkan oleh Wattimena et al. (1999) bahwa sitokinin berperan dalam pembelahan sel, morfogenesis, dan pembentukan tunas. Terbentuknya sejumlah daun baru tanaman S. trifasciata ‘Lime Streaker’ pada filter cahaya CuSO4 dan Plastik Selektif Film, diduga juga dipengaruhi oleh rangsangan sitokinin ini. Lestari (2007) telah melakukan penelitian pada tanaman S. trifasciata ‘laurentii’ dengan hasil penelitian bahwa tanaman S. trifasciata ‘laurentii’ yang diletakkan di bawah filter selektif film dan CuSO4 2.5% menghasilkan lebih sedikit daun dibandingkan perlakuan plastik dan paranet 55%. Hasil penelitian Lestari (2007) ini berbeda dengan hasil penelitian yang telah dilakukan oleh penulis. Hal ini diduga karena tanaman Sansevieria termasuk tanaman yang kurang sensitif dan efektif terhadap perlakuan gelombang cahaya R/FR Tabel 9. Interaksi Filter Cahaya dan Media Tanam terhadap Jumlah Daun Tanaman Induk S trifasciata ‘Lime Streaker’ pada 9 MSA Media Tanam A1 A2 A3 Rataan Plastik Selektif Film 3.80abc 5.20a 4.00abc 4.33i Filter Cahaya Paranet 55 % Plastik 3.80abc 3.20bc 4.40ab 2.60c 3.00bc 3.20bc 3.73i 3.00i CuSO4 2.5% 4.00abc 3.20bc 4.60ab 3.93i Rataan 3.7j 3.85j 3.7j Keterangan : angka-angka yang diikuti huruf yang sama pada kolom dan baris yang sama tidak berbeda nyata pada uji lanjut BNJ 5% A1= Pasir : tembakau = 3:1 A2= Pasir: arang sekam : pakis = 2:1:1 A3= Pasir = 1 Media tanam tidak berpengaruh sejak awal sampai akhir pengamatan. Interkasi antara filter cahaya dan media tanam mulai berpengaruh nyata pada 9 12 MSA dan berpengaruh sangat nyata pada 13 dan 14 MSA. Pada Tabel 9 disajikan tabel interaksi filter cahaya dan media tanam terhadap jumlah daun tanaman induk S.trifasciata ‘Lime Streaker’ pada 9 MSA. 34 Pada 9 MSA, tanaman S.trifasciata ‘Lime Streaker’ yang di tanam pada media tanam pasir: arang sekam : pakis = 2:1:1 dan ditumbuhkan di bawah bangunan filter plastik selektif film memiliki jumlah daun tanaman induk yang paling banyak (5.20 lembar) di bandingkan dengan kombinasi perlakuan yang lain. Namun jika tanaman S.trifasciata ‘Lime Streaker’ di tanam pada media tanam pasir: arang sekam : pakis = 2:1:1 dan ditumbuhkan di bawah bangunan filter plastik, jumlah daun tanaman induknya paling sedikit (2.60 lembar). Tabel 10. Interaksi Filter Cahaya dan Media Tanam terhadap Jumlah Daun Tanaman Induk S trifasciata ‘Lime Streaker’ pada 14 MSA Media Tanam A1 A2 A3 Rataan Plastik Selektif Film 4.20abc 5.60a 5.00ab 4.93i Filter Cahaya Paranet 55 % Plastik 4.20abc 4.00bcd 4.60abc 2.60d 3.20cd 3.20cd 4.33ij 3.30j CuSO4 2.5% 4.80ab 3.20cd 5.20ab 4.02ij Rataan 4.3k 4k 4.11k Keterangan : angka-angka yang diikuti huruf yang sama pada kolom dan baris yang sama tidak berbeda nyata pada uji lanjut BNJ 5% A1= Pasir : tembakau = 3:1 A2= Pasir: arang sekam : pakis = 2:1:1 A3= Pasir = 1 Respon yang sama terlihat pada 14 MSA (Tabel 10), tanaman S.trifasciata ‘Lime Streaker’ yang di tanam pada media tanam pasir: arang sekam : pakis = 2:1:1 dan ditumbuhkan di bawah bangunan filter plastik selektif film lebih banyak memiliki daun dibandingkan dengan tanaman S.trifasciata ‘Lime Streaker’ ditumbuhkan di bawah bangunan filter paranet 55% dan filter CuSO4 2.5%. Namun pada tanaman S.trifasciata ‘Lime Streaker’ yang ditanam pada media tanam pasir = 1 dan ditumbuhkan di bawah bangunan filter plastik selektif film dan filter CuSO4 2.5% berbeda dengan tanaman yang ditumbuhkan di bawah filter paranet 55% dan plastik. Pada minggu yang sama, tanaman S.trifasciata ‘Lime Streaker’ yang di tanam pada media tanam pasir: arang sekam : pakis = 2:1:1 dan ditumbuhkan di bawah bangunan filter CuSO4 2.5% memiliki jumlah daun (3.2) yang lebih rendah dibandingkan dengan tanaman yang ditanam pada media tanam yang lainnya. Intensitas cahaya pada bangunan plastik selektif film sebesar 30 386.30 2 kal/cm /hari diduga merupakan nilai intensitas cahaya yang paling sesuai untuk pertumbuhan tanaman S.trifasciata ‘Lime Streaker’ terutama dalam menghasilkan 35 daun baru. Intensitas cahaya yang sesuai ini akan menghasilkan fotosintat yang cukup bagi tanaman S.trifasciata ‘Lime Streaker’ dalam mendeferensiasikan setiap selnya untuk membentuk daun baru. Media tanam pasir: arang sekam : pakis = 2:1:1 merupakan media tanam yang porous, drainase baik dan mampu memegang air dengan cukup baik. Selain itu, dari faktor ketersediaan nutrisi dalam media tanam, komposisi media tanam pasir : arang sekam : pakis = 2 : 1 : 1 memberikan ketersediaan unsur makro nitrogen (0.32%), fosfor (0.05%), dan kalium (0.27%) yang paling mendekati kebutuhan unsur hara tanaman Sansevieria. Henley et al. (2006) menyebutkan kebutuhan unsur nitrogen dalam Sansevieria adalah 1.7-3.0 %, fosfor 0.15-0.3 %, dan kalium 2.0-3.0 %. Unsur-unsur dalam media tanam pasir : arang sekam : pakis (a2) = 2 : 1 : 1 ini tidak tercuci jika diletakkan di bawah filter cahaya plastik selektif film. Lebar Daun Tanaman Induk Berdasarkan Tabel 5 dan 6, perlakuan media tanam, filter cahaya maupun interaksinya tidak berpengaruh nyata pada lebar daun tanaman induk S.trifasciata ‘Lime Streaker’ bagian atas, tengah, maupun bawah sejak awal sampai akhir pengamatan. Pada peubah lebar daun dilakukan penghitungan terhadap selisih lebar daun antara akhir pengamatan (14 MSA) dan awal pengamatan (1 MSA). Hal ini dilakukan untuk mengetahui seberapa besar pengaruh perlakuan terhadap lebar daun. Pada awal penelitian, lebar daun tanaman tidak sama sehingga penghitungan selisih ini berguna untuk menghindari terjadinya kebiasan hasil. Berikut disajikan pengaruh filter cahaya terhadap lebar daun tanaman induk S.trifasciata ‘Lime Streaker’ bagian atas, tengah, dan bawah (Tabel 11). Berdasarkan Tabel 11 pada akhir pengamatan daun tanaman S.trifasciata ‘Lime Streaker’ bagian atas paling lebar diperoleh pada bangunan filter paranet 55% dan plastik sedangkan daun bagian tengah dan bawah yang terlebar diperoleh pada bangunan filter paranet 55%. Tanaman S.trifasciata ‘Lime Streaker’ yang ditumbuhkan pada paranet 55% memiliki daun yang terlebar sebagai mekanisme adaptasi tanaman terhadap cekaman naungan yaitu 36 kekurangan cahaya. Hasil penelitian ini sama dengan Lestari (2007) bahwa S.trifasciata ‘Laurentii’ yang ditumbuhkan pada paranet 55% memiliki daun yang terlebar dibandingkan dengan filter cahaya yang lainnya. Tabel 11. Pengaruh Filter Cahaya terhadap Lebar Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ Bagian Atas, Tengah, dan Bawah Filter Cahaya 1 Plastik Selektif Film Paranet 55% Plastik CuSO4 2.5% 3.41 3.87 3.39 3.75 Plastik Selektif Film Paranet 55% Plastik CuSO4 2.5% 5.09 4.90 4.68 5.01 Plastik Selektif Film Paranet 55% Plastik CuSO4 2.5% 3.65 3.27 3.64 3.85 Umur (MSA) 5 10 .........cm......... Bagian Atas 3.69 3.75 4.28 4.43 3.81 3.95 4.09 4.21 Bagian Tengah 5.27 5.31 5.07 5.24 4.89 5.05 5.15 5.35 Bagian Bawah 3.68 3.80 3.39 3.71 3.72 3.85 3.84 3.92 14 Selisih (14 MSA-1 MSA) 3.79 4.45 3.97 4.24 0.38 0.58 0.58 0.49 5.38 5.35 5.09 5.41 0.29 0.45 0.41 0.40 3.83 3.79 3.89 3.96 0.18 0.52 0.25 0.11 Media tanam tidak berpengaruh terhadap peubah lebar daun baik daun bagian atas, tengah maupun bawah. Pada Tabel 13 disajikan mengenai pengaruh media tanam terhadap lebar daun tanaman induk S.trifasciata ‘Lime Streaker’ bagian atas, tengah dan bawah pada 1, 5, 10, dan 14 MSA. Berdasarkan Tabel 12, pada akhir pengamatan daun tanaman S.trifasciata ‘Lime Streaker’ bagian atas paling lebar diperoleh pada perlakuan limbah tembakau : pasir = 1:3 dan pasir : arang sekam : pakis = 2 : 1 : 1 sedangkan daun bagian tengah yang memiliki selisih lebar daun terbesar adalah tanaman yang ditanam pada media tanam tembakau : pasir = 1:3. Selisih lebar tanaman yang paling besar pada daun bagian bawah didapatkan pada tanaman yang ditanam pada media pasir. 37 Tabel 12. Pengaruh Media Tanam terhadap Lebar Daun Tanaman Induk S.trifasciata ‘Lime Streaker’ Bagian Atas, Tengah, dan Bawah Media Tanam 1 Limbah tembakau : pasir = 1:3 Pasir : arang sekam : pakis = 2 : 1 : 1 Pasir = 1 3.48 3.82 3.52 Limbah tembakau : pasir = 1:3 Pasir : arang sekam : pakis = 2 : 1 : 1 Pasir = 1 4.87 5.02 4.88 Limbah tembakau : pasir = 1:3 Pasir : arang sekam : pakis = 2 : 1 : 1 Pasir = 1 3.71 3.60 3.51 Umur (MSA) 5 10 .........cm......... Bagian Atas 3.86 3.98 4.23 4.33 3.82 3.95 Bagian Atas 5.07 5.28 5.18 5.30 5.04 5.14 Bagian Atas 3.77 3.87 3.64 3.79 3.57 3.80 14 Selisih (14 MSA-1 MSA) 4.02 4.36 3.97 0.54 0.54 0.40 5.32 5.40 5.20 0.45 0.38 0.32 3.92 3.88 3.81 0.21 0.28 0.30 Jumlah Tunas Baru Pada peubah jumlah tunas baru tidak dilakukan uji F karena keterbatasan data. Tidak semua tanaman S.trifasciata ‘Lime Streaker’ yang diujikan menghasilkan tunas baru. Namun pada akhir pengamatan (14 MSA) dihitung jumlah tunas baru yang muncul setiap perlakuan. Pada Gambar 10 disajikan mengenai pengaruh filter cahaya terhadap jumlah tunas baru yang muncul pada akhir pengamatan. Jumlah Daun 10 8 6 4 2 0 Plastik Selektif Paranet 55 % Film Plastik CuSO4 2,5% Filter Cahaya Gambar 10. Pengaruh Filter Cahaya terhadap Jumlah Tunas Baru Tanaman S. trifasciata ‘Lime Streaker’ pada Akhir Pengamatan 38 Filter cahaya plastik merupakan filter cahaya yang paling berpengaruh terhadap jumlah tunas baru yang dihasilkan. Hal ini dapat dilihat dari jumlah tunas baru yang muncul pada plastik (9 tunas baru) paling banyak secara berturut-turut diikuti oleh filter larutan CuSO4 2.5 %, plastik selektif film, dan paranet. Hasil penelitian ini sama dengan penelitian yang dilakukan Lestari (2007) bahwa tanaman dalam filter plastik menghasilkan jumlah tunas terbanyak. Penelitian yang dilakukan oleh Rajapakse dan Wilson (2006) menyatakan bahwa larutan CuSO4 dapat meningkatkan daya berkecambah benih, mengurangi pemanjangan batang, dan meningkatkan pertumbuhan tunas lateral. Sifat larutan CuSO4 ini tidak berbeda dengan plastik selektif film. Pada penelitian ini, jumlah tunas baru tanaman S.trifasciata ‘Lime Streaker’ yang dihasilkan pada bangunan filter dengan penutup larutan CuSO4 dan plastik selektif film hampir sama. Kedua bangunan filter ini dapat meningkatkan rasio panjang gelombang merah (R) dan infra merah (FR) sehingga tanaman lebih banyak menerima gelombang merah dibanding infra merah. Cahaya merah akan mengaktifkan fitokrom merah menjadi fitokrom merah jauh yang dapat merangsang perkecambahan dan meningkatkan pertumbuhan tunas lateral. Media tanam merupakan salah satu faktor yang berperan dalam proses pertumbuhan tanaman. Pada Gambar 11 berikut disajikan mengenai pengaruh media tanam terhadap jumlah tunas baru yang muncul pada akhir pengamatan. Jumlah Tunas Baru 12 10 8 6 4 2 0 pasir : tembakau = 1:3 pasir : arang sekam : pakis = 2 : 1 : 1 pasir = 1 Media Tanam Gambar 11. Pengaruh Media Tanam terhadap Jumlah Tunas Baru Total Tanaman S. trifasciata ‘Lime Streaker’ pada Akhir Pengamatan 39 Media limbah tembakau : pasir = 1:3 merupakan media yang paling berperanannya dalam menghasilkan tunas baru tanaman S.trifasciata ‘Lime Streaker’ terbanyak pada akhir penelitian ini. Hasil penelitian ini bertentangan dengan pernyataan Lingga (2005) bahwa tanaman Sansevieria tidak membutuhkan bahan organik yang banyak untuk pertumbuhannya. Faktor yang diduga mempengaruhi hal ini adalah kandungan nitrogen (1.3%) dan kalium (3.75%) yang cukup tinggi dibandingkan dengan media tanam yang lain. Peranan unsur nitrogen menurut Soepardi (1983) salah satunya untuk merangsang pertumbuhan vegetatif tanaman. Leiwakabessy dan Sutandi (1998) menyatakan peranan unsur kalium untuk pembelahan sel, fotosintesis, translokasi fotosintat. Jumlah Stomata Contoh stomata diambil dari daun tanaman S.trifasciata ‘Lime Streaker’ pada setiap perlakuan filter cahaya. Sampel diamati dari bagian atas maupun bawah daun serta bagian hijau maupun kuning daun. Contoh stomata diambil pada tiga titik yang berbeda pada masing-masing bagian tersebut. Pengulangan dilakukan 3 kali. Hasil yang didapat disajikan pada Gambar 12 berikut. 24,00 Jumlah Stomata 23,00 22,00 21,00 Hijau atas 20,00 Hijau bawah 19,00 Kuning atas Kuning bawah 18,00 17,00 16,00 Plastik Selektif Film Paranet 55% Plastik CuSO4 Filter Cahaya Gambar 12. Perbandingan Jumlah Stomata S.trifasciata ‘Lime Streaker’ pada Setiap Perlakuan Filter Cahaya. Tanaman S.trifasciata ‘Lime Streaker’ yang ditumbuhkan di bawah bangunan filter plastik selektif film memiliki jumlah stomata rata-rata (20.87/mm2) paling banyak dibandingkan dengan perlakuan filter cahaya yang lain. Secara berturut-turut jumlah stomata rata-rata yang terdapat pada ketiga 40 perlakuan yang lain adalah sebagai berikut: plastik 20.11/mm2, larutan CuSO4 19.21/mm2, paranet 55% 18.92/mm2. S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film memiliki jumlah stomata paling banyak. Sutarmi (1983) menyatakan bahwa pada tanaman yang menerima intensitas cahaya rendah menghasilkan jumlah stomata lebih banyak. Intensitas cahaya pada bangunan filter plastik selektif film yaitu sebesar 30 386.3 (kal/cm2/hari) lebih rendah daripada perlakuan filter cahaya lainnya. Hal inilah yang diduga sebagai penyebab jumlah stomata pada S.trifasciata ‘Lime Streaker’ yang ditanam di bawah filter plastik selektif film lebih tinggi dibandingkan perlakuan filter cahaya yang lain. Namun, penelitian Rajapakse et al. (1993) pada Chrysanthemum menyatakan bahwa pemberian sinar merah dapat mengurangi jumlah stomata. Pada tanaman Sansevieria yang lain, yaitu S.trifasciata ’Lilian True’ tanaman hasil stek yang diberi perlakuan filter CuSO4 2.5% memiliki jumlah stomata terbanyak, yakni stomata 10.59 per mm2, diikuti filter plastik (8.08), filter paranet 55% (6.66), dan filter selektif film (6.60) (Lestari, 2007). Fahn (1991) menjelaskan bahwa jumlah stomata per milimeter persegi dapat berbeda pada tumbuhan yang berlainan walaupun mereka masih satu spesies. Jumlah stomata S.trifasciata ‘Lime Streaker’ lebih banyak terdapat pada daun tanaman yang berwarna kuning dan terletak di bagian bawah daun (21.69/ mm2) diikuti oleh hijau bawah (20.46/mm2), kuning atas (18.63/ mm2), hijau atas (18.35/ mm2). Secara umum, jumlah stomata S.trifasciata ‘Lime Streaker’ lebih banyak terdapat pada bagian daun berwarna kuning dan terletak di bagian bawah daun. Hopskin dan Huner (2004) menguatkan bahwa stomata pada tanaman secara umum banyak terdapat pada bagian permukaan bawah daun. Namun pada tanaman herba monokotil stomata terletak pada bagian atas (adaxial) maupun bawah (abaxial) Sansevieria merupakan tanaman yang dikenal mampu menyerap polutan (Peart, 2003). Mekanisme penyerapan polutan terjadi melalui stomata (Giese et al., 1994). Oleh karena itu, semakin banyak jumlah stomata, tanaman ini diharapkan lebih efektif dalam menyerap polutan 41 Perilaku Stomata Pengamatan terhadap peubah perilaku stomata dilakukan pada pagi (09.00 WIB) dan sore hari (17.00 WIB). Sampel diamati dari bagian atas maupun bawah daun serta bagian hijau maupun kuning daun. Berdasarkan pengamatan yang telah dilakukan, tanaman stomata Sansevieria membuka pada sore hari yaitu sekitar pukul 17.00 sedangkan pada pagi harinya stomata menutup. Hal ini senada dengan pernyataan Lingga (2005) bahwa Sansevieria memiliki stomata yang banyak membuka pada sore hari. Pada Gambar 13 berikut merupakan hasil pengamatan kondisi pembukaan stomata pada pagi dan sore hari selama pengamatan. (a) (b) Gambar 13. Kondisi stomata Sansevieria trifasciata ’Lime Streaker’ (a) Stomata menutup pada pagi hari (pkl 09.00) (b) Stomata membuka pada sore hari (pkl 17.00) Hal ini menunjukkan bahwa Sansevieria merupakan tanaman sukulen yang memiliki metabolisme sistem Crassulacean Acid Metabolism (CAM). Salisbury dan Ross (1995) menjelaskan bahwa stomata pada tanaman CAM hanya membuka pada malam hari (pada saat itu tingkat evaporasi lebih rendah) dan menutup sepanjang hari untuk mengefisienkan penggunaan air. Sansevieria memiki habitat asli pada daerah kering atau gurun (Lingga, 2005 dan Henley et al., 2006). Pada habitat tersebut Sansevieria harus mengefisienkan penggunaan air dan CO2 untuk fotosintesis dengan cara menutup stomata pada pagi dan siang hari. Lingga (2005) menyebutkan bahwa Sansevieria termasuk tanaman bertipe fotosintesis CAM. Hal ini dibuktikan pada penelitian ini bahwa stomata tanaman Sansevieria membuka pada sore hari yaitu sekitar pukul 17.00 WIB. Pada waktu tersebut, suhu lingkungan lebih sejuk dan 42 kelembaban nisbi tinggi sehingga jika Sansevieria membuka stomatanya maka Sansevieria tidak terlalu kehilangan air dan CO2 (Salisbury dan Ross, 1992). Tanaman yang diletakkan di bawah paranet 55% memiliki persentase jumlah total stomata membuka lebih besar dibandingkan perlakuan filter lainnya, yaitu sebesar 59.06% (Tabel 13). Persentase pembukaan stomata pada filter CuSO4 dan plastik selektif film lebih rendah dari paranet 55%, masing-masing sebesar 16.57% dan 14.02 %. Persentase pembukaan stomata yang terdapat pada daun tanaman yang berwarna hijau pada bagian atas daun lebih besar (44.68%) Tabel 13. Persentase Stomata yang Membuka pada Sore Hari Filter Cahaya Plastik Selektif Film Paranet 55% Plastik CuSO4 Rataan Hijau Atas Hijau Kuning Kuning Bawah Atas Bawah ..........................%...................... 3.60 33.60 0 18.86 85.97 64.91 18.95 68.62 55.33 47.16 25.29 32.14 33.82 32.47 0 0 44.54 11.06 29.91 44.68 Rataan 14.02 59.06 39.98 16.57 Dalimunthe (2007) menyatakan bahwa cahaya merah turut mempengaruhi pembukaan stomata. Pada filter CuSO4 dan plastik selektif film yang diduga memiliki cahaya merah lebih tinggi justru persentase pembukaan stomatanya lebih rendah dari perlakuan paranet 55%. Cahaya merah selain merangsang masuknya ion kalium ke sel penjaga, juga berperan dalam pemecahan molekul pati untuk menghasilkan fosfoenol piruvat (PEP) yang dapat menerima CO2 untuk membentuk asam malat (Lakitan, 2004). Warna Daun Secara umum, kualitas warna daun Sansevieria antar perlakuan hampir sama. Tidak ada kekontrasan warna yang terlalu mencolok. Namun pada tanaman S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film dan larutan CuSO4 2.5% daunnya terlihat lebih cerah dibandingkan dengan filter cahaya paranet 55 % dan plastik seperti ditunjukkan pada Gambar 14. 43 Plastik Selektif Film Paranet 55% Plastik CuSO4 2.5% Gambar 14. Warna Daun S. trifasciata ‘Lime Streaker’ pada Berbagai Perlakuan Filter Cahaya Keterangan: Gambar diambil pada keadaan pencahayaan, hari dan kamera yang sama. Cahaya merupakan faktor penting bagi pertumbuhan dan perkembangan tanaman, karena selain berperan dominan pada proses fotosintesis, cahaya juga dapat berfungsi untuk mengendalikan proses morfogenesis tanaman (Salisbury dan Ross, 1995). Penyerapan cahaya hijau kuning (510 – 600 nm) terjadi dengan lemah dan banyak foton dari gelombang cahaya ini yang berpendar. Oleh karena itu daun terlihat berwarna hijau. Namun radiasi cahaya merah jauh tidak terlihat oleh mata karena cahaya merah jauh ini bukan merupakan cahaya tampak. Menurut Rajapakse et al. (1993) filter CuSO4 dapat menurunkan panjang gelombang merah jauh yang ditransmisikan oleh cahaya dan meningkatkan jumlah cahaya merah yang akan diterima tanaman. Besarnya rasio antara panjang cahaya merah (R) : merah jauh (FR) yang diterima tanaman akan berpengaruh pada fisiologi dan morfologi tanaman. Pengaruh yang sama diberikan oleh plastik selektif film. Pada penelitian ini, tanaman S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film dan larutan CuSO4 2.5% daunnya terlihat lebih cerah dibandingkan dengan perlakuan yang lain. Hal ini dapat meningkatkan kualitas penampilan dari tanaman S.trifasciata ‘Lime Streaker’ ini. Tanaman akan terlihat lebih menarik, eksotik, dan indah. Apabila penelitian ini diterapkan maka diharapkan dapat meningkatkan nilai jual tanaman Sansevieria. Pengamatan terhadap peubah warna daun dapat menggunakan pengolahan citra yaitu sebuah proses pengolahan dan analisis citra yang banyak melibatkan 44 persepsi visual. Penelitian yang mempelajari penggunaan pengolahan citra untuk menentukan kualitas tanaman Sansevieria belum pernah dilakukan sebelumnya. Oleh karena itu, penggunaan pengolahan citra pada tanaman Sansevieria perlu diteliti sehingga kualitas warna yang diukur menjadi lebih akurat. Kekompakan Tanaman Ukuran tanaman Sansevieria seringkali tidak seragam sehingga sering menyulitkan pemanfaatannya sebagai elemen dekorasi. Menurut Sachs dalam Dasoju, Evans, dan Whipker (1998) tinggi optimal tanaman pot adalah 1.5-2 kali lebar pot. Kualitas tanaman S.trifasciata ‘Lime Streaker’ yang diinginkan adalah yang memiliki tinggi tanaman proporsional dengan jumlah daun yang banyak. Acuan untuk penentuan kekompakan tanaman S.trifasciata ‘Lime Streaker’ dijabarkan di bagian bahan dan metode (Gambar 7). Seluruh peubah vegetatif yang diamati berperan dalam menentukan kekompakan tanaman. Kekompakan tanaman dalam penelitian ini dilihat dari perlakuan yang memberikan pertambahan tinggi tanaman terkecil, jumlah daun terbanyak, lebar daun terlebar dan memiliki jumlah anak terbanyak. Kemudian dari setiap perlakuan ditentukan rataannya. Rekapitulasi pengaruh filter cahaya dan media tanam terhadap berbagai peubah yang mempengaruhi kekompakan tanaman S. trifasciata ‘Lime Streaker’ ditunjukkan pada Tabel 14. Ballare et. al. (2002) menyatakan bila rasio R/FR besar, maka tanaman akan membentuk tajuk yang kompak. Pada penelitian ini tanaman yang ditanam pada filter cahaya CuSO4 dan plastik selektif film tidak lebih kompak dibandingkan paranet 55% dan plastik. Khattak et al. (1999) menyatakan bahwa cahaya merah jauh dapat menyebabkan tanaman krisan menjadi lebih pendek 10% dibandingkan dengan kontrol. Menurut Rajapakse et al. (1993) penggunaan filter CuSO4 6% pada tanaman krisan dalam rumah kaca dapat mengurangi tinggi dan panjang internode, meningkatkan klorofil daun dan tanaman menjadi lebih kompak. 45 Tabel 14. Rekapitulasi Pengaruh Faktor Filter Cahaya dan Media Tanam terhadap Kekompakan Tanaman S.trifasciata ‘Lime Streaker’ Peubah Pertambahan tinggi tanaman induk Jumlah daun tanaman induk Lebar daun atas tanaman induk Lebar daun tengah tanaman induk Lebar daun bawah tanaman induk Jumlah tunas baru Rataan P1 1 4 1 1 2 2 1.83 Keterangan: P1 = Plastik Selektif Film P2 = Paranet 55% P3 = Plastik P4 = CuSO4 2.5% 4 = sangat kompak 3 = kompak P2 3 3 3 4 4 1 3 Perlakuan P3 P4 A1 A2 A3 2 4 2 3 2 1 2 3 1 2 3 1 2 2 1 3 2 3 2 1 3 1 1 2 3 4 3 3 1 2 2.67 2.17 2.33 1.83 1.83 A1= Pasir : tembakau = 3:1 A2= Pasir : arang sekam : pakis = 2:1:1 A3= Pasir = 1 2 = agak kompak 1 = kurang kompak Tanaman S.trifasciata ‘Lime Streaker’ yang kompak pada penelitian ini justru didapatkan pada tanaman yang ditanam pada paranet 55%. Hal ini dimungkinkan karena S.trifasciata ‘Lime Streaker’ mengalami etiolasi sehingga memiliki daun lebar namun memiliki pertambahan tinggi tanaman yang tidak banyak. Secara umum, tanaman yang ditanam dibawah naungan akan lebih tinggi untuk mendapatkan cahaya dan lebih lemah. Pada Gambar 15 disajikan gambar mengenai hasil perlakuan filter cahaya dan media tanam terhadap kekompakan daun pada akhir pengamatan. 30 cm 20 cm plastik paranet selektif film plastik CuSO4 Gambar 15. Kekompakan Tanaman S.trifasciata ‘Lime Streaker’ pada Berbagai Perlakuan Filter Cahaya pada Akhir Pengamatan. 46 Media tanam tidak berpengaruh terhadap semua peubah. Namun berdasarkan Tabel 14, rataan tertinggi untuk peubah kekompakan tanaman diperoleh pada media tanam tembakau : pasir = 1 : 3. Hal ini diduga karena media tanam tembakau : pasir = 1 : 3 memiliki ketersediaan unsur makro dan mikro yang mendekati kebutuhan Sansevieria. Namun Henley et al. (2004) dan Lingga (2005) menyatakan bahwa tanaman Sansevieria merupakan tanaman asli gurun dan tidak membutuhkan banyak bahan organik. Oleh karena itu diperlukan adanya kajian dan penelitian lebih lanjut sehingga diperoleh informasi yang lebih akurat. Pembahasan Umum Secara umum, kondisi tanaman selama penelitian cukup baik. Filter cahaya berpengaruh nyata pada peubah pertambahan tinggi tanaman induk (2 MSA) dan jumlah daun tanaman induk (1-3 MSA) dan berpengaruh sangat nyata terhadap jumlah daun tanaman induk (4-14 MSA). Namun filter cahaya tidak berpengaruh terhadap lebar daun tanaman induk baik daun bagian atas, tengah maupn bawah. Perlakuan media tanam yang diberikan tidak berpengaruh pada semua peubah yang diamati. Kombinasi perlakuan antara filter cahaya dan media tanam hanya berpengaruh nyata terhadap jumlah daun tanaman induk pada 9-12 MSA dan sangat nyata pada 13 – 14 MSA. Tanaman induk S.trifasciata ’Lime Streaker’ yang paling pendek diperoleh pada tanaman yang ditumbuhkan di bawah bangunan filter larutan CuSO4 2.5%. Hal di atas senada dengan penelitian Mortensen dan Stromme (1987) dan Mc Mahon (1991) dalam Young et al. (1994) bahwa filter cahaya CuSO4 dengan konsentrasi 2.5% dapat menekan pertumbuhan tanaman. Tanaman induk S.trifasciata ‘Lime Streaker’ yang ditanam didalam bangunan dengan penutup (covering) plastik selektif film dan larutan CuSO4 memiliki jumlah daun yang lebih banyak. Penggunaan filter cahaya CuSO4 dan plastik selektif film memiliki fungsi yang sama yaitu meningkatkan rasio penerimaan cahaya R/FR oleh tanaman. Wilson dalam www.clemson.edu cahaya merah meningkatkan konsentrasi sitokinin pada tanaman 47 Kombinasi antara media tanam pasir: arang sekam : pakis = 2:1:1 dan filter plastik selektif film menghasilkan tanaman induk S.trifasciata ‘Lime Streaker’ yang memiliki jumlah daun paling banyak (5.60 lembar) di bandingkan dengan kombinasi perlakuan yang lain. Intensitas cahaya pada bangunan plastik selektif film (30 386.30 kal/cm2/hari) diduga sesuai untuk pertumbuhan tanaman S.trifasciata ‘Lime Streaker’ terutama dalam menghasilkan daun baru. S.trifasciata ‘Lime Streaker’ akan berfotosintesis untuk membentuk daun baru. Komposisi media tanam pasir : arang sekam : pakis = 2 : 1 : 1 memberikan ketersediaan unsur makro nitrogen (0.32%), fosfor (0.05%), dan kalium (0.27%) yang paling mendekati kebutuhan unsur hara Sansevieria. Henley et al. (2006) menyebutkan kebutuhan unsur nitrogen dalam Sansevieria adalah 1.7-3.0 %, fosfor 0.15-0.3 %, dan kalium 2.0-3.0 %. Selain itu, unsur-unsur dalam media tanam pasir : arang sekam : pakis = 2 : 1 : 1 ini tidak tercuci jika diletakkan di bawah filter cahaya plastik selektif film. Pada penelitian ini, perlakuan filter cahaya dan media tanam tidak banyak berpengaruh pada berbagai peubah yang diamati. Hal ini diduga karena Sansevieria merupakan tanaman yang kurang sensitif terhadap perlakuan gelombang cahaya R/FR dan memiliki pertumbuhan lambat. Selain itu waktu pengamatan yang terlalu singkat diduga sebagai faktor lainnya. Keterbatasan alat dan bahan turut mempengaruhi hasil penelitian ini. Harga alat dan bahan dalam penelitian ini cukup mahal sehingga cukup sulit untuk mendapatkan hasil yang akurat. Faktor iklim mikro disekitar area penelitian yang tidak seragam turut mempengaruhi hasil penelitian ini. Tanaman S.trifasciata ‘Lime Streaker’ yang ditanam di bawah bangunan plastik menghasilkan tunas baru paling banyak (9 tunas baru) dan media limbah tembakau : pasir = 1:3 merupakan media yang menghasilkan tunas baru tanaman S.trifasciata ‘Lime Streaker’ terbanyak pada akhir penelitian ini (11 tunas baru). S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film memiliki jumlah stomata paling banyak (20.87/mm2) dan lebih banyak terdapat pada daun tanaman yang berwarna kuning dan terletak di bagian bawah daun (21.69/ mm2). Tanaman yang diletakkan di bawah paranet 55 % memiliki persentase jumlah stomata yang membuka lebih besar dibandingkan perlakuan 48 filter lainnya, yaitu sebesar 59.06% dan lebih besar pada daun tanaman yang berwarna hijau pada bagian atas daun (44.68%). Hasil penelitian ini berbeda dengan pernyataan Rajapakse, McMahon, dan J. W. Kelly (1993) dan Dalimunthe (2007) bahwa sinar merah dapat mengurangi jumlah dan pembukaan stomata. Stomata tanaman Sansevieria membuka pada sore hari yaitu pukul sekitar pukul 17.00. Hal ini senada dengan pernyataan Lingga (2005) bahwa Sansevieria memiliki stomata yang banyak membuka pada sore hari dan sekaligus menunjukkan bahwa Sansevieria merupakan tanaman sukulen yang memiliki metabolisme sistem Crassulacean Acid Metabolism (CAM). Salisbury dan Ross (1995) menjelaskan bahwa stomata pada tanaman CAM hanya membuka pada malam hari (pada saat itu tingkat evaporasi lebih rendah) dan menutup sepanjang hari untuk mengefisienkan penggunaan air Tanaman S. trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film dan larutan CuSO4 2.5% daunnya terlihat lebih cerah. Hal ini karena penyerapan cahaya hijau kuning (510 – 600 nm) pada tanaman yang ditumbuhkan di bawah filter plastik selektif film dan larutan CuSO4 2.5% terjadi dengan lemah dan banyak foton dari gelombang cahaya ini yang berpendar akibat adanya cahaya merah yang lebih tinggi. Pada penelitian ini tanaman yang kompak diperoleh pada tanaman yang ditanam di paranet 55% dan media tanam pasir : tembakau = 3 : 1. Penggunaan media tanam pasir : tembakau = 3 : 1 memang menghasilkan tanaman yang lebihkompak namun jika menggunakan media limbah tembakau ini sebaiknya tidak terlalu banyak karena tanaman Sansevieria tidak menyukai terlalu banyak bahan organik. Untuk mendapatkan Sansevieria yang lebih kompak perlu diteliti lebih lanjut mengenai penggunaan filter cahaya dan media tanam sehingga diperoleh informasi yang lebih akurat. KESIMPULAN DAN SARAN Kesimpulan Pada penelitian ini dapat disimpulkan bahwa : 1. Filter cahaya berpengaruh pada peubah pertambahan tinggi tanaman induk dan jumlah daun tanaman induk. Tanaman S.trifasciata ’Lime Streaker’ yang di tanam di bawah filter CuSO4 2.5% paling pendek (0.77cm) dibandingkan dengan filter yang lain sedangkan yang tertinggi adalah tanaman S.trifasciata ’Lime Streaker’ yang di tanam di bawah filter plastik selektif film (0.98 cm). 2. Media tanam tidak berpengaruh pada semua peubah yang diamati. 3. Interaksi antara filter cahaya dan media tanam hanya berpengaruh terhadap peubah jumlah daun tanaman induk. Kombinasi antara plastik selektif film dan media tanam dengan komposisi pasir : arang sekam : pakis = 2 : 1 : 1 menghasilkan jumlah daun baru paling banyak (5.6 lembar daun). 4. S.trifasciata ‘Lime Streaker’ yang ditanam dibawah filter plastik selektif film dan larutan CuSO4 2.5% memiliki daun yang lebih cerah dibandingkan dengan perlakuan lainnya. 5. Tanaman yang kompak diperoleh pada paranet 55% dan media tanam pasir : tembakau = 3 : 1 Saran Pada penelitian selanjutnya disarankan untuk membangun filter cahaya dalam kondisi yang seragam. Untuk mengukur rasio R/FR sebaiknya menggunakan alat pengukur kualitas cahaya (spektroradiometer). Perlu digunakan metoda dan alat khusus (pengolahan citra) untuk menentukan tingkat kecerahan dan kekontrasan warna tanaman. Penggunaan berbagai filter cahaya berwarna lainnya juga perlu diteliti untuk menambah khasanah ilmu pengetahuan dan mempelajari keefektifannya dalam menghasilkan tanaman yang memiliki pertumbuhan dan kualitas penampilan yang baik. Selain itu juga perlu melihat pengaruh berbagai macam filter cahaya pada berbagai jenis tanaman hias lain. DAFTAR PUSTAKA Ballare, C. L. A. Scopel, J. J. Casal and R. A. Sánchez. 2002. Know They Neighbour Trough Phytocrome. www.plantphys.net. 23 Maret 2006. Bidwell, R.G.S. 1974. Plant Physiology. Macmillan Publishing Co., Inc. 643 p. Bonar, A. 1994. Indoor Conservatory and Greenhouse Gardening. Cassell. London. Chamberlain. 1986. Deposition of gases and particles on vegetation and soils. p 189-209. In: A. H. Legge and S. V. Krupa. (Eds.). Air Pollutants and Their Effect on The Terrestrial Ecosystem. John Wiley and son. New York. Campbell, N. A., J. B. Reece. L. G. Mitchell. 1999. Biologi. Erlangga. Jakarta Cemy, T.A., Shumin Li, N.C Rajapakse,. 2000. Greenhouse product news. 4(10). Dalimunthe,A. 2004. Stomata: Biosintesis, Mekanisme Kerja, dan Peranannya dalam Metabolisme. Program Studi Kehutanan Universitas Sumatra Utara. USU Digital library. 29 Juli 2007. Dariana, A. 2005. Tumbuhan Obat dan Khasiatnya. Seri 2. Penebar Swadaya. Depok. Dasoju, S. M. R. Evans, and B. E. Whipker. 1998. Paclobutrazol drenches control growth of potted sunflower. Hortech (8):235-237 Decoteau, D. 1998. Plant Physiology: Manipulating Plant Growth with Solar Radiation. Greenhouse Glazing & Solar Radiation Transmission Workshop. Rutgers University. Ellis, C. and M. W. Swaney. 1947. Soilless Growth of Plants. Reinhold Publishing Corporation. New York. 277p. Fahn, A. 1991. Anatomi Tumbuhan. Universitas Gajah Mada. Yogyakarta. 943 hal. Flegmann, A. W., and A. T. George. 1975. Soils and Other Growth Media. The Macmillan Press. Fletcher, J.M., A. Tatsiopoulou, P. Hadley, F.J. Davis, and R.G.C. Henbest. 2002. Growth, Yield and Development of Strawberry Cv ‘ Elsanta’ Under Novel Photoselective Film Clad Greenhouses. ISHS Acta Horticulturae 633 Gardner, F. P., R. B. Pearce, R. L. Mitchell. 1991. Fisiologi Tanaman Budidaya. Jakarta. UI Press. Giese, M., U. Bauer-Doranth, C. Langebartels and H. Sandermann, Jr. 1994. Detoxification of Formaldehyde by the Spider Plant (Chlorophytum comosum L.) and by soybean (Glycine max L.) cell suspension cultures, Plant Physiology. 104:1301-1309. Harjadi, S. S. 1989. Dasar-Dasar Hortikultura. Departemen Agronomi dan Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. 51 Henley, R.W., A.R. Chase, and L.S. Osborne. 2006. Sansevieria Production Guide. Central Florida Research and Education Center University of Florida. Florida. Hopkins, W. G. dan N. P. A. Huner. 2004. Introduction to Plant Physiology. John Wiley and Sons, Inc. New York. 559 p. Julianti, E. D. 2003. Hujan Emas di Ladang Sansevieria. Trubus 405:94-95 Khattak, A. M., S. Pearson, C. B. Johnson. 1999. The effect of spectral filters and nitrogen dose on the growth of chrysanthemum (Chrysantemum morifolium Ramat., cv. Snowdon). The Journal of Horticultural Science and Biotechnology Trustees 74(2):206-212. Lakitan, B. 1996. Fisiologi Pertumbuhan dan Perkembangan Tanaman. Grafindo Persada. Jakarta. 217 hal. Leiwakabessy, F. M. dan A. Sutandi. 1998. Pupuk dan Pemupukan. Departemen Tanah. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. Lembaga Ilmu Pengetahuan Indonesia (LIPI). 2006. Limbah Tembakau Dimanfaatkan untuk Kompos. www.lipi.go.id. 31 Agustus 2006. Lestari, P. 2007. Penggunaan Beberapa Filter Cahaya dan Cara Perbanyakan Vegetatif Untuk Memperbaiki Kualitas Fenotipe Bibit Sanseivieria trifasciata ‘Laurentii’ dan ‘Lilian True’. Skripsi. Departemen Agronomi dan Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. 94 hal. Lingga, L. 2005. Panduan Praktis Budidaya Sanseviera. AgroMedia Pustaka. Depok McMahon, M J and J. W. Kelly. 2006. Influence of Spectral Filters on Growth of Euphorbia pulcherrima 'Glory'. Department of Horticulture and Crop Science, The Ohio State University. Ohio Mortensen, L. M., E. Stromme, Z. Sebesta and Wenner. 1987. Growth chamber with control of light quality. Norwegian Journal of Agricultural Science 1:15. Murbandono, H. S. L. 1993. Membuat Kompos. Penebar Swadaya. Jakarta. 44hal. Mulyana, N. 2006. Adaptasi Morfologi, Anatomi, dan Fisiologi Empat Genotipe Kedelai (Glycine Max (L) Merr.) pada Kondisi Cekaman Naungan. Skripsi. Departemen Agronomi dan Hortikultura. IPB. Bogor. Peart, V. 2003. Indoor Air Quality in Florida:Houseplants to Fight Pollution. Department of Family, Youth and Community Sciences. Florida Cooperative Extension Service. Institute of Food and Agricultural Sciences. University of Florida. Florida. Rajapakse, N. C., McMahon, and J. W. Kelly. 1993. End of Day to Far-Red Light Reverses the Height Reduction of Chrysanthemum Induced by Copper Sulfate Spectral Filters. Department of Horticulture. Clemson University. Rajapakse, N. C. and S. Wilson. 2001. Growth Regulating Photoselective Greenhouse Covers. http://www.clemson.edu. 10 Februari 2006. 52 Ransom, S. L. and Thomas M. 1960. Crassulacean acid metabolism. Annual Rev Plant Physiol 11: 81-110 Rubatzky, V. E. and M. Yamaguchi. 1998. Sayuran Dunia 1. Penerbit ITB. Bandung. 313 hal. Salisbury, F. B. dan C. W. Ross. 1995. Fisiologi Tumbuhan (Terjemahan Plant Physiology.). Jilid 2. Penerbit ITB. Bandung. Sampoerna. 2007. Potensi Pemanfaatan Limbah Pabrik PT HMS Sampoerna. PT Sampoerna.( Tidak dipublikasikan) Sopandie, D., Trikoesoemaningtyas, dan N. Khumaida. 2005. Fisiologi, genetika dan molekuler adaptasi kedelai terhadap intensitas cahaya rendah: pengembangan varietas unggul kedelai sebagai tanaman sela. Departemen Agonomi dan Hortikultura, IPB. Bogor. (Tidak dipublikasikan) Soepardi, G. 1983. Sifat dan Ciri Tanah. Jurusan Tanah. Fakultas Pertanian. Institut Pertanian Bogor. Surkati, A. 1987. Aplikasi Teknologi pada Produksi Bunga. Jurusan Budidaya Pertanian. Institut Pertanian Bogor. Bogor. 18 hal. Sutarmi, S. 1983. Botani Umum Jilid II. Angkasa. Bandung. 180 hal. Young, R. E., Margaret J. Mc., Nihal C. R., and Dennis R. D. 1994. Spectral Filtering for Plant Production. International Lighting in Controlled Environments Workshop. Wattimena, G. A., L. W. Gunawan, N. A. Mattjik, E. Syamsudin, N. M. A. Wiendi. A. Ernawati. 1992. Bioteknologi Tanaman. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor. Wilson, S. 2006. Application of Photomorphogenesis Research to Horticultural Systems. http://www.clemson.edu Wilson, S.and N. Rajapakse. 2001. Use of photoselective plastic films to control growth of three perennial salvias. J. Appl. Hort., 3(2):71-74. Wikipedia. 2006. Tembakau. http://id.wikipedia.org. 11 Oktober 2006 LAMPIRAN 54 Lampiran 1. Denah Tata Letak Percobaan P1A2 P1A1 P1A3 P3A2 P3A3 P3A1 P2A1 P2A3 P2A2 P2A2 P2A3 P2A1 P4A1 P4A2 P4A3 Keterangan: P1 = Plastik Selektif Film P2 = Paranet 55% P3 = Plastik P4 = CuSO4 2.5% Ulangan 1 P3A2 P2A3 P3A1 P2A1 P3A3 P2A2 Ulangan 2 P2A1 P1A3 P2A2 P1A2 P2A3 P1A1 Ulangan 3 P1A2 P4A1 P1A3 P4A3 P1A1 P4A1 Ulangan 4 P1A1 P3A1 P1A3 P3A2 P1A2 P3A3 Ulangan 5 P1A2 P2A1 P1A1 P2A2 P1A3 P2A3 P4A1 P4A2 P4A3 P4A2 P4A1 P4A3 P3A1 P3A2 P3A3 P4A3 P4A1 P4A2 P3A1 P3A3 P3A2 A1= Pasir : tembakau = 3:1 A2= Pasir : arang sekam : pakis = 2:1:1 A3= Pasir = 1 55 Lampiran 2. Metode Pengamatan Jumlah dan Perilaku Stomata Bahan : Daun S. trifasciata ‘Lime Streaker’ dan cat kuku bening. Alat : Kaca objek, selotif, dan mikroskop. Metode: a. Daun S. trifasciata ‘Lime Streaker’ bagian bawah dan atas serta bagian daun yang berwarna kuning dan hijau diolesi cat kuku bening selebar selotip kecil secara merata dan tipis sehingga mudah diangkat. b. Lapisan cat kuku bening yang telah kering tersebut selanjutnya dikelupas dengan cara menempelkan selotif di bagian atas cata kuku bening kemudia ditarik (diangkat). c. Potongan selotif yang mengandung lapisan cat kuku bening (epidermis daun) tersebut ditempelkan pada kaca objek d. Preparat selanjutnya diamati di bawah mikroskop dengan pembesaran 100x20 e. Jumlah stomata yang terlihat dalam bidang pandang dihitung setiap masing-masing perlakuan sehingga didapat jumlah stomata per luas bidang pandang tersebut. Pengamatan diulang sebanyak tiga kali dengan cara mengeser bidang pandang namun tetap pada kaca objek yang sama. f. Perilaku membuka dan menutupnya stomata juga diamati seperti layaknya mengamati jumlah stomata diatas. Setelah dihitung jumlah stomata yang membuka selanjutnya dihitung persentase pembukaan stomata. Persentase pembukaan stomata = Jumlah stomata membuka X 100 % Jumlah seluruh stomata g. Diameter bidang pandang pada pembesaran 100 x 10 diukur menggunakan mikrometer untuk menghitung luas bidang pandang tersebut h. Luas bidang pandang dihitung dengan rumus: A = π d2 4 Keterangan: A = Luas bidang pandang, π = tetapan (3.14) dan d = diameter bidang pandang