KIMIA LARUTAN
advertisement

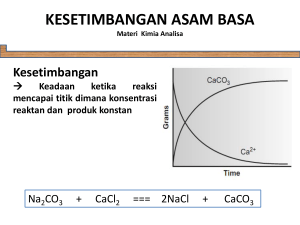
KIMIA LARUTAN Pada topik ini larutan yang dimaksud dibatasi pada larutan dengan pelarut air (aqueous solution). Air merupakan pelarut universal, tersedia melimpah, mudah untuk dimurnikan dan tidak beracun. LARUTAN ELEKTROLIT Kebanyakan solute yang akan dibahas adalah merupakan elektrolit yang membentuk ionion ketika dilarutkan dalam air menghasilkan larutan yang menghantarkan arus listrik. Elektrolit kuat terionisasi seluruhnya di dalam pelarut sedangkan elektrolit lemah terionisasi sebagian. ELEKTROLIT KUAT ELEKTROLIT LEMAH 1. Asam anorganik: HNO3, HClO4, H2SO4, HCl, 1. Kebanyakan asam anorganik termasuk HI, HBr, HClO3, HBrO3, H2CO3, H3BO3, H3PO4, H2S, H2SO3 2. Hidroksida alkali dan alkali tanah 2. Kebanyakan asam organik, spt asam asetat 3. Hampir semua garam 3. Amonia dan kebanyakan basa organic 4. Halida, sianida dan tiosianat dari Hg, Zn dan Cd ASAM DAN BASA Menurut Bronsted-Lowry, asam adalah donor proton dan basa adalah akseptor proton. Hal terpenting dari teori Bronsted-Lowry adalah konsep konjugasi. Basa konjugat adalah spesi yg terbentuk jika suatu asam kehilangan sebuah proton Asam1 Basa1 + proton Dalam hal ini, asam1 dan basa1 merupakan pasangan asam/basa konjugat. Demikian pula asam konjugat adalah spesi yg terbentuk jika suatu basa menerima sebuah proton Basa2 + proton Asam2 Jika dua proses ini disatukan hasilnya adalah reaksi asam basa atau netralisasi Asam1 + Basa2 Sonny Widiarto, 2009 Basa1 + Asam2 Kimia Analitik 1 Page 1 Kebanyakan pelarut dapat memiliki sifat menyumbangkan proton atau menerima proton, sehingga menghasilkan sifat asam atau basa pada larutan. Contoh dalam larutan aqueous, amonia bertindak sebagai basa sedangkan air sebagai asam NH3 + H2O Basa1 Asam2 NH4+ + OHAsam1 Basa2 Sedangkan dalam larutan asam nitrit dengan pelarut air, air bertindak sebagai basa H2O + HNO2 Basa1 Asam2 H3O+ + NO2Asam1 Basa2 + Asam konjugat dari H2O adalah H3O (ion hidronium) yang mengandung sebuah proton yang berikatan kovalen dengan molekul air. Yang perlu ditekankan disini adalah, suatu asam yang telah mendonorkan protonnya akan menjadi basa konjugat yang dapat menerima proton, seperti pada ion nitrit (yg merupakan basa konjugat dari asam nitrit) merupakan akseptor proton dari H2O menghasilkan ion OH-. Inilah penyebab larutan aqueous dari NaNO2 bersifat basa. NO2- + H2O Basa1 Asam2 HNO2 + OHAsam1 Basa2 SPESI AMFIPROTIK Beberapa solute memiliki kedua sifat asam maupun basa. Contohnya ion dihidrogen fosfat, H2PO4- yang bertindak sebagai basa dengan adanya donor proton seperti H3O+. H2PO4- + H3O+ H3PO4 + H2O Basa1 Asam1 Asam2 Basa2 Dalam hal ini, H3PO4 merupakan asam konjugat dari H2PO4-. Sedangkan apabila terdapat akseptor proton seperti OH-, maka H2PO42- bertindak sebagai asam H2PO42- + OH- HPO42- + H2O Asam1 Basa1 Basa2 Asam2 Asam amino sederhana merupakan contoh penting dari jenis senyawa amfiprotik yang mengandung kedua gugus fungsional yang bersifat asam lemah dan basa lemah. Jika dilarutkan dalam air, suatu asam amino seperti glisin melangsungkan semacam reaksi asam basa internal yang menghasilkan zwitterion – spesi yang memiliki kedua muatan positip dan negatip NH2CH2COOH Glisin NH3+ CH2COOZwitterion Reaksi tersebut analog dengan reaksi asam basa antara suatu asam karboksilat dengan suatu amina Sonny Widiarto, 2009 Kimia Analitik 1 Page 2 R’COO- +R’’NH3+ R’COOH + R’’NH2 Asam1 Basa2 Basa1 Asam2 PELARUT AMFIPROTIK Air merupakan pelarut dengan sifat amfiprotik, yaitu pelarut yang dapat bertindak sebagai asam maupun basa, tergantung pada solutnya. Air bertindak sebagai asam dengan adanya solute basa dan bertindak sebagai basa dengan adanya solute asam. Pelarut amfiprotik lainnya adalah metanol, etanol serta asam asetat anhidrous. NH4+ + CH3O- NH3 + CH3OH Basa1 Asam2 Asam1 CH3OH + HNO2 CH3OH2+ Basa1 Asam2 Basa2 + NO2- Asam1 Basa2 AUTO-PROTOLISIS Pelarut-pelarut amfiprotik mengalami ionisasi-diri atau auto-protolisis membentuk sepasang spesi ionik yang juga dapat dikategorikan reaksi asam basa Basa1 Asam2 H2O + Asam1 + H2O H3O + OH- CH3OH2+ + CH3O- CH3OH + CH3OH HCOOH2 + + HCOO- HCOOH + HCOOH NH3 + Basa2 NH4+ + NH2- NH3 Pada suhu kamar, air mengalami auto-protolisis/auto-ionisasi dengan kadar yang sangat sedikit, dimana konsentrasi H3O+ dan OH- dalam air murni hanya sekitar 10-7 M. Reaksi disosiasi merupakan reaksi peruraian senyawa menjadi ion-ion di dalam pelarut, yang berpengaruh terhadap kekuatan suatu asam/basa. HClO4 + H2O → H3O+ + ClO4- HCl + H2O → H3O+ + Cl- H3PO4 + H2O H3O+ + H2PO4- Al(H2O)63+ + H2O H3O+ + AlOH(H2O)52+ HC2H3O2 + H2O H3O+ + C2H3O2- H2PO4- + H2O H3O+ + HPO42- NH4+ + H2O H3O+ + NH3 Sonny Widiarto, 2009 Kimia Analitik 1 Page 3 KEKUATAN ASAM DAN BASA Tabel di atas memperlihatkan reaksi disosiasi beberapa asam di dalam air. Dua asam pertama merupakan asam kuat karena reaksinya dengan pelarut berlangsung lengkap, sehingga tidak menyisakan molekul solute yang tidak terdisosiasi di dalam larutan. Asamasam berikutnya merupakan asam lemah, karena terdisosiasi sebagian di dalam larutan. Pada tabel diatas semakin ke bawah kekuatan asam semakin berkurang. Pada asam perklorat dan asam klorida seluruhnya terdisosiasi dalam air, bandingkan dengan asam asetat yang hanya terdisosiasi 1%. Ion amonium bahkan lebih lemah lagi, dimana hanya 0,01% yang terdisosiasi menjadi H3O+ dan molekul amonia. Juga terlihat bahwa asam yang terlemah menghasilkan basa konjugat yang terkuat, yaitu amonia yang memiliki afinitas terkuat terhadap proton. Pelarut sangat menentukan kekuatan asam atau basa yang larut di dalamnya. Contohnya bila HClO4 dilarutkan dalam asam asetat anhidrous maka tidak mengalami disosiasi sempurna. Yang berlaku adalah kesetimbangan CH3COOH + HClO4 Basa1 CH3COOH2 + + ClO4- Asam2 Asam1 Basa2 Namun demikian di dalam pelarut asam asetat anhidrous, konstanta disosiasi HClO4 5000 kali lebih besar dari HCl. Asam asetat dikatakan memiliki pelarut dengan sifat pembeda (differentiating) bagi kedua asam tersebut, sedangkan air merupakan pelarut penyetara (leveling) bagi HClO4, HCl, HNO3, dan H2SO4. KESETIMBANGAN KIMIA Kebanyakan reaksi kimia tidak berlangsung sempurna dimana seluruh reaktan berubah menjadi produk. Yang sering terjadi adalah adanya kesetimbangan antara reaktan dan produk yaitu perbandingan antara konsentrasi reaktan dan produk konstan yang digambarkan dalam Konstanta kesetimbangan. Pada kesetimbangan berikut H3AsO4 + 3I- + 2H+ H3AsO3 + I3- + H2O Kecepatan reaksi dan tingkat kesempurnaan reaksi dapat diamati dengan terbentuknya warna merah-jingga ion triiodida (I3-). Misalkan 1 mmol asam arsenat H3AsO4 ditambahkan ke dalam 100 mL larutan yang mengandung 3 mmol KI, warna merah dari triiodida akan muncul dengan cepat, dan dalam beberapa detik warna tersebut akan konstan, yang menandakan konsentrasi triiodida telah konstan. Sonny Widiarto, 2009 Kimia Analitik 1 Page 4 Warna dengan intensitas yang sama juga dapat dihasilkan dengan mereaksikan 1 mmol asam arsenit H3AsO3 dengan 100 mL larutan yang mengandung 1 mmol ion triiodida. Pada reaksi ini warna merah dari triiodida akan berkurang H3AsO3 + I3- + H2O H3AsO4 + 3I- + 2H+ Kedua reaksi di atas menghasilkan larutan dengan warna yang sama PRINSIP LE CHATELIER Bila suatu sistem kesetimbangan diberi suatu paksaan, maka posisi kesetimbangan sistem itu cenderung bergeser sedemikian untuk mengurangi akibat paksaan itu. Pada kesetimbangan arsenat-arsenit, penambahan asam arsenat atau ion H+ akan meningkatkan warna ion triiodida dan pembentukan asam arsenit. Pergeseran posisi kesetimbangan yang diakibatkan oleh perubahan konsentrasi salah satu reaktan atau produk dalam sistem kesetimbangan dinamakan efek aksi massa. UNGKAPAN KONSTANTA KESETIMBANGAN wW + xX yY + zZ ungkapan konstanta kesetimbangan untuk persamaan di atas: [Y]y [Z]z K= [W]w [X]x kurung persegi menandakan konsentrasi molar jika spesi merupakan zat terlarut tekanan parsial di atmosfer jika spesi berbentuk gas jika dalam sistem kesetimbangan terdapat spesi berbentuk padatan murni, cairan murni atau pelarut berlebih, maka tidak dimasukkan dalam ungkapan konstanta kesetimbangan JENIS-JENIS KONSTANTA KESETIMBANGAN JENIS KESETIMBANGAN Dissosiasi air Kesetimbangan padatan dan ion pada Sonny Widiarto, 2009 SIMBOL KONSTAN CONTOH TA Kw 2 H2O Ksp BaSO4 (s) Kimia Analitik 1 H3O+ + OHBa2+ + SO42- UNGKAPAN KONSTANTA KESETIMBANGAN Kw = [H3O+][OH-] Ksp =[Ba2+][SO42-] Page 5 larutan jenuh H3O + + CH3COOH + H2O Ka = - CH3COO Disosiasi asam/basa [H3O +][CH3COO-] [CH3COOH] Ka atau Kb lemah CH3COO- + H2O OH - + Kb = [OH -][CH3COOH] [CH3COO-] CH3COOH Ni2+ + 4 CN βn Pembentukan - Ni(CN)42- kompleks Kesetimbangan redoks Kredoks Kesetimbangan Kd MnO42- + 5Fe 2+ Mn2++ 5Fe 3+ I2 (aq) β4= + 8H+ [Ni(CN)42-] [Ni2+][CN-]4 [Mn2+][Fe K= + 4H2O [MnO42-] [Fe I2(org) Kd = distribusi Ni2+ + CN - Ni(CN)+ Ni(CN)+ + CN - Ni(CN)2 + CN - Ni(CN)3- + CN - K1 = Ni(CN)2 K2 = Ni(CN)3- K3 = Ni(CN)42- K4 = 2+ 5 [I2]org [I2] aq [Ni(CN)+] [Ni2+][CN-] [Ni(CN)2] [Ni(CN)+][CN-] [Ni(CN)3- ] [Ni(CN)2][CN-] [Ni(CN)42- ] [Ni(CN)3- ][CN-] FUNGSI – p Pada saat membahas konstanta kesetimbangan seringkali kita menjumpai nilai yang sangat kecil, misal konstanta hasil kali ion untuk air Kw = 10-14. Untuk nilai tersebut, dapat digunakan fungsi – p atau nilai – p, yaitu logaritma negatip dari nilai tersebut. pKw = - log (10-14) = 14 KONSTANTA HASIL KALI ION UNTUK AIR Larutan berair mengandung sejumlah kecil ion hidronium dan ion hidroksida, yg merupakan disosiasi air Sonny Widiarto, 2009 Kimia Analitik 1 3+]5 Page 6 ] [H+]8 H3O+ + OH- 2 H2O K= [H3O+][OH-] [H2O]2 K [H2O]2 = [H3O+][OH-] Kw = [H3O+][OH-] Dalam larutan aq encer, konsentrasi molar dari air adalah: [H2O] = 1000 g H2O x 1 mol H2O = 55,6 M 18 g H2O 1L H2O jika ke dalam air dimasukkan 0,1 mol HCl, maka kesetimbangan berikut H3O+ + OH- 2 H2O akan bergeser ke kiri. Awalnya terdapat 10-7 mol/L OH-, bila semuanya berubah mjd H2O maka konsentrasi H2O [H2O] =55,6 mol H2O L H2O + 1 x 10-7 1 mol H2O mol OHL H2O x mol OH- ≈ 55,6 M peningkatan sebesar 10-7 M dari 55,6 M (2 x 10-7%) dapat diabaikan sehingga nilai K[H2O]2 merupakan konstanta, Kw = 10-14 hitung [H3O+] dan [OH-] dalam 0,2 M larutan aq NaOH jawab: dalam pelarut air [OH-] = [H3O+]. Setelah penambahan 0,2 M OH-, [OH-] = 0,2 + [H3O+] ≈ 0,2 [H3O+] = 1 x 10-14 Kw - [OH ] = 0,2 = 5 x 10-14 KONSTANTA HASIL KALI KELARUTAN (KSP) Jika suatu garam dilarutkan dalam air, maka akan membentuk kesetimbangan antara padatan dan ion-ion terlarut. Contoh pada larutan jenuh Ba(IO3)2 Ba(IO3)2 (s) Ba2+ (aq) + 2IO3- (aq) [Ba2+][IO3-]2 K= [Ba(IO3)2 (s)] konsentrasi zat dalam keadaan padat adalah konstan K [Ba(IO3)2 (s)] = Ksp = [Ba2+][IO3-]2 Sonny Widiarto, 2009 Kimia Analitik 1 Page 7 Soal: berapa gram Ba(IO3)2 (487 g/mol) dapat larut dalam 250 mL air pada 25oC. Diketahui Ksp Ba(IO3)2 = 1,57 x 10-9 Jawab: pada kesetimbangan Ba(IO3)2 (s) Ba2+ (aq) + 2IO3- (aq) Ksp = [Ba2+][IO3-]2 = 1,57 x 10-9 Dari persamaan diketahui bahwa untuk setiap mol Ba(IO3)2 yang larut maka akan terbentuk 1 mol Ba2+. Dengan kata lain Kelarutan molar Ba(IO3)2 = [Ba2+] Konsentrasi iodat dua kali konsentrasi Ba2+, [IO3-] = 2[Ba2+] Ksp = [Ba2+][IO3-]2 = 1,57 x 10-9 [Ba2+] (2[Ba2+])2 = 1,57 x 10-9 4 [Ba2+]3 = 1,57 x 10-9 [Ba2+] = 7,32 x 10-4 M Kelarutan molar Ba(IO3)2 = [Ba2+]= 7,32 x 10-4 M mmol Ba(IO3)2 =7,32 x 10-4 mmol Ba(IO3)2 mL x 500 mL Berat Ba(IO3)2 = (7,32 x 10-4 x 500) mmol Ba(IO3)2 x 487 mg Ba(IO3)2 1 mmol Ba(IO 3)2 = 178 mg EFEK ION SEJENIS Berkurangnya kelarutan suatu endapan ionik bila suatu senyawa soluble yg mengandung salah satu ion endapan ditambahkan ke dalam larutan jenuh endapan tersebut Soal: Hitung kelarutan molar Ba(IO3)2 dalam suatu larutan Ba(NO3)2 0,02 M. Jawab: Kelarutan molar Ba(IO3)2 = [Ba2+]= ½[IO3-]. [Ba2+] tidak lagi mewakili kelarutan Ba(IO3)2 karena terdapat Ba(NO3)2 yang juga merupakan sumber bagi Ba2+. Dari larutan Ba(NO3)2 diperoleh [Ba2+]= 0,02. Dari Ba(IO3)2, [Ba2+]= ½[IO3-]. Maka: [Ba2+]= 0,02 + ½[IO3-] Ksp = [Ba2+][IO3-]2 = 1,57 x 10-9 (0,02 + ½[IO3-]) [IO3-]2 = 1,57 x 10-9 persamaan ini memerlukan penyelesaian yang cukup rumit, kita dapat menyederhanakan [Ba2+]= 0,02 + ½[IO3-] dengan asumsi harga ½[IO3-] << 0,02, dengan kata lain besarnya ½[IO3-] dapat diabaikan, sehingga: [Ba2+]= 0,02 + ½[IO3-] ≈ 0,02 Ksp = [Ba2+][IO3-]2 = 1,57 x 10-9 0,02 [IO3-]2 = 1,57 x 10-9 [IO3-] = 2,8 x 10-4 Sonny Widiarto, 2009 Kimia Analitik 1 Page 8 apakah asumsi kita dapat diterima? 0,02 + ½(2,8 x 10-4) = 0,02014. Ya ! karena penyimpangan dari harga sebenarnya hanya 0,7% (diperoleh dari 0,00014 / 0,02). Asumsi seperti ini masih dapat diterima jika penyimpangan kurang dari 10%. Kelarutan molar Ba(IO3)2 = ½[IO3-] = 0,00014 M = 1,4 x 10-4 M Jika kita bandingkan kelarutan molar Ba(IO3)2 dalam air murni (7,32 x 10-4 M) dengan kelarutannya dalam 0,02 M Ba(NO3)2 maka terdapat pengurangan kelarutan sekitar 5 kali dengan adanya efek ion sejenis. KONSTANTA DISOSIASI ASAM DAN BASA Jika suatu asam lemah atau basa lemah dilarutkan dalam air maka disosiasi parsial akan terjadi, contoh untuk asam nitrit dan amonia + HNO2 + H2O H3O NH3 + H2O NH4 + + Ka = NO2- Kb = - + OH [H3O+][NO2-] [HNO2] [NH4+][OH-] [NH3] KONSTANTA DISOSIASI UNTUK PASANGAN ASAM BASA KONJUGAT Untuk pasangan konjugat amonium-amonia, NH3 + H2O NH4 + NH4 Kb = - + OH Ka = + + H2O Ka x Kb = + NH3 + H3O [NH3][H3O+] [NH4+] x [NH4+][OH-] [NH3] [NH4+][OH-] [NH3] [NH3][H3O+] [NH4+] = [H3O+][OH-] karena Kw = [H3O+][OH-], Ka Kb = Kw SOAL: Berapakah Kb untuk kesetimbangan reaksi berikut CN- + H2O HCN + OH- Jika diketahui Ka untuk HCN adalah 6,2 x 10-10 Jawab: Sonny Widiarto, 2009 Kimia Analitik 1 Page 9 [HCN][OH-] Kb = Kb = [CN-] 1 x 10-14 Kw = = 1,62 x 10-5 6,2 x 10-10 Kb HCN KONSENTRASI ION H3O+ DALAM LARUTAN ASAM LEMAH Jika suatu asam lemah dilarutkan dalam air maka akan terbentuk 2 buah kesetimbangan + HA + H2O H3O + A Ka = - [HA] Kw = [H3O+][OH-] H3O+ + OH- 2 H2O [H3O+][A-] Ion H3O+ yg dihasilkan dari kesetimbangan pertama nilainya jauh lebih besar dibanding H3O+ yg dihasilkan auto-ionisasi air, sehingga [A-] ≈ [H3O+] kemudian, jumlah konsentrasi molar asam lemah dan basa konjugatnya sama dengan konsentrasi analitik asam lemah CHA CHA = [A-] + [HA] CHA = [H3O+] + [HA] → [HA] = CHA - [H3O+] [H3O+]2 Ka = CHA - [H3O+] → [H3O+]2 +Ka [H3O+] - Ka CHA = 0 jawaban positip untuk persamaan kuadrat ini adalah - Ka + √ Ka2 + 4 Ka CHA [H3O+] = 2 SOAL: hitung konsentrasi ion H3O+ dalam larutan 0,120 M asam nitrit HNO2 + H2O H3O+ + NO2- Jawab: Ka = [H3O+][NO2-] [HNO2] Ka = 7,1 x10-4 [H3O+] = [NO2-] [HNO2] = CHNO2 - [H3O+] Ka = [H3O+]2 0,12 - [H3O+] = 7,1 x 10-4 jika diasumsikan [H3O+] << 0,120, maka 7,1 x 10-4 = Sonny Widiarto, 2009 [H3O+]2 0,12 Kimia Analitik 1 Page 10 [H3O+] = √ 0,12 x 7,1 x 10-4 = 9,2 x 10-3 M untuk menguji asumsi kita, 0,12 – 0,0092 = 0,1108 (penyimpangan sekitar 8%). Dengan menggunakan persamaan kuadrat diperoleh hasil [H3O+] = 8,9 x 10-3. SOAL: hitung konsentrasi ion H3O+ dalam larutan anilin hidroklorida 2,0 x 10-4 M. Dalam larutan C6H5NH3Cl terdisosiasi sempurna menjadi C6H5NH3+ dan Cl-. Asam lemah C6H5NH3+ terdisosiasi mengikut persamaan C6H5NH3++ H2O Ka = C6H5NH2 + H3O+ [C6H5NH2][H3O+] → [C6H5NH3+] Ka C6H5NH3+adalah 2,51 x 10-5 [C6H5NH2]=[H3O+] [C6H5NH3+]=2 x 10-4 - [H3O+] dengan asumsi [H3O+] << 2 x 10-4, maka [C6H5NH3+]=2 x 10-4 Ka = [C6H5NH2][H3O+] [C6H5NH3+] [H3O+] =√ 5,02 x 10-9 2,51 x 10-5= [H3O+]2 2,0 x 10-4 = 7,09 x 10-5 M membandingkan 0,0000709 dengan 0,0002, maka jelas terdapat penyimpangan yang signifikan. Jika dikerjakan dengan menggunakan persamaan kuadrat akan didapat hasil [H3O+]2 2,0 x 10-4 -[H3O+] = 2,51 x 10-5 [H3O+]2 + 2,51 x 10-5 [H3O+] – 5,02 x 10-9 = 0 - 2,51 x 10-5 + √ 2,51 x 10-5 [H3O+] = 2 2 + 4 (5,02 x 10-9) = 5,94 x 10-5 Metode Successive Approximation Anda dapat menyelesaikan soal di atas tanpa menggunakan persamaan kuadrat, yaitu dengan menggunakan metode Successive approximation. Nilai x yang diperoleh dari pendekatan pertama, dimasukkan lagi pada persamaan Ka, contoh pada soal di atas, diperoleh x=7,09 x 10-5 M. Sonny Widiarto, 2009 Kimia Analitik 1 Page 11 [H3O]2=3,2416 x 10-9 [H3O]=5,69 x 10-5 Hasil ini, dimasukkan lagi pada persamaan Ka, [H3O]2=3,590 x 10-9 [H3O]=5,99 x 10-5 Bandingkan hasil ini dengan hasil persamaan kuadrat, 5,94 x 10-5. SOAL: hitung konsentrasi ion OH- dari larutan 0,075 M NH3. Kesetimbangan reaksi adalah NH4+ + OH- NH3 + H2O Kb = [NH4+][OH-] [NH3] Kb = 1,75 x 10-5 persamaan reaksi menunjukkan bahwa: [NH4+] = [OH-], kedua ion tersebut berasal dari larutan 0,075 M NH3, sehingga [NH4+]+[OH-] = CNH3= 0,075 M. [NH3] =0,075 – [OH-] [OH-]2 7,5 x 10-2 - [OH-] = 1,75 x 10-5 dengan asumsi [OH-] << 0,075 , maka [OH-] = √7,5 x 10-2 x 1,75 x 10-5 = 1,15 x 10-3 Sonny Widiarto, 2009 Kimia Analitik 1 Page 12