TINJAUAN PUSTAKA Karbon Karbon merupakan
advertisement

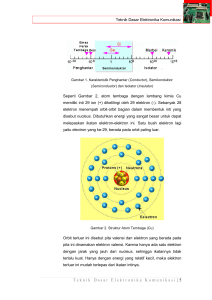
5 TINJAUAN PUSTAKA Karbon Karbon merupakan unsur yang paling serbaguna dalam tabel periodik, berkat jenis, kekuatan, dan jumlah ikatan dapat terbentuk dengan unsur-unsur yang berbeda. Keragaman ikatan dan geometri yang berhubungan memungkinkan adanya struktur isomer, isomer geometrik, dan enansiomer. Sifat-sifat karbon akibat langsung dari susunan elektron di sekitar inti atom. Ada enam elektron valensi dalam sebuah atom karbon, dibagi secara merata antara orbital 1s, 2s, dan 2p. Karena orbital atom 2p dapat menyimpan hingga enam elektron, karbon dapat membuat hingga empat ikatan. Namun, elektron valensi yang terlibat dalam ikatan kimia menempati orbital 2s dan 2p (O’Connell 2006). Ikatan kovalen dibentuk oleh promosi elektron 2s untuk satu atau lebih orbital 2p dimana orbital hibrida yang dihasilkan adalah jumlah dari orbital asli. Tergantung pada seberapa orbital p yang terlibat, hal ini dapat terjadi dalam tiga cara yang berbeda. Pada tipe pertama, persilangan pasangan orbital 2s dengan salah satu orbital 2p yang membentuk dua orbital hibrida sp1 dalam geometri linier dipisahkan oleh sudut 180˚. Jenis kedua melibatkan hibridisasi orbital 2s dengan hibridisasi dua orbital 2p. Sebagai akibatnya, tiga orbital sp2 terbentuk. Ini berada di bidang yang sama dipisahkan dengan sudut 120˚. Dalam hibridisasi ketiga, salah satu orbital 2s disilangkan dengan tiga orbital 2p, menghasilkan empat orbital sp3 dipisahkan dengan sudut 109,5˚. Hibridisasi sp3 menghasilkan pengaturan tetrahedral karakteristik ikatan. Ketiga kasus tersebut, energi yang diperlukan untuk hibridisasi orbital atom diberikan melalui energi bebas membentuk ikatan kimia dengan atom lain (O’Connell 2006). Karbon dalam fasa padat dapat hadir dalam tiga bentuk allotrop: grafit, berlian, dan Buckminsterfullerene (gambar 1). Berlian memiliki struktur kristal di mana setiap atom karbon hibridisasi sp3 terikat pada empat yang lain dalam susunan tetrahedral. 6 Gambar 1 Tiga allotrop karbon. Jaringan kristal memberikan kekerasan berlian (substansi yang paling sulit diketahui) dan sifat konduksi panas yang sangat baik (sekitar lima kali lebih baik dari tembaga). Grafit terbuat dari lembaran planar berlapis karbon terhibridisasi sp2 atom terikat bersama-sama dalam jaringan heksagonal. Geometri yang berbeda dari ikatan kimia membuat grafit lembut, licin, buram, dan konduktif listrik. Berbeda dengan berlian, setiap atom karbon dalam lembaran grafit hanya terikat pada tiga atom lainnya. Buckminsterfullerenes, atau fullerenes adalah allotrop karbon ketiga dan terdiri dari golongan molekul bulat atau silinder dengan semua atom karbon terhibridisasi sp2 (O’Connell 2006). Pati Pati merupakan polisakarida paling melimpah kedua setelah selulosa. Seperti yang dinyatakan oleh namanya, molekul polisakarida terdiri dari banyak satuan monosakarida. Jika satuan monosakarida itu gula pentosa, C5H12O5, maka polisakarida itu dikelompokkan sebagai pentosan, (C5H8O4)x. Jika satuan monosakaridanya adalah suatu gula heksosa, C6H12O6, polisakarida itu dikelompokkan sebagai heksosan, (C6H10O5)x. Polisakarida jenis heksosan, (C6H10O5)x yang paling melimpah adalah heksosan yang satuan heksosannya adalah glukosa. Pati dan selulosa termasuk dalam kelompok ini. Cara satuansatuan glukosa dihubung-hubungkan dalam molekul pati (Gambar 2). 7 Gambar 2 Pati (Keenan 1992) Pati dapat dipisahkan menjadi dua fraksi utama berdasarkan kelarutan bila dibubur (triturasi) dengan air panas: sekitar 20% pati adalah amilosa (larut) dan 80% sisanya ialah amilopektin (tidak larut). Amilosa Hidrolisis lengkap amilosa menghasilkan hanya D-glukosa; hidrolisis parsial menghasilkan maltosa sebagai satu-satunya disakarida. Disimpulkan bahwa amilosa adalah polimer linear dari α-D-glukosa yang dihubungkan secara 1,4’. Beda antara amilosa dan selulosa ialah ikatan glikosidanya: β dalam selulosa dan α dalam amilosa. Perbedaan ini menyebabkan perbedaan sifat antara kedua polisakarida ini. Gambar 3 Amilosa 8 Terdapat 250 satuan glukosa atau lebih per molekul amilosa. Pengukuran panjang rantai dikacaukan oleh fakta bahwa amilosa alamiah terdegradasi menjadi rantai yang lebih kecil selama pemisahan dan pemuaian. Molekul amilosa membentuk spiral di sekitar molekul I2; timbul warna biru tua dari intaraksi antara keduanya. Warna ini merupakan dasar uji iod untuk pati, dimana suatu larutan iod ditambahkan ke suatu contoh yang tidak diketahui untuk menguji hadirnya pati. Amilopektin Suatu polisakarida yang jauh lebih besar dari pada amilosa, mengandung 1000 satuan glukosa atau lebih per molekul. Seperti rantai dalam amilosa, rantai utama dari amilopektin mengandung 1,4’-α-D-glukosa. Tidak seperti amilosa, amilopektin bercabang sehingga terdapat satu glukosa ujung untuk kira-kira tiap 25 satuan glukosa. Ikatan pada titik percabangan ialah ikatan 1,6’-α-glikosida. Gambar 4 Amilopektin Hidrolisis lengkap amilopektin hanya menghasilkan D-glukosa. Namun hidrolisis tak lengkap menghasilkan suatu campuran disakarida maltosa dan isomaltosa, yang kedua ini berasal dari percabangan-1,6’. Campuran oligosakarida yang diperoleh dari hidrolisis parsial amilopektin, yang biasa dirujuk sebagai dekstrin, digunakan untuk membuat lem, pasta dan kanji tekstil. 9 Gambar 5 Isomaltosa; 6-O-(α-D-glukopiranosil)-D-glukopiranosa Glikogen Dari segi struktur, glikogen mirip amilopektin. Glikogen mengandung rantai glukosa yang terikat -1-4’-α dengan percabangan-percabangan (1,6’-α). Beda antara glikogen dan amilopektin ialah bahwa glikogen lebih bercabang daripada amilopektin (Fessenden 1982). Katalis Sebuah katalis mempercepat reaksi kimia dengan membentuk reaksi ikatan dengan molekul, dan dengan membiarkan ini untuk bereaksi terhadap suatu produk yang terlepas dari katalis, dan sedemikian rupa sehingga tersedia untuk reaksi berikutnya. Bahkan dapat digambarkan reaksi katalis sebagai peristiwa siklik dimana katalis berpartisipasi dan kembali dalam bentuk aslinya pada akhir siklus. Berikut reaksi katalis antara dua molekul A dan B untuk menghasilkan produk P (Gambar 6). Siklus ini dimulai dengan ikatan molekul A dan B pada katalis. A dan B kemudian bereaksi di dalam kompleks ini untuk menghasilkan produk P yang juga terikat pada katalis. Pada tahap terakhir, P terpisah dari katalis sehingga meninggalkan siklus reaksi di daerah asalnya. 10 Gambar 6 Setiap reaksi katalis merupakan siklus tahap dasar, di mana mengikat molekul reaktan ke katalis, bereaksi, dan setelah produk terlepas dari katalis keduanya bebas untuk siklus berikutnya. Untuk melihat bagaimana katalis mempercepat reaksi, perlu dilihat diagram energi potensial pada Gambar 7 yang membandingkan reaksi non-katalis dan reaksi katalis. Untuk reaksi non-katalis, jumlah tersebut adalah mekanisme yang umum untuk memvisualisasikan persamaan Arrhenius: hasil reaksi ketika A dan B bertumbukan dengan energi yang cukup untuk mengatasi hambatan aktivasi pada gambar 7. Perubahan energi bebas Gibbs antara reaktan A + B dan produk P adalan ∆G. Reaksi katalis dimulai dengan ikatan reaktan A dan B pada katalis dalam reaksi spontan. Oleh karena itu, pembentukan kompleks ini adalah eksotermik, dan energi bebas diturunkan. Selanjutnya mengikuti reaksi antara A dan B, sementara keduanya terikat pada katalis. Tahap ini terkait dengan energi aktivasi, namun secara signifikan lebih rendah daripada untuk reaksi tanpa katalis. Akhirnya, produk P terpisah dari katalis pada tahap endotermik. Gambar 7 Diagram energi potensial dari reaksi katalis heterogen, dengan gas reaktan dan produk serta katalis padat. Reaksi tanpa katalis harus mengatasi hambatan energi besar, sedangkan hambatan di jalur katalis jauh lebih rendah. 11 Diagram energi Gambar 7 menggambarkan beberapa poin penting: Katalis menawarkan jalan alternatif untuk reaksi yang lebih kompleks, sangat aktif tapi jauh lebih menguntungkan. Energi aktivasi reaksi katalis secara signifikan lebih kecil daripada reaksi tanpa katalis, sehingga laju reaksi katalis lebih jauh. Perubahan energi bebas secara keseluruhan untuk reaksi katalis sama dengan reaksi tanpa katalis. Oleh karena itu, katalis tidak mempengaruhi tetapan kesetimbangan untuk reaksi keseluruhan A + B ke P. Katalis mempercepat reaksi baik maju dan sebaliknya pada tingkat yang sama. Dengan kata lain, jika katalis mempercepat pembentukan produk P dari A dan B, maka hal yang sama terjadi untuk dekomposisi P menjadi A dan B. (Chorkendorff 2003). Beberapa bahan yang digunakan dalam penyusunan katalis industri terbagi dalam tiga unsur utama: agen katalis aktif, pendukung dan promotor. Agen katalis aktif merupakan konstituen yang terutama bertanggung jawab untuk fungsi katalitis termasuk logam, semikonduktor dan isolator. Jenis konduktivitas listrik (terutama untuk kenyamanan) mengklasifikasikan komponen aktif. Baik konduktivitas listrik dan sifat katalis tergantung pada konfigurasi elektronik atom, meskipun tidak saling berhubungan. Pendukung atau pembawa adalah bahan yang sering digunakan sebagai pendukung katalis padat berpori dengan area permukaan keseluruhan (eksternal dan internal) menyediakan luas permukaan yang tinggi untuk komponen aktif. Pendukung juga memberikan bentuk dan kekuatan mekanis untuk katalis dan dalam beberapa kasus hal itu mempengaruhi aktivitas katalis. Promotor merupakan penambahan senyawa untuk meningkatkan fungsi fisika atau kimia katalis. Meskipun promotor ditambahkan dalam jumlah yang relatif kecil seringkali dipilih untuk menentukan sifat katalis. Promotor mungkin dimasukkan ke dalam katalis selama setiap tahapan dalam pengolahan kimia unsur katalis. Dalam beberapa kasus, promotor ditambahkan selama reaksi. Sebagian besar katalis lain, bahan aktif adalah komponen kecil yang diletakkan di atas penyangga berpori yang lebih atau kurang inert. Penyangga 12 secara luas digunakan termasuk alumina, silica gel, karbon aktif, zeolit, silikon karbida, titania, magnesia, dan berbagai silikat. Kebanyakan katalis, dimana logam merupakan komponen aktif yang didukung katalis karena persyaratan utamanya adalah penggunaan area permukaan logam besar. Contoh katalis pendukung adalah karbon aktif didukung Pt dan Pd, dan Ni dalam alumina. Katalis industri diproduksi melalui beberapa metode yang melibatkan satu atau lebih tahapan proses seperti pengendapan, pencucian, proses mengapur, peresapan, pencucian, dan pembentukan fusi termal. Rangka katalis terdiri dari kerangka logam yang tersisa setelah dikurangi komponen campuran logam mulia setelah dihilangkan melalui penyucian dengan basa atau asam. Kerangka logam secara eksklusif masuk ke grup IB dan VIIB dari tabel periodik (Fe, Co, Ni, Cu, dan Ag), sedangkan Al, Zn, Si, dan Mg adalah komponen campuran logam paling sering digunakan. Campuran logam disusun oleh fusi komponen dalam proporsi yang tepat. Raney mempeloporkan pengembangan rangka katalis. Katalis Ni dan Co digunakan secara luas, yang sangat aktif untuk reaksi hidrogenasi. Katalis dibuat dari campuran logam nikelaluminium dengan pencucian hampir semua aluminium dengan larutan asam kuat memisahkan katalis nikel berpori. Pelucutan campuran logam 50-50 dengan 2030% larutan natrium hidroksida memberikan katalis Ni yang sangat aktif yang mengandung 90-97% Ni, 4 - 8% logam Al, 0,3 - 0,5% aluminium oksida, dan 12% hidrogen terlarut dalam kerangka (Wijngaarden 1998). Dalam industri, penekanan utama pada pengembangan sebuah katalis aktif, selektif, stabil dan kuat secara mekanis. Untuk mencapai hal ini, dibutuhkan alat yang mengidentifikasi sifat struktural yang efisien membedakan dari katalis yang kurang efisien. Hubungan empiris antara faktor-faktor yang mengatur komposisi katalis (misalnya ukuran partikel dan bentuk, dan dimensi pori) dan ini menentukan kinerja katalis yang sangat berguna dalam pengembangan katalis, walaupun tidak selalu memberikan wawasan mendasar tentang bagaimana katalis beroperasi pada tingkat molekuler . Beberapa spektroskopi, teknik mikroskopis dan difraksi digunakan untuk menyelidiki katalis. Seperti diilustrasikan Gambar 8, teknik ini didasarkan pada 13 beberapa jenis eksitasi (dalam anak panah pada Gambar 8) dimana respon katalis (dilambangkan dengan panah keluar). Misalnya, penyinaran katalis dengan foton sinar-X menghasilkan foto elektron, pada spektroskopi foto elektron sinar-X (XPS) merupakan salah satu alat karakterisasi yang paling berguna. Gambar 8 Teknik karakterisasi katalis: lingkaran merupakan sampel yang diteliti, tanda panah menunjukkan proses eksitasi, dan panah keluar menunjukkan bagaimana informasi harus diekstrak (Chorkendorff 2003). Hidrotermal Rogers (1966) menyatakan bahwa hidrotermal adalah proses yang melibatkan air panas atau cairan panas lainnya yang mudah menguap karena adanya hubungan dengan sebuah sumber panas. Endapan hidrotermal adalah endapan yang terbentuk karena pengendapan mineral-mineral dari air panas atau cairan-cairan lainnya secara komparatif (Suparman 2010). Penggunaan metode hidrotermal antara lain: Bergius (1913) mentransformasi hidrotermal selulosa menjadi karbon, Berl & Schmidt (1932) menggunakan sumber biomassa dan suhu bervariasi, Schuhmacher (1960) menganalisis pengaruh pH pada hasil HTC; Antonietti, Sun, Yu (2005) eksperimen hidrotermal suhu rendah pada sintesis karbon sferis (Beccile 2008); Hu (2008) tentang proses karbonisasi hidrotermal (HTC) senyawa biomassa dipanaskan dalam autoclave yang disegel di dalam asam sitrat pada suhu 200 ◦C selama 16 jam. 14 Karbonisasi Hidrotermal Bahan Karbon Proses karbonisasi hidrotermal (HTC) untuk sintesis bahan karbon fungsional dari biomassa telah dipelajari secara intensif. Biasanya, biomassa yang digunakan untuk proses ini meliputi bahan tanaman mentah dan karbohidrat. Bahan tanaman mentah secara langsung diperoleh dari residu pertanian dan kayu, sedangkan karbohidrat biasanya termasuk gula, pati, hemiselulosa, dan selulosa. Eksperimen menggunakan produk tertentu yang mengandung selulosa, hemiselulosa, sampai lignin, dan lebih kecil jumlah polimer polar sebagai bahan awal. Setelah senyawa biomassa dipanaskan dalam autoclave yang disegel dalam asam sitrat pada suhu 200 ◦C selama 16 jam, maka diperoleh dua jenis bahan karbon. Jaringan "Soft" tanaman tanpa diperpanjang suatu rangka kristal selulosa menghasilkan karbon nanopartikel berbentuk bola dengan ukuran yang sangat kecil. Di samping itu, menarik untuk dicatat bahwa permukaan nanopartikel karbon sangat hidrofilik dan mudah didispersikan air karena penguraian bagian komponen lain dalam biomassa. Gambar 9 Skema ilustrasi sintesis bahan karbon fungsional dari biomassa dan karbohidrat melalui proses karbonisasi hidrotermal (HTC). Bahan karbon fungsional dapat disintesis secara langsung atau dibantu katalis/template. Jaringan "Hard" tanaman dengan struktur rangka kristal selulosa walaupun dapat mempertahankan bentuk luar dan besarnya skala struktur fitur dalam skala 15 makro dan mikro diakibatkan oleh hilangnya massa yang cukup besar. Munculnya perubahan struktur yang signifikan pada skala nanometer menghasilkan spons, mengakibatkan jaringan karbon berikutnya dengan struktur mesopori. Mekanisme karbonisasi hidrotermal dengan menggunakan bahan biomassa ditunjukkan melalui skema berikut: Gambar 10 Karbonisasi hidrotermal (Beccile 2008). Penting untuk memperoleh pemahaman tentang mekanisme katalisis dalam proses HTC selama pembentukan bahan karbon dan modifikasi permukaan terkait. Yu et al (2004) melaporkan bahwa karbonisasi hidrotermal pati dapat secara efektif dipercepat dengan adanya ion logam yang juga mengarahkan sintesis terhadap nanoarsitektur berbagai logam-karbon. Selain itu, kehadiran [Fe(NH4)2(SO4)2] efektif dapat mengkatalisis karbonisasi butiran beras mentah dalam proses HTC. Konversi hidrotermal (250-350 °C) dari glukosa diselidiki menggunakan reaktor sejumlah kapiler kuarsa. Kinetika penguraian glukosa secara keseluruhan umumnya ditentukan dan disesuaikan dengan data literatur. Perhatian telah ditujukkan untuk memulai penguraian glukosa dimana produk peluruhan glukosa primer diidentifikasi dari literatur dan digunakan dalam eksperimen. Ditemukan bahwa semua komponen peluruhan utama glukosa, dengan pengecualian formaldehida menghasilkan jenis char (produk tidak larut aseton). Karakteristik reaksi pembentukan gas (terutama CO2) dibahas berdasarkan tes terpisah dengan bagian utama dan produk lain yang dikenal dengan degradasi glukosa awal. Massa lengkap dan sisa unsur diperoleh untuk dua suhu yang berbeda, 300 °C dan 350 °C, dan selang waktu bervariasi dari 10 detik hingga 10 hari. Dua tingkat yang berbeda dari pembentukan produk diamati sebagai fungsi dari selang waktu. Laju tercepat dalam 5-10 menit pertama, dan laju lebih lambat 16 setelah waktu ini. Ditemukan bahwa produk air terjadi terutama di selang waktu 5 menit pertama, yang konstan (3 mol/mol glukosa) dan tidak terpengaruh oleh suhu atau konsentrasi glukosa. Hasil produk minyak disebut air-aseton larut (WSS) menunjukkan hasil maksimum dalam selang waktu kurang lebih 5 menit. Setelah 5 menit berkurang dalam rangka gas dan char, yang dinamakan air-aseton tidak larut (WSIS). Namun, kuantitas tertentu dari WSS stabil bahkan setelah selang waktu 10 hari. Komposisi unsur dari WSS dan WSIS ditemukan sangat mirip menunjukkan bahwa keduanya sebenarnya adalah produk yang sama dimana difraksinasi dengan metode pemisahan sesuai dengan kelarutan dalam aseton. Komposisi gas, WSS, dan WSIS digunakan sebagai dasar untuk estimasi dari entalpi reaksi secara keseluruhan, dengan perhitungan ΔHr = 1,5 ± 0,5 MJ/kg. Ditemukan bahwa konsentrasi glukosa yang lebih tinggi menghasilkan lebih banyak WSIS dan WSS kurang, sedangkan hasil gas dan air tidak berubah. Semua temuan itu dimasukkan ke dalam satu jalur reaksi rekayasa dan model kinetik dekomposisi hidrotermal glukosa (Knezevic 2009). Sifat Listrik Arus listrik pada kawat didefinisikan sebagai jumlah total muatan yang melewatinya per satuan waktu pada suatu titik. Dengan demikian, arus rata-rata I didefinisikan sebagai: (1) Dimana ΔQ adalah jumlah muatan yang melewati konduktor pada suatu lokasi selama jangka waktu Δt. Arus listrik diukur dalam coulomb per detik dengan nama khusus ampere yang disingkat amp atau A. Untuk menghasilkan arus listrik pada rangkaian dibutuhkan beda potensial. Melalui eksperimen bahwa arus pada kawat logam sebanding dengan beda potensial V yang diberikan yaitu I ∞ V. Sebagai ilustrasi dibandingkan arus listrik dengan aliran air di sungai atau pipa yang dipengaruhi oleh gravitasi. Jika pipa (atau sungai) hampir rata, kecepatan alir akan kecil. Tetapi jika satu ujung lebih tinggi dari yang lainnya, kecepatan aliran atau arus akan lebih besar. Makin besar perbedaan ketinggian, 17 makin besar arus. Demikian pula beda potensial listrik yang lebih besar, atau tegangan menyebabkan aliran arus listrik menjadi lebih besar. Tepatnya besar aliran arus pada kawat tidak hanya bergantung pada tegangan, tetapi juga pada hambatan yang diberikan kawat terhadap aliran elektron. Dinding-dinding pipa, atau tepian sungai dan batu-batu ditengahnya memberikan hambatan terhadap aliran arus. Dengan cara yang sama, elektron-elektron diperlambat karena adanya interaksi dengan atom-atom kawat. Makin tinggi hambatan ini, makin kecil arus untuk suatu tegangan V sehingga arus berbanding terbalik dengan hambatan yaitu: (2) Dimana R adalah hambatan kawat atau suatu alat lainnya, V adalah beda potensial dan I adalah arus yang mengalir. Hubungan di atas sering dituliskan: (3) Persamaan tersebut dikenal sebagai hukum Ohm. Hukum Ohm menyatakan bahwa arus yang melalui konduktor logam sebanding dengan tegangan yang diberikan, I∞V. Sehingga R konstan, tidak bergantung V untuk konduktor logam. Tetapi hubungan ini tidak berlaku umum untuk bahan dan alat lain seperti dioda, tabung hampa udara, transistor dan sebagainya. Dengan demikian “hukum Ohm” bukan merupakan hukum dasar, tetapi lebih berupa deskripsi mengenai kelas bahan (konduktor logam) tertentu. Bahan atau alat yang tidak mengikuti hukum Ohm dikatakan nonohmik. Hambatan didefinisikan oleh: (4) Dimana R adalah hambatan dengan satuan Ohm dan disingkat Ω (Giancoli 2001). Konduktivitas listrik (σ) bahan superionik adalah kontribusi jumlah muatan ion pada bahan dan ditulis : (5) dimana ni adalah konsentrasi pembawa muatan dengan muatan Zi dan mobilitas µi. Konduktivitas ionik sebagai fungsi suhu dapat didekati dengan model Arrhenius yaitu : (6) 18 dimana σο, k, T, Ea adalah konstanta eksponen, konstanta Boltzman, suhu (Kelvin) dan energi aktivasi. Konduktivitas ionik suatu bahan ditentukan oleh struktur kristalnya, misalnya bahan dengan konduktivitas tinggi mempunyai tipe struktur dengan tumpukan atom tidak padat, sehingga mempunyai jaringan untuk dilewati ion yang bergerak. Persamaan konduktivitas : (7) menghubungkan antara kerapatan arus (J) dan medan listrik (ε) dimana σ adalah konduktivitas, kebalikan dari resistivitas (ρ). Misalnya arus I pada sebuah sampel bahan ionik dengan penampang tetap A (m2) dan panjang L (m) dan diberi tegangan V pada bahan yang diukur. Kerapatan arus (J) adalah I/A (Ampere/m2), dan medan listrik (ε) adalah V/L (V/m) persamaan 7, direduksi menjadi: (8) Tahanan R dari bahan diberikan sebagai R= V/I maka : (9) atau (10) Konduktansi, G = 1/R; resistivitas, ρ = 1/σ, maka persamaan 10 ditulis : (11) satuannya adalah Ω−1m-1 atau Siemen/m (Purwanto 2007). Kapasitor dan Bahan Dielektrik. Kapasitor adalah piranti yang berguna untuk menyimpan muatan dan energi. Kapasitor terdiri dari dua konduktor yang berdekatan tetapi terisolasi satu sama lain dan membawa muatan yang sama besar dan berlawanan. Kapasitor memiliki banyak kegunaan. Pemberi cahaya kilat pada kamera menggunakan suatu kapasitor uantuk menyimpan energi yang diperlukan untuk memberikan cahaya kilat secara tiba-tiba. Kapasitor juga digunakan untuk memperhalus riak yang timbul ketika arus bolak-balik dikonversi menjadi arus searah pada catu 19 daya, sehingga dapat digunakan pada kalkulator atau radio ketika baterai tidak dapat digunakan. Kapasitor yang biasa digunakan adalah kapasitor keping sejajar yang menggunakan dua keping konduktor sejajar. Ketika keping-keping terhubung pada piranti yang bermuatan, contohnya baterai seperti yang ditunjukkan pada Gambar 11. Muatan dipindahkan dari satu konduktor ke konduktor lainnya sampai perbedaan potensial antara konduktor-konduktor, akibat muatan-muatan yang sama dan berlawanan tanda yang dimiliki konduktor-konduktor tersebut, sama dengan beda potensial antara ujung-ujung baterai. Jumlah muatan pada keping bergantung pada perbedaan potensial dan pada geometri dari kapasitor, contohnya pada luas dan jarak antarkeping pada kapasitor keping sejajar. Misalkan Q adalah besar muatan pada tiap keping dan V adalah perbedaan potensial antara keping-keping. Rasio Q/V disebut kapasitansi C: C = Q/V (12) Kapasitansi adalah suatu ukuran dari “kapasitas” penyimpanan muatan untuk suatu perbedaan potensial tertentu. Gambar 11 Suatu kapasitor terdiri dari dua keping konduktor sejajar yang terpisah. Ketika konduktor-konduktor dihubungkan pada ujungujung suatu baterai, baterai memindahkan muatan dari satu konduktor ke konduktor lainnya sampai perbedaan potensial antara ujung-ujung konduktor sama dengan perbedaan potensial antara ujung-ujung baterai. Jumlah muatan yang dipindahkan sebanding dengan perbedaan potensial. Untuk menghitung kapasitansi suatu kapasitor, mula-mula berikan muatan +Q pada suatu konduktor –Q pada konduktor lainnya. Selanjutnya diintegrasikan medan dari satu konduktor ke konduktor lainnya untuk menentukan perbedaan potensial V antar konduktor. Oleh karena perbedaan potensial sebanding dengan muatan Q, kapasitansi C = Q/V tidak bergantung pada Q muatan V. 20 Gambar 12 (a) Garis-garis medan listrik antara keping-keping suatu kapasitor keping sejajar yang terpisah pada jarak yang sama menunjukkan bahwa medan listrik bersifat seragam. (b) garis-garis medan listrik antara keping-keping suatu kapasitor keping sejajar ditunjukkan oleh semburan minyak. Misalkan suatu kapasitor keping sejajar terdiri dari dua keping yang sama luasnya A dan terpisah dengan jarak s. Harga s lebih kecil dibanding panjang dan lebar keping. Diberikan muatan +Q pada satu keping dan –Q pada keping lainnya. Karena keping-keping ini berdekatan, medan listrik pada suatu titik diantara keping (tidak termasuk titik-titik di dekat ujung keping) mendekati besar medan yang diakibatkan oleh dua bidang tak berhingga yang sejajar tetapi muatannya berlawanan. Tiap bidang memberikan medan listrik seragam sebesar σ/2ε0, sehingga total medan diantara keping adalah E = σ/ε0, dimana σ = Q/A adalah muatan persatuan luas pada tiap bidang. Oleh karena medan listrik antara bidangbidang kapasitor bersifat seragam (Gambar 12), perbedaan potensial antara bidang sama dengan medan dikali jarak pemisah s: (13) Dengan demikian kapasitansi dari kapasitor keping sejajar adalah (14) Oleh karena V sebanding dengan Q maka kapasitansi tidak bergantung pada muatan maupun tegangan kapasitor tetapi hanya pada faktor-faktor geometri. Untuk suatu kapasitor sejajar, kapasitansi sebanding dengan luas keping dan 21 berbanding terbalik dengan jarak pemisah. Secara umum, kapasitansi bergantung pada ukuran, bentuk, dan pengaturan geometri dari konduktor-konduktor. Karena kapasitansi dinyatakan dengan Farad dan A/s dalam meter, maka satuan SI untuk permisivitas ruang hampa (ε0) juga dapat ditulis sebagai Farad per meter sesuai dengan persamaan 14: ε0 = 8,85 x 10-12 F/m = 8,85 pF/m (15) (Tipler 2001). Sebagian besar kapasitor memiliki lembar isolator yang disebut dielektrikum yang diletakan diantara pelat-pelatnya. Hal ini dilakukan untuk beberapa tujuan. Pertama, karena tegangan yang lebih tinggi dapat diberikan tanpa adanya muatan yang melewati ruang antar pelat, walaupun tidak secepat udara, dielektrikum terputus (muatan tiba-tiba mulai mengalir melaluinya ketika tegangan cukup tinggi). Disamping itu dielektrikum memungkinkan pelat diletakan lebih dekat satu sama lain tanpa bersentuhan, sehingga memungkinkan naiknya kapasitansi karena jarak d lebih kecil. Secara eksperimental ditemukan bahwa jika dielektrikum memenuhi ruang antara kedua konduktor tersebut, kapasitor akan naik sebesar faktor K yang dikenal sebagai konstanta dielektrikum (Giancoli 2001). Berbeda dari konduktor, material dielektrik tidak memiliki elektron bebas yang dapat bergerak dengan mudah didalam material; elektron dalam dielektrik merupakan elektron terikat. Dibawah pengaruh medan listrik, pada suhu kamar, pergerakan elektron hampir tidak terdeteksi. Namun pada temperatur tinggi aliran arus bisa terdeteksi jika diberikan medan listrik pada dielektrik. Arus ini bukan saja ditimbulkan oleh elektron yang bergerak tetapi juga oleh pergerakan ion dan pergerakan molekul polar yaitu molekul yang membentuk dipole. Dalam kaitan ini, suatu teknik yang disebut thermostimulated current merupakan salah satu teknik untuk mempelajari perilaku dielektrik. Peristiwa pergerakan elektron, ion, dan molekul-molekul polar di dalam dielektrik yang diakibatkan oleh adanya medan listrik disebut peristiwa polarisasi. Peristiwa polarisasi menyebabkan dielektrik terpolarisasi yaitu suatu keadaan di mana dua sisi yang berlawanan dari selembar dielektrik mengandung muatan yang berlawanan. Keadaan dielektrik seperti ini disebut elektret (Sudirham 2010). 22 Permitivitas relatif suatu dielektrik disebut juga konstanta dielektrik (εr) yang didefinisikan sebagai perbandingan antara permitivitas dielektrik (ε) dengan permitivitas ruang hampa (ε0). (16) Jika suatu dielektrik dengan permitivitas relatif εr disisipkan di antara elektroda kapasitor pelat paralel yang memiliki luas A dan berjarak d, maka kapasitansi pelat paralel yang semula (sebelum disisipi dielektrik) adalah: (17) Berubah menjadi (18) atau (19) Jadi penyisipan dielektrik pada kapasitor pelat paralel akan meningkatkan kapasitansi sebesar εr kali (Sudirham 2010). Struktur Kristal Kristal merupakan susunan atom-atom yang teratur dalam ruang tiga dimensi. Keteraturan susunan tersebut terjadi karena harus terpenuhinya kondisi geometris, ketentuan ikatan atom, serta susunan yang rapat. Walaupun tidak mudah untuk menyatakan bagaimana atom tersusun dalam padatan, namun ada hal-hal yang bisa menjadi faktor penting yang menentukan terbentuknya polihedra koordinasi susunan atom-atom. Secara ideal, susunan polihedra koordinasi paling stabil adalah yang memungkinkan terjadinya energi per satuan volume yang minimum. Keadaan tersebut dicapai jika: kenetralan listrik terpenuhi, ikatan kovalen yang diskrit dan terarah terpenuhi, gaya tolak ion-ion menjadi minimal, serta susunan atom serapat mungkin (Sudirham 2010). Produk Elektroda Tidak selalu mudah atau bahkan tidak mungkin untuk meramalkan produk-produk apa yang akan dihasilkan bila suatu arus listrik dilewatkan suatu larutan elektrolit. Di samping ion-ion yang berasal dari elektrolit itu, terdapat juga 23 molekul air dan ion-ion air (H+ dan OH-) yang mempunyai peranan dalam reaksi elektrokimia. Pada katode inert terjadi proses sebagai berikut: 1. Jika ion logam lebih muda direduksi daripada ion hidrogen, elektrolisis larutan air (dari) garam-garamnya akan mengakibatkan terbentuknya logam pada katode. Misalnya, jika suatu larutan air (dari) CuCl2, AgNO3, atau HgCl2 dielektrolisis akan terbentuk masing-masing Cu, Ag atau Hg. 2. Jika ion logam lebih sukar direduksi daripada ion hidrogen, elektrolisis larutan air (dari) garam-garamnya biasanya membebaskan gas hidrogen pada katode. Misalnya, jika NaCl, KCl atau MgCl2 dalam air dielektrolisis, hidrogen akan dibebaskan pada katode pada tiap kasus. Pada Anode inert terjadi proses sebagai berikut: 1. Oksigen dibebaskan selama elektrolisis dari garam anion-oksi yang mengandung suatu unsur dengan keadaan oksidasi tinggi, misalnya, SO42- dan NO3-. Artinya, H2O lebih muda dioksidasi daripada anion semacam itu. Misalnya: 4AgNO3 + 2H2O H2O 4Ag + O2 + 4HNO3 O2 + 4H+ + 4e- (anode) 2. Anion seperti Cl-, Br- dan I- (tetapi tidak F-) lebih mudah dioksidasi daripada air. Jadi akan dibebaskan halogen bebas. Misalnya, selama elektrolisis natrium klorida pekat. Dalam hal larutan encer, baik oksigen maupun klor akan terbentuk. Oleh karena potensial penguraian relatif untuk Cl- dan H2O berubah karena berkurangnya konsentrasi ion klorida. (Keenan 1992). Karakterisasi Material Nanostruktur Scanning Elektron Microscopy (SEM) SEM adalah salah satu jenis mikroskop elektron yang menggunakan berkas elektron untuk menggambarkan profil permukaan benda. Prinsip kerja SEM adalah menembakkan permukaan benda dengan berkas elektron berenergi tinggi seperti diilustrasikan Gambar 13 permukaan benda yang dikenai berkas 24 akan memantulkan kembali berkas tersebut atau menghasilkan elektron sekunder ke segala arah. Tetapi ada satu arah dimana berkas dipantulkan dengan intensitas tertinggi. Detektor di dalam SEM mendeteksi elektron yang dipantulkan dan menentukan lokasi berkas yang dipantulkan dengan intensitas tertingggi. Arah tersebut memberi informasi profil permukaan benda seperti seberapa landai dan kemana arah kemiringan. Pada saat dilakukan pengamatan, lokasi permukaan benda yang ditembak dengan berkas elektron di scan ke seluruh area pengamatan. Lokasi pengamatan dapat dibatasi dengan melakukan zoom-in atau zoom-out. Berdasarkan arah pantulan berkas pada berbagai titik pengamatan maka profil permukaan benda dapat dibangun mengggunakan program pengolahan gambar yang ada dalam komputer. Gambar 13 Dalam SEM berkas elektron berenergi tinggi mengenai permukaan material. Elektron pantulan dan elektron sekunder dipancarkaan kembali dengan sudut yang bergantung pada profil permukaan material. SEM memiliki resolusi yang lebih tinggi daripada mikroskop optik. Hal ini disebabkan panjang gelombang de Broglie yang dimiliki elektron lebih pendek daripada gelombang optik. Makin kecil panjang gelombang yang digunakan makin tinggi resolusi mikroskop. Panjang gelombang de Broglie elektron adalah: λ = h/p (20) dengan h adalah konstanta Planck dan p adalah momentum elektron. Momentum elektron dapat ditentukan dari energi kinetik melalui hubungan: K = p2/2m (21) 25 dengan K energi kinetik elektron dan m adalah massanya. Dalam SEM, berkas elektron keluar dari filamen panas lalu dipercepat pada potensial tinggi V. Akibat percepatan tersebut, akhirnya elektron memiliki energi kinetik K = eV (22) Dengan menggunakan persamaan (21) dan (22) kita dapat menulis momentum elektron sebagai (23) dengan demikian panjang gelombang de Broglie yang dimiliki elektron adalah (24) Umumnya tegangan yang digunakan pada SEM adalah puluhan kilo Volt. Sebagai ilustrasi, misalnya SEM dioperasikan pada tegangan 20 kV maka panjang gelombang de Broglie elektron sekitar 9x10-12 m. Syarat agar SEM dapat menghasilkan citra permukaan yang tajam adalah permukaan benda harus bersifat sebagai pemantul elektron atau dapat melepaskan elektron sekunder ketika ditembak dengan berkas elektron. Material yang memiliki sifat demikian adalah logam. Jika permukaan logam diamati di bawah SEM maka profil permukaan akan tampak dengan jelas. Agar profil permukaaan bukan logam dapat diamati secara jelas dengan SEM maka permukaan material tersebut harus dilapisi dengan logam seperti emas. Film tipis logam dibuat pada permukaan material tersebut sehingga dapat memantulkan berkas elektron. Metode pelapisan yang umumnya dilakukan adalah evaporasi dan sputtering. Pada metode evaporasi, material yang akan diamati permukaannya ditempatkan dalam satu ruang (Chamber) bersama dengan material logam yang akan digunakan sebagai sumber pelapis. Ruang tersebut dapat divakumkan dan logam pelapis dapat dipanaskan hingga mendekati titik leleh. Logam pelapis diletakan di atas filamen pemanas. Mula-mula chamber divakumkan diikuti dengan pemanasan logam pelapis. Atom-atom menguap pada permukaan logam. Ketika sampai pada permukaan material yang memiliki suhu lebih rendah, atomatom logam terkondensasi dan membentuk lapisan film tipis di permukaan material. Ketebalan lapisan dapat dikontrol dengan mengatur lama waktu 26 evaporasi. Agar proses ini dapat berlangsung efisien maka logam pelapis yang digunakan harus yang memiliki titik lebur rendah. Prinsip kerja sputtering mirip dengan evaporasi. Namun sputtering dapat berlangsung pada suhu rendah (suhu kamar). Permukaan logam ditembak dengan ion gas berenergi tinggi hingga terpental keluar dari permukaan sampel, atomatom logam tersebut membentuk fase padat dalam bentuk film tipis. Ketebalan lapisan dikontrol dengan mengatur lama waktu sputtering. Pada saat pengukuran dengan SEM, lokasi di permukaan sampel tidak boleh terlalu lama dikenai berkas. Elektron yang berenergi tinggi pada berkas dapat mencabut atom-atom di permukaan sampel hingga permukaan tersebut akan rusak dengan cepat. Film tipis di permukaan sampel akan menguap dan kembali menjadi isolator. Akhirnya bayangan yang terekam tiba-tiba menjadi hitam (Abdullah 2009). Difraksi Sinar-X (XRD). Pada kristal sederhana seperti NaCl, atom tersusun dengan pola kubus yang teratur dan atom-atom berjarak d satu sama lain (Gambar 14). Gambar 14 Difraksi sinar-X oleh kristal. Seberkas sinar-X jatuh pada kristal dengan sudut φ terhadap permukaan, dan kedua berkas yang ditunjukkan dipantulkan dari dua bidang atom setelahnya seperti digambarkan. Kedua berkas akan berinterferensi konstruktif jika jarak ekstra yang ditempuh berkas I lebih jauh sebesar kelipatan bilangan bulat dari panjang gelombang dibandingkan dengan yang ditempuh berkas II. Jarak ekstra ini adalah 2d sin φ. Dengan demikian, interferensi konstruktif akan terjadi ketika 27 mλ = 2d sin φ, m = 1,2,3,....., (25) dimana m bisa merupakan bilangan bulat berapa saja dan φ bukan sudut terhadap normal permukaan. Persamaan di atas dikenal dengan persamaan Bragg. Dengan demikian, jika panjang gelombang sinar-X diketahui dan sudut φ dimana interferensi konstruktif terjadi diukur, d bisa didapatkan. Pola difraksi sinar-X yang sebenarnya sangat rumit. Pertama, kristal merupakan benda tiga dimensi dan sinar-X dapat didifraksikan dari bidang-bidang yang berbeda dengan sudut berbeda di dalam kristal. Walaupun analisisnya kompleks, banyak yang dapat dipelajari mengenai zat apa saja yang bisa dibuat dalam bentuk kristal. Jika zat tersebut bukan merupakan kristal tunggal tetapi campuran dari banyak kristal yang kecil seperti pada logam atau serbuk maka yang didapatkan bukan serangkaian bercak (Gambar 15) melainkan serangkaian lingkaran (Gambar 16). Setiap lingkaran berhubungan dengan orde m tertentu (persamaan 25) dari satu pasangan bidang paralel tertentu. Gambar 15 Pola difraksi sinar-X pada kristal seng sulfida. Pola difraksi dideteksi langsung pada pelat potografis. Gambar 16 Difraksi sinar-X dari zat polikristalin menghasilkan serangkaian lingkaran yang merupakan pola untuk polikristalin natrium asetat. (Giancoli 2001). 28 Ukuran kristalin ditentukan berdasarkan pelebaran puncak difraksi sinar-X yang muncul. Metode ini sebenarnya memprediksi ukuran kristal dalam material, bukan ukuran partikel. Jika satu partikel mengandung sejumlah kristal kecil (kristalin), seperti diilustrasikan pada Gambar 17(a), maka informasi yang diberikan metode Schrerrer adalah ukuran kristalin tersebut, bukan ukuran partikel. Untuk partikel berukuran nanometer, biasanya satu partikel hanya mengandung satu kristalin, seperti yang diilustrasikan pada Gambar 17(b). Dengan demikian, ukuran kristalin yang diprediksi dengan metode Schreer juga merupakan ukuran partikel. Gambar 17 (a) Satu partikel mengandung sejumlah kristalin dan (b) satu partikel hanya mengandung satu kristalin (kristal tunggal). Kristal yang berukuran besar dengan satu orientasi menghasilkan puncak difraksi yang mendekati sebuah garis vertikal. Kristalin yang sangat kecil menghasilkan puncak difraksi yang sangat lebar. Lebar puncak difraksi tersebut memberikan informasi tentang ukuran kristalin. Kristalin yang kecil menghasilkan puncak yang lebar karena kristalin yang kecil memiliki bidang pantul sinar-X yang terbatas. Puncak difraksi dihasilkan oleh interferensi secara konstruktif gelombang yang dipantulkan oleh bidangbidang kristal. Di dalam interferensi gelombang didapatkan bahwa makin banyak jumlah celah interferensi makin sempit ukuran garis frinji pada layar. Interferensi celah banyak dengan jumlah celah tak berhingga menghasilkan frinji yang sangat tipis, tetapi sangat terang. Jumlah celah yang sangat banyak identik dengan kristalin yang berukuran besar. Difraksi sinar-X pada dasarnya adalah interferensi oleh sejumlah sumber sehingga kita dapat memprediksi hubungan antara lebar puncak difraksi dengan ukuran kristallitas berdasarkan perumusan interferensi celah banyak. 29 Gambar 18 Makin lebar puncak difraksi sinar-X makin kecil ukuran kristalin. Ukuran kristalin yang menghasilkan pola difraksi pada gambar bawah lebih kecil daripada ukuran kristalin yang menghasilkan pola difraksi atas. Hubungan antara ukuran kristalin dengan lebar puncak difraksi sinar-X dapat diproksimasi dengan persamaan Schreer: (26) dengan D adalah ukuran (diameter) kristalin, λ adalah panjang gelombang sinar-X yang digunakan, θB adalah sudut Bragg, B adalah FWHM satu puncak yang dipilih, dan K adalah konstanta material yang nilainya kurang dari satu. Nilai yang umumnya dipakai untuk K adalah 0,9 (Abdullah 2009).