2 Tinjauan Pustaka
advertisement

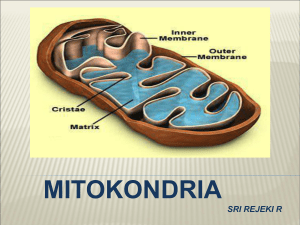
2 2.1 Tinjauan Pustaka Mitokondria Berdasarkan hipotesis endosimbiosis mitokondria berasal dari sel eukariot yang bersimbiosis dengan prokariot (bakteri) sehingga membentuk organel sel (Marguillis, 1981). Adanya DNA pada mitokondria menunjukkan bahwa dahulu mitokondria merupakan entitas yang terpisah dari sel inangnya dan hipotesis ini ditunjang oleh beberapa kemiripan mitokondria dengan bakteri. Mitokondria ini menyerupai bakteri mulai dari bereproduksi dengan cara membelah diri menjadi dua; memiliki sistem genetik sendiri; dan memiliki ribosom. Ribosom mitokondria lebih mirip dengan bakteri dibandingkan dengan ribosom yang dikode oleh inti sel eukariot (Cooper, 2000). Gambar 2. 1 Struktur mitokondria Mitokondria berbentuk elips dengan diameter ~5 μm dan panjang 0,5 – 1,0 μm. Strukturnya terdiri dari membran luar, membran dalam, krista, ruang antar membran, dan matriks yang mengandung antara lain materi genetik, mtDNA, dan ribosom (Margullis, 1981). Gambar 2.1 adalah struktur mitokondria yang merupakan organel sel penting dalam sel eukariot, berbentuk elips, dan memiliki empat bagian penting yaitu: (1) membran luar, (2) ruang antar-membran, (3) membran dalam, dan (4) matriks. Membran luar yang bersifat permeabel; ruang antar-membran tempat dihasilkannya nukleotida kinase; membran dalam yang berlekuk-lekuk, terjadi respirasi sel dan sintesis fosfolipid; serta di dalam matriks yang terjadi oksidasi piruvat dan siklus asam sitrat (siklus Krebs). Mitokondria pada eukariot berjumlah sangat banyak dan esensial karena tanpa mitokondria maka sel-sel akan mengandalkan proses anaerob untuk menghasilkan ATP. 2.2 Fungsi Mitokondria Peranan utama mitokondria adalah sebagai organel yang menghasilkan energi bagi sel berupa ATP. Energi yang dihasilkan merupakan hasil konversi gula melalui proses fosforilasi oksidatif dan menghasilkan sekitar 90% energi tubuh kita sehingga seringkali disebut “the power house”. Berdasarkan penjelasan di atas menunjukkan bahwa keberadaan mitokondria sangat diperlukan bagi tubuh. Gambar 2. 2 Tiga tahap respirasi sel dalam mitokondria Tahap pertama adalah pembentukan fragmen berkarbon dua teraktivasi (gugus asetil dari asetil CoA) dari piruvat (sitoplasma), asam lemak (mitokondria), atau asam amino (sitoplasma/mitokondria). Tahap kedua adalah oksidasi fragmen karbon dari gugus asetil dalam siklus asam sitrat (mitokondria). Tahap ketiga adalah produksi ATP melalui sistem transpor elektron dan fosforilasi oksidatif. Pada tahap glikolisis, dihasilkan dua molekul ATP dan molekul piruvat yang kemudian masuk ke dalam siklus asam sitrat untuk dioksidasi menjadi CO2 dan air. Pada siklus asam sitrat ini dihasilkan sekitar tiga puluh molekul ATP untuk setiap molekul glukosa yang masuk ke dalam glikolisis. Proses pembentukan energi ini dikenal sebagai fosforilasi oksidatif (OXPHOS) yang terdiri atas lima tahapan reaksi enzimatis dan melibatkan kompleks enzim pada membran dalam mitokondria. Pada fosforilasi oksidatif, molekul berenergi tinggi NADH dan FADH2 yang dihasilkan dari katabolisme karbohidrat, lipid, dan protein, akan dijadikan substrat untuk diubah menjadi ATP. Pada Gambar 2.2 diilustrasikan secara umum tiga tahap respirasi yang terjadi dalam mitokondria. 16 Kompleks enzim yang terlibat dalam proses transpor elektron terdiri dari kompleks I (NADH dehidrogenase), kompleks II (suksinat dehidrogenase), kompleks III (koenzim Q-sitokrom C reduktase), dan kompleks IB (sitokrom oksidase). Kompleks I menerima elektron dari NADH dan mengalirkannya menuju koenzim-Q, bersamaan dengan pemompaan proton dari matriks menuju ruang antar-membran. Selain itu, koenzim-Q juga akan menerima elektron dari FADH2 (kompleks II) yang dihasilkan siklus Krebs dan elektron dari kompleks III. Elektron dari koenzim-Q ini kemudian dialirkan menuju sitokrom C dan proses ini menyebabkan empat proton terpompa dari matriks menuju ruang antar-membran. Proses saat elektron ini dialirkan dari sitokrom C menuju O2 dan O2 direduksi menjadi H2O, dilakukan oleh kompleks IV yang menghasilkan dua proton untuk dipompa dari matriks menuju ruang antar-membran. Proses pemompaan proton dari matriks menuju ruang antar-membran mitokondria (reaksi transpor elektron) di atas menyebabkan terbentuknya gradien elektrokimia, yaitu pH di ruang antar-membran yang lebih rendah dibandingkan pH dalam matriks mitokondria. Perbedaan proton ini mengandung energi potensial sehingga bila proton mengalir kembali melalui kompleks V (ATP sintase), maka energi dilepas dan menggerakkan sintesis ATP dari ADP dan fosfat inorganik (Browning, et al., 1982). Teori pembentukan ATP akibat adanya gradien elektrokimia ini dikenal sebagai chemiosmotic coupling yang diilustrasikan pada Gambar 2.3. Gambar 2. 3 Proses pembentukan ATP menurut teori chemiosmotic coupling pada matriks mitokondria Proses transpor elektron menyebabkan terjadinya gradien pH dimana pH pada ruang antar membran lebih rendah dibandingkan dengan pH di dalam matriks mitokondria. Gradien pH ini mengandung energi potensial. Bila proton mengalir kembali, maka energi dilepaskan dan menggerakkan sintesis ATP oleh ATP sintase (kompleks V) (Browning, et al., 1982). 17 2.3 DNA Mitokondria Mitokondria memiliki materi genetik sendiri yaitu DNA mitokondria, berbentuk sirkuler tertutup yang terdiri atas untai H (Heavy) yang memiliki basa G lebih banyak dan untai L (Light) yang memiliki basa C lebih banyak (Wallace, 1997). DNA mitokondria manusia (Gambar 2.4) tidak memiliki intron dan semua gen pengode terletak berdampingan (Anderson et al., 1981, Wallace et al., 1992, Zeviani et. al., 1998). Urutan lengkapnya pertama kali ditentukan pada tahun 1981 oleh Anderson et al. dan dikenal dengan sebutan Cambridge Reference Sequence (CRS). DNA mitokondria pada CRS mengandung 16.569 pasang basa dengan 37 gen pengode 13 protein, 22tRNA, dan dua rRNA. Sedangkan gen sisanya menyediakan perintah dalam pembuatan tRNA dan rRNA. Tiga belas polipeptida ini merupakan subunit kompleks enzim yang terlibat dalam fosforilasi oksidatif, yaitu : subunit 1, 2, 3, 4, 4L, 5, dan 6 dari kompleks I (NADH dehidrogenase); subunit b (sitokrom b) dari kompleks III (koenzim Q - sitokrom C reduktase); subunit I, II, dan III dari kompleks IV (sitokrom oksidase); serta subunit 6 dan 8 dari kompleks V (ATP sintase). D-Loop Gambar 2. 4 Struktur DNA mitokondria mtDNA berbentuk sirkular, beruntai ganda (untai H untuk Heavy dan untai L untuk Light), berukuran 16569 pb yang terdiri dari daerah pengode (coding region) yang mengode 2 rRNA, 22 tRNA, 13 polipeptida dan daerah yang tidak mengode (non coding region) atau daerah pengontrol yang mengandung D-loop. D-loop ini terdiri atas dua daerah dengan variasi tinggi, yaitu hypervariable segment I (HVSI) dan hypervariable segment II (HVSII). (Anderson et al.., 1981, Wallace et al.., 1992, Zeviani et al.., 1998). 18 Secara umum, mtDNA terdiri atas daerah pengode dan daerah non-pengode. Selain daerah pengode yang telah dijelaskan sebelumnya, DNA mitokondria juga memiliki daerah yang tidak mengode (non-coding region) sepanjang 1122 pb. Daerah non-pengode ini mengandung daerah yang memiliki variasi tinggi pada tiap individu yang disebut dengan displacement loop (D-loop) sehingga seringkali digunakan untuk keperluan studi filogenetik. D-loop merupakan daerah beruntai tiga (triple stranded), dan untai ketiga ini lebih dikenal dengan nama 7S DNA. Terlihat pada Gambar 2.4 bahwa D-loop ini memiliki dua daerah yang sangat bervariasi, yaitu Hypervariable Region I (HVSI) pada posisi 16024-16365 dan Hypervariable Region II (HVSII) pada posisi 57-732. Selain D-loop juga terdapat daerah pengontrol atau non-coding region yang mengandung origin of replication (ORI) untuk untai (OH) dan promotor untuk untai H dan L (PL dan PH). Selain mengandung daerah dengan variasi tinggi, daerah non coding juga memiliki tiga daerah yang lestari, yang disebut dengan Conserved Sequence Block (CSB) I, II, dan III. Daerah yang lestari ini diduga memegang peranan penting dalam replikasi mtDNA. Jika dilihat dari sifatnya, DNA mitokondria memiliki sifat yang berbeda dengan DNA inti karena tidak adanya mekanisme perbaikan (repairing system) dan kandungan radikal bebas yang tinggi pada mitokondria sehingga laju mutasi pada mtDNA ini lebih tinggi dibanding DNA inti. Secara umum, tiga hal mendasar yang membedakan genom mitokondria dengan genom inti yaitu (1) Tingkat polimorfisme mtDNA lebih tinggi, ditunjukkan dengan laju mutasi yang lebih tinggi bila dibandingkan laju mutasi DNA inti; (2) Pewarisan mtDNA spesifik, yaitu hanya diturunkan melalui garis keturunan ibu tanpa disertai dengan adanya rekombinasi mtDNA ayah; (3) Memiliki sistem kode genetik yang berbeda dengan sistem kode genetik DNA inti (Anderson, et al. 1981). 2.4 2.4.1 Sifat DNA Mitokondria Pola pewarisan secara maternal Berbeda halnya dengan DNA inti, DNA mitokondria diwariskan melalui garis keturunan ibu (Browning, et al., 1982). Hal ini terjadi karena hampir tidak adanya rekombinasi DNA mitokondria dari ayah dan DNA mitokondria dari ibu saat pembuahan sel telur oleh sperma. Saat terjadi pembuahan, bagian ekor sperma dilepaskan sehingga hampir tidak ada DNA mitokondria dari ayah yang masuk ke dalam sel telur. Selain itu, jumlah kopi mtDNA pada sel sperma sangat rendah (100-500) sedangkan sel telur memiliki jumlah kopi mtDNA yang tinggi ( ≥ 100000) (Chen et al.., 1995). Oleh karena itu, mtDNA bersifat haploid yaitu karena diturunkan dari ibu ke seluruh keturunannya (Gambar 2.5) (Cann et al., 1987, Wallace, 1997). 19 Gambar 2. 5 Skema pewarisan DNA mitokondria Pola pewarisan DNA mitokondria ditunjukkan dengan warna merah yang diwariskan melalui garis keturunan ibu 2.4.2 Laju Mutasi mtDNA Sifat lainnya DNA mitokondria adalah laju mutasinya yang tinggi sekitar 10-17 kali DNA inti (Wallace, et al., 1997). Hal ini disebabkan karena mtDNA yang tidak memiliki mekanisme reparasi DNA yang efisien (Bogenhagen, 1999); terletak berdekatan dengan membran dalam mitokondria tempat berlangsungnya reaksi fosforilasi oksidatif yang menghasilkan radikal oksigen; dan tidak memiliki protein pelindung seperti histon. Akibat tidak adanya aktivitas ini menyebabkan pada mtDNA ini tidak memiliki sistem perbaikan yang dapat menghilangkan kesalahan replikasi sehingga mutasi pada mtDNA akan mudah terjadi. Perbedaan sifat DNA mitokondria dengan DNA inti ditunjukkan pada Tabel 2.1. Tabel 2. 1 Perbedaan karakteristik DNA inti dan DNA mitokondria manusia (Sudoyo, 2003) Karakteristik DNA Inti DNA Mitokondria Ukuran 3 x 109 pb 16.569 pb Kopi/sel 1 Bisa > 1000 Struktur Linear Sirkular Pewarisan Paternal & Maternal Maternal Rekombinasi Ya Tidak Laju Mutasi Rendah Tinggi Mutasi yang dapat terjadi pada DNA mitokondria sama halnya dengan jenis mutasi yang juga terjadi pada DNA inti, yaitu substitusi, delesi, dan insersi. Substitusi terbagi menjadi dua jenis, yaitu (1) substitusi transisi, yaitu perubahan nukleotida menjadi nukleotida lain yang jenis 20 basanya sama, dari purin menjadi purin atau dari pirimidin menjadi pirimidin, misalnya substitusi A G , C → T, dan sebaliknya, serta (2) substitusi transverse, yaitu perubahan nukleotida menjadi nukleotida lain yang jenis basanya berbeda, dari purin menjadi pirimidin atau sebaliknya, misalnya dari A → C dan C → G. Substitusi terjadi ketika ada perubahan basa pada nukleotida. Insersi terjadi akibat adanya penyisipan nukleotida, sedangkan delesi terjadi akibat adanya pengurangan nukleotida. DNA polimerase γ untuk replikasi DNA mitokondria merupakan DNA polimerase yang tidak mempunyai aktivitas proofreading (eksonuklease) sehingga mtDNA ini tidak memiliki sistem perbaikan untuk menghilangkan kesalahan replikasi dan mudah terjadi mutasi. Mutasi yang terjadi akan diturunkan dari satu generasi ke generasi selanjutnya sehingga semakin jauh hubungan kekerabatan antara dua individu, maka semakin jauh pula jumlah perbedaan mutasi. Variasi basa atau polimorfisme yang disebabkan mutasi disebut dengan Single Nucleotide Polymorphism (SNP) yang dapat terjadi pada daerah pengode (coding region) maupun daerah bukan pengode (noncoding region). 2.5 Mitochondrial Disease Mitochondrial disease merupakan penyakit-penyakit yang berkaitan dengan mitokondria, biasanya muncul sebagai akibat dari terjadinya disfungsi mitokondria dalam proses pengubahan energi (ATP) pada tahap respirasi. Tahap respirasi di mitokondria merupakan metabolisme aerob yang penting karena jaringan dan organ tubuh kita bergantung pada energi yang dihasilkan dari metabolisme aerob ini. Mitochondrial disease ini juga memiliki ciri khas yang unik karena sifat penyakitnya yang seringkali diturunkan dan dihubungkan dengan mitokondria karena mitokondria sebagai organel sel yang penting bagi sel tubuh. Oleh karena itu, jaringan dan organ tubuh yang terlibat dengan mitochondrial disease ini biasanya merupakan jaringan yang membutuhkan energi banyak dan bergantung pada metabolisme aerob tersebut (Wallace, 1997). Lebih dari 70 polipeptida berbeda yang berinteraksi dengan membran dalam mitokondria untuk membentuk suatu sistem rantai respirasi. Sebagian besar subunit enzim ini disintesis oleh DNA inti di sitosol, tetapi 13 subunit esensial justru dikode oleh DNA mitokondria. Pada struktur DNA mitokondria (Gambar 2.4), daerah ND1-ND6 dan ND4L mengode tujuh subunit dari kompleks I. Cyt b merupakan satu-satunya mtDNA yang mengode subunit kompleks III. COX I hingga III mengode subunit kompleks IV (sitokrom c oksidase atau COX), dan gen ATPase 6 serta ATPase 8 mengode dua subunit dari kompleks V. Dua gen RNA ribosom (12S dan 16S rRNA) dan 22 gen RNA transpor berada di antara gen pengode protein. Gen tRNA dan rRNA ini menyediakan komponen RNA yang penting bagi sintesis protein di dalam 21 mitokondria. OH dan OL merupakan origin of replication dari untai H (heavy) dan untai L (Light). Masing-masing sel manusia saat lahir mengandung ribuan kopian mtDNA yang biasanya identik (homoplasmi). Manusia dengan penyakit “mitochondrial disease” yang merupakan hasil mutasi DNA mitokondria biasanya adalah campuran dari mutan dan wild-type DNA mitokondria pada sel-selnya (heteroplasmi). Suatu studi mengatakan bahwa proporsi mutan DNA harus melebihi tingkat kritis tertentu sebelum sel akhirnya mengekspresikan keabnormalan biokimia dari rantai respirasi pada mitokondria. Mutasi mutan DNA mitokondria bisa bervariasi antar individu dalam satu keluarga bahkan juga bisa bervariasi antar jaringan dan organ dalam satu individu. Contohnya adalah pada individu yang memiliki mutasi 8993T>G lebih tinggi akan memperlihatkan penyakit Leigh syndrome dibandingkan memperlihatkan penyakit neurogenic weakness with ataxia and retinitis pigmentosa (NARP). Secara umum beberapa penyakit yang disebabkan kecacatan mitokondria (mitochondrial disease) ini dapat dilihat pada Tabel 2.2 yang diklasifikasikan berdasarkan genetik. Tabel 2. 2 Klasifikasi genetik dari Mitochondrial Disorder yang disebabkan adanya kecacatan DNA mitokondria Penyakit Gen LHON (Leber's hereditary optic neuropathy) Pengode protein NARP atau Leigh syndrome (Neuropathy, ataxia, retinitis pigmentosa, and ptosis) Exercise intolerance and myoglubinuria MELAS (Mitochondrial encephalomyopathy with lactic acidosis and stroke-like episode) MERRF (Myoclonus epilepsy with ragged-red fibers) CPEO (chronic progressive external ophthalmoplegia) tRNA Myopathy tRNA Encephalomyopathy tRNA Cardiomyopathy tRNA MIDD (Maternally Inherited Diabetes and Deafness) tRNA Mutasi G11778A, T14484C, G3460A Pengode protein T8993G/C Pengode protein Mutasi Cyt b A3243G, T3271C, A3251G A8344G, T8356C A3243G, T4274C T14709C, A12320G G1606A, T10010C A3243G, A4269G A3243G, C12258A tRNA tRNA 22 2.5.1 MIDD (Maternally Inherited Diabetes and Deafness) Maternally Inherited Diabetes and Deafness (MIDD) ini merupakan klasifikasi penyakit dengan kombinasi gejala diabetes dan tuli (deafness) dan diwariskan berdasarkan garis keturunan ibu. Telah banyak publikasi menyatakan bahwa penyakit ini terjadi karena adanya ”single defect” pada pengode genetik di DNA mitokondria. Cacat genetik yang terjadi pada DNA mitokondria akan berpengaruh pada sintesis protein dalam mitokondria sehingga akhirnya berdampak pada proses konversi energi. Jaringan tubuh yang memiliki resiko terbesar akibat defisiensi energi ini adalah telinga dan pankreas sehingga berakhir pada timbulnya gejala diabetes dan ketulian. Penyakit MIDD ini timbul jika sifat DNA mitokondria pada penderita adalah heteroplasmi, yaitu ketika mtDNA mutan mencapai tingkat tertentu hingga mitokondria dapat dikatakan mengalami kecacatan. MIDD merupakan mitochondrial disease yang disebabkan adanya mutasi pada gen tRNALeu yaitu mutasi A3243G. Mutasi A3243G juga menjadi salah satu kecacatan yang berkaitan dengan penyakit MELAS (Mitochondrial Encephalomyopathy with Lactic Acidosis and Stroke-like episode). Mutasi yang terjadi pada posisi 3243 ini diduga mengarah kepada disfungsi mitokondria yaitu pengurangan protein sintesis yang dikode oleh mtDNA sehingga terjadi ketidak-seimbangan protein yang dikode oleh DNA inti dengan protein yang dikode oleh genom mitokondria. Beberapa publikasi juga melaporkan bahwa mutasi A3243G ini memang menyebabkan timbul gejala diabetes karena terjadi penurunan sekresi insulin oleh sel beta-pankreas atau terjadi perubahan sensor glukosa pada sel beta pankreas sendiri. 2.6 Teknologi PCR PCR atau Polymerase Chain Reaction merupakan teknik in vitro tanpa menggunakan organisme hidup untuk mengamplifikasi daerah spesifik suatu DNA yang dibatasi oleh sepasang primer (oligonukleotida pendek) menggunakan enzim DNA polimerase dan dNTP sebagai monomernya (Innis and Gelfand, 1990). Metode yang meraih nobel tahun 1993 ini mampu memperbanyak sampel DNA yang sedikit menjadi lebih dari satu miliar kopi. Metode PCR ini memiliki keunggulan dibandingkan teknik amplifikasi DNA lainnya yaitu sensitif (hanya dengan sebuah fragmen kecil maka proses sudah dapat berjalan), cepat (dapat dilakukan dengan waktu kurang dari satu hari), dan aman (tidak menggunakan bahan radioaktif dan larutan organik berbahaya). Melalui metode perbanyakan DNA ini akan mempermudah pekerjaan peneliti untuk menganalisis DNA. Selain itu, metode PCR ini juga membantu peneliti dalam pembuatan suatu mutasi yang disebut dengan metode site directed mutagenesis atau mutasi terarah. 23 Bahan-bahan yang dibutuhkan agar reaksi amplifikasi dapat berjalan adalah: 1. DNA templat, diperoleh dari sampel yang mengandung fragmen DNA yang diinginkan untuk diperbanyak atau diamplifikasi. 2. Taq buffer (buffer PCR), sebagai penyedia dan penjaga suasana kimia dalam larutan agar enzim polimerase dapat berfungsi dengan baik. 3. Primer, yang digunakan terdiri dari primer forward (maju) dan reverse (balik) yang urutannya merupakan komplemen dari masing-masing untai DNA. 4. dNTP, sebagai sumber nukleotida untuk memperpanjang rantai DNA primer yang menjadi daerah awal berjalannya proses perbanyakan. 5. Enzim Taq polimerase, yaitu enzim yang diisolasi dari bakteri termofilik dan berfungsi sebagai katalis perpanjangan rantai (polimerisasi). Serupa halnya dengan DNA polimerase yang ada dalam tubuh kita saat proses replikasi. 6. MgCl2, sebagai kofaktor enzim yang esensial dalam reaksi amplifikasi. Untuk mendapatkan hasil perbanyakan yang baik maka biasanya dilakukan optimasi konsentrasi MgCl2 untuk setiap primer dan templat yang digunakan. Secara umum cara kerja PCR terbagi menjadi 3 tahap yang digambarkan dalam Gambar 2.6. Tahap pertama adalah pemisahan DNA untai ganda menjadi untai tunggal karena terjadi pemutusan ikatan hidrogen basa-basanya pada suhu tinggi (94-96oC) selama minimum lima menit. Suhu yang tinggi ini biasanya merupakan suhu tertentu di atas titik leleh DNA tersebut. Lalu diikuti dengan tahapan kedua, yaitu penempelan primer pada templat DNA yang umumnya dilakukan pada suhu 45-60°C atau 5°C dibawah temperatur denaturasi, dengan waktu kurang lebih satu menit. Biasanya suhu penempelan ini juga dapat dihitung berdasarkan nilai melting temperature (Tm) dari primer yang digunakan. Temperatur yang digunakan diatur sedemikian rupa sehingga tidak terlalu rendah. Jika temperatur terlalu rendah maka dapat mengakibatkan terjadinya penempelan primer yang salah pada DNA tersebut. Konsentrasi primer juga dibuat cukup tinggi untuk mencegah terjadinya penempelan templat kembali. Pada tahapan ketiga adalah tahapan perpanjangan rantai yang umumnya dilakukan pada suhu sekitar 72°C atau tergantung jenis polimerase yang digunakan agar enzim polimerase bekerja optimal. Waktu yang dibutuhkan pada tahap pemanjangan ini tergantung pada panjang fragmen yang diamplifikasi dan kecepatan reaksi (processity) dari enzim DNA polymerase yang digunakan. Tahap reaksi polimerisasi dilakukan oleh enzim Taq polimerase menggunakan dNTP sebagai monomernya dan dimulai dari ujung 3’ primer sepanjang templat DNA hingga terbentuk untai DNA baru. Perpanjangan rantai ini selalu berjalan dari arah 5’ ke 3’. Rantai baru akan menjadi templat untuk reaksi berikutnya. Ketiga tahap tersebut sama 24 dengan satu siklus, dan proses akan terus berjalan selama beberapa siklus sampai mencapai jumlah DNA yang diinginkan. Siklus yang dibutuhkan oleh sampel bergantung dari templat dan jenis primer yang digunakan. Hal yang harus diperhatikan adalah pada proses penempelan primer dan suhu perpanjangan rantai, karena proses inilah yang menjadi penentu apakah DNA tersebut berhasil teramplifikasi atau tidak. Tahap terakhir dari PCR adalah tahap pemantapan yang merupakan tahap untuk meyakinkan bahwa rantai DNA telah teramplifikasi semuanya. Suhu pada tahap ini berada pada kisaran 72OC. Bila ada rantai yang belum teramplifikasi dengan sempurna maka rantai tersebut akan terurai kembali sehingga tidak mengganggu proses selanjutnya yaitu sekuensing. Skema PCR secara umum tergambar pada Gambar 2.6. Gambar 2. 6 Skema PCR Garis biru melambangkan template, garis merah melambangkan primer, garis hijau melambangkan rantai baru. (1)Tahap denaturasi. (2)Tahap penempelan primer. (3)Tahap perpanjangan rantai, P=Polimerase. (4)Siklus pertama selesai dengan dihasilkannya dua pasang DNA yang akan menjadi template di reaksi berikutnya. 2.7 Rujukan Analisis MtDNA Analisis urutan nukleotida pada fragmen DNA mitokondria dilakukan dengan membandingkan urutan nukleotida sampel terhadap urutan nukleotida standar pada basis data revised Cambridge Reference Sequence (rCRS) oleh Andrews et al. (1999) yang merupakan perbaikan dari basis data original Cambridge Reference Sequence (CRS) (Anderson et al., 1981). Data rCRS ini terakhir diperbaharui pada 7 Mei 2008. Selain itu urutan nukleotida 25 sampel juga dibandingkan terhadap data-data sekunder yang didapat dari basis data mutasi pada Mitomap. 2.7.1 Cambridge Reference Sequence Cambridge Reference Sequence (CRS) adalah urutan mtDNA manusia yang ditentukan pertama kali oleh Anderson, et al. (1981). Kini CRS telah diperbaharui oleh Andrews et al. (1999) dengan beberapa perbaikan sehingga urutan mtDNA ini dipublikasikan pada revised Cambridge Reference Sequence (rCRS). Publikasi organisasi genom DNA mitokondria pertama ini terdiri dari rRNA 12S, rRNA 16S, 22 tRNA, dan 13 gen pengode polipeptida, dan daerah yang tidak mengode protein yaitu D-loop. Pada data di rCRS dilakukan pengulangan sequencing oleh peneliti lain sebanyak tiga kali karena ditemukan beberapa ketidaksesuaian. Dalam pengulangan berikutnya, dilaporkan bahwa publikasi original mengandung sebelas kesalahan sequencing, termasuk satu tambahan pasangan basa di posisi 3107. Hasil perbaikan yang dipublikasikan oleh Andrews, et al. pada tahun 1999 ini tetap mempertahankan nomor urutan nukleotida untuk menghindari kebingungan. Urutan mtDNA yang menjadi referensi ini berasal dari ras eropa yang termasuk dalam Haplogrup H. Dalam studi yang berkaitan dengan mtDNA manusia misalnya studi antropologi dan studi penentuan mutasi yang berkaitan dengan penyakit, urutan CRS juga digunakan sebagai urutan nukleotida mtDNA standar (Marzuki et al., 1991). CRS hanyalah merupakan sebuah urutan yang dijadikan acuan atau standar dan bukan dokumen mtDNA manusia terdahulu sehingga perbedaan ini bukan berarti mutasi dalam keadaan yang sesungguhnya. Gambar 2.7 menunjukkan urutan nukleotida Cambridge Reference Sequence daerah 2900-4000 (daerah yang akan diamplifikasi dan dianalisis pada penelitian ini) yang diambil dari Mitomap. Urutan nukleotida yang digunakan sebagai standar dalam penelitian ini adalah modifikasi atau revisi terbaru Cambridge Reference Sequence (REFSEQ AC_000021.2 gi:115315570 dan GenBank J01415.2 gi:113200490 (Mitomap, 2008). 26 Gambar 2. 7 Fragmen yang akan dianalisis dan diamplifikasi, yaitu posisi 2900-3800 Urutan nukleotida posisi 2900-3800 sebagai daerah yang akan diamplifikasi untuk menganalisis daerah mutasi pada posisi 3243 diambil dari data Cambridge Reference Sequence. 2.7.2 Mitomap Penelitian mengenai polimorfisme yang terjadi pada daerah pengode dan menimbulkan penyakit ataupun polimorfisme yang terjadi pada daerah non-pengode seperti D-loop serta penelitian mengenai keragaman mtDNA manusia telah banyak dilakukan. Mutasi-mutasi yang teramati dicatat dalam suatu basis data yang dapat diakses melalui situs http://www.mitomap.org. Basis data ini berisi mutasi-mutasi termasuk mutasi substitusi, delesi dan insersi yang terjadi di daerah pengode maupun non-pengode, yang menyebabkan penyakit maupun tidak, posisi mutasi tersebut, serta sumber publikasinya. Mitomap menggunakan pembacaan urutan nukleotida DNA mitokondria untuk mendapatkan informasi-informasi mengenai struktur DNA mitokondria, fungsi, mutasi-mutasi patogen, karakteristik klinis, kaitan variasinya dengan populasi, dan interaksi antar gen. Gambar 2.8 menunjukkan tampilan Mitomap yang berisi daftar mutasi (substitusi basa) yang berkaitan dengan penyakit. 27 Gambar 2. 8 Tampilan Mitomap untuk mutasi yang terkait dengan penyakit Mitomap ini menunjukkan daftar mutasi yang dapat menyebabkan penyakit dan sudah dipublikasikan. Sumber publikasi dapat dilihat pada kolom ‘Reference’ (http://www.mitomap.org) dengan tanggal akses 5 Juni 2008. 2.8 Diabetes Mellitus Diabetes Mellitus (DM) merupakan salah satu penyakit yang memiliki kecenderungan diturunkan secara genetik, berasal dari kata Yunani διαβαίνειν (diabaínein), "tembus" atau "pancuran air", dan kata Latin mellitus, “rasa manis”. Umumnya dikenal sebagai kencing manis dan merupakan penyakit yang ditandai dengan hiperglisemia (peningkatan kadar gula darah) yang terus-menerus dan bervariasi, terutama setelah makan. Adapun sumber lain yang menyebutkan bahwa Diabetes Mellitus adalah keadaan hiperglisemia kronik yang disertai berbagai kelainan metabolik akibat gangguan hormonal sehingga menimbulkan berbagai komplikasi kronik pada mata, ginjal, dan pembuluh darah. Hiperglisemia sendiri dapat menyebabkan dehidrasi dan ketoasidosis serta komplikasi jangka lama termasuk penyakit kardiovaskular, kegagalan kronis ginjal (penyebab utama dialisis), kerusakan retina yang dapat menyebabkan kebutaan, serta kerusakan saraf yang dapat menyebabkan impotensi dan gangren dengan risiko amputasi. Komplikasi yang lebih serius lebih umum bila kontrol kadar gula darah buruk. 28 2.8.1 Jenis Diabetes Mellitus Menurut World Health Organization (WHO) terdapat tiga jenis penyakit Diabetes Mellitus, yaitu tipe-1, tipe-2, dan gestational diabetes atau diabetes saat kehamilan. Pada jenis diabetes tipe-1 atau biasa disebut insulin-dependent diabetes (IDDM, diabetes yang tergantung pada insulin), dicirikan dengan kurangnya produksi insulin atau bahkan hilangnya sel beta penghasil insulin pada pulau-pulau Langerhans pankreas sehingga terjadi kekurangan insulin pada tubuh. Penyebab utama hilangnya sel beta pankreas ini adalah kesalahan reaksi autoimunitas, yaitu suatu reaksi tubuh penderita sendiri yang menghancurkan sel beta pankreas. Autoimunitas ini dapat terjadi karena dipicu oleh adanya infeksi pada tubuh. Diabetes tipe ini dapat diderita oleh anak-anak maupun orang dewasa. Diabetes tipe-1 ini hanya dapat diobati dengan menggunakan insulin dengan pengawasan teliti terhadap tingkat glukosa darah melalui alat monitor pengujian darah. Penderita diabetes tipe-1 juga rentan terjadi ketoasidosis, yaitu suatu keadaan saat darah menjadi asam akibat dihasilkannya keton ketika sel lemak dipecah sebagai sumber energi selain glukosa. Diabetes Mellitus tipe-2 seringkali disebut non-insulin-dependent Diabetes Mellitus (NIDDM, diabetes yang tidak bergantung pada insulin), terjadi karena kombinasi dari kecacatan sekresi insulin dan resistensi jaringan tubuh terhadap insulin atau berkurangnya sensitivitas reseptor insulin terhadap insulin di membran sel. Pada tahap awal gejala yang paling utama adalah berkurangnya sensitifitas terhadap insulin, yang ditandai dengan meningkatnya kadar insulin di dalam darah. Pada tahap ini, hiperglikemia dapat diatas dengan berbagai cara yaitu dengan mengonsumsi obat Anti-Diabetes yang dapat meningkatkan sensitifitas terhadap insulin. Hampir 55% penderita diabetes tipe-2 ini mengalami obesitas atau kegemukan. Diabetes tipe2 ini dapat diderita oleh orang dewasa ataupun anak-anak dan terkadang tidak menunjukkan gejala-gejala selama beberapa tahun. Menurut kriteria diagnostik PERKENI (Perkumpulan Endokrinologi Indonesia) 2006, seseorang dikatakan menderita diabetes jika memiliki kadar gula darah puasa >126 mg/dL dan pada tes sewaktu >200 mg/dL. Tingkat glukosa rata-rata untuk pasien diabetes tipe 1 harus sedekat mungkin ke angka normal (80-120 mg/dL, 4-6 mmol/L). Angka di atas 200 mg/dL (10 mmol/L) seringkali diikuti dengan rasa tidak nyaman dan buang air kecil yang terlalu sering sehingga menyebabkan dehidrasi. Angka di atas 300 mg/dL (15 mmol/L) biasanya membutuhkan perawatan secepatnya dan dapat mengarah ke ketoasidosis. Peningkatan kadar gula darah setelah makan atau minum merangsang pankreas untuk menghasilkan insulin sehingga mencegah kenaikan kadar gula darah yang lebih lanjut dan menyebabkan kadar gula darah menurun secara perlahan. 29 2.8.2 Gejala Diabetes Gejala awal berhubungan dengan efek langsung dari kadar gula darah yang tinggi mencapai 160-180 mg/dL sehingga glukosa akan dikeluarkan melalui urin. Jika kadarnya lebih tinggi lagi maka ginjal akan membuang air tambahan untuk mengencerkan sejumlah besar glukosa yang hilang. Oleh karena ginjal menghasilkan urin dalam jumlah yang berlebihan, maka penderita sering buang air (urin) dalam jumlah yang banyak (poliuri). Akibatnya adalah penderita merasakan haus yang berlebihan sehingga banyak minum (polidipsi). Ketika sejumlah besar kalori hilang ke dalam urin sehingga penderita mengalami penurunan berat badan, maka penderita seringkali merasakan lapar yang luar biasa sehingga banyak makan (polifagi). Gejala lainnya adalah pandangan kabur, pusing, mual dan berkurangnya ketahanan tubuh selama melakukan olah raga. Penderita diabetes yang gula darahnya kurang terkontrol lebih peka terhadap infeksi. Pada penderita diabetes tipe-1, gejalanya timbul secara tiba-tiba dan bisa berkembang dengan cepat ke dalam suatu keadaan yang disebut dengan ketoasidosis diabetikum. Kadar gula dalam darah tinggi tetapi karena sebagian besar sel tidak dapat menggunakan glukosa tanpa peranan insulin, maka sel-sel ini akan mengambil energi dari sumber yang lain yaitu sel lemak. Ketika sel lemak dipecah dan menghasilkan keton maka darah pun akan bersifat asam, gejala ini disebut ketoasidosis. Gejala awal ketoasidosis diabetikum adalah rasa haus dan buang urin yang berlebihan, mual, muntah, lelah, dan nyeri perut (terutama pada anak-anak). Pernapasan menjadi dalam dan cepat karena tubuh berusaha untuk memperbaiki keasaman darah, serta bau napas penderita tercium seperti bau aseton. Tanpa pengobatan selanjutnya, ketoasidosis diabetikum dapat berkembang menjadi koma dalam waktu hanya beberapa jam. Pada penderita diabetes tipe-2 justru tidak menunjukkan gejala-gejala selama beberapa tahun. Ketika kekurangan insulin semakin parah maka timbul gejala sering buang air kecil dan sering merasa haus. Jika kadar gula darah sangat tinggi (lebih dari 1.000 mg/dL biasanya terjadi akibat stres), maka penderita akan mengalami dehidrasi berat dan menyebabkan kebingungan mental, pusing, kejang dan suatu keadaan yang disebut koma hiperglikemik-hiperosmolar non-ketotik. 30