Disini
advertisement

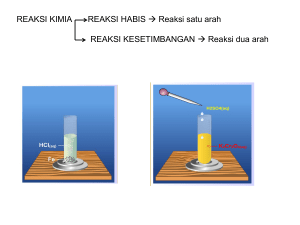
KESETIMBANGAN KIMIA Bahan Ajar Mata Pelajaran Kimia Kelas XI Semester I SK+KD+Indikator Materi Evaluasi Referensi Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan seharihari dan industri Standar Kompetensi dan Kompetensi Dasar Standar Kompetensi Kompetensi Dasar Kompetensi Dasar 3.3 Menjelaskan kesetimbangan dan faktor-faktor yang mempengaruhi pergeseran arah kesetimbangan dengan melakukan percobaan Indikator Indikator 1. 2. 3. Mendeskripsikan kesetimbangan dinamis Menjelaskan Azas Le Chatelier Menjelaskan Faktor-faktor yang mempengaruhi kesetimbangan Kesetimbangan Dinamis Pada reaksi reversible (dapat balik) akan tercapai suatu kondisi dimana laju reaksi ke kanan (pembentukan hasil reaksi) sama besar dengan reaksi ke kiri (pembentukan kembali pereaksi) Pada kondisi ini secara makroskopis tidak terjadi perubahan, tetapi secara mikroskopis reaksi terus berlangsung. Kondisi ini disebut kesetimbangan dinamis. Kesetimbangan Kimia Pergeseran Kesetimbangan Azas Le Chatelier : “Bila suatu keadaan setimbang menerima aksi, maka keadaan setimbang tersebut akan bereaksi untuk menghilangkan/ meminimalisasi pengaruh aksi tersebut” Kesetimbangan akan bergeser, sehingga harga K tetap Faktor-Faktor yang Mempengaruhi Pergeseran Kesetimbangan Konsentrasi Tekanan Volume Suhu Katalis Konsentrasi Pada suhu tetap, perubahan konsentrasi zat dalam reaksi kesetimbangan akan menyebabkan pergeseran kesetimbangan untuk mempertahankan harga K Contoh: NO + NO2 N2O3 Penambahan konsentrasi NO atau NO2 menyebabkan reaksi bergeser ke ruas kanan, konsentrasi N2O3 bertambah Tekanan Pada suhu tetap, perubahan tekanan pada kesetimbangan gas akan menggeser kesetimbangan untuk mempertahankan harga K. Tekanan Pada reaksi 2 NO2(g) N2O4(g) Bila tekanan dinaikkan, kesetimbagan akan bergeser ke ruas dengan jumlah partikel lebih sedikit. Kesetimbangan akan bergeser ke ruas kanan, karena reaksi ke kanan menghasilkan jumlah partikel yang lebih sedikit Tekanan Bila tekanan diturunkan, reaksi akan bergeser ke ruas dengan jumlah partikel lebih banyak. Kesetimbangan akan bergeser ke kiri, karena reaksi ke kiri menghasilkan jumlah partikel yang lebih banyak. Animasi Tekanan Pada reaksi H2(g) + I2(g) 2 HI(g) Perubahan tekanan tidak mempengaruhi kesetimbangan; harga K tidak berubah; karena kedua ruas memiliki jumlah partikel yang sama. Animasi Volume Pada suhu tetap, perubahan volume menyebabkan perubahan tekanan. Bila volume diperkecil berarti tekanan diperbesar, sedangkan bila volume diperbesar maka tekanan diperkecil. Perubahan volume menggeser kesetimbangan, berlawanan dengan perubahan tekanan Suhu Perubahan suhu berpengaruh pada kesetimbangan, dan menyebabkan harga K berubah. Akibat perubahan suhu, kesetimbangan bergeser menyebabkan konsentrasi koponen reaksi berubah, sehingga harga K berubah. Suhu Pada reaksi : CO2(g) + H2(g) CO(g) + H2O(g) ΔH=41,2 Kj Kenaikan suhu akan menggeser kesetimbangan ke arah endoterm; ke kanan; sehingga konsentrasi CO2 dan H2 berkurang, harga K naik. Penurunan suhu akan berdampak sebaliknya. Katalis Katalis tidak mempengaruhi keadaan setimbang, katalis berpengaruh pada kecepatan tercapainya keadaan setimbang. Evaluasi Tuliskan persamaan tetapan keseimbangan untuk reaksi-reaksi berikut: 1. N2O4(g) 2 NO2(g) 2. 2 SO2(g) + O2(g) 2 SO3(g) 3. 3 Fe(s) + 4 H2O(g) Fe3O4(s) + 4 H2(g) 4. 2 NH3(g) + CO2(g) CO(NH2)2(s) + H2O(l) Evaluasi Untuk reaksi setimbang berikut: 2NH3(g) + CO2(g) CO(NH2)2(s) + H2O(l); ΔH=+a Kj apa yang tejadi jika a. Konsentrasi CO2 ditambah b. Tekanan dinaikkan c. Volume diperbesar d. Suhu dinaikkan e. Ditambahkan katalis Referensi Petrucci, Ralph. H, 1992. Kimia Dasar, Prinsip dan Terapan Modern. Terjemahan Suminar. Jakarta: Erlangga Brady, James E. dan J.R. Holum. 1988. Fundamentals of Chemistry. Edisi 3, New York: Jon Willey & Sons, Inc. Parning, Horale, Tiopan, 2006, Kimia SMA Kelas XI Semester I, Jakarta: Yudistira Selesai Keluar