materi hukum dasar kimia
advertisement
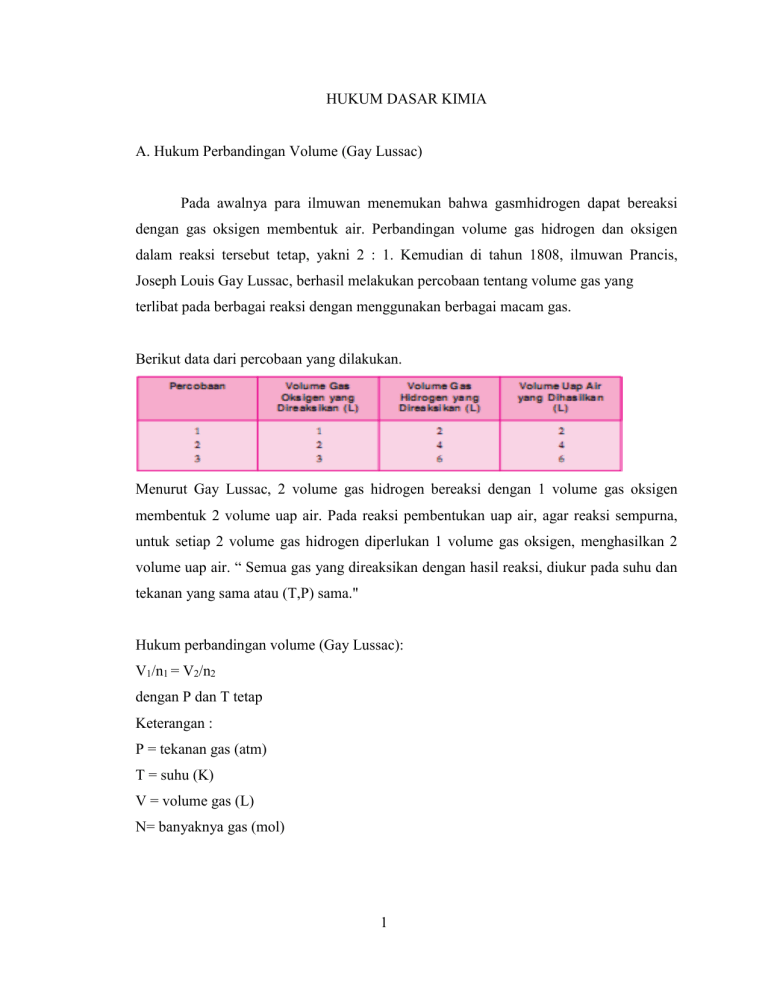
HUKUM DASAR KIMIA A. Hukum Perbandingan Volume (Gay Lussac) Pada awalnya para ilmuwan menemukan bahwa gasmhidrogen dapat bereaksi dengan gas oksigen membentuk air. Perbandingan volume gas hidrogen dan oksigen dalam reaksi tersebut tetap, yakni 2 : 1. Kemudian di tahun 1808, ilmuwan Prancis, Joseph Louis Gay Lussac, berhasil melakukan percobaan tentang volume gas yang terlibat pada berbagai reaksi dengan menggunakan berbagai macam gas. Berikut data dari percobaan yang dilakukan. Menurut Gay Lussac, 2 volume gas hidrogen bereaksi dengan 1 volume gas oksigen membentuk 2 volume uap air. Pada reaksi pembentukan uap air, agar reaksi sempurna, untuk setiap 2 volume gas hidrogen diperlukan 1 volume gas oksigen, menghasilkan 2 volume uap air. “ Semua gas yang direaksikan dengan hasil reaksi, diukur pada suhu dan tekanan yang sama atau (T,P) sama." Hukum perbandingan volume (Gay Lussac): V1/n1 = V2/n2 dengan P dan T tetap Keterangan : P = tekanan gas (atm) T = suhu (K) V = volume gas (L) N= banyaknya gas (mol) 1 Perhatikan data hasil percobaan volume gas yang bereaksi pada suhu dan tekanan yang sama. (untuk lebih memahami hukum perbandingan volume). Data hasil percobaan sebagai berikut. Berdasarkan data percobaan dalam tabel di atas, perbandingan volume gas yang bereaksi dan hasil reaksi, ternyata berbanding sebagai bilangan bulat. Data percobaan tersebut sesuai dengan hukum perbandingan volume atau dikenal dengan hukum Gay Lussac bahwa: "Pada suhu dan tekanan yang sama perbandingan volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat". B. Hukum Avogadro Pada tahun 1811, Amadeo Avogadro (Italia), mengajukan hipotesisnya yang terkenal, yaitu: “Gas (atau uap) apa saja bervolum sama akan mengandung jumlah molekul yang sama jika kondisi (suhu dan tekanan) gas itu sama” Hipotesis ini selanjutnya dinyatakan sebagai Hukum Avogadro, karena berhasil dibuktikan di kemudian hari (50 tahun) oleh 2 ilmuwan lain. Bentuk lain dari pernyataan hukum Avogadro: “22,4 L gas (atau uap) apa saja pada suhu 0°C dan tekanan 1 atm akan mengandung jumlah partikel yang sama sebesar 6 x 1023 partikel”. “1 mol gas (atau uap) apa saja pada suhu 0°C dan tekanan 1 atm akan memiliki volume yang sama, yakni 22,4 L”. 2 Catatan: Bilangan 6 x 1023 ini kemudian disebut bilangan Avogadro (simbol N) sebagai penghormatan kepada Avogadro. Istilah “mol” akan dibahas di bagian berikutnya pada BBM ini. Selain itu, hukum Avogadro juga memperlihatkan adanya hubungan antara volum dan koefisien masing-masing gas dalam persamaan reaksinya. Untuk reaksi 2 H2(g) + O2(g) → 2 H2O(g) pada suhu dan tekanan yang sama berlaku: volum gas H2 : volum gas O2 : volum uap H2O = koef H2 : koef O2 : koef H2O =2:1:2 LATIHAN SOAL DAN PEMBAHASAN 1.. Bagaimanakah bunyi Hukum Gay Lussac? Jelaskan! # “ Volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat yang sederhana bila diukur pada suhu dan tekanan yang sama “ 2. 150 gas H2S dibakar sesuai dengan persamaan reaksi yang sudah setara sebagai berikut : 2 H2S (g) + 3 O2 (g) 2 H2O (g) + 2 SO2(g) Hitung (T,P) : a. Volume gas oksigen yang diperlukan ! b. Volume gas SO2 yang terbentuk ! 3 # a. Berdasarkan hukum Gay Lussac, Volume gas H2S dan gas O2 berbanding 2:3. Jadi volume gas O2 yang diperlukan : 225 L b. Berdasarkan dari persamaan reaksi diatas, dua volume H2S menghasilkan dua volume gas SO2. Jadi Volume gas SO2 yang terbentuk adalah 150 L 3. Apa yang dimaksud dengan Hipotesis Avogadro? Jelaskan! #“ Pada suhu dan tekanan yang sama, gas-gas yang mempunyai volume yang sama akan mengandung jumlah partikel yang sama banyaknya. “ 4. Satu liter gas nitrogen (N2 ) tepat bereaksi dengan 2 liter gas oksigen (O2 ) membentuk satu liter gas X . Tentukan rumus molekul gas X tersebut ! (suhu dan tekanan sama) # Dalam molekul gas X pasti mengandung unsure Nitrogen dan Oksigen, jadi dimisalkan rumus molekul gas X : NxOy Persamaan reaksinya : N2 + 2O2 NxOy 1L 1L 2L Perbandingan volume =Perbandingan jumlah partikel =Perbandingan koefisien reaksi, maka diperoleh N2 + 2O2 NxOy 1L 1L 2L Σ N kiri = Σ N kanan 2=x Σ O kiri = Σ O kanan 4=y Jadi, rumus molekul gas X adalah N2O4 4 LATIHAN 1. Apa perbedaan Hukum Gay Lussac dan Avogadro? 2. 20 liter gas hydrogen bereaksi sempurna dengan gas oksigen menghasilkan uap air. Menurut persamaan reaksi berikut: 2H2(g) + O2(g) → 2H2O(g) Jika volume gas-gas yang bereaksi diukur pada P,T yang sama,tentukanlah: a. Volume gas O2 yang diperlukan b. Volume H2O yang terbentuk 3. 20 ml gas N2 tepat habis bereaksi dengan 50 ml gas O2 menghasilkan 20 ml gas NxOy.Tentukanlah rumus kimia gas NxOy tersebut ! 5 6











