Bab I Thermodinamika untuk Teknik Lingkungan
advertisement

1 Thermodinamika untuk Teknik Lingkungan
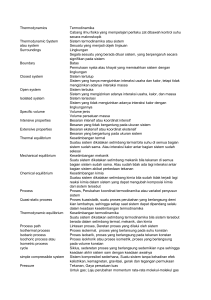
Bab I Thermodinamika untuk Teknik Lingkungan Termodinamika adalah studi tentang energi yang terjadi pada proses reaksi (baik fisika maupun kimia), dan transformasi energi dari satu bentuk energi ke bentuk energi yang lain. Dua kata yang sangat penting dalam termodinamika adalah panas dan kerja, yang berhubungan dengan bentuk‐bentuk energi. Panas dapat melakukan (menimbulkan) kerja, dan kerja dapat menghasilkan panas. Dua hal prinsip berkenaan dengan energi (panas dan kerja) dan materi adalah sistem (adalah bagian yang terpilih untuk dipelajari) dan lingkungan (adalah semua bagian yang melingkupi sistem). Suatu batas (real atau imaginer) memisahkan sistem dari lingkungan. Suatu contoh kasus mudah untuk memahami termodinamika adalah green house effect yang terjadi di atmosfer bumi dengan keberadaan sistem energi matahari dan gas‐gas rumah kaca. Suatu ilustrasi hubungan antara suatu sistem dengan lingkungan dengan batas yang bisa dipelajari dengan jelas, dalam kasus ini diperankan oleh adanya gas‐gas rumah kaca seperti CO2, CH4, O2‐O3, H2O dan sebagainya, seperti pada Gambar 1.1. Gambar 1.1 Ilustrasi Greenhouse effect dan gas‐gas rumah kaca Ada tiga macam sistem yang berlaku dalam teori termodinamika, yaitu sistem terbuka (dapat terjadi pertukaran materi maupun energi antara sistem dan lingkungan), sistem tertutup (dapat terjadi pertukaran energi, dan tidak terjadi perubahan (pertukaran) materi), dan sistem terisolasi (tidak terjadi pertukaran keduanya, baik materi maupun energi). Satu 1 1 Thermodinamika untuk Teknik Lingkungan
lagi sistem dalam termodinamika adalah sistem Adiabatik: Tidak ada panas yang dapat dipertukarkan, tetapi suatu kerja dapat diterapkan pada sistem (yaitu PV work). Contoh sistem ini pengambilan dan pengeluaran panas oleh kerja alektrik ekspansi dan kompresi pada lemari pendingin (kulkas). Gambar 1.2 Sistem thermodinamika terbuka dan terutup Prinsip dasar termodinamika antara lain sifat‐sifat sebagai berikut: (1) Sifat Keadaan Thermodinamis, yaitu Extensive (Variabel atau sifat ini tergantung pada jumlah material yang ada (e.g. mass or volume)) dan Intensive (Variabel atau sifat ini tidak tergantung pada jumlah material (e.g. density, pressure, and temperature)). (2) Proses Ideal Thermodinamika, yaitu Irreversible –Keadaan sistem awal tidak stabil atau metastabil dan perubahan spontan dalam sistem menghasilkan sistem baru dengan energi keadaan akhir yang lebih rendah‐ dan Reversible –Keadaan sistem awal maupun akhir dalam keadaan kesetimbangan, keadaan ini berlangsung secara kontinyu dan kenyataannya sulit didapati di alam. Ilustarasi perubahan spontan mengikuti perubahan energi seperti pada Gambar 1.3 berikut. Gambar 1.3 Profil energi perubahan (reaksi) spontan 2 1 Thermodinamika untuk Teknik Lingkungan
1.1 Temperatur, Panas (Heat), dan Kerja (Work) Hukum ke‐nol Termodinamika, dapat dinyatakan sebagai berikut : sistem‐sistem dalam kesimbangan termal mempunyai temperatur yang sama. Jika dua sistem dalam kesetimbangan termal kemudian ada sistem ketiga, dan terjadi kesetimbangan termal yang baru antara satu dengan yang lain, maka ketiga sistem mempunyai temperatur yang sama. Panas adalah bentuk energi yang mengalir dari satu benda ke benda lain sebagai hasil dari perbedaan temperatur. Jika temperatur dari sistem dijaga konstan (tetap), dT = 0, dinamakan dalam keadaan isotermal. Dan jika suatu proses dimana tidak ada transfer panas antara sistem dan lingkungannya, dq = 0, dinamakan proses adiabatis. Satuan dasar untuk panas adalah kalori, yaitu panas yang dibutuhkan untuk menaikkan temperatur 1 gram air sebesar 1oC. (satuan lain adalah Btu untuk menaikkan temperatur 1 pound air sebesar 1oF, = 252 kalori). Sangat dimungkinkan untuk melakukan kerja sistem, sebagai kerja tekanan‐volume. Dalam sistem tertutup kerja ekivalen dengan tekanan dikalikan dengan perubahan volume dw = P dV (i) Hukum ke‐satu Termodinamika, atau hukum konservasi energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, secara matematis ΔE = q – w (ii) dimana, ΔE adalah perubahan dalam energi internal dari sistem, dengan panas yang mengalir ke dalam sistem sebesar q, dan kerja oleh sistem adalah w. Nilai q positif jika panas diserap oleh sistem dan sebaliknya, dan w positif jika sistem melakukan kerja untuk lingkungan. Dalam pengertian termodinamika, maka suatu sistem reaksi dapat dijalankan dengan empat macam cara yaitu isobarik, isokhorik atau isometrik, isotermal dan adiabatis. Isobarik jika reaksi dijalankan pada suatu sistem yang dijaga tekanan tetapnya, sehingga sistem ini memberikan perubahan volume. Isokhprik atau isometrik jika sistem reaksi dijalankan pada reaktor dengan volume tertentu dan tetap. Isotermal jika reaksi dibuat sedemikian rupa sehingga suhu reaktor terjaga selalu sama mulai awal hingga akhir. Dan adiabatis jika dalam sistem reaksi tidak ada transfer panas antara sistem dan lingkungan. Dalam sistem kimia, jika volume sistem selalu konstan maka kerja ekspansi adalah nol ΔE = qv ( V=konstan) (iii) Sebagian besar sistem kimia yang ditangani, dalam teknik lingkungan, terbuka ke atmosfer sehingga lebih memungkinkan bekerja pada tekanan yang relatif konstan daripada pada volume konstan. Pada sistem seperti ini, entalphy (panas/energi pada tekanan konstan), lebih berperan, dimana : 3 1 Thermodinamika untuk Teknik Lingkungan
H = E + PV (iv) Jika diasumsikan dalam reaksi kimia tekanan dan temperatur konstan, perubahan energi internal sistem menjadi ΔE = E2 – E1 = qp – w = qp – PdV = qp – P(V2 – V1) (v) dimana qp adalah panas yang diserap pada tekanan tetap (konstan), dengan penataan ulang secara matematis didapatkan :
(E2 + PV2) – (E1 + PV1) = qp = H2 – H1 (vi) ΔH = qp ( T, P = konstan) (vii) Hukum ke‐dua Termodinamika menyatakan secara teori bahwa semua proses di alam cenderung terjadi hanya dengan peningkatan enthropy (derajat ketidakteraturan) dan bahwa arah perubahan selalu menuju ke enthrophy yang lebih tinggi. Konsep enthropy merujuk pada kriteria ke‐spontan‐an perubahan kimia atau fisika, dan arah dari transformasi energi, yang didefinisikan sebagai : S = k ln Ω (viii) Dimana k adalah konstanta Boltzmann dan Ω adalah probabilitas termodinamik derajat kebebasan. Pada umumnya enthropy juga didefinisikan sebagai dS = dqrev / T (ix) untuk perubahan yang spontan, selalu diperoleh nilai dS positif. Perhitungan entropi dapat membantu kita untuk menentukan apakah transformasi fisika atau kimia dapat terjadi. Jika S > 0 perubahan akan terjadi spontan, S < 0 perubahan akan terjadi spontan ke arah sebaliknya, dan jika S = 0 sistem dalam kesetimbangan. Jika hukum pertama mengisyaratkan bahwa energi alam raya ini konstan, maka hukum kedua mengindikasikan bahwa energi mempunyai kualitas/bentuk yang berbeda‐beda dan entropi alam raya menuju kearah maximum. Dengan makin meningkatnya entropi maka sistem akan menuju kearah grade energi yang lebih rendah (terpecah‐pecah hal ini karena energi tidak dapat diciptakan atau dimusnahkan) dalam derajat ketidak teraturan yang tinggi antar anggota sistem yang bersifat irreversibel, sehingga sistem akan menuju pada krisis energi, atau polusi entropi. Energi bebas. Dalam sistem alam entropi alam adalah ΔSuniverse = ΔSsistem + ΔSlingkungan = ΔSsistem + qlingkungan
T
> 0 (x) (xi) karena, ΔΗ = qsistem = ‐q lingkungan (xii) 4 1 Thermodinamika untuk Teknik Lingkungan
ΔSuniverse = ΔSsistem ‐ ΔH sistem
> 0 T
(xiii) (xiv) dengan mengalikan –T pada persamaan, didapat − TΔS universe = ΔH sistem − TΔS sistem = ΔGsistem ≤ 0 ΔGsistem didefinisikan oleh persamaan (xiv) dan dikenal sebagai perubahan energi bebas Gibbs dari sistem. Sehingga jika ΔG < 0, reaksi akan berlangsung spontan; dan jika ΔG = 0 sistem berada dalam kesetimbangan. Dengan persamaan (iv) dan (xiv), dapat diperoleh persamaan energi bebas gibbs dalam bentuk : ΔG = ΔH + PΔV ‐ TΔS (xv) (xvi) dan dengan persamaan (ii) diperoleh ΔG = q – w + PΔV ‐ TΔS Jika sistem hampir reversibel, q menjadi qrev dan w menjadi wmax dan kualitas maximum kerja dapat didapat dengan ΔG = qrev – wmax + PΔV ‐ qrev dan ‐ ΔG = wmax ‐ PΔV (xvii) (xviii) Hukum ke‐tiga termodinamika. Pada kajian entropi sifat keteraturan kristal akan makin bagus jika suhu sistem diturnkan. Dalam perhitungan kristal akan berada dalam keadaan sangat teratur dan fix jika suhu mendekati nol absolut (0 K), dan pada suhu 0 K entropi sistem nol dan bahkan elektron dalam atom akan berada pada tempat yang fix (elektron akan berhenti berputar). Secara prinsip tidak mungkin dapat dicapai temperatur nol absolut di sistem alam dan tidak mungkin pula didapatkan efesiensi proses (mesin carnot) yang mencapai 100 %. Siklus Carnot sampai saat ini dipercaya sebagai siklus termodinamika yang paling efisien untuk operasi panas mesin, merupakan siklus reversibel yang terdiri atas 2 isotermal dan 2 adiabatis. Efisiensi Carnot dinyatakan: Qc
Tc
eC = 1 −
Qh
= 1−
Th
< 100%
(xix) 1.2 Sifat‐sifat Termodinamika Sistem termodinamika mungkin terdiri atas satu atau beberapa bagian yang disebut fasa. Satu fasa zat harus bersifat homogen baik secara fisik maupun kimia. Sifat‐sifat termodinamika system dibagi dalam dua jenis yaitu sifat extensive, yang tergantung pada jumlah substansi yang ada seperti massa‐volume‐dan energi, dan sifat intensive, yang memiliki harga tidak tergantuing dari jumlah substansi seperti tekanan‐temperatur‐volume 5 1 Thermodinamika untuk Teknik Lingkungan
molar‐potensial kimia. Beberapa fungsi termodinamika dapat diturunkan dari beberapa kode kalimat berikut : The Gibbs Potensial Has Shown Endless Valuable Applications atau, T= temperatur , G=energi bebas Gibbs, P= tekanan, H= entalpi, S=entropi, E=energi, V= volume dan A=luas area kerja Beberapa prinsip formula aplikasi dalam termodinamika : dE = − PdV + TdS
dG = VdP − SdT
dH = VdP + TdS
dA = − PdV − SdT Expressi kerja termodinamik, dw pada sistem Type Sifat Intensif Variasi Extensif Expressi Ekspansi Tekanan, P Volume,V ‐PdV Listrik Potensial, E Muatan, de ‐Ede Gravitasi Gaya, mg Tinggi, dh mg dh Kimia Potensial kimia,μ mol, dn μ dn Permukaan Gaya antar muka,γ Luas area, dA γ dA + T G P – A H + V E S – ⎛ ∂E ⎞
⎜
⎟ = − P ⎝ ∂V ⎠ S
⎛ ∂E ⎞
⎜ ⎟ =T ⎝ ∂S ⎠V
⎛ ∂G ⎞
⎜
⎟ = − S , dan seterusnya (xx) ⎝ ∂P ⎠ P
6 1 Thermodinamika untuk Teknik Lingkungan
Perubahan energi yang berhubungan dengan reaksi kimia sangat penting diketahui dalam teknik lingkungan, karena beberapa sistem terutama dalam pengolahan air limbah, sampah dan bidang‐bidang lainnya. Panas spesifik (C) adalah panas yang dibutuhkan untuk meningkatkan suhu suatu material atau bahan dengan berat 1 gram, sebesar 1 kelvin. C = q/(m x ΔT) (xxi) dimana : C q m ΔT : panas spesifik (kal/mol K atau J/mol K) atau kal/gram K : panas (kalori, joule). : berat dalam gram atau dalam mol : perubahan suhu yang terjadi selama proses dalam kelvin Dalam ilmu lingkungan pengetahuan panas sangat penting, baik pemanasan itu sendiri, evaporasi, pengeringan, panas yang digunakan untuk melebur banyak dimanfaatkan dalam pengolahan sampah, reaksi sistem lingkungan industri dan sebagainya. Dalam sistem kimia energi dapat diartikan interaksi dari tiga hal yaitu : ¾ Kerja yang dilakukan sistem. ¾ Aliran panas dalam sistem. ¾ Energi yang disimpan dalam sistem. ΔE = q – w (xxii) dimana : ΔE : perubahan energi dalam sistem. q : aliran panas dalam sistem. w : kerja yang dilakukan. Pada suhu dan tekanan konstan perubahan entalpi sama dengan panas yang diserap oleh suatu sistem. Perubahan kimia dalam entalphi bisa bernilai positif bisa negatif. Bila nilai + maka proses menyerap panas dinamakan sistem endotermik, sedangkan bila – melepaskan panas sistem eksotermik. Standard untuk perhitungan entalpi biasanya dilakukan pada tekanan 1 atm dengan suhu 25oC (298 K), karena itu untuk standard entalpi dilambangkan dengan : ΔHo298 satuan dalam kcal/mol. Gross heat : adalah panas yang terbentuk jika uap air dari pembakaran dikondensasikan menjadi air. Net heat : adalah panas yang tercipta jika air berubah menjadi uap. Entropi merupakan kriteria yang sangat umum dan sukar untuk menentukan proses berlangsung secara spontan atau tidak. Karena itu ada tambahan fungsi untuk mengukur 7 1 Thermodinamika untuk Teknik Lingkungan
spontan tidaknya suatu rekasi adalah Energi bebas. Energi bebas adalah energi yang ditentukan oleh entalphi dan entropi dalam suatu rekasi sehingga dapat diketahui reaksi mana yang berlangsung secara spontan. G = H – T . S Pada temperatur dan tekanan konstan perubahan energi bebas akan mengikuti : ΔG = ΔH – T .ΔS Berdasarkan persamaan diatas dapat dilihat bah perubahan energi bebas sama dengan kerja berguna maksimal yang dapat diperoleh sistem bila perubahan dilakukan secara reversible. ΔG standard pada tekanan dan suhu konstan dinyatakan dengan : ΔGo298 satuan dalam kcal/mole. Dalam persamaan reaksi kimia: aA + bB cC + dD maka : ΔG = ΔGo + RT ln ({C}c{D}d)/({A}a{B}b) dimana : ΔG ΔGo R T : perubahan energi bebas reaksi sataun kalori. : standard perubahan energi bebas satuan dalam kalori. : konstanta gas = 1.99 cal/deg‐mol. : suhu absolute dalam oK. Jika rekasi di atas mengalami keseimbangan maka ΔG = 0, dan persamaan akan menjadi : ΔGo = ‐ RT ln ({C}c{D}d)/({A}a{B}b) = ‐ RT ln K Bila nilai dari ΔG negatif berarti proses berlansung secara spontan, bila positif tidak spontan dan bila = 0 proses dalam keadaan setimbang. 1.3 Sifat Larutan TEKANAN UAP PADA ZAT CAIR Zat cair tidak mempunyai bentuk tetap dan molekulnya bergerak bebas tapi volumenya tetap. Di alam dalam sistem terbuka kebanyakan partikel tidak akan kembali dan zat cair dikatakan menguap. Dalam sistem tertutup bagaimanapun juga partikel akan kembali ke dalam phase cair ke konsentrasinya pada phase gas. Tekanan uap pada semua zat cair bertambah dengan bertambahnya suhu. Persamaan untuk menghitung tekanan uap adalah Formula Rankine : Log P = [A/T] + B log T + C dimana : P T A, B dan C : tekanan uap : suhu : konstanta 8 1 Thermodinamika untuk Teknik Lingkungan
Pada saat zat cair dipanaskan, tekanan uap dari zat cair akan naik dan setelah mencapai 1 atm, maka cairan akan mulai mendidih. Temperatur pada saat tekanan air sama dengan 1 atm disebut titik didih normal. Pada tekanan rendah, zat cair dapat mendidih pada temperatur yang jauh lebih rendah daripada titik didih normalnya. Penggunaan tekanan uap pada teknik lingkungan terutama dalam proses wet oxidation untuk pembakaran organic sludge. Hukum Tekanan parsial dinyatakan dengan hukum Dalton untuk gas ideal, diberikan sebagai berikut: Pa = Ya P dimana: Ya P = fraksi mol komponen a dalam campuran gas, dan = Tekanan total sistem gas dalam campuran Dan hukum Amagat menyatakan volume komponen gas dalam sistem campuran akan sebanding dengan prosentase kadar gas tersebut dalam campuran. Suatu contoh, jika dalam sistem tertutup 10 ft 3 campuran gas dengan tekanan total 2 atm berisi 30% CO2, 5% CO, 5% H2O, 50% N2, and 10% O2, dalam perbandingan volume. Maka secara sederhana keadaan campuran ini bisa dihitung sebagai berikut: VolumeCO2 = 0.30(10) = 3.00 ft3
Volume CO = 0.05(10) = 0.50 ft3
Volume H2O = 0.05(10) = 0.50 ft3
Volume N2 =0.50(10) = 5.00 ft3
Volume O2 =0.10(10)= 1.00ft3
Volume total = 10.00 ft3
Tekanan parsial CO2 = 0.30(2) = 0.60 atm
Tekanan Parsial CO = 0.05(2) = 0.10 atm
Tekanan Parsial H2O = 0.05(2) = 0.10 atm
Tekanan Parsial N2 =0.50(2) = 1.00 atm
Tekanan Parsial O2 =0.10(2) = 0.20 atm
Tekanan Total (P) =2.00 atm
HUKUM GAS IDEAL Suatu gas ideal adalah gas imaginer yang digambarkan secara sederhana oleh hukum Boyle, hukum Charels dan hukum gas ideal. Tidak ada gas nyata yang memenuhi hukum gas ideal secara tepat, meskipun gas‐gas yang sangat encer pada kondisi ambient mendekati sifat asumsi ini. Seluruh perhitungan terhadap gas akan mendapati deviasi yang nyata dari hukum gas ideal, namun demikian hukum gas ideal ini digunakan untuk pendekatan perhitungan teknis karena memberikan gambaran hasil yang cukup memadai. Hukum gas ideal secara sederhana dinyatakan: dimana, PV = nRT P = tekanan absolut sistem gas V = volume T = absolute temperature n = jumlah mol gas R =konstanta hukum gas ideal 9 1 Thermodinamika untuk Teknik Lingkungan
Nilai konstanta gas dapat digunakan yang sesuai antara lain sebagai berikut: R = 10.73 psia • ft3/(lbmol • 0R) = 1545psfa‐ft3/(lbmol‐°R) = 0.73 atm • ftVObmol • 0R) = 555 mm Hg • ft3/(lbmol • 0R) = 82.06 atm • cm3/(gmol • K) = 8.314kPa • m3/(kgmol • K) = 1.986cal/(gmolK) = 1.986 Btu/(lbmol‐ 0R) Densitas gas menggunakan cara pendekatan dapat dilakukan dengan menggunakan rumus ρ = P(MW)/RT; dengan MW untuk gas ambient (udara ambient) diasumsikan rata‐rata 29 g/mol TEGANGAN MUKA ZAT CAIR Tegangan permukaan zat cair : gaya yang bekerja pada permukaan cairan sepanjang 1 cm, sejajar dengan permukaan cairan. Tegangan permukaan ditetapkan melalui kenaikan kapiler, dimana : γ = 0.5 h d g r. γ h d g r : tegangan permukaan (dyne/cm). : tinggi cairan : rapat cairan. : percepatan gravitasi. : jari‐jari kapiler. Tegangan permukaan zat cair biasanya dihitung dengan Du Nuoy Tensiometer. Tegangan muka zat cair dipengaruhi beberapa faktor antara lain jenis cairan, temperatur dimana bila temperatur makin tinggi maka γ makin turun. Selain itu adanya zat lain juga berpengaruh terhadap γ dimana zat seperti sabun, alkohol atau asam (Surfactant) dapat menurunkan tegangan permukaan zat cair. Hukum Poiseuille's : Apabila zat cair melalui tabung kapiler biasanya berhubungan erat dengan viskositas zat cair dan hukum Poiseuille's. Viskositas adalah gaya tahan lapisan zat cair dengan lapisan lainnya. Viskositas dapat menyatakan kecepatan aliran zat cair. V = (π P r4/ 8 μ l) dimana : P r μ
l Pengetahuan : tekanan. : radius kapiler. : viskositas cairan. : panjang kapiler. mengenai hukum Poiseuille's sangat penting untuk membantu menjelaskan bagaimana mekanisme proses filtrasi. OSMOSIS Osmosis adalah proses perpindahan suatu larutam melalui membran yang impermiable dari larutan dengan konsentrasi yang rendah atau lebih encer menuju ke larutan 10 1 Thermodinamika untuk Teknik Lingkungan
konsentrasi lebih tinggi yang lebih pekat. Peristiwa osmosis ini adapat dilihat dari lewatnya air garam melalui selaput semipermiable. Persamaan dari tekanan osmosa adalah : π = ((R.T) /(Va)) x ln (Pa0/Pa) dimana : π : tekanan osmotik (atm) R : 0.082 dalam 1 am/mol T : suhu (kelvin) 0
Pa /Pa : tekanan uap larutan pada konsentrasi encer atau pekat. Va : volume larutan per mol (0.018 liter untuk air). Hukum Raoult, menyatakan bahwa bila dari larutan encer menuju larutan pekat maka dapat dinyatakan : π = c RT dimana c adalah konsentrasi partikel‐partikel yang terdapat dalam larutan (molar). Pengetahuan tentang osmosis ini sangat penting untuk proses demineralisasi yaitu untuk penyediaan air bersih bagi penduduk terutama di daerah yag sebagian besar menggunakan air payau sebagai sumber air utama. Proses tersebut adalah reverse osmosis, pemanfaatan teknologi membran dalam proses pengolahan air bersih. Membran bertindak hampir sama dengan filter untuk menahan partikel‐partikel yang tidak diinginkan dalam air bersih. 11