Daya Hantar
advertisement

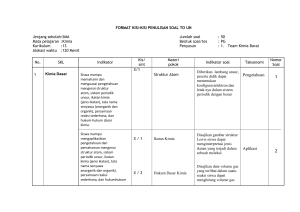
BAB I PENDAHULUAN 1.1 Latar Belakang Daya hantar listrik adalah parameter yang dipengaruhi oleh salinitas tinggi rendahnya berkaitan erat dengan nilai salinitas. Konduktivitas (Daya Hantar Listrik / DHL) adalah gambaran numeric dari kemampuan air untuk meneruskan listrik. Oleh karena itu, semakin banyak garam-garam terlarut yang dapat terionisasi, semakin banyak pula nilai DHL. Reaktivitas, bilangan valensi, dan kosentrasi ion-ion terlarut sangat dipengaruhi oleh nilai-nilai DHL. 1.2 Tujuan a. Mengetahui perubahan daya hantar pada titrasi asam basa b. Mengetahui beda hantar dari senyawa yang berbeda BAB II ISI 2.1 Pengertian Elektrolit Elektrolit adalah suatu senyawa yang bila dilarutkan dalam pelarut (misalnya air) akan menghasilkan larutan yang dapat menghantarkan arus listrik. Elektrolit diklasifikasikan berdasarkan kemampuannya dalam menghantarkan arus listrik yaitu elektrolit kuat dan elektrolit lemah. Suatu elektrolit dapat berupa asam, basa maupun garam. Menurut Michael Faraday, elektrolit merupakan suatu zat yang dapat menghantarkan listrik jika berada dalam bentuk larutan atau lelehannya. Dalam suatu larutan elektrolit bila diberi dua batang elektroda inert dan diberi tegangan listrik diantaranya, maka anion-anion akan bergerak ke elektroda negatif (katoda). Proses ini merupakan fenomena transport seperti halnya yang terjadi dalam molekul gas adalah adanya pengaruh medan listrik dan molekul pelarut. Analisis kimia yang didasarkan pada daya hantar listrik berhubungan dengan pergerakan suatu ion didalam larutan ion yang mudah bergerak mempunyai daya hantar listrik yang besar (salirawati,2008). Sumber gambar: (salirawati, 2008) 2.2 Macam-Macam Elektrolit 1) Larutan Elektrolit Kuat Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar arus listrik, karena zat terlarut yang berada didalam pelarut (biasanya air), seluruhnya dapat berubah menjadi ion-ion dengan harga derajat ionisasi adalah satu (α = 1) (Kamaludin,2010). Studi tentang elektrolit telah menunjukkan bahwa beberapa dari mereka yang hadir dalam larutan hampir seluruhnya sebagai ion, tetapi bahwa tingkat ionisasi zat lain yang lebih terbatas. asam sulfat, natrium hidroksida, dan natrium klorida, untuk contoh, hampir sepenuhnya terionisasi dalam air, dan mereka dikenal sebagai elektrolit kuat (Kath,2004). Yang tergolong elektrolit kuat adalah : a) Asam kuat, Larutan Asam kuat adalah zat asam yang terionisasi 100% dalam larutan. Karena itu, larutan ini dapat menghasilkan ion hidrogen yang banyak untuk dapat menhantarkan listrik dengan baik. antara lain: HCl Di dalam air HCl akan terionisasi sempurna menjadi ion H+ dan Cl- . mekanisme reaksi penghantaran listriknya adalah HCl (aq) → H+(aq) + Cl- (aq) H2SO4 Aliran electron dari sumber arus listrik masuk ke dalam larutan melalui salah satu elektroda sehingga elektroda itu bermuatas negative. Ion 2H+ akan bermigrasi menuju elektroda yang bermuatan listrik negative dan mengambil elektronnya. Pada elektroda lain, ion SO4 melepaskan electron dan keluar dari larutan elektroda tersebut. Mekanisme reaksi penghantaran listriknya adalah H2SO4 → 2H+ + SO44- HNO Ion H+ mengambil electron dan ion NO3- melepaskan electron. Mekanisme reaksi penghantaran listriknya adalah HNO3 → H+ + NO3(Hong,2008) HBr Adalah asam kuat dan di dalam air akan terionisasi sempurna membentuk ion H+ dan ion Br-. Mekanisme reaksi penghantaran listriknya adalah HBr → H+ + Br- HClO4 Ion H+ adalah sangat reaktif dalam larutan tidak dapat berdiri sendiri. Ion H+ akan terikat oleh molekul H2O membentuk H3O+ akan disolvasi oleh moleku-molekul air, begitu pula dengan ion Cl- sehingga larutan tersebut dapat menghantarkan arus listrik dengan kuat. Mekanisme reaksi penghantaran listriknya adalah HClO4 + H2O → H3O+ + ClO4(Sutrisna,2008) b) Basa kuat. Larutan Basa kuat adalah zat basa yang terpisah 100% menjadi ion logam dan ion hidroksida dalam larutan. Karena itu, larutan ini juga dapat menghasilkan ion hidroksida yang banyak untuk dapat menghantarkan listrik dengan baik antara lain: NaOH Adalah basa kuat dan di dalam air akan terionisasi sempurna membentuk ion Na + dan ion OH-. Mekanisme reaksi penghantaran listriknya adalah NaOH → Na + + OH- KOH Larutan ini akan terionisasi menjadi K+ dan OH-. Mekanisme reaksi penghantaran listriknya adalah KOH → K+ + OH- Ca(OH)2 Di dalam air, Ca(OH)2 akan terionisai sempurna membentuk ion Ca 2+ dan 2OH-. Mekanisme reaksi penghantaran listriknya adalah Ca(OH)2 → Ca 2+ + 2OH Ba(OH)2 Larutan ini akan terionisasi menjadi Ba2+ dan 2OH-. Mekanisme reaksi penghantaran listriknya adalah Ba(OH)2 → Ba2+ + 2OH- Mg(OH)2 Adalah basa kuat dan di dalam air akan terionisasi sempurna membentuk Mg2+ dan ion ion 2OH-. Mekanisme reaksi penghantaran listriknya adalah Mg(OH)2 →Mg2+ + 2OH- c) Garam, Suatu garam akan terdiosiasi sempurna di dalam air menjadi kation dan anionnya. Oleh karena itu, larutan garam digolongkan kepada larutan elektrolit kuat . Garam yang mempunyai kelarutan tinggi, antara lain : NaCl NaCl→Na+ + Cl- KCl KCl→K- + Cl- KI KI→K+ + I- Al2(SO4)3 Al2(SO4)3→2Al3+ + 3(SO4)4(Sutrisna,2008) 2) Larutan Elektrolit Lemah Larutan elektrolit lemah adalah larutan yang mampu menghantarkan arus listrik dengan daya yang lemah, dengan har ga derajat ionisasi lebih dari nol tetapi kurang dari satu (0 < α < 1) (Kamaludin,2010). Yang tergolong elektrolit lemah adalah: a) Asam lemah, antara lain: a) CH3COOH CH3COOH C2H5COOH C2H5COOH HCN HCN H2CO3 H2CO3 H2S H2S CH3COO- + H+ C2H5COO- + H+ H+ + CN2H3+ + 3 CO32H+ + S- Basa lemah, antara lain: NH4OH NH4OH 4NH+ + OH- Ni(OH)2 Ni(OH)2 Ni2+ + 2OH- Fe(OH) Fe(OH) Fe+ + OH- Fe(OH)3 Fe(OH)3 Fe3+ + 3OH- Al(OH)2 Al(OH)2 Al2+ +2OH- b) Garam-garam yang sukar larut, antara lain: AgCl AgCl Ag+ + Cl - CaCrO4 CaCrO4 Ca+ + CrO4- PbI2 PbI2 Pb2+ + 2I(Sutrisna,2008) 3) Larutan non-Elektrolit Larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, hal ini disebabkan karena larutan tidak dapat menghasilkan ion-ion (tidak meng-ion). Nilai derajat ionisasi larutan ini = 0. (Kamaludin,2010). Yang termasuk dalam larutan non elektrolit antara lain : Larutan urea (CO(NH)2) Larutan gula (C12H22O11) Larutan glukosa (C6H12O6) Etanol (C2H5OH), dan lain-lain (Sutrisna,2008) 2.3 Hukum Daya Hantar Larutan Menurut Arrhenius (tahun 1890), hantaran listrik larutan disebabkan oleh partikel bermuatan yang disebut ion. Ion positif tertarik ke katoda dan ion negative tertatik ke anoda. Orbitalnya merupakan perpindahan muatan dari suatu kutub ke kutub lainnya. Oleh sebab itu, listrik dapat mengalir dalam dua medium, yaitu logam dan larutan. Dalam logam, listrik dihantarkan oleh elektron (bermuatan negative) yang bergerak sehingga disebut penghantar elektronik. Dalam larutan, listrik dihantarkan oleh ion yang bergerak dan disebut penghantar elektronik. Hantaran listrik larutan ditentukan dengan mengukur kuat arus yang melalui larutan. Kemudian diketahui bahwa cara ini mengandung kesalahan, karena arus listrik dalam larutan menimbulkan polarisasi, yaitu penumpukan ion pada elektroda. Ini dapat diatasi dengan menggunakan arus bolak-balik, dan mengukur tahanan larutan. Daya hantar larutan (L) adalah kebalikan dari tahanan (R)-nya, yaitu : 1 𝑅 Karena satuan tahanan adalah ohm, maka satuan daya hantar adalah 𝐿= 1 𝑜ℎ𝑚 atau 𝑜ℎ𝑚−1 . Tahanan dihitung dari beda potensial listrik yang digunakan dan kuat arusnya sesuai dengan hukum Ohm : 𝐸 = 𝐼 𝑅 𝑎𝑡𝑎𝑢 𝑅 = 𝐸 𝐼 hingga : 𝐿= 𝐼 𝐸 Dengan : L = hantaran (𝑜ℎ𝑚−1 ) I = kuat arus (ampere) E = beda potensial (volt) R = tahanan (Syukuri, 2003) Hambatan, Konduktansi, Konduktivitas, dan Konduktivitas Molar Konduktansi larutan merupakan kebaikan dari tahanan R : makin rendah tahanan larutan, makin besar konduktansinya. Karena tahan dinyatakan dalam ohm, Ω, maka konduktansi sampel dinyatakan dalam Ω−1 . Kebalikan ohm biasanya disebut mho, tetapi sekarang satuan resminya adalah siemens, S, dan 1 S = 1 Ω−1. Tahanan sampel bertambah dengan pertambahan panjang l dan berkurang dengan pertambahan luas penampang lintang A. Oleh karena itu kita menuliskan : 𝑅=𝜌 × 𝑙 𝐴 Konstanta perbandingan 𝜌 disebut resisvitas sampel. Konduktivitas K merupakan kebalikan resisvitas, sehingga : 𝑅= 1 𝑙 𝑙 × 𝑎𝑡𝑎𝑢 𝐾 = 𝐾 𝐴 𝑅𝐴 Dengan tahanan dalam Ω dan dimensi dalam m, maka satuan K adalah S𝑚−1 (kadang-kadang lebih mudah S 𝐶𝑚−1 ). Perhitungan konduktivitas secara langsung dari tahanan sampel dan dimensi sel l dan A tidak dapat diandalkan, karena distribusi arusnya rumit. Dalam prakteknya, sel dikalibrasikan dengan sampel yang diketahui konduktivitasnya K* (yang khas adalah larutan kalium klorida dalam air), dan konstanta sel C ditentukan dari : 𝐾∗= Dengan R* merupkan 𝐶 𝑅∗ tahanan standar. Dimensi C adalah [𝑝𝑎𝑛𝑗𝑎𝑛𝑔]−1 . Jika sampel mempunyai tahanan R dalam sel yang sama, maka konduktivitasnya adalah : 𝐾 = 𝐶 𝑅 Konduktivitas larutan bergantung pada jumlah ion yang ada, dan kita biasa memperkenalkan konduktivitas molar 𝐴𝑚 , yang didefinisikan sebagai : 𝐴𝑚 = 𝐾 𝐶 Dengan c merupakan konsentrasi molar elektrolit yang ditambahkan. Konduktivitas molar biasanya dinyatakan dalam S𝐶𝑚2 𝑚𝑜𝑙 −1 . Konduktivitas molar elektrolit, tidak bergantung pada konsentrasi jika K tepat sebanding dengan konsetrasi elektrolit. Walaupun demikian pada prakteknya, konduktivitas molar bervariasi terhadap konsentrasi. Salah satu alasannya adalah : jumlah ion dalam larutan mungkin tidak sebanding dengan konsentrasi elektrolit. Misalnya, konsentrasi ion dalam larutan asam lemah bergantungpada konsentrasi asam secara rumit, dan penduakalian konsentrasi nominal asam itu, tidak menduakalikan jumlah ion tersebut. Kedua, karena ion saling berinteraksi dengan kuat , maka konduktivitas larutan tidk tepat sebanding dengan jumlah ion yang ada (Atkins, 2003) 2.4 Alat Pengukur Daya Hanta 2.5 Faktor yang Mempengaruhi Daya Hantar suatu Larutan Besarnya daya hantar jenis dapat dicari dari tahanan larutan. Jadi dengan mengukur tahanan larutan dapat ditentukan daya hantar ekivalen. Untuk ini biasanya dipakai jembatan wheat stone. Daya hantar suatu larutan tergantung dari : 1. Jenis ion 2. Konsentrasi ion 3. Jarak elektroda 4. Luas kedua elektroda 5. Suhu (Syukuri, 2003) 2.5 Aplikasi dalam Teknologi Pertanian a) Larutan elektrolit berperan sebagai bahan pokok minuman istonik. Contohnya yaitu minuman Pocari Sweat. b) Pengukuran daya hantar listrik mempunyai arti penting dalam proses-proses kimia. Pada pembuatan akuades, efisiensi dari penghilang zat terlarut yang berupa garam-garam dapat diikuti dengan mudah dengan cara mengukur daya hantar larutan selama titrasi dan dengan menggunakan grafik dapat digunakan untuk menentukan titik akhir titrasi. Derajat ionisasi elektrolit lemah dapat ditentukan dengan pengukuran daya hantarnya. Seperti diketahui, daya hamtar berbanding lurus dengan jumlah ion yang ada dalam larutan. BAB III PENUTUP 3.1 Kesimpulan Dari laporan daya hantar listrik tersebut dapat disimpulkan bahwa ditinjau dari kemampuannya menghantarkan arus listrik, larutan dibedakan menjadi dua yaitu larutan elektrolit dan larutan nonelektrolit. Larutan elektrolit adalah larutan yang mampu menghantarkan arus listrik, sedangkan larutan non elektrolit tidak mampu menghantarkan arus listrik. Elektrolit dibedakan menjadi elektrolit kuat dan elektrolit lemah. Elektrolit kuat merupakan elektrolit yang larutannya menghasilkan ion, sedangkan pada elektrolit lemah tidak menghasilkan ion. 3.2 Kesan dan pesan Laporan makalah daya hantar memberikan pengetahuan bahwa ada beberapa macam larutan yang dapat menghantarkan listrik dan tidak dapat menghantarkan listrik. Dam juga mengajarkan tentang berbagai jenis elektrolisis, serta prisip-prinsip dalam arus listrik. DAFTAR PUSTAKA Atskin, P.W. 2003. Kimia Fisika Jilid 2 Edisi keempat. Jakarta: Erlangga Hong, Eng Nguan, dkk. 2008. Fokus Supet Hot SPM Chemistry. Malaysia: Penerbit Pelangi Sdn Bhd Kamaludin, Agus. 2010. Cara Cepat Kuasai Konsep Kimia dalam 8 Jam SMA Kelas X. Yogyakarta: C.V Andi Kath, J. Laidler. 2004. Principles of Chemistry. New York: Mc Graw Hill Salirawati, Das, dkk. 2008. Belajar Kimia Secara Menarik Kelas X. Jakarta: Grasindo Sutresna, Nana, dkk. 2008. Persiapan Ujian Nasional Kimia untuk SMA/MA. Bandung: Grafindo Media Utama Syukuri,S. 2003. Kimia Dasar Jilid 3. Bandung: Penerbit ITB