INSEMINASI BUATAN PADA AYAM
advertisement

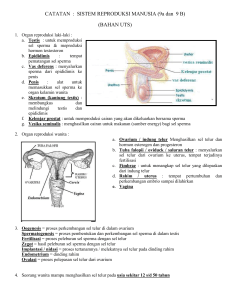
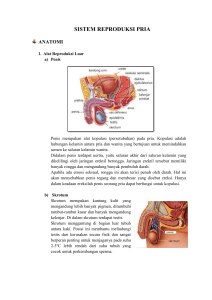
INSEMINASI BUATAN PADA AYAM Secara umum prinsip IB pada ayam adalah sama dengan IB pada sapi, yaitu pada tahapan prosesnya, yang meliputi penampungan pengenceran, penyimpanan maupun teknis inseminasinya. semen, penilaian, Namun oleh karena jenis ternaknya yang berbeda memang terdapat beberapa perlakuan yang agak berbeda diantaranya pada penyimpanan semen dan teknis IB nya. Penampungan Sperma Penampungan biasanya dilakukan pada sore hari karena berkaitan dengan pelaksanaan IB yang umumnya dilaksanakan pada sore hari (sekitar jam 16). Hal ini mengingat pelaksanaan IB pada ayam sebaiknya dilakukan setelah telur yang berada pada saluran reproduksi betina sudah di keluarkan (ditelurkan). Namun jika sperma akan disimpan (diawetkan) maka penampungan sperma ayam dapat dilakukan kapan saja sesuai keinginan si penampung. Penampungan sperma pada unggas (ayam) biasanya dilakukan oleh dua orang, yang satu orang memegang ayam jantan yang akan ditampung sambil melakukan pengurutan (massage) seorang lainnya memegang tabung penampung sperma pada saat sperma diejakulasikan oleh pejantan ayam tadi. Ayam pejantan dipegang dan diletakkan di atas ke dua paha penampung dan pada saat yang sama menahan sayapnya supaya tidak dikebas. Ayam pejantan diletakkan pada posisi horisontal sehingga memudahkan untuk proses penampungannya. Penampung meletakkan telapak tangan kirinya pada otot bagian ekor dan mendorong bulu ekor ke atas untuk menyingkap cloaka. Ibu jari dan jari telunjuk tangan kiri diletakkan pada kedua sisi dan dekat dengan cloaca. Tangan kiri berada pada posisi yang cocok untuk melakukan pemerahan sperma. Telapak tangan kanan dipakai juga untuk mengurut dari arah bawah cloaka, hingga kedua tangan mengarah pada arah yang sama (ke arah cloaka). Dapat juga dilakukan dengan cara telapak tangan kiri yang mengurut bagian dorso abdominal (punggung di atas perut) menuju ke arah cloaca dimulai dari bagian pangkal leher terus ke punggung hingga ke pangkal ekor. Pada saat mengurut telapak tangan membentuk sudut 45o dari tulang belakang pejantan. Pengurutan dilakukan beberapa kali hingga ayam pejantan menunjukkan ereksi maksimal yang ditandai dengan meregangnya bulu ekor ke atas dan mencuatnya papilae keluar dari permukaan cloaca. Cara lain adalah dapat menggunakan metoda Burrows dan Quin (1935), yaitu dilakukan dengan cara pengurutan pada bagian dorso abdominal dengan diikuti penekanan pada bagian cloaca. Teknik penampungannya dilakukan dua orang, satu orang mengurut bagian dorso abdominal dengan menggunakan tangan kirinya yang diikuti dengan penekanan pada bagian cloaca dan satu orang lainnya menampung sperma secara cepat dengan menggunakan waktu yang sesingkatsingkatnya dengan tetap menjaga kebersihan sperma. Atau dapat juga dilakukan dengan cara jari-jari tangan kiri pejantan dirangsang secara ritmik dengan cara memijat ujung caudal (bagian belakang) tubuh ayam jantan tepat di bawah tulang-tulang pubis (tulang duduk) sehingga akan menimbulkan reflek ejakulatoris. Cara melakukan pemijatan atau pengurutan adalah secara cepat dan kontinyu (ajeg) sampai ayam jantan meresponnya dengan keluarnya papillae (penis) nya. Pada saat papillae keluar maka ibu jari dan telunjuk tangan kanan dan kiri secara bersamaan bekerja sama memerah hingga keluar cairan berwarna putih menempel pada cloaca. Oleh karena semen terdapat di dalam bulbus vas defferent (saluran sperma) maka beberapa gerakan memerah terus dilakukan sampai mendapatkan ejakulat yang maksimal. Kemudian sperma yang keluar di sekitar cloaca kita tampung dengan hati-hati dan dijaga agar tidak tercampur dengan kotoran yang kadang keluar bersamaan oleh karena rangsangan pengurutan tadi. Setelah papillae mengeluarkan cairan bening maka kita lakukan penampungan secara hati-hati dan jangan sampai tercampur dengan kotoran maupun cairan lainnya dari cloaca ayam yang kadang keluar bersama-sama oleh karena proses pengurutan. Cara menanganinya adalah cairan maupun kotoran dari cloaca tadi kita bersihkan dengan kertas tisue yang telah dibasahi dengan cairan NaCl 0,9% untuk membersihkan kotoran dari cloaca yang keluar bersama sperma. Setelah dilakukan penampungan maka sperma tadi harus segera di IB pada ayam-ayam betina periode produksi yang sudah dipersiapkan sebelumnya. Daya tahan sperma unggas segar agar tetap mempunyai kemampuan pembuahan (fertilitas) adalah sampai 30 - 45 menit setelah penampungan. Cepatnya spermatozoa mengalami penurunan kualitas disebabkan karena sperma pada suhu kamar akan mengalami peningkatan aktifitas metabolisme yang berakibat terjadinya peningkatan gerakannya, disamping kondisi lingkungan yang berubah oleh karena terjadinya timbunan asam laktat hasil metabolisme juga menipisnya cadangan makanan (plasma seminal) yang ada. Selain itu peningkatan aktifitas metabolisme secara anaerob juga akan menghasilkan CO2 dan CO2 ini akan menurunkan aktifitas gerakan spermatozoa. Dari beberapa sperma pejantan yang ditampung selanjutnya disimpan dalam termos es yang suhunya 5 – 10 oC dan mampu mempertahankan fertilitasnya (kemampuan pembuahan) hingga sekitar 5 jam setelah penampungan. Spermasperma tadi yang berdasarkan penampilannya baik kita satukan (campurkan menjadi satu) sedangkan yang jelek dibuang. Sperma yang jelek adalah berwarna kemerahan atau kehijauan karena terkontaminasi darah maupun kotoran dan urine. Sedangkan sperma yang baik akan berwarna putih krem dengan kekentalan sangat tinggi. Penilaian Semen Jika akan dilakukan pemeriksaan kualitas sperma maka dalam kondisi lapangan pemeriksaan harus dilakukan secara cepat dan berkualitas. Sebenarnya informasi kualitas sperma ini sangat penting untuk mengetahui kemampuan pembuahan. Namun jika kondisi di lapangan tidak memungkinkan maka proses penampungan yang benar dan bersih (steril) dapat diprediksikan kualitasnya berdasarkan parameter pada umumnya. Contohnya perhitungan konsentrasi umumnya sekitar 3 – 6 milyard per ml, motilitas 90 – 100%, dst. Penilaian konsistensi sperma unggas umumnya memiliki konsistensi yang sangat kental dengan volume sangat sedikit 0,2 – 0,5 ml. Berdasarkan hasil riset diketahui konsentrasi sperma unggas (ayam) adalah 4 – 6 milyard sel / ml. Penilaian untuk mengetahui kemampuan pembuahan biasanya di lapangan cukup dengan mengetahui motilitasnya saja sedangkan konsentrasinya cukup diduga berdasarkan hasil riset yang sudah pernah dilakukan. Sperma yang telah diperoleh jika akan dilakukan uji kualitas maka dapat dilakukan terhadap kualitas makro dan mikroskopis. Pemeriksaan makroskopis meliputi volume ejakulasi, warna, bau, pH(derajat keasaman) dan tingkat kekentalannya (konsistensi). Sedangkan uji mikroskopis dapat meliputi gerak masa, gerak individu (motilitas), konsentrasi, dsb. Pemeriksaan volume sperma dilakukan langsung dengan cara melihat angka pada tabung penampung sperma yang berskala. Volume sperma yang diejakulasikan pada awal perkawinan mampu mencapai 1 cc kemudian akan menurun hingga 0,5 cc pada saat frekuensi perkawinannya tinggi. Sperma yang ditampung pada pagi hari mempunyai volume, motilitas dan konsentrasi yang sedikit lebih tinggi dari pada penampungan siang dan sore hari. Sperma yang ditampung 3 kali per minggu walaupun fertilitasnya tidak berkurang dibandingkan dengan penampungan 1 kali per minggu namun akan terjadi penurunan volume spermanya. Konsistensi diamati dengan melihat langsung pada tabung penampung dengan cara menggoyang-goyangkan tabung secara perlahan-lahan. Sperma ayam yang berkualitas baik akan mempunyai konsistensi tebal dan warnanya putih seperti mutiara. Bila sperma terkontaminasi dengan urine dikenal dengan istilah flek putih padat, sedangkan jika terkontaminasi dengan asam urat maka akan berwarna coklat kekuning-kuningan. Kontaminasi akan menyebabkan kehilangan secara cepat potensi fertilitas, khususnya pada temperatur tinggi. Semen ayam dengan jumlah spermatozoa kurang dari standart warnanya adalah keabu-abuan atau nampak encer jika konsentrasinya sangat rendah. Konsistensi semen bervariasi dari suatu suspensi keruh tebal sampai encer. Semen ayam rata-rata berwarna putih, sedangkan warna sperma kalkun adalah coklat atau kekuning-kuningan. Pemeriksaan warna sperma dapat dilakukan dengan melihat secara langsung warna dari tabung penampung. Pengukuran derajat keasaman (pH) dapat dilakukan pada tabung yang berisi semen yang akan di IB kan pada ayam betina, pH diukur dengan pH paper maupun alat pH elektrik. PH sperma ayam yang normal adalah antara 7 – 7,6 dan cenderung agak basa. pH ini akan berpengaruh terhadap daya hidup spermatozoa. Rendahnya pH sebagai akibat timbunan asam laktat yang diproduksi dari metabolisme glikolisis selama penyimpanan yang akan menyebabkan motilitas sel sperma rendah. Pengurangan Oksigen secara cepat merupakan indikator berkurangnya aktifitas metabolisme dari sperma ayam. Motilitas spermatozoa adalah salah satu ciri penentu dalam penilaian semen. Semen yang baik mengandung spermatozoa yang bergerak progresif dan menghasilkan gerakan masa, semakin tinggi motilitasnya maka persentase spermatozoa hidup juga semakin tinggi. Lebih dari 80 % ejakulasi menunjukkan motilitas spermatozoa yang progresif. Semen unggas tetap mempunyai daya gerak dalam kisaran suhu 2 – 43C dan akan meningkat motilitasnya seiring dengan peningkatan suhu lingkungannya. Motilitas yang dinilai merupakan ukuran kesanggupan membuahi, sehingga semakin tinggi persentase motilitasnya maka akan semakin tinggi pula kesanggupan spermatozoa untuk membuahi sel telur (ovum). Kemampuan induk-induk betina untuk menghasilkan telur-telur fertil berkorelasi positif dengan motilitas spermatozoa yang diinseminasikan, hal ini dapat diukur berdasarkanh sampel semen secara in vitro sebelum inseminasi. Secara in vivo sel sperma harus bergerak motil dalam vagina dan setelah masuk ke uterovaginal (perbatasan shall gland dengan vagina) sel sperma akan disimpan dalam tubulus (saluran serupa tabung). Konsentrasi spermatozoa dipengaruhi oleh frekuensi penampungan semen, variasi diantara pejantan dan jumlah pengenceran. Untuk mengetahui konsentrasi sperma ayam biasanya menggunakan alat spectrofotometer. Pada perhitungan konsentrasi sperma sapi, domba, kambing maupun pada manusia dapat menggunakan metoda perhitungan sel darah merah (dengan toma). Pengenceran Semen Energi diperlukan oleh spermatozoa untuk hidup dan pergerakan. Substrat energi dapat ditambahkan dalam bentuk bahan pengencer untuk kehidupan dan aktifitas spermatozoa. Penggunaan fruktosa lebih efisien dari pada glukosa maupun inositol dan spermatozoa akan mengandalkan metabolisme glikolisis untuk kehidupannya. Metabolisme spermatozoa merupakan aktifitas yang penting pada spermatozoa yang disimpan. Fruktosa merupakan jenis gula sumber energi yang cocok ditambahkan pada pengencer sperma dan cocok juga pada penyimpanan sperma ayam. Pengencer buatan disusun untuk lingkungan in vitro dimana sel sperma dapat hidup secara normal sebagaimana pada lingkungan in vivo (Christensen, 1995). Komposisi kimia dari jenis pengencer pertama kali disampaikan oleh Lake (1960) yang kemudian dilanjutkan Christensen (1995) yaitu berdasarkan komposisi plasma seminal, medium biologi natural dari sel sperma dalam saluran reproduksi (Christensen, 1995). Bahan pengencer pada pelaksanaan IB ayam sangat penting untuk ditambahkan mengingat volume sperma ayam sangat sedikit (sekitar 0,2-0,5 cc) per ejakulasi (per penampungan). Bahan pengencer yang digunakan pada IB yang menggunakan sperma segar cukup NaCl fisiologis yaitu terdiri atas garam dapur sebanyak 1,025 % dalam pH 7 – 8 dan kalau memungkinkan dapat ditambahkan antibiotika seperti dihidrostreptomicyn pada konsentrasi 200 – 400 g/ml. Kemudian dapat langsung dicampurkan dengan perbandingan sekitar 1 : 10. Bahan pengencer sperma yang akan disimpan biasanya harus memenuhi kriteria yang lengkap seperti disebutkan di atas oleh karena berfungsi secara kompleks baik sebagai cadangan nutrisi, penyangga pH, zat anti kuman, dsb. Pada pusat-pusat IB (BIB = Balai Inseminasi Buatan) biasanya menggunakan bahan pengencer yang baku dan sudah diteliti dengan tingkat fertilitas yang sangat baik. Sedangkan untuk sperma ayam yang disimpan disamping menggunakan bahan pengencer khusus yang standar (BPSE = Beltsville Poultry Semen Extender) juga masih membutuhkan perlakuan khusus oleh karena adanya zat penghambat fertilitas yang selalu dikeluarkan selama penampungan sperma pada ayam jantan. Pengencer semen ayam dapat digunakan NaCl fisiologis maupun pengencer BPSE (Beltsville Poultry Semen Extender) dengan komposisi yang tertera pada Tabel 3 berikut ini. Tabel 3. Komposisi BPSE sebagai pengganti plasma seminal sperma ayam (g/l) Bahan Fruktosa Magnesium klorida. 6H2O Jumlah 5,00 0,34 Tripotasium sitrat. H2O 0,64 Sodium asetat. 3H2O 4,30 Sodium glutamat. 2H2O TES* Potassium monofosfat (anhydrous) Dipotassium hidrogen fosfat. 3H2O PH Tekanan osmose(mOs/kg H2O) 8,67 1,95 0,75 12,70 7,50 333,00 *) N-Tris (hydroxymethyl) methyl-2-amino ethane sulphonic acid Beberapa bahan pengencer yang dapat digunakan selain BPSE menurut Sastrodihardjo dan Resnawati (1999) adalah : 1. Cairan fisiologis infus manusia (NaCl fisiologis 0,9%, Ringer’s dan Dekstrosa 5% dan NaCl 0,9%) pada penyimpanan 5 – 7 oC dapat bertahan pada kondisi fertil (dapat membuahi) sampai 48 jam dan pada suhu kamar (20 – 25oC) ketahanan fertilitas berturut-turut untuk tiga macam pengencer tadi adalah 1,89; 2,29 dan 3,35 jam). 2. Cairan infus manusia + kuning telur (4:1) yang meliputi NaCl 0,9% + Kuning telur (dalam 5 – 7oC bertahan hingga 24 jam; dan pada suhu kamar dapat bertahan hingga 3,61 jam); Ringer’s + putih telur (dalam 5 – 7 oC bertahan hingga 48 jam dan dalam suhu kamar bertahan sampai 1,91 jam) dan Dekstrosa 5% dan NaCl 0,9% + putih telur (dalam 5 – 7oC bertahan hingga 48 jam dan pada suhu kamar dapat bertahan hingga 2,20 jam). 3. Air kelapa (bukan santan) + kuning telur (6 : 1) dapat digunakan sebagai pengencer yang mudah dan murah pada penyimpanan 5 – 7oC dapat bertahan hingga 24 jam dan pada suhu kamar dapat bertahan sampai 3,09 jam. SOAL-SOAL LATIHAN : 1. 2. 3. 4. Jelaskan perbedaan IB pada sapi dengan IB pada ayam ! Apa yang saudara ketahui dengan pengencer BPSE ? Jelaskan macam pengencer pada sperma ayam !! Jelaskan metoda penampungan semen pada ayam dengan metoda “Burrows dan Quin (1935)”!!