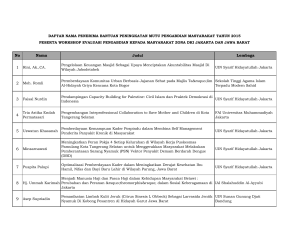
UIN SYARIF HIDAYATULLAH JAKARTA UJI EFEK
advertisement

UIN SYARIF HIDAYATULLAH JAKARTA UJI EFEK ANTIHIPERLIPIDEMIA EKSTRAK ETANOL 70% BUAH PARIJOTO (Medinilla speciosa Blume) TERHADAP JARINGAN HATI TIKUS PUTIH JANTAN SKRIPSI ELSA ELFRIDA NIM: 1111102000032 PROGRAM STUDI FARMASI FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA JULI 2015 UIN SYARIF HIDAYATULLAH JAKARTA UJI EFEK ANTIHIPERLIPIDEMIA EKSTRAK ETANOL 70% BUAH PARIJOTO (Medinilla speciosa Blume) TERHADAP JARINGAN HATI TIKUS PUTIH JANTAN SKRIPSI Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi ELSA ELFRIDA NIM: 1111102000032 PROGRAM STUDI FARMASI FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA JULI 2015 iv UIN Syarif Hidayatullah Jakarta v UIN Syarif Hidayatullah Jakarta ABSTRAK Nama Program Studi Judul : Elsa Elfrida : Farmasi : UjiEfek Antihiperlipidemia Ekstrak Etanol 70% Buah Parijoto (Medinilla Speciosa Blume)Terhadap Jaringan Hati Tikus Putih Jantan Buah Parijoto memiliki senyawa flavonoid, tanin, dan saponin yang telah diketehui pada penelitian sebelumnya memiliki efek antihiperlipidemia. Tujuan dari penelitian ini untuk mengetahui aktivitas ekstrak etanol 70% buah parijoto sebagai antihiperlipidemia dengan melihat jaringan hati tikus jantan. Parameter yang dilihat adalah perlemakan sel hati di sekitar vena sentral. Tikus diberi induksi kolesterol dan lemak dengan komposisi kuning telur 80%, larutan sukrosa 65% sebesar 15%, dan lemak hewan 5%. Sebanyak 30 ekor tikus galur Sprague Dawley berusia 2 bulan dibagi dalam enam kelompok yang terdiri dari kontrol normal (Na CMC 0,5%), kontrol induksi kolesterol dan lemak, kontrol pembanding (Simvastatin), kelompok Dosis I (0,9 mg/kgbb), Dosis II (9 mg/kgbb), dan Dosis III (90 mg/kgbb). Setelah 42 hari, dilakukan terminasi dan diambil organ hati lalu dibuat preparat histologi. Hasil penelitian menunjukkan bahwa ketiga dosis dapat mengurangi perlemakan hati tetapi efek yang paling banyak mengurangi perlemakan hati terdapat pada dosis III (90 mg/KgBB) karena sel normal dan sel steatosis berbeda secara signifikan (p<0,05) dengan kelompok hiperlipid. Kata Kunci : Medinilla speciosa Blume, efek antihiperlipidemia, histologi hati, perlemakan hati vi UIN Syarif Hidayatullah Jakarta ABSTRACT Name Study Program Title : Elsa Elfrida : Farmasi : Test of Antihiperlipidemia Effect 70% Ethanol Extract of Parijoto Fruit (Medinilla Speciosa Blume) Judging from Liver Tissue of White Male Rats Parijoto fruit has been known from the previous research contain flavonoid, tanin and saponin compound which has Antihyperlipidemic effect. The purpose of this research is to know the activity of 70% ethanol extract of Parijoto fruit as Antihyperlipidemic by observing the liver tissue of male rats. The parameter which observed is the fatty of liver cell around central vena. The rats were given induction cholesterol and fat with the composition 80% of yolk egg,15% of 65% sucrose solution, and 5% of animal fat . There were 30 Sprague dawley groove rats 2 months old were divided into six groups, they were the normal control (Na CMC 0.5%), the control with cholesterol and fat induction, the comparator control (Simvastatin), the Dose I control (0.9 mg/kgbb), the Dose II control (9 mg/kgbb) and the Dose III control (90 mg/kgbb). After 42 days, termination were perfomed to all groups of animal experiments and the liver were taken and were made into preparations histology. The results showed that all three doses can reduce fatty liver. The best effects of fatty liver reduce was at the third dose (90 mg / kgbb) because the normal cells and steatosis cells was significantly different (p <0.05) with the hyperlipid group. Keywords: Medinilla Speciosa Blume, Antihiperlipidemia Effect, Liver Histological, Fatty Liver vii UIN Syarif Hidayatullah Jakarta KATA PENGANTAR Puji syukur saya panjatkan kehadirat Allah SWT yang selalu memberikan jalan dan bantuan sehingga dapat menyelesaikan skripsi ini. Shalawat serta salam semoga senantiasa terlimpahkan kepada Nabi Muhammad SAW. Penulisan skripsi ini dilakukan sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. Selama proses penulisan skripsi tidak dipungkiri ada banyak hambatan yang terkadang membuat saya berada titik terlemah, adanya dukungan, doa, dan restu dari orang tua membuat penulis tetap semangat dalam melanjutkan penulisan skripsi ini. Untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada mereka, Bapak Iskandar dan Ibu Alhusna. Selanjutnya dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada : 1. Bapak Yardi Ph.D., Apt selaku pembimbing I dan sekaligus selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta, terimakasih atas ilmu, arahan, bimbingan dan kesabaran dalam meluangkan waktu, pikiran, dan tenaga untuk membimbing penulis selama ini. 2. Ibu Puteri Amelia, M.Farm., Apt selaku pembimbing II sekaligus dosen pembimbing akademik, terimakasih telah banyak memberikan ilmu, pengarahan, bimbingan, dukungan serta perhatian yang begitu besar kepada penulis. 3. Ibu dr. Dyah Ayu Woro Setyaningrum, M.Biomed dan Ibu Rr. Ayu Fitri Hapsari, M.Biomed, terimakasih telah bersedia memberikan ilmu serta waktu kepada penulis selama penelitian berlangsung. 4. Dr. Arif Sumantri, M.KM selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. 5. Bapak dan Ibu Dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan atas ilmu yang telah diberikan kepada penulis. 6. Seluruh kakak laboran (kak eris, kak lisna, mbak rani, dll) yang sangat membantu penulis selama penelitian di kampus. viii UIN Syarif Hidayatullah Jakarta 7. Adik tercinta, Febriyanti Elfrida, yang senantiasa memberikan pengertian, dorongan, semangat, dukungan dan perhatian terbesar bagi penulis. 8. Bapak Herry dan keluarga yang telah membantu mengumpulkan sampel buah parijoto (Medinilla speciosa Blume) dari Gunung Muria Kudus. 9. Sahabat seperjuangan sepenelitian Ani Kurniawati dan Askandari yang selalu mendampingi, terimakasih atas bantuan, kesabaran, motivasi dan kebersamaannya selama penelitian. 10. Sahabat-sahabat tersayang yang selalu ada Rahmi, Dijah, Asrul, Tiara, Atiyah, Pipit, Indah, Aci, Galih, Fattah dan Mozer, yang tak henti memberikan doa, semangat, dan masukan untuk kelancaran penyusunan skripsi. 11. Laurensius Agus Triantoro, yang telah menjadi rekan, sahabat, sekaligus keluarga dan moodbooster terbaik bagi penulis. 12. Sahabat Serabi (Bunda, Anti, Abang Nissa, Nci, Njes, Itun, dan Upay) atas setiap dukungan kepada penulis selama penyusunan skripsi. 13. Keluarga besar Beng-Beng, terimakasih atas segala dukungan, doa, dan kenangan terindah yang diberikan kepada penulis selama masa perkuliahan. 14. Pihak-pihak yang tidak dapat disebutkan satu-satu oleh penulis, yang telah membantu penyelesaian skripsi. Semoga Allah SWT memberikan balasan yang berlipat ganda kepada semuanya. Demi perbaikan selanjutnya, saran dan kritik yang membangun sangat saya harapkan demi kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat dan memberikan pengetahuan yang lebih luas khususnya bagi penulis dan umumnya bagi pembaca. Jakarta, Juli 2015 Penulis ix UIN Syarif Hidayatullah Jakarta x UIN Syarif Hidayatullah Jakarta DAFTAR ISI HALAMAN PERNYATAAN ORISINILITAS ..... Error! Bookmark not defined. HALAMAN PERSETUJUAN PEMBIMBING ................................................ iii HALAMAN PENGESAHAN SKRIPSI ................. Error! Bookmark not defined. ABSTRAK ..............................................................................................................v ABSTRACT .......................................................................................................... vi KATA PENGANTAR ......................................................................................... vii HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ..................... ix DAFTAR ISI ...........................................................................................................x DAFTAR TABEl ................................................................................................. xii DAFTAR GAMBAR .......................................................................................... xiii DAFTAR LAMPIRAN ...................................................................................... xiv BAB 1 PENDAHULUAN ......................................................................................1 1.1. Latar Belakang Masalah ........................................................................ 1 1.2. Rumusan masalah .................................................................................. 3 1.3. Tujuan Penelitian ................................................................................... 3 1.4. Manfaat Penelitian ................................................................................. 3 BAB 2 TINJAUAN PUSTAKA .............................................................................4 2.1. Medinilla speciosa Blume ..................................................................... 4 2.1.1 Taksonomi ................................................................................... 4 2.1.2Pertelaan ....................................................................................... 4 2.1.3Tempat Tumbuh ........................................................................... 5 2.1.4Kandungan Kimia ........................................................................ 5 2.1.5Khasiat .......................................................................................... 5 2.2. Ekstraksi ................................................................................................ 5 2.3. Penapisan Fitokimia .............................................................................. 7 2.3. Lipid....................................................................................................... 8 2.4.1 Lipoprotein .................................................................................. 8 2.4.2 Kolesterol .................................................................................. 11 2.4.3 Trigliserida ................................................................................ 12 2.6. Hati ...................................................................................................... 12 2.6. Hiperlipidemia ..................................................................................... 16 2.6.1 Definisi ......................................................................................16 2.6.2 Obat-obat yang digunakan dalam hiperlpidemia ...................... 17 2.6.3 Induksi Hiperlipidemia .............................................................. 19 BAB 3 METODE PENELITIAN ........................................................................20 3.1. Jenis Penelitian dan Metode ............................................................... 20 3.2. Lokasi dan Waktu Penelitian ............................................................... 20 3.2.Alat...................... ................................................................................. 20 3.3. Bahan ................................................................................................... 20 3.3.1. Bahan Uji.................................................................................. 20 3.3.2. Hewan Uji ................................................................................ 20 3.3.3. Bahan Kimia ............................................................................. 20 3.4. Cara Kerja ............................................................................................ 21 3.4.1. Persiapan Hewan Uji ................................................................ 21 xi UIN Syarif Hidayatullah Jakarta 3.4.2. Penentuan Dosis Bahan Uji ...................................................... 21 3.4.3. Penentuan Dosis Simvastatin ................................................... 21 3.4.4. Penyiapan Bahan Uji ................................................................ 21 7.4.7. Pelaksanaan Percobaan ............................................................ 25 3.4.8. Pengamatan Histologi .............................................................. 27 BAB 4 HASIL DAN PEMBAHASAN ................................................................28 4.1 Hasil dan Pembahasan Penelitian ......................................................... 28 4.1.1 Ekstraksi Buah Parijoto ............................................................. 28 4.1.2 Uji Penapisan Fitokimia ............................................................ 29 4.1.3 Uji Kadar Air ............................................................................. 30 4.1.4 Uji Antioksidan Kualitatif ......................................................... 30 4.1.6 Pengamatan Berat Badan Hewan Uji ........................................ 31 4.1.7 Makanan Induksi Kolesterol dan Lemak .................................. 32 4.2.3 Pelaksanaan percobaan Antihiperlipidemia .............................. 32 4.2.4 Pengamatan Histologi Hati....................................................... 33 BAB 5 KESIMPULAN DAN SARAN ................................................................46 5.1. Kesimpulan ................................................................................. 46 5.2 Saran ........................................................................................... 46 DAFTAR PUSTAKA ...........................................................................................47 xii UIN Syarif Hidayatullah Jakarta DAFTAR TABEL Tabel 2.1 Klasifikasi kadar lipid dalam plasma ................................................... 17 Tabel 3.2 Kelompok perlakuan. .............................................................................26 Tabel 4.3 Hasil uji penapisan fitokimia ekstrak .....................................................28 Tabel 4.4 Hasil uji kadar air ekstrak.......................................................................30 Tabel 4.5 Penilaian Degenarasi Lemak Sel Hati Hewan Percobaan......................34 xiii UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR Gambar 2.1 Gambar 4.2 Gambar 4.3 Gambar 4.4 Parijoto (Medinilla speciosa Blume)...................................................4 Hasil Uji Antioksidan Kualitatif ........................................................ 9 Grafik peningkatan berat badan hewan .............................................32 Pengamatan Mikroskopi Histologi Hati Hewan Percobaan ..............36 xiv UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN Lampiran 1. Kerangka Penelitian .........................................................................48 Lampiran 2. Pembuatan larutan uji ......................................................................49 Lampiran 3. Perhitungan dosis dan pembuatan suspensi simvastatin..................50 Lampiran 4. Pembuatan diit tinggi kolesterol dan lemak ....................................51 Lampiran 5. Jumlah sel normal, sel nekrosis, dan sel steatosis ...........................52 Lampiran 6. Persentase sel normal, sel nekrosis, dan sel steatosis ......................57 Lampiran 7. Uji statistik sel normal hewan uji (SPSS 16.0) ................................60 Lampiran 8. Uji statistik sel steatosi hewan uji (SPSS 16.0) ...............................64 Lampiran 9. Uji statistik sel nekrosis hewan uji (SPSS 16.0) ..............................68 Lampiran 10. Skrinning Fitokimia .........................................................................70 Lampiran 11. Hasil determinasi buah parijoto (Medinilla speciosa Blume) .........72 xv UIN Syarif Hidayatullah Jakarta BAB I PENDAHULUAN 1.1. Latar Belakang Saat ini banyak terjadi perubahan gaya hidup dan pola makan pada masyarakat. Perubahan pola makan ini menyebabkan masyarakat banyak mengkonsumsi makanan yang berkadar lemak tinggi sehingga dapat mengganggu kesehatan dan menyebabkan hiperlipidemia (Dinayanti, Tezza., DK, Kusmiyati. 2010). Hiperlipidemia akan meningkatkan risiko terjadinya berbagai penyakit yang salah satunya adalah jantung koroner. Penyakit jantung koroner yang merupakan salah satu bagian dari penyakit kardiovaskuler ditimbulkan karena kebutuhan sel-sel serabut otot jantung akan zat makanan maupun oksigen yang biasanya dialirkan melalui pembuluh nadi koroner kurang atau tidak terpenuhi. Hal ini disebabkan karena penyempitan dan penyumbatan dinding arteri oleh kolesterol dan trigliserida sehingga terjadi arteriosklerosis (Dyatmiko, 2004) . Penyakit jantung koroner adalah penyakit dengan angka kematian yang cukup tinggi. Hasil Riset Kesehatan Dasar (Riskesdas) tahun 2007 menunjukkan bahwa penyakit jantung koroner menjadi penyebab kematian yang cukup besar di Indonesia, yaitu 5,1% dari seluruh kematian pada semua golongan usia. Presentase tersebut meningkat menjadi 8,7% pada rentang usia 45-54 tahun. (Karina, 2011). Faktor-faktor yang menyebabkan jantung koroner antara lain, konsumsi makanan tinggi kalori, kurang aktivitas fisik, merokok, usia, konsumsi alkohol dan disposisi genetik. Faktor-faktor tersebut mengakibatkan kelainan pada metabolisme lipid dan lipoprotein termasuk produksi berlebihan dan defisiensi lipoprotein. (Kolawole, Kolawole, Ayankunle dan Olaniran, 2012). Obat-obat penurun kadar kolesterol seperti golongan statin, telah terbukti efektif menurunkan kadar kolesterol. Akan tetapi obat-obat tersebut memiliki efek samping seperti miopati, kemerahan, dan gatal-gatal pada wajah (Brunton., et al , 2008 dalam Purwanti, 2012). Sehingga banyak dilakukan penelitian tanaman yang memiliki efek yang sama dengan obat sintetik namun memiliki efek samping yang 4 UIN Syarif Hidayatullah Jakarta 2 lebih ringan (Mun’im, 2011 dalam Purwanti 2012). Parijoto (Medinilla speciosa Blume) pengunaannya dalam masyarakat mempunyai khasiat untuk menyembuhkan sariawan, diare, serta obat bagi penyakit kolesterol (Anonim, 2014). Pada tanaman Melastoma malabathricum yang memiliki famili yang sama dengan buah parijoto juga mengandung senyawa tannin, saponin dan flavonoid, dan terbukti memiliki efek antihiperlipidemia dan antidiabetes (Balamurugan, 2013). Pada penelitian sebelumnya dinyatakan bahwa parijoto (Medinilla speciosa Blume) mengandung tanin, flavonoid, dan saponin (Wachidah, 2013). Kandungan tersebut telah terbukti memiliki efek antihiperlipidemia seperti pada tanaman buah oyong, buah kenaf, dan bunga rosella (Purwanti, 2012; Shivali et al., 2010; dan Dinayanti, 2010). Hiperlipidemia berkaitan dengan metabolisme lipid. Metabolisme lipid itu sendiri banyak dilakukan di hati. Hiperlipidemia mengindikasikan adanya akumulasi radikal bebas dalam tubuh. Peningkatan radikal bebas dapat menurunkan aktivitas enzim lipoprotein lipase yang menyebabkan terjadinya akumulasi trigliserida dalam sel hati dan terjadi degenerasi lemak sel hati (Goldberg, 2001). Pengamatan degenerasi lemak secara histologi menunjukkan hepatosit yang mengandung banyak lemak, terlihat sebagai vesikel kosong yang berbentuk bulat (Klaassen & Watkins III, 1999 dalam Kaniati, 2012). Pada penelitian Kaniati (2012), pengamatan histologi kelompok yang mengalami hiperlipidemia didapati sel yang mengalami perlemakan (sel steatosis) dan sel nekrosis. Pada penelitian Wulandari (2012), kelompok kontrol hiperlipidemia mengalami perlemakan dengan ditandai sinusoid yang tampak melebar, degenerasi lemak pada sel yang dilihat dari inti sel yang terdorong ke pinggir, dan sel yang mengalami nekrosis. Penelitian ini bertujuan mengetahui aktivitas dari ekstrak parijoto (Medinilla speciosa Blume) sebagai terapi antihiperlipidemia dilihat dari jaringan hati pada tikus dengan variasi dosis selama 42 hari. Parameter yang diamati adalah degenerasi lemak sel hati di sekitar vena sentral dan sinusoid. UIN Syarif Hidayatullah Jakarta 3 1.2. Rumusan Masalah Berdasarkan latar belakang yang telah disebutkan terdapat rumusan masalah sebagai berikut: 1. Apakah ekstrak buah parijoto (Medinilla speciosa Blume) mempunyai efek antihiperlipidemia terhadap degenarasi lemak sel hati pada hewan uji? 2. Bagaimanakah pengaruh variasi dosis pemberian ekstrak buah parijoto (Medinilla speciosa Blume) terhadap efek antihiperlipidemia apabila dibandingkan dengan pemberian simvastatin sebagai kontrol positif terhadap degenarasi lemak sel hati hewan uji? 1.3.Tujuan Penelitian Tujuan dari penelitian ini adalah untuk mengetahui adanya efek antihiperlipidemia pada ekstrak parijoto (Medinilla speciosa Blume) dan menganalisa pengaruh dosis pemberian ekstrak tersebut terhadap degenarasi lemak sel hati pada hewan uji. 1.4. Manfaat Penelitian Manfaat dari penelitian ini adalah : 1. Diharapkan dapat memberikan ilmu dan pengetahuan baru terhadap dunia kesehatan bahwa terdapat efek antihiperlipidemia di dalam ekstrak buah parijoto. 2. Diharapkan hasil dari penelitian ini dapat dikembangkan lebih lanjut dan dapat dijadikan acuan untuk penelitian selanjutnya mengenai efek antihiperlipidemia. UIN Syarif Hidayatullah Jakarta BAB II TINJAUAN PUSTAKA 2.1 Medinilla speciosa Blume 2.1.1 Taksonomi Kingdom : Plantae (Tumbuhan) Subkingdom : Tracheobionta (Tumbuhan berpembuluh) Super Divisi : Spertaphyta (menghasilkan biji) Divisi : Magnoliophyta (Tumbuhan Berbunga) Kelas : Rosidae Ordo : Myrtales Famili : Melastomaceae Genus : Medinilla Species : Medinilla speciosa Blume (www.plantamor.com) (Gambar 2.1) [Sumber: Niswah, 2014] 2.1.2 Pertelaan Parijoto merupakan tanaman obat dengan bentuk perdu, tegak dengan tinggi 1-2 m. memiliki batang bulat, jika tua kulit batangnya berlapis gabus, bergerigi, kasar, dan berwarna putih kecoklatan. Morfologi daun tunggal, bersilang berhadapan, memiliki tangkai pendek, bulat, lunak, berwarna ungu kemerahan, helaian daun berbentuk lonjong sedangkan pangkal dan ujung daun runcing, bertepi rata, panjang 10-20 cm, lebar 5-15 cm, pertulangan melengkung, permukaan alas licin, berwarna hijau, permukaan bawah kasar dan berwarna hijau 4 UIN Syarif Hidayatullah Jakarta 5 kelabu. Bunga majemuk, di ketiak daun, sempurna, berkelamin ganda, kelopak 5 helai, ujung runcing, pangkal berlekatan, panjang 3-8 mm, warna ungu tua, benang sari 2 kali lipat jumlah mahkota, kepala sari berupa kuncup membengkok, warna merah keunguan, kepala putik duduk di atas bakal buah, kepala putik bulat, ungu, mahkota lepas, 5 helai, bentuk kuku, panjang 5-8 mm, warna merah muda. Buah buni, bulat, bagian ujung berbenjol bekas pelekatan kelopak, diameter 5-8 mm, warna merah keunguan. Biji bulat, berjumlah banyak, kecil, putih. Akar serabut, putih kotor (Anonim, 2014 dalam Niswah, 2014). 2.1.3 Tempat Tumbuh Parijoto merupakan tumbuhan liar yang tumbuh di lereng –lereng gunung atau di hutan-hutan dan terkadang dibudidayakan sebagai tanaman hias. Tumbuh baik pada tanah yang berhumus tinggi dan lembab, pada ketinggian 800 m sampai 2.300 m di atas permukaan laut. Tanaman ini berbunga pada bulan NovemberJanuari dan waktu panen yang tepat bulan Maret-Mei (Anonim, 2014 dalam Niswah, 2014). 2.1.4 Kandungan Kimia Hasil penelitian Wachidah (2013) menunjukkan buah parijoto mengandung tannin, saponin, flavonoid dan glikosida. Pada tanaman Melastoma malabathricum yang memiliki famili yang sama dengan buah parijoto juga mengandung senyawa tanin, saponin dan flavonoid, dan terbukti memiliki efek antihiperlipidemia dan antidiabetes (Balamurugan, 2013). 2.1.5 Khasiat Buah parijoto (Medinilla speciosa Blume) digunakan secara empiris untuk menyembuhkan sariawan, diare, serta obat untuk penyakit kolesterol (Anonim,2014). Buah parijoto ini telah diuji memiliki aktivitas sebagai antioksidan dan antibakteri pada penelitian Wachidah (2013) dan Niswah (2014). 2.2 Ekstraksi 2.2.1 Definisi Ekstrak adalah sediaan kental yang diperoleh dengan mengesktraksi senyawa aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, UIN Syarif Hidayatullah Jakarta 6 kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah ditetapkan (Depkes RI, 2000). Adapun faktor-faktor yang mempengaruhi mutu ekstrak meliputi: a. Faktor biologi Faktor-faktor biologi yang mempengaruhi mutu ekstrak adalah identitas jenis (spesies), lokasi tumbuhan asal, periode pemanenan hasil tumbuhan, penyimpanan bahan tumbuhan, umur tumbuhan dan bagian yang digunakan. b. Faktor kimia Faktor-faktor kimia yang mempengaruhi mutu ekstrak adalah: 1) Faktor internal : jenis senyawa aktif dalam bahan, komposisi kualitatifkuantitatif seyawa aktif, dan kadar total rata-rata senyawa aktif. 2) Metode eksternal: metode ekstraksi, perbandingan ukuran alat ekstraksi (diameter dan tinggi alat) ukuran, kekerasan dan kekeringan bahan,pelarut yang digunakan, kandungan logam berat, dan kandungan pestisida. 2.2.2 Metode Ekstraksi menggunakan pelarut Ekstraksi menggunakan pelarut dibagi menjadi dua, yaitu ekstraksi dengan cara dingin dan cara panas. Menurut Departemen Kesehatan (2000) ekstraksi cara dingin dapat dilakukan dengan beberapa cara diantaranya : a. Maserasi Maserasi adalah proses pengesktrakan simplisia dengan menggunakan beberapa pelarut dengan beberapa kali pengocokan atau pengadukan pada teperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu. Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya. b. Perkolasi Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya UIN Syarif Hidayatullah Jakarta 7 (penetesan/penampungan esktrak, terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan. Menurut Depkes RI (2000), ekstraksi dengan cara panas dapat dilakukan dengan beberapa cara, yaitu : a. Refluks Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendinginan balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraski sempurna. b. Soxhlet Soxhlet adalah ekstraski menggunakan pelarut yang selalu baru umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. c. Digesti Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar) 40-50oC. d. Infus Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus terceluo dalam penangas air mendidih, temperatur terukur 96-98oC) selama waktu tertentu (15-20 menit). e. Dekok Dekok adalah infus pada waktu yang lebih lama (≥30 menit) dan temperatur sampai titik didih air. 2.3 Penapisan Fitokimia Tujuan utama dari penapisan fitokimia adalah mengetahui informasi awal golongan senyawa sehingga memudahkan proses pengisolasiannya. Selain itu juga bertujuan untuk mengetahui apakah suatu jenis tumbuhan tersebut potensial untuk dimanfaatkan. Pendekatan ini meliputi analisa kualitatif kandungan dalam tumbuhan atau bagian tumbuhan (akar, batang, daun, bunga, dan biji) terutama kandungan metabolit sekunder seperti alkaloid, flavonoid, saponin, tanin, antrakuinon, dan glikosida (Harborne, 1987). UIN Syarif Hidayatullah Jakarta 8 Kandungan kimia ekstrak buah parijoto menurut Niswah (2014) dan Wachidah (2013) mengandung senyawa tanin, saponin, flavonoid dan glikosida. 2.4 Lipid Lipid adalah sekelompok senyawa heterogen yang terdiri dari lemak, minyak, steroid, malam (wax), dan senyawa terkait, yang berkaitan lebih karena sifat fisiknya dari pada sifat kimianya. Lipid secara relatif tidak larut dalam air dan dapat larut dalam pelarut nonpolar (eter dan kloroform). Lipid dibagi menjadi lipid sederhana (lemak dan wax), lipid kompleks (fosfolipid, glikolipid, dan lipid kompleks lain), dan prekusor serta turunan lipid (asam lemak, gliserol, steroid, alkohol lain, aldehida, lemak, badan keton, hidrokarbon, vitamin larut lemak, dan hormon (Murray, Granner, dan Rodwell, 2009). Lemak (fat) yang diserap dari makanan dan lipid yang disintesis di hati dan jaringan adiposa harus diangkut ke berbagai jaringan dan organ untuk digunakan dan disimpan. Karena lipid tidak larut dalam air, maka untuk mengangkut lipid dalam plasma darah diperlukan penggabungan lipid nonpolar (trigliserida dan ester kolesterol) dengan lipid amfipatik (fosfolipid dan kolesterol) serta protein untuk menghasilkan lipoprotein yang dapat bercampur dengan air (Murray, Granner, dan Rodwell, 2009). Lipid diangkut di dalam plasma sebagai lipoprotein. Lipid plasma terdiri dari trigliserida (16%), fosfolipid (30%), kolesterol (14%), dan ester kolesterol (36%), serta sedikit asam lemak rantai panjang tak terseterifikasi (asam lemak bebas, FFA) (4%) merupakan lemak plasma yang paling aktif secara metabolik (Murray, Granner, dan Rodwell, 2009). 2.4.1 Lipoprotein Lipoprotein merupakan kompleks antara lipid dengan protein. Lipoprotein mengangkut lipid dari usus sebagai kilomikron dan dari hati sebagai lipoprotein berdensitas sangat rendah atau VLDL (Very Low Density Lipoprotein) ke sebagian jaringan untuk dioksidasi dan ke jaringan adiposa untuk disimpan. Kelainan metabolisme lipoprotein dapat menyebabkan hipo/hiperlipoproteinemia. Lipoprotein terdiri dari inti nonpolar (trigliserida dan ester kolesterol) serta dikelilingi oleh satu lapisan permukaan molekul kolesterol dan fosfolipid amfipatik. Terdapat empat kelompok utama lipoprotein plasma yang telah UIN Syarif Hidayatullah Jakarta 9 diketahui dan penting secara fisiologis dan penting dalam diagnosa klinis, meliputi: kilomikron, VLDL (Very Low Density Lipoprotein), LDL (Low Density Lipoprotein), dan HDL (High Density Lipoprotein) (Murray, Granner, dan Rodwell, 2009). 2.4.1.1 Kilomikron Kilomikron ditemukan dalam kilus yang hanya dibentuk oleh sistem limfe yang mengaliri usus. Kilomikron bertanggung jawab mengangkut semua lipid dari makanan ke dalam sirkulasi. Pembersihan kilomikron dari darah berlangsung cepat, dengan waktu paruh kurang dari satu jam pada manusia. Asam-asam lemak dari triasilgliserol, kilomikron terutama disalurkan 80% ke jaringan adiposa, jantung, dan otot dan 20% ke hati. (Murray, Granner, dan Rodwell, 2009). Pada individu normal, kilomikron terdapat di dalam plasma setelah 3-6 jam mengkonsumsi daging berlemak, namun setelah 10-12 jam kilomikron tidakterdapat lagi di dalam plasma (Gilman, 2012). 2.4.1.2 VLDL (Very Low Density Lipoprotein) VLDL (Very Low Density Lipoprotein) atau pra-β-lipoprotein berasal dari hati untuk ekspor trigliserida ke jaringan ekstrahepatik. Reseptor VLDL berperan penting dalam penyaluran asam lemak dari trigliserida VLDL ke adiposit dengan mengikat VLDL dan membawanya berkontak dengan lipoprotein lipase (Murray, Granner, dan Rodwell, 2009). VLDL memiliki diameter 400-1000 A dan cukup besar untuk menimbulkan kekeruhan plasma, tetapi tidak seperti kilomikron, partikel VLDL tidak mengapung spontan ke permukaan tubular plasma yang didiamkan tanpa diganggu selama 12 jam (Gilman, 2012). Kilomikron dan VLDL dimetabolisme melalui hidrolisis triasilgliserolnya, dan sisa lipoprotein tetap berada di dalam sirkulasi. Sisa lipoprotein ini diserap oleh hati, tetapi sebagian sisa (IDL) yang berasal dari VLDL membentuk LDL yang diserap oleh hati jaringan lain melalui reseptor LDL (Murray, Granner, dan Rodwell, 2009). Faktor-faktor yang meningkatkan sintesis trigliserida dan VLDL oleh hati meliputi; keadaan kenyang, mengkonsumsi diit tinggi karbohidrat terutama sukrosa dan fruktosa yang meningkatkan lipogenesis dan esterifikasi asam lemak, UIN Syarif Hidayatullah Jakarta 10 tingginya kadar asam lemak bebas dalam darah, konsumsi etanol, dan adanya insulin yang tinggi dan kadar glukagon yang rendah sehingga meningkatkan sintesis dan esterifikasi asam lemak serta manghambat oksidasinya (Murray, Granner, dan Rodwell, 2009). 2.4.1.3 LDL (Low Density Lipoprotein) LDL atau β-lipoprotein merupakan lipoprotein berdensitas rendah yang menggambarkan suatu tahap akhir metabolisme VLDL. LDL bertugas menyalurkan kolesterol ke jaringan. Setelah dimetabolisme menjadi IDL, VLDL kemudian dapat diserap oleh hati secara langsung melalui reseptor LDL (apo B100 E) atau dapat diubah menjadi LDL. Hanya terdapat satu molekul apo B-100 di masing-masing partikel lipoprotein dan dipertahankan selama transformasi sehingga setiap partikel LDL berasal dari satu partikel VLDL prekusor. Pada manusia, cukup banyak IDL membentuk LDL dan merupakan penyebab meningkatnya kadar LDL pada manusia dibanding hewan mamalia (Murray, Granner, dan Rodwell, 2009). Hati dan banyak jaringan ekstrahepatik mengeskpresikan reseptor LDL (apo B-100, E). Pada hiperkolestrolemia familial, reseptor ini terganggu sekitar 30% di jaringan ekstrahepatik dan 70 % di hati (Murray, Granner, dan Rodwell, 2009). LDL memiliki waktu paruh 1,5-2 hari, hal ini menyebabkan konsentrasi LDL dalam plasma lebih tinggi dibanding VLDL dan IDL. Penanganan hiperkolesterolemia yang paling efektif melalui diit dan farmakologi bekerja dengan meningkatkan ekspresi reseptor LDL di hati (Gilman, 2012). 2.4.1.4 HDL HDL (High density Lipoprotein) atau α-lipoprotein disintesis di hati dan diekskresikan ke dalam usus. HDL berperan dalam transpor kolesterol bebas keluar jaringan yang dikenal sebagi transport kolesterol balik (reverse cholesterol transport) dan pada metabolisme VLDL dan kilomikron. HDL yang disintesis miskin akan kolesterol dan mengandung Apo A, C, dan E, disebut HDL nascent yang menerima kolesterol bebas. Fungsi utama HDL adalah bertindak sebagai tempat penyimpanan untuk apo C dan E yang dibutuhkan dalam metabolisme UIN Syarif Hidayatullah Jakarta 11 kilomikron dan VLDL. Lipoprotein ini disintesis dalam hati dan usus, namun sintesis di usus terjadi lewat rute tak langsung. Kadar HDL bervariasi secara timbal balik dengan kadar trigliserida plasma dan secara langsung dengan aktivitas lipoprotein lipase yang mungkin disebabkan oleh konstituen permukaan surplus, misanya fosfolipid dan apo A-1 yang dibebaskan sewaktu hidrolisis kilomikron dan VLDL serta ikut membentuk pra β-HDL dan HDL diskoid (Murray, Granner, dan Rodwell, 2009). 2.4.2 Kolesterol Kolesterol terdapat di jaringan dan plasma sebagai kolesterol bebas atau dalam bentuk simpanan, yang berikatan dengan asam lemak rantai panjang sebagai ester kolesterol. Kolesterol meruapakan lipid amfipatik dan merupakan komponen struktural esensial pada membran dan lapisan luar lipoprotein plasma. Senyawa ini disintesis di banyak jaringan dari asetil-koA dan sebagai prekusor semua steroid di dalam tubuh. Sebagai produk tipikal metabolisme hewan, kolesterol terdapat dalam makanan hewani seperti kuning telur, daging, hati dan otak. Kolesterol adalah unsur pokok batu empedu dan sebagai faktor utama pembentukan aterosklerosis arteri-arteri vital, yang menimbulkan penyakit pembuluh darah perifer, koroner, dan serebrovaskuler. Peningkatan kadar kolesterol yang terdapat di VLDL dan IDL, atau LDL menyebabkan aterosklerosis, sedangkan HDL dalam kadar tinggi memberikan efek protektif. (Murray, Granner, dan Rodwell, 2009). Biosintesis kolesterol dapat dibagi menjadi lima tahap : 1. Mevalonat, yang merupakan senyawa enam-karbon, disintesis dari asetil KoA. 2. Unit isoprenoid dibentuk dari mevalonat dengan menghilangkan CO2. 3. Enam unit isoprenoit mengadakan kondensasi untuk membentuk intermediat, skualen. 4. Skualen mengalami siklisasi untuk menghasilkan senyawa steroid induk, yaitu lanosterol. UIN Syarif Hidayatullah Jakarta 12 5. Kolesterol dibentuk dari lanosterol setelah melewati beberapa tahap lanjut, termasuk menghilangnya tiga gugus metil. Sintesis kolesterol dikendalikan oleh regulasi HMG KoA reduktase (Murray, Granner, dan Rodwell, 2009). Setiap hari, sekitar 1 gram kolesterol di keluarkan dari tubuh, separuhnya di dalam tinja setelah mengalami konversi menjadi asam empedu. Sisanya diekskresikan sebagai kolesterol. Koprostanol adalah sterol utama dalam tinja, senyawa ini dibentuk dari kolesterol oleh bakteri di usus di bagian bawah (Murray, Granner, dan Rodwell, 2009). 2.4.3 Trigriserida Trigliserida (triasilgliserol) merupakan ester trihidrat alkohol gliserol dengan asam lemak dan merupakan bentuk simpanan utama asam lemak. Monodan diasilgliserol, tempat satu atau dua asam lemak teresteriifikasi dengan gliserol, juga ditemukan di jaringan. Simpanan trigliseridadi jaringan adiposa terus menerus mengalami lipolisis (hidrolisi) dan re-esterifikasi. Sintesis trigliserida terjadi di hati dan sejumlah kecil di jaringan adiposa. Tahap biosintesis trigliserida berawal dari molekul asil-KoA yang dibentuk dari pengaktifan asam lemak oleh asil-KoA sintase, berikatan dengan gliserol 3-fosfat untuk membentuk fosfatidat (1,2-diasilgliserol fosfat), yaitu, prekusor dalam biosintesis triasilgliserol. Fosfatidat ini akan diubah oleh fosfatidat fosfohidrolase dan diasilgliserol asiltransferase (DGAT) menjadi 1,2-diasilgliserol dan kemudian menjadi triasilgliserol (Murray, Granner, dan Rodwell, 2009). 2.5 Hati 2.5.1 Anatomi, Fisiologi dan Histologi Hati 2.5.1.1 Anatomi Hati adalah kelenjar terbesar di dalam tubuh, yang terletak di bagian teratas dalam rongga abdomen di sebelah kanan di bawah diafragma. Hati secara luas dilindungi iga-iga (Pearce, 2009). Hati terbagi dalam dua belahan utama, kanan dan kiri. Permukaan atas berbentuk cembung dan terletak di bawah diafragma; permukaan bawah tidak rata dan memperlihatkan lekukan, fisura transversus. Permukaannya dilintasi oleh berbagai pembuluh darah yang masuk-keluar hati. Fisura longitudinal UIN Syarif Hidayatullah Jakarta 13 memisahkan belahan kanan dan kiri di permukaan bawah, sedangkan ligamen falsiformis melakukan hal yang sama di permukaan atas hati. Selanjutnya hati dibagi lagi dalam empat belahan (kanan, kiri, kaudata dan kwadrata). Dan setiap belahan atau lobus terdiri atas sel hati berbentuk kubus, dan cabang-cabang pembuluh darah diikat bersama oleh jaringan hati. Hati mempunyai dua jenis persediaan darah, yaitu yang datang melalui arteri hepatika dan yang melalui vena porta (Pearce, 2009). Menurut Pearce (2009), hati disuplai oleh dua pembuluh darah yaitu : a. Arteri hepatika yang keluat dari aorta dan memberikan seperlima darahnya kepada hati. b. Vena porta yang terbentuk dari vena lienalis dan vena mesenterika superior, mengantarkan empat perlima darahnya ke hati. Darah vena porta ini membawa kepada hati zat makanan yang telah diabsorpsi oleh mukosa usus halus. c. Vena hepatika mengembalikan darah dari hati ke vena kava inferior. Di dalam vena hepatika tidak terdapat katup. d. Saluran empedu terbentuk dari penyatuan kapiler-kapiler empedu yang mengumpulkan empedu dari sel hati. 2.5.1.2 Fisiologi Menurut Murray.R.K., Granner, and Rodwell. (2009), fungsi utama hati dalam metabolisme lipid adalah: a. Mempermudah pencernaan dan penyerapan lipid dengan menghasilkan empedu yang mengandung kolestrol dan garam empedu di hati atau dari penterapan kolestrol lipoprotein. b. Secara aktif membentuk dan mengoksidasi asam lemak dan juga membentuk triasilgliserol dan fosfolipid. c. Hati mengubah asam lemak menjadi badan keton (ketogenesis) d. Hati merupakan bagian integral dari sintesis dan metabolisme lipoprotein plasma. 2.5.1.3 Histologi Hati UIN Syarif Hidayatullah Jakarta 14 Secara histologis, hati tersusun atas lobulus-lobulus hati. Lobulus tersebut terdiro dari sel-sel hati (hepatosit) yang tersusun dalam suatu lempeng-lempeng (Corwin, 2000). 2.5.1.3.1 Lobulus Hati Hati terbagi atas dua unit operasional, yaitu lobulus dan asinus. Istilah lobulus lebih sering dipergunakan untuk menjelaskan bagian parenkim hati yang mengalami kerusakan secara patologi (Klassen & Watkins III, 1999). Lobulus tersebut terdiri dari hepatosit yang tersusun dalam suatu lempeng-lempeng (Corwin, 2000). Asinus merupakan istilah yang digunakan untuk menyebut bagian fungsional pada hati. 2.3.1.3.2 Sel Hati Sel hepatosit berbentuk polihedral dengan inti bulat dan terletak di tengah (Delmann & Brown, 1992). Hepatosit tersusun secara radial dari tepi lobulus hingga ke vena sentralis. Sel-sel tersebut beranastomosa dan berbatasan dengan sinusoid-sinusoid berisi darah (Bevalander & Ramaley, 1988). Dinding sinusoid memiliki pori yang cukup besar dan tidak memiliki membran dasar, sehingga materi xenobiotik yang terkandung dalam darah dapat masuk ke hepatosit. Sebaliknya, hepatosit juga dapat mensekresikan substansi berupa protein dan getah empedu ke dalam darah yang mengalir di sinusoid (Sherwood, 2004). 2.5.1.3.3 Vena Sentralis Vena sentralis merupakan bagian tengah dari lobulus hati yang dikelilingi oleh sel-sel hati dan sinusoid yang beranastomosa secara radial (Little., et al , 1941 dalam Kaniawati 2012). Vena sentralis menerima darah yang berasal dari vena porta dan arteri hepatika melalui sinusoid-sinusoid yang mengelilinginya (Corwin, 2000). Aliran darah ke vena sentralis tersebut mengalir melalui sinusoidsinusoid dari bagian tepi lobulus ke bagian tengah lobulus. Aliran tersebut menyebabkan bagian perifer lobulus menerima asupan oksigen dan konsentrasi bahan makanan yang lebih tinggi dibandingkan bagian tengah lobulus. Selain itu, daerah tengah lobulus lebih banyak menerimak substansi toksik dari sel-sel bagian UIN Syarif Hidayatullah Jakarta 15 perifer. Hal tersebut menyebabkan bagian tengah lobulus rentan mengalami hipoksia dan kerusakan (Greep, 1953 dalam Kaniawati 2012). 2.5.2 Peran Hati sebagai Sentral Dalam Transpor dan Metabolisme Lipid Lipid seperti trigliserida dan kolesterilester tidak larut dalam air dan ditranspor dalam plasma pada inti partikel (lipoprotein) yang mempunyai suatu cangkang hidrofilik yang terdiri fosfolipid dan kolestrol bebas. Lapisan permukaan ini distabilisasi oleh satu atau lebih apoliprotein yang juga berperan sebagai ligan untuk reseptor permukaan sel. Sekitar dua pertiga lipoprotein plasm disintesis di hati. Trigliserida disekresi ke dalam darah sebagai VLDL. Di dalam otot dan jaringan adiposa, kapiler-kapiler memiliki suatu enzim yaitu lipoprotein lipase yang menghidrolisis trigliserida menjadi asam lemak, kemudian asam lemak ini memasuki sel otot untuk energi dan adiposit untuk simpanan. Partikel residu yang terdiri dari inti yang kaya akan kolesterilester disebut partikel LDL. Hati dan sel-sel lain memiliki reseptor LDL yang menyingkirkan LDL dari plasma melalui endositosis. Penyingkiran LDL yang diperantarai hati merupakan mekanisme utama untuk mengendalikan kadar LDL plasma (J. Lean, 2005). Asam lemak dan kolestrol dari lemak makanan mengalami reesterifikasi dalam sel mukosa intestin dan membentuk ini kilomikron yang masuk ke dalam plasma melalui duktus torasikus. Asam lemak dihidrolisi dari kilomikron dan lipoprotein lipase dan remnant yang kekurangan trigliserida residu, kemudian disingkirkan oleh hati (J. Lean, 2005). Menurut Murray.R.K., Granner, and Rodwell. 2009, faktor-faktor yang meningkatkan sintesis triasilgliserol maupun sekresi VLDL oleh hati mencakup: 1. Keadaan kenyang 2. Mengonsumsi diit kaya karbohidrat (terutama jika mengandung sukrosa atau fruktosa) sehingga lipogenesis dan esterifikasi asam lemak meningkat. 3. Tingginya kadar asam lemak bebas dalam darah 4. Konsumsi etanol UIN Syarif Hidayatullah Jakarta 16 5. Adanya insulin dengan kadar tinggi dan glukagon dengan kadar rendah yang meningkatkan sintesis dan esterifikasi asam lemak serta menghambat oksidasinya. 2.5.3 Ketidakseimbangan Laju Pembentukan Triasilgliserol dan Ekspornya Menyebabkan Perlemakan Hati Perlemakan hati dibagi menjadi dua kategori utama. Tipe pertama berkaitan dengan peningkatan kadar asam lemak bebas plasma akibat mobilisasi lemak dari jaringan adiposa atau dari hidrolisis triasilgliserol lipoprotein oleh lipoprotein lipase jaringan ekstrahepatik. Pembentukan VLDL tidak dapat mengimbangi meningkatnya influks dan esterifikasi asam lemak bebas sehingga terjadi penumpukan triasilgliserol yang menyebabkan perlemakan hati. Hal ini terjadi selama kelaparan dan mengonsumsi diit tinggi lemak (Murray.R.K., Granner, and Rodwell. 2009) Menurut Murray.R.K., Granner, and Rodwell, 2009, tipe kedua perlemakan hati biasanya disebabkan oleh blok metabolik dalam produksi lipoprotein plasma sehingga terjadi penimbunan triasilgliserol. Secara teoritis, lesi dapat disebabkan oleh: 1. Blok pada sintesis apoliprotein 2. Blok pada sintesis lipoprotein dari lipid dan apoliprotein 3. Kegagalan penyediaan fosfolipid yang ditemukan pada lipoprotein 4. Kegagalan mekanisme sekretorik itu sendiri. 2.6 Hiperlipidemia 2.6.1 Definisi Hiperlipidemia merupakan keadaan dimana terdapat peningkatan kadar lipid dalam darah yaitu trigliserida, kolesterol atau keduanya, sedangkan dislipidemia diartikan sebagai perubahan kadar profil lipid darah dapat meningkat (kolesterol total, trigliserida, LDL) atau menurun HDL (Winter, 2002). Berdasarkan etiologinya, hiperlipidemia dibedakan menjadi 2 yaitu hiperlipidemia primer dan hiperlipidemia sekunder. Hiperlipidemia primer adalah UIN Syarif Hidayatullah Jakarta 17 keadaan peningkatan kadar lemak darah yang tidak ada hubungannya dengan penyakit lain (herediter). Hiperlipidemia primer atau Hiperkolesterolemia Familial (FH) ada dua macam yaitu homozygot dan heterozygot. Hiperlipidemia sekunder merupakan gangguan metabolisme lemak yang dijumpai dalam hubungannya dengan penyakit organik atau metabolik tertentu. Penyebab hiperlipidemia sekunder adalah diabetes melitus, hipotiroidism, minum alkohol yang berlebihan, obesitas, penyakit hati, penyakit ginjal, pankreatitis dan penggunaan obat-obat tertentu (beta blocker, diuretik, kontrasepsi oral estrogen dan gestagen) (Harper, 1990). Tabel 2.1 Klasifikasi Kadar Lipid dalam Plasma (Sumber: Gilman, 2012) Kolesterol Total <200 Optimal 200-239 Diinginkan ≥240 Tinggi Kolesterol LDL <100 Optimal 100-129 Mendekati optimal 130-159 Diinginkan 160-189 Tinggi ≥190 Sangat tinggi Kolesterol HDL <40 Rendah ≥60 Tinggi Trigliserida <150 Optimal 150-199 Diinginkan 200-499 Tinggi ≥500 Sangat tinggi 2.6.2 Obat-obat Untuk Terapi Hiperlipidemia UIN Syarif Hidayatullah Jakarta 18 2.6.2.1 Asam Nikotianat Niasin cenderung mempengaruhi hampir semua parameter lipid. Niasin adalah senyawa yang paling baik yang tersedia untuk meningkatkan HDL-C (peningkatan 30%-40%). Niasin menurunkan trigliserida sebesar 35%-45% dan menurunkan kadar LDL-C sebesar 20%-30%. Niasin menghambat lipolisis trigliserida oleh lipolisis sensitif hormon di jaringan adiposa yang akan mengurangi transpor asam lemak bebas ke hati dan menurunkan sintesis trigliserida di hati. Di dalam hati, niasin mengurangi sintesis trigriselida dengan menghambat sintesis dan esterifikasi asam lemak. Berkuranganya trigliserida juga memberikan pada penurunan VLDL dan menyebabkan berkurangnya kadar LDL. Niasin juga meningkatkan kadar LPL yang mendorong bersihan kilomikron dan trigliserida VLDL. Dua efek samping yang penting untuk diperhatikan adalah terjadinya kulit memerah dan dispepsia yang berakibat terhadap ketidakpatuhan pasien (Gilman, 2012). 2.6.2.2 Statin Statin merupakan senyawa yang paling efektif dan baik toleransinya untuk mengobati dislipidemia. Obat ini merupakan inhibitor kompetitif 3-OH-3metilglutaril koenzim A (HMG-CoA) reduktase yang mengkatalisis tahap awal pembatasan laju pada biosintesis kolesterol. Statin yang lebih kuat (atorvastatin dan simvastatin) dalam dosis tinggi dapat menurunkan kadar trigliserida yang disebabkan naiknya kadar VLDL (Gilman, 2012). Statin mempengaruhi kadar kolesterol darah dengan menghambat pembentukan kolesterol di dalam hati yang menyebabkan peningkatan ekspresi gen reseptor LDL. Efek samping yang perlu diperhatikan adalah terjadinya gangguan pencernaan, miopati, dan gangguan hati. Contoh golongan statin adalah atorsvastatin, simvastatin, lovastatin, dan fluvastatin (Gilman, 2012). 2.6.2.3 Resin Resin adalah salah satu obat hipokolesterolemia yang saat ini disarankan untuk anak berusia 11-20 tahun. Karena statin sangat efektif sebagai monoterapi, resin paling sering digunakan sebagai pilihan kedua jika terapi statin tidak berhasil menurunkan LDL-C secara memadai. Dosis maksimum (24 g kolestiramin atau UIN Syarif Hidayatullah Jakarta 19 30 g kolestipol) dapat menurunkan LDL-C sebesar 25%, tetapi menyebabkan efek samping gastrointestinal yang sangat menganggu bagi pasien (Gilman, 2012). Kolestiramin dan kolestipol mengikat banyak obat lain dan menganggu absorpsi obat tersebut. Obat-obat yang terkena efek ini antara lain beberapa tiazid, furosemid, propanolol, l-tiroksin, beberapa glikosida jantung, antikoagulan kumarin, dan beberapa statin. Contoh golongan resin adalah kolestiramin, kolestipol, dan loesevelam (Gilman, 2012). 2.6.2.4 Asam Fibrat Asam fibrat diduga bekerja dengan cara berikatan dengan reseptor proxisme proliferator-actived receptors (PPARs), yang mengatur transkripsi gen. akibat interaksi obat ini dengan PPAR isotipe α, maka terjadi peningkatan oksidasi asam lemak, sintesis LPL dan penurunan ekspresi Apo C-II. Peninggian kadar LPL meningkatkan klirens lipoprotein yang kaya trigriselida. Semua derivat asam fibrat diabsorbsi lewat usu secara cepat dan lengkap, terutama bila diberikan bersama makanan. Pemecahan ikatan ester terjadi sewaktu absorbsi dan kadar puncak plasma tercapai dalam 1-4 jam (Ganiswara, 1995). Efek samping yang sering ditemukan adalah gangguan saluran cerna. Contoh obat golongan asam fibrat adalah klofibrat, gemfibrat, fenofibrat, sipofibrat, dan bezalfibrat (Ganiswara, 1995). 2.6.3 Induksi Hiperlipid Induksi hiperlipidemia dapat dilakukan secara endogen dan eksogen. Induksi eksogen dilakukan dengan memberikan propiltiourasil yang merupakan antitiroid golongan tioamida. Hormon tiroid berperan dalam mengaktifkan hormon sensitif lipase yang bertanggung jawab terhadap proses katabolisme lipid dalam tubuh, sehingga hewan hipertitoid laju katabolisme lipid di dalam tubuh menjadi tinggi. Propiltiourasil merupakan antitiroid yang dapat menurunkan kadar hormon tiroid, maka pemberian propiltiourasil pada hewan uji dapat menurunkan hormon tiroid sehingga terjadi penurunan laju katabolisme lipid (Tisnadjaja dkk, 2010). Induksi secara eksogen dilakukan dengan pemberian diit tinggi kolesterol dan lemak yang terdiri dari campuran kuning telur, sukrosa dan lemak hewani. UIN Syarif Hidayatullah Jakarta 20 Kuning telur dan lemak hewani merupakan sumber kolestrol dan lemak. Sedangkan sukrosa dapat meningkatkan trigriserilida (Juheini, 2003). UIN Syarif Hidayatullah Jakarta BAB III METODOLOGI PENELITIAN 3.1 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Penelitian I, Penelitian II, Laboratorium Fitokimia, Laboratorium PMC dan Laboratorium Animal House, Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta, Ciputat, sejak bulan Februari hingga Mei 2015. 3.2 Alat Alat-alat yang dgunakan dalam penelitian ini adalah mikroskop, sonde lambung, timbangan analitik (AND, 6M202), timbangan hewan, evaporator (N1001S-W, EYELA-USA), alkoholmeter, waterbath (SB-1000, EYELA-USA), pisau bedah, serta alat-alat gelas (DURAN). 3.3 Bahan 3.3.1 Bahan Uji Buah Medinilla speciosa Blume dengan spesifikasi warna merah muda keunguan dan rasa asam sepat. Buah parijoto yang digunakan pada penelitian ini dikumpulkan pada bulan Oktober 2014 dari Gunung Muria Desa Colo Kecamatan Dewa Kabupaten Kudus. 3.3.2 Hewan Uji Hewan yang akan digunakan dalam penelitian ini adalah tikus galur Sprague Dawley sebanyak 30 ekor, berumur 2 bulan, berjenis kelamin jantan dengan berat 150-200 gram. 3.3.3 Bahan Kimia Bahan kimia yang akan digunakan dalam penelitian ini adalah formalin 10%, Na CMC, eter, simvastatin (Kimia Farma), aquadest, etanol 70%, pereaksi Dragendorff, pereaksi Meyer, HCl pekat, asam sulfat pekat, H2SO4 1 M, , FeCl3, NaCl 10%, FeCl3 0,1%, NaOH, dan kloroform. 21 UIN Syarif Hidayatullah Jakarta 22 3.4 Cara Kerja 3.4.1 Penyiapan Hewan Uji Hewan uji akan diaklimatisasi selama 14 hari dengan tujuan untuk mengadaptasikan hewan uji dengan lingkungannya yang baru dan mengurangi stres pada tikus yang dapat mempengaruhi metabolisme dan mengganggu penelitian. Setiap tikus akan diberi makan dan minum. Pada tahap ini akan dilakukan pengamatan terhadap keadaan umum uji meliputi berat badan dan keadaan fisiknya. Tikus yang akan diikutsertakan dalam percobaan ini adalah tikus yang sehat dengan ciri-ciri mata jernih, bulu tidak berdiri, warna putih bersih, aktif, tingkah laku normal, dan mengalami peningkatan berat badan. 3.4.2 Penentuan Dosis Bahan Uji (Literatur) Penentuan dosis yang digunakan adalah dosis skrining yaitu dosis I (0,9 mg/kgbb/hari), dosis II (9 mg/kgbb/hari), dan dosis III (90 mg/kgbb/hari). Pengujian efek antihiperlipidemia pada ekstrak etanol buah parijoto baru pertama kali dilakukan sehingga belum ada acuan dosis penggunaan ekstrak ini secara langsung sebagai antihiperlipidemia. 3.4.3 Penentuan Dosis Simvastatin Dosis lazim simvastatin pada manusia adalah 10-20 mg/hari (Dipiro, 2009). Dosis simvastatin yang akan digunakan pada percobaan adalah 10 mg/hari. Dosis tikus didapatkan dari perkalian dengan faktor konversi dari manusia ke tikus yaitu 0,018 dan faktor farmakokinetik yaitu 10. Dosis untuk tikus adalah 10 mg x 0,018 x 10 = 1,8 mg/200 g bb per hari. 3.4.4 Penyiapan Bahan Uji 3.4.4.1 Pembuatan Ekstrak Buah parijoto yang digunakan pada penelitian ini dikumpulkan pada bulan Oktober 2014 dari Gunung Muria Desa Colo Kecamatan Dewa Kabupaten Kudus. Selanjutnya dilakukan sortasi untuk dipisahkan dari kotoran-kotoran atau bahanbahan asing sehingga dapat mengurangi jumlah pengotor yang ikut terbawa dalam bahan uji kemudian dicuci dengan air mengalir lalu diangin-anginkan hingga tidak terdapat sisa air. UIN Syarif Hidayatullah Jakarta 23 Buah segar kemudian ditimbang lalu dihaluskan dengan blender. Setelah diblender kemudian buah yang sudah halus dimaserasi dengan etanol 70% selama 24 jam kemudian maserat disaring, lalu dilakukan remaserasi hingga filtrat jernih. Maserat diuapkan menggunakan evaporator dengan suhu 40oC hingga diperoleh ekstrak kental. 3.4.4.2 Skrinning Fitokimia Penapisan fitokimia dilakukan terhadap ekstrak etanol kental. Uji penapisan fitokimia yang dilakukan meliputi uji alkaloid, flavonoid, saponin, tannin, antrakuinon, dan glukosida. Prosedur masing-masing pengujian adalah sebagai berikut (Guevera, 1985 dalam Wachidah, 2013): 1. Identifikasi Alkaloid Ekstrak kental ditimbang sebanyak 10 mg, lalu ditambahkan 10 mL kloroform diaduk rata. Campuran disaring kedalam tabung reaksi. Kemudian ditambahkan 0,5 mL H2SO4 1 M dan dikocok baik-baik, dibiarkan beberapa saat. Lapisan atas yang jernih dipipet kedalam 2 tabung reaksi kecil. Salah satunya diberikan pereaksi Dragendorff dan tabung lainnya pereaksi Meyer 2-3 tetes. Reaksi positif apabila menunjukan endapan kuning jingga (orange) dengan pereaksi Dragendorff dan endapan putih dengan perekasi Meyer. 2. Identifikasi Flavonoid Ekstrak kental ditimbang sebanyak 10 mg, ditambahkan 20 mL etanol dan dipipet 10 mL larutan ke dalam tabung reaksi lain. Campuran ditambahkan 0,5 mL HCl pekat, 3-4 butir magnesium dan ditambahkan 1 mL amil alkohol. Kocok kuat-kuat dan biarkan beberapa saat kemudian amati perubahan warna pada masing-masing lapisan pelarut. Apabila terjadi pembentukan atau perubahan warna menunjukkan reaksi positif terhadap flavonoid dan sianidin. 3. Identifikasi Saponin Ekstrak kental ditimbang sebanyak 10 mg, lalu ditambahkan 10 mL air panas. Selanjutnya dikocok kuat selama 10 detik, akan terbentuk buih yang mantap setinggi 1-10 cm selama 10 menit. Kemudian ditambahkan 1 tetes HCl 2N dan diamati. UIN Syarif Hidayatullah Jakarta 24 4. Identifikasi Tanin Identifikasi tannin menggunakan metode feri klorida dengan cara menimbang ekstrak sebanyak 10 mg, kemudian ditambahkan 20 ml air panas dan 5 tetes larutan NaCl 10%. Campuran dibagi menjadi 2 tabung reaksi, salah satunya sebagai kontrol negatif dan lainnya ditambahkan larutan FeCl3 1% sebanyak 3 tetes. Perubahan warna diamati, dimana jika warna yang terbentuk biru atau biru-hitam menandakan tannin terhidrolisa. Sedangkan kondensasi tannin akan memberikan warna biru-hijau dan dibandingkan dengan kontrol. 5. Identifikasi Senyawa Glikosida Indentifikasi senyawa glikosida menggunakan metode Keller-Killiani dengan cara menimbang ekstrak sebanyak 10 mg lalu ditambahkan 3 ml pereaksi FeCl3 kemudian diaduk dan dipindahkan campuran ke dalam tabung reaksi. Diteteskan 1 ml larutan asam sulfat pekat melalui dinding tabung reaksi. Biarkan campuran beberapa lama sehingga terbentuk warna dari merah kecoklatan, yang mungkin berubah menjadi biru atau lembayung. Perubahan tersebut menunjukkan reaksi positif terhadap 2-deoksi-gula. 6. Identifikasi Terpenoid Sebanyak 0,5 g ekstrak ditimbang kemudian ditambahakan 2 ml klorofom. Sebanyak 3 ml H2SO4 ditambahkan dengan hati-hati untuk membentuk lapisan. Perubahan warna menjadi coklat kemerahan pada antar lapisan mengindikasikan adanya terpenoid. 3.4.4.3 Uji Kadar Air Uji kadar air dilakukan untuk mengetahui sisa kandungan air di dalam ekstrak. Sebanyak 1 g ekstrak etanol 70% dimasukkan ke dalam cawan porselen yang telah ditara secara terpisah kemudian dikeringkan dalam oven 105 oC selama 5 jam dan ditimbang. Pengeringan dilanjutkan kemudian ditimbang lagi pada 1 jam berikutnya sampai perbedaan antara penimbangan berturut-turut tidak lebih dari 0,25% (Depkes RI, 2000). UIN Syarif Hidayatullah Jakarta 25 3.4.4.4 Uji Antioksidan Kualitatif (Conforti et al., 2008 dalam Wachidah, 2013) Uji aktivitas antioksidan dilakukan dengan metode penangkal radikal bebas (DPPH). 3.4.4.4.1 Pembuatan Larutan Uji Ekstrak dibuat dengan konsentrasi 100 ppm kemudian dilarutkan dengan etanol 70% hingga 5 mL. 3.4.4.4.2 Pembuatan Larutan Vitamin C Vitamin C dibuat dengan konsentrasi 50 ppm lalu dilarutkan dengan etanol 70% hingga 10 ml. 3.4.4.4.3 Pembuatan Larutan DPPH 0,5 mM DPPH ditimbang sebanyak 2 mg kemudian dilarutkan dengan etanol 70%. 3.4.4.4.4 Pengujian Kualitatif Aktivitas Antioksidan Larutan uji diambil sebanyak 1 mL kemudian ditambahkan 1 mL laruran DPPH 0,5 mM dan ditambahkan etanol 70% sebanyak 3 mL, didiamkan selama 30 menit (untuk kontrol negatif, larutan sampel diganti dengan etanol 70%). Setelah 30 menit, amati perubahan warna yang terjadi. 3.4.4.5 Pembuatan Suspensi Ekstrak Etanol 70% Parijoto Ekstrak etanol 70% bauh parijoto sesuai dengan dosis yang telah ditentukan disuspensikan dengan Na CMC 0,5%. Pembuatan suspensi ini dimulai dengan dosis tertinggi yaitu 90 mg ekstrak kental/200 g bb (dosis I). Dosis II dan dosis III diperoleh dengan cara mengencerkan dosis I. Suspensi yang sudah dibuat nantinya kan diberikan peroral ke hewan uji dengan volume yang disesuaikan dengan berat badan (Lampiran 2). 3.4.4.6 Pembuatan Suspensi Simvastatin Pada uji efek antihiperlipidemia tetapi menggunakan ekstrak yang berbeda, Simvastatin akan disuspensikan dengan konsentrasi 0,18% b/v dalam larutan Na CMC 0,5%. Tiap 3 ml suspensi simvastatin, mengandung 1,8 mg simvastatin (Lampiran 2) (Purwanti, 2012). UIN Syarif Hidayatullah Jakarta 26 3.4.4.7 Pembuatan Larutan Na CMC 0,5% Larutan Na CMC yang akan dibuat dengan cara menimbang Na CMC sejumlah 0,5 g dan dikembangkan dalam akuades dengan dipanaskan pada suhu 60oC sebanyak 10 ml (20 kali berat Na CMC) selama 30 menit lalu dihomogenkan. Volume larutan dicukupkan hingga 100 ml kemudian dihomogenkan kembali (Lampiran 3) (Purwanti, 2012). 3.4.4.8 Pembuatan Makanan Diit Tinggi Kolesterol dan Lemak Menurut Purwanti (2012) makanan diit tinggi kolesterol dan lemak yang diberikan ke hewan uji dibuat dengan komposisi kuning telur sebesar 80%, sukrosa 65% sebesar 15%, dan lemak hewan sebesar 5%. Dibuat dalam bentuk emulsi, semua bahan dicampurkan, kemudian dikocok dengan kecepatan tinggi hingga homogen dan dibuat baru setiap hari dan diberi peroral ke hewan uji dengan volume yang sesuai dengan berat badan (Lampiran 4). Induksi makanan diit tinggi kolesterol dan lemak diberikan satu hari sekali pada pagi hari. 3.4.5 Pelaksanaan Percobaan 3.4.5.6 Pengelompokan Hewan Uji dan Perlakuan Menurut kriteria World Health Organization (WHO), jumlah sampel minimal tiap kelompok hewan coba adalah 5 ekor. Dalam penelitian ini digunakan 5 ekor tikus disetiap kelompok dengan jumlah 6 buah kelompok. Kelompok tersebut terdiri dari kelompok normal, induksi, simvastatin, dan kelompok dosis. Kelompok kontrol normal bertujuan untuk mengetahui tikus yang tidak mengalami hiperlipidemia, sedangkan kelompok kontrol simvastatin digunakan sebagai kelompok pembanding untuk melihat perbandingan pengaruh bahan uji dengan obat yang telah diketahui efektif dalam menurunkan kadar lipid. Kelompok dosis dibuat dalam 3 variasi dosis untuk melihat secara signifikan lipid pada jaringan hati. Setiap kelompok akan diberi perlakuan selama 42 hari dengan rancangan perlakuan yang tercantum pada tabel 3.2 UIN Syarif Hidayatullah Jakarta 27 Tabel 3.2 Kelompok Perlakuan No. Kelompok 1. Kontrol normal Kontrol Induksi kolesterol dan lemak 2. Jumlah Perlakuan tikus Hari ke 1-42 (ekor) 5 Diberi larutan Na CMC 0,5% 5 3. Kontrol simvastatin 5 4. Dosis I (0,9 mg/Kgbb) 5 5. Dosis II (9 mg/Kgbb) 5 6. Dosis III (90 mg/Kgbb) 5 Diberi induksi kolesterol dan lemak 2,5 g/200 g bb/hari Diberi induksi kolesterol dan lemak 2,5 g/200 g bb/hari, suspensi simvastatin 1,8 mg/200 g bb Diberi induksi kolesterol dan lemak 2,5 g/200 g bb/hari, suspensi ekstrak uji dosis I Diberi induksi kolesterol dan lemak 2,5 g/200 g bb/hari, suspensi ekstrak uji dosis II Diberi induksi kolesterol dan lemak 2,5 g/200 g bb/hari, suspensi ekstrak uji dosis III Keterangan : Selama 42 hari kelompok kontrol normal akan diberikan Na CMC 0,5%, sedangkan kelompok kontrol induksi, simvastatin, dosis I, II, III diberikan makanan diit tinggi kolesterol dan lemak 2,5 g/200 g bb pada pagi hari pukul 07.00. Setelah 9 jam, diberikan larutan Na CMC 0,5% untuk kelompok kontrol normal, ekstrak buah parijoto untuk kelompok dosis I, II, III dan suspensi simvastatin untuk kelompok kontrol simvastatin. 3.4.5.7 Pengamatan Berat Badan Hewan Uji Hewan uji yang akan dikelompokkan dan diberi perlakuan, juga akan dilakukan pengamatan berat badan dengan cara menimbang semua hewan uji pada setiap kelompok perlakuan setiap hari selama 42 hari. Pengamatan peningkatan berat badan dilakuakn perminggu atau pada hari ke-7, ke-14, ke-21, ke-28, ke-35, dan ke-42. 3.4.5.8 Pengambilan Jaringan Hati UIN Syarif Hidayatullah Jakarta 28 Pengambilan jaringan hati dilakukan pada hari ke-43. Hewan uji tersebut di terminasi dengan menggunakan eter. Lalu tikus dibedah di bagian abdomen dan diambil organ hatinya bagian lobus kanan. Organ hati tikus direndam dengan formalin 10%. Preparasi jaringan hati dilakukan di Laboratorium Histologi Fakultas Kedokteran Universitas Indonesia. 3.4.5.9 Pengamatan Histologi Hati Hasil pemeriksaan preparat dianalisis secara deskriptif dan untuk membandingkan keseluruhan gambaran preparat dilakukan pengamatan hepatosit pada 5 lapang pandang. Preparat dilihat dengan mikroskop perbesaran 10 x 40 (Anggraini, 2014). Parameter yang diamati adalah degenerasi lemak sel hati di sekitar vena sentral dan sinusoid. Penilaian yang dilakukan adalah menghitung jumlah sel yang normal, sel steatosis (sel yang mengalami perlemakan) dan sel nekrosis, selanjutnya dilakukan analisis statistik dengan menggunakan one-way ANOVA (Kaniati, 2012). UIN Syarif Hidayatullah Jakarta BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil dan Pembahasan Penelitian 4.1.1 Ekstraksi Buah Parijoto Buah parijoto sebanyak 1.950 gram diekstraksi dengan 15 liter etanol 70% didapatkan ekstrak kental sebesar 54,409 gram dengan rendemen 2,790%. Setelah didapatkan ekstrak kental kemudian di keringkan dengan cara freeze-dried didapatkan ekstrak kering sebesar 33,486 gram. Rendemen yang dihasilkan dari ekstraksi buah parijoto relatif kecil kemungkinan karena faktor pemilihan pelarut. Hasil penelitian yang dilakukan Wachidah (2012) yang menggunakan metanol sebagai pelarut menghasilkan rendemen sebesar 4,60% di mana adanya perbedaan pelarut mempengaruhi jumlah ekstrak yang dihasilkan. Buah parijoto segar diekstraksi dengan metode maserasi. Pelarut yang digunakan adalah etanol 70%. Menurut Depkes RI tahun 2000 tentang penggunaan etanol sebagai pelarut, penelitian ini menggunakan hewan uji sehingga bila digunakan pelarut lain, seperti metanol yang penggunaannya dihindari karena sifatnya yang toksik akut dan kronik. 4.1.2 Uji Penapisan Fitokimia Ekstrak kental buah parijoto kemudian dilakukan penapisan fitokimia untuk mengetahui kandungan kimia ekstrak. Tabel 4.3. Hasil uji penapisan fitokimia ekstrak kental No. Metabolit Sekunder Ekstrak Kental 1. Alkaloid - 2. Saponin + 3. Tanin + 29 UIN Syarif Hidayatullah Jakarta 30 4. Flavonoid + 5. Glikosida + 6. Terpenoid - Keterangan : ( + ) = Ada ( - ) = Tidak Ada Skrining fitokimia yang dilakukan merupakan jenis analisis kualitatif yang hanya mengidentifikasi keberadaan suatu senyawa tanpa menentukan kadarnya (Harvey, 2000). Dari hasil penapisan fitokimia pada uji saponin, tanin, flavonoid, dan glikosida memberikan hasil positif. Sedangkan pada uji alkaloid dan terpenoid memberikan hasil negatif. Secara organoleptis ekstrak etanol 70% buah parijoto berupa serbuk kering, berbau aromatik, berwarna coklat kemerahan, dan terasa pahit. Hasil tersebut sesuai dengan yang telah dilakukan oleh penelitian sebelumnya yaitu Wachidah (2012) dan Niswah (2013). Pada uji tanin diperoleh hasil positif, adanya tanin akan mengendapkan protein pada gelatin. Tanin bereaksi dengan gelatin membentuk kopolimer mantap yang tidak larut dalam air (Harborne, 1996 dalam Marliana et al 2005). Pada uji saponin diperoleh hasil positif . Busa yang timbul menunjukkan adanya glikosida yang mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi glukosa dan senyawa lainnya (Rusdi, 1990 dalam Marliana et al 2005). Pada uji flavonoid memberikan hasil positif. Adanyaa flavonoid dapat dilakukan dengan metode wilstater sianidin. Uji wilstater sianidin biasa digunakan untuk mendeteksi senyawa yang mempunyai inti alfa-benzophiron. Warna merah yang terbentuk pada uji wilstater disebabkan karena terbentuknya garam flavilium (Ahmad, 1986 dalam Marlina et al., 2005). 4.1.3 Uji Kadar Air Uji kadar air dilakukan terhadap ekstrak etanol 70% buah parijoto pada suhu 105oC hingga bobot tetap. Hasil uji susut pengeringan dapat dilihat pada tabel 4.4. UIN Syarif Hidayatullah Jakarta 31 Tabel 4.4. Hasil uji kadar air ekstrak buah parijoto No. Berat Awal Berat Akhir Kadar Air Ekstrak (g) Ekstrak (%) (g) 1. 1,001 0,94 6,093 2. 1,000 0,92 8,000 Rata-rata 7,047 Pada ekstrak buah parijoto dilakukan uji kadar air untuk memberikan batasan minimal atau rentang besarnya kandungan air dalam bahan (Depkes RI, 2000) dan karena sampel yang digunakan merupakan sampel segar sehingga perlu dicek kandungan air yang terdapat dalam ekstrak (Wachidah, 2012). Ekstrak yang digunakan adalah ekstrak kental dan batas kadar air untuk ekstrak kental yaitu 530% (Voigt, 2004 dalam Saifudin, A., Rahayu, dan Teruna 2011). 4.1.4 Uji Antioksidan Uji aktivitas senyawa antioksidan dilakukan dengan metode radical scavenger atau penangkal radikal bebas (DPPH). Metode DPPH (2,2-difenil-1pikrilhidrazil) dilakukan berdasarkan kemampuan antioksidan untuk menghambar radikal bebas dengan mendonorkan atom hidrogen kepada DPPH, yang merupakan radikal bebas yang stabil pada suhu kamar. Metode DPPH ini dipilih karena merupakan metode yang cepat, sederhana, dan murah untuk melihat aktivitas antioksidan (Prakash et al., 2001 dalam Wachidah, 2013). UIN Syarif Hidayatullah Jakarta 32 Keterangan : (A) Larutan Ekstrak, (B) dan (C) Larutan Vitamin, (D) dan (E) Larutan Uji, (F) Larutan DPPH. Gambar 4.2 Hasil Uji Antioksidan Kualitatif Uji antioksidan kualitatif didapatkan perubahan warna menjadi kuning pada larutan uji. Pengujian antioksidan secara kualitatif menghasilkan warna kuning pada larutan uji. Hal ini dikarenakan senyawa DPPH yang berwana ungu dengan adanya delokalisasi elektron pada atom nitrogen menjadi kuning setelah direaksikan dengan senyawa antioksidan (Reynetson, 2007). Aktivitas antioksidan ini berhubungan dengan adanya senyawa flavonoid dan tanin yang terdapat dalam ekstrak parijoto (Meenakshi et al., 2012). Hal ini juga dipaparkan oleh Dubey (2015), bahwa flavonoid dan tanin memiliki aktivitas antioksidan. 4.1.6 Pengamatan Berat Badan Hewan Pada penelitian dilakukan pengamatan berat badan hewan uji setiap minggu selama 6 minggu. Grafik perubahan Berat badan ditunjukkan oleh Gambar 4.2. UIN Syarif Hidayatullah Jakarta 33 Gambar 4.3 Grafik peningkatan berat badan hewan uji Dari grafik di atas memperlihatkan kenaikan berat badan pada kelompok hiperlipid perminggu, sedangkan pada kelompok lain terjadi kenaikan badan yang fluktuatif setiap minggunya. 4.1.7 Makanan Induksi Kolesterol dan Lemak Komposisi makanan induksi kolesterol dan lemak adalah campuran kuning telur 80%, larutan sukrosa 65% sebanyak 15%, dan lemak hewan 5%. Komposisi ini telah dilakukan pada penelitian sebelumnya oleh Nurcahyaningtias (2012) dan Purwanti (2012) menghasilkan kenaikan kadar kolestrol total dan trigliserida secara bermakna. Kuning telur dan lemak hewan yang digunakan berasal dari ayam ras. Kandungan kolesterol kuning telur dan lemak hewan yang berasal dari ayam ras memiliki kadar kolestrol cukup tinggi sekitar 290 mg – 732 mg (Saidin, 2000). Pada penelitian sebelumnya oleh Juheini (2003) dan Purwanti (2012) juga menggunakan kuning telur dan lemak hewan dari ayam ras. Pengambilan lemak hewan dari kulit ayam ras dilakukan dengan memanaskan kulit ayam dalam api kecil. Kemudian setelah minyak yang berwarna kuning keluar ditampung dalam wadah kedap udara serta terhindar dari cahaya untuk menghindari oksidasi lemak (Nurcahyaningtias, 2012). UIN Syarif Hidayatullah Jakarta 34 Pemberian induksi kolesterol dan lemak secara eksogen dipilih karena hewan uji ingin dibuat sebagai model hiperlipidemia seperti yang dialami penderita hiperlipidemia yaitu pola makan yang tidak sehat dengan mengkonsumsi makanan yang banyak mengandung kolesterol. Selain itu juga karena bahan-bahan yang diperlukan mudah didapatkan dan harganya lebih murah. 4.1.8 Pelaksanaan Percobaan Antihiperlipidemia Dalam penelitian, tikus dibagi menjadi 6 kelompok yaitu kelompok normal yang hanya diberikan Na CMC, kelompok induksi kolesterol dan lemak, kelompok dosis dan kelompok simvastatin. Simvastatin digunakan sebagai kontrol pembanding mengacu pada Nurcahayaningtias (2012) dan Purwanti (2012). Percobaan ini dilakukan selama 42 hari (6 minggu) disesuaikan dengan dengan tujuan untuk memastikan bahwa hewan percobaan sudah mengalami hiperlipidemia. Penelitian yang sama juga dilakukan oleh Juheini (2003) yang juga menguji efek antihiperlipidemia selama 42 hari dan mengalami hiperlipidemia. Lamanya percobaan juga disesuaikan dengan simvastatin yang dapat memberikan efek terapi maksimum dalam 4-6 minggu (28-42 hari) terhadap penurunan kadar kolesterol total dan trigliserida (Ascent, 2012). Induksi kolesterol dan lemak diberikan kepada hewan uji dalam bentuk emulsi melalui sonde lambung satu hari sekali pada pagi hari. Rentang waktu yang dibutuhkan antara pemberian induksi kolesterol dan lemak dengan pemberian simvastatin atau ekstrak buah parijoto adalah ± 9 jam. Hal ini dikarenakan ketika diberikan induksi pada pagi hari, sintesis kolesterol berlangsung 9 jam setelah pemberian induksi (Edwards et al., 1972 dalam Santosa et al., 2006). Pada hari ke-43 dilakukan terminasi pada hewan uji. Bagian abdomen tikus dibedah dan diambil organ hatinya. Organ hati ditimbang lalu direndam menggunakan formalin. Pada hari ke-44, formalin 10% diganti dengan formalin 10% yang baru dan dimasukkan kedalam botol gelap. Preparasi histologi hati tikus dilakukan di Laboratorium Histologi Fakultas Kedokteran Universitas Indonesia. UIN Syarif Hidayatullah Jakarta 35 4.1.9 Pengamatan Histologi Hati Parameter pengamatan histologi hati dilihat adalah degenerasi lemak sel hati di sekitar vena sentral dan sinusoid. Sel hati yang lihat adalah sel yang normal, sel steatosis (sel yang mengalami perlemakan) dan sel nekrosis (Kaniati, 2012). Preparat dilihat menggunakan perbesaran 10 x 40 dengan 5 lapang pandang dan dilakukan penilaian dengan cara menghitung jumlah sel yang normal, nekrosis, dan steatosis lalu dijadikan persentase. Sel steatosis adalah sel yang mengalami perlemakan dengan ditandai dengan inti sel yang terdorong ke pinggir karena adanya lemak. Sel nekrosis adalah sel yang rusak ditandai dengan sudah tidak adanya inti didalam sel. Hasil penilaian degenerasi lemak sel hati hewan percobaan dapat diamati pada tabel 4.5. Analisis dilakukan dengan menggunakan one way ANOVA dengan nilai signifikansi p≤0,05. Tabel 4.5 Penilaian Degenarasi Lemak Sel Hati Hewan Percobaan Rata-rata Kelompok Normal Normal Steatosis Nekrosis 39.58 28.03 32.39 Hiperlipid 10.55 50.52 40.38 Simvastatin 23.25 45.21 31.54 Dosis 1 39.42 29.97 30.61 Dosis 2 38.50 35.89 25.61 Dosis 3 47.52 29.54 22.94 SD 13.60 9.33 6.05 Analisis statistik terhadap perbandinan penilaian sel yang normal pada semua kelompok berbeda nyata (p≤0,05), sehingga analisis dilanjutkan menggunakan uji Least Significant Difference (LSD). Dari hasil uji LSD, diketahui bahwa data penilaian sel normal berbeda secara nyata (p<0,05) antara kelompok hiperlipid dengan kelompok dosis 3. Data penilaian sel normal pada UIN Syarif Hidayatullah Jakarta 36 kelompok dosis 1, 2, dan 3 tidak berbeda secara nyata (p>0,05) antar semua kelompok. Analisis statistik terhadap penilaian sel steatosis semua kelompok diperoleh hasil bahwa data penilaian sel steatosis semua kelompok berbeda nyata (p≤0,05), sehingga analisis dilanjutkan menggunakan uji Least Significant Difference (LSD). Dari hasil uji LSD diketahui bahwa data penilaian sel steatosis berbeda secara nyata (p<0,05) antara kelompok normal dengan hiperlipid, kelompok hiperlipid dengan dosis 1, dan kelompok hiperlipid dengan dosis 3. Analisis statistik terhadap penilaian sel nekrosis semua kelompok diperoleh hasil bahwa data penilaian sel steatosis semua kelompok tidak berbeda nyata (p≥0,05). Gambaran histologi hati diamati menggunakan mikroksop dengan perbesaran 10 x 40. Pengamatan tersebut dilakukan untuk melihat perlemakan yang terjadi pada histologi hati kelompok kontrol Na CMC, kontrol hiperlipidemia, kontrol simvastatin, dosis I, II, dan III. KN1 KN2 KN3 KH1 KH2 KH3 UIN Syarif Hidayatullah Jakarta 37 KS1 KS2 KS3 D1P1 D1P2 D1P3 D2P1 D2P2 D2P3 D3P1 Keterangan : SN : Sel Normal N : Sel Nekrosis SS : Sel Steatosis VS : Vena Sentral D3P2 D3P3 Gambar 4.4 Pengamatan Mikroskopi Histologi Hati Hewan Percobaan Gambaran histologi hati kelompok kontrol Na CMC pada tikus 1 dapat dilihat pada gambar 4.4 KN1. Gambar tersebut memperlihatkan sinusoid memancar secara sentrifugal dari vena sentral. Hepatosit yang terdapat pada gambar tersebut menunjukkan sel yang normal (Wulandari, 2012). Pada gambar UIN Syarif Hidayatullah Jakarta 38 4.4 KN2 dan KN3 memperlihatkan sinusoid yang tidak memancar secara sentrifugal dan terdapat sel steatosis. Inti sel pada sel steatosis berada di tepi karena terdesak oleh adanya lemak yang memenuhi bagian sitoplasma sel (Wulandari, 2012). Gambaran histologi kelompok kontrol hiperlipid tikus 1 dan 2 dilihat pada gambar 4.4 KH1 dan KH3 terdapat degenerasi lemak karena adanya sel steatosis dan sinusoid tidak beraturan. Pada gambar 4.4 KH2 juga terdapat sel steatosis dan sinusoid tidak beraturan serta tampak melebar. Degenerasi lemak sel hati dapat menyebabkan terjadinya perubahan susunan sel sehingga sel tidak mampu kembali kekeadaan semula dan menyebabkan sinusoid melebar (Oktaviana, 2005 dalam Wulandari 2012). Hasil pengolahan data statistik sel stetaosis didapati perbedaan secara nyata (p<0,05) antara kelompok hiperlipid dengan kelompok normal. Berdasarkan hal tersebut dapat disimpulkan induksi kolesterol dan lemak sudah dapat membuat perlemakan hati. Gambaran histologi kelompok kontrol simvastatin menunjukkan gambaran yang sama pada ketiga preparat tersebut. Pada gambar 4.4 KS1, KS2, dan KS3 terdapat sinusoid yang tidak beraturan dan sel steatosis. Pada ketiga gambar tersebut sudah mulai mengalami perbaikan dengan ditandai dengan sinusoid yang tidak tampak melebar seperti gambar 4.4 KH2. Hasil pengolahan data dari sel normal, sel steatosis, dan sel nekrosis tidak terdapat perbedaan secara nyata (p>0,05) terhadap kelompok hiperlipid. Sehingga dapat disimpulkan adanya efek dari simvastatin terhadap terjadinya perlemakan hati tetapi tidak terlihat signifikan. Gambaran histologi kelompok dosis 1 yang diberikan ekstrak parijoto sebanyak 0,9 mg/kgBB. Pada ketiga gambar sudah memperlihatkan perbaikan dengan ditandai sinusoid yang mulai beraturan dan sedikit mengalami pelebaran dibandingkan dengan gambar KH2. Sel steatosis masih terlihat pada ketiga gambar tersebut. Hasil pengolahan data sel steatosis pada kelompok dosis 1 berbeda secara signifikan dengan kelompok hiperlipid (p<0,05). Sehingga dapat disimpulkan dosis 1 (0,9 mg/kgBB) sudah dapat sedikit mengurangi perlemakan hati. UIN Syarif Hidayatullah Jakarta 39 Gambaran histologi kelompok dosis 2 yang diberikan ekstrak parijoto sebanyak 9 mg/kgBB. Pada gambar 4.4 D2P1 dan D2P3 sudah mulai mengalami perbaikan ditandai dengan sinusoid yang mulai beraturan dan tampak sedikit melebar. Pada gambar 4.4 D2P2 sinusoidnya masih terlihat tidak beraturan dan terdapat sel yang nekrosis, kemungkinan masih mengalami degenarasi lemak. Hasil pengolahan data sel normal, sel steatosis dan sel nekrosis pada kelompok dosis 2 tidak berbeda secara nyata (p>0,05) terhadap kelompok hiperlipid. Berdasarkan uraian diatas dapat disimpulkan bahwa dosis 2 (9 mg/kgBB) sudah dapat mengurangi perlemakan hati tetapi belum signifikan. Gambaran histologi kelompok dosis 3 yang diberikan ekstrak parijoto sebanyak 90 mg/KgBB. Pada ketiga gambar sudah terlihat perbaikan dengan ditandai oleh sinusoid yang memancar secara sentrifugal dan sudah mulai terlihat sel hepatosit normal. Hasil pengolahan data sel normal dan sel steatosis pada kelompok dosis 3 mengalami perbedaan secara nyata (p<0,05) terhadap kelompok hiperlipid. Berdasarkan uraian diatas dapat disimpulkan, dosis 3 lebih banyak mengurangi perlemakan hati dibandingkan dengan dosis 1 dan dosis 2. Berdasarkan hasil pengamatan gambaran histologi hati terdapat beberapa tanda perlemakan hati seperti sinusoid melebar dan tidak beraturan, sel steatosis, dan sel nekrosis. Perlemakan tersebut terjadi akibat makanan kolesterol dan lemak yang diinduksikan selama 42 hari. Ketika lipid, karbohidrat atau protein meningkat dalam tubuh, beberapa jaringan akan langsung mengambil dan menyimpannya. Kadar lipid yang tinggi dalam darah dapat menyebabkan penyerapan lemak ke dalam dinding pembuluh darah serta ke dalam hati (Bullock, 2013). Campuran kuning telur dan lemak hewan merupakan sumber kolesterol dan lemak yang dapat meningkatkan kadar kolesterol dan lemak secara eksogen (Nurcahayaningtyas, 2012). Larutan sukrosa yang didalamnya terkandung glukosa akan mengalami glikolisis menjadi piruvat dan piruvat akan terdekarboksilasi oksidatif menjadi asetil koA dan menghasilkan energi. Jika kebutuhan energi sudah terpenuhi maka asetil koA akan mengalami lipogenesis menjadi asam lemak dan disimpan sebagai trigliserida. Penumpukan trigliserida yang akan menyebabkan perlemakan hati (Murray. R. K., Granner, and Rodwell. 2009). UIN Syarif Hidayatullah Jakarta 40 Degenerasi lemak juga bisa terjadi karena terdapat penurunan aktifitas enzim LPL dalam menghidrolisa VLDL yang mengakibatkan butiran trigliserida terakumulasi dalam sel hati (Goldberg, 2001). Pembentukan radikal bebas menyebabkan sel tidak mampu mengeluarkan trigliserida sehingga terjadi degenerasi lemak. Peningkatan kadar radikal bebas lebih jauh akan menyebabkan terjadinya nekrosis (Porth and Matfin, 2008). Akumulasi lipid didalam sel hati dikarenakan gangguan insufisiensi enzim atau enzim yang tidak aktif. Akumulasi lipid ini termasuk kedalam penyakit penyimpanan pada lisosom karena melibatkan penyimpanan lipid didalam lisosom. Peningkatan penyimpanan lipid pada lisosom akan ditemukan di dalam sel hati. Akumulasi lipid di dalam sel hati menyebabkan perlemakan hati (McCance, 2014) Mekanisme terjadinya penumpukan lipid di dalam sel yaitu (1) Peningkatan asam lemak bebas ke dalam hati (peningkatan kerusakan trigliserida di dalam jaringan adiposa dan melepaskan asam lemak kemudian masuk ke dalam sel hati), (2) Proses metabolisme yang gagal untk merubah asam lemak ke fosfolipid, mengakibatkan perubahan asam lemak menjadi trigliserida, (3) Peningkatan sintesis trigliserida dari asam lemak karena peningkatan enzim alfa gliserofosfat yang berhubungan dengan sintesis trigliserida, (4) Penurunan sintesis apoprotein, (5) Gagalnya proses pengikatan antara lipid dengan apoprotein and lipoprotein, (6) Mekanisme perpindahan lipoprotein ke luar sel (McCance, 2014). Pada kelompok kontrol simvastatin terjadi perbaikan perlemakan hati dikarenakan golongan statin dapat menurunkan kolesterol total 20% - 45% dan menurunkan trigliserida 10%-45% (Walker, 2003). Obat ini merupakan inhibitor kompetitif 3-OH-3-metilglutaril koenzim A (HMG-CoA) reduktase yang mengkatalisis tahap awal pembatasan laju pada biosintesis kolesterol. Sehingga dapat terjadi pengurangan perlemakan hati. Pada kelompok dosis I, II, dan II juga terjadi perbaikan terhadap perlemakan hati. Perbaikan tersebut kemungkinan karena senyawa tanin, saponin, dan flavonoid yang terdapat dalam ekstrak buah parijoto. Tanin mampu mengurangi penimbunan kolesterol dalam darah dan mempercepat pembuangan kolesterol melalui feses (Rahayu, 2005 dalam UIN Syarif Hidayatullah Jakarta 41 Umarudin, 2012). Aktivitas senyawa tanin dapat mencegah terjadinya gangguan keseimbangan antara produksi oksidan dan antioksidan terkait dengan konsumsi radikal bebas. Mekanisme tanin dalam ekstrak parijoto kemunginan adalah menurunkan kadar kolesterol total dengan menghambat oksidasi LDL (Sukandar, 2006). Sehingga dari kemungkinan mekanisme tanin tersebut membuat pengurangan terhadap perlemakan hati. Pada penelitian Gross (2004) tentang flavonoid dan penyakit kardiovaskuler, kandungan flavonoid dapat menurunkan kolesterol total. Beberapa studi telah meneliti efek dari flavonoid pada sintesis dan kadar dalam sel, hewan percobaan, dan manusia (Gebhardt, 2001). Quercetin, luteolin, dan taxifolin dapat menghambat sintesis kolesterol. Efek dapat terjadi melalui mekanisme tidak langsung yang memodulasi aktivitas HMG-CoA. Luteolin dapat menyebabkan sekresi empedu kolesterol dan dengan demikian mengurangi kadar kolesterol (Gross, 2004). Sehingga flavonoid memungkinkan untuk mengurangi perlemakan didalam hati. Saponin didalam ekstrak buah parijoto diduga memiliki efek sebagai antihiperlipidemia adalah saponin. Saponin bekerja dengan mengendapkan kolesterol dan ikut campur dalam sirkulasi enterohepatik asam empedu yang membuat penyerapan kolesterol di usus terganggu (Kamesh dan Tangarajan, 2012). Mekanisme saponin tersebut kemunginan terdapat didalam ekstrak buah parijoto sehingga dapat mengurangi perlemakan hati yang terjadi. Berdasarkan uraian diatas dapat disimpulkan bahwa ekstrak etanol 70% dengan adanya senyawa flavonoid, saponin dan tanin kemungkinan dapat memperbaiki kerusakan sel hati yang mengalami perlemakan. Efek antihiperlipidemia tersebut dapat terlihat lebih banyak pada dosis 3 (90 mg/KgBB), tetapi perlu dilakukan penelitian lebih lanjut untuk menentukan dosis optimum yang dapat mengurangi perlemakan hati. UIN Syarif Hidayatullah Jakarta BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa ekstrak etanol 70% buah parijoto memiliki efek antihiperlipidemia yang dilihat dari jaringan hati. Efek yang paling banyak mengurangi perlemakan hati terdapat pada dosis III (90 mg/KgBB) karena sel normal dan sel steatosis berbeda secara signifikan (p<0,05) dengan kelompok hiperlipid. Sel nekrosis pada semua kelompok tidak memiliki perbedaan yang signifikan (p>0,05). 5.2 Saran Saran yang dapat diberikan untuk penelitian selanjutnya sebagai berikut: a. Perlu dilakukan penelitian lebih lanjut untuk mengetahui dosis optimum yang mendekati dosis 90 mg/kgBB dalam mengurangi perlemakan hati. b. Perlu dilakukan uji lebih lanjut terhadap senyawa aktif yang berperan sebagai antihiperlipidemia. 42 UIN Syarif Hidayatullah Jakarta 43 DAFTAR PUSTAKA Anonim, 2014 dalam Niswah, 2014. Uji aktivitas antibakteri dari ekstrak buah parijoto (Medinilla speciosa Blume) menggunakan metode difusi cakram. Skripsi UIN Syarif Hidayatullah Jakarta Ahmad, 1986 dalam Marliana et al., 2005.. Skrining Fitokomia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule jacq. Swartz) Dalam Ekstrak etanol. Jurnal Biofarmasi 3(1): 26-31. Ascent. 2012. Simvastatin-DP Product Information. South Melbourn. 130603.p125. Balamurugan, K. Nishantini, A., Mohan., V.R. 2013. Antidiabetic And Antihyperlipidaemic Activity Of Ethanol Extract Of Melastoma Malabathricum L. Leaf In Alloxan Induced Diabetic Rats. Ethnopharmacology Unit, Research Department of Botany, V. O. Chidambaram College, Tuticorin 628 008, Tamil Nadu, India. Bullock, Shane., Hayes, Majella. 2013. Principles of Pathophysiology. 2013. Pearson Australia. Brunton., et al , 2008 dalam Purwanti, Septi. 2012. (Skripsi) Efek Antihiperlipidemia Ekstrak Etanol 70% buah Oyong (Luffa acutangula (L.) Roxb) Pada Tikus Putih Jantan yang Diberi Diit Tinggi Kolesterol dan Lemak. Skripsi. Depok: Universitas Indonesia. Conforti et al., 2008 dalam Wachidah, Leliana N., 2013. Uji aktivitas antioksidan serta penentuan kandungan fenola dan flavonoid total dari buah parijoto (Medinilla speciosa Blume).Skripsi UIN Syarif Hidayatullah Jakarta. Departemen Kesehatan Republik Indonesia. 2000.Parameter Standar umum ekstrak tumbuhan obat. Jakarta:Departemen Kesehatan RI., Hal. 13-17. Dinayanti, Tezza. 2010. Pengaruh Pemberian Seduhan Kelopak Kering Bunga Rosella (Hibiscus sabdariffa) Terhadap Kadar Kolesterol Total Serum Tikus Sprague-Dawley Hiperkolesterolemik. Skripsi Fakultas Kedokteran Universitas Diponegoro: Semarang. Dipiro, Joseph T., 2005. Pharmacotherapy : A patophysiologic Approach. New York : McGaraw-Hill., 429-452. Dyatmiko, Wahjo. 2004. Pengaruh Pemberian Perasan Sechium edule (Jacq.) Swartz Terhadap Kadar Kolesterol Total Dan Trigliserida Mencit Queckerbus. Fakultas Farmasi Universitas Airlanggaberk. Penel.Hayati: 9 UIN Syarif Hidayatullah Jakarta 44 (139-142), 2004 Fakultas MIPA Universitas Katolik Widya Mandala Madiun. Dubey, Nawal Kishore. 2015. Plant as A Source of Natural Antioxidants. USA: CAB International. Edwards et al., 1972 dalam Santosa, Sylvia., et al., 2007. Physiological and therapeutic factor affecting cholesterol metabolism: Does a reciprocal relationship between cholesterol absorption and synthesis really excist?. Science Direct. 80. 505-514. Ganiswara, G, Suliatia, dkk., 1995., Farmakologi Dan Terapi Edisi ke-4., Fakultas Kedokteran UI., Jakarta. Gebhardt, R. 2001. Anticholestatic Activity Of Flavonoids From Artichoke (Cynara Scolymus L.) And Of Their Metabolites. Med Sci Monit 7 (Suppl 1): 316. Gilman, 2012. Goodman and Gilman: Dasar farmakologi terapi. Edisi 10. Vol. 2 Jakarta : EGC. Hal. 943-968. Goldberg, I.J. and M. Merkel. 2001. Lipoprotein Lipase, physiology, biochemistry and molecular biology. Front Biosci 6:D388. Gross, Myron. 2004. Flavonoid and Cardiovascular Disease. Pharmaceutical Biology. 21-35. Guevara, 1985 dalam Wachidah, Leliana N., 2013. Uji aktivitas antioksidan serta penentuan kandungan fenola dan flavonoid total dari buah parijoto (Medinilla speciosa Blume).Skripsi UIN Syarif Hidayatullah Jakarta. Harvey D. 2000. Modern Analytical Chemistry. The McGraw-Hill Companies, Inc. 2-8. Harborne, 1996 dalam Marliana et al., 2005. Skrining Fitokomia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule jacq. Swartz) Dalam Ekstrak etanol. Jurnal Biofarmasi 3(1): 26-31 Juheini. 2002. Pemanfaatan Herba Seledri (Apium graveolens L.) Untuk Menurunkan Kolesterol dan Lipid dalam Darah Tikus Putih yang Diberi Diit Tinggi Kolesterol dan Lemak. Jurusan Farmasi, FMIPA UI. Makara Sains, Vol.6, No.2. Agustus 2002. Kamesh, Venkatakrishnan and Thangarajan Sumathi. 2012. Antihypercholesterolemic effect of Bacopa monniera Linn. On high cholesterol diet induced hypercholesterolemia in rats. Asian Pasific Journal of Tropical medicine. UIN Syarif Hidayatullah Jakarta 45 Kaniati, Sri Dewi. 2012. (Skripsi) Uji Potensi Hepatoprotektif Senyaws Dimer dari Isoeugenol Terhadap Histologi Hati Mencit (Mus Musculus) Jantan Galur DDY.Fakultas Matematika dan Ilmu Pengetahuan Alam Departemen Biologi Universitas Indonesia. Kimble, Marry A., et al., 2009. Applied Therapeuics-The clinical Use of Drugs. USA: Lippincott Williams & Wilkins. 12-28. Marlina, S. 2003. Pengaruh Ekstrak Campuran Buah Labu Siam (Sechium edule) dan Daun Salam (Eugena polyantha Wighy) terhadap Kadar Kolesterol Total dan Trigliserida Tikus Jantan Putih yang Diberi Diit Kolesterol Tinggi dan Lemak. Depok: Skripsi Farmasi FMIPA UI. Marliana, et al., 2005. Marliana et al., 2005.. Skrining Fitokomia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule jacq. Swartz) Dalam Ekstrak etanol. Jurnal Biofarmasi 3(1): 26-31. Mayes PA. Lipid transport and stirage Harper’s Bio chemistry, 22nd Ed.PrenticeHall International Inc, 1990. McCance, Kathryn L., Huether, Sue E.,. 2013. Pathophysiology: The Biologic Basis For Disease In Adulys And Children. Canada: Elsevier. Meenakshi, S., Umayaparvath, S., Arumugan, M. and Balasubramanian, T. 2012. In Vitro Antioksidant Properties and FTIR Analysis of Two Seeweeds of Gulf of Mannar. Asian Pac. J. Trop. Biomed., 2:66-70 Mu’nim, 2011 dalam Purwnti, Septi. 2012. (Skripsi) Efek Antihiperlipidemia Ekstrak Etanol 70% buah Oyong (Luffa acutangula (L.) Roxb) Pada Tikus Putih Jantan yang Diberi Diit Tinggi Kolesterol dan Lemak. Skripsi. Depok: Universitas Indonesia. Murray.R.K., Granner, and Rodwell. 2009. Biokimia Harper (Brahm U. Pendit, et all, penerjemah.). (Ed ke-27). Jakarta:Penerbit Buku Kedokteran EGC. Niswah, Lukluatun. 2014. Uji aktivitas antibakteri dari ekstrak buah parijoto (Medinilla speciosa Blume) menggunakan metode difusi cakram. Skripsi UIN Syarif Hidayatullah Jakarta Nugroho, Christianto Adhy. 2012. Aktivitas Hipokolesterolimik Ekstrak Rosela (Hibiscus Sabdariffa) Pada Tikus Putih Diabetes. Program Studi Biologi. Nurcahyaningtias, Haviani. 2012. (Skripsi) Efek Antihiperlipidemia Susu Kacag kedelai (Glycine Max (L.) Merr.) Pada Tikus Putih Jantan yang Diberi Diit Tinggi Kolesterol dan Lemak. Skripsi. Depok: Universitas Indonesia. O. T. Kolawole, S. O. Kolawole, A. A. Ayankunle and I. O. Olaniran Methanol Leaf Extract of Persea americana Protects Rats against UIN Syarif Hidayatullah Jakarta 46 Cholesterol-Induced Hyperlipidemia. British Journal of Medicine & Medical. Research 2(2): 235-242, 2012. Oktavianti, 2005 dalam Wulandari, Debin. 2012. Kadar Malondialdehida ( Mda ) Dan Gambaran Histopatologi Organ Hati pada Hewan Model Tikus (Rattus Norvegicus) Hiperkolesterolemia Setelah Terapi Ekstrak Air Benalu Mangga (Dendrophthoe Pentandra L. Miq). Fakultas Kedokteran Hewan. Universitas Brawijaya. Parijoto. www. Platamor.com/index.php?plant=826 diakses pada tanggal 30 Juni 2014. Pearce, C. Evelyn. 2009. Anatomi dan Fisiologi Untuk Paramedis. Jakarta: PT. Gramedia. Porth, C and G. Matfin. 2008. Pathophysiology: Concepts of Altered Health States. Lippincott Williams & Wilkins 8th edition. Purwanti, Septi. 2012. (Skripsi) Efek Antihiperlipidemia Ekstrak Etanol 70% buah Oyong (Luffa acutangula (L.) Roxb) Pada Tikus Putih Jantan yang Diberi Diit Tinggi Kolesterol dan Lemak. Skripsi. Depok: Universitas Indonesia. Prakash et al., 2001 dalam Marliana et al., 200.. Skrining Fitokomia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule jacq. Swartz) Dalam Ekstrak etanol. Jurnal Biofarmasi 3(1): 26-3. Rahayu, 2005 dalam Umarudin, Susanti, dan Yuniastuti, Ari. 2012. Efektivitas Ekstrak Tanin Seledri Terhadap Profil Hiperkolesterolemi Lipid Tikus Putih. Jurusan Biologi, FMIPA, Universitas Negeri Semarang, Indonesia Unnes Journal of Life Science. Reynertson. A. L. 2007. Phytochemical Analysis of Bioactive Constituents ftom Edible Myrtaceae Fruits. Dissertation. University of New York. New York. Riset Kesehatan Dasar (Riskesdas). 2007. Badan Penelitian dan Pengembangan Kesehatan Kementrian Kesehatan RI., 115. Riset Kesehatan Dasar (Riskesdas). 2013. Badan Penelitian dan Pengembangan Kesehatan Kementrian Kesehatan RI. 92, 259-260. Saidin, Muhammad. 2002. Cholesterol Content of Foods Originatinf From Animal Tissue. Litbangkes-Depkes RI. 27(2). 224-230. Sukandar, 2006 dalam Umarudin, Susanti, dan Yuniastuti, Ari. 2012. Efektivitas Ekstrak Tanin Seledri Terhadap Profil Hiperkolesterolemi Lipid Tikus UIN Syarif Hidayatullah Jakarta 47 Putih. Jurusan Biologi, FMIPA, Universitas Negeri Semarang, Indonesia Unnes Journal of Life Science. Wachidah, Leliana N., 2013. Uji aktivitas antioksidan serta penentuan kandungan fenola dan flavonoid total dari buah parijoto (Medinilla speciosa Blume).Skripsi UIN Syarif Hidayatullah Jakarta. Wibowo, H.A., Wasino & Dewi Lisnoor Setyowati. 2012. Kearifan lokal dalam menjaga Lngkungan Hidup (Studi Kasus Masyarakat di Desa Colo Kecematan Dawe Kapbupaten Kudus), Journal of Educational Social Studies 1 (1) : 25-30 Wulandari, Debin. 2012. Kadar Malondialdehida ( Mda ) Dan Gambaran Histopatologi Organ Hati pada Hewan Model Tikus (Rattus Norvegicus) Hiperkolesterolemia Setelah Terapi Ekstrak Air Benalu Mangga (Dendrophthoe Pentandra L. Miq). Fakultas Kedokteran Hewan. Universitas Brawijaya. UIN Syarif Hidayatullah Jakarta LAMPIRAN 42 UIN Syarif Hidayatullah Jakarta 48 Lampiran 1 : Kerangka Penelitian Buah parijoto segar ekstraksi dengan etanol 70% evaporasi Ekstrak kental etanol 70% parijoto Adaptasi Sampel tikus 14 hari, dibagi 6 kelompok uji Hewan siap diberikan intervensi sesuai kelompok uji Cek BB sampel seminggu sekali % rendemen Uji kadar air Skrining fitokimia Pemberian intervensi kepada hewan uji Pembuatan suspensi ekstrak etanol 70% parijoto Pemberian intervensi selama 42 hari Diberikan kepada hewan uji sesuai dengan dosis yang telah ditentukan Hari 43, pengambilan hati hewan uji Dilihat dengan mikroskop Preparasi jaringan hati hewan uji UIN Syarif Hidayatullah Jakarta 49 Lampiran 2 : Pembuatan larutan Uji Pembuatan larutan ekstrak etanol dibuat dengan perhitungan sebagai berikut dengan volume larutan yang diberikan adalah 3 ml/200 bb, maka volume yang dibutuhkan untuk masing-masing dosis adalah: Dosis III : 5 ekor x 3 ml = 15 ml Dosis II : 1/10 x 15 ml = 1,5 ml Dosis I : 1/100 x 15 ml = 0,15 ml Untuk suspensi bahan uji dosis I dan II, dibuat dengan pengenceran dari dosis III, yakni dengan cara mensuspensikan larutan uji dosis III dalam Na CMC 0,5% sampai volumenya 15 ml untuk masing-masing dosis I dan dosis II. Jumlah total suspensi bahan uji dosis III yang dibutuhakan perhari adalah 15 + 1,5 + 0,15 ml = 16,65 ml ≈ 18 ml. Jumlah ekstrak dosis III yang harus ditimbang = 18 ml/3 ml x 90 mg = 540 mg (disuspensikan dengan larutan CMC 0,5% ad 18 ml) Dosis I dan II akan dibuat dari pengenceran dosis III Dosis II : 1,5 ml suspensi dosis III, ditambahkan larutan Na CMC 0,5% ad 15 ml Dosis I : 0,15 ml suspensi dosis, ditambahkan larutan Na CMC 0,5% ad 15 ml UIN Syarif Hidayatullah Jakarta 50 Lampiran 3: Perhitungan dosis dan pembuatan suspensi simvastatin Dosis efektif simvastatin pada manusia adalah 10-20 mg/hari, dan dosis yang akan dipakai adalah simvastatin dengan dosis 10 mg/hari. Maka dosis untuk tikus per 200 g bb adalah 10 mg/hari x 0,018 x 10 = 1,8 mg/hari. Volume larutan yang akan diberikan adalah 3 ml maka volume yang dibutuhkan adalah: 5 ekor x 3 ml =15 ml. Jadi jumlah simvastatin yang akan ditimbang : x 1,8 mg = 9 mg (disuspensikan dengan larutan CMC 0,5% ad 15 ml) CMC yang ditimbang Larutan CMC 0,5% dibuat dengan menimbang 0,1 g CMC lalu ditaburkan dalam air panas pada suhu 80oC dengan volume 20 kali berat CMC yaitu 2 ml dan didiamkan selama kurang lebih 30 menit hingga CMC mengembang. Setelah pendiaman, CMC digerus hingga homogen, lalu ditambahkan aquadest hingga 15 ml. UIN Syarif Hidayatullah Jakarta 51 Lampiran 4: Pembuatan diit tinggi kolesterol dan lemak Diit tinggi kolesterol dan lemak akan dibuat dengan komposisi: Kuning telur 80% Larutan sukrosa 65% 15% Lemak hewan 5% Volume emulsi yang diberikan 3 ml maka volume yang dibutuhkan adalah: [(5 kelompok x 5 ekor) x 3 ml]= 75 ml Kuning telur : Larutan sukrosa 65% : Lemak hewan : Diit tinggi kolesterol dan lemak dibuat dalam bentuk emulsi, sama bahan dicampur, kemudian dikocok dengan kecepatan tinggi hingga homogen. Diit dibuat baru setiap harinya. UIN Syarif Hidayatullah Jakarta 52 Lampiran 5: Jumlah sel normal, sel nekrosis, dan sel steatosis Kelompok Normal 1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 3 2 4 6 8 Normal 71 84 61 65 50 Steatosis 10 4 4 5 7 Kelompok Normal 2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 14 11 22 26 22 Normal 11 15 7 10 17 Steatosis 30 35 20 37 38 Kelompok Normal 3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 60 43 42 35 35 Normal 5 10 8 11 15 Steatosis 12 20 21 17 20 Kelompok Hiperlipid 1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 34 27 25 47 25 Normal 4 6 8 8 16 Steatosis 33 29 29 55 46 UIN Syarif Hidayatullah Jakarta 53 Kelompok Hiperlipid 2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 20 27 22 21 27 Normal 5 7 12 3 14 Steatosis 45 47 45 52 42 Kelompok Hiperlipid 3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 30 27 26 30 31 Normal 3 5 17 7 4 Steatosis 24 32 39 21 24 Kelompok Lapang Simvastatin Pandang 1 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 26 29 21 12 12 Normal 7 10 13 10 7 Steatosis 28 31 28 24 27 Kelompok Lapang Simvastatin Pandang 1 2 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 29 20 25 10 13 Normal 5 7 8 7 10 Steatosis 27 26 24 20 20 UIN Syarif Hidayatullah Jakarta 54 Kelompok Lapang Simvastatin Pandang 1 3 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 17 12 11 10 12 Normal 16 17 20 17 32 Steatosis 20 22 20 20 22 Kelompok D1P1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 14 20 20 21 21 Normal 26 21 22 19 20 Steatosis 13 13 12 13 19 Kelompok D1P2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 20 24 20 14 17 Normal 37 32 10 24 30 Steatosis 26 8 15 26 21 Kelompok D1P3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 12 19 18 17 14 Normal 26 30 25 19 19 Steatosis 19 22 20 23 21 UIN Syarif Hidayatullah Jakarta 55 Kelompok D2P1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 12 19 19 17 19 Normal 24 20 19 27 28 Steatosis 28 22 24 21 22 Kelompok D2P2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 18 20 18 17 12 Normal 23 19 19 20 22 Steatosis 20 24 22 18 20 Kelompok D2P3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 12 10 12 13 11 Normal 22 24 24 25 25 Steatosis 19 20 20 19 20 Kelompok D3P1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 16 17 16 20 17 Normal 35 40 25 27 30 Steatosis 15 20 20 23 24 UIN Syarif Hidayatullah Jakarta 56 Kelompok D3P2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 13 15 17 16 13 Normal 30 33 27 28 20 Steatosis 21 19 18 19 23 Kelompok D3P3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis 10 17 12 12 10 Normal 40 37 35 25 27 Steatosis 23 24 9 10 19 UIN Syarif Hidayatullah Jakarta 57 Lampiran 6: Persentase sel normal, sel nekrosis, dan sel steatosis Normal 1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 3.57 84.52 11.90 2.22 93.33 4.44 5.80 88.41 5.80 7.89 85.53 6.58 12.31 76.92 10.77 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 25.45 20.00 54.55 18.03 24.59 57.38 44.90 14.29 40.82 35.62 13.70 50.68 28.57 22.08 49.35 Normal 3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 77.92 6.49 15.58 58.90 13.70 27.40 59.15 11.27 29.58 55.56 17.46 26.98 50.00 21.43 28.57 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 47.89 5.63 46.48 43.55 9.68 46.77 40.32 12.90 46.77 42.73 7.27 50.00 28.74 18.39 52.87 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 28.57 7.14 64.29 33.33 8.64 58.02 27.85 15.19 56.96 27.63 3.95 68.42 32.53 16.87 50.60 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 52.63 5.26 42.11 47.37 7.81 50.00 45.61 20.73 47.56 52.63 12.07 36.21 54.39 6.78 40.68 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 42.62 41.43 33.87 26.09 26.09 Nekrosis Normal Steatosis Normal 2 Hiperlipid 1 Nekrosis Normal Steatosis Hiperlipid 2 Nekrosis Normal Steatosis Hiperlipid 3 Nekrosis Normal Steatosis Simvastatin 1 Nekrosis Ratarata 6.36 85.74 7.90 Ratarata 30.51 18.93 50.55 Ratarata 60.31 14.07 25.62 Ratarata 40.64 10.78 48.58 Ratarata 29.98 10.36 59.66 Ratarata 50.53 10.53 43.31 Ratarata 34.02 UIN Syarif Hidayatullah Jakarta 58 Normal Steatosis 11.48 45.90 14.29 44.29 20.97 45.16 21.74 52.17 15.22 58.70 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 47.54 8.20 44.26 37.74 13.21 49.06 43.86 14.04 42.11 27.03 18.92 54.05 30.23 23.26 46.51 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 32.08 30.19 37.74 23.53 33.33 43.14 21.57 39.22 39.22 21.28 36.17 42.55 18.18 48.48 33.33 d1p1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 26.42 49.06 24.53 37.04 38.89 24.07 37.04 40.74 22.22 39.62 35.85 24.53 35.00 33.33 31.67 d1p2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 24.10 44.58 31.33 37.50 50.00 12.50 44.44 22.22 33.33 21.88 37.50 40.63 25.00 44.12 30.88 d1p3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 21.05 45.61 33.33 26.76 42.25 30.99 28.57 39.68 31.75 28.81 32.20 38.98 25.93 35.19 38.89 d2p1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 18.75 37.50 43.75 31.15 32.79 36.07 30.65 30.65 38.71 26.15 41.54 32.31 27.54 40.58 31.88 d2p2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal 29.51 37.70 31.75 30.16 30.51 32.20 30.91 36.36 22.22 40.74 Simvastatin 2 Nekrosis Normal Steatosis simvastatin 3 16.74 49.24 Ratarata 37.28 15.52 47.20 Ratarata 23.33 37.48 39.20 Ratarata 35.02 39.57 25.40 Ratarata 30.58 39.68 29.73 Ratarata 26.22 38.99 34.79 Ratarata 26.85 36.61 36.54 Ratarata 28.98 35.43 UIN Syarif Hidayatullah Jakarta 59 Steatosis 32.79 38.10 37.29 32.73 37.04 d2p3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 22.64 41.51 35.85 18.52 44.44 37.04 21.43 42.86 35.71 22.81 43.86 33.33 19.64 44.64 35.71 d3p1 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 24.24 53.03 22.73 22.08 51.95 25.97 26.23 40.98 32.79 28.57 38.57 32.86 23.94 42.25 33.80 d3p2 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 20.31 46.88 32.81 22.39 49.25 28.36 27.42 43.55 29.03 25.40 44.44 30.16 23.21 35.71 41.07 d3p3 Lapang Pandang 1 Lapang Pandang 2 Lapang Pandang 3 Lapang Pandang 4 Lapang Pandang 5 Nekrosis Normal Steatosis 13.70 54.79 31.51 21.79 47.44 30.77 21.43 62.50 16.07 25.53 53.19 21.28 17.86 48.21 33.93 35.59 Ratarata 21.01 43.46 35.53 Ratarata 25.01 45.36 29.63 Ratarata 23.75 43.97 32.29 Ratarata 20.06 53.23 26.71 UIN Syarif Hidayatullah Jakarta 60 Lampiran 7: Uji statistik sel normal hewan uji (SPSS 16.0) 1. Uji normalitas terhadap sel normalseluruh kelompok hewan uji (spss 16.0) Tujuan: untuk melihat data sel normal seluruh kelompok hewan uji terdistribusi normal atau tidak Hipotesis: Ho = Data sel normal tikus terdistribusi normal Ha = sel normal tikus tidak terdistribusi normal Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 One-Sample Kolmogorov-Smirnov Test Normal N 18 Normal Parametersa Mean Std. Deviation Most Extreme Differences 33.1361 1.93620E1 Absolute .158 Positive .157 Negative -.158 Kolmogorov-Smirnov Z .671 Asymp. Sig. (2-tailed) .758 Keputusan : Data sel normal tikuspada tiap kelompok terdistribusi normal 2. Uji homogenitas (Uji Levene) terhadap sel normal seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk melihat sel normal seluruh kelompok hewan uji bervariasi homogen atau tidak Hipotesis: Ho = Data sel normal tikus bervariasi secara homogen Ha = Data sel normal tikus tidak bervariasi secara homogen UIN Syarif Hidayatullah Jakarta 61 Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 Test of Homogeneity of Variances Levene Statistic df1 df2 11.892 5 Sig. 12 .000 Keputusan : Data sel normal tikus pada tiap kelompok tidak bervariasi homogen 3. Uji analisis kruskall-wallis terhadap sel normal seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk mengetahui ada tidaknya perbedaan data terhadap sel normal seluruh kelompok hewan uji Hipotesis: Ho = Data sel normal tikus tidak berbeda secara bermakna Ha = Data sel noraml tikus berbeda secara bermakna Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 Test Statisticsa,b Normal Chi-Square df Asymp. Sig. 12.233 4 .016 Keputusan : Data sel normal tikus antar kelompok perlakuan berbeda secara bermakna UIN Syarif Hidayatullah Jakarta 62 4. Uji Beda Nyata Terkecil (BNT) terhadap sel normal kelompok hewan uji (SPSS 16.0) Tujuan: Untuk mengetahui letak perbedaan data sel normal antar kelompok hewan uji Hipotesis: Ho = Data sel normal tikus tidak memiliki perbedaan Ha = Data sel normal tikus berbeda memiliki perbedaan p : 0,05 Pengambilan keismpulan : Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 95% Confidence Interval Mean Difference (I) Kelompok (J) Kelompok Normal Hiperlipid 29.02333 14.14290 .063 -1.7914 59.8381 simvastatin 16.33333 14.14290 .271 -14.4814 47.1481 dosis 1 .16667 14.14290 .991 -30.6481 30.9814 dosis 2 1.08000 14.14290 .940 -29.7347 31.8947 dosis 3 -7.94000 14.14290 .585 -38.7547 22.8747 Normal -29.02333 14.14290 .063 -59.8381 1.7914 simvastatin -12.69000 14.14290 .387 -43.5047 18.1247 dosis 1 -28.85667 14.14290 .064 -59.6714 1.9581 dosis 2 -27.94333 14.14290 .072 -58.7581 2.8714 dosis 3 -36.96333* 14.14290 .023 -67.7781 -6.1486 Normal -16.33333 14.14290 .271 -47.1481 14.4814 12.69000 14.14290 .387 -18.1247 43.5047 dosis 1 -16.16667 14.14290 .275 -46.9814 14.6481 dosis 2 -15.25333 14.14290 .302 -46.0681 15.5614 dosis 3 -24.27333 14.14290 .112 -55.0881 6.5414 Normal -.16667 14.14290 .991 -30.9814 30.6481 Hiperlipid 28.85667 14.14290 .064 -1.9581 59.6714 simvastatin 16.16667 14.14290 .275 -14.6481 46.9814 dosis 2 .91333 14.14290 .950 -29.9014 31.7281 dosis 3 -8.10667 14.14290 .577 -38.9214 22.7081 Hiperlipid simvastatin Hiperlipid dosis 1 (I-J) Std. Error Sig. Lower Bound Upper Bound UIN Syarif Hidayatullah Jakarta 63 dosis 2 dosis 3 Normal -1.08000 14.14290 .940 -31.8947 29.7347 Hiperlipid 27.94333 14.14290 .072 -2.8714 58.7581 simvastatin 15.25333 14.14290 .302 -15.5614 46.0681 dosis 1 -.91333 14.14290 .950 -31.7281 29.9014 dosis 3 -9.02000 14.14290 .536 -39.8347 21.7947 Normal 7.94000 14.14290 .585 -22.8747 38.7547 Hiperlipid 36.96333* 14.14290 .023 6.1486 67.7781 simvastatin 24.27333 14.14290 .112 -6.5414 55.0881 dosis 1 8.10667 14.14290 .577 -22.7081 38.9214 dosis 2 9.02000 14.14290 .536 -21.7947 39.8347 UIN Syarif Hidayatullah Jakarta 64 Lampiran 8: Uji statistik sel steatosis hewan uji (SPSS 16.0) 1. Uji normalitas terhadap sel steatosis seluruh kelompok hewan uji (spss 16.0) Tujuan: untuk melihat data sel steatosis seluruh kelompok hewan uji terdistribusi normal atau tidak Hipotesis: Ho = Data sel steatosis tikus terdistribusi normal Ha = Data sel steatosis tikus tidak terdistribusi normal Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 One-Sample Kolmogorov-Smirnov Test Steatosis N 18 Normal Parametersa Mean Std. Deviation Most Extreme Differences 36.5261 12.08062 Absolute .123 Positive .111 Negative -.123 Kolmogorov-Smirnov Z .522 Asymp. Sig. (2-tailed) .948 Keputusan : Data sel steatosis tikus pada tiap kelompok terdistribusi normal 2. Uji homogenitas (Uji Levene) terhadap sel steatosis seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk melihat sel steatosis seluruh kelompok hewan uji bervariasi homogen atau tidak Hipotesis: Ho = Data sel steatosis tikus bervariasi secara homogen Ha = Data sel steatosis tikus tidak bervariasi secara homogen UIN Syarif Hidayatullah Jakarta 65 Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 Test of Homogeneity of Variances Levene Statistic df1 df2 3.316 5 Sig. 12 .041 Keputusan : Data sel steatosis tikus pada tiap kelompok tidak bervariasi homogen 3. Uji analisis kruskall-wallis terhadap sel steatosis seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk mengetahui ada tidaknya perbedaan data terhadap sel steatosis seluruh kelompok hewan uji Hipotesis: Ho = Data sel steatosis tikus tidak berbeda secara bermakna Ha = Data sel steatosis tikus berbeda secara bermakna Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 Test Statisticsa,b Steatosis Chi-Square df 12.233 4 Asymp. Sig. .016 Keputusan : Data sel steatosis tikus antar kelompok perlakuan berbeda secara bermakna 4. Uji Beda Nyata Terkecil (BNT) terhadap sel steatosis kelompok hewan uji (SPSS 16.0) Tujuan: Untuk mengetahui letak perbedaan data sel steatosis antar kelompok hewan uji Hipotesis: Ho = Data sel steatosis tikus tidak memiliki perbedaan UIN Syarif Hidayatullah Jakarta 66 Ha = Data sel stetaosis tikus berbeda memiliki perbedaan p : 0,05 Pengambilan keismpulan : Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 95% Confidence Interval Mean Difference (I) Kelompok (J) Kelompok (I-J) Normal Hiperlipid -22.49333* 8.07665 .016 -40.0908 -4.8958 simvastatin -17.19000 8.07665 .055 -34.7875 .4075 dosis 1 -1.95000 8.07665 .813 -19.5475 15.6475 dosis 2 -7.86333 8.07665 .349 -25.4608 9.7342 dosis 3 -1.52000 8.07665 .854 -19.1175 16.0775 Normal 22.49333* 8.07665 .016 4.8958 40.0908 5.30333 8.07665 .524 -12.2942 22.9008 dosis 1 20.54333* 8.07665 .026 2.9458 38.1408 dosis 2 14.63000 8.07665 .095 -2.9675 32.2275 dosis 3 20.97333* 8.07665 .023 3.3758 38.5708 Normal 17.19000 8.07665 .055 -.4075 34.7875 Hiperlipid -5.30333 8.07665 .524 -22.9008 12.2942 dosis 1 15.24000 8.07665 .084 -2.3575 32.8375 dosis 2 9.32667 8.07665 .271 -8.2708 26.9242 dosis 3 15.67000 8.07665 .076 -1.9275 33.2675 Normal 1.95000 8.07665 .813 -15.6475 19.5475 Hiperlipid -20.54333* 8.07665 .026 -38.1408 -2.9458 simvastatin -15.24000 8.07665 .084 -32.8375 2.3575 dosis 2 -5.91333 8.07665 .478 -23.5108 11.6842 dosis 3 .43000 8.07665 .958 -17.1675 18.0275 Normal 7.86333 8.07665 .349 -9.7342 25.4608 Hiperlipid -14.63000 8.07665 .095 -32.2275 2.9675 simvastatin -9.32667 8.07665 .271 -26.9242 8.2708 dosis 1 5.91333 8.07665 .478 -11.6842 23.5108 dosis 3 6.34333 8.07665 .447 -11.2542 23.9408 Hiperlipid simvastatin simvastatin dosis 1 dosis 2 Std. Error Sig. Lower Bound Upper Bound UIN Syarif Hidayatullah Jakarta 67 dosis 3 Normal 1.52000 8.07665 .854 -16.0775 19.1175 Hiperlipid -20.97333* 8.07665 .023 -38.5708 -3.3758 simvastatin -15.67000 8.07665 .076 -33.2675 1.9275 dosis 1 -.43000 8.07665 .958 -18.0275 17.1675 dosis 2 -6.34333 8.07665 .447 -23.9408 11.2542 UIN Syarif Hidayatullah Jakarta 68 Lampiran 9: Uji statistik sel nekrosis hewan uji (SPSS 16.0) 1. Uji normalitas terhadap sel nekrosis seluruh kelompok hewan uji (spss 16.0) Tujuan: untuk melihat data sel nekrosis seluruh kelompok hewan uji terdistribusi normal atau tidak Hipotesis: Ho = Data sel nekrosis tikus terdistribusi normal Ha = Data sel nekrosis tikus tidak terdistribusi normal Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 One-Sample Kolmogorov-Smirnov Test Nekrosis N 18 Normal Parametersa Mean Std. Deviation Most Extreme Differences 30.5206 1.19496E1 Absolute .165 Positive .165 Negative -.135 Kolmogorov-Smirnov Z .699 Asymp. Sig. (2-tailed) .713 Keputusan : Data sel nekrosis tikus pada tiap kelompok terdistribusi normal 2. Uji homogenitas (Uji Levene) terhadap sel nekrosis seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk melihat sel nekrosis seluruh kelompok hewan uji bervariasi homogen atau tidak Hipotesis: Ho = Data sel nekrosis tikus bervariasi secara homogen Ha = Data sel nekrosis tikus tidak bervariasi secara homogen UIN Syarif Hidayatullah Jakarta 69 Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 Test of Homogeneity of Variances Levene Statistic 2.684 df1 df2 5 Sig. 12 .075 Keputusan : Data sel nekrosis tikus pada tiap kelompok tidak bervariasi homogen 3. Uji analisis variansi (ANOVA) satu arah terhadap sel nekrosis seluruh kelompok hewan uji (SPSS 16.0) Tujuan: untuk mengetahui ada tidaknya perbedaan data terhadap sel nekrosis seluruh kelompok hewan uji Hipotesis: Ho = Data sel nekrosis tikus tidak berbeda secara bermakna Ha = Data sel nekrosis tikus berbeda secara bermakna Pengambilan Kesimpulan: Ho diterima jika nilai signifikan > 0,05 Ho ditolak jika nilai signifikan < 0,05 ANOVA Sum of Squares Between Groups df Mean Square 566.746 5 113.349 Within Groups 1860.718 12 155.060 Total 2427.465 17 F Sig. .731 .614 Keputusan : Data sel nekrosis tikus antar kelompok perlakuan tidak berbeda secara bermakna UIN Syarif Hidayatullah Jakarta 70 Lampiran 10: Hasil Skrinning Fitokimia Uji Alkaloid dengan Meyer (-) Uji Alkaloid dengan Dragendorf (-) Uji Flavonoid (+) Uji Saponin (+) UIN Syarif Hidayatullah Jakarta 71 Uji Tanin (+) Uji Glikosida (+) Uji Terpenoid (-) UIN Syarif Hidayatullah Jakarta 72 Lampiran 11: Hasil Determinasi Buah Parijoto (Medinilla speciosa Blume) UIN Syarif Hidayatullah Jakarta