BAB I PENGANTAR METABOLISME A
advertisement
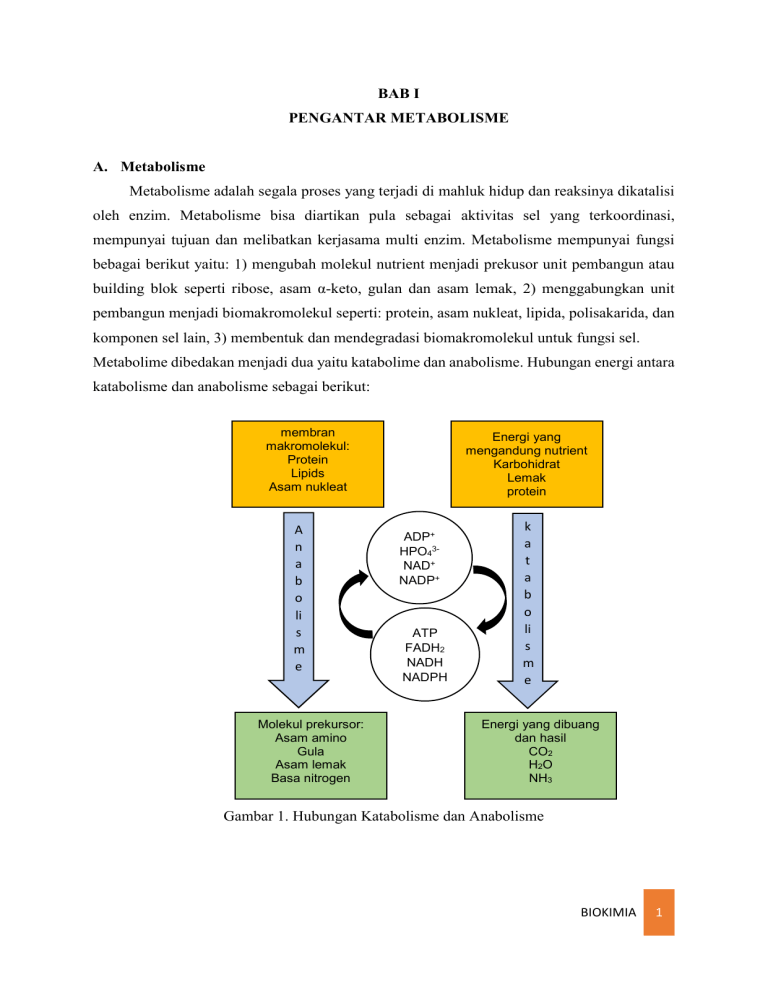
BAB I PENGANTAR METABOLISME A. Metabolisme Metabolisme adalah segala proses yang terjadi di mahluk hidup dan reaksinya dikatalisi oleh enzim. Metabolisme bisa diartikan pula sebagai aktivitas sel yang terkoordinasi, mempunyai tujuan dan melibatkan kerjasama multi enzim. Metabolisme mempunyai fungsi bebagai berikut yaitu: 1) mengubah molekul nutrient menjadi prekusor unit pembangun atau building blok seperti ribose, asam α-keto, gulan dan asam lemak, 2) menggabungkan unit pembangun menjadi biomakromolekul seperti: protein, asam nukleat, lipida, polisakarida, dan komponen sel lain, 3) membentuk dan mendegradasi biomakromolekul untuk fungsi sel. Metabolime dibedakan menjadi dua yaitu katabolime dan anabolisme. Hubungan energi antara katabolisme dan anabolisme sebagai berikut: membran makromolekul: Protein Lipids Asam nukleat A n a b o li s m e Molekul prekursor: Asam amino Gula Asam lemak Basa nitrogen Energi yang mengandung nutrient Karbohidrat Lemak protein ADP+ HPO43NAD+ NADP+ ATP FADH2 NADH NADPH FAD k a t a b o li s m e Energi yang dibuang dan hasil CO2 H2O NH3 Gambar 1. Hubungan Katabolisme dan Anabolisme BIOKIMIA 1 Energi yang dibawa dari lintas katabolik ke lintas anabolik dalam bentuk: 1. ATP (Adenosin Tripospat) yaitu pembawa gugus pospat yang memiliki energi tinggi 2. NADH, NADPH, dan FADH2 sebagai tenaga pereduksi, pembawa elektron atau atom H berenergi tinggi Ada tiga pendekatan untuk mengidentifikasi urutan metabolik, yaitu pendekatan melalui: 1. Reaksi invitro Reaksi invitro dilakukan di dalam tabung reaksi terhadap ekstrak sel atau enzim dari sel yang mampu mengkatalis proses metabolik yang diselidiki. 2. Mutase genetik Dengan mutase genetik organisme muatan dibuat agar tidak bisa memproduksi enzim aktif yang diselidiki sehingga memungkinkan menyimpulkan sifat-sifat tahap tertentu dalam metabolisme. 3. Pelacakan isotop Metabolit tertentu dilabel dengan isotop radioaktif kemudian lintas metabolit dilacak lewat sifat radioaktivitasnya. Jenis reaksi yang terjadi dalam metabolisme dikelompokkan berdasarkan enzim yang mengakatalisisnya yaitu: (1) oksidasi reduksi, (2) transfer gugus, (3) reaksi hidrolisis, (4) reaksi pemutusan non hidrolisis, (5) reaksi isomerisasi, dan (6) reaksi pembentukan ikatan. Sedangkan urutan reaksi dalam jalur metabolisme digolongkan berdasarkan pola urutan reaksinya yang digambarkan sebagai: (1) linear, (2) bercabang, (3) bercabang divergen, (4) siklik, (5) spiral, (6) lingkar 2 atau lebih, (7) tangga, dan (8) reversible langsung. Regulasi di dalam lintas metabolik digolongkan ke dalam tiga jenis mekanisme yaitu: 1. Regulasi allosteric Aktivitas katalitik enzim diubah oleh modulator positif atau modulator negative yang biasanya terdapat pada atau dekat permulaan suatu urutan multienzim. Contohnya aspartate carbamoyltransferase. 2. Pengontrolan hormone Jalur metabolik diatur melalui perangsangan atau hambatan beberapa aktifitas metabolik spesifik berdasarkan isyarat yang disampaikan hormone pada bagian dalam sel. Contohnya: epinefrin mengontrol aktivitas degradasi glikogen. BIOKIMIA 2 3. Control sistensis enzim/ control transkripsi Sel hati dapat menghidupkan atau mematikan biosintesis enzim tertentu tergantung pada sifat nutrient yang masuk proses induksi enzim. Contohnya: operon laktosa. Sel hidup bersifat isothermal, oleh karena itu energi dari reaksi katabolisme dibawa ke reaksi anabolisme dalam bentuk energi kimia (ATP, NADH, NADPH, dan FADH2). 1. ATP adalah pembawa gugus pospat yang kaya energi, reaksi penguraiannya: ATP ADP + Pi + energi ATP merupakan sumber energi untuk melakukan: reaksi biosintesis, kontransi dan motilitas sel, transport aktif (transport nutrient melalui membrane gradient konsentrasi), pemindahan informasi genetic selama biosintesis DNA, RNA, dan protein. 2. NADH, NADPH, dan FADH2 NADH, NADPH, dan FADH2 merupakan pembawa electron atau atom H yang kaya energi untuk reaksi biosintetik reduktif. B. METABOLISME INTERMEDIET Metabolisme Intermediet adalah jalur pusat metabolik yang menyajikan jalur sintesis, degradasi, interkonversi metabolit-metabolit penting serta konversi energi. Jalur lingkar yang memainkan peranan katabolisme dan anabolisme disebut jalur amfibolik. Bagan di bawah ini menggambarkan jalur-jalur metabolisme intermediet. BIOKIMIA 3 Gambar 2. Bagan Metabolisme Intermediet BIOKIMIA 4 C. LOKASI METABOLISME Gambar 3. Lokasi Metabolisme di dalam Tubuh 1. Brain/ otak Dalam keadaan istirahat otak memerlukan sebanyak 20% oksigen dari seluruh kebutuhan oksigen tubuh dan 70% glukosa tubuh. Adanya kebutuhan oksigen yang tinggi dikarenakan karena aktivitas otak yang terus menerus sehingga otak memerlukan makanan yang cukup dan teratur. Di otak terjadi metabolisme, otak memerlukan glukosa untuk menghasilkan energy melalui proses glikolisis dan siklus Krebs. Metabolisme di otak utamanya terjadi di mitokondria yang akan menghasilkan senyawa phospat yang bernergi tinggi. 2. Mouth/ mulut : terjadi katabolisme polisakarida Proses mencerna makanan pertama kali ada di mulut, saliva mengandung enzim amilase untuk menghidrolisis pati dan glikogen. 3. Blood and circulatory system/ darah dan sistem peredarannya Pembuluh darah sebagai jaringan transportasi O2 dan CO2, asam lemak, glukosa, asam amino dan regulasi hormone yang diedarakan ke seluruh organ dan jaringan yang bervariasi. 4. Lung/ paru-paru : tempat pertukaran gas O2 dan CO2 BIOKIMIA 5 Pertukaran gas O2 dan CO2 terjadi antara pembuluh darah dan udara. O2 diambil dari udara karena tubuh membutuhkan untuk proses oksidasi. Sedangkan CO2 dilepaskan sebagai hasil buang katabolisme karbohidrat. 5. Heart/ Jantung : Katabolisme asam lemak katabolisme asam lemak menghasilkan asetil Co-A yang akan masuk ke siklus Krebs. 6. Skeletal Muscle/ jaringan otot : Katabolisme asam lemak, mobilisasi glikogen dan sintesis glikogen terjadi di jaringan otot. 7. Liver/ hati Fungsi hati terutama adalah menjaga konsentrasi gula darah di dalam tubuh. Dapat kita sebut pula hati sebagai buffer, ketika kadar gula dalam darah naik maka hati akan menyimpan glukosa, sebaliknya ketika kadar gula turun, maka hati akan melepaskan glukosa dalam darah. Selain itu di hati juga sebagai tempat terjadinya gluconeogenesis, katabolisme asam amino, sintesis glikogen, sintesis lipoprotein, katabolisme asam lemak dan jalur phopspoglukonat. 8. Pancreas/ pancreas Pankreas sebagai regulator metabolisme dalam tubuh. Ketika keadaan lapar, maka pankreas akan mengeluarkan insulin, sebaliknya dalam keadaan kenyang, pancreas akan melepaskan hormone glucagon. Sehingga kadar gula dalam darah tetap stabil, tepatnya 90 menit setelah makan adalah 10 mmol/l atau sekitar 180 mg/dl. Pada malam hari kadar gula darah normal manusia adalah 8 mmol/l atau 144 mg/dl. Dan ketika seseorang berpuasa, kadar gula darah normalnya adalah 4-7 mmol/l atau sekitar 72-126 mg/dl. 9. Small intestine/ usus halus Katabolisme protein, katablosme disakarida, dan proses penyerapan terjadi di usus halus. 10. Adiposa Tissue/ jaringan adipose : Mobilisasi triacilgliserol, sintesis asam lemak, penyimpanan triasilgliserol dan jalur pospoglikonat. BIOKIMIA 6 BAB II ENZIM A. Enzim Suatu reaksi kimia, khususnya antara senyawa organik yang dilakukan dalam laboratorium memerlukan suatu kondisi yang ditentukan oleh beberapa faktor seperti suhu, tekanan, waktu dan lain-lain. Apabila salah satu kondisi tidak sesuai dengan apa yang seharusnya dibutuhkan maka reaksi tidak dapat berlangsung dengan baik. Tubuh kita merupakan laboratorium yang sangat rumit, sebab di dalamnya terjadi reaksi kimia yang beraneka ragam. Penguraian zat-zat yang terdapat dalam makanan kita, penggunaan hasil uraian untuk memperoleh energi, penggabungan kembali hasil uraian untuk membentuk persediaan makanan dalam tubuh serta banyak macam reaksi lain yang apabila dilakukan dalam laboratorium atau in vitro membutuhkan keahlian khusus serta waktu yang lama, dapat berlangsung dengan baik di dalam tubuh atau in vivo tanpa memerlukan suhu tinggi dan dapat terjadi dalam waktu yang relatif singkat. Reaksi atau proses kimia yang berlangsung dengan baik dalam tubuh kita ini dimungkinkan karena adanya katalis yang disebut enzim. Pengetahuan tentang katalis telah dirintis oleh Berzelius pada tahun 1837. Ia mengusulkan nama ‘katalis’ untuk zat-zat yang dapat mempercepat reaksi tetapi zat itu sendiri tidak ikut bereaksi. Proses kimia yang terjadi dengan pertolongan enzim telah dikenal sejak zaman dahulu, misalnya pembuatan anggur dengan cara fermentasi atau peragian. Demikian pula pembuatan asam cuka termasuk proses kimia berdasarkan aktivitas enzim. Dahulu proses fermentasi dianggap hanya terjadi dengan adanya sel yang mengandung enzim. Pasteur adalah salah seorang yang banyak bekerja dalam fermentasi ini. Anggapan tersebut berubah setelah Buchner membuktikan bahwa cairan yang berasal dari ragi tanpa adanya sel hidup dapat menyebabkan terjadinya fermentasi gula menjadi alkohol dan karbondioksida. Hingga sekrang kata ‘enzim’ yang berarti ‘di dalam ragi’ tetap dipakai untuk nama katalis dalam proses biokimia. Enzim dikenal untuk pertama kalinya sebagai protein oleh Sumner pada tahun 1926 yag telah berhasil mengsolasi urease dari jack bean. Urease adalah enzim yang dapat menguraikan urea menjadi CO2 dan NH3. Beberapa tahun kemudian Northrop dan Kunitz dapat mengisolasi pepsin, tripsin, kimotripsin. Selanjutnya makin banyak enzim yang telah dapat diisolasi dan telah dibuktikan bahwa enzim tersebut ialah suatu protein. BIOKIMIA 7 Sejak tahun 1926 pengetahuan tentang enzim atau enzimologi berkembang dengan cepat. Dari hasil penelitian para ahli biokimia ternyata bahwa banyak enzim mempunyai gugus bukan protein, jadi termasuk golongan protein majemuk. Enzim semacam ini (holoenzim) terdiri atas protein (apoenzim) dan suatu gugus bukan protein (kofaktor). Sebagai contoh enzim katalase terdiri atas protein dan ferriprotorfirin. Ada juga enzim yang terdiri dari protein dan logam. Misalnya askorbat oksidase adalah protein yang mengikat tembaga. Gugus bukan protein yang dinamakan kofaktor ini secara umum ada 3 yaitu Aktifator Ion Logam, Gugus Prostetik dan Koenzim. Ketiganya merupakan bagian enzim yang memungkinkan enzim bekerja terhadap substrat, yaitu zat-zat yang diubah atau direaksikan oleh enzim. Aktifator Ion Logam adalah ion-ion anorganik yg biasanya berikatan lemah dengan apoenzim. Contoh : K+, Fe++, Fe+++, Cu++, Co++, Zn++, Mn++, Mg++, Ca++, Mo+++. Gugus Prostetik adalah senyawa non protein yg dapat terdialisa, termostabil dan terikat kuat dengan apoenzim. Contoh : molybdoprotein, lipoamide, dan biotin. Koenzim adalah kofaktor berupa molekul organik kecil yang mentranspor gugus kimia atau elektron dari satu enzim ke enzim lainnya. Contoh koenzim mencakup NADH, NADPH dan adenosin trifosfat (ATP). Gugus kimiawi yang dibawa mencakup ion hidrida (H–) yang dibawa oleh NAD atau NADP+, gugus asetil yang dibawa oleh koenzim A, formil, metenil, ataupun gugus metil yang dibawa oleh asam folat, dan gugus metil yang dibawa oleh S-adenosilmetionina. Beberapa koenzim seperti riboflavin, tiamina, dan asam folat adalah vitamin. B. Sifat-Sifat Enzim 1. Enzim hanya mengubah kecepatan reaksi, artinya enzim tidak mengubah produk akhir yang dibentuk atau mempengaruhi keseimbangan reaksi, hanya meningkatkan laju suatu reaksi. 2. Enzim bekerja secara spesifik, artinya enzim hanya mempengaruhi substrat tertentu saja. 3. Enzim merupakan protein. Oleh karena itu, enzim memiliki sifat seperti protein. Antara lain bekerja pada suhu optimum, umumnya pada suhu kamar. Enzim akan kehilangan aktivitasnya karena pH yang terlalu asam atau basa kuat, dan pelarut organik. Selain itu, panas yang terlalu tinggi akan membuat enzim terdenaturasi sehingga tidak dapat berfungsi sebagai mana mestinya. BIOKIMIA 8 4. Enzim diperlukan dalam jumlah sedikit. Sesuai dengan fungsinya sebagai katalisator, enzim diperlukan dalam jumlah yang sedikit. 5. Enzim bekerja secara bolak-balik. Reaksi-reaksi yang dikendalikan enzim dapat berbalik, artinya enzim tidak menentukan arah reaksi tetapi hanya mempercepat laju reaksi sehingga tercapai keseimbangan. Enzim dapat menguraikan suatu senyawa menjadi senyawa-senyawa lain. Atau sebaliknya, menyusun senyawa-senyawa menjadi senyawa tertentu. Reaksinya dapat digambarkan sebagai berikut. 6. Enzim dipengaruhi oleh faktor lingkungan. Faktor-faktor yang mempengaruhi kerja enzim adalah suhu, pH, aktivator (pengaktif), dan inhibitor (penghambat) serta konsentrasi substrat. C. Fungsi dan Cara Kerja Enzim Fungsi suatu enzim adalah sebagai katalis untuk proses biokimia yang terjadi dalam sel maupun di luar sel. Suatu enzim dapat mempercepat reaksi 108 sampai 1011 kali lebih cepat daripada apabila reaksi tersebut dilakukan tanpa katalis. Jadi enzim dapat berfungsi sebagai katalis yang sangat efesien, di samping itu mempunyai derajat kekhasan yang tinggi. Seperti juga katalis lainnya, maka enzim dapat menurunkan energi aktivasi suatu reaksi kimia. Enzim mengkatalis reaksi dengan cara meningkatkan laju reaksi. Enzim meningkatkan laju reaksi dengan cara menurunkan energi aktivasi (energi yang diperlukan untuk reaksi). Penurunan energi aktivasi dilakukan dengan membentuk kompleks dengan substrat. Setelah produk dihasilkan, kemudian enzim dilepaskan. Enzim bebas untuk membentuk kompleks baru dengan substrat yang lain. Gambar 4. Cara Kerja Enzim BIOKIMIA 9 D. Kompleks Enzim-Substrat Suatu enzim bekerja secara khas terhadap suatu substrat tertentu. Kekhasan inilah ciri suatu enzim. Ini sangat berbeda dengan katalis lain (bukan enzim) yang dapat bekerja terhadap berbagai macam reaksi. Enzim urease hanya bekerja terhadap urea sebagai substratnya. Ada juga enzim yang bekerja terhadap lebih dari satu substrat namun enzim tersebut tetap mempunyai kekhasan tertentu. Misalnya enzim esterase dapat menghidrolisir beberapa ester asam lemak, tetapi tidak dapat menghidrolisir substrat lain yang bukan ester. Suatu contoh tentang kekhasan ini misalnya enzim arginase bekerja terhadap L-arginin dan tidak terhadap D-arginin. Suatu enzim dikatakan mempunyai kekahasan nisbi apabila ia dapat bekerja terhadap beberapa substrat misalnya esterase dan D-asam amino oksidase yang dapat bekerja D-asam amino dan L-asam amino tetapi berbeda kecepatannya. Karena adanya kekhasan ini maka suatu enzim dapat digunakan untuk memisahkan komponen D dari L pada suatu campuran rasemik. Telah dijelaskan bahwa suatu enzim mempunyai kekhasan yaitu hanya bekerja pada satu reaksi saja. Untuk dapat berkerja terhadap suatu zat atau substrat harus ada hubungan atau kontak antara enzim dengan substrat. Suatu enzim mempunyai ukuran yang lebih besar daripada substrat. Oleh karena itu tidak seluruh bagian enzim dapat berhubungan dengan substrat. Hubungan antara substrat dengan enzim hanya terjadi pada bagian atau tempat tertentu saja. Tempat atau bagian enzim yang mengadakan hubungan atau kontak dengan substrat dinamai bagian aktif (active site). Pada sisi ini, terdapat gugus prostetik yang diduga berfungsi sebagai zat elektrofilik sehingga dapat mengkatalis reaksi yang diinginkan. Hubungan hanya mungkin terjadi apabila bagian aktif mempunyai ruang yang tepat dapat menampung substrat. Apabila substrat mempunyai bentuk atau konformasi lain, maka tidak dapat ditampung pada bagian aktif suatu enzim. Dalam hal ini enzim itu tidak dapat berfungsi sebagai substrat. Ini adalah penjelasan mengapa tiap enzim mempunyai kekhasan terhadap substrat tertentu. Hubungan atau kontak antara enzim dengan substrat menyebabkan terjadinya kompleks enzim-substrat. Kompleks ini merupakan kompleks yang aktif, yang bersifat sementara dan akan terurai lagi apabila reaksi yang diinginkan telah terjadi. BIOKIMIA 10 Gambar 5. Kompleks Enzim-Substrat Cara kerja enzim-substrat dapat dijelaskan dengan dua teori, yaitu teori gembok dan anak kunci, dan teori kecocokan yang terinduksi. 1. Teori gembok dan anak kunci (Lock and key theory) Enzim dan substrat bergabung bersama membentuk kompleks, seperti kunci yang masuk dalam gembok. Di dalam kompleks, substrat dapat bereaksi dengan energi aktivasi yang rendah. Setelah bereaksi, kompleks lepas dan melepaskan produk serta membebaskan enzim. 2. Teori kecocokan yang terinduksi (Induced fit theory) Menurut teori kecocokan yang terinduksi, sisi aktif enzim merupakan bentuk yang fleksibel. Ketika substrat memasuki sisi aktif enzim, bentuk sisi aktif termodifikasi melingkupi substrat membentuk kompleks. Ketika produk sudah terlepas dari kompleks, enzim tidak aktif menjadi bentuk yang lepas. Sehingga, substrat yang lain kembali bereaksi dengan enzim tersebut. Gambar 6. Teori Lock and key dan Induced fit BIOKIMIA 11 E. Tatanama dan Klasifikasi Enzim Satu abad yang lalu, baru ada beberapa enzim yang dikenal dan kebnyakan di antaranya mengatalisis reaksi hidrolisis ikatan kovalen. Semua enzim ini diidentifikasi dengan penambahan akhiran –ase pada nama substansi atau substrat yang dihidrolisisnya (kecuali beberapa enzim proteolitik yang diakhiri dengan -in seperti papain, bromelin, pepsin). Misal, lipase menghidrolisis lemak (Yunani lipos), amilase menghidrolisis pati (Yunani amylon), dan protease menghidrolisis protein. Meskipun peristilahan ini masih tetap bertahan sampai sekarang, pemakaiannya sudah terbukti tidak memadai ketika ditemukan berbagai enzim yang mengkatalisis reaksi yang berbeda terhadap substrat yang sama, misal, oksidasi atau reduksi terhadap fungsi alkohol suatu gula. Sementara akhiran –ase tetap digunakan, nama enzim yang ada sekarang ini lebih menekankan pada tipe reaksi yang dikatalisisnya. Sebagai contoh, enzim dehidrogenase mengkatalisis pengeluaran hidrogen, sementara enzim transferase mengkatalisis reaksi pemindahan gugus. Dengan semakin banyaknya enzim yang ditemukan, ketidakjelasan juga semakin tidak terelakkan, dan kerap kali tidak jelas enzim mana yang tengah dibicarakan oleh seorang peneliti. Untuk mengatasi permasalahan ini, International Union of Biochemistry (IUB) telah mengadopsi sebuah sistem yang kompleks tetapi tidak meragukan bagi peristilahan enzim yang didasarkan pada mekanisme reaksi. Meskipun kejelasan dan pengurangan keraguan tersebut membuat sistem nomenklatur IUB dipakai untuk tujuan riset, nama yang lebih pendek tetap digunakan dalam berbagai kepentingan lain. Berikut beberapa poin penjelasan mengenai sistem nomenkltur IUB : 1. Reaksi dan enzim yang mengatalisis reaksi tersebut membentuk enam kelas, masingmasing mempunyai 4-13 subkelas. (Kelas dan penjelasannya akan dibahas di bawah). 2. Nama enzim terdiri dari 2 bagian. Nama pertama menunjukkan substrat. Nama kedua, yang berakhiran -ase, menyatakan tipe reaksi yang dikatalisis. 3. Informasi tambahan, bila diperlukan untuk menjelaskan reaksi, dapat dituliskan dalam tanda kurung pada bagian akhir; misal, enzim yang mengkatalisis reaksi L-malat + NAD+ ↔ piruvat + CO2 + NADH + H+ diberi nama 1.1.1.37 + L-malat:NAD oksidoreduktase (dekarboksilasi). 4. Setiap enzim mempunyai nomor kode (EC) yang mencirikan tipe reaksi ke dlam kelas (gidit pertama), subkelas (digit kedua), dan subsubkelas (digit ketiga). Digit keempat adalah untuk enzim spesifik. Jadi, EC 2.7.1.1 menyatakan kelas 2 (transferase), subkelas 7 (transfer fosfat), subsubkelas 1 (alkohol merupakan akseptor fosfat). Digit BIOKIMIA 12 terakhir menyatakan heksokinase atau ATP:D-heksosa 6-fosfotransferase, sebuah enzim yang mengatalisis pemindahan fosfat dari ATP ke gugus hidroksil pada atom karbon keenam molekul glukosa. Enam kelompok enzim menurut Commision on Enzymes of the International Union of Biochemistry adalah sebagai berikut : 1. Oksidureduktase Enzim-enzim yang termasuk dalam golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenase dan oksidase. Dehidrogenase bekerja pada reaksi-reaksi dehidrogenase, yaitu reaksi pengambilan atom hidrogen dari suatu senyawa (donor). Hidrogen yang dilepas diterima oleh senyawa lain (akseptor). Reaksi pembentukan aldehida dari alkohol adalah contoh reaksi dehidrogenase. Enzim yang bekerja pada reaksi ini ialah alkohol dehidrogenase. Di sini alkohol adalah donor hidrogen, sedangkan senyawa yang menerima hidrogen adalah suatu koenzim nikotinadenindinukleotida. Enzim-enzim oksidase juga bekerja sebagai katalis pada reaksi pengambilan hidrogen dari suatu substrat. Dalam reaksi ini yang bertindak selaku akseptor hidrogen adalah oksigen. Sebagai contoh enzim glukosa oksidase bekerja sebagai katalis pada reaksi oksidasi glukosa menjadi asam glukonat. 2. Transferase Enzim yang termasuk golongan ini bekerja sebagai katalis pada reaksi pemindahan suatu gugus dari suatu senyawa kepada senyawa lain. Beberapa contoh enzim yang termasuk golongan ini ialah metiltransferase, hidroksimetiltransferase, karboksiltransferase, asiltransferase, dan aminotransferase atau disebut uga transaminase. 3. Hidrolase Enzim yang termasuk dalam kelompok ini bekerja sebagai katalis pada reaksi hidrolisis. Ada tiga jenis hidrolase, yaitu yang memecah ikatan ester, memecah glikosida dan yang memecah ikatan peptida. Beberapa enzim sebagai contoh ialah esterase, lipase, fosfatase, amilase, amino peptidase, karboksi peptidse, pepsin, tripsin, kimotripsin. 4. Liase BIOKIMIA 13 Enzim yang termasuk golongan ini mempunyai peranan penting dalam reaksi pemisahan suatu gugus dari suatu substrat (bukan cara hidrolisis) atau sebaliknya. Contoh enzim golongan ini antara lain dekarboksilase, aldolase, hidratase. 5. Isomerase Enzim yang termasuk golongan ini bekerja pada reaksi perubahan intramolekuler, misalnya reaksi perubahan glukosa menjadi fruktosa, perubahan senyawa L menjadi senyawa D,senyawa sis menjadi senyawa trans dan lain-lain. Contoh enzim yang termasuk dalam golongan ini antara lain ribulosafosfat epimerase dan glukosafosfat isomerase. 6. Ligase Enzim yang termasuk golongan ini bekerja pada reaksi-reaksi penggabungan dua molekul. Oleh karenanya enzim-enzim tersebut juga dinamakan sintetase. Ikatan yang terbentuk dari penggabungan tersebut adalah ikatan C-O, C-S, C-N, atau C-C. Contoh enzim golongan ini antara lain ialah glutamin sintetase dan piruvat karboksilase. F. Kinetika Enzim Persamaan Henri dan Michaelis-Menten Hubungan antara [S] dengan Vo untuk reaksi substrat tunggal atau tunggal semu (pseudo) berupa grafik hiperbola. Gambar 7. Grafik Michaelis-Menten Vo = k2 [Eo] = Vmax [S] [S] + b BIOKIMIA 14 Model kinetika untuk persamaan tersebut dikemukakan oleh Henri (1903) serta Leonor Michaelis dan Maud Menten (Michaelis-Menten). Kedua persamaan mirip, tetapi MichaelisMenten lebih lengkap dan menekankan pentingnya Vo dibandingkan V lainnya. Reaksi antara E dan S dinyatakan sebagai : K1 K2 k-1 Laju pembentukan ES pada waktu t = k1 [E][S] dimana [E] adalah konsentrasi E bebas dan [S] adalah konsentrasi substrat bebas. Asumsi Michaelis-Menten terdapat kesetimbangan antara E,S dan ES, maka : k1 [E][S] = k-1 [ES] [E][S] = k-1 = Ks [ES] k1 Ks = konstanta disosiasi ES Jika [E] = [Eo] - [ES] maka ([Eo] - [ES]) [S] = Ks [ES] Ks[ES] = ([Eo] - [ES]) [S] = [Eo][S] - [ES][S] [ES][S] + Ks[ES] = [Eo][S] [ES] ([S] + Ks) = [Eo][S] Atau [ES] = [Eo][S] [S]+Ks Karena Vo = k2 [ES] = k2[Eo][S] dan Vmax = k2 [Eo], maka : [S] + Ks Vo = k2 [Eo] = Vmax[S] [S]+Ks Karena [S] >>> [E] [S] ≈ [So], maka pada [Eo] kostan, persamaan Michaelis-Menten ditulis sebagai : Vo = Vmax[So] [So]+Ks Persamaan Briggs-Haldan Briggs-Haldan (1925) memodifikasi persamaan Michaelis-Menten dengan asumsi umum transition-state, dengan menganggap [E] dan [ES] <<< [S]. Laju perubahan [ES] diabaikan terhadap laju perubahan [P], dan dalam kesetimbangan harga [ES] tetap konstan. Karena k1[E][S] = k-1[ES] + k2[ES] = [ES][k2+k-1] [E][S] = k-1+k2 = Km BIOKIMIA 15 [ES] k1 Jika [E] = [Eo] - [ES] maka : ([Eo] - [ES])[S] = Km atau [ES] = [Eo][S] [ES] [S] + Km Vo = k2[ES] = k2[Eo][S] [S]+Km Vmax = k2[Eo] = Vmax[S] [S] + Km Karena [S] >>> [E] [S] ≈ [So], maka pada [Eo] konstan, persamaan Michaelis-Menten ditulis sebagai : Vo = Vmax[So] [So] + Km Km (konstanta Michaelis-Menten) dapat dinyatakan sebagai [So] yang memberikan laju = ½ Vmax Plot Lineweaver-Burk Grafik Michaelis-Menten berbentuk parabola, secara teknis kurang praktis, maka oleh Lineweaver-Burk, dibuat reciprocal sehingga diperoleh persamaan garis lurus. 1 = [So] + Km = [So] + Km Vo Vmax[So] Vmax[So] Vmax[So] Maka persamaan Lineweaver-Burk dapat ditulis sebagai : 1 = Km 1 + 1 Vo Vmax [So] Vmax Atau Y = a X + b merupakan persamaan garis lurus. Persamaan Lineweaver-Burk (Double Reciprocal Plot) dapat digunakan untuk menentukan Km dan Vmax. Gambar 8. Grafik Lineweaver-Burk G. Zat Aktivator dan Inhibitor pada Enzim Aktivator merupakan molekul yang mempermudah ikatan antara enzim dengan substratnya, misalnya ion klorida yang bekerja pada enzim amilase. Inhibitor merupakan suatu BIOKIMIA 16 molekul yang menghambat ikatan enzim dengan substratnya. Inhibitor akan berikatan dengan enzim membentuk kompleks enzim-inhibitor. Oleh karena inhibitor menghambat fungsi enzim, inhibitor sering digunakan sebagai obat. Contohnya adalah inhibitor yang digunakan sebagai obat aspirin. Aspirin menginhibisi enzim COX-1 dan COX-2 yang memproduksi pembawa pesan peradangan prostaglandin, sehingga ia dapat menekan peradangan dan rasa sakit. Hambatan yang dilakukan oleh inhibitor dapat berupa hambatan tidak reversibel dan hambatan reversibel. Hambatan tidak reversibel pada umumnya disebabkan oleh terjadinya proses destruksi atau modifikasi sebuah gugus fungsi atau lebih yang terdapat pada molekul enzim. Dengan demikian mengurangi aktivitas katalitik enzim tersebut. Sebagai contoh inhibitor dalam hal ini ialah molekul iodoase-tamida yang dapat bereaksi dengan gugus –SH suatu enzim tertentu. Reaksi ini berlangsung tidak reversibel sehingga menghasilkan produk reaksi dengan sempurna. Inhibitor lain ialah diisopropil fosfofluoridat. Inhibitor ini termasuk senyawa fosfor organik yang bersifat racun, karena dapat berikatan dengan asetilkolin esterase yang terdapat dan berfungsi pada sistem syaraf pusat. Dengan terbentuknya ester ini maka enzim tidak dapat berfungsi sebagaimana mestinya, sehingga dapat mengganggu kerja sel syaraf pusat. Ester yang terbentuk berifat stabil dan tidak mudah terhidrolisis. Dengan demikian hambatan yang diakibatkan oleh diisopropilfosfofluoridat ini merupakan hambatan tidak reversibel. Hambatan reversibel terdiri dari 2 macam yaitu Inhibitor kompetitif dan nonkompetitif : 1. Inhibitor kompetitif : Molekul penghambat yang strukturnya mirip substrat, sehingga molekul tersebut berkompetisi dengan substrat untuk bergabung pada sisi aktif enzim. Contoh : sianida bersaing dengan oksigen untuk mendapatkan Hemoglobin pada rantai akhir respirasi. Inhibitor kompetititif dapat diatasi dengan penambahan konsentrasi substrat. 2. Inhibitor nonkompetitif : Molekul penghambat yang bekerja dengan cara melekatkan diri pada bagian bukan sisi aktif enzim. Inhibitor ini menyebabkan sisi aktif berubah sehingga tidak dapat berikatan dengan substrat. Inhibitor nonkompetitif tidak dapat dipengaruhi oleh konsentrasi substrat. Penggabungan antara inhibitor dengan enzim ini terjadi pada enzim bebas, atau pada enzim yang telah mengikat substrat (kompleks enzim-substrat). Keduanya, baik kompleks EI maupun EIS bersifat inaktif karena tidak menghasilkan reaksi yang diharapkan. Contoh inhibitor nonkompetitif yang banyak dikenal ialah ion-ion logam berat (Cu2+, Hg2+ dan Ag+) yang dapat berhubungan dengan BIOKIMIA 17 gugus –SH yang terdapat pada sistein dalam enzim. Dengan cara berikatan dengan logam berat maka gugus –SH tidak lagi mempunyai aktivitas katalitik bagi enzim tersebut. Beberapa jenis enzim yang membutuhkan ion logam berat sebagai aktivator dapat pula mengalami hambatan tidak bersaing dengan ion yang dapat mengikat aktivator tersebut. Ion CN- dapat menghambat enzim yang menggunakan ion Fe2+ atau Fe3+, karena terbentuknya ion kompleks ferosianida atau ferisianida yang bersifat inaktif. Demikian pula etilen diamida tetra asetat (EDTA) dapat mengikat ion-ion bervalensi dua misalnya Mg2+ sehingga dapat pula menghambat enzim yang menggunakan ion tersebut sebagai aktivatornya. Gambar 9. Inhibitor Kompetitif dan Nonkompetitif Ketika dilihat dari tempat berikatan inhibitor, berbagai sumber menyebutkan ada 3 jenis pembagian hambatan reversibel, yaitu : Hambatan Kompetitif, Hambatan Unkompetitif dan Hambatan Campuran atau yang telah dibahas di atas sebagai Hambatan Nonkompetitif. Pada Hambatan Kompetitif, inhibitor berikatan dengan enzim pada sisi aktifnya. Pada Hambatan Unkompetitif , inhibitor hanya dapat berikatan dengan kompleks enzim-substrat. Pada Hambatan Campuran, inhibitor dapat berikatan dengan enzim maupun dengan kompleks enzim-substrat. Berikut adalah gambar penjelasannya : BIOKIMIA 18 Gambar 10. Tiga Macam Hambatan Reversibel (sumber : Lehninger, 2004) Hambatan Umpan Balik / Feed-back inhibition Gambar 11. Hambatan Umpan Balik BIOKIMIA 19 Pada contoh di atas, reaksi A B dapat mengalami hambatan oleh E yang merupakan hasil akhir serangkaian reaksi. Hambatan semacam ini disebut hambatan umpan balik / feedback inhibition dan berfungsi sebagai mekanisme pengatur reaksi-reaksi kimia dalam tubuh, misalnya reaksi pembentukan asam-asam amino. Isoleusin dapat dihasilkan dari treonin melalui lima tahapan reaksi. Enzim treonin deaminase yang bekerja pada tahap pertama dihambat oleh isoleusin yang terjadi pada tahap akhir apabila konsentrasi isoleusin cukup besar. Oleh karena reaksi ini merupakan reaksi reversibel, maka apabila konsentrasi isoleusin berkurang, treonin deaminase menjadi aktif kembali dan dengan demikian, isoleusin terbentuk lagi. BIOKIMIA 20 BAB III KARBOHIDRAT A. Struktur dan Klasifikasi Karbohidrat Karbohidrat memiliki nama lain sakharida yang berarti manis/ gula. Sukrosa dari tebu, laktosa dari susu dan selulosa pada tumbuhan memiliki unsur karbon (C), hidrogen (H) dan oksigen (O), sehingga karbohidrat berdasarkan ilmu kimia juga dapat diartikan sebagai polihidroksi-aldehid ataupun polihidroksi-keton beserta turunannya. Karbohidrat dihasilkan oleh tumbuhan melalui anabolisme pada proses fotosintesis. Contoh zat yang dihasilkan dari proses fotosintesis adalah glukosa. Glukosa disintesis tumbuhan dengan reaksi sebagai berikut: 6 CO2 (karbondioksida) + 6 H2O (air) C6H12O6 (glukosa) + 6 O2 (oksigen) Sedangkan glukosa dalam jaringan tubuh manusia akan dioksidasi melalui proses respirasi sehingga melepaskan energi kimia guna melakukan kerja dalam sel, gas sisa CO2 dan H2O yang dihasilkan akan dilepaskan ke lingkungan. Gambar 12. Reaksi Fotosintesis Proses fotosintesis dan respirasi inilah yang dikenal sebagai metabolisme (siklus karbon). Berdasarkan jumlah unitnya, maka karbohidrat dibedakan menjadi 3 tipe, yaitu: monosakarida, oligosakarida dan polisakarida. Monosakarida Karbohidrat sederhana yang tidak dapat diuraikan atau pun dihidrolisis menjadi karbohidrat yang lebih kecil lagi dikenal sebagai monosakarida. Pada umumnya monosakarida tersusun dari 3-6 atom C, gugus karbonil berupa aldehid atau keton dan beberapa gugus hidroksil. Berdasarkan struktur kimia, atom C monosakarida berupa rantai lurus tak bercabang, salah satu atom C-nya adalah gugus karbonil dan atom C lainnya BIOKIMIA 21 mengikat gugus hidroksil. Adanya gugus karbonil pada monosakarida menyebabkan adanya 2 tipe, yaitu aldosa dan ketosa. Aldosa adalah monosakarida dengan gugus aldehid (-COH) yang terletak pada atom C nomor satu. Apabila 3 atom C dengan gugus aldehid pada monosakarida disebut aldo-triosa, jika 4 atom C dengan gugus aldehid pada monosakarida disebut aldo-tetrosa, 5 atom C dengan gugus aldehid pada monosakarida disebut aldo-pentosa dan 6 atom C dengan gugus aldehid pada monosakarida disebut aldo-heksosa. Sedangkan ketosa adalah monosakarida dengan gugus keton (-CO-) yang terletak pada atom C nomor dua. Sama halnya dengan aldosa, penyebutan 3 atom C dengan gugus keton pada monosakarida disebut keto-triosa, begitu pun seterusnya hingga 6 atom C. Gambar 12. Struktur Senyawa Aldosa dan Ketosa Struktur monosakarida dapat berupa rantai terbuka (asiklik) dan rantai tertutup (siklik). Untuk rantai terbuka mempergunakan proyeksi Fisher, pada bagian atas struktur merupakan lokasi gugus yang mudah teroksidasi dan atom C kiral digambarkan sebagai perpotongan garis vertikal-horizontal. Pada proyeksi Fisher, gugus –OH pada atom C kiral terjauh dari gugus karbonil menentukan suatu isomer L (Levo/ kiri) dan D (Dekstro/ kanan). Gambar 13. Proyeksi Fisher dari Gugus Karbonil BIOKIMIA 22 Bila jumlah atom C kiral (asimetris) meningkat, maka jumlah isomer optik pun meningkat. Jumlah total dari isomer dapat ditentukan dengan menggunakan aturan Van’t Hoff yang menyatakan bahwa suatu senyawa yang mempunyai n atom C kiral, maksimum mempunyai 2n stereoisomer. Contoh: n = 3, maka terdapat 23 atau 8 stereoisomer (4 buah konfigurasi D dan 4 buah konfigurasi L). Gambar 14. Struktur Stereoisomer Glukosa Struktur siklik dari monosakarida dapat dibuat melalui proyeksi Haworth, dengan langkah sebagai berikut: 1. Beri nomor rantai karbon dan putar searah jarum jam ke bentuk linier rantai terbuka. 2. Lipat menjadi heksagon dengan ikatan pada atom C-5 dan C-1 terhadap –O--, tempatkan lokasi gugus C-6 berada di atas cincin, untuk yang lainnya melengkapi sesuai lipatan. 3. Tulis gugus –OH pada C-1. Di atas untuk bentuk β dan di bawah untuk bentuk α. Gambar 15. Proyeksi Haworth dari Glukosa BIOKIMIA 23 Ketika terdapat dalam larutan, struktur siklik terbuka dan tertutup, α-D-glukosa berubah ke β-D-glukosa, begitupun sebaliknya. Hal tersebut menyebabkan pada setiap saat, hanya sebagian kecil ditemui rantai terbuka/ asiklik. Berikut ini adalah beberapa monosakarida yang penting bagi manusia. Gambar 16. Struktur Monosakarida a. D-glukosa/ dekstrosa, terdapat pada buah, sayur, sirup jagung dan madu. D-glukosa merupakan bahan bakar utama pada makhluk hidup. Pada manusia normal kadar glukosa darah bernilai 70-90 mg/dL. b. D-galaktosa, tidak terdapat bebas di alam karena didapatkan dari hasil hidrolisis laktosa dan berperan sebagai epimer. c. D-fruktosa adalah ketoheksosa yang berasa manis, kemanisannya 2x lebih manis dari sukrosa. Oligosakarida/ Disakarida Oligosakarida adalah polimer dengan berat molekul rendah, umumnya banyak terikat pada polipeptida dalam glikoprotein dan beberapa glikolipid atau secara struktur menyatakan bahwa oligosakarida berupa gabungan dari 2-8 unit/ monomer monosakarida. Monomer-monomer tersebut dapat bergabung disebabkan adanya ikatan glikosidik (dijelaskan dalam MK Kimia Dasar 2) di antara monomer gula sederhana. Penamaan disakarida didasari karena adanya minimal 2 monomer gula sederhana yang terikat. Berikut adalah beberapa disakarida: BIOKIMIA 24 1. Maltosa/ gula malt adalah disakarida yang jika dihirolisis akan menghasilkan glukosa dan glukosa. Maltosa terikat oleh ikatan α-1,4-glikosidik yg dibentuk dari α−OH pd C1 glukosa pertama dan −OH pd C4 glukosa ke dua. Ikatan glikosidik mengikat 2 molekul glukosa dengan melepaskan satu molekul air. Maltosa memiliki 2 anomer yaitu anomer α dan β. Karbon anomerik ini juga terbuka membentuk gugus aldehida bebas yang dapat dioksida sehingga maltosa adalah gula pereduksi. Free α-OH Gambar 17. Struktur Haworth Maltosa 2. Laktosa/ gula susu adalah disakarida yang jika dihidrolisis menghasilkan glukosa dan galaktosa. Laktosa terdapat dalam air susu dan produk susu olahan. Ikatan dalam laktosa adalah ikatan β-1,4 glikosidik karena anomer β dari galaktosa membentuk asetal dengan gugus –OH pada atom C-4 dari glukosa. Dalam molekul laktosa, asetal dari galaktosa tidak dapat dibuka, namun karbon hemiasetal dalam glukosa dapat mengalami mutarotasi membentuk α dan β-laktosa. Rantai terbuka membunyai aldehid bebas, maka dapat mengoksidasi sehingga laktosa adalah gula pereduksi. BIOKIMIA 25 rm αα-f-ofo rm Gambar 18. Struktur Haworth Laktosa 3. Sukrosa/ gula meja adalah disakarida terbanyak di alam. Pada umumnya sukrosa untuk gula meja berasal dari gula tebu dan gula bit. Sukrosa terdiri atas molekul α-D-glukosa dan β-fruktosa yang berikatan dengan ikatan α,β-1,2 glikosidik. Struktur sukrosa berbeda dengan disakarida lainnya karena ikatan glikosida terjadi antara atom Canomerik dari kedua monosakarida pembentuknya, sehingga tidak terdapat isomer sukrosa. Tanpa gugus aldehid bebas, maka sukrosa tidak terjadi mutarotasi dan sukrosa bukan gula pereduksi. α-D-glucose β -D-fructose Gambar 19. Struktur Haworth Sukrosa BIOKIMIA 26 4. Selobiosa adalah produk degradasi selulosa yang mengandung 2 molekul glukosa yang terikat dengan ikatan β-1,4 glikosidik. Struktur kimianya identik dengan maltosa, kecuali ikatan glikosidiknya dan selobiasa tidak terdapat di bebas di alam. Polisakarida Polisakarida adalah polimer dari banyak monosakarida yang berikatan satu sama lain, terdapat 2 polisakarida yaitu homopolisakarida dan heteropolisakarida. Homopolisakarida tersusun dari satu jenis monosakarida dan terdapat banyak di alam, yaitu pati/ amilum, glikogen, selulosa dan kitin yang jika dihidrolisis akan menghasilkan D-glukosa, kecuali kitin. Kitin akan menghasilkan turunan glukosa berupa N-asetil glukosamina jika dihidrolisis. Kitin yang diperkeras dengan kalsium karbonat Gambar 20. Struktur Haworth Kitin BIOKIMIA 27 Sedangkan heteropolisakarida tersusun dari dua atau lebih monosakarida, sehingga heteropolisakarida merupakan polimer karbohidrat dengan bobot molekul tinggi. Yang termasuk heteropolisakarida adalah glikosaminoglikan dan murein/ peptidoglikan. B. Metabolisme Karbohidrat Kegiatan metabolisme karbohidrat berupa penguraian polisakarida dan oligosakarida menjadi monosakarida/ gula sederhana untuk diubah menjadi energi kimia melalui beberapa tahap, yang sering dikenal dengan istilah katabolisme. Penguraian karbohidrat terlaksana mulai dari cavum oris dengan bantuan enzim amilase/ ptialin, yang selanjutnya melewati esofagus menuju gaster untuk selanjutnya dilakukan pencernaan secara kimiawi dan mekanik hingga terjadi penyerapan gula sederhana berupa glukosa. Glukosa yang diserap intestinum-illeum masih terjadi proses/ tahapan untuk menjadi energi yang dibutuhkan tubuh. Tahapan tersebut adalah glikolisis, siklus krebs dan tranportasi elektron. Pada peristiwa glikolisis, glukosa (gula yang mempunyai 6 atom karbon) dibagi menjadi dua molekul gula yang mempunyai 3 atom karbon. Glikolisis menghasilkan 2 molekul ATP (energi bebas molekul), 2 molekul asam piruvat dan 2 elektron energi tinggi pembawa molekul NADH. Glikolisis dapat terjadi dengan atau tanpa oksigen. Jika terdapat oksigen, glikolisis ini adalah tahapan pertama dari respirasi seluler (aerob). Namun jika tidak terdapat oksigen/ anaerob, pada glikolisis hanya dihasilkan sedikit ATP dibandingkan yang aerob. Langkah pertama pada glikolisis adalah penambahan gugus fosfat oleh heksokinase fosforilat pada glukosa di sitoplasma. Dalam proses ini, gugus fosfat dari ATP ditransfer ke glukosa menghasilkan glukosa 6-fosfat. Reaksi ini tidak dapat kembali (irreversible). Glukosa (C6H12O6) + heksokinase + ATP → ADP + Glukosa 6-fosfat (C6H11O6P1) Selanjutnya enzim fosfoglukoisomerase mengubah glukosa 6-fosfat menjadi isomernya, yaitu fruktosa 6-fosfat. Isomer adalah senyawa yang memiliki rumus molekul sama, tetapi berbeda susunan atom-atomnya. Reaksi pada langkah ini bersifat reversible. Glukosa 6-fosfat (C6H11O6P1) + Fosfoglukoisomerase → Fruktosa 6-fosfat (C6H11O6P1) Berikutnya adalah peran enzim fosfofruktokinase dalam menggunakan molekul ATP lain untuk mentransfer gugus fosfat menjadi fruktosa 6-fosfat untuk membentuk fruktosa 1, 6bisfosfat. Fruktosa 6-fosfat (C6H11O6P1) + fosfofruktokinase + ATP → ADP + Fruktosa 1,6bisfosfat (C6H10O6P2) BIOKIMIA 28 Enzim aldolase membagi fruktosa 1,6-bisfosfat menjadi dua gula yang berisomerisasi satu sama lain. Kedua gula tersebut adalah fosfat dihidroksiaseton dan fosfat gliseraldehida. Fruktosa 1, 6-bisfosfat (C6H10O6P2) + aldolase → dihidroksiaseton fosfat (C3H5O3P1) + gliseraldehida fosfat (C3H5O3P1) Gambar 21. Jalur Glikolisis Enzim triose fosfat isomerase mengubah molekul dihidroksiaseton fosfat dan gliseraldehida fosfat. Gliseraldehida fosfat dihapus setelah dibentuk untuk digunakan pada langkah glikolisis berikutnya. Dihidroksiaseton fosfat (C3H5O3P1) → gliseraldehida fosfat (C3H5O3P1) Hasil dari dua langkah sebelumnya adalah fruktosa 1, 6-bisfosfat (C3H5O3P1) ⇌ 2 molekul gliseraldehida fosfat (C3H5O3P1) BIOKIMIA 29 Enzim triose fosfat dehidrogenase memiliki dua fungsi dalam langkah ini. Pertama transfer enzim hidrogen (H-) dari gliseraldehida fosfat ke oksidator nikotinamida adenin dinukleotida (NAD+) untuk membentuk NADH. Selanjutnya menambahkan fosfat (P) dari sitosol ke gliseraldehida fosfat teroksidasi untuk membentuk 1, 3-bisfosfogliserat. Proses ini melibatkan dua molekul gliseraldehida fosfat yang dihasilkan pada langkah di atas. 1. Triose fosfat dehidrogenase + 2 H- + 2 NAD+ → 2 NADH + 2 H+ 2. Triose fosfat dehidrogenase + 2 P + 2 gliseraldehida fosfat (C3H5O3P1) → 2 molekul dari 1,3-bisfosfogliserat (C3H4O4P2) Enzim fosfogliserokinase memindahkan P dari 1,3-bissfosfogliserat ke molekul ADP untuk membentuk ATP, yang terjadi untuk setiap molekul dari 1,3-bisfosfogliserat. Proses ini menghasilkan 2 molekul 3-fosfogliserat dan 2 molekul ATP. 2 molekul 1,3-bisfosfogliserat (C3H4O4P2) + fosfogliserokinase + 2 ADP → 2 molekul 3fosfogliserat (C3H5O4P1) + 2 ATP Enzim fosfogliseromutase memindahkan P dari 3-fosfogliserat dari karbon ketiga menuju karbon kedua untuk membentuk 2-fosfogliserat. 2 molekul 3-fosfogliserat (C3H5O4P1) + fosfogliseromutase → 2 molekul 2-fosfogliserat (C3H5O4P1) Enzim enolase melepas molekul air dari 2-fosfogliserat untuk membentuk asam fosfoenolpiruvat (PEP). Hal ini terjadi untuk setiap molekul 2-fosfogliserat. 2 molekul 2-fosfogliserat (C3H5O4P1) + enolase → 2 molekul asam fosfoenolpiruvat (PEP) (C3H3O3P1) Enzim piruvat kinase memindahkan P dari PEP ke ADP untuk membentuk asam piruvat dan ATP. Hal ini terjadi untuk setiap molekul PEP. Reaksi ini menghasilkan 2 molekul asam piruvat dan 2 molekul ATP. 2 molekul PEP (C3H3O3P1) + piruvat kinase + 2 ADP → 2 molekul asam piruvat (C3H4O3) + 2 ATP Piruvat hasil glikolisis selanjutnya akan diubah menjadi asetil ko-A dalam keadaan oksigen. Reaksi ini merupakan reaksi penghubung antara glikolisis dengan jalur metabolisme siklus krebs. Reaksi ini terjadi di mitokondria yang dikatalisis oleh kompleks enzim piruvat dehidrogenase yang melibatkan 3 jenis enzim (piruvat dehidrogenase, dihidrolipoli transasetilase dan dihidrolipoli dehidrogenase) dan 5 jenis koenzim (tiaminpirofosfat, asam BIOKIMIA 30 lipoat, koenzim-A, flavin adenin dinukleotida dan nikotinamid adenin dinukleotida). Asetil koA yang terbentuk akan masuk ke siklus krebs. Siklus Krebs/ siklus trikarboksilat (asam sitrat) yang merupakan pembongkaran asam piruvat secara aerob menjadi CO2, H2O dan energi kimia (ATP). Siklus krebs terdapat dalam sel hewan, tumbuhan dan jasad renik aerob, serta merupakan salah satu tahap dari respirasi. Siklus krebs terjadi di dalam mitokondria dan dikatalisis oleh enzim yang terdapat dalam matriks mitokondria, yang memudahkan pemindahan ekuivalen pereduksi ke enzim-enzim respirasi yang letaknya dekat membran mitokondria. Gambar 22. Siklus TCA (Tricaboxylic Acid) Tahapan terakhir dari metabolisme adalah transportasi elektron. Imbasan dari siklus krebs keluarnya elektron dan ion H+ yang dibawa sebagai NADH2 dan FADH2 sehingga di dalam mitokondria akan terbentuk air H2O sebagai hasil sampingan dari respirasi. Glukoneogenesis Glukoneogenesis adalah proses pembentukan molekul glukosa baru dari prekusor nonkarbohidrat yang terjadi di dalam hati. Prekursor tersebut antara lain laktat, piruvat, gliserol dan asam-asam α-keto tertentu yang diturunkan dari asam-asam amino. Pada situasi tertentu BIOKIMIA 31 (seperti asidosis/ kelaparan), ginjal mampu membuat glukosa baru. Pada kondisi kecukupan makanan, kadar glukosa darah dipertahankan oleh hidrolisis glikogen di hati. Namun, ketika glikogen di hati habis, alur glukoneogenesis yang akan mengambil peranan sehingga tubuh mendapat kadar glukosa yang cukup. Otak dan sel darah mengandalkan glukosa sebagai sumber energi, namun pada keadaan luar biasa, sel otak mampu menggunakan turunan asamasam lemak tertentu untuk menghasilkan energi. Urutan reaksi dalam glukoneogenesis merupakan reaksi kebalikan dari glikolisis. Namun, terdapat 3 reaksi glikolisis yang tidak dapat balik (irreversible), yaitu reaksi yang dikatalisis glukokinase, reaksi yang dikatalisis oleh fosfofruktokinase dan reaksi yang dikatalisis oleh piruvat kinase. Substrat utama untuk glukoneogenesis adalah asam-asam amino yang diturunkan dari otot, laktat yang dibentuk di otot dan sel darah merah, dan gliserol yang diproduksi dari degradasi triasilgliserol. Selain itu, reaksi glikolisis terjadi di sitoplasma sedangkan beberapa reaksi glukoneogenesis terjadi di dalam mitokondria (reaksi yang dikatalisis oleh piruvat karboksilase dan dalam beberapa spesies dikatalisis oleh fosfoenol piruvat karboksikinase) dan dalam retikulum endoplasma (reaksi dikatalisis oleh glukosa-6-fosfotase). Gambar 23. Jalur Glikoneogenesis BIOKIMIA 32 Gambar 24. Hubungan Jalur Glikolisis dan Glukoneogenesis Glikogenesis dan Glikogenolisis Sintesis glikogen (glikogenesis) dan katabolisme glikogen (glikogenolisis) diatur secara detail sehingga kecukupan glukosa untuk tubuh dapat menghasilkan energi dapat dipertahankan. Kedua proses tersebut dipengaruhi oleh hormon insulin, glukagon dan epinefrin. Insulin yang dihasilkan oleh kelenjar pankreas berfungsi menurunkan kadar glukosa dengan menaikkan pembentukan glikogen dari glukosa. Sedangkan epinefrin (adrenalin) dan glukagon berperan dalam menaikkan kadar glukosa dalam darah. Bila kadar glukosa darah tinggi, maka sintesis glikogen terjadi setelah makan, yaitu glukosa-6-fosfat dan glukosa-1- BIOKIMIA 33 fosfat sebagai senyawa antara. Kebalikannya adalah glikogenolisis, yaitu penguraian glikogen menjadi glukosa, yang sama-sama mempergunakan senyawa antara tersebut. Siklus Pentosa Fosfat (SPF) Siklus pentosa fosfat merupakan alur metabolik alternatif untuk oksidasi glukosa yang tidak menghasilkan ATP. Siklus ini berlangsung dalam cairan sitoplasma. SPF terjadi dalam 2 fase, yaitu oksidatif dan non-oksidatif. Fase oksidatif mengubah glukosa-6-fosfat menjadi ribulosa-5-fosfat yang diikuti oleh produksi 2 molekul NADPH. Sedangkan fase non-oksidatif melibatkan proses isomerasi dan kondensasi dari sejumlah molekul karbohidrat berbeda. SPF bertugas menghasilkan bentuk energi di luar mitokondria, selain NADH yaitu NADPH (nikotinamid adenin dinukleotida fosfat). Bentuk energi tersebut digunakan untuk proses biosintesis. Tugas lainnya adalah sebagai penghasil senyawa antara pentosa (ribosa-5-fosfat) untuk biosintesis asam nukleat, untuk masuk ke glikolisis dan terjadilah metabolisme fotosintesis. BIOKIMIA 34 Gambar 25. Jalur Pentosa Pospat BIOKIMIA 35 BAB IV PROTEIN A. Asam Amino dan Protein Asam amino adalah senyawa penyusun protein. Asam amino mempunyai satu gugus karboksil dan satu gugus amino. Pada umumnya gugus amino terikat pada posisi α dari gugus karboksil. basa asam NH3 NH2 R CH COOH asam -amino R CH COO- ion switter pH : 7,4 (Amfoter) Gambar 26. Struktur Asam Amino Protein tersusun atas asam amino (Amino Acids) berantai panjang dan setiap Protein-nya menjadi berbeda karena tersusun atas 20 Asam Amino yang urutan-nya unik. Protein adalah biomolekul yang sangat penting. Berdasarkan jumlahnya, protein hampir sepertujuh dari berat orang. Misalkan saja berat orang 70 kg maka jumlah proteinnya adalah 10 kg. Sebagian besar protein berada di otot. Metabolisme protein menentukan kesimbangan nitrogen. Keseimbangan nitrogen dinyatakan sebagai banyaknya nitrogen yang masuk dan yang keluar. Kebutuhan protein ditentukan dari keseimbangan nitrogen. Masa hidup protein sangat singkat yaitu 2-8 hari. Didalam tubuh protein dipecah menjadi asam amino tetapi dalam waktu bersamaan protein baru juga diresintesis untuk mengganti yang lama. Proses ini disebut Turn Over. Proteolisis adalah penguraian protein menjadi asam amino. B. Metabolisme Protein Transaminasi dan Deaminasi Selama degradasi protein, nitrogen amino terakumulasi dan tidak dapat digunakan untuk produksi energi oksidatif. Gugus amino yang tidak dapat digunakan lagi untuk biosintesis digabungkan dengan urea dan diekskresi. Reaksi transfer gugus-NH2 yang penting adalah transaminase dan deaminasi. BIOKIMIA 36 Transaminasi Proses transaminase dikatalis oleh enzim transaminase yang terlibat dalam katabolitik dan anabolitik asam amino. Proses kombinasi deaminasi dan aminasi sebagai berikut: Asam amino 1 + α keto glutarat asam amino 2 + L-glutamat Contoh reaksi transaminase yang penting: L-aspartat + α keto glutarat oksaloasetat + L glutamate L-alanin + α keto glutarat piruvat + L glutamate L-leusin + α keto glutarat α ketoisokaproat + L glutamate L-tirosin + α keto glutarat p hidroksifenilpiruvat + L glutamate OH HO P O N O O OH pyridoxal phosphate OH O HO NH2 N P OH OH OH pyridoxamine phosphate Gambar 27. Proses transaminase BIOKIMIA 37 Enzim transaminase mempunyai dua subunit dengan kofaktor piridoksal phospat (PLP). PLP diikat oleh enzim melalui interaksi nonkovalen dan ikatan basa Schiff pada residu lysin disisi aktifnya. Deaminasi Deaminasi adalah reaksi pelepasan asam amino sebagai ammonia. Deaminasi hidrolitik adalah pelepasan NH3 dari gugus amida. Contohnya pada reaksi glutaminase. Deaminasi eliminasi adalah proses eliminasi gugus NH3. Sedangkan deaminasi oksidatif adalah gugus amino dioksidasi menjadi gugus imino oleh NAD+ atau NADP+, kemudian gugus imino dilepaskan dengan hidrolisis. Contohnya pada reaksi glutamate dehydrogenase. Degradasi Asam Amino Asam amino walaupun berfungsi utama sebagai unit pembangun bagi biosintesisis protein, asam amino dapat mengalami degradasi oksidatif dalam keadaan 3 metabolik, yaitu: Selama siklus normal protein, jika sam amino dibebaskan tidak diperlukan untuk sintesis protein tubuh yang baru. Asam amino tidak dapat disimpan, jika yang masuk dari diet makanan jumlahnya melebihi kebutuhan untuk untuk sintesis protein maka kelebihannya di degradasi. Selama puasa atau penderita DM, jika karbohidrat tiak tersedia atau tidak dapat dimanfaatkan maka asam amino dari protein didegradasi untuk menghasilkan glukosa yang akan masuk ke siklus TCA. Diagram Katabolisme Asam Amino pada Mamalia Degradasi asam amino di hati melepaskan ammonia (NH3) baik langsung maupun tidak langsung. Ammonia adalah basa kuat, racun bagi sel. Pada konsentrasi tinggi dapat merusak saraf sel. Karenanya NH3 harus segera di sekresi. Berdasarkan bentuk eksresi ammonia, hewan dibedakan menjadi: 1. Ammonotelik : ammonia disekresi secara langsung 2. Ureotelik : ammonia dieksresi dalam bentuk urea 3. Uricotelik : ammonia disekresi dalam bentuk asam urat BIOKIMIA 38 O H N NH2 O H2N NH3 N H O ammonia NH urea N H O uric acid Gambar 28. Struktur ammonia, urea dan asam urat Siklus Glukosa Alanin muscle protein asam amino NH4+ Glukosa Piruvat glikolisis Alanin Blood glucose glutamat alpha-ketoglutarat Blood alanin Alanin alpha-ketoglutarat glutamat Glukosa piruvat glukoneogenesis Gambar 29. Siklus Glukosa-Alanin Alanin mentransport asam amino ke hati dalam bentuk non toksik melalui jalur siklus glukosa-alanin Glutamate diubah menjadi glutamin untuk ditransport ke hati Atau glutamate mentransfer gugus α-aminonya ke piruvat hasil glikolisis otot Alanine yang terbentuk di bawa ke hati melalui darah BIOKIMIA 39 Di hati, gugus amino dari alanine di transfer ke- α -ketoglutarat membentuk piruvat dan asam glutamate kembali. Katabolisme Kerangka Karbon Kerangka karbon dari 20 jenis asam amino hanya menghasilkan 7 hasil degradasi yang berbeda, yang semuanya dapat masuk ke dalam siklus kreb untuk dioksidasi sempurna menghasilkan CO2 dan H2O, yaitu sectyl Co-A, Acetoacetyl Co-A, pyruvate, oxaloacetate, fumarat, succinyl Co-A, dan α-ketoglutarat. Ringkasan katabolisme asam amino sebagai berikut: leusin lysin phenilalanin triptopan tirosin arginin histisin prolin glutamin glutamat isoleusin methionin threonin valin isositrat aacetoacetyl Co-A alpha-ketoglutarat citrate succinyl Co-AS acetyl Co-A CITRIC ACID CYCLE succinat oxaloasetat isoleusin leusin phenilalanin tirosin fumarat malat piruvat triptopan alanin sistein glysin serin triptopan asparagina aspartat Gambar 30. Rangkuman katabolisme kerangka karbon BIOKIMIA 40 BIOSINTESIS ASAM AMINO Semua kerangka karbon asam amino diturunkan dari kerangka intermediet yang berasal dari tiga sumber yaitu: glikolisis, TCA dan jalur pentose phospat. BIOSINTESIS PROTEIN Ada 5 tahap sintesis protein yaitu: 1) aktivasi asam amino, 2) inisiasi rantai polipeptida, 3) pemanjangan, 4) terminasi, dan 5) pelipatan dan pengolahan. Tahap 1: Aktivasi asam amino Terjadi di dalam sitosol, bukan pada ribosom Masing-masing dari 10 asam amino ini diikat secara kovalen dengan suatu RNA, dengan memanfaatkan energi ATP Dikatalis oleh enzim pengaktif dengan Mg2+ sebagai kofaktor Masing-masing spesifik bagi satu asam amino dan bagi t-RNA nya Tahap 2: Inisiasi Rantai Polipeptida RNA pembawa sandi bagi polipeptida yang akan diikat oleh Sub unit ribosom yang berukuran lebih kecil, diikuti oleh inisiasi asam amino yang diikat oleh t-RNA nya membentuk suatu kompleks inisiasi t-RNA Asam amino penginisiasi berpasangan dengan triplet nukleotida spesifik/ kodon mRNA yang menyandi permulaan rantai polipeptida Proses diatas memerlukan GTP Dilangsungkan oleh tiga faktor inisiasi (proses sitosol) Tahap 3: Pemanjangan Asam amino diangkut menuju ribosom dan diletakan ke tempatnya secara benar oleh t-RNA masing-masing yang berapasangan dengan kodonnya pada molekul RNA pembawa pesan Pemanjangan digiatkan oleh protein sitosol Energi untuk mengikat setiap aminoasil t-RNA yang datang dan untuk pergerakan ribosom disepanjang m RNA satu kodon hidrolisis dua molekul GTP Tahap 4: Terminasi dan Pembebasan Penyempurnaan rantai polipeptida, yang dicirikan oleh suatu kodon terminasi m-RNA Diikuti oleh pembebasannya dari ribosom, yang dilangsungkan oleh faktor pembebas Tahap 5: Pelipatan dan Pengolahan Untuk memperoleh bentuk aktifnya secara biologis polipeptida baru mengalami pelipatan menjadi konformasi 3D yang benar Sebelum atau setelah pelipatan, polipeptida baru dapat mengalami pengolahan oleh kerja enzimatik untuk melepaskan asam amino penginisiasi, mengikat gugus phospat, metil, karboksil dan gugus lainnya. BIOKIMIA 41 GLUKOSA GLUKOSA-6-PHOSPAT RIBOSE-6-PHOSPAT 4-step HYSTIDINE ERITROS 6-PHOSPAT SERIN 3-PHOSPOGLISERAT PHOSPOENOL PIRUVAT TRIPTOPAN PHENILALANIN TYROSIN GLYSIN SISTEINA ALANIN VALIN LEUSIN ISOLEUSIN PIRUVAT CITRAT ALPHA-KETOGLUTARAT OXALOACETAT GLUTAMAT ASPARAGIN TYROSIN LYSIN METHIONIN GLUTAMIN PROLIN ARGININ Gambar 31. Kerangka intermediet glikolisis, TCA dan jalur pentose phospat. BIOKIMIA 42 BAB V LIPID A. Lipid Lipid merupakan ester dari asam karboksilat rantai panjang dengan alkohol (gliserol). Dilihat dari susunan asam lemaknya, lipid diklasifikasikan menjadi dua yaitu lipid sederhana dan lipid campuran. Lipid sederhana tersusun dari asam lemak sejenis sedangkan lipid campuran tersusun dari asam lemak yang tidak sejenis. O OH2C H HO C O C17H35 H2C O H HO C C17H35 HC O C O C17H35 C17H35 H2C O C C17H35 O OH2C H HO Gliserol + C C17H35 O O HC C Asam stearat Tristearin Gambar 32. Struktur Lipid Sederhana dari Asam Stearat B. Metabolisme Lipid Trigliserida adalah senyawa lipid utama yang terkandung dalam bahan makanan dan sebagai energi yang penting, khusunya bagi hewan. Sebagian besar triasilgliserol disimpan dalam sel-sel jaringan adipose. Triasilgliserol secara konstans didegradasi dan diresintesis. Pemrosesan dan distribusi lipid dijelaskan dalam 8 tahap yaitu: 1. Triasilgliserl yang berasal dari diet makanan tidak larut dalam air. Untuk mengangkutnya menuju usu halus dan agar dapat diakses oleh enzim yang dapat larut di air seperti lipase, triasilgliserol tersebut disolvasi oleh garam empedu seprti kholast dan glikolat membentuk misel. 2. Di usus halus enzim pancreas lipase mendegradasikan triasilgliserol menjadi asam lemak dan gliserol. Asam lemak dan gliserol diabsorbsi ke dalam mukosa usus. 3. Di dalam mukosa usus asam lemak dan gliserol diresintesis kembali menjadi triasilgliserol. 4. Triasilgliserol tersebut kemudian digabungkan dengan kolesterol dari diet makanan dan protein khusus membentuk agregat yang disebut kilomikron. 5. Kilomikron bergerak melalui system limpa dan aliran darah ke jaringan-jaringan. BIOKIMIA 43 6. Triasilgliserol diputus pada dinding pembuluh darah oleh lipoprotein lipase menjadi asam lemak dan gliserol. 7. Komponen ini kemudian diangkut menuju sel-sel target. 8. Di dalam sel otot asam lemak dioksidasi untuk energi dan di dalam sel adipose asam lemak diesterifikasi untuk disimpan sebagai triasilgliserol. Selama olahraga otot membutuhkan dengan cepat sejumlah energi simpanan. Asam lemak yang disimpan dalam asiposit dapat dilepaskan dan ditransport ke sel otot oleh serum albumin untuk didegradasi menghasilkan energi. Ada 3 sumber asam lemak untuk metabolisme energi pada hewan, yaitu: 1) suplai triasilgliserol dari makanan, 2) sintesis triasilgliserol dalam hati jika sumber energi internal melimpah, 3) simpanan triasilgliserol dalam adiposite. Gambar 33. Pemrosesan dan distribusi lipid pada vertebrata BIOKIMIA 44 Metabolisme Lipid Pada Jaringan Adiposa Untuk proses lipogenesis (sintesis lipid) pada jaringan adipose, triasil gliserol disuplai dari hati ke hati dan usus dalam bentuk lipoprotein, VLDL, dan kilomikron. Asam lemak dari lipoprotein dilepaskan oleh lipoprotein lipase yang berlokasi pada permukaan sel-sel endothelial pembuluh kapiler darah. Asam lemak kemudian diubah menjadi triasilgliserol. Proses liposis (degradasi lipid) pada jaringan adiosa dikatalisis oleh hormone sensitif lipase yang dikontrol oleh hormone, dengan mobilisasi sebagai berikut: 1. Jika glukosa dalam darah rendah akan memicu pelepasan epinefrin atau glukagon. Kedua hormone menginggalkan aliran darah dan mengikat molekul reseptor yang ditemui di dalam membrane adiposit atau sel lemak. 2. Hal ini menyebabkan adenilat siklase melalui protein G mengubah ATP menjadi Camp. 3. CAMP kemudian mengaktifkan protein kinase. Protein kinase aktif mengaktifkan triasilgliserol lipase melalui posporilase. 4. Protein kinase aktif juga mengkatalisis posporilasi molekul perilipin pada permukaan butiran lemak (lipid droplet) sehingga triasilgliserol lipase dapat mengakses permukaan butiran lemak. 5. Selanjutnya triasilgliserol diuraikan menjadi asam lemak bebas dan gliserol oleh triasilgliserol lipase 6. Molekul asam lemak yang dihasilkan dilepaskan dari adiposity dan diikat oleh protein serum albumin dalam darah untuk diangkut melalui pembuluh darah menuju myocyte (sel otot) jika dibutuhkan. Jumlah asam lemak yang dilepaskan oleh jaringan adipose ini tergantung pada aktivitas triasilgliserol lipase. Hanya asam lemak rantai pendek yang dapat larut dalam air, sedangkan asam lemak rantai panjang tidak. Oleh karena itu untuk pengangkutan asam lemak rantai panjang diikatkan pada serum albumin. 7. Asam lemak tersebut dilepaskan dari albumin dan masuk ke sel otot mellaui transport khusus. 8. Di sel otot asam lemak mengalami β-oksidasi yang menghasilkan CO2 dan energi ATP. DEGRADASI ASAM LEMAK DI HATI Jaringan menangkap asam lemak dari aliran darah untuk dibangun kembali menjadi lipid atau untuk memperoleh energi dari oksidasinya. Metabolisme asam lemak intensif khususnya di dalam sel hati (hepatocyte). BIOKIMIA 45 Proses terpenting dari degradasi asam lemak adalah β-oksidasi yang terjadi di dalam mitokondria. Asam lemak dalam sitoplasama diaktifkan dengan mengikatkannya pada coenzyme A, kemudian dengan sistem transport karnitin masuk ke mitokondria untuk didegradasi menjadi acetyl Co-A melalui β-oksidasi. Residu acetyl Co-A dapat dioksidasi lanjut menjadi CO2 melalui siklus Krebs atau TCA dan rantai respirasi dengan menghasilkan ATP. Jika produksi acetyl Co-A melebihi kebutuhan energi sel hepatocyte akan diubah menjadi keton body untuk mensuplai energi pada jaringan lain. Hal ini terjadi jika suplai asam lemak dalam plasama darah tinggi, missal dalam kondisi kelaparan atau diabetes mellitus. Biosintesis lipid dalam hati Biosintesis asam lemak dalam hati terjadi di sitoplasma, khususnya di hati, jaringan adipose, ginjal, paru-paru dan kelenjar mamae. Pensuplai karbon yang paling penting adalah glukosa. Akan tetapi prekusor acetyl Co-A yang lain seperti asam amino ketogenik dapat digunakan. Mula-mula asetyl Co-A dikarboksilasi menjadi malonyl Co-A, kemudian dipolimerisasi menjadi asam lemak. Asam lemak selanjutnya diaktivasi dan disintesis menjadi lipid (triasilgliserol) dengan gliserol 3-pospat. Untuk mensuplai jaringan lain, lipid tersebut dipak kedalam kompleks lipoprotein (VLDL) oleh hepatocyte dan dilepaskan ke dalam darah. Katabolisme Asam Lemak Degradasi Asam Lemak : β-oksidasi Degradasi asam lemak terjadi di mitokondria dalam beberapa tahap: Tahap 1. Aktivasi asam lemak di sitoplasma. Asam lemak difosforilasi dengan menggunakan satu molekul ATP dan diaktifkan dengan asetil Co-A menghasilkan asam lemak Co-A, AMP, dan piropospat inorganic. BIOKIMIA 46 Gambar 34. Aktivasi Asam Lemak Tahap 2. Pengangkutan asam lemak Co-A dari sitoplasma ke mitokondria dengan bantuan molekul pembawa carnitine, yang terdapat dalam membrane mitokondria. Gambar 35. Masuknya asam lemak ke mitokondria melalui transport acyl-carnitine BIOKIMIA 47 Tahap 3. Reaksi β-oksidasi berlangsung dalam 4 tahap yaitu: 1) dehidrogenasi I, 2) hidratasi, 3) dehidrogenasi II, dan 4) tiolasi (tahap pemotongan) (gambar 7). 1. Dehidrogenasi I, yaitu dehidrogenasi asam lemak Co-A yang sudah berada dalam mitokondria oleh enzim acyl Co-A dehydrogenase, menghasilkan senyawa enoyl Co-A. Pada reaksi ini, FAD (Flavim adein dinukleotida) yang bertindak sebagai koenzim direduksi menjadi FADH2. Dengan mekanisme posporilasi bersifat oksidati melalui rantai pernafasan, suat molekul FADH2 dapat mengahsilkan 2 molekul ATP. 2. Hidratasi, yaitu ikatan rangkap pada enoyl-Co-A dihidratasi menjadi 3-hidroxylacyl-Co-A oleh enzim enoyl-Co-A hydratase. 3. Dehidrogenasi II, yaitu dehidrogenasi 3-hidroxyacyl-CoA oleh enzim β -hydroxyacyl-CoA dehydrogenase dengan NAD+ sebagai koenzimnya menjadi β-ketoacyl-CoA. NADH yang terbentuk dari NAD+ dapat dioksidasi kembali melalui mekanisme posporilasi oksidatif yang dirangkaiakan dengan rantai pernafasan menghasilkan 3 molekul ATP. 4. Thiolasi, yaitu pemecahan molekul dengan enzim β-ketoacylCo-A thiolase. Pada reaksi ini satu molekul ketoacyl-CoA menghasilkan satu molekul asetyl-Co-A dan sisa rantai lemak dalam bentuk Co-A nya, yang mempunyai rantai dua atom karbon lebih pendek dari semula. Gambar 36. Tahapan Reaksi β -Oksidasi Proses degradasi asam lemak selanjutnya adalah pengulangan mekanisme β -oksidasi secara berurutan sampai panjang rantai asam lemak tersebut habis dipecah menjadi molekul acetylCoA. Dengan demikian satu molekul asam miristat (C14) menghasilkan 7 molekul acetyl CoA (C2) dengan melalui 6 siklus β-oksidasi. BIOKIMIA 48 C14 asam lemak menghasilkan 7 acetyl Co-A dan 6 siklus β oksidasi. Tiap satu siklus β oksidasi dihasilkan energi sebesar: 1 FADH2 = 2 ATP 1 NADH = 3 ATP Dan 1 acetyl Co-A yang akan masuk ke siklus TCA menghasilkan = 12 ATP Gambar 37. Siklus β oksidasi C-14 Jadi jumlah ATP yang dihasilkan satu siklus β oksidasi = 17 ATP β oksidasi Asam Lemak atom C ganjil Pada asam lemak dengan jumlah atom C ganjil, setelah pengambilan acetyl Co-A (2C) maka sisanya adalah residu propionil Co-A (3C). propionil Co-A ini masuk ke siklus Krebs lewat succinyl Co-A. Dalam hal ini propionil Co-A dikarboksilasi menjadi D-metylmalonyl-Co-A, kemudian diubah menjadi succinyl Co-A melalui intermediet L-methylmalonylCo-A. Jumlah energi yang dihasilkan dalam 1 siklus Krebs jika masuk lewat succinyl Co-A hanya sebesar 6 ATP. Karena masuk siklus Krebs lewat succinyl Co-A maka degradasi asam lemak dengan atom C ganjil lebih cepat dibandingkan dengan degradasi asam lemak C genap. Hal ini penting untuk memberikan konsumsi pada orang yang membutuhkan energi cepat missal orang Eskimo. Bagi penderita anemia perniosa BIOKIMIA 49 sebagai akibat kekurangan vitamin B, kerja enzim methylmalonyl-CoA mtase terganggu, sehingga L-methylmalonil CoA tidak bisa diubah menjadi succinyl Co-A. dalam urin penderita ini ditemukan L-methylamlonyl Co-A maupun propionyl Co-A dalam jumlah besar. ANABOLISME LIPID Hati adalah tempat penting untuk pembentukan asam lemak, lemak, keton bodi, dan kolesterol. Meskipun jaringan adipose juga mensintesis lemak, tetapi fungsi utamanya adalah menyimpan lipid. Metabolisme lipid di dalam hati berkaitan erat dengan karbohidrat dan asam amino. Dalam keadaan absorpsi, hati mengubah glukosa mejadi asam lemak melalui asetyl CoA. Hati dapat juga mendapatkan kembali asam lemak dari suplai lipid dengan kilomikron dari usus. Asam lemak dari kedua sumber tersebut kemudian dikonversi menjadi lemak netral dan fosfolipid. BIOSINTESIS KETON BODIES Tujuan pembentukan keton bodies adalah: 1) untuk mengalihkan sebagian acetyl Co-A yang terbentuk dari asam lemak di dalam hati dari oksidasi menjadi CO2 dan H2O (salah satu cara distribusi bahan bakar ke bagian lain dalam tubuh). Dalam keadaan paska absorpsi, khususnya selama puasa atau kondisi lapar, atau menderita diabetes mellitus (DM) ada pergeseran dalam metabolisme lipid. Pada penderita DM jaringan tidak dapat memanfaatkan glukosa dari darah, akibatnya hati lebih banyak menguraikan asam lemak yang diperolehnya dari jaringan adiposa sebagai bahan bakar. Acetyl Co-A hasil degradasi asam lemak jika konsentrasinya dalam mitokondria hati tinggi, maka dua molekul asetyl Co-A akan berkondensasi membentuk acetoacetyl- Co-A, penambahan satu gugus acetyl selanjutnya menghasilkan 3-hydroxy-β-methylglutyryl-CoA(HMG-CoA), dan pelesapasan satu acetyl Co-A dan acetoacetate disebut keton bodies. Senyawa acetoacetate dapat direduksi menjadi 3-hydroxybutirat atau diurai menjadi aceton. Keton bodies selanjutnya dilepaskan hati ke darah. Dalam kondisi lapar, keton bodies dalam darah naik. Acetoacetate dan 3-hydroxybutirate bersama asam lemak digunakan sebagai sumber energi untuk hati, otot skeletal, ginjal dan otak. Sedangkan aceton yang tidak diperlukan dikeluarakan melalui paru-paru. Jika produksi keton bodi melebihi penggunaannya di luar sel hati, maka keton bodies ini akan terakumulasi dalam plasama darah (ketonemia), dan diekskresikan bersama urin (ketonuria). Karena keton bodies adalah asam kuat moderat dengan pKa sekitar 4, maka dapat menurunkan pH plasam darah (ketoacidosis). BIOKIMIA 50 Gambar 38. Reaksi-reaksi pembentukan keton bodies. Reaksi 1: pembentukan acetoacetyl-Co-A. Reaksi 2: pembentukan HMG-CoA. Reaksi 3: Pembentukan acetoacetate. Reaksi 4. Pengubahan acetoacetate menjadi aceton dan β-hydroxybutirat. BIOSINTESIS ASAM LEMAK Biosisntesis asam lemak sangat penting, khususnya dalam jaringan hewan, karena mempunyai kemampuan terbatas untuk menyimpan energi dalam bentuk karbohidrat. Proses ini dikatalisis oleh asam lemak synthase, suatu multienzim yang berlokasi di sitoplasma. Biosintesis Asam Lemak Jenuh Biosintesis asam lemka jenuh dimulai dari acetyl-CoA menjadi starter. Acetyl Co-A ini dapat berasal dari β-oksidasi asam lemak maupun dari pyruvate hasil glikolisis atau degradasi BIOKIMIA 51 asam amino melalui reaksi pyruvate dehydrogenase. Acetyl Co-A tersebut kemudian ditransport dari mitokondria ke sitoplasama melalui system citrate shuttle untuk disintesis menjadi asam lemak. Reduktan NADPH + H+disuplai dari jalur hexose monophosphate. Asam lemak synthase disusun oleh dua rantai peptide yang identic yang disebut homodimer yang dapat dilihat pada gambar 11. Masing-masing dari 2 rantai peptide yang digambarkan sebagai hemispheres tersebut, mengkatalis 7 bagian reaksi yang berbeda yang dibutuhkan dalam sintesis asam palmitat. Katalisis reaksi multi urutan dengan satu protein mempunyai beberapa keuntungan dibandingkan dengan beberapa enzim yang terpisah. Keuntungan tersebut antara lain: 1) reaksi-rekasi kompetitif dapat dicegah, 2) reaksi terjadi dalam satu garis koordinasi, dan 3) lebih efisien karena konsentrasi substrat local yang tinggi, kehilangan karena difusi rendah. Enzim kompleks asam lemak synthase bekerja dalam bentuk dimer. Tiap monomernya secara kovalen dapat mengikat substrat sebagai tioester pada bagian gugus-SH. Ada dua gugus SH yang masing-masing terikat residu Cysteine (Cys-SH) pada β-ketoacyl-ACP-Synthase dan 4-phospopantethine (Pan-SH). Pan-SH, yang mirip dengan koenzim A (CoA-SH), diikat dalam suatu domain enzim yang disebut acyl-carrierprotein (ACP). Aktivitas yang terlibat dalam system enzim kompleks asam lemak synthase dilokasikan dalam 3 domain protein yang berbeda. Domain 1 bertanggungjawab pada katalisis reaksi 2a, 2b, dan 3 yaitu masuknya sustrat asetyl-Co-A atau acyl-CoA dalam malonyl-CoA yang diikuti dengan kondensasi kedua substrat tersebut. Domain 2 mengkatalisis reaksi 4,5, dna 6 yaitu reaksi reduksi pertama rantai perpanjangan asam lemak, dehydratase dan reduksi kedua. Sedangkan domain 3 atau domain tiolase mengkatalisis pelepasan produk akhir asam lemak setelah 7 tahap perpanjangan (reaksi 7). Reaksi Biosintesis asam lemak Jenuh (Asam Palmitat) Biosintesis asam lemak jenuh, dalam hal ini sebagai pokok bahasan adalah biosintesis asam plamitat, karena proses metabolisme sudah banyak diketahui. Reaksi ini dibagai dalam tiga tahap, yaitu tahap aktivasi, tahap elongasi, tahap tiolasi atau pelepasan produk akhir. Tahap aktivasi Reaksi 1. Acetyl Co-A + Oksaloacetat Reaksi 2. Sitrat + ATP+ KoASH sitrat + KOA-SH. Asetyl-KoA + Oksaloasetat + ADP+Pi BIOKIMIA 52 Reaksi 3. Acetyl-CoA + CO2+ ATP malonyl Co-A + ADP+ Pi Tahap elongasi Reaksi 1: Pembentukan acetyl-ACP sebagai starter atau molekul pemula Transfer residu acetyl dari acetyl Co-A ke gugus SH dari molekul ACP pada enzim kompleks asam lemak synthase merupakan reaksi pemula dalam mekanisme biosintesis lemak. Kedua atom karbon ini akan menjadi atom karbon ujung (atom karbon nomor 15 dan 16) dari asam palmitat yang terbentuk. Reaksi ini dikatalis oleh salah satu dari enam enzim kompleks asam lemak synthase, acetyl-CoA-ACP transacylase. Reaksi 2: transfer residu acetyl ke Cys-SH dari enzim dan residu malonyl ke Pan-SH dari ACP Residu acetyl dari molekul ACP kemudian ditransfer (translokasi) ke gugus-SH dari residu cysteine pada β-ketoacyl-ACP-Synthase. Secara bersamaan gugus malonyl dari malonyl- CoA dipindah ke Pan-SH dari ACP membentuk malonyl-ACP oleh enzim malonyl-CoA-ACPtransferase. Reaksi 3: Reaksi kondensasi pembentukan acetoacetyl-S-ACP Gugus acetyl yang diesterkan pada enzim β-ketoacyl-ACP-Synthase ditransfer ke atom C nomer 2 pada malonyl ACP dengan pelepasan CO2 yang berasal dari HCO3- oleh enzim βketoacyl-ACP-Synthase membentuk acetoacetyl-S-ACP. Dengan demikian dalam reaksi karboksilasi acetyl-Co-A, CO2, dari HCO3- tersebut memegang peran katalitik karena dilepaskan kembali sebagai CO2. Reaksi 4: Reaksi residu pertama Malonyl Co-A Acetoacetyl-S-ACP direduksi oleh NADPH membentuk D-β-hydroxybutyryl-ACP, yang dikatalis oleh β-ketoacyl-ACP redukatse. Struktur intermediet yang dihasilkan oleh D bukan L. Reaksi 5: Reaksi dehidratasi D-β-hydroxybutyryl-ACP selanjutnya didehidratasi oleh enoyl-ACP hydratase menjadi α,βtransbutenoyl-ACP. Reaksi 6: α,β-transbutenoyl-ACP direduksi oleh enoyl ACP reductase menghasilkan butyryl-ACP. NADPH digunakan sebagai reduktor pada E coli dan jaringan hewan. Pembentukan butyryl-ACP berarti menyempurnakan satu siklus dari 7 siklus dalam pembentukan palmitoyl-ACP. Untuk memulai siklus berikutnya, dilakukan proses translokasi, yaitu gugus butyryl dari butyril-ACP- ditransfer ke gugus SH dari enzim β-ketoacyl-ACP synthase. ACP kemudian diesterkan dengan gugus malonyl dari molekul-molekul malonylBIOKIMIA 53 CoA lain oleh malonyl-CoA-ACP transferase. Kemudian siklus diulang, yang mana pada tahap berikutnya kondensasi malonyl-ACP dengan butyryl-β-ketoacyl-ACP synthase menghasilkan β-ketohexanoyl-ACP dan CO2. Setelah 7 siklus dihasilkan palmitoyl-ACP sebagai produk akhir dari system enzim kompleks asam lemak synthase. Tahap Tiolasi Reaksi 7: Pelepasan asam palmitat Palmitoyl-ACP dapat dilepaskan menjadi asam palmitat bebas oleh kerja enzim palmitoyl thioesterase atau ditransfer dari ACP ke CoA atau digabungkan secara langsung ke asam fosfatidat dalam jalur yang menuju fospolipid dan triasilgliserol. Pada kebanyakan organisme, system enzim kompleks asam lemak synthase berhenti pada produk asam palmitat dan tidak menghasilkan asam stearate. Hal ini karena: (1) spesifitas panjang rantai maksimum yang dapat diakomodasi oleh enzim kompleks asam lemak synthase adalah gugus tetradecanoyl, gugus hexadecanoyl tidak diterima oleh system ini, palmitoyl-CoA merupakan penghambat feedback system enzim kompleks asam lemak synthase. Reaksi keseluruhan dari reaksi biosintesa asam palmitat yang dimulai dari asetil-CoA adalah: 8 asetyl CoA 14 NADPH 14 H+ 7 ATP H2O asam palmitat 8CoA 14NADP+ 7ADP 7Pi Bandingkan dengan reaksi β-oksidasi asam palmitat adalah: asam palmitat 8CoA 14NAD+ 7 FAD 7H2O 8 asetyl CoA 7 NADPH 7H+ 7 FADH2 14 Molekul NADPH+ + 14 H+ diperlukan pada biosintesis asam palmitat bersumber dari: a. System malat yang ditemukan di hati dan jaringan hewan lainnya BIOKIMIA 54 -O NADP+ NADPH H+ O C O- O C CH CO2 CH2 HO malic enzim C H3C C O O- O piruvat malate b. Jalur pentose phosphate NADP+ NADPH NADP+ glucose 6-phospate NADPH ribulose 5-phospate pentose phospate pathway c. Fotosintesis light H2O + NADP+ ½ O2+ NADPH + H+ Biosintesis Asam Lemak Jenuh dengan jumlah atom C ganjil Asam lemak dengan jumlah atom C ganjil banyak terdapat pada organisme laut. Asam lemak ini juga disintesis oleh system enzim kompleks asam lemak synthase. Sintesisnya dimulai dari molekul propionyl-ACP bukan acetyl-ACP. Penambahan 2 atom C dilakukan melalui kondensasi dengan malonyl-ACP melalui kondensasi dengan malonyl-ACP, sama pada biosintesis asam lemak jenuh beratom C genap. Dari uraian tentang jalur β-oksidasi asam lemak (katabolisme) dan biosintesis asam lemak (anabolisme) terdapat lima perbedaan yang dapat diamati yaitu: 1. Lokasi intraseluler: β-oksidasi terjadi di mitokondria, biosintsis di sitoplasma 2. Tipe pembawa gugus acyl: dalam β-oksidasi adalah Co-A, dalam biosintesis adalah ACP. 3. Dalam β-oksidasi asam lemak sebaga akseptor electron (oksidator) adalah FAD, sedangkan dalam biosintesis asam lemak NADPH sebagaai donor electron (Reduktor) 4. Senyawa intermediet yang terbentuk pada reaksi hidratasi mempunyai konfigurasi L, pada reaksi hidratasi dalam biosintesis asam lemak senyawa intermedietnya mempunyai konfigurasi D BIOKIMIA 55 5. Malonyl Co-A berperan sebagai prekusor penambahan unit C2 dalam biosintesis asam lemak, sedangkan dalam β-oksidasi pengurangan unit C2 dalam bentuk acetyl Co-A. Selain kelima perbedaan di atas, pada β-oksidasi dihasilkan energi sedangkan pada biosintesis asam lemak diperlukan energi. BIOKIMIA 56 BAB VI ASAM NUKLEAT A. Asam Nukleat Terdapat dua jenis asam nukleat, yaitu : Ribonucleic Acid (RNA) atau Asam Ribonukleat dan Deoxyribonecleic Acid (DNA) atau Asam Dioksiribonukleat. DNA pertama kali ditemukan oleh seorang dokter muda bernama Friedrich Miescher pada tahun 1869. Ia meneliti sel pada nanah yang ia peroleh dari pembalut luka di ruang bedah. Sel-sel tersebut dilarutkan dalam asam encer dan dengan cara ini diperolehnya inti sel yang masih terikat pada sejumlah protein. Kemudian dengan menambahkan enzim pemecah protein ia dapat memperoleh inti sel saja dan dengan cara ekstraksi terhadap inti sel ini ia memperoleh satu zat yang larut dalam basa tetapi tidak larut dalam asam. Pada waktu itu ia belum dapat menentukan rumus kimia zat tersebut, sehingga ia menamakannya nuclein. Sebenarnya apa yang ia peroleh dari ekstrak inti sel tersebut adalah campuran senyawa-senyawa yang mengandung 30% DNA. Sejak tahun 1940 studi tentang genetika telah berkembang pesat dan orang telah mengetahui bahwa kromosom dalam sel adalah pembawa sifat-sifat keturunan pada seseorang. Pada tahun 1951 seorang ahli genetika Amerika, James Watson, bekerja sama dengan dua orang sarjana fisika dari Inggris Francis Crick dan Maurice Wilkins yang telah melakukan penelitian terhadap kromosom ini. Atas ketekunan mereka, telah dapat dijelaskan bentuk model DNA dengan sebuah model, dan untuk itu pada tahun 1962 mereka memperoleh hadiah Nobel. Asam nukleat terdapat dalam semua sel dan mempunyai peranan yang sangat penting dalam biosintesis protein (Poedjiadi dan Supriyanti, 2009). Basa Nitrogen Basa nitrogen pada asam nukleat merupakan turunan dari pirimidin dan purin. Basabasa yang merupakan turunan pirimidin adalah: Cytosine (C), Uracil (U), and Thymine (T). Cytosine dan Thymine terdapat pada DNA, sedangkan Cytosine dan Uracil terdapat pada RNA. Basa dengan cincin purin adalah Guanine (G) dan Adenine (A). Keduanya digunakan pada DNA dan RNA. BIOKIMIA 57 6 4 5 3 N 7 5 1 N N 8 2 6 2 N N 1 3 4 N9 H Purin Pirimidin Gambar 39. Struktur Pirimidin dan Purin DNA O NH2 HN O O N N H Uracil O N H Cytosine HN O CH3 N H Thymine RNA Gambar 40. Struktur Uracil, Cytosine dan Thymine Gambar 41. Struktur Adenine dan Guanine Sifat-sifat purine and pyrimidine : Cincin pyrimidine berbentuk planar, sedangkan cincin purine sedikit membengkok. Molekul purine and pyrimidine memiliki kelarutan yang rendah, tetapi basa G, A, T, C and U kelarutannya lebih tinggi karena adanya gugus polar Purine dan pyrimidine dapat mengalami tautomerisasi keto-enol. Tautomer Keto disebut laktam, sedangkan tautomer enol disebut laktim. Tautomer laktam (keto) merupakan bentuk yang dominan pada pH netral. Dalam bentuk laktam, atom nitrogen berperan sebagai donor ikatan-H, dan oksigen keto berperan sebagai akseptor ikatan-H, ketika berinteraksi dengan molekul lain. BIOKIMIA 58 Semua basa pirimidin dan purin menyerap sinar U.V. (akibat dari cincin aromatik). Sehingga, konsentrasi DNA atau RNA dalam sample dapat ditentukan dengan mengukur absorbansi UV-nya. Gambar 42. Cincin Lactam dan Lactim Nukleosida dan Nukleotida Selain basa purin dan pirimidin, RNA dan DNA mempunyai gugus ribosa yaitu gula dengan 5 atom karbon. RNA mengandung molekul ribosa sedangkan DNA mengandung molekul deoksi-ribosa (2'-deoksi-ribosa). 5 CH OH 2 OH H 4 H 5 CH OH 2 O H 1 3 2 OH OH H 4 H H OH O 3 OH D-Ribosa H 2 1 H H D-2-Deoksiribosa Gambar 43. Struktur Gula Ribosa dan Deoksiribosa Molekul ribosa berikatan secara kovalen dengan basa nitrogen melalui ikatan glikosida membentuk molekul nukleosida. NH2 4 5 N3 2 6 CH2OH 5' N1 O O ikatan glikosida 4' 1' 3' OH 2' OH Nukleosida ikatan-glikosida menghubungkan antara D-ribosa dengan cytosin Gambar 44. Struktur Nukleosida BIOKIMIA 59 Ikatan glikosida pada nukleosida selalu bentuk b-glikosida. Nukleosida diberi nama dengan menambahkan akhiran"-idine" pada pirimidin atau "-osine" pada nama purin. Nukleosida Pirimidin : Cytidine, Thymidine, dan Uridine; Nukleosida Purin : Adenosine dan Guanosine. O NH2 NH N CH2OH O OH N CH2OH O O N OH OH O OH NH2 Uridine Cytidine N CH2OH O OH O N N N CH2OH O N OH OH Adenosine NH N N NH2 OH Guanosine Gambar 45. Struktur Cytidine, Uridine, Adenosine, Guanosine Nukleosida di atas semuanya ribonukleosida yang terdapat pada RNA. Untuk deoksiribonukleosida yang terdapat pada DNA, Uridine diganti dengan deoxyThymidine. O O H3C N NH CH2OH O N OH CH2OH O O OH H N NH N NH2 H deoksiGuanosine deoksiThymidine Gambar 46. deoksiThymidine dan deoksiGuanosine Nukleotida adalah nukleosida yang mengandung gugus fosfat. Nukleotida terbentuk bila gugus hidroksil pada C-5’ bergabung dengan asam fosfat membentuk nukleotida monofosfat (suatu ester). NH2 ikatan fosfoester N O - O O N O P O (deoksi-)Cytidine O - H H OH H H H (Deoksi-)Cytidine-5'-monofosfat (5'-dCMP) (deoxy-)cytidylic acid Gambar 47. Struktur Nukleotida BIOKIMIA 60 Nukleotida monofosfat umumnya disingkat menjadi NTP atau dNTP, dimana dNTP menunjukkan adanya gugus deoxyribose (spt pada DNA). Asam fosfat mempunyai pKa1 ~1.0 dan pKa2 ~6.0 Sehingga, pada pH neutral nukleotida akan memiliki muatan antara -1 and -2, dan nukleotida bersifat asam. Nama dari nukleotida menunjukkan sifat asam dari gugus fosfat seperti tabel di bawah : Basa Nukleosida Nukleotida Adenine (deoxy-) Adenosine (deoxy-) Adenylic acid Guanine (deoxy-) Guanosine (deoxy-) Guanylic acid Cytosine (deoxy-) Cytidine (deoxy-) Cytidylic acid Thymine Thymidine Uracil Uridine RNA DNA (mono-Pi) (mono-Pi) AMP Kode dAMP A dGMP G CMP dCMP C Thymidylic acid - dTMP T Uridylic acid UMP - U GMP Nukleosida monofosfat dapat membentuk dua ikatan ester dengan asam fosfat, dan ini dapat terjadi pada satu molekul melalui gugus 5' dan 3' hidroksil dari gula ribosa. cAMP, dan cGMP adalah regulator yang penting pada metabolisme sel dan terdapat pada hampir semua sel. Nukleotide monofosfat dapat mengikat gugus asam fosfat lainnya yang akan terikat pada gugus fosfat yang ada, sehingga membentuk di- dan tri-fosfat. Ikatan antara gugus fosfat merupakan ikatan anhidrida fosfat yang berenergi tinggi . Fosfat pada carbon 5' diberi tanda "α", dan phosphate selanjutnya diberi label "β" dan “g" . NDP, dan NTP (dimana N adalah basa) menandakan perbedaan struktur nukleosida difosfat dan trifosfat. dNDP dan dNTP menunjukkan deoksinukleosida di- dan tri-fosfat. Nukleosida di- dan tri- fosfat ditemukan sebagai molekul-molekul bebas di dalam sel. Masing-masing NTP memiliki peran yang unik sebagai molekul berenergi tinggi : ATP: "energi currency" untuk sel GTP: sumber energi utama pada sintesis protein CTP: metabolit penting dalam sintesis fosfolipid BIOKIMIA 61 UTP: digunakan dalam pembentukan “activated intermediates” dalam biosintesis karbohidrat Karena perbedaan pada molekul-molekul ini hanya pada perbedaan basa-basa yang terikat pada ribosa trifosfat, maka basa-basa tersebut mengandung informasi yang mengatur fungsi dari molekul-molekul tersebut. Asam Nukleat Asam Nukleat adalah suatu polimer yang terdiri atas banyak molekul nukleotida. Telah disinggung di atas bahwa asam nukleat ada dua macam, yaitu DNA dan RNA. Asamasam nukleat terdapat pada jaringan-jaringan tubuh sebagai nukleoprotein, yaitu gabungan antara asam nukleat dengan protein. Untuk memperoleh asam nukleat dari jaringan-jaringan tersebut, dapat dilakukan ekstraksi terhadap nukleoprotein terlebih dahulu menggunkn larutan garam 1 M. Setelah nukleoprotein terlarut, dapat diuraikan atau dipecah menjadi proteinprotein dan asam nukleat dengan menambah asam-asam lemah atau alkali secara hati-hati, atau dengan menambah NaCl hingga larutan menjadi jenuh. Setelah terpisah dari protein yang mengikatnya, asam nukleat dapat diendapkan dengan penambahan alkohol perlahan-lahan. Disamping itu penambahan NaCl hingga jenuh akan mengendapkan protein. Cara lain untuk memisahkan asam nukleat dari protein ialah menggunakan enzim pemecah protein, misalnya tripsin. Ekstraksi terhadap jaringan-jaringan dengan asam triklorasetat, dapat pula memisahkan asam nukleat. Denaturasi protein dalam campuran dengan asam nukleat ini dapat pula menyebabkan terjadinya denaturasi asam nukleat itu sendiri. Oleh karena asam nukleat itu mengandung pentosa, maka bila dipanasi dengan asam sulfat akan terbentuk furfural. Furfural ini akan memberikan warna merah dengan anilina asetat atau warna kuning dengan p-bromfenilhidrazina. Apabila dipanasi dengan difenilamina dalam suasana asam, DNA akan memberikan warna biru. Pada dasarnya reaksi-reaksi warna untuk ribosa dan deoksiribosa dapat digunakan untuk keperluan identifikasi asam nukleat. Struktur Asam Deoksiribonukleat (DNA) Asam ini adalah polimer yang terdiri atas molekul-molekul deoksiribonukleotida yang terikat satu dengan lain, sehingga membentuk rantai polinukleotida yang panjang. Basa purin yang terdapat pada DNA ialah adenin dan guanin. Sitosin dan timin adalah basa pirimidin yang terdapat pada asam nukleat ini. Molekul DNA yng panjang ini terbentuk oleh ikatan antara atom C nomor 3 dengan atom C nomor 5 pada molekul deoksiribosa dengan perantaraan gugus fosfat, sebagaimana terlihat pada struktur sebagian dari molekul DNA (gambar 10). Dari gambar tersebut terlihat bahwa basa yang mengandung oksigen ditulis dalam bentuk keto atau BIOKIMIA 62 laktam. Sebenarnya terdapat keseimbangan antara bentuk keto (laktam) dengan bentuk enol (laktim). Keseimbangan ini dipengaruhi oleh pH di lingkungannya. Dalam tubuh, bentuk laktam terdapat lebih banyak daripada bentuk laktim, oleh karena itu basa tersebut ditulis dalam bentuk laktam. Dari struktur DNA tersebut dapat pula dilihat bahwa karakteristik atau ciri khas suatu asam nukleat terletak pada urutan basa purin dan pirimidin yang terdapat pada molekul asam nukleat tersebut. Gambar 48. Struktur Sebagian dari Molekul DNA Disamping itu, hasil penelitian dengan sinar X menunjukkan bahwa molekul DNA dari bebagai sumber mempunyai pola difraksi sinar X yang serupa. Dari hasil-hasil peneitian tersebut, Watson dan Crick menyusun model bentuk molekul DNA pada tahun 1953. Model ini menunjukkan bahwa dua buah rantai polideokiribonukleotida ini membentuk heliks ganda (double helix). Model ini membawa beberapa arti penting dalam informasi genetik, yaitu : 1. G selalu berpasangan dengan C, dan T selalu berpasangan dengan A. Sehingga, bila DNA double helix dipisahkan menjadi dua utas tunggal, masing-masing utas dapat bertindak sebagai “template” untuk pembentukan rantai baru 2. Dasar dari kecocokan pasangan adalah ikatan hidrogen, sehingga interaksi non-kovalen dapat dengan mudah diputuskan dan digabung kembali. 3. Pasangan basa G-C distabilkan oleh tiga ikatan hidrogen, sedangkan pasangan basa A-T distabilkan oleh dua. Berarti bahwa interaksi G-C lebih kuat daripada interaksi AT 4. Informasi yang dibawa DNA terletak pada keunikan susunan basa pada DNA. BIOKIMIA 63 5. Kedudukan non-equatorial dari gugus gula menunjukkan bahwa DNA helix akan mempunyai major groove dan minor groove. 6. Muatan yang sama akan tolak menolak, sehingga gugus fosfat berada pada bagian luar (terpisah satu sama lain sejauh mungkin). Gambar 49. Struktur Heliks Ganda Informasi genetik yang tersimpan di dalam rangkaian nukleotida DNA mempunyi dua fungsi. Informasi genetik tersebut merupakan sumber informasi bagi sintesis semua molekul protein sel serta organisme, dan juga menyediakan informasi yang diwarisi oleh sel anak atau sel generasi berikutnya. Kedua fungsi ini mensyaratkan molekul DNA untuk berfungsi sebagai cetakan-dalam hal pertama untuk transkripsi informasi ke dalam RNA, dan dalam hal kedua, untuk replikasi informasi ke dalam molekul DNA turunannya. Sifat komplementer (komplementaritas) pada model DNA unti ganda dari Watson dan Crick sangat memberi kesan bahwa replikasi molekul DNA terjadi secara semikonservatif. Dengan demikian, jika masing-masing untai pada molekul induk DNA untai ganda terpisah daro komlementernya saat replikasi, setiap bagian tersebut akan berfungsi sebagai cetakan, yang dengan cetakan ini , disintesis sebuah untai komplementer baru. Kedua molekul DNA turunan beruntai ganda yang baru terbentuk, masing-masing mengandung satu untai (tetapi bersifat komplementer, bukan identik) yang berasal dari molekul DNA induk beruntai ganda, kemudian dikelompokkan di antara kedua sel turunan. Setiap sel turunan mengandung molekul BIOKIMIA 64 DNA yang berisikan informasi identik dengan yang dimiliki sel induk; namun, dalam setiap sel turunan, molekul DNA sel induk hanya dilestarikan sebagian (semikonservatif). Struktur Asam Ribonukleat (RNA) Asam Ribonukleat adalah suatu polimer yang terdiri atas molekul-molekul ribonukleotida. Seperti DNA, asam ribonukleat ini terbentuk oleh adanya ikatan antara atom C nomor 3 dengan atom C nomor 5 pada molekul ribosa dengan perantaraan gugus fosfat. Meskipun banyak persamaannya dengan DNA, RNA mempunyai beberapa perbedaan dengan DNA yaitu : 1. Bagian gula pentosa RNA adalah ribosa, sedangkan bagian gula pentosa DNA adalah deoksiribosa. 2. Bentuk molekul DNA adalah heliks ganda sedangkan RNA berupa untai tunggal. Meskipun demikian, mengingat rangkaian basa komplementer yang sesuai yang mempunyai olaritas berlawanan, untai tunggal RNA dapat melipat dirinya sendiri seperti penjepit rambut sehingga mendapatkan sifat untai ganda. 3. RNA mengandung basa adenin, guanin dan sitosin seperti DNA, tetapi tidak mengandung timin. Sebagai gantinya, RNA mengandung urasil. Dengan demikian bagian basa pirimidin RNA berbeda dengan bagian pirimidin DNA. 4. Karena molekul RNA merupakan untai tunggal yang komlementer terhadap hanya salah satu dari kedua untai gen, kandungan guaninnya tidak harus sama dengan kandungan sitosin, dan kandungan adeninnya juga tidak harus sama dengan kandungan urasilnya. 5. RNA dapat dihidrolisis oleh alkali menjadi senyawa siklik 2’,3’-diester dari mononukleotida, senyawa yang tidak bisa dibentuk dari DNA yang diproses dengan larutan alkali karena tidak memiliki gugus 2’hidroksil. Ketidakstabilan RNA terhadap larutan alkali memberikn manfaat diagnostik dan analitik. BIOKIMIA 65 Gambar 50. Struktur Sebagian dari Molekul RNA Ada tiga macam RNA, yaitu tRNA (transfer RNA), mRNA (messenger RNA), dan rRNA (ribosomal RNA). Ketiga macam RNA ini mempunyai fungsi yang berbeda-beda, tetapi ketiganya secara bersama-sama mempunyai peranan penting dalam sintesis protein. RNA messenger (mRNA) terutama berfungsi dalam sintesis protein, berperan dalam kapasitasnya sebagai pembawa pesan yg membawa informasi berupa instruksi-instruksi yg dikodekan oleh DNA, menuju situs-situs sintesis protein di ribosom dalam sel. Ribosom mengandung sebuah kelas khusus RNA yg disebut RNA ribosomal (rRNA) yg menyusun sebagian besar RNA selular. RNA transfer (tRNA), melekat ke asam-asam amino dan saat sintesis protein membawa molekul-molekul tersebut ke posisi yg tepat bersama asam-asam amino lainnya menggunakan kompleks m-RNA-ribosom sebagai cetakan (template). Dalam sel manusia, terdapat jenis RNA nukler kecil (SnRNA, small nuclear RNA) yang tidak terlibat langsung di dalam sintesis protein, tetapi mungkin berperan dala pemrosesan RNA serta arsitektur sel. Molekul yang relatif kecil ini mempunyai ukuran bervariasi, dari 90 hingga sekitar 300 nukleotida). Materi genetik sebagian virus hewan dan tumbuhan adalah RNA, bukan DNA. Meskipun informasi pada beberapa virus RNA tidak pernah ditranskripsikan ke dalam molekul DNA, banyak virus RNA hewan-khususnya retrovirus (sebagai contoh HIV)-ditranskripsi oleh suatu polimerase DNA bergantung-RNA, disebut reverse transcriptase, untuk menghasilkan salinan DNA untai ganda dari genom RNAnya. Pada banyak kejadian, transkip DNA untai ganda yang dihasilkan diintegrasikan ke dalam genom pejamu dan kemudian bertindak sebagai cetakan bagi ekspresi gen, dan yang darinya dapat ditranskripsikan suatu genom RNA virus baru. BIOKIMIA 66 B. Metabolisme Purin dan Pirimidin Purin dan pirimidin bukan merupakan unsur esensial di dalam diet manusia, dan defisiensi purin pada manusia jarang dijumpai. Asam nukleat pada makanan akan diurai di dalam traktus gastrointestinalis menjadi purin dan pirimidin. Meskipun reaksi “penyelamatan” mengubah purin dan ribo- serta deoksiribonukleosidanya langsung menjadi mononukleotida yang sesuai, sebagian besar purin, pirimidin, dan derivatnya yang ada di dalam tubuh akan terbentuk lewat biosintesis dari intermediat amfibolik. Biosintesis senyawa-induk nukleotida purin, inosin monofosfat (IMP), melibatkan rangkaian panjang sejumlah reaksi dan sebagian di antaranya dikatalisis oleh katalisator multifungsional. Karena derivat folat serta glutamin turut berpartisipasi di dalam rangkaian reaksi ini, obat-obat antifolat serta preparat analog glutamin akan menghambat biosintesis purin. Oksidasi dan aminasi IMP akan membentuk AMP serta GMP, dan reaksi berikutnya yang berupa pemindahan gugus fosfat dari ATP akan membentuk ADP serta GDP. Pemindahan gugus fosforil lebih lanjut dari ATP ke GDP membentuk GTP. ADP diubah menjadi ATP melalui fosforilasi oksidatif. Biosintesis nukleotida purin di dalam hati diatur secara ketat terutama melalui ukuran depot fosforibosil pirofosfat (PRPP) dan inhibisi-umpan balik PRPP-glutamil amidotransferase oleh produk akhir AMP serta GMP. Reduksi NDP membentuk deoksiribonukleotida difosfat (dNDP). Sementara uridin dan sitidin diselamatkan, nukleotida pirimidin terutama dibentuk melalui biosintesis dari intermediat amfibolik. Biosintesis ini melibatkan suatu rangkaian reaksi panjang yang berbeda dari rangkaian reaksi pada biosintesis purin, tetapi melibatkan reaksi yang analog begitu sebuah mononukleotida terbentuk. Beberapa analog pirimidin tertentu merupakan substrat bagi enzim pada biosintesis nukleotida pirimidin, dan dengan demikian, menghambat proses ini. Regulasi biosintesis nukleotida pirimidin melibatkan kontrol, baik terhadap ekspresi gen maupun aktivitas enzimatiknya. Regulasi biosintesis purin dan pirimidin yang terkoordinasi menjamin keberadaan kedua basa ini dalam proporsi yang tepat bagi biosintesis asam nukleat serta kebutuhan metabolik lain. Sementara reaksi dan senyawa intermediat pada biosintesis purin dan pirimidinn di dalam bakteri sama dengan yang terdapat di dalam tubuh manusia, enzim yang mengkatalisis reaksi in dikelola secara berbeda. Pada bakteri, setiap reaksi dikatalisis oleh protein yang berbeda. Sebaliknya, sebagian enzim dalam biosintesis de novo purin dan pirimidin pada manusia merupakan polipeptida multifungsional yang mengkatalisis sejumlah reaksi yang berkeinambungan. Keuntungan nyata dari polipeptida multifungsional mencakup ekspresi BIOKIMIA 67 berbagai aktivitas katalitik secara terkoordinasi serta penyaluran produk reaksi yang satu ke reaksi berikutnya dalam rangkaian reaksi tanpa memerlukan disosiasi dari sebuah enzim. Pada manusia, purin dikatabolisasi menjadi asam urat yang merupakan asam lemah (pK 5,8) dan, bergantung pada pH, terdapat sebagai asam yang relatif tidak larut (pada pH asam) atau sebagai garam natrium urat yang lebih larut (pada pH mendekati netral). Kristal urat merupakan petunjuk diagnostik untuk penyakit gout, suatu kelainan matabolik pada katabolisme purin. Kelainan lain pada katabolisme purin adalah sindrom Lesch-Nyhan, penyakit von Gierke, dan hipourisemia. Berbeda dengan asam urat dan garam urat yang merupakan produk katabolisme purin yang relatif tidak larut, produk akhir hasil katabolisme pirimidin bersifat sangat larut dalam air ; CO2, NH3, dan β-aminoisobutirat. Meskipun demikian, pseudouridin dieksresikan dalam keadaan tidak berubah. Overproduksi hasil katabolisme pirimidin umumnya tidak disertai dengan kelainan klinis bermakna. Penderita asiduria orotat berespons terhadap nukleosida pirimidin diet. Obat –obat tertentu juga dapat mencetuskan asiduria orotat. Meskipun demikian, ekskresi prekursor pirimidin dapat terjadi akibat defisiensi enzim ornitin transkarbamoilase yang terdapat di dalam siklus urea , mengingat senyawa karbomil fosfat yang terhindar dari reaksi oleh enzim tersebut akan dapat dimanfaatkan bagi biosintesis pirimidin. BIOKIMIA 68 BAB VII VITAMIN DAN MINERAL A. VITAMIN Vitamin adalah senyawa-senyawa organik tertentu yang diperlukan dalam jumlah kecil dalam diet seseorang namun esensial untuk reaksi metabolisme dalam sel dan penting untuk melangsungkan pertubuhan normal serta memelihara kesehatan. Kebanyakan vitamin tidak dapat disintesis oleh tubuh. Beberapa diantaranya masih dapat dibentuk oleh tubuh, namun kecepatan pembentukannya sangat kecil sehingga jumlah yang terbentuk tidak dapat memenuhi kebutuhan tubuh. Oleh karenanya tubuh harus memperoleh vitamin dari makanan sehari-hari. Jadi vitamin mengatur metabolisme, mengubah lemak dan karbohidrat menjadi energi, dan ikut mengatur pembentukan tulang dan jaringan. Sejarah penemuan vitamin dimulai oleh Eijkman yang pertama kali mengemukakan adanya zat yang bertindak sebagai faktor diet esensial dalam kasus penyakit beri-beri. Pada tahun 1897 ia memberikan gambaran adanya suatu penyakit yang diderita oleh anak ayam yang serupa dengan beri-beri pada manusia. Gejala penyakit tersebut terjadi setelah binatang diberi makanan yang terdiri atas beras giling murni. Ternyata penyakit ini dapat disembuhkan dengan memberi makanan sisa gilingan beras yang berupa serbuk. Hasil penemuan yang menyatakan bahwa dalam makanan ada faktor lain yang penting selain karbohidrat, lemak, dan protein sebagai energi, mendorong para ahli untuk meneliti lebih lanjut tentang vitamin, sehingga diperoleh konsep tentang vitamin yang kita kenal sekarang. Polish kemudian memberi nama faktor diet esensial ini dengan vitamin. Selanjutnya hasil pekerjaan Warburg tentang koenzim (1932-1935) dan kemudian penyelidikan R Kuhn dan P Kerrer menunjukkan adnya hubungan antara struktur kimia vitamin dengan koenzim. Vitamin dibagi ke dalam dua golongan. Golongan pertama oleh Kodicek (1971) disebut prakoenzim (procoenzyme), dan bersifat larut dalam air, tidak disimpan oleh tubuh, tidak beracun, diekskresi dalam urin. Yang termasuk golongan ini adalah : Tiamin, Riboflavin, Asam Nikotinat, Piridoksin, Asam Kolat, Biotin, golongan Vitamin B, Vitamin C dll. Golongan kedua yang larut dalam lemak disebut alosterin, dan dapat disimpan dalam tubuh. Apabila vitamin ini dikonsumsi berlebihan makan akan menumpuk dalam tubuh dan menimbulkan gejala penyakit tertentu (hipervitaminosis). Kekurangan vitamin juga mengakibatkan terjadinya penyakit defisiensi, tetapi biasanya akan hilang apabila kebutuhan vitamin kembali terpenuhi. Vitamin larut lemak mempunyai berbagai fungsi, misal, Vitamin A : pengelihatan; BIOKIMIA 69 Vitamin D : metabolisme kalsium dan fosfat; Vitamin E : antioksidan; Vitamin E : pembekuan darah. Dibawah ini hanya akan dibahas beberapa contoh vitamin. Niasin Niasin merupakan nama generik asam nikotinat dan nikotinamida, yang keduanya dapat berfungsi sebagai sumber vitamin tersebut di dalam makanan. Asam nikotinat merupakan derivat asam monokarboksilat dari piridin. Nikotinat merupakan bentuk niasin yang diperlukan bagi sintesis Nikotinamida Adenin Dinukleotida (NAD+) dan Nikotinamida Adenin Dinukleotida Fosfat (NADP+) oleh enzim yang terdapat di dalam sitosol sebagian besar sel. Oleh karena itu, setiap nikotiamida di dalam makanan pertama-tama harus mengalami deamidasi menjadi nikotinat. Di dalam sitosol, nikotinat diubah menjadi senyawa desamido-NAD+ melalui reaksi yang mula-mula berlangsung dengan 5-fosforibosil 1-pirofosfat (PRPP), dan kemudian melalui adenilasi dengan ATP. Gugus amido pada glutamin kemudian turut membentuk koenzim NAD+. Koenzim ini bisa mengalami fosforilasi lebih lanjut membentuk NADP+. Nukleotida nikotinamida memainkan peran luas sebagai koenzim banyak enzim dehidrogenase yang terdapat baik di dalam sitosol (misal, laktat dehidrogenase) maupun di dalam mitokondria (misal, malat dehidrogenase). Oleh karena itu, vitamin ini merupakan komponen kunci pada banyak lintasan metabolik yang mempengaruhi metabolisme karbohidrat, lipid, serta asam amino. Enzim dehidrogenase terkait-NAD umumnya mengatalisis reaksi oksidoreduksi pada lintasan oksidatif (misal, siklus asam sitrat), sedangkan enzim reduktase atau dehidrogenase terkait-NADP kerap kali ditemukan dalam lintasan yang berhubungan dengan sintesis reduktif (misal, lintasan pentosa fosfat). Kekurangan niasin menyebabkan sindrom defisiensi pelagra (pele =kulit, agra=kasar). Penyakit ini dapat mengenai usus, kulit dan sistem syaraf. Kulit misalnya pada muka, leher, dada, lengan menjadi kemerah-merahan, kemudian menjadi coklat mengeras. Gejala sindrom ini mencakup penurunan berat badan, berbagai gangguan pencernaan, dermatitis, depresi, serta demensia. Niasin ditemukan secara luas di dalam sebagian besar makanan hewani dan nabati. Meskipun demikian, penilaian kandungan niasin suatu makanan harus mempertimbangkan kenyataan bahwa asam amino esensial triptofan dapat diubah menjadi NAD+. Dari setiap 60 mg triptofan dapat dihasilkan 1 mg ekuivalen niasin. Jadi, untuk terjadinya defisiensi niasin, makanan harus kekurangan kandungan niasin sekaligus triptofan. Kriteria semacam ini terjadi BIOKIMIA 70 dalam populasi yang bergantung pada jagung sebagai makanan pokoknya, sehingga menyebabkan pelagra. Niasin sebenarnya ada di dalam jagung, tetapi dalam bentuk terikat yang tidak dapat digunakan : niasitin. Dari niasitin ini dapat dilepaskan niasin setelah niasitin diproses terlebih dahulu dengan senyawa alkali. Kebergantungan pada sorghum (cantel) juga bersifat pelagragenik, bukan karena rendahnya kadar triptofan melainkan karena kandungan leusin yang tinggi. Kelebihan leusin di dalam diet tampaknya dapat menimbulkan defisiensi niasin melalui penghambatan enzim kuinolinat fosforibosil transferase, suatu enzim penting dalam proses konversi triptofan menjadi NAD+. Perlu diperhatikan pula bahwa piridoksal fosfat, bentuk aktif vitamin B6, turut berperan sebagai kofaktor pada lintasan sintesis NAD+ dari triptofan, dan dengan demikian, defesiensi vitamin B6 dapat mendorong timbulnya defisiensi niasin. Sumber vitamin ini diantaranya adalah makanan yang kaya akan protein seperti telur, daging, dan susu. Sumber vitamin nabati misalnya biji-bijian (beras dan sebangsanya), sayuran hijau, kentang, dan beberapa jenis kacang-kacangan. BIOKIMIA 71 Gambar 51. Biosintesis dan pemecahan NAD+ Tiamin Tiamin telah lama dikenal sebagai antineuritik karena digunakan untuk membuat normal kembali susunan syaraf. Koenzim yang berasal dari vitamin ini adalah tiamin pirofosfat (TPP) yang berfungsi dalam reaksi-reaksi dekarboksilasi asam α-keto, oksidasi asam α-keto, transketolasi. Adapun bagian aktif koenzim TPP adalah gugus tiazolnya. Kekurangan tiamin menyebabkan penyakit beri-beri. Tiamin terdapat pada hampir semua tanaman dan jaringan tubuh hewan yang lazim digunakan sebagai makanan, tetapi BIOKIMIA 72 kandungan vitamin ini biasanya kecil. Biji-bijian yang tidak digiling sempurna dan daging merupakan sumber tiamin yang baik. Gambar 52. Struktur Tiamin Biotin Biotin merupakan derivat imidazol yang tersebar luas di dalam berbagai makanan alami. Biotin sebagai kofaktor terikat kuat pada bagian protein enzim. Ada tiga jenis reaksi yang dapat dilangsungkan oleh biotin yaitu : (a) reaksi karboksilasi pada karbon dari asil KoA, (b) reaksi karboksilasi pada atom karbon yang berikatan ganda dari rantai karbon senyawa asil KoA, (c) reaksi transkarboksilasi pada senyawa asil KoA. Sumber yang baik untuk vitamin ini ialah daging, kuning telur, kacang polong, kemiri, kenari. Mengingat proporsi kebutuhan tubuh yang besar akan biotin sudah dipenuhi oleh sintesis dari bakteri usus, defisiensi biotin disebabkan bukan oleh defisiensi diet sederhana, melainkan akibat gangguan pada penggunaannya. Gambar 53. Struktur Biotin Vitamin B6 Vitamin B6 terdiri atas tiga derivat piridin yang berhubungan erat : piridoksin, piridoksal, dan piridoksamin (gambar 54), serta derivat fosfatnya yang bersesuaian. Dari semua derivat ini, piridoksin, piridoksal fosfat, dann piridoksamin fosfat merupakan wakil utama BIOKIMIA 73 vitamin tersebut di dalam makanan. Ketiga bentuk ini memiliki aktivitas vitamin yang sama karena dapat melakukan interkonversi satu sama lain di dalam tubuh. Gambar 54. Bentuk Alami Vitamin B6 Semua bentuk vitamin B6 diabsorpsi dari usus, tetapi selama proses pencernaan, terjadi sejumlah hidrolisis tertentu terhadap senyawa ester fosfatnya. Piridoksal fosfat merupakan bentuk utama yang diangkut di dalam plasma. Sebagian besar jaringan mengandung enzim piridoksal kinase yang dapat mengatalisis reaksi fosforilasi oleh ATP terhadap bentuk vitamin yang belum terfosforilasi menjadi masing-masing derivat ester fosfatnya (Gambar 55). Sementara piridoksal fosfat merupakan koenzim utama yang mengekspresikan aktivitas B6, piridoksamin fosfat juga dapat bertindak sebagai sebuah koenzim aktif. Gambar 55. Reaksi oleh Enzim Piridoksal Kinase BIOKIMIA 74 Dengan memasuki kombinasi basa Schiff di antara gugus aldehid dan gugus amino asam α-aminonya, piridoksal fosfat dapat memfasilitasi perubahan pada ketiga ikatan karbon α-amino yang tersisa, masing-masing secara berurutan untuk memungkinkan reaksi transminasi, dekarboksilasi, atau aktifitas treonin aldolase. Peran piridoksal fosfat di dalam transaminasi digambarkan pada gambar 56. Gambar 56. Peran Koenzim Piridoksal Fosfat di dalam Transaminasi Asam α-Amino BIOKIMIA 75 Defisiensi akibat kekurangan vitamin B6 biasanya jarang terjadi, dan defisiensi apapun merupakan bagian dari defisiensi umum vitamin B kompleks. Hati, ikan makarel, alpukat, pisang, daging, sayuran dan telur merupakan sumber vitamin B6 yang baik. Para peminum alkohol juga bisa mengalami defesiensi akibat metabolisme etanol menjadi asetaldehid, yang merangsang hidrolisis gugus fosfat koenzim tersebut. Asam Askorbat (Vitamin C) Struktur asam askorbat sangat mirip dengan glukosa; dari glukosa inilah asam askorbat diturunkan pada sebagian besar mamalia. Meskipun demikian, pada primata, termasuk manusia dan sejumlah hewan lain-misal, marmut, sebagian kelelawar, burung, ikan, serta invertebratatidak adanya enzim L-gulonolakton oksidase akan mencegah sintesis tersebut. Gambar 57. Struktur Asam Askorbat Mekanisme kerja berbagai aktivitas asam askorbt masih belum jelas sama sekali, tetapi berikut ini adalah sejumlah proses yang tercatat membutuhkan asam askorbat. Dalam banyak proses ini, asam askorbat tidak berpartisipasi langsung, tetapi diperlukan untuk mempertahankan agar kofaktor logam tetap berada dalam keadaan tereduksi. Kofaktor logam ini mencakup Cu+ pada mono oksigenase dan Fe2+ pada enzim dioksigenase. 1. Pada sintesis kolagen, asam askorbat diperlukan bagi hidroksilasi prolin. 2. Pada penguraian tirosin, oksidasi p-hidroksifenilpiruvat menjadi homogentisat membutuhkan vitamin C, yang bisa mempertahankan tereduksinya ion tembaga untuk memberikan aktivitas maksimal. Tahap selanjutnya dikatalisis oleh homogentisat dioksigenase yang merupakan enzim dengan kandungan besi fero yang juga membutuhkan asam askorbat. 3. Pada sintesis epinefrin dari tirosin, asam askorbat diperlukan dalam tahap dopamin βhidroksilase. 4. Pada pembentukan asam empedu, asam askorbat diperlukan dalam tahap awal reaksi 7α-hidroksilase. BIOKIMIA 76 5. Korteks adrenal mengandung vitamin C dalam jumlah besar, yang dengan cepat akan habis terpakai jika kelenjar tersebut dirangsang oleh hormon adrenokortikotroik. Penyebab peristiwa ini masih belum jelas, tetapi steroidogenesis melibatkan berbagai reaksi sintesis yang bersifat reduktif. 6. Penyerapan besi meningkat bermakna oleh Vitamin C. 7. Asam askorbat dapat bertindak sebagai antioksidan umum yang larut air, misalnya dalam mereduksi tokoferol-teroksidasi di dalam membran, dan dapat menghambat pembentukan nitrosamin selama berlangsungnya proses pencernaan. Skorbut adalah sindrom klasik defesiensi vitamin C. Keadaan ini berhubungan dengan gangguan sintesis kolagen yang diperlihatkan dalam bentuk pendarahan subkutan serta pendarahan lain, kelemahan otot, gusi yang membengkak dan menjadi lunak, serta tanggalnya gigi. Skorbut dapat disembuhkan dengan mengkonsumsi buah serta sayuran segar. Cadangan normal vitamin C cukup untuk waktu 3-4 bulan sebelum tanda-tanda skorbut muncul. Vitamin A (Retinol) Vitamin A adalah suatu alkohol. Di dalam tumbuhan vitamin A terdapat sebagai provitamin A, yaitu senyawa karoten. Pada hidrolisis karoten terjadi vitamin A. Gambar 58. Struktur Vitamin A dan Beta-Karoten Vitamin A berperan dalam proses melihat, yaitu pada proses fotokimia pada retina. Pada retina mata terdapat pigmen yang sensitif terhadap cahaya, yaitu rodopsin, suatu protein gabungan yang dapat berdisosiasi menjadi protein opsin dan retinen trans (vitamin A dalam bentuk aldehida). Disosiasi ini terjadi apabila rodopsin terkena cahaya. Trans retinen selanjutnya dapat direduksi oleh NADH dan enzim dehidrogenase alkohol membentuk trans vitamin A1. Peran lain dari cahaya pada siklus rodopsin adalah menghambat pembentukan rodosin dari protein opsin dan sis retinen. Melalui isomerisasi sis BIOKIMIA 77 retinen menjadi trans retinen. Sebaliknya, dalam keadaan gelap, sis retinen membentuk rodopsn kembali dengan opsin. Sis retinen juga dapat terbentuk kembali melalui isomerasi trans resinen atau melalui oksidasi sis vitamin A. Defesiensi vitamin A akan menyebabkan seseorang tidak dapat melihat dengan jelas dalam cahaya redup (rabun senja). Dalam proses reproduksi, vitamin A berfungsi sebagai salah satu faktor pertumbuhan. Tikus yang kekurangan vitamin A ternyata sering kurang subur, dan mengalami gangguan dalam sintesis androgen. Gambar 59. Proses Fotokimia pada Retina Vitamin E Vitamin E ditemukan pada tahun 1922, oleh Evans dan Bishop, dengan istilah tokoferol (dari bahasa Yunani, tocos berarti kelahiran anak dan phero berarti mengasuh). Terdapat enam jenis tokoferol, α (alfa), ß (beta), γ (gama), δ (delta), ρ (eta), λ (zeta). Tokoferol yang terbesar aktivitasnya adalah tokoferol alfa. Gambar 60. Struktur Vitamin E Vitamin E lebih mudah diserap usus, apabila terdapat lemak dan dalam kondisi tubuh yang mempermudah penyerapan lemak. Tokoferol dari makanan diserap oleh usus digabungkan BIOKIMIA 78 dengan kilomikron dan ditransportasikan ke hati melalui sistim limfatik dan saluran darah. Di hati, tokoferol disebarkan ke sel-sel jaringan tubuh melalui saluran darah. Di dalam plasma darah, tokoferol bergabung dengan lipoprotein, terutama VLDL ( Very Low Density Lipoprotein). Asam lemak tidak jenuh ganda (PUFA/ Poly Unsaturated Fatty Acid), dapat menurunkan penyerapan dan penggunaan vitamin E. Hal ini berkaitan kemungkinan dengan kecenderungan vitamin E bersifat mudah teroksidasi. Oleh karena itu kebutuhan vitamin E akan bertambah seiring dengan semakin bertambahnya konsumsi PUFA. Di dalam hati, α-tokoferol diikat oleh α-TPP (α-tokoferol transfer protein). Setelah menjalankan fungsinya sebagai antioksidan, tokoferol dapat teroksidasi menjadi tokoferil (tokoferol bentuk radikal) bentuk radikal ini dapat direduksi kembali menjadi tokoferol oleh kerja sinergi dari antioksidan yang lain, misalnya vitamin C dan glutation. Kelebihan vitamin E dalam tubuh akan disimpan dalam beberapa organ, antara lain hati, jaringan adiposa, otak dan lipoprotein. Vitamin E diekskresikan dari tubuh bersama dengan empedu melalui feses, sebagian lagi melalui urin setelah diubah lebih dahulu menjadi asam tokoferonat dan tokoferonalakton yang dapat berkonjugasi dengan glukoronat. B. Mineral Mineral merupakan kebutuhan tubuh manusia yang mempunyai peranan penting dalam pemeliharaan fungsi tubuh, seperti untuk pengaturan kerja enzim, pemeliharaan keseimbangan asam-basa, membantu pembentukan ikatan yang memerlukan mineral seperti hemoglobin dan Adenosin Tri Phospat (ATP). Mineral digolongkan menjadi mineral makro dan mikro. Mineral makro adalah mineral yang dibutuhkan tubuh sebanyak lebih 100 gram sehari. Sedangkan mineral mikro adalah mineral yang dibutuhkan tubuh kurang dari 100 gram sehari. Yang termasuk mineral makro antara lain: Natrium, Phospor, Klorida, Kalium, Kalsium, Magnesium, dan Sulfur. Phospor (P) merupakan mineral yang dibutuhkan tubuh sebanyak 22% dari sejumlah mineral yang ada dalam tubuh atau setara dengan 0, 9 gram sehari. Di dalam tubuh phosphor ada dalam bentuk kalsium phospat, sehingga penting untuk pertumbuhan tulang dan gigi. Phospor memiliki peranan penting dalam metabolisme karbohidrat, lemak dan protein. Sebagai contoh, phopsor memegang peranan penting dalam reaksi ikatan yang berkaitan dengan pelepasan dan penyimpanan energi dalam bentuk ATP. Bentuk lain phopor adalah sebagai phopolipid. Phopor BIOKIMIA 79 juga komponen essensial bagi banyak sel dan alat transport asam lemak. Selain itu, phopor juga berperan dalam keseimbangan asam basa. Natrium (Na) adalah kation utama dalam cairan ekstraselular. Sebanyak 30-40% natrium ada di dalam kerangka tubuh. Di dalam tubuh, Na terdapat di dalam sel (intraseluler) dan terutama terdapat dalam cairan di luar sel (cairan extraseluler). Kebutuhan tubuh akan natrium sebanyak 1 gram sehari. Nilai normal dalam tubuh 136-145 mEq/L darah. Natrium berfungsi: 1) Menjaga keseimbangan cairan dalam tubuh (ekstrasel), 2) Menjaga keseimbangan asam basa di dalam tubuh, 3) Berperan dalam pengaturan kepekaan otot dan saraf, 4) Berperan dalam transmisi saraf yang menghasilkan terjadinya kontaksi otot, 5) Berperan dalam absorpsi glukosa dan 6) Berperan sebagai alat angkut zat-zat gizi lain melalui membran, terutama melalui dinding usus. Kalium (K) memiliki fungsi menjaga keseimbangan asam basa dan keseimbangan air dalam tubuh. Kalium dibutuhkan tubuh sejumlah 2 gram sehari. Kalium merupakan ion bermuatan positif, kalium terutama terdapat di dalam sel. Perbandingan natrium dan kalium di dalam cairan intraselular adalah 1:10, sedangkan di dalam cairan ekstraselular 28:1. Sebanyak 95% kalium tubuh berada di dalam cairan intaselular. Fungsi kalium yaitu: 1) Bersama Natrium memelihara keseimbangan cairan dan elektrolit serta keseimbangan asam basa, 2) Bersama Kalsium: berperan dalam transmisi saraf dan relaksasi otot, 3) di dalam sel: katalisator dalam banyak reaksi biologik (metabolisme energi, sintesis glikogen, dan protein), 4) terutama metabolisme energi dan sintesis glikogen dan protein, dan 5) Berperan dalam pertumbuhan sel. Jika kadar kalium dalam darah rendah dapat menyebabkan kelumpuhan dan gangguan jantung. Kalsium (Ca) memiliki fungsi utama dalam pembentukan tulang dan gigi, pembekuan darah, fungsi saraf dan otot. Kekurangan kalsium dalam darah dapat menyebabkan kejang otot. Jumlah kalsium yang dibutuhkan tubuh adalah 1 gram. Konsumsi Ca yang berlebihan dapat menyebabkan sulit buang air besar dan mengganggu penyerapan mineral seperti zat besi, seng, dan tembaga. Kelebihan Ca dalam jangka panjang akan meningkatkan risiko terkena hiperkalsemia. Magnesium (Mg) merupakan bagian komponen senyawa kimia Adenosin Tri phospat (ATP) dan kation terbanyak setelah natrium di dalam cairan interselular. Fungsi magnesium adalah sebagai pengaktif enzim, pembentukan tulang dan gigi. Jumlah magnesium yang dibutuhkan tubuh adalah 0.3 gram. Kekurangan magnesium dapat menyebabkan fungsi saraf menjadi abnormal dan menyebabkan gangguan absorpsi atau penurunan fungsi ginjal dan endokrin. BIOKIMIA 80 Kelebihan magnesium dapat menyebabkan tekanan darah rendah, kegagalan pernafasan, dan ganggungan irama jantung. Zat Besi (Fe) mempunyai peranan sangat penting yaitu mengubah reaksi kimia di dalam tubuh seperti pembentukan enzim, pembentukan sel darah merah dan sel-sel otot. Kebutuhan tubuh akan zat besi adalah 12 miligram sehari. Kekurangan zat besi dapat menyebabkan anemia, kesulitan menelan, kuku berbentuk sendok, kelainan usus, berkurangnya kinerja, dan gangguan kemampuan belajar. Kelebihan zat besi dapat menyebabkan sirosis hati, diabetes mellitus dan pewarnaan kulit. Zeng (Zn) memiliki peranan yang penting yaitu sebagai komponen enzim, pembentukan sel darah merah, pembentukan enzim dan pembentukan tulang. Kebutuhan tubuh akan seng dalam sehari adalah 15 miligram. Kekurangan zeng dapat menyebabkan pertumbuhan yang lambat dan tertunda kematangan seksual. Tembaga (Cu) dibutuhkan tubuh sebanyak 2 miligram. Fungsi tembaga paling utama adalah sebagai salah satu komponen enzim. Selain itu tembaga juga berperan dalam pembentukan sel darah merah dan tulang. Kekurangan tembaga dapat menyebabkan anemia. Mangan (Mn) diperlukan tubuh sebanyak 3,5 miligram. Fungsi utama mangan adalah sebagai komponen enzim, Kekurangan mangan bisa menyebabkan berkurangnya berat badan, perubahan warna rambut, iritasi warna kulit, mual dan muntah serta dapat menyebabkan pertumbuhan rambut yang lambat. Molibdenum (Mo) dibutuhkan tubuh sebanyak 150 mikrogram dan memiliki fungsi utama sebagai pengaktif enzim. Kekurangan mineral ini bisa menyebabkan asidosis, denyut jantung cepat, bitnik buta, rabun senja dan mudah tersinggung. Selenium (Se) dibutuhkan tubuh 60 mikrogram dan fungsi utamanya adalah berperan dalam sintesis enzim antioksidan. Iodium (I) berfungsi untuk membentuk hormone tiroid yang berperan mengkontrol mekanisme energi tubuh. Tubuh membutuhkan 150 mikrogram mineral ini. Jika kekurangan iodium dapat menyebabkan kreatinisme, pembesaran kelenjar tiroid, pertumbuhan janin dan otak abnormal dan bisa mengakibatkan bisu-tuli. Fluor (F) dibutuhkan tubuh sebanyak 2,5 miligram. Fungsi utamanya adalah pembentukan tulang dan gigi. Kekurangan mineral ini dapat menyebabkan kavitasi gigi atau yang sering BIOKIMIA 81 dikenal karies, dan penipisan tulang. Namun jika kebihan fluor dapat menyebabkan fluorosis gigi maupun tulang yaitu salah satu gejala yang muncul apabila seseorang mendapat asupan fluor secara berlebih. Fluorosis gigi merupakan indikasi yang jelas dari kelebihan fluor pada masa kanak – kanak ketika mineralisasi sedag berlangsung dan efek ini tidak tampak jika kelebihan fluor terjadi ketika gigi sudah tumbuh sepenuhnya. Klorida (Cl) merupakan anion utama cairan ekstraselular. Klorin merupakan 0,15% berat badan. Konsentrasi klorida tertinggi adalah dalam cairan serebrospinal (otak dan sumsum tulang belakang), lambung dan pancreas. Fungsi Cl anatara lain: 1) Mengatur keseimbangan asam basa di dalam plasma, 2) Merangsang produksi asam lambung yang diperlukan untuk mencerna protein dan makanan berserat, 3) Merangsang hati berfungsi lebih baik sebagai alat penyaring, 4) Menolong membersihkan zat-zat beracun dari dalam tubuh, dan 5) Memelihara kesehatan sendi dan menolong mengatur distribusi hormon. BIOKIMIA 82 DAFTAR PUSTAKA Brody, Tom. 1994. Nutritional Biochemistry. United Kingdom: Academic Press. Linder, MC. 1992. Biokimia Nutrisi dan Metabolisme. Parakkasi Aminuddin, penerjemah. Jakarta : Universitas Indonesia press. Terjemahan dari : Nutritional Biochemistry and Metabolism Martoharsono Soeharsono. 1978. Biokimia jilid I. Yogyakarta: Gadjah Mada University press. Mulyani, Sri. 2010. Pengantar Biokimia. Surakarta: Universitas Sebelas Maret Press. Page David S. 1989. Prinsip-prinsip Biokimia. Soendoro R, penerjemah. Jakarta : Erlangga.. Terjemahan dari : Principles of Biological Chemistry. Timberlake KC. 2002. Organic and Biological Chemistry: Structures of Life. San Fransisco. Benjamin Cumings BIOKIMIA 83











