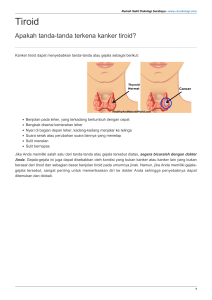
9 BAB II KAJIAN PUSTAKA 2.1 Struktur Normal Tiroid 2.1.1 Anatomi
advertisement

BAB II KAJIAN PUSTAKA 2.1 Struktur Normal Tiroid 2.1.1 Anatomi Makroskopis Tiroid Kelenjar tiroid normal berbentuk seperti sayap kupu-kupu dengan dua lobus lateral dihubungkan oleh isthmus. Lebar lobus lateralis dua sampai dua setengah cm, panjang limasampai enam cm, dan tebal dua cm. Lobus yang satu bisa lebih besar dibandingkan lobus yang lain. Lobuspiramidalis, yang merupakansisa duktus tiroglosusditemukan pada 40% kelenjar tiroid. Ini terlihat sebagai tonjolan pendek dari jaringan tiroid yang memanjang dari isthmus sampai permukaan tulang rawan tiroid (Kondo et al., 2006; Carcangiu, 2007; Merino, 2008; Rosai, 2010). Kelenjar tiroid terletak di tengah leher dan terikat dengan bagian depan trakea oleh jaringan ikat longgar. Kedua lobus lateralis mengelilingi bagian ventral danlateral laring serta trakea sampai bagian bawah tulang rawan tiroid dan menutupi cincin trakea ke dua, tiga, dan empat. Berat normal tiroid 15 sampai 25 gram (Kondo et al., 2006; Carcangiu, 2007). Variasi berat tiroid dipengaruhi oleh umur, jenis kelamin, berat badan, status fungsional kelanjar tiroid, serta asupan iodine. Volume kelenjar tiroid meningkat pada wanita saat menstruasi. Kapsel jaringan ikat tipis menutupi kelenjar tiroid. Septa jaringan ikat fibrus berhubungan dengan kapsel ini dan menembus parenkim tiroid, membagi tiroid menjadi lobulus (disebut thyromeres) (Carcangiu, 2007). 9 10 Warna normal tiroid merah kecoklatan. Pada orang tua kelenjar tampak kehitaman, karena penumpukan pigmen menyerupai melanosit pada sel folikel. Fenomena ini disebut melanosis thyroid atau black thyroid. Hal ini juga ditemukan pada pasien yang mendapatkan pengobatan minocycline (Carcangiu, 2007; Baloch and LiVolsi, 2010; Rosai, 2010). Aliran darah tiroid berasal dari arteri tiroid superior, arteri tiroid inferior, dan arteri tiroid ima. Jaringan limfatik menembus kelenjar tiroid, mengelilingi folikel dan menghubungkan kedua lobus melalui isthmus. Aliran limfe dari lobus superior dan isthmusmenuju kelenjar getah bening jugularis interna, dan bagian inferior menuju kelenjar getah bening pretracheal, paratracheal, serta prelaryngeal. Lokasi tumor primer berhubungan dengan lokasi awal metastasis kelenjar getah bening. Derajat anastomosis kelenjar betah bening dapat memberikan petunjuk lokasi tumor primer (Carcangiu, 2007). 2.1.2 Anatomi MikroskopisTiroid Folikel adalah unit dasar kelenjar tiroid. Bentuknya bulat sampai oval, ditutupi selapis epitel yang terletak pada membran basalis. Lumen folikel berisi koloid, yaitu bahan jernih yang sebagian besar terdiri dari protein, termasuk thyroglobulin (TGB) yang dikeluarkan oleh sel folikular (Gambar 2.1 A) (Carcangiu, 2007; Baloch and LiVolsi, 2010). Folikel dipisahkan dengan folikel lainnya oleh jaringan ikat longgar tipis. Rerata ukuran diameter folikel adalah 200 µm (Kondo et al., 2006; Carcangiu, 2007). Ukuran folikel bervariasi tergantung status fungsi kelenjar dan umur. 11 Bentuk folikel yang memanjang merupakan gambaran hiperplasia atau neoplasia sebagai akibat adanya penekanan pada struktur folikel (Gambar 2.1 B) (Carcangiu, 2007). Gambar 2.1 Mikroskopiskelenjar tiroid.A. Bentuk folikel bulat sampai oval. B. Folikel tampak memanjang akibat kompresi (Carcangiu, 2007) Sel epitel kelenjar yang melapisi folikel adalah sel folikular atau thyrocytes. Selain itu, ada pula komponen sel lain yang disebut sebagai sel C atau parafolikular. Sel folikular atau thyrocytes mempunyai ukuran dan bentuk yang bervariasi sesuai dengan status fungsional kelenjar. Ada tiga tipe sel, yaitu pipih (endotelioid), kubus, dan kolumnar (silindris). Sel pipih tidak aktif. Sel kubus merupakan sel yang paling banyak, dan fungsi utamanya untuk sekresi koloid. Sel kolumnar berfungsi menyerap TGB, menyimpanhormon aktif, dan mengeluarkan hormon tersebut ke pembuluh darah (Carcangiu, 2007). Pemeriksaan mikroskop elektron menunjukkan sel folikel tersusun selapis melingkari koloid dengan ketebalan sekitar 35 sampai 40 µm dan terletak di membran basalis, terpisah dengan stroma interstitial. Tampak mikrovili pada permukaan sel dengan jumlah dan panjang yang meningkat pada sel yang aktif. Jumlah retikulum endoplasma bervariasi, ukuran mitokondria, dan lisosom 12 biasanya kecil. Apabila jumlah mitokondria meningkat akan tampak butir-butir dengan sitoplasma lebih eosinofilik (hurthle cell) (Carcangiu, 2007; Rosai, 2010). 2.1.3 Fisiologi Tiroid Fungsi utama kelenjar tiroid adalah menghasilkan hormon tiroid. Hormon tiroid yang paling penting adalah triiodothyroxine (T3) dan thyroxine (T4). Hormon ini mengatur metabolisme, peningkatan sistesis protein di setiap jaringan tubuh, meningkatkan penggunaan oksigen, meningkatkan produksi panas tubuh, cardiac output, dan denyut jantung.. Hormon tiroid juga penting untuk perkembangan tubuh dan pematangan sistem saraf pusat serta saraf perifer. Pengaruh hormon tiroid terhadap pertumbuhan melalui kerja langsung pada sel untuk meningkatkan kecepatan pertumbuhan, mengatur hormon yang lain, atau dengan memicu pengeluaran growth hormone (Merino et al., 2008; Maitra, 2010). Biosintesis hormon tiroid dimulai dari asupanion iodine yang terdapat pada air atau makanan, kemudian diserap dan dibawa ke cairan ekstraseluler, dan akhirnya ke dalam tiroid dimana konsentrasi iodine dalam sel 30 kali lebih tinggi dibandingkan konsentrasi di darah tepi. Pengambilan iodide secara aktif melewati membran basalis difasilitasi oleh human sodium iodide symporter. Sistem transpor ini berpasangan dengan aliran natrium. Iodide di dalam tiroid kemudian dioksidasi menjadi iodine. Iodine selanjutnya diubah menjadi thyrosine. Hasil akhirnya adalah monoiodotyrosine (MIT) apabila satu molekul thyrosine yang terikat, dan diiodotyrosine (DIT) apabila dua molekul thyrosine yang terikat. Sisa iodothyrosine kemudian mengendap dan membentuk hormon tiroid aktif T3 dan 13 T4. Hormon T3 terbentuk dari penggabungan satu molekul DIT dan satu molekul MIT, sedangkan hormon T4 dibentuk dari penggabungan dua molekul DIT (Carcangiu, 2007; Merino et al., 2008; Maitra, 2010). Hormon tiroid disimpan di dalam TGB termasuk sisa endapan serta T3 dan T4. Pada penelitian tentang variasi rantai molekul TGB ditemukan perbedaan antara kelenjar tiroid normal dan kondisi patologis seperti pada neoplasma. Thyroglobulin dikumpulkan di tengah folikel tiroid dan merupakan isi utama koloid. Pada pemeriksaan menggunakan mikroskop elektron tampak adanya perubahan morfologi kelenjar tiroid pada saat fase produksi hormon dan sekresi hormon. Sintesis TGB dimulai di retikulum endoplasma, dan berlanjut di aparatus golgi dimana karbohidrat kehilangan rantai gulanya, selanjutnya dikumpulkan di mikrovesikel dan isinya kemudian dikeluarkan ke lumen folikel (Carcangiu, 2007). Penyerapan TGB terjadi di pseudopodia sitoplasma. Thyroglobulin kemudian masuk ke dalam lisosom. Isi dari TGB akan dicerna oleh enzim-enzim lisosom. Hasil pemecahannya meliputi hormon T3 dan T4, kemudian mengalir ke dalam darah yang diangkut terutama oleh protein spesifik, thyroxine binding globulin (TBG). Thyroxine binding globulin mengangkut sekitar 70% hormon tiroid, serta 20% diangkut oleh transthyretin (prealbumin) dan albumin. Hanya sebagian kecil hormon tiroid di dalam darah terlepas bebas dan aktif, yaitu 0,05% T3 dan 0,015% T4. Jumlah hormon T4 di sirkulasi lebih banyak dibandingkan hormon T3, tetapi hormon T3 empat kali lebih aktif dibandingkan hormon T4, sehingga peranan kedua hormon ini seimbang (Carcangiu, 2007; Merino et al., 2008). 14 Sintesis dan pengeluaran hormon tiroid diatur oleh kadar hormon Thyroid StimulatingHormone (TSH) di dalam darah. Thyroid StimulatingHormone dihasilkan oleh kelenjar pituitary anterior. Hormon ini berikatan dengan reseptor spesifik pada membran sel folikular, dan mengaktifkan adenyl cycklase pathway yang mengatur T3 dan T4. Stimulasi kelenjar tiroid oleh TSH akan meningkatkan sekresi hormon tiroid dan aliran darah ke kelenjar tiroid. Kondisi ini akan menyebabkan hipertrofi dan hiperplasia sel folikular yang diikuti dengan penurunan cadangan koloid. Pada tingkat fungsional sel, hal ini ditandai dengan peningkatan konsentrasi iodide dan protein pengikat, peningkatan sintesis, dan sekresi hormon (Merino et al., 2008; Maitra, 2010; Viglietto, 2011). Pengeluaran hormon TSH dari kelenjar pituitary anterior diatur oleh Thyroid ReleasingHormone (TRH)di hipotalamus. Pengeluaran TSH dan TRH diatur oleh kadar T3 dan T4 yang bebas di dalam darah melalui mekanisme umpan balik negatif ke pituitary dan hipotalamus. Kadar T3 dan T4 yang rendah akan memacu pengeluaran TSH dan TRH, begitu juga sebaliknya kadar T3 dan T4 yang tinggi akan menghambat pengeluaran TSH dan TRH. Di perifer, T3 dan T4 berikatan dengan reseptor hormon tiroid (TR), dan membentuk kompleks hormon-reseptor yang akan menuju inti dan merangsang transkripsi, sehingga disebut thyroid response elements (TREs) (Gambar 2.2) (Carcangiu, 2007; Maitra, 2010; Viglietto, 2011). 15 Gambar 2.2 Homeostasis hormon tiroid yang diatur oleh poros hipotalamus-pituitary-tiroid (Maitra, 2010) 2.2 Nodul Tiroid yang Berasal dari Diferensiasi Sel Folikular 2.2.1 Nodul Tiroid Nonneoplastik Nodul tiroid nonneoplastik dengan diferensiasi sel folikular yang tersering adalah hiperplasia nodular, yang dapat merupakan suatu endemic goiter atau sporadic (nodular) goiter. Endemic goiter disebabkan oleh kurangnya asupan iodine, sehingga terjadi defisiensi produksi hormon tiroid. Hal ini mengakibatkan sekresi TSH meningkat, yang pada fase awal menyebabkan tiroid menjadi hiperaktif dengan epitel folikular yang tinggi dan koloid yang sedikit (disebut parenchymatous goiter), dan selanjutnya sel epitel folikel menjadi atrofi dengan 16 jumlah koloid yang masif, dengan atau tanpa membentuk struktur nodularity (disebut diffuse atau nodular colloid goiter) (Rosai, 2010). Penyebab sporadic (nodular) goiter diantaranya adalah kurangnya asupan iodine, gangguan sintesis hormon tiroid, meningkatnya iodide clearance oleh ginjal, adanya thyroid-stimulating immunoglobulins, dan meningkatnya produksi insulin-like growth factor (Rosai, 2010). Gejala klinis sporadic goiter tampak pada 2% hingga 4% dari populasi. Kira-kira 10% lesi tiroid ini ditemukan saat otopsi, yang umumnya multipel (Baloch and LiVolsi, 2006; 2010). Status hormonal pasien umumnya euthyroid (Rosai, 2010). Secara makroskopis hiperplasia nodular ini menunjukkan pembesaran kelenjar ringan sampai masif, dengan berat berkisar antara 50 gram hingga mencapai lebih dari 800 gram, kapsel jaringan tampak utuh, dan permukaan luar jaringan tampak tidak rata. Pada irisan, tampak nodul yang terpisah dari jaringan tiroid normal di sekitarnya, dapat dikelilingi oleh kapsel yang utuh atau parsial (Baloch and LiVolsi, 2010). Nodul terutama tersusun dari jaringan tiroid berwarna coklat, jaringan ikat fibrus, dan sering ditemukan kalsifikasi, perdarahan, dan degenerasi kistik (Gambar 2.3 A) (Baloch and LiVolsi, 2010; Maitra, 2010; Rosai, 2010). Secara mikroskopis tampak nodul tersusun dari folikel dalam berbagai bentuk dan ukuran. Folikel dapat melebar dilapisi oleh epitel pipih yang atrofi. Sebagian area tampak lebih hiperseluler dan hiperplastik, dan dapat pula didominasi oleh sel-sel hurthle (Gambar 2.3 B). Beberapa folikel yang berdilatasi dapat menunjukkan folikel-folikel kecil yang aktif, dan disebut sebagai sanderson’s 17 polsters (Gambar 2.3 C). Dapat pula ditemukan struktur papiler menonjol ke dalam lumen folikel yang berdegenerasi kistik, yang gambarannya dapat dikelirukan dengan karsinoma papiler (Gambar 2.3 D) (Rosai, 2010). A B C D Gambar 2.3 Hiperplasia nodular. A. Makroskopis hiperplasia nodular. B. Mikroskopis tampak hiperplasia nodular tidak diliputi oleh kapsel. C. Gambaran sanderson’s polsters. D. Hiperplasia nodular dengan pola papiler, menonjol ke bagian tengah folikel yang berdilatasi kistik. Inti sel tampak terletak di basal (Rosai, 2010) Folikel yang ruptur dapat menimbulkan reaksi granulomatosa, dan ditemukan sel histiosit serta foreign body-type giant cell. Sering pula ditemukan area perdarahan, trabekulasi jaringan ikat fibrus, dan fokus kalsifikasi. Kadangkala 18 dapat ditemukan osseus metaplasia dan penebalan pembuluh darah dengan kalsifikasi pada tunika media. Sebukan sel radang kronik dapat ditemukan pada stroma, yang mengindikasikan adanya tiroiditis kronis. Pada kasus-kasus adanya riwayat paparan bahan radioaktif dapat ditemukan inti sel folikel yang atipik (Merino et al., 2008; Maitra, 2010; Rosai, 2010). Hiperplasianodular dengan gambaran mikrofolikular dan makrofolikular khusus, dan adenoma dengan kapsel yang tidak utuh dapat menimbulkan kesulitan dalam diagnosis (Rosai, 2010). Pada beberapa kasus dapat ditemukan nodul tunggal folikular, yang secara histologis setidaknyatampakidentik dengan nodul multipel yang terlihat pada hiperplasia nodular, sehingga dapat muncul pertanyaan,“apakah nodul ini merupakan nodul regeneratif atau nodul proliferatif, namun bukan neoplasma, atau sebaliknya, apakah nodul ini merupakan adenoma folikular jinak?”. Beberapaahli patologi lebih suka istilah yang kurang definitif, yakni "adenomatous atau adenomatoid follicular nodule" terhadap lesi seperti ini, untuk menghindari masalah histogenesis (Baloch and LiVolsi, 2010). Hiperplasia nodular terjadi karena sel epitel folikel secara intrinsik berkembang lebih pesat. Perkembangan awal bersifat poliklonal, yang melibatkan satu folikel atau mungkin sekelompok folikel yang mengakibatkan iskemia fokal, nekrosis, dan proses peradangan. Proses yang sama selanjutnya mempengaruhi kelompok folikel lainnya. Selama berlangsungnya proses tersebut terjadi fenomena sekunder berupa perdarahan, fibrosis, dan kalsifikasi. Sementara itu, rangsangan hormonal pada kelenjar tetap berlangsung. Distorsi terhadap pasokan 19 pembuluh darah dan adanya folikel melebar yang mengandung bahan koloid mengganggu distribusi iodide dan thyrotropine. Beberapa bagian dari kelenjar terpapar kelebihan thyrotropine, sehingga mengalami hiperplasia fokal, sedangkan area lainnya mengalami defisiensi thyrotropine, sehingga mengalami zona atrofi (Baloch and LiVolsi, 2010). 2.2.2 Nodul Neoplastik Jinak Tiroid Adenoma folikular atau solitary adenomatous atau adenomatoid nodule merupakan tumor jinak berkapsel, bersifat monoklonal, terdiri dari proliferasi folikel tiroid yang umumnya tampak seragam pada seluruh area nodul (Ghossein, 2009; Baloch and LiVolsi, 2010; Rosai, 2010).Adenoma bersifat soliter, berbatas tegas dengan jaringan sekitarnya (Gambar 2.4 A). Apabila pada satu lobus atau kelenjar tiroid tampak beberapa nodul, maka lebih tepat didiagnosis sebagai multinodular goiter dengan perubahan adenomatosa (adenomatous hyperplasia) (Merino et al., 2008). Secara histologis, gambaran Meissner digunakan untuk membedakan adenoma dengan adenomatous nodule yang merupakan hiperplasia nodular, meliputi adanya kapsel, keseragaman pola pada adenoma, dan adanya penekanan kelenjar sekitarnya oleh adenoma dan kapselnya (Baloch and LiVolsi, 2010). Adenoma dapat menunjukkan berbagai pola, baik tunggal maupun kombinasi, antara lain normofolikular (simple), makrofolikular (koloid), mikrofolikular (fetal) (Gambar 2.4 B), dan trabekular atau solid (embrional). Mitosis jarang dijumpai atau bahkan tidak ditemukan. Kadang, dinding pembuluh darah pada kapsel 20 adenoma mengalami penebalan fokal yang nyata, dan disebut sebagai muscular cushions. Gambaran ini juga dapat ditemukan pada bagian tepi dari hiperplasia nodular. Adenoma juga dapat menunjukkan struktur papiler atau pseudopapiler, yang dapat dikelirukan dengan gambaran karsinoma papiler. Beberapa peneliti menyebut lesi ini sebagai adenoma papiler, yang kemudian diganti menjadi adenoma folikular dengan arsitektur papiler (Rosai, 2010). A B Gambar 2.4 Adenoma folikular. A Makroskopis tampak nodul berbatas tegas dengan jaringan di sekitarnya B. Mikroskopis nodul tersusun atas proliferasi folikel tiroid yang tampak seragam (Baloch and LiVolsi, 2010) Pada adenoma ditemukan pula berbagai gambaran, seperti perdarahan, edema, dan fibrosis, yang terutama terjadi pada bagian tengah tumor (Maitra, 2010; Rosai, 2010).Area yang mengalami tusukan saat pemeriksaan FNAB dapat menunjukkan gambaran nekrosis, peningkatan aktivitas mitosis, serta atipia seluler di sepanjang area tusukan jarum. Dapat pula ditemukan kalsifikasi dan beberapa komponen yang jarang, antara lain lemak, tulang rawan, atau signet ring cells. Kadang pada adenoma dijumpai pula sel-sel besar yang secara sitologis 21 tampak atipik dengan inti hiperkromatik, dan sel besar berinti banyak (Baloch and LiVolsi, 2010; Rosai, 2010). Selain itu ada pula kelompok adenoma folikular atipik yang diperkenalkan oleh Hazard dan Kenyon,terdiri dari lesi noninvasif dengan peningkatan selularitas, adanya gambaran atipia inti dan atau aktivitas mitosis, dan sering ditemukan nekrosis tumor dan infark. Secara klinis adenoma folikular atipik ini berperilaku jinak (Baloch and Livolsi, 2010). 2.2.3 Nodul Neoplastik Ganas Tiroid Berdasarkan penelitian yang didukung oleh World Health Organization (WHO) pada tahun 2010, ditemukan sekitar 44.670 kasus baru dan 1.690 kematian disebabkan oleh kanker tiroid setiap tahunnya.Insiden karsinomatiroid di Amerika Serikat sekitar 1% dari semua jenis kanker, dan mengakibatkan kematian sebesar 0,2% (LiVolsi, 2011). Di Indonesia, berdasarkan data registrasi kanker berbasis patologi pada tahun 2010, disebutkan bahwa kanker tiroid menduduki peringkat ke lima kanker tersering, dan juga merupakan kanker ke empat terbanyak yang terjadi pada perempuan, setelah kanker payudara, leher rahim, dan ovarium (Anonim, 2010). Kanker tiroid tercatat menduduki lima besar kanker tersering di Denpasar dari tahun 2007 hingga 2010. Pada tahun 2007 ditemukan sebanyak 127 kasus kanker tiroid (Anonim, 2007), yang naik menjadi 155 kasus pada tahun 2008 (Anonim, 2008). Tahun 2009 terjadi penurunan jumlah kejadian menjadi 84 kasus, namun naik menduduki peringkat ke tiga kanker terbanyak (Anonim, 2009). Jumlah 22 kasus kanker tiroid kembali bertambah tahun 2010 menjadi 118 kasus, yang merupakan 10,58% dari semua jenis kanker yang terjadi di Denpasar (Anonim, 2010). Secara epidemiologi,karsinoma tiroid terjadi pada usia dewasa muda dan pertengahan, serta jarang ditemukan pada anak-anak (DeLellis and Williams, 2004; LiVolsi, 2011). Sebagian besar karsinoma tiroid (kecuali karsinoma medullary) berasal dari diferensiasi sel folikular tiroid. Lebih dari 85% kasus keganasan organ tiroid tersebut merupakan karsinoma papiler, yang tidak jarang menimbulkan kesulitan diagnosis (Maitra, 2010; Rosai, 2010; LiVolsi, 2011). Sebagian besar pasien didiagnosis pada usia dekade ke tiga sampai lima, dan kejadian pada jenis kelamin perempuan dua hingga empat kali lebih tinggi dibandingkan dengan laki-laki (Kondo et al., 2006; LiVolsi, 2011). Berikut akan dibahas secara lebih rinci mengenai karsinoma papiler tiroid. 2.2.3.1 Karsinoma papiler tiroid Karsinoma papiler tiroid merupakan tumor epitelial ganas yang menunjukkan diferensiasi sel folikular dan ditandai dengan gambaran inti yang khas (LiVolsi et al., 2004). Epidemiologi dari karsinoma papiler tiroid ini menimbulkan ketertarikan banyak pihak. Studi dari berbagai belahan dunia yang telah membandingkan insiden karsinoma papiler tiroid pada populasi yang tinggal di daerah pegunungan dengan populasi yang tinggal di dekat laut menyimpulkan bahwa konsentrasi konsumsi yodium berpengaruh terhadap kejadian penyakit ini, 23 dan pada beberapa kasus mempengaruhi morfologi karsinoma papiler (Kondo et al., 2006; LiVolsi, 2011). Pada akhir abad 20, seiring dengan meningkatnya penggunaan terapi radiasi, diantaranya pada pasien-pasien dengan tumor jinak bagian kepala dan leher, seperti hemangioma, limfangioma, pembesaran kelenjar gondok, pembesaran tonsil, dan adenoid, dalam perjalanan terapinya didapatkan karsinoma papiler tiroid sebagai „tumor primer kedua‟. Ditemukan fakta bahwa radiasi pada daerah leher merusak folikel tiroid dan menyebabkan hipotiroid relatif. Akibat hipotiroid relatif adalah terjadinya peningkatan sekresi TSH. Diperkirakan peningkatan TSH pada epitel folikel tiroid yang „rusak‟ (gangguan pada DNA yang berakibat pada mutasi dan translokasi), akan mengakibatkan transformasi neoplastik pada sel tiroid (juga harus dipertimbangkan pula individu yang memiliki cacat genetik, dimana hal ini merupakan faktor predisposisi terjadinya neoplasma multipel). Pada akhirnya, peristiwa ledakan dan kebakaran pada pembangkit listrik tenaga nuklir di Chernobyl, Uni Soviet pada bulan April 1986, disusul dengan „epidemi‟ karsinoma tiroid yang terutama terjadi pada anak-anak usia di bawah 15 tahun, dan beberapa didapatkan pada janin dalam kandungan (LiVolsi, 2011). Gambaran makroskopis karsinoma papiler tiroid cukup bervariasi. Lesi dapat muncul dimana saja pada kelenjar tiroid. Secara umum karsinoma papiler memiliki rerata ukuran dua hingga tiga cm. Lesi dapat berukuran besar atau berukuran kurang dari satu cm. Lesi berbatas tegas, dan umumnya tampak berwarna putih (Gambar 2.5 A). Biasanya ditemukan pula kalsifikasi. Pada sklerosis yang luas, lesi akan tampak menyerupai bekas luka. Selain itu, dapat 24 ditemukan pula bentukan kista dan area-area nekrosis (Baloch and LiVolsi, 2010; Rosai, 2010; LiVolsi, 2011). Secara mikroskopis karsinoma papiler tiroid mempunyai gambaran yang khas. Tumor dapat didominasi bentukan papiler (Gambar 2.5 B), atau dapat pula menunjukkan pola folikular (Gambar 2.5 C). Dapat ditemukan fibrovascular core (kadang hanya jaringan ikat fibrus) yang dilapisi satu atau beberapa lapis sel berbentuk kuboid atau kolumnar, dengan inti yang jernih (ground glass), berbentuk oval, tampak membesar, terletak saling tumpang tindih,membran inti tidak beraturan, adanya inklusi sitoplasma intranuklear, serta nuclear grooves(Chan, 2004; Elsheikh et al., 2008; Fischer and Asa, 2008). Ground glass nuclei dideskripsikan sebagai inti yang jernih, ground glass, kosong, atau orphan annie eyes. Inti tampak lebih besar dan lebih oval bila dibandingkan dengan inti sel folikel normal dan mengandung kromatin yang hipodens (Gambar 2.5 C) (LiVolsi, 2011). Inklusi sitoplasma intranuklear yang lebih sering ditemukan pada bahan aspirasi, menunjukkan gambaran sitoplasma yang masuk ke inti dan harus terlihat batas yang jelas. Kriteria yang harus dipenuhi, yaitu selnya harus sel epitel folikel dengan diameter paling sedikit seperempat diameter inti, warna serupa dengan sitoplasma, serta tepi inklusi sitoplasma dalam inti harus jelas, bulat, dan reguler. Sementara itu, nuclear grooves merupakan invaginasi membran inti yang paralel dengan aksis elongasi inti (Rosai, 2010). Beberapa penelitian berusaha mengungkap penyebab gambaran khas inti di atas. Dilaporkan bahwa sel-sel folikel tiroid yang terpapar dengan onkogen RET 25 gambaran morfologinya menyerupai karsinoma papiler, namun penelitian ini tidak dijelaskan lebih lanjut. Penelitian terkini melaporkan bahwa pengecatan imunohistokimia dengan protein emerin menunjukkan perbedaan pola yang jelas antara inti karsinoma papiler dengan inti pada sel tiroid normal atau pada tumor jinak, namun tidak dapat menjelaskan perubahan morfologi yang terjadi pada inti tersebut (LiVolsi, 2011). B D Gambar 2.5 Karsinoma papiler tiroid. A. Makroskopis tampak tumor berbatas tegas, menyerupai adenoma folikular. B. Mikroskopis karsinoma papiler tiroid varian klasik. C. Mikroskopis karsinoma papiler tiroid varian folikular. Inti sel epitel folikel tampak jernih, membesar, tersusun saling tumpang tindih, dan membran inti tidak beraturan. D. Karsinoma papiler tiroid varian folikular yang berkapsel. Daerah invasi transkapsular (inset) menunjukkan gambaran inti yang khas (Baloch and LiVolsi, 2010) 26 Gambaran mikroskopis lain yang dapat ditemukan adalah psammoma bodies, dan respon desmoplastik di daerah invasif (Al-Brahim and Asa, 2006; Rosai, 2010; LiVolsi, 2011).Psammoma bodymerupakan gambaran papila yang „mati‟, berdiferensiasi dari kalsifikasi distrofi oleh karena proses lamelasi. True psammoma body dibentuk oleh fokus infark di ujung papila yang menyerap kalsium. Teori lain menyebutkan bahwa mekanisme akumulasi kalsium intraseluler oleh sel tumor akan berujung pada lamelasi. Psammoma bodybiasanya terlihat pada inti papila, stroma tumor, atau pada kelenjar getah bening. Didapatkannya psammoma bodypada kelenjar getah bening servikal merupakan bukti dari karsinoma papiler tiroid. Pada tumor jinak tiroid jarang ditemukan psammoma body (kurang dari 1%) (LiVolsi, 2011). Beberapa laporan menemukan adanya variabilitas di antara para ahli patologi dalam menentukan kriteria minimal untuk mendiagnosis karsinoma pepiler tiroid (Chan, 2004; Elsheikh et al., 2008). Beberapa peneliti merekomendasikan beberapa kriteria dasar dan mengusulkan penggunaan kombinasi gambaran histologis mayor dan minor. Kriteria tambahan lainnya mencakup adanya gambaran folikel memanjang atau berbentuk tidak teratur, pewarnaan koloid gelap, dan yang jarang dapat ditemukan pula histiosit berinti banyak dalam lumen folikel (Chan, 2004; Fischer and Asa, 2008). Mitosis merupakan hal yang jarang ditemukan pada karsinoma papiler (LiVolsi, 2011). Karsinoma papiler yang menampilkan arsitektur folikular disebut sebagai karsinoma papiler varian folikular (Gambar 2.5 C). Menurut LiVolsi (2011), 27 varian folikular harus menunjukkan pola folikular secara keseluruhan. Keganasan ini menunjukkan gambaran yang kontroversial. Tipe ini sulit ditentukan, karena awalnya lesi ini telah diklasifikasikan sebagai karsinoma folikular atau adenoma folikular (atau adenoma folikular atipik). Diagnosis varian ini lebih mudah bila ditemukan gambaran inti yang khas serta pola pertumbuhan yang tidak berbatas tegas dan infiltratif, akan tetapi tidak jarang tipe ini berbatas tegas, dan bahkan berkapsel. Ada dua tipe dari varian folikular, antara lain diffuse follicular variant dan encapsulated follicular variant. Pada diffuse follicular variant, kelenjar secara difus digantikan oleh jaringan tumor, dan sering ditemukan metastasis ke kelenjar getah bening serta organ jauh, sehingga prognosisnya lebih buruk. Sementara itu, pada encapsulated follicular variant, jaringan tumor tampak dikelilingi oleh kapsel yang utuh, dengan distribusi umumnya multifocal, sehingga secara morfologi sering dikelirukan dengan adenomatoid nodule atau adenoma folikular (Gambar 2.5 D) (Baloch and LiVolsi, 2010). Pada beberapa kasus kita dapat menemukan kesulitan dalam menegakkan diagnosis suatu lesi folikular ganas tiroid. Sebagai contoh, dapat ditemukan adanya lesi folikular dengan invasi kapsel yang tidak jelas (questionable) atau hanya minimal tidak melintasi seluruh ketebalan kapsel, apabila tidak disertai dengan perubahan karakteristik inti karsinoma papiler, maka disebut sebagai follicular tumor of uncertain malignant potential (Rosai, 2010). Pada kasus dengan perubahan inti yang minimal, invasi kapsel atau pembuluh darah tidak ada atau tidak jelas, maka tumor didiagnosis sebagai well- 28 differentiated tumor of uncertain malignant potential. Apabila ditemukan invasi kapsel atau pembuluh darah yang jelas, maka digunakan istilah well-differentiated carcinoma, not otherwise specified (Gambar 2.6)(Rosai, 2010). Gambaran inti karsinoma papiler tiroid Jelas Dengan atau tanpa invasi kapsel atau pembuluh darah Karsinoma papiler tiroid Minimal atau fokal Invasi kapsel atau pembuluh darah jelas Invasi kapsel atau pembuluh darah tidak ada atau tidak jelas (questionable) Well-differentiated carcinoma, not otherwise specified Well-differentiated tumor of uncertain malignant potential Gambar 2.6 Nomenklatur tumor folikular ganas tiroid (Rosai, 2010) 2.2.3.2 Patologi molekular karsinoma papiler tiroid Jalur kaskade RAS-BRAF-MAPK merupakan jalur genetik pada karsinoma papiler. Pengaktifan jalur ini bisa melalui salah satu dari dua mekanisme utama. Mekanisme pertama melalui tata ulang gen RET atau neurotrophic tyrosine kinase receptor 1 (NTRK1) yang menyandi reseptor tirosine kinase transmembrane (Chien and Koeffler, 2012).Mekanisme keduamelalui aktivasi point mutation padaV-raf murine sarcoma viral oncogene homolog B1 (BRAF), yang merupakan produk komponen signaling intermediate dari jalur mitogen activated protein 29 kinase (MEK/MAPK), yang selanjutnya mengaktivasi extracellular signal regulated kinase (ERK), sehingga terjadi proliferasi sel (Gambar 2.7). Jalur sinyal ini terutama terjadi pada tumor sporadis (Fuhrer, 2006; Electron, 2007; Chien and Koeffler, 2012). Gambar 2.7 Jalur patogenesis karsinoma papiler tiroid(Chien and Koeffler, 2012) Tata ulang (rearrangement) gen RET/PTC disebutkan sebagai alterasi genetik spesifik pertama pada keganasan ini (Baloch and LiVolsi, 2010; Maitra, 2010; Rosai, 2010; Chien and Koeffler, 2012).Gen RET merupakan protoonkogen yang mengkode reseptor tirosin kinase dari glial cell-derived nervous growth factor dan 30 secara endogen terekspresi pada sel neuroendokrin. Terjadi ekspresi yang salah dari potongan gen RET pada karsinoma papiler melalui fusi promotor pada regio N-terminal dari gen terkait (disebut PTC-1,2 dan seterusnya), dan regio Cterminal fungsional dari gen RET (mengandung tirosin kinase). Hasilnya adalah aktivasi RAS-RAF-MAPK signaling (Santoro et al., 2006; Chien and Koeffler, 2012). Saat ini teridentifikasi lebih dari delapan protein chimera RET/PTC pada karsinoma tiroid, dimana RET/PTC-1 (inv(10)(q11.2;q21) dan RET/PTC-3 (inv(10)(q11.2;q10) terhitung kira-kira 80% dan merupakan fusi gen yang tersering (Chien and Koeffler, 2012). Keduanya melibatkan inversi pada lengan panjang kromosom 10, menghasilkan perpaduan antara RET dengan gen histone proteinnucleosome (histone H4) pada RET/PTC-1 atau RET dengan nuclear receptor coactivator 4 (NCOA4) pada RET/PTC-3 (Santoro et al., 2006; Chien and Koeffler, 2012). Tata ulang gen RET/PTC spesifik untuk karsinoma papiler dan prevalennya ditemukan lebih tinggi (30% sampai 65%) pada keganasan yang disebabkan oleh radiasi (chernobyl-tumor), dan lebih jarang (5% sampai 15%) pada kanker yang sporadis. Penjelasan yang menarik mengenai terjadinya fusi RET/PTC secara spesifik pada sel epitel tiroid disampaikan oleh Nikifora dalam penelitiannya. Dengan menggunakan teknik fluorescent in situ hybridization, mereka mampu menunjukkan bahwa potongan gen RET dan PTC yang berlokasi pada kromosom 10, mendekat pada sekitar 35% sel epitel tiroid normal selama interfase, meskipun kedua gen berjarak mencapai 30 megafase (Chien and Koeffler, 2012). 31 Tata ulang gen lainnya pada karsinoma papiler adalah inversi kromosom 7q menghasilkan fusi antara BRAF dan A-kinase anchor protein 9 (AKAP 9) gene. Fusi protein ini meningkatkan aktivitas kinase. Sepertiga sampai setengah dari kasus karsinoma papiler ditemukan gain-of-function mutation pada gen BRAF (Fuhrer, 2006; Chien and Koeffler, 2012). Data lain menyebutkan 18% sampai 87% dari karsinoma papiler. Gen BRAF berlokasi pada kromosom 7q32, dan terjadi transversi thymine ke adenine yang menyebabkan perubahan valine menjadi glutamate pada kodon 600 (BRAFv600E) (Fuhrer, 2006; Electron, 2007).Mutasi pada BRAFV600E dapat menyebabkan aktivasi RAF kinase, dan secara invitro dapat menyebabkan transformasi sel dengan efikasi yang lebih tinggi daripada wild-type BRAF. Mutasi BRAFV600E dilaporkan sebagai defek molekular yang sering terjadi pada karsinoma papiler yang sporadis (berkisar antara 36% sampai 69%), sementara tata ulang gen AKAP9/BRAF (inv(7)(q2122q34)) terjadi pada radiation-induced karsinoma tiroid (Fuhrer, 2006; Kondo et al., 2006; Electron, 2007; Chien and Koeffler, 2012).Mutasi BRAF berkaitan dengan tumor yang lebih agresif, sehingga memiliki prognosis yang buruk (LiVolsi, 2011). Beberapa penelitian menunjukkan model multistep karsinogenesis neoplasma tiroid. Gambar 2.8 A menunjukkan faktor risiko, seperti paparan radiasi menyebabkan ketidakstabilan genomik melalui mekanisme langsung maupun tidak langsung, melibatkan jalur sinyal MAPK. Aktivasi onkogen MAPK meningkatkan ketidakstabilan genomik lebih lanjut yang mengarah ke perubahan genetik, selanjutnya melibatkan jalur sinyal lain, seperti regulator siklus sel dan 32 berbagai molekul adesi. Interaksi antara ketidakstabilan genomik dan perubahan genetik merangsang perkembangan well differentiated menjadi undifferentiated karsinoma tiroid (Kondo et al., 2006; Viglietto et al., 2011). A B Gambar 2.8 Multistep karsinogenesis pada neoplasma tiroid (Kondo et al., 2006) Berdasarkan pengamatan klinis, histologis, dan molekular, ditemukan tiga jalur berbeda proliferasi neoplastik dari sel folikel tiroid, antara lain hiperfungsi adenoma folikular tiroid (tumor yang hampir selalu jinak, tanpa kecenderungan 33 progresif), karsinoma folikular, dan karsinoma papiler tiroid. Cacat genetik yang menyebabkan aktivasi RET atau BRAF merupakan kejadian awal yang sering dikaitkan dengan paparan radiasi. Ekspresi yang rendah dari inhibitor cyclindependent kinase p27KIP1 dan ekspresi yang tinggi dari cyclin D1 merupakan prediktor yang kuat adanya metastasis kelenjar getah bening pada karsinoma papiler tiroid. Sebagian besar poorly differentiated dan undifferentiated carcinoma berasal dari well differentiated carcinoma tiroid melalui peristiwa genetik tambahan, termasuk β-catenin (yang dikode oleh CTNNB1) dan inaktivasi P53, namun dapat pula terjadi secara de novo (Gambar 2.8 B). Interaksi antara faktor risiko, ketidakstabilan genomik, dan perubahan genetik ke depannya dapat dijadikan fokus studi tentang kanker tiroid (Kondo et al., 2006; Viglietto et al., 2011). Secara ringkas melalui tabel berikut diuraikan berbagai gangguan molekular yang terjadi pada adenoma folikular dan karsinoma papiler pada organ tiroid. Tabel 2.1. Patologi genetik pada tumor folikular tiroid (Rosai, 2010) Adenoma Karsinoma Papiler Karsinoma Papiler Folikular Varian Klasik Varian Folikular RAS (20%-40%) BRAF (30%-70%) RAS (25%-45%) PAX8/PPARγ (5%-20%) RET/PTC (20%-40%) RET/PTC (5%-10%) TSH-R & GNAS 1 RAS (0-10%) BRAF (5%-10%) Chromosomal unstable TRK (0-10%) PAX8/PPARγ (0-30%) Chromosomal unstable Chromosomal unstable 34 2.3 Galectin-3 2.3.1 Struktur Galectin-3 Galectin merupakan family protein yang menampilkan unit N-acetyllactosamine beragam, mengikat β-galactoside pada glikoprotein dan glikolipid permukaaan sel. Struktur kristal dari sebagian besar galectin menunjukkan bahwa protein ini setidaknya terdiri dari satu domain yang mengandung 130 asam amino, dan disebut sebagai carbohydrate-recognition domain (CRD) yang masing-masing bertanggungjawab terhadap carbohydrate-binding properties (Gambar 2.9 A). Secara umum galectin merupakan soluble protein yang mempunyai gambaran khas pada molekul sitoplasma sel. Akan tetapi, lokasinya tidak terbatas pada sitoplasma saja, galectin juga dapat ditemukan pada inti, permukaan sel, dan bahkan pada ruang ekstraseluler. Pada beberapa kasus, regulasinya berkaitan dengan kontrol langsung diferensiasi selular dan diaktivasi dengan bekerja sebagai tombol “on-and-off” yang mengontrol aktivitas transkripsional spesifik. Pada kasus lainnya, galectin mampu meregulasi berbagai mekanisme, antara lain kelangsungan hidup, proliferasi, dan transformasi sel (Laderach et al., 2010). Saat ini teridentifikasi 15 jenis galectin pada berbagai sel dan jaringan (Inohara et al., 2008; Laderach et al., 2010). Berdasarkan strukturnya, galectin dibedakan menjadi tiga kelompok (Chiu et al., 2010), yaitu: 1. “Prototype” subfamily, meliputi galectin-1, -2, -5, -7, -10, -11, -13, -14, dan 15. Subfamily ini hanya mengandung satu CRD, dan mampu membentuk struktur dimer yang berperan pada interaksi nonkovalen. 35 2. “Tandem-repeat” subfamily, mengandung dua CRD, dan terdiri dari galectin4, -6, -8, -9, dan 12. 3. “Chimera-type” subfamily, yaitu galectin-3 yang menunjukkan domain Nterminal yang berdekatan dengan CRDnya. Gambar 2.9 Struktur protein galectin-3. A. Galectin-3 tersusun atas domain N-terminal yang mengandung 100 sampai 150 asam amino dan domain C-terminal yang mengandung 135 asam amino. B. Galectin-3 membentuk struktur pentamer, sehingga mampu berperan pada interaksi antar sel dan sel dengan matriks ekstraselular, receptor clustering, dan transduksi sinyal, serta pembentukan glycoprotein-galectin lattices (Argueso and Panjwani, 2012) Human galectin-3 adalah protein yang dikode oleh gen tunggal, LGALS3, yang berlokasi pada kromosom 14. LGALS3 terdiri dari enam ekson dan lima intron. Ekson IV sampai VI mengkode domain C-terminal yang mengandung CRD, sehingga bertanggungjawab terhadap pengikatan lectin dengan karbohidrat 36 spesifiknya. Ekson III dan 18bp dari ekson II mengkode domain N-terminal yang kaya akan proline, tyrosine, dan residu glisine, serta memungkinkan pembentukan struktur pentamer, sehingga membrane plasma galectin lattice microdomains mampu mengadakan reaksi silang dengan glikoprotein permukaan sel, dan terlibat dalam sinyal selular dan stabilisasi reseptor (Gambar 2.9 B) (Krzeslak, 2004; Argueso and Panjwani, 2012). Galectin-3 mempunyai berat molekul 31-kDa dan merupakan satu-satunya anggota family galectin yang mempunyai struktur pentamer yang unik (Herrmann, 2004; Collet, 2005; Scognamiglio et al., 2006). Pada pembelahan proteolitik dari domain N-terminal, fungsi ekstraselular galectin-3 hilang, mungkin karena ketidakmampuannya membentuk struktur pentamer. Selanjutnya, fosforilasi galectin-3 dapat terjadi pada domain N-terminal pada residu serin-6 dan serin-12. Galectin-3 teridentifikasi pada inti, sitoplasma, dan ruang ekstraselular. Protein ini berperan dalam regulasi apoptosis, motilitas sel, dan perkembangan sel T, serta mempengaruhi progesivitas kanker tiroid (Chiu et al., 2010). 2.3.2 Peran Galectin-3 pada Biologi dan Kanker 2.3.2.1 Regulasi apoptosis Upregulasi galectin-3 dan translokasinya ke dalam inti menunjukkan fungsinya pada pertumbuhan sel normal. Pada karsinoma papiler tiroid, galectin-3 ditemukan secara signifikan mengalami ekspresi yang tinggi pada area inti. Pada inti, galectin-3 berperan sebagai up-regulator aktivitas transkripsional dari thyroid-specific transcription factor-1, dan berkontribusi terhadap tingginya 37 tingkat proliferasi sel tersebut. Lebih lanjut ditemukan pula penurunan ekspresi galectin-3 melalui siRNA silencing dapat menginduksi apoptosis pada keganasan papiler tiroid (Fischer and Asa, 2008; Chiu et al., 2010). Sebuah domain fungsional pada area COOH-terminal menunjukkan bahwa galectin-3 terbukti homolog dengan domain BH1 bcl-2 gene family yang mengandung apoptosis-inducing NWGR (Asp-Trp-Gly-Arg) amino acid motif. Kemampuan antiapoptosis ini bertanggungjawab terhadap inhibisi pelepasan cytochrome-c dari mitokondria. Penemuan terbaru menyatakan bahwa galectin-3 juga berperan pada jalur apoptosis p53/HIPK2. Gen p53 merupakan faktor transkripsi spesifik yang mampu menekan ekspresi galectin-3, dan p53-induced apoptosis tergantung pada efek regulasi dari galectin-3. Penelitian menunjukkan adanya korelasi positif antara mutasi p53 dengan ekspresi galectin-3 pada karsinoma tiroid. Ekspresi yang sesuai antara p53 dengan galectin-3 ditemukan pada 52% poorly differentiated dan 71% undifferentiated karsinoma tiroid, dan ekspresi protein galectin-3 ditemukan relatif lebih tinggi pada kanker tiroid yang mengekspresikan mutasi p53. Lebih lanjut dinyatakan pula bahwa protein lain yang terlibat dalam regulasi apoptosis, seperti CD95 dan nuclin juga berinteraksi dengan sitoplasma galectin-3 (Chiu et al., 2010; Laderach et al., 2010). 38 2.3.2.2 Transformasi selular dan metastasis Ekspresi tinggi protein galectin-3 yang disebabkan oleh transfeksi stabil sel-sel folikel tiroid dapat mengakibatkan perubahan fenotip sel, termasuk pertumbuhan yang tidak tergantung usia, peningkatan proliferasi sel, dan hilangnya kontak inhibisi bila dibandingkan dengan sel yang tidak mengalami transfeksi (Chiu et al., 2010). Enzim golgi β1,6 N-acetylglucosaminyltransferase V (Mgat-V) mengalami peningkatan pada berbagai tipe kanker. Ekspresinya merangsang produksi poly Nacetyllactosamine antennae pada N-glycans, yang merupakan ligan dengan afinitas tinggi terhadap galectin-3. Peningkatan Mgat-V produced N-glycans berkaitan dengan transformasi keganasan dan juga berkorelasi dengan progresivitas penyakit (Chiu et al., 2010). Berbagai glikoprotein, seperti epidermal growth factor receptor (EGFR) dan transforming growth factor receptor β (TGFR β) mempunyai beberapa N-glycan binding site. Jumlah rantai N-glycan berbeda pada setiap glikoprotein, menentukan afinitas reseptor terhadap lattice galectin, sehingga berpengaruh terhadap proliferasi dan diferensiasi selular. Galectin lattice terbukti bersaing dengan caveolin-1 (cav-1) pada mikrodomain permukaan sel dengan menghambat difusi EGFR dan membatasi down-regulasinya melalui endositosis, sehingga meningkatkan kemampuan sinyal EGFR dan mendorong kelangsungan hidup serta pertumbuhan sel. Selain itu, polimerisasi fibronektin dan migrasi sel tumor diatur oleh derajat pengikatan galectin-3. Ekspresi lattice galectin bersamaan dengan adanya cav-1 yang terfosforilasi memainkan peranan dalam migrasi sel 39 tumor dengan menstabilkan focal adhesion kinase dan menyebabkan peningkatan focal adhesion turnover. Ekspresi Mgat-V dan galectin-3 serta perekrutan reseptor galectin lattice domain menstimulasi local receptor-mediated signaling event yang mengakibatkan proliferasi dan migrasi sel tumor (Chiu et al., 2010). Penurunan ekspresi galectin-3 dapat menekan sinyal selular, menginduksi apoptosis, dan penekanan transformasi selular pada berbagai tipe kanker. Dengan demikian dapat dinyatakan bahwa galectin-3 merupakan regulator proliferasi sel normal, dan ekspresi yang tinggi ditemukan pada transformasi keganasan dan metastasis (Krzeslak, 2004; Chiu et al., 2010). 2.3.2.3 Distribusi selular galectin-3 Galectin-3 mempunyai sifat biologis yang kompleks, dan kontribusi relatifnya pada fraksi sitoplasma dan inti pada tumorigenesis dan metastasis belum sepenuhnya diketahui. Galectin-3 dapat diidentifikasi dalam inti dan diangkut ke bagian perinuklear. Pada sel fibroblast 3T3 tikus, galectin-3 yang terfosforilasi ditemukan pada inti dan sitoplasma, sedangkan bentuk yang tidak terfosforilasi secara khusus ditemukan pada inti. Proliferasi sel berkaitan dengan peningkatan fraksi yang terfosforilasi (Chiu et al., 2010). 2.3.3 Metodologi Pemeriksaan Galectin-3 Berbagai metodologi digunakan untuk mengevaluasi gambaran ekspresi imunohistokimia galectin-3 pada spesimen jaringan tiroid, yang meliputi variasi protokol penggunaan biotin dan antigen retrieval, karakteristik antibodi, antibodi dilution, lokasi marker, dan kriteria ekspresi positif (Chiu et al., 2010). 40 2.3.3.1 Biotin endogen Tirosit mempunyai kemampuan yang unik pada studi imunohistokimia. Afinitas yang tinggi ikatan avidin (dan juga streptavidin) terhadap biotin merupakan hal penting pada pemeriksaan imunohistokimia menggunakan kompleks avidin-biotin peroksidase (atau kompleks sistem streptavidin-biotin-peroksidase). Biotinlabeled marker antigen diidentifikasi menggunakan avidin-containing probe. Akan tetapi, tirosit mempunyai kadar biotin endogen tinggi yang dapat menyebabkan hasil positif palsu terhadap ekspresi marker antigen. Karena itu, penelitian yang menggunakan avidin-based detection system tanpa blokade terhadap biotin harus diinterpretasikan dengan hati-hati. Selain itu, reaktivitas biotin endogen dari suatu spesimen yang telah difiksasi dengan formalin dan dilakukan paraffin embeding dapat ditingkatkan dengan prosedur antigen retrieval yang diinduksi oleh panas, terutama pada tekanan yang lebih rendah dari pemanasan microwave. Suatu studi menemukan pewarnaan biotin yang positif pada delapan dari 12 tumor tiroid setelah penggunaan antigen retrieval, bahkan tanpa aplikasi marker antibodi. Penggunaan biotin-free detection systems atau avidin-biotin treatment blockade, sangat penting untuk deteksi akurat marker galectin-3 pada spesimen jaringan tiroid (Chiu et al., 2010). 2.3.3.2 Heterogenitas antibodi galectin-3 Suatu penelitian juga dapat dipengaruhi oleh variasi reaktivitas dari berbagai tipe dan konsentrasi antibodi galectin-3. Setiap antibodi mungkin mengenali isotype atau komponen yang berbeda dari galectin-3. Namun, belum diketahui sepenuhnya adanya suatu antibodi tunggal yang memiliki sensitivitas atau 41 spesifisitas superior untuk mendeteksi kanker tiroid. Karakteristik kinerja masingmasing antibodi juga dipengaruhi oleh metode lainnya, diantaranya tingkat pengenceran antibodi, proses pengambilan antigen, dan penanganan biotin (Chiu et al., 2010). 2.3.3.3 Kriteria skoring Interpretasi positif ekspresi galectin-3 perlu mendapatkan perhatian khusus, karena distribusi selular pulasan galectin-3 kompleks dan bervariasi. Beberapa penelitian menyatakan perlunya interpretasi pulasan pada inti, selain evaluasi reaktivitas sitoplasma dalam menentukan kriteria positif. Sebagaimana telah dijelaskan sebelumnya, peran galectin-3 di sitoplasma terlibat lebih menonjol pada tumorigenesis dan metastasis. Telah dilakukan berbagai penelitian menggunakan spesimen jaringan tiroid yang telah di-paraffin embeding, untuk mengevaluasi ekspresi galectin-3 yang terpulas pada inti dibandingkan dengan sitoplasma dikaitkan dengan kemampuannya dalam mendiagnosis kanker tiroid. Beberapa penelitian melaporkan pada karsinoma papiler tiroid, ekspresi galectin-3 yang terpulas pada sitoplasma lebih tinggi dibandingkan yang terpulas pada inti. Disebutkan pula bahwa galectin-3 tidak terpulas, baik di sitoplasma maupun inti pada jaringan tiroid normal (Fischer and Asa, 2008). 2.3.4 Ekspresi Protein Galectin-3 pada Kanker Tiroid 2.3.4.1 Ekspresi galectin-3 pada spesimen jaringan tiroid Sebagian besar penelitian melaporkan galectin-3 terpulas positif pada 90% sampai 100% kasus karsinoma papiler tiroid (Gambar 2.10 A). Disebutkan pula bahwa 42 ekspresi galectin-3 cenderung lebih rendah pada karsinoma papiler varian folikular (rata-rata 75% kasus), bila dibandingkan varian klasik (berkisar antara 82% sampai 100%, dengan rata-rata 91%). Cvejic, et al (2005) dalam studinya juga melaporkan bahwa ekspresi galectin-3 teridentifikasi pada 81% kasus papillary microcarcinoma. Hal ini menunjukkan bahwa perubahan ekspresi galectin-3 juga ditemukan pada kejadian awal perkembangan karsinoma papiler, sehingga mungkin terlibat dalam karsinogenesis. Galectin-3 juga dilaporkan terdeteksi pada 60% sampai 85% kasus follicular-patterned lesions of uncertain malignant potential (Hermann et al., 2004; Oestreicher et al., 2004; Fischer and Asa, 2008; Inohara et al., 2008). A B C Gambar 2.10 Ekspresi pulasan IHK galectin-3. A. Terpulas difus dan kuat pada karsinoma papiler. B. Terpulas fokal pada adenoma folikular. C. Tidak terpulas pada hiperplasia nodular (Saleh et al., 2010) Sebaliknya, imunoreaktivitas galectin-3 hanya ditemukan pada sejumlah kecil kasus tumor tiroid jinak dan tidak terpulas pada spesimen jaringan tiroid normal. Sebagian besar studi melaporkan galectin-3 terpulas pada 0 hingga 30% kasus adenoma, dengan pengecualian sebuah studi yang dilaporkan Mehrotra, et al (2004). Tingginya tingkat ekspresi galectin-3 pada kasus adenoma folikular yang 43 dilaporkan pada penelitian tersebut (sebesar 72%) mungkin disebabkan oleh penggunaan sistem deteksi avidin-biotin peroxidase complex langsung tanpa blokade biotin (Fischer and Asa, 2008; Chiu et al., 2010). Tabel 2.2. Berbagai penelitian mengenai deteksi imunohistokimia galectin-3 pada spesimen tiroid (Fischer and Asa, 2008) Fernan dez dkk Hermann dkk Kovacs dkk Weber dkk Prasad dkk Cvejic dkk Bartolazzi dkk Saggio rato dkk 0 (0) Oestrei cherKedem dkk ….. N 0 ….. ….. …. ….. 0/75 (0) …… TLK …….. …… 7/7 (100) ….. ….. ….. ….. 2/4 (50) …… HN 0 (0) 0 (0) …… ….. 16/29 (55) ….. ….. 0/50 (0) ….. AF 0 (0) 3/8 (37) 4/19 (21) 4/13 (31) 2/21 (9) 7/15 (47) …. 5/132 (4) 3/50 (6) KP 18/18 (100) 22/34 (64) 19/20 (95) 22/24 (92) 63/67 (94) 15/18 (83) 169/2 02(84 ) 195/20 1 (97) 39/39 (100) KF 4/8 (50) 2/3 (67) 7/10 (70) 4/9 (44) 4/6 (67) 7/11 (64) …… 54/57 (95) 16/19 (84) PDC 2/3 (67) …… ….. ….. ……. …… ….. 13/20 (90) ……. KA 5/5 (100) ….. ….. …… 4/4 (100) ….. ….. 18/20 (90) ……. (0) Keterangan : Nilai adalah nomor/total (persen). N : Normal, TLK : tiroiditis limfositik kronis, HN : hiperplasia nodular, AF : adenoma folikular, KP : karsinoma papiler,KF : karsinoma folikular,PDC : poorly differentiated carcinoma, KA:karsinoma anaplastik. Tanda titik-titik menunjukkan tidak dilakukan penilaian variabel penelitian pada studi tersebut. 44 Saleh, et al (2010), dalam penelitiannya melaporkan bahwa proporsi pulasan positif galectin-3 pada keseluruhan lesi jinak, baik lesi nonneoplastik maupun neoplastik adalah 27,5%. Penelitian yang sama menyebutkan galectin-3 terpulas positif pada 41,3% kasus adenoma folikular (Gambar 2.10 B) dan 15,3% kasus hiperplasia nodular (Gambar 2.10 C). Sedangkan, proporsi ekspresi positif galectin-3 pada karsinoma papiler mencapai 90% (Gambar 2.10 A). Sensitivitas, spesifisitas, nilai prediktif positif, dan nilai prediktif negatif galectin-3 dalam membedakan lesi tiroid jinak dan ganas, masing-masing adalah 85,2%, 72,4%, 63,0%, dan 89,9% (Saleh et al., 2010). Beberapa literatur menyebutkan galectin-3 terekspresi pada 0 sampai 100% kasus tiroiditis. Secara khusus, kaitan antara tiroiditis hashimoto dengan karsinoma papiler tiroid diteliti pada studi berikutnya. Prasad, et al (2004) dalam penelitiannya menyebutkan adanya perubahan inti yang khas untuk karsinoma papiler juga dilaporkan pada tiroiditis hashimoto. Hasil penelitian tersebut menyebutkan bahwa galectin-3 terpulas positif pada 87% kasus tiroiditis hashimoto, termasuk dua kasus yang selanjutnya direview dan direklasifikasi sebagai karsinoma papiler tiroid. Dengan demikian, ekspresi galectin-3 memungkinkan untuk identifikasi awal perubahan ganas pada kasus tiroiditis hashimoto (Prasad et al., 2004; Chiu et al., 2010). Galectin-3 juga disebutkan terekspresi positif pada kanker tiroid tipe lainnya. Pada karsinoma folikular, baik dengan invasi minimal maupun luas, galectin-3 terekspresi pada 44% sampai 95% kasus (rata-rata 65%) (Ito et al., 2005). Protein ini juga terekspresi pada sebagian besar kasus karsinoma tiroid poorly 45 differentiated dan undifferentiated (karsinoma anaplastik). Pada kasus karsinoma anaplastik, galectin-3 terekspresi pada sebagian besar kasus (mencapai 100%). Karsinoma medullary yang sporadis menunjukkan ekspresi galectin-3 berkisar antara 45% sampai 80%. Galectin-3 terekspresi rendah pada hiperplasia nodular dan sel epitel folikel tiroid normal (Fischer and Asa, 2008; Chiu et al., 2010). 2.3.4.2 Interpretasi pulasan galectin-3 Ekspresi galectin-3 dipertimbangkan positif ketika warna coklat terpulas pada sitoplasma dan inti. Dua parameter yang dievaluasi adalah persentase sel yang tercat positif dengan galectin-3 dan reaksi intensitasnya. Persentase sel-sel yang tercat positif digrading sebagai berikut: grade (0): negatif, tidak ada sel yang tercat; grade (1): sel yang positif >0-<5%; grade (2): sel yang positif 5%-25%; grade (3): sel yang positif >25%-75%; grade (4): sel yang positif >75%. Reaksi intensitasnya diskor sebagai berikut: (0): negatif; (1): lemah; (2): sedang; (3): kuat (deMatos et al., 2005). 2.3.4.3 Korelasi klinikopatologi ekspresi galectin-3 Beberapa studi telah meneliti korelasi klinikopatologi antara ekspresi galectin-3 dengan kanker tiroid. Diantara kasus-kasus tersebut, korelasi ditentukan oleh kuat atau lemahnya intensitas pulasan atau proporsi sel yang terpulas positif protein ini. Yang menarik dikemukakan oleh Ito, et al (2005), yang menyatakan bahwa ekspresi galectin-3 secara signifikan meningkat sesuai dengan tingkat invasi pembuluh darah atau invasi kapsel pada tumor folikular. Beberapa penelitian juga melaporkan adanya korelasi yang kuat antara ekspresi galectin-3 dengan metastasis kelenjar getah bening pada karsinoma papiler, karsinoma folikular, 46 karsinoma anaplastik, dan karsinoma medularry. Dengan demikian, kedepannya perlu dilakukan penelitian lebih lanjut mengenai korelasi ekspresi galectin-3 dengan indikator prognostik, seperti invasi kapsel, ukuran tumor, status kelenjar getah bening, atau stadium penyakit (Cvejic et el., 2005; Chiu et al., 2010). 47