Respon Berbagai Jenis Anggrek (orchidaceae) terhadap Infeksi
advertisement

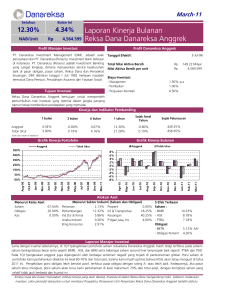
RES SPON BE ERBAGA AI JENIS ANGGRE A EK (Orch hidaceae) TERH HADAP IN NFEKSI Cymbidium C m Mosaicc Virus (C CyMV) DA AN Odoontoglossu um Ringsp spot Virus (ORSV) PUT TRI SYAH HIERAH H DEPA ARTEME EN PROT TEKSI TA ANAMAN N FAKU ULTAS PE ERTANIA AN IN NSTITUT T PERTA ANIAN BO OGOR 2010 0 ABSTRAK PUTRI SYAHIERAH. Respon Berbagai Jenis Anggrek (Orchidaceae) terhadap Infeksi Cymbidium mosaic virus (CyMV) dan Odontoglossum ringspot virus (ORSV). Dibimbing oleh GEDE SUASTIKA. Penelitian ini dilakukan untuk mempelajari respon anggrek (Orchidaceae) terhadap infeksi tunggal Cymbidium mosaic virus (CyMV) dan Odontoglossum ringspot virus (ORSV). Inokulasi mekanik dilakukan untuk menularkan CyMV dan ORSV ke tanaman anggrek. Deteksi virus pada jaringan tanaman anggrek dilakukan melalui RT-PCR dan DAS-ELISA. Pada umumnya gejala ORSV muncul lebih cepat dibandingkan dengan gejala CyMV setelah inokulasi. Hasil penelitian menunjukkan bahwa tanaman anggrek Coelogyne pandurata merupakan tanaman anggrek yang mendekati imun terhadap infeksi CyMV akan tetapi rentan terhadap ORSV. Oncidium Golden Shower, dan Cattleya Blc. Lucky Man x Blc. Lijinan Pearl toleran terhadap infeksi CyMV akan tetapi rentan terhadap ORSV; Dendrobium Woxin dan Grammatophyllum scriptum agak resisten terhadap infeksi CyMV dan ORSV; Phalaenopsis violacea dan D. stratiotes merupakan tanaman anggrek yang rentan terhadap CyMV akan tetapi toleran terhadap ORSV; D. Burana Jade x D. nindii dan D. Burana Mainil Wrap x D. Strip merupakan tanaman anggrek yang agak resisten terhadap ORSV akan tetapi rentan terhadap CyMV; dan D. nindii, D. liniae, D. lasiantera, D. schulleri, D. discolor, D. Kyosimori P. amabilis merupakan jenis anggrek yang rentan terhadap infeksi CyMV dan ORSV. Sebagian besar tanaman anggrek yang diinokulasi virus campuran menimbulkan interaksi yang bersifat sinergistik pada kedua virus, kecuali pada anggrek G. scriptum yang menunjukkan interaksi yang bersifat interferensi. Respon Berbagai Jenis Anggrek (Orchidaceae) terhadap Infeksi Cymbidium Mosaic Virus (CyMV) dan Odontoglossum Ringspot Virus (ORSV) PUTRI SYAHIERAH Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR 2010 Judul : Respon Berbagai Jenis Anggrek (Orchidaceae) terhadap Infeksi Cymbidium Mosaic Virus (CyMV) dan Odontoglossum Ringspot Virus (ORSV). Nama Mahasiswa : Putri Syahierah NIM : A34052634 Menyetujui, Pembimbing Dr. Ir. Gede Suastika, M.Sc. NIP: 19620607 1987031 003 Mengetahui, Ketua Departemen Proteksi Tanaman Dr. Ir. Dadang, M.Sc. NIP: 19640204 1990021 002 Tanggal lulus : RIWAYAT HIDUP Penulis dilahirkan di Bogor, Jawa Barat. Lahir pada tanggal 24 Maret 1987. Penulis merupakan anak dari keluarga Bapak Ervizal A.M Zuhud dan Ibu Nur luk lu in. Penulis menyelesaikan Pendidikan di SD Insan Kamil pada tahun 1999, SLTP Al-Azhar Plus Bogor pada tahun 2002, dan SMU Negeri 5 Bogor pada tahun 2005. Pada tahun 2005 penulis diterima di IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Pada tahun 2006, penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian. Selama menempuh pendidikan di IPB, penulis aktif dalam kegiatan kemahasiswaan, diantaranya sebagai pengurus Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) Biro Komunikasi dan Informasi pada masa periode 20072008, Panitia Musyawarah Nasional Himpunan Proteksi Tanaman Indonesia pada tahun 2008, Panitia Seminar Nasional Perlindungan Tanaman tahun 2009, panitia Olimpiade Mahasiswa IPB 2008. Penulis pernah menjadi asisten mata kuliah Dasar-dasar Perlindungan Tanaman tahun 2008 dan Ilmu Hama Tumbuhan Dasar tahun 2009. PRAKATA Puji syukur kehadirat Allah SWT. atas rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Respon Berbagai Jenis Anggrek (Orchidaceae) terhadap Infeksi Cymbidium Mosaic Virus (CyMV) dan Odontoglossum Ringspot Virus (ORSV)” Penelitian ini dilaksanakan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Juli 2009 sampai bulan Januari 2010 Penulis mengucapkan terima kasih yang sebesar-besarnya kepada: 1. Dr. Ir. Gede Suastika, M.Sc. selaku dosen pembimbing yang telah membimbing, memberikan ilmu dan perhatian kepada penulis selama penelitian dan proses penulisan skripsi ini. 2. Dr. Ir. Sugeng Santoso M.Agr. selaku dosen penguji tamu yang telah memberikan masukan dan saran. 3. Seluruh dosen dan staf pegawai di lingkungan Departemen Proteksi Tanaman atas ilmu dan layanan terbaik yang telah diberikan kepada penulis. 4. Kedua orang tua saya bapak Ervizal AM Zuhud dan Ibu Nur luk lu in, serta seluruh keluarga kakak, adik-adik yang senantiasa memberikan dukungan dan doanya. 5. Bapak Edi, selaku teknisi Laboratorium Virologi Tumbuhan atas bantuan dan layanan yang telah diberikan, Bapak Irwan Lakani, SP. atas segala bantuan, motivasi dan dukungannya selama penelitian. Rakan di Laboratorium Virologi Tumbuhan Faperta IPB; Mba Tuti, Ibu Ifa, Ibu Rita, Ibu Rika, Mba Cici, Mba Devi, Mba Dona, Mba Pipit, Lulu, Sri yang telah memberi dukungan dan motivasinya. 6. Nia, Mpit, Eri, Pipit, Ratih dan rekan-rekan Departemen Proteksi Tanaman seperjuangan lainnya atas segala saran, kritik, kebersamaan, dan suka cita selama penulis menempuh studi di IPB. Semoga kebaikan yang telah diberikan memperoleh balasan yang lebih dari Allah SWT. Penulis berharap semoga hasil penelitian ini dapat memberikan manfaat bagi dunia pendidikan dan ilmu pengetahuan. Bogor, Maret 2010 Putri Syahierah DAFTAR ISI Halaman DAFTAR TABEL ........................................................................................ viii DAFTAR GAMBAR ................................................................................... ix PENDAHULUAN ..................................................................................... 1 Latar Belakang .................................................................................. 1 Tujuan Penelitian ............................................................................... 3 Manfaat Penelitian .............................................................................. 3 TINJAUAN PUSTAKA ............................................................................ 4 Tanaman Anggrek ............................................................................. 4 Karakteristik Tanaman Anggrek ............................................... 4 Syarat Tumbuh Anggrek ........................................................... 6 Virus Anggrek ................................................................................... 7 CyMV ........................................................................................ 8 ORSV ........................................................................................ 9 Penularan Virus Secara Mekanik ...................................................... 9 Deteksi Virus ..................................................................................... 10 Serologi ..................................................................................... 10 Molekuler .................................................................................. 11 Respon Tanaman terhadap Patogen ................................................... 11 Interaksi Virus pada Tanaman yang Terinfeksi ................................. 12 BAHAN DAN METODE .......................................................................... 14 Tempat dan Waktu .......................................................................... 14 Isolasi Virus ...................................................................................... 14 Persiapan Tanaman Anggrek ........................................................... 15 Persiapan Inokulum........................................................................... 16 Inokulasi Virus pada Tanaman Anggrek ......................................... 16 Pemeliharaan dan Pengamatan Tanaman ......................................... 16 Deteksi Virus pada Jaringan Tanaman Anggrek ............................... 17 Deteksi melalui DAS-ELISA .................................................... 17 Deteksi melalui RT-PCR........................................................... 18 Penentuan Ketahanan Tanaman ........................................................ 19 HASIL DAN PEMBAHASAN .................................................................. 20 Isolat CyMV dan ORSV ..................................................................... 20 Respon Tananan Anggrek Terhadap Infeksi Tunggal CyMV dan ORSV.................................................................................................. 21 Respon Tanaman Anggrek Terhadap Infeksi Ganda CyMV dan ORSV ................................................................................................. 30 Deteksi Virus pada Jaringan Tanaman Anggrek ................................ 34 KESIMPULAN ........................................................................................... 36 DAFTAR PUSTAKA .................................................................................. 37 viii DAFTAR TABEL Halaman 1. Pengelompokan respon tanaman anggrek terhadap infeksi tunggal CyMV atau ORSV .................................................................................. 19 2. Respon berbagai jenis tanaman anggrek terhadap inokulasi virus tunggal CyMV atau ORSV...................................................................... 22 3. Tingkat ketahanan berbagai jenis tanaman anggrek terhadap infeksi CyMV ...................................................................................................... 28 4. Tingkat ketahanan berbagai jenis tanaman anggrek terhadap infeksi ORSV ................................................................................................... 29 5. Respon berbagai jenis tanaman anggrek terhadap inokulasi virus campuran (CyMV dan ORSV) ............................................................... 32 ix DAFTAR GAMBAR Halaman 1. Gejala penyakit CyMV dan ORSV pada tanaman Datura stratomonium dan Nicotian benthamiana ...................................................................... 20 2. Gejala infeksi CyMV pada Nicotiana benthamiana .............................. 21 3. Gejala infeksi CyMV pada berbagai jenis tanaman anggrek .................. 24 4. Gejala infeksi CyMV pada berbagai jenis tanaman anggrek .................. 25 5. Gejala infeksi ORSV pada berbagai jenis tanaman anggrek ................... 26 6. Gejala infeksi virus campuran (CyMV dan ORSV) pada berbagai jenis tanaman anggrek ............................................................................. 30 7. Gejala penyakit virus campuran (CyMV dan ORSV) pada berbagai jenis tanaman anggrek ............................................................................. 31 8. Hasil amplifikasi DNA isolat CyMV dan ORSV dengan RT-PCR ........ 35 PENDAHULUAN Latar Belakang Anggrek (Orchidaceae) merupakan tanaman hias yang memiliki nilai estetika tinggi. Bentuk dan warna bunga serta karakteristik lainnya yang unik menjadi daya tarik tersendiri. Permintaan anggrek terus meningkat dimanapun di dunia untuk berbagai keperluan seperti upacara keagamaan, hiasan dan dekorasi ruangan, ucapan selamat serta untuk ungkapan suka cita. Selain sebagai tanaman hias tanaman anggrek memiliki manfaat sebagai campuran ramuan obat-obatan, bahan minyak wangi/minyak rambut. Hongkong, Singapura dan Amerika Serikat merupakan negara dengan permintaan anggrek asal Indonesia yang cukup banyak, karena bunga anggrek Indonesia memiliki keunikan warna dan bentuk yang berbeda dengan anggrek manapun di dunia (BPTP 2005). Akan tetapi persyaratan bebas dari Organisme Pengganggu Tanaman (OPT) yang menjadi standar mutu dalam perdagangan internasional menjadi tantangan tersendiri bagi penangkar anggrek Indonesia. Produktivitas anggrek di Indonesia, berdasarkan data Balai Pengkajian Teknologi Pertanian dan Badan Pusat Statistik tahun 2004-2008, rata-rata 5,4 tangkai per tanaman. Angka ini masih lebih rendah dibandingkan dengan yang dicapai oleh Thailand yang sudah mencapai 10-12 tangkai per tanaman. Oleh karenanya, sampai saat ini permintaan anggrek dalam negeri masih banyak dipenuhi melalui impor terutama dari Thailand. Produktivitas anggrek Indonesia masih sangat mungkin ditingkatkan bila faktor produksi dapat diperbaiki. Salah satu faktor yang perlu mendapat perhatian adalah serangan virus yang saat ini sudah sangat mengganggu budidaya anggrek (Khalimi 2008). Dua dari 25 spesies virus yang dapat menyerang tanaman anggrek, yaitu Cymbidium mosaic virus (CyMV) dan Odontoglossum ringspot virus (ORSV), dilaporkan paling banyak merugikan secara ekonomi pada pertanaman anggrek di dunia (Lawson & Branningam 1986; Hadley et al. 1987; Zettler et al. 1990; Matthews R 1992; Agrios 2005). Inouye (1996) melaporkan bahwa 8 kultivar anggrek di Indonesia terinfeksi CyMV yaitu anggrek Aranthera, Calanthe, Cattleya, Cymbidium, Grammatophyllum, Phalaenopsis, Oncidium, dan Vanda. 2 Selain itu ORSV juga terdeteksi pada 5 kultivar yaitu anggrek Bulbophylum, Calanthe, Cattleya, Oncidium dan Phalaenopsis. Begitu juga Khalimi (2008) melaporkan bahwa beberapa kultivar anggrek di Gunung Sindur (Parung) dan Kebun Raya Bogor terinfeksi oleh CyMV dan ORSV. Hasil survei di lapang dilakukan oleh Inouye (1996) membuktikan bahwa CyMV dan ORSV memiliki daerah penyebaran yang cukup luas di Jawa, Ujung Pandang dan Bali. Kedua virus tersebut ditemukan pada setiap pertanaman anggrek yang diamati walaupun proporsi kejadian penyakit berbeda untuk setiap tempat. Adanya infeksi ganda oleh CyMV dan ORSV juga ditemukan dalam pengamatan. Selanjutnya dilaporkan bahwa infeksi CyMV atau ORSV secara tunggal maupun bersamasama pada tanaman anggrek dapat mengurangi vigor tanaman dan pertumbuhan, serta mengurangi kualitas bunga (Hu et al. 1993). Tanaman anggrek yang terinfeksi CyMV akan menunjukkan gejala klorotik hingga nekrotik membentuk cekungan pada bagian daun dan menyebabkan gejala nekrosis pada bunga. Sedangkan ORSV dapat menyebabkan gejala mosaik dengan pola garis, berbentuk cincin, nekrotik berbentuk cincin/ringspot pada daun, dan bunga yang terinfeksi mengalami breaking dan distorsi (penyimpangan) (Khentry et al. 2005). CyMV dan ORSV di lapangan tidak menular melalui vektor alami oleh serangga dan melalui biji, tetapi menyebar melalui kontaminasi peralatan potong dan pot yang digunakan selama perawatan dan pada saat panen bunga. Selain itu CyMV dan ORSV dapat ditularkan melalui inokulasi mekanis dan melalui perbanyakan vegetatif tanaman (Lowson 1995; Agrios 2005). Suatu virus dapat menimbulkan gejala yang berlainan pada tanaman yang berbeda, sementara virus yang berbeda dapat menyebabkan gejala yang hampir sama pada tanaman inang yang sama (Badwen 1964; Withner 1959). Gejala yang disebabkan oleh infeksi CyMV dan ORSV pada tanaman anggrek sangat bervariasi tergantung pada strain virus, kultivar, dan kondisi lingkungan (Navalinskiene et al. 2005). Pengetahuan ekologi virus yang merupakan kajian interaksi antara tanaman inang dengan virus dan pengaruh lingkungan dalam interaksi tersebut sangat penting. Hasil interaksi tersebut adalah gejala penyakit virus pada populasi tanaman. Gejala penyakit virus di lapangan pada tanaman anggrek merupakan 3 data pertama yang diperlukan untuk identifikasi virus. Informasi ekologi virus berupa gejala penyakit merupakan aspek yang sangat penting untuk menentukan tindakan pengelolaan dan pengendalian penyakit terutama untuk para petani dan petugas yang berkerja di lapangan. Sejalan dengan pengetahuan tentang ekologi virus, pengetahuan mengenai respon berbagai jenis tanaman anggrek juga dapat menjadi dasar dalam pemilihan jenis anggrek yang akan dikembangkan di daerahdaerah endemis CyMV atau ORSV sehingga penyakit yang mungkin timbul dapat dihindari. Tujuan Penelitian Penelitian ini bertujuan untuk menganalisa respon beberapa jenis tanaman anggrek terhadap infeksi CyMV dan ORSV secara tunggal maupun ganda. Manfaat Penelitian Penelitian ini diharapkan memberikan informasi mengenai respon berbagi jenis tanaman anggrek terhadap infeksi virus CyMV dan ORSV dan interaksi keduanya. Jenis anggrek yang resisten atau toleran dapat langsung dibudidayakan pada daerah endemis CyMV atau ORSV atau digunakan sebagai sumber gen ketahanan untuk merakit varietas anggrek yang diinginkan. TINJAUAN PUSTAKA Tanaman Anggrek Karakteristik Tanaman Anggrek Anggrek (Orchidaceae) merupakan satu grup terbesar diantara tumbuhan berbunga. Diperkirakan di seluruh dunia terdapat 15.000-20.000 spesies anggrek dengan 900 genus (marga yang dihuni rimba belantara dan tersebar di 750 negara). Kurang lebih 5.000 spesies diantaranya tersebar di Indonesia. Secara garis besar 5 subfamili, 16 tribe (suku), dan 28 subtribe. Klasifikasi tanaman anggrek didasarkan pada keiistimewaan bunga khususnya pada bagian alat reproduksi (Sutarni 2002). Berdasarkan pola pertumbuhanya, tanaman anggrek dibedakan menjadi dua, yaitu tipe simpodial dan tipe monopodial. Anggrek tipe simpodial adalah anggrek yang tidak memiliki batang utama, bunga keluar dari ujung batang dan akan berbunga kembali pada pertumbuhan anakan atau tunas baru. Contoh anggrek tipe simpodial antara lain Dendrobium, Cattleya, Oncidium, dan Cymbidium. Dendrobium mempunyai kekhasan tersendiri, yaitu dapat mengeluarkan tangkai bunga baru di sisi batangnya. Adapun anggrek tipe monopodial adalah anggrek yang dicirikan oleh adanya titik tumbuh di ujung batang, pertumbuhanya lurus ke atas pada satu batang, bunga keluar dari sisi batang diantara dua ketiak daun. Contoh anggrek tipe monopodial antara lain Vanda, Arachnis, Rananthera, Phalaenopsis dan Aranthera. Bentuk daun anggrek ada beberapa macam yaitu agak bulat, lonjong sampai lanset. Tebal daun beragam dari tipis sampai berdaging, rata dan kaku. Daun anggrek tidak bertangkai, sepenuhnya duduk pada batang. Tepi daun anggrek tidak bergerigi (rata). Ujung daun berbelah, daun memanjang, tulang daun sejajar dengan tepi daun hingga ke ujung daun. Bentuk batang anggrek beraneka ragam, ada yang ramping, gemuk berdaging seluruhnya, atau menebal di bagian tertentu dengan atau tanpa umbi semu (pseudobulb). Pseudobulb yang sudah agak tua akan tampak berkerut. Pada umumnya anggrek tipe simpodial (Dendrobium, Cattleya, Oncidium, dan 5 Cymbidium) mempunyai batang berumbi semu (pseudobulb) dengan pertumbuhan ujung batang terbatas. Pertumbuhan batang akan terhenti bila pertumbuhan ke atas telah mencapai maksimal. Pertumbuhan baru dilanjutkan oleh tunas anakan yang tumbuh di samping. Pada anggrek simpodial terdapat suatu penghubung dari tunas satu ke tunas lainya yang disebut rhizome atau batang di bawah media. Pertumbuhan tunas baru akan keluar dari rhizome tersebut. Anggrek tipe moopodial (Vanda, Arachnis, Rananthera, Phalaenopsis dan Aranthera) mempunyai batang utama dengan pertumbuhan tidak terbatas. Tangkai bunga akan keluar diantara dua ketiak daun. Bentuk batang ramping dan tidak berumbi. Pada umumnya akar anggrek berbentuk silindris dan berdaging, lunak serta mudah patah dengan ujung meruncing licin dan sedikit lengket. Dalam keadaan kering, akar tampak berwarna putih keperak-perakan pada bagian luarnya dan hanya pada bagian ujung akar saja yang berwarna hijau atau tampak agak keunguan. Akar-akar yang sudah tua akan menjadi coklat dan kering kemudian digantikan oleh akar yang baru tumbuh. Akar anggrek mempunyai velamen yang terdiri dari beberapa lapis sel berongga dan transparan serta merupakan lapisan pelindung pada sistem saluran akar. Velamen berfungsi melindungi akar dari kehilangan air selama proses transpirasi dan evaporasi, menyerap air dan melindungi bagian dalam akar, serta membantu melekatnya akar pada benda yang ditumpanginya. Pada anggrek simpodial, akar diproduksi pada bagian dasar pseudobulb atau sepanjang rhizome yang menghubungkan pseudobulb satu dengan lainya. Berbeda dengan anggrek monopodial, akarnya banyak tumbuh pada ruas-ruas batang. Bunga anggrek memiliki lima bagian utama yaitu sepal (daun kelopak), petal (daun mahkota), stamen (benang sari), pistil (putik) dan ovary (bakal buah). Sepal anggrek berjumlah 3 buah, satu buah sepal bagian atas disebut sepal dorsal sedangkan dua lainya disebut sepal lateral. Anggrek memiliki tiga buah petal, petal ke satu dan kedua letaknya berseling dengan sepal. Petal ketiga mengalami modifikasi menjadi labellum (bibir). Labellum anggrek biasanya berwarna lebih cerah dari pada sepal dan petal. Pada bibir bunga terdapat gumpalan-gumpalan seperti massa sel (callus) yang mengandung protein, minyak, dan zat pewangi. 6 Buah anggrek berbentuk kapsular dengan biji yang sangat banyak didalamnya. Biji berukuran sangat kecil dan halus seperti tepung. Biji-biji tersebut tidak memiliki endosperm (cadangan makanan) sehingga dalam perkecambahanya diperlukan tambahan nutrisi dari luar atau dari lingkungan sekitarnya. Perkecambahan baru terjadi jika biji jatuh pada medium yang sesuai dan melanjutkan perkembangannya hingga kemasakan (Darmono 2002). Syarat Tumbuh Anggrek Tanaman anggrek dapat dibedakan menurut habitatnya yaitu anggrek epifit, teresterial, dan saprofit. Anggrek epifit adalah jenis anggrek yang menupang pada batang/pohon lain tetapi tidak merusak/merugikan yang ditumpangi. Alat yang dipakai untuk menempel adalah akarnya, sedangkan akar yang fungsinya untuk mencari makanan adalah akar udara. Anggrek ini memiliki akar serabut, tidak dalam. Jenis-jenis epifit yaitu mengembangkan akar sukulen dan melekat pada batang pohon tempatnya tumbuh, namun tidak merugikan pohon inang. Anggrek ini membutuhkan naungan dari cahaya matahari, misalnya Cattleya memerlukan cahaya sekitar 30%, Dendrobium 55-65%, Phalaenopsis sekitar 25% dan Oncidium sekitar 65%. Suhu malam yang diperlukan sekitar 21oC, sedangkan suhu siang antara 27-30 oC. Selain itu anggrek epifit membutuhkan kelembaban relatif (RH) 60-85% (Setiawan 2005). Anggrek teresterial, yaitu anggrek yang tumbuh dipermukaan tanah dan membutuhkan cahaya matahari langsung. Contohnya Vanda, Arachnis, Rananthera, dan Aranthera. Tanaman anggrek teresterial membutuhkan cahaya matahari sekitar 70-100% dengan suhu siang berkisar antara 19-38 oC dan malam hari sekitar 21 oC anggrek ini juga membutuhkan kelembahan relatif sebesar 6085% (Setiawan 2005). Anggrek saprofit, yaitu anggrek yang tumbuh pada media yang mengandung humus atau daun-daun kering, serta membutuhkan sedikit cahaya matahari, misalnya anggrek Goodyera sp. Anggrek litofit, yaitu anggrek yang tumbuh pada batu-batuan serta tahan terhadap cahaya matahari penuh dan hembusan angin kencang, misalnya Dendrobium phalaenopsis (Darmono 2002). 7 Virus Anggrek Faktor-faktor penting yang mempengaruhi pertumbuhan dan perkembangan anggrek meliputi cahaya matahari, suhu udara, kelembaban udara, penyiraman, pemupukan, sirkulasi udara, media tanam, repotting, hama dan penyakit. Tanaman yang terserang penyakit akibat infeksi patogen dapat menyebabkan penghambatan atau gangguan dari aktivitas fisiologis atau perubahan struktural yang dapat menghambat pertumbuhan, menyebabkan bentuk tanaman yang abnormal, menyebabkan susunan bagian tanaman yang berbeda, menyebabkan kematian bagian tanaman atau seluruh tanaman sebelum waktunya. Virus yang dapat menginfeksi tanaman anggrek diantaranya adalah Cymbidium mosaic virus (CyMV), Odontoglosum ringspot virus (ORSV), Cymbidium ringspot virus (CRSV), Cucumber mosaic virus (CMV), Orchid fleck virus (OFV) (Kondo et al.2006), Bean yellow mosaic virus (BYMV), Vanilla mosaic virus (VMV), Tomato ringspot virus (TRSV) (Lawson & Hsu 1995), Dendrobium mosaic virus, Clover yellow vein virus, Dendrobium vein necrosis virus, Cypripedium filamentous virus, Turnip mosaic virus, Tobacco rattle virus, Cymbidum mild mosaic virus, Trichopilia isometric virus, Masdevallia isometric virus, Short orchid rhabdovirus, Grammatophyllum bacilliform virus, Long orchid rhabdovirus, Laelia red leafspot virus, Tomato spotted wilt virus, dan Impatiens necrotic spot virus (Lawson & Hsu 1995) Capsicum chlorosis virus (CaCV) (Zheng et al. 2008). CyMV dan ORSV adalah virus yang paling banyak menimbulkan kerugian secara ekonomi (Lawson & Branningam 1986; Zettler et al. 1990; Matthews R 1992). Burnet (1974) mengemukakan bahwa virus dapat menyerang genera anggrek dalam kisaran yang luas. Ditemukan penyakit yang disebabkan oleh virus paling sedikit pada 55 genera anggrek, tetapi ini bukan berarti bahwa terdapat 55 jenis virus yang berbeda, karena virus yang sama sering dapat menginfeksi genera yang berlainan. Gejala yang dihasilkan bermacam-macam tergantung pada virus, spesies, atau hibrida anggrek yang diinfeksi, dan kondisi lingkungan. 8 CyMV Penyakit yang disebabkan oleh CyMV adalah penyakit yang paling umum pada anggrek di seluruh dunia yang memiliki dampak ekonomi. Adanya penyakit ini di Indonesia untuk pertama kalinya dilaporkan Suseno (1976) pada Cattleya. CyMV merupakan spesies dari genus Potexvirus dan famili Flexiviridae. Bentuk partikel virus adalah memanjang, lentur dan panjangnya rata-rata 448 nm hingga 488 nm, tidak memiliki enveloped dan memiliki RNA berukuran ±600bp (Lee & Chang 2006). Genom CyMV merupakan ss-RNA linier dan berukuran 8.1 kb (Frowd & Tremaine 1977). CyMV dapat ditularkan secara mekanik dengan cairan perasan, melalui perkembangbiakan vegetatif, tetapi tidak dapat ditularkan dengan biji dan secara alami oleh serangga vektor. CyMV di lapangan dapat ditularkan melalui kontak langsung antara tanaman sakit dengan tanaman sehat, kontaminasi peralatan potong dan pot selama perawatan dan pada saat panen bunga (Lawson 1995). CyMV dapat bertahan dalam cairan perasan tanaman sakit pada temperatur 65oC selama 10 menit, tetapi tidak dapat diinaktifkan pada temperatur 70 oC. Selain itu virus tersebut juga tidak aktif pada tanaman yang direndam dalam air yang bertemperatur 45 oC selama 2 jam (Smith 1972). Menurut Jensen (1951) CyMV banyak menyerang spesies dalam famili Orchidaceae dan hanya beberapa spesies pada famili lainya. Pada famili Orchidaceae virus ini dijumpai pada 8 genera, yaitu Aranthera sp., Calanthe sp., Cattleya sp., Cymbidium sp., Grammatophyllum sp., Phalaenopsis sp., Oncidium sp., dan Vanda sp. Gejala mosaik akan tampak lebih jelas pada daun-daun muda berupa garisgaris klorotik memanjang searah serat daun. Bunga pada tanaman Cattleya sp. yang terinfeksi biasanya memperlihatkan gejala bercak-bercak coklat nekrosis pada petal dan sepal. Bunga biasanya berukuran lebih kecil dan mudah rontok dibandingkan dengan bunga tanaman sehat (Jensen 1951). Pada tanaman Grammatophyllum menunjukan gejala mosaik pada daun, pada tanaman Phalaenopsis menunjukkan gejala mosaik, dan nekrosis pada bagian daun (Inouye 1996). 9 ORSV ORSV merupakan spesies dari genus Tobamovirus. Partikel virus berbentuk batang berukuran 18 x 300 nm, tidak memiliki enveloped, terdiri atas molekul ssRNA berukuran 6 kb. Virus ini mudah ditularkan secara mekanik melalui ekstrak bagian tanaman sakit, tetapi tidak menular melalui serangga vektor dan biji. (Lawson dan Brannigan 1986). ORSV menyerang anggrek jenis Aranda, Epidendrum, Calanthe, Cattleya, Dendrobium, Aruundinia, Miltonia, Oncidium, Spathoglottis dan Vanda (Suseno 1976). Pada jenis anggrek Cattleya sp. gejala infeksi ini bervariasi yaitu berupa garis-garis klorotik dan mosaik pada daun muda, bercak klorotik sampai nekrotik atau bercak berbentuk cincin. Pada Oncidium sp. bercak nekrotik berwarna hitam tampak nyata pada permukaan bawah daun. Penularan Virus Secara Mekanik Macam virus yang menyerang suatu tanaman biasaya tidak selalu dapat ditentukan berdasarkan gejala saja. Suatu macam virus dapat menimbulkan gejala yang berlainan pada tanaman yang berbeda, semantara virus yang berbeda dapat menyebabkan gejala yang hampir sama pada tanaman inang yang sama (Badwen 1964; Withren 1959) Penularan secara mekanis merupakan metode penularan yang mudah dilakukan dan banyak digunakan untuk percobaan penularan di laboratorium. Inokulasi secara mekanik dilakukan dengan mengoleskan sap (ekstrak daun) pada permukaan daun tanaman yang mengalami luka mikro secara mekanis (Wahyuni 2005). Hal-hal yang perlu diperhatikan untuk keberhasilan inokulasi adalah konsentrasi virus dalam sap, sumber inokulum, metode penyiapan inokulum, ketahanan virus dalam sap, dan tanaman inang. Kondisi lingkungan sebelum dan sesudah inokulasi, seperti cahaya dan suhu juga mempengaruhi keberhasilan inokulasi. Konsentrasi virus yang tinggi biasanya didapatkan pada daun muda yang telah menunjukkan gejala penyakit. Metode penyiapan inokulum juga menjadi faktor penentu keberhasilan penularan virus secara mekanis. Selama 10 penggerusan daun, berbagai metabolit dan debris dari sel daun akan terlepas secara bersamaan dengan virus. Beberapa senyawa itu dapat merusak virion atau dapat menghambat keefektifan virus. Oleh sebab itu, ekstraksi daun yang akan digunakan sebagai inokulum perlu dilakukan dalam larutan bufer fosfat pada pH 7-7,5 dengan konsentrasi yang sesuai untuk virus yang akan ditularkan. Senyawa penstabil virus seperti senyawa pengelat dan antioksidan dapat ditambahkan untuk menghilangkan atau menghambat aktivitas senyawa yang dapat merusak virus. Penambahan senyawa pereduksi seperti merkaptoetanol dapat menghambat senyawa yang dapat merusak virus (Akin 2006). Penambahan zat abrasif, seperti karborundum. Zat abrasif menyebabkan luka yang kecil pada sel tanaman dan memudahkan penetrasi virus ke dalam sel (Agrios 2005). Tanaman yang tumbuh dalam keaadaan intensitas cahaya rendah akan lebih rentan daripada yang tumbuh dalam cahaya terang. Kerentenan juga meningkat dengan menyimpan tanaman yang tumbuh dalam gelap selama beberapa waktu atau beberapa hari sebelum inokulasi (Bawden 1964; Noordam 1973). Deteksi Virus Serologi Teknik serologi ELISA (Enzime-Linked Immunosorbent Assay), yang dikembangkan pada akhir 1970-an telah digunakan secara luas oleh ahli penyakit tumbuhan untuk mendeteksi virus tumbuhan. Teknik ini memiliki kelebihan, yaitu dapat mengidentifikasi banyak sampel sekaligus dengan dengan biaya yang relatif murah dan cepat dilakukan. Prinsip ELISA adalah mereaksikan antara antigen dan antiserum yang membentuk kompleks antigen-antiserum (Ag-As) pada lubang plat mikrotiter yang terbuat dari polystyrene. Zat-zat yang dapat mengindikasikan terbentuknya antibodi di dalam serum disebut antigen. Antigen umumnya adalah protein. Serum yang mengandung antibodi disebut antiserum. Interaksi antara antigen dan antiserum bersifat spesifik, artinya antiserum hanya mengenali satu jenis epitop dan antigen. Epitop merupakan bagian dari antigen yang dapat dikenali oleh antibodi dari antigen yang dapat berinteraksi dengan antibodi (Crowther 1996). 11 Metode ELISA dibagi dalam Direct ELISA atau Double Antibody Sandwich (DAS) ELISA dan Indirect-ELISA. Perbedaan kedua metode tersebut adalah pada Direct-ELISA, enzim konjugat terdapat pada molekul immunoglobulin pertama yang langsung bereaksi dengan antigen. Pada Indirect-ELISA, enzim konjugat terdapat pada molekul immunoglobulin kedua yang bereaksi dengan antiserum (Crowther 1996; Dijkstra & De Jegger 1998). Deteksi CyMV dan ORSV telah berhasil dilakukan Hu et al. (1994); Navalinskiene (2005); dan Khalimi (2008) dengan menggunakan metode serologi DAS-ELISA. Molekuler Deteksi dan identifikasi virus tanaman dapat juga dilakukan melalui teknik molekuler misalnya reverse transcriptase-polimerase chain reaction (RT-PCR) (Khalimi 2009). Metode ini merupakan metode pengembangan metode PCR yaitu dengan menambahkan enzim transcriptase balik (reverse transcriptase). Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan maka terlebih dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul mRNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Enzim transcriptase balik adalah enzim DNA polimerase yang menggunakan molekul RNA sebagai cetakan untuk mensintesis molekul DNA (cDNA) yang komplementer dengan molekul RNA tersebut. Metode RT-PCR telah terbukti dapat digunakan sebagai teknik deteksi virus yang memiliki sensitifitas yang tinggi (Yuwono 2006). Deteksi CyMV dan ORSV telah dilakukan pada tanaman anggrek dengan teknik RT-PCR terbukti dapat digunakan untuk mendeteksi dan identifikasi CyMV dan ORSV (Khalimi 2008; Ajjikuttira et al. 2005). Respon Tanaman terhadap Patogen Respon tanaman terhadap infeksi patogen dapat digolongkan menjadi empat yaitu imun, resisten, toleran, dan rentan (Matthews 1992). Tanaman yang memiliki respon imun terhadap patogen merupakan tanaman yang sel-selnya tidak 12 dapat dipenetrasi oleh patogen, sehingga patogen tidak dapat masuk (Wheeler 1975) dan tidak terjadi infeksi (Hull 2002). Seandainya virus diinokulasikan pada tanaman yang imun, virus ditemukan masih terbungkus selubung protein dan tidak mampu untuk bereplikasi di dalam sel tanaman. Selain itu, bila virus tersebut mampu melepaskan selubung proteinnya (hanya asam nukleatnya saja yang ada di dalam sel), virus tidak mampu untuk memperbanyak genomnya (Hull 2002). Tanaman resisten merupakan tanaman yang dapat diinfeksi oleh patogen, tetapi sel-sel tanaman tidak mendukung pertumbuhan dan perkembangan patogen, sehingga tidak terjadi penyakit (Wheeler 1975). Pada tanaman yang toleran, patogen dapat menginfeksi, sel-sel tanaman mendukung pertumbuhan dan perkembanganya, tetapi tanaman terlihat normal karena gejala tidak muncul (Hull 2002) atau mengalami kehilangan hasil yang tidak berarti secara ekonomi (Wheeler 1975). Tanaman yang rentan adalah tanaman yang mendukung pertumbuhan dan perkembangan patogen, serta patogen mampu menimbulkan kerusakan pada tanaman dan menyebabkan kehilangan hasil (Wheeler 1975). Interaksi Virus pada Tanaman yang Terinfeksi Gejala pada tanaman yang sakit dapat disebabkan oleh lebih dari satu virus dan hal tersebut sering terjadi di lapangan (Falk & Duffus 1981). Virus-virus yang terdapat pada tanaman yang terinfeksi akan berinteraksi, sehingga dapat mempengaruhi gejala penyakit yang timbul. Interaksi tersebut dapat bersifat sinergis, aditif (Oku 1994) atau antagonis (interferensi) (Matthews 1991). Interaksi akan mempengaruhi jumlah lesio lokal yang timbul, replikasi virus, pergerakan virus dan gejala yang timbul. Sel-sel tanaman inang akan mengalami nekrosis dan virus-virus yang berinteraksi akan bereplikasi dan membentuk badan inkusi pada sel-sel yang tidak mati (Matthews 1991). Interaksi yang bersifat sinergis akan menyebabkan gejala penyakit yang lebih parah pada tanaman yang terinfeksi dibandingkan bila virus menginfeksi tanaman sendiri-sendiri (Kosaka & Fukunishi 1997; Murphy & Kyle 1995; Zhang et al. 2001). Fenomena yang timbul dari interaksi yang bersifat aditif sebenarnya hampir sama dengan sinergistik, yaitu infeksi campuran yang menyebabkan kerusakan yang timbul lebih parah dibandingkan infeksi tunggal, tetapi kerusakan 13 yang timbul tidak separah gabungan kerusakan yang ditimbulkan dari infeksi tunggal. Interaksi yang bersifat antagonis menyebabkan gejala penyakit yang timbul tidak separah bila hanya ada satu virus pada tanaman (Hull 2002). Hal tersebut dimanfaatkan dalam proteksi silang, yaitu dalam menginfeksi tanaman dengan menggunaklan strain virus yang lemah untuk menghambat infeksi strain yang lebih virulen (Gibbs & Harrison 1980). BAHAN DAN METODE Tempat dan Waktu Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dari akhir Juli 2009 sampai awal Januari 2010. Isolasi Virus Sumber virus yang digunakan pada penelitian ini berasal dari tanaman anggrek Dendrobium sp. yang terinfeksi tunggal oleh CyMV dan ORSV setelah dilakukan uji serologi. Isolasi CyMV dan ORSV dilakukan dengan metode serial transfer passage pada tanaman uji sebanyak tiga kali dari tanaman anggrek yang terinfeksi virus ke tanaman inang uji. Tanaman inang yang digunakan untuk mengisolasi CyMV adalah Datura stramonium. Sedangkan tanaman inang yang digunakan untuk mengisolasi ORSV adalah Nicotiana benthamiana. Tanaman anggrek digerus dalam mortar dan pistil steril. Larutan bufer 0,05 M pH 7,0 ditambahkan dengan perbandingan 0.1 g per 1 ml larutan bufer fosfat dan merkaptoetanol 1% (1:10 b/v). Cairan perasan inokulum ini segera diinokulasikan ke tanaman D. stramonium untuk isolasi CyMV dan ke tanaman N. benthamiana untuk isolasi ORSV. Inokulasi dilakukan pada dua helai daun termuda yang telah membuka penuh. Sebelum diinokulasi, jaringan permukaan daun dilukai dengan karborondum 600 mesh pada bagian atas daun, kemudian cairan inokulum dioleskan dengan menggunakan kapas steril pada permukaan daun. Pengolesan dilakukan searah tulang daun, setelah itu dilakukan pembilasan sisa karborondum yang masih melekat pada permukaan daun tanaman dengan aquades. Bagian tanaman anggrek yang terinfeksi CyMV pada tanaman D. stramonium menunjukkan gejala lesio lokal pada hari ke 15-20 setelah inokulasi sedangkan tanaman N. benthamiana yang terinfeksi ORSV menunjukkan gejala ringspot pada hari ke 9 setelah inokulasi. Selanjutnya satu lesio yang dihasilkan digunakan sebagai sumber inokulum berikutnya pada jenis tanaman yang sama. Setelah tiga kali serial transfer passage, inokulum dianggap murni terbebas dari 15 jenis strain virus lain dan siap digunakan sebagai inokulum virus yang akan diperbanyak (propagasi). Persiapan Tanaman Anggrek Tanaman anggrek yang digunakan pada penelitian ini ialah bibit anggrek spesies dan anggrek silangan yang berasal dari perbanyakan kultur jaringan berjumlah 16 spesies tanaman anggrek, diantaranya; Phalaenopsis amabilis, P. violacea, Grammathopyllum scriptum, Coelogyne pandurata, Dendrobium lasiantera, D. nindii, D. stratiotes, D. discolor, D. schulleri, D. liniae , D. Burana Jade x D. nindii dan Cattlaya Black Lucky Man x Black Lijinan Pearl. Sedangkan bibit anggrek yang berasal dari kompot diantaranya D. Woxin, D. Burana Mainil Wrap x D. Stip, D. Kyosimori, dan Oncidium Golden Shower. Pemindahan bibit dari botol kultur jaringan ke pot dilakukan dengan mengeluarkan bibit dengan memasukkan air bersih ke dalam botol, selanjutnya bibit dikeluarkan satu per satu (akar terlebih dahulu). Bibit anggrek yang sudah dikeluarkan dari dalam botol dicuci di bawah air mengalir, kemudian direndam dengan larutan fungisida 1% selama 7 menit setelah itu ditiriskan. Sedangkan bibit anggrek yang berasal dari kompot, dilakukan pemisahan bibit dengan perlahan dari media tanam, kemudian bibit anggrek direndam dengan larutan fungisida 1% selama 7 menit setelah itu ditiriskan. Selanjutnya bibit dipindahkan ke pot individu yang berdiameter 5 cm. Pot diisi dengan media pakis dan areng dengan perbandingan 1:1 yang telah disteril dan direndam dengan larutan fungisida 1% selama sepuluh menit. Sedangkan untuk jenis anggrek G. scriptum media yang digunakan adalah mos spagnum. Bibit yang telah ditanam dipelihara sampai satu bulan hingga bibit tumbuh dengan baik dan siap diinokulasi CyMV dan ORSV. Pemeliharaan tanaman dilakukan dengan melakukan pemupukan dan penyiraman. Pupuk yang digunakan adalah pupuk daun yang disemprotkan pada daun (0,2 g/ l air). 16 Persiapan Inokulum Inokulum awal diperoleh dari tanaman hasil isolasi virus yang terinfeksi tunggal CyMV atau ORSV. Tanaman yang digunakan untuk perbanyakan virus ialah N. benthamiana. Tanaman N. benthamiana sehat berumur satu bulan setelah semai diinokulasi secara mekanis dengan isolat murni yang berasal dari hasil isolasi virus, dan masing-masing isolat dicampurkan dengan bufer fosfat dengan perbandingan 1:10 b/v dan merkaptoetanol 1%. Hasil perbanyakan virus pada tanaman N. benthamiana digunakan sebagai sumber inokulum pada penelitian ini. Inokulasi Virus pada Tanaman Anggrek Inokulasi CyMV atau ORSV pada tanaman anggrek dilakukan secara mekanis dengan perbandingan 0,5 g daun per 5 ml larutan bufer fosfat (1:10 b/v) dan merkaptoetanol 1%. Perlakuan inokulasi virus pada anggrek terdiri atas CyMV, ORSV, serta CyMV dan ORSV dengan 5 ulangan untuk masing-masing spesies tanaman anggrek. Inokulasi untuk CyMV dan ORSV (inokulasi campuran) yaitu dengan mencampurkan cairan perasan tanaman yang mengandung CyMV dan ORSV dengan perbandingan 1:1. Cairan perasan yang mengandung virus dioleskan pada daun tanaman anggrek sehat. Inokulasi dilakukan pada dua helai daun paling muda yang sudah membuka penuh pada bibit anggrek yang sehat. Semua perlakuan inokulasi dilakukan sebanyak tiga kali dengan interval waktu satu minggu. Pemeliharaan dan Pengamatan Tanaman Tanaman yang sudah diinokulasi dipelihara di dalam rumah kasa. Pemupukan dilakukan seminggu se-kali, dengan menggunakan pupuk daun. Selain itu tanaman juga disiram setiap hari pada waktu pagi hari pukul 07.00 WIB atau sore pukul 15.00 WIB. Pengamatan dilakukan setiap hari setelah inokulasi. Pengamatan dilakukan terhadap gejala dan variasi gejala yang timbul, masa inkubasi, dan jumlah tanaman yang bergejala atau persentase kejadian penyakit. Persentase kejadian penyakit yang terjadi pada tanaman menggunakan rumus: 17 KP = ே x 100% (KP = kejadian penyakit; n = jumlah tanaman yang menunjukkan gejala virus, N = jumlah tanaman yang diamati) Deteksi Virus pada Jaringan Tanaman Anggrek Deteksi melalui DAS-ELISA. Sampel tanaman anggrek yang telah diinokulasi CyMV dan ORSV dideteksi dengan metode DAS-ELISA mengikuti metode Clark & Adams (1977). Antiserum dilarutkan ke dalam coating buffer ( 1,59 g sodium carbonate, 2,93 g sodium bicarbonate, 0,2 g sodium azide dilarutkan dalam 1000 ml H2O, pH 9,6) 1:1000 dan dimasukkan ke dalam plat mikrotiter sebanyak 100 µl tiap sumuran plat mikrotiter kemudian diinkubasikan 37oC selama 2 sampai 4 jam. Setelah proses inkubasi selesai plat mikrotiter dicuci dengan PBST ( 8 g sodium chloride, 0,2 g monobasic potassium phosphate, 1,15 g dibasic sodium phosphate, 0,2 potassium chloride, 0,2 g sodium azide dan 0,5 g Tween-20 yang dilarutkan dalam 1000 ml H2O, pH 7,4) sebanyak 3-5 kali. Sampel tanaman anggrek digerus dalam sampel extraction buffer (8 g sodium chloride, 0,2 g monobasic potassium phosphate, 1,15 g dibasic sodium phosphate, 0,2 g potassium chloride, 0,2 g sodium azide, dan 0,5 g Tween -20, 2 g polyvinyl pyrrolidone yang dilarutkan dalam 1000 ml H2O, pH 7,4) dengan perbandingan 1:5 (b/v). Cairan perasan tanaman yang dihasilkan diambil sebanyak 100 µl kemudian dimasukkan ke dalam plat mikrotiter dan diinkubasi selama semalam pada suhu 4 oC. Selanjutnya plat mikrotiter dicuci lagi dengan PBST sebanyak 5-7 kali. Sumur yang telah dicuci diisi 100 µl enzim konjugat yang sudah diencerkan dengan bufer konjugat (2 g polyvinyl pyrrolidone, 0,2 g egg albumin yang dilarutkan dalam 100 ml PBST, pH 7,4) dan diinkubasi pada 37 oC selama 4 jam. Selanjutnya dilakukan pencucian dengan PBST sebanyak 5-7 kali, sumuran plat mikrotiter kemudian diisi dengan 100 µl substrat p-nitrophenyl phosphate (PNP) yang dilarutkan dalam bufer PNP (97 ml diethanolamine, 600 ml H2O, 0,2 g sodium azide dilarutkan dalam 1000 ml H2O, pH 9,8) dan diinkubasi pada suhu ruang selama 30 menit. Jika terjadi perubahan warna, menunjukan bahwa sampel tersebut positif terinfeksi CyMV atau ORSV. Analisis hasil DAS-ELISA secara kuantitatif dilakukan dengan membaca nilai absorban pada panjang gelombang 18 405 nm dengan ELISA reader. Selanjutnya nilai absorban tersebut digunakan untuk menentukan reaksi positif hasil DAS-ELISA, yaitu dengan mencari nilai standar deviasinya. Kisaran nilai absorban tanaman yang positif terinfeksi virus adalah dua kali nilai kontrol negatif ± nilai standar deviasi. Deteksi Melalui RT-PCR. RNA total diekstrak dari 100 mg jaringan daun tanaman anggrek menggunakan Rneasy Plant Mini Kits (Qiagen inc., Chatsworth, CA., USA). RNA hasil ekstraksi selanjutnya ditraskripsi balik menjadi DNA komplementer (cDNA) dengan menggunakan teknik RT-PCR. Reaksi reverse transcriptase (RT) RNA sebanyak 10 µl terdiri atas 2 µl template RNA, 1µl buffer RT 10x, 0,35 µl M-MuLV RT (200U/µl), 2 µl 10mM dNTP, 0,75 µl 10 µM oligo-dT, 0,35 µl Rnase H (40U/µl), 0,35 µl 10mM DTT, dan 3,2 µl H2O (NEB). Reaksi RT dilakukan dalam sebuah Automated Thermal Cycler (Gene Amp PCR System 9700 thermocycler; Perkin-Elmer Crop., Norwalk, CT) diprogram untuk satu siklus pada 25 oC selama 5 menit, 42 oC selama 60 menit dan 70 oC salama 15 menit. cDNA hasil reaksi RT dipakai sebagai template pada reaksi PCR. Sepasang primer digunakan untuk CGGGATCCATGGGAGAGTCCACTCCA amplifikasi -3’ yaitu dan Forward 5’- reverse 5’- GGAATTCTCAGTAGGGGGTCCAGGC -3’. Primer-primer ini conserved dengan sekuen CyMV Coat Protein. Untuk ORSV digunakan primer-F 5’GCTCTAGAATGTCTTACACTATTACAGACC 3’ dan primer-R 5’ GCTCTAGAATGGGTCGTTTGCGTTTTGTAG 3’. Reaksi PCR (total volume 25 µl) menggunakan Go Taq green master mix (Promega) dengan komposisi 12,5 µl, primer reverse dan forward masing-masing terdiri atas 1 µl (10 µM), cDNA 2 µl, dan 8,5 µl RNAse free water. Amplifikasi dilakukan dalam sebuah Automated Thermal Cycler (Gene Amp PCR System 9700 thermocycler; Perkin-Elmer Crop., Norwalk, CT) diprogram untuk 35 siklus amplifikasi sebagai berikut: pemisahan utas DNA (denaturasi) pada suhu 95 oC selama 30 detik, penempelan primer pada DNA (annealing) 50 oC selama 45 detik dan sintetis DNA pada suhu 72 oC selama 1 menit (extention) (Ajjikuttira et al. 2005). Elektroforesis dilakukan pada gel agarose 1 % (w/v) (dalam TBE 1X) yang ditambahkan ethidium bromide. Pengukuran DNA digunakan marker 1000 bp (Fermentas, USA), selanjutnya masing-masing sampel diisikan dalam sumuran gel dengan pipet mikro sebanyak 19 8 µl DNA. Elektroforesis dijalankan pada tegangan 80 V selama 45 menit. Hasil visualisasi elektroforesis tersebut dilihat dibawah transilluminator ultraviolet dan dipotret. Penentuan Ketahanan Tanaman Penentuan kriteria respon berbagai jenis anggrek terhadap infeksi CyMV atau ORSV berdasarkan beberapa faktor, diantaranya persentase kejadian penyakit dan infeksi virus. Respon tanaman anggrek dikelompokkan menjadi mendekati imun, toleran, agak resisten dan rentan (Tabel 1). Tabel 1 Pengelompokan respon tanaman anggrek terhadap infeksi tunggal CyMV atau ORSV (Matthews 1992). Tingkat ketahanan Reaksi tanaman inang Kejadian penyakit (%)1) Infeksi virus2) Mendekati imun - - Toleran - + Agak resisten + + Rentan ++ + 1) 2) Kejadian penyakit - : Tidak ada kejadian penyakit. + : Kejadian penyakit 0 < x ≤ 40. ++ : Kejadian penyakit 40 ≤ x < 100. Infeksi virus - : Berdasarkan DAS ELISA tidak ada infeksi virus. + : Berdasarkan DAS ELISA ada infeksi virus. HASIL DAN PEM MBAHAS SAN Isolaat CyMV dan ORSV Isolaasi CyMV berhasil diilakukan melalui penuularan secarra mekanis pada tanaman D. stramonium dari tanaman sumber s virrus Dendroobium sp. yang diketahui terinfeksi tuunggal CyM MV pada uji serologi. CyMV C mennimbulkan gejala g lesio nekrrotik pada daun D. stramonium yang diinookulasi (Gaambar 1). Lesio nekrotik teerbentuk 155 hari setelaah inokulasi. Isolasi OR RSV juga beerhasil dilak kukan melalui penularan p s secara mekkanis pada tanaman N. N bentham miana dari daun anggrek Dendrobium D m sp. yangg diketahuii terinfeksii tunggal O ORSV pad da uji serologi. ORSV meenimbulkann gejala beercak ringsspot pada daun mud da N. benthamiaana yang diinokulasi d (Gambar 1). 1 Mula-m mula tepi daaun meleng gkung kebawah kemudian k m muncul berccak klorosis hingga nekkrotik berbeentuk cincin n pada daun muda, gejala rinngspot terbeentuk 9 harii setelah inookulasi. Penuularan viruus dari satuu lesio ditu ujukan untuuk mendappatkan inok kulum homogen, sehingga dapat d diangggap sebagai isolat murrni. Penularran isolat CyMV C dan ORSV V juga berhhasil dilakuukan ke tan naman N. benthamianaa dan digun nakan sebagai sumber s isollat CyMV dan ORSV pada peenelitian inni. Tanamaan N. benthamiaana yang terinfeksi t C CyMV men nunjukkan gejala mossaik. Mula--mula gejala terllihat berupaa bercak-beercak putih h yang lamaa kelamaann menjadi coklat c pada area tulang dauun, kemudian bercak-b bercak mennyebar mem menuhi luass area daun. A B D stram monium (A)), gejala ringspot Gambar 1 Gejala lesio lokal CyyMV pada Datura a Nicotianna benthamiana (B). ORSV pada 21 Pengujian infeksi CyMV dan ORSV pada tanaman indikator menunjukkan bahwa strain CyMV dan ORSV yang digunakan dalam penelitian ini sebagai sumber inokulumnya cukup infektif. Gambar 2. Gejala infeksi CyMV pada Nicotiana benthamiana. Respon Tanaman Anggrek Terhadap Infeksi Tunggal CyMV dan ORSV Gejala yang muncul pada tanaman anggrek bervariasi antar spesies tanaman anggrek dan jenis inokulum virus. Gejala pada tanaman anggrek yang terinfeksi CyMV tunggal berupa klorosis membentuk cekungan, dan mosaik yang memiliki pola bervariasi antar spesies tanaman anggrek. Infeksi tunggal ORSV pada tanaman anggrek menyebabkan gejala klorosis, bercak nekrotik, klorosis hingga nekrotik berbentuk cincin/ringspot pada bagian daun. Berdasarkan gejala yang terlihat pada pengamatan, maka CyMV dan ORSV cukup infektif terhadap tanaman anggrek yang diuji. Pada umumnya gejala ORSV muncul lebih cepat dibandingkan dengan gejala CyMV setelah inokulasi, kecuali pada anggrek P. amabilis dan G. scriptum yang menunjukkan gejala CyMV muncul lebih cepat. Pada anggrek jenis Dendrobium rata-rata gejala ORSV muncul pada hari ke 11 setelah inokulasi, sedangkan gejala CyMV muncul rata-rata pada hari ke 20 setelah inokulasi. Pada anggrek P. amabilis masa inkubasi CyMV adalah hari ke 31 setelah inokulasi, sedangkan masa inkubasi ORSV adalah hari ke 37-39 setelah inokulasi. Pada anggrek G. scriptum masa inkubasi CyMV adalah hari ke 19 setelah inokulasi, sedangkan masa inkubasi ORSV adalah hari ke 65 setelah inokulasi (Tabel 2). Perbedaan masa inkubasi berkaitan dengan sistem ketahanan yang dimiliki oleh tanaman dan tingkat virulensi virus yang menginfeksi. 22 Tabel 2 Respon berbagai jenis tanaman anggrek terhadap inokulasi virus tunggal CyMV atau ORSV Jenis Anggrek 1) Gejala CyMV Masa Inkubasi (hari) Infeksi virus2) (%) Gejala 1) ORSV Masa Inkubasi (hari) Infeksi virus2) (%) Denrobium Klo, Mo 16 40 Klo, RS 14-22 40 D. Kyosimori Klo 44 80 Klo 18-31 80 D. nindii Mo 16 100 RS 10 100 D. liniae Klo, Mo, Cek 16-37 100 RS 13-18 100 D. lasiantera Klo, Mo, Cek 14 100 RS 8 100 D. schulleri Klo, Nek, Mo, 16 100 RS 4-7 100 D. discolor Klo, Mo 16 100 Klo, RS 6-8 100 D. stratiotes Klo, Mo 25 80 Tg - 100 D. Burana Jade X D.nindii Klo 27 100 Klo 10 40 D. Burana Mainil Wrap x D. Strip Klo 16 100 Klo 15-22 40 D. Woxin 23 Tabel 2 lanjutan Jenis Anggrek 1) Gejala CyMV Masa Inkubasi (hari) Infeksi virus2) (%) Gejala 1) ORSV Masa Inkubasi (hari) Infeksi virus2) (%) Phalaenopsis P. amabilis Mo 31 100 Klo, Cek 37-39 60 P. violacea Mo 33 100 Tg - 100 Tg - 0 Klo, RS, Nek 13-15 100 Klo, Mo 19 20 Klo 65 100 Oncidium Golden Shower Tg - 20 Nek 21 100 Cattleya Blc. Lucky Man x Blc. Lijinan Pearl Tg - 20 RS 54 100 Klo, Mo 25 100 RS 9 100 Coelogyne pandurata Grammatophyllum scriptum Tanaman Indikator N. benthamiana 1) 2) Gejala: Klo (Klorosis), Nek (Nekrotik), RS (Ringspot), Mo (Mosaik), Cek (Cekungan), Tg (Tidak bergejala). Persentase tanaman yang terinfeksi virus setelah diverifikasi dengan ELISA. 24 Tipe gejala mosaik yang terlihat pada tanaman anggrek yang terinfeksi CyMV bervariasi, tergantung pada spesies tanaman anggrek. Pada anggrek Dendrobium tipe gejala mosaik yang terlihat adalah belang (mottling) berwarna hijau terang dan kuning pada bagian daun anggrek diantaranya; D. nindii, D. lasiantera, D. Burana Jade x D. nindii, dan D. Burana Mainil Wrap x D. Stip, bercak klorosis bentuk cincin pada anggrek D. Woxin dan D. stratiotes dan bercak konsentris pada anggrek D. schulleri. Gejala mosaik berbentuk garis terlihat pada anggrek G. scriptum yang terinfeksi CyMV, sedangkan anggrek P. amabilis dan P. violacea. menunjukkan gejala mosaik berbentuk belang. Gejala klorosis terlihat pada tanaman anggrek D. discolor dan D. liniae (yang disertai cekungan) (Gambar 3 dan 4). Gejala mosaik yang terjadi pada tanaman anggrek yang terinfeksi CyMV dimulai dengan gejala klorosis sepanjang tulang daun ke seluruh bagian daun. Gejala klorosis terjadi pada daun akibat terjadinya pengurangan klorofil, tidak normalnya bentuk kloroplas, dan kerusakan histologi sel daun seperti kerusakan sel palisade dan vakuola sel (Akin 2006). Adanya perbedaan jenis gejala pada tanaman anggrek yang terinfeksi virus disebabkan oleh respon yang berbeda dari setiap spesies dan hibrida tanaman anggrek. Matthews (1991) menyebutkan bahwa jenis gejala yang tampak pada tanaman yang terinfeksi virus dipengaruhi oleh genetik inang. A B C D Gambar 3. Gejala infeksi CyMV pada berbagai jenis tanaman anggrek. Dendrobium Woxin (A), D. nindii (B), D. liniae (C), D. schulleri (D). 25 A B F C G D E H Gambar 4 Gejala infeksi CyMV pada berbagai jenis tanaman anggrek. Dendrobium lasiantera (A), D. Burana Jade x D. nindii (B), D. stratiotes (C), D. Burana Mainil Wrap x D. Stip (D), D. discolor (E), Grammatophyllum scriptum (F), Phalaenopsis violacea (G), P. amabilis (H). Gejala ringspot yang dicirikan dengan munculnya klorosis atau nekrosis berbentuk cincin pada daun terlihat pada tanaman anggrek yang terinfeksi ORSV, gejala ringspot terlihat hampir pada semua anggrek Dendrobium, Coelogyne, dan Cattleya. Gejala ringspot pada bagian daun yang terinfeksi dilingkari garis berbentuk cincin yang merupakan sel yang terinfeksi. Selain berupa klorosis dan nekrosis, pada anggrek D. nindii, dan D. lasiantera gejala ringspot berupa lingkaran terpusat. Anggrek Phalaenopsis dan Grammathophyllum yang terinfeksi ORSV menunjukkan gejala klorosis disertai cekungan bulat pada anggrek Phalaenopsis, sedangkan pada anggrek Oncidium Golden Shower gejala yang terlihat adalah bercak nekrotik yang disebabkan karena kematian sel tanaman (Gambar 5). L 26 A B D C E G F H I J K L M Gambar 5 Gejala infeksi ORSV pada berbagai jenis tanaman anggrek. Dendrobium nindii (A), D. Woxin (B), D. Kyosimori (C), D. liniae (D), D. lasiantera (E), D. schulleri (F), D. discolor (G), D. Burana Mainil Wrap x D.Strip (H), Cattleya Blc. Lucky Man x Blc. Lijinan Pearl (I), Grammatophyllum scriptum (J), Oncidium Golden Shower (K), Coelogyne pandurata (L), Phalaenopsis amabilis (M). 27 Gejala penyakit virus pada tanaman inang dapat terjadi akibat penggunaan hasil metabolisme tanaman untuk sintesis virus, penumpukan virion atau bagian dari virus dan dampak dari polipeptida khas yang disandi oleh gen virus. Dampak infeksi virus pada senyawa yang mengandung nitrogen, seperti pada zat pengatur tumbuh dan senyawa fenol, sering dianggap sebagai penyebab langsung dari berbagai tipe gejala. Hal ini karena zat pengatur tumbuh tersebut berperan dalam pertumbuhan dan diferensisasi tumbuhan (Akin 2006). Beberapa tanaman tidak menunjukkan gejala setelah diinokulasi hingga akhir pengamatan, diantaranya tanaman anggrek D. stratiotes dan P. violacea yang diinokulasi ORSV, dan anggrek Oncidium Golden Shower, Cattleya Blc. Lucky Man x Blc. Lijinan Pearl, dan C. pandurata yang diinokulasi CyMV. Setelah dilakukan deteksi melalui ELISA, anggrek yang tidak menunjukkan gejala terinfeksi virus, kecuali anggrek C. pandurata yang tidak bergejala juga tidak terinfeksi virus (Tabel 2). Menurut Matthews (1992) respon tanaman terhadap patogen dapat dikelompokan menjadi imun, resisten, toleran, dan rentan. Berdasarkan hasil pengamatan respon tanaman anggrek terhadap infeksi tunggal CyMV atau ORSV dengan mengamati kejadian penyakit dan infeksi virus, maka respon tanaman anggrek dikelompokkan menjadi mendekati imun, toleran, agak resisten, dan rentan. Hasil penelitian menunjukkan bahwa tanaman anggrek C. pandurata merupakan tanaman anggrek yang mendekati imun terhadap infeksi CyMV. Oncidium Golden Shower, dan Cattleya Blc. Lucky Man x Blc. Lijinan Pearl toleran terhadap infeksi CyMV. D. Woxin dan G. scriptum agak resisten terhadap infeksi CyMV dan D. nindii, D. liniae, D. lasiantera, D. schulleri, D. discolor, D. stratiotes, D. Burana Jade X D. nindii, D. Burana Mainil Wrap x D. Strip, D. Kyosimori P. amabilis, dan P. violacea merupakan jenis anggrek yang rentan terhadap infeksi CyMV (Tabel 3). 28 Tabel 3 Tingkat ketahanan berbagai jenis tanaman anggrek terhadap infeksi CyMV. Jenis anggrek Denrobium D. Woxin D. Kyosimori D. nindii D. liniae D. lasiantera D. schulleri D. discolor D. stratiotes D. Burana Jade X D. nindii D. Burana Mainil Wrap x D. Strip Phalaenopsis P. amabilis P. violacea Coelogyne pandurata Grammatophyllum scriptum Oncidium Golden Shower Cattleya Blc. Lucky Man x Blc. Lijinan Pearl 1) Kejadian penyakit 2) Infeksi virus Reaksi tanaman inang Kejadian Infeksi Kriteria respon penyakit 1) virus2) tanaman + ++ ++ ++ ++ ++ ++ ++ ++ ++ + + + + + + + + + + Agak resisten Rentan Rentan Rentan Rentan Rentan Rentan Rentan Rentan Rentan ++ ++ - + + - + - + + + Rentan Rentan Mendekati Imun Agak resisten Toleran Toleran - : Tidak ada kejadian penyakit. + : Kejadian penyakit 0 < x ≤ 40. ++ : Kejadian penyakit 40 ≤ x < 100. - : Berdasarkan DAS ELISA tidak ada infeksi virus. + : Berdasarkan DAS ELISA ada infeksi virus. Pada pengujian infeksi ORSV menunjukkan bahwa tanaman anggrek jenis D. stratiotes dan P. violacea merupakan tanaman anggrek yang toleran terhadap infeksi ORSV. G. scriptum, D. Woxin, D. Burana Jade x D. nindii, dan D. Burana Mainil Wrap x D. Strip merupakan jenis anggrek yang agak resisten terhadap infeksi ORSV, dan anggrek jenis D. Kyosimori, D, nindii, D. liniae, D. lasiantera, D. schulleri, D. discolor, P. amabilis, C. pandurata, Oncidium Golden 29 Shower dan Cattleya Blc. Lucky man x Blc. Lijinan Pearl merupakan jenis anggrek yang rentan terhadap infeksi ORSV (Tabel 4). Tabel 4 Tingkat ketahanan berbagai jenis tanaman anggrek terhadap infeksi ORSV. Jenis anggrek Denrobium D. Woxin D. Kyosimori D. nindii D. liniae D. lasiantera D. schulleri D. discolor D. stratiotes D. Burana Jade X D. nindii D. Burana Mainil Wrap x D. Strip Phalaenopsis P. amabilis P. violacea Coelogyne pandurata Grammatophyllum scriptum Oncidium Golden Shower Cattleya Blc. Lucky man x Blc. Lijinan Pearl 1) Kejadian penyakit 2) Infeksi virus Reaksi tanaman inang Infeksi Kriteria respon Kejadian 1) virus2) penyakit tanaman + ++ ++ ++ ++ ++ ++ + + + + + + + + + + + + Agak resisten Rentan Rentan Rentan Rentan Rentan Rentan Toleran Agak resisten Agak resisten ++ ++ + ++ ++ + + + + + + Rentan Toleran Rentan Agak resisten Rentan Rentan - : Tidak ada kejadian penyakit. + : Kejadian penyakit 0 < x ≤ 40. ++ : Kejadian penyakit 40 ≤ x < 100. - : Berdasarkan DAS ELISA tidak ada infeksi virus. + : Berdasarkan DAS ELISA ada infeksi virus. Respon tanaman anggrek C. pandurata terhadap CyMV adalah mendekati imun, diduga karena CyMV tidak dapat bereplikasi di dalam sel tanaman. Anggrek yang memiliki respon resisten terhadap CyMV atau ORSV adalah tanaman anggrek yang dapat diinfeksi virus, tetapi sel-sel tanaman tidak mendukung pertumbuhan dan perkembangan virus, sehingga tidak terjadi penyakit. Pada tanaman anggrek yang memiliki respon toleran, CyMV atau 30 ORSV mampu menginfeksi, sel-sel tanaman mendukung pertumbuhan dan perkembanganya, tetapi tanaman anggrek terlihat normal sehingga gejala tidak muncul. Sedangkan anggrek yang memiliki respon rentan terhadap CyMV atau ORSV adalah tanaman anggrek yang mendukung pertumbuhan dan perkembangan virus, serta virus mampu menimbulkan kerusakan (Wheeler 1975; Hull 2002). Respon Tanaman Anggrek Terhadap Infeksi Ganda CyMV dan ORSV Secara umum tanaman anggrek yang terinfeksi ganda CyMV dan ORSV menimbulkan gejala yang lebih parah dibandingkan infeksi tunggal masingmasing virus (Gambar 6). Demikian pula masa inkubasi infeksi ganda terlihat lebih awal dan kejadian penyakit infeksi ganda pada tanaman lebih besar dibandingkan infeksi tunggal masing-masing virus (Tabel 5). B A F G C H D I J E K Gambar 6. Gejala infeksi virus campuran (CyMV dan ORSV) pada berbagai jenis anggrek. Dendrobium Woxin (A), D. Kyosimori (B), D. Burana jade x D. nindii (C), D. stratiotes (D), D. nindii (E), D. Burana Mainil Wrap x D. Strip (F), D. schulleri (G), D. liniae (H), D. lasiantera (I), Oncidium Golden Shower (J), Cattleya Blc. Lucky Man x Blc. Lijinan Pearl (K). 31 A B C D Gambar 7 Gejala infeksi virus campuran (CyMV dan ORSV) pada tanaman anggrek. Phalaenopsis violacea (A), Grammatophyllum scriptum (B), Coelogyne pandurata (C), Phalaenopsis amabilis (D). Gejala awal yang terlihat pada infeksi ganda pada tanaman anggrek Dendrobium adalah gejala ringspot yang disebabkan oleh ORSV, kecuali pada anggrek D. stratiotes yang menunjukkan gejala mosaik. Akan tetapi lama kelaman gejala yang terlihat pada infeksi campuran merupakan gabungan gejala kedua virus (ORSV dan CyMV) walaupun gejala ORSV lebih dominan terlihat pada hampir semua anggrek Dendrobium. Pada anggrek Dendrobium, Phalaenopsis, Coelogyne, Oncidium, dan Cattleya yang terinfeksi ganda menimbulkan gejala yang lebih parah dibandingkan infeksi tunggal masing-masing virus, demikian pula masa inkubasi infeksi ganda terlihat lebih awal, kecuali pada anggrek Cattleya. Gejala penyakit yang lebih parah pada tanaman anggrek yang diinokulasi campuran, disebabkan oleh interaksi kedua virus pada tanaman yang terinfeksi, sehingga dapat mempengaruhi gejala penyakit yang timbul. 32 Tabel 5 Respon berbagai jenis tanaman anggrek terhadap inokulasi virus campuran (CyMV dan ORSV) Gejala1) Masa inkubasi (hari) Infeksi oleh kedua virus (%)2) D. Woxin RS, Mo 9 80 D. Kyosimori RS,Mo 9 100 D. nindii RS, Mo 4 100 D. liniae RS, Klo, Cek 14 100 D. lasiantera Klo, RS, Cek 5 100 D. schulleri RS, Mo, Cek 4 100 D. discolor RS, Mo 8 100 D. stratiotes Mo 10 100 D. Burana Jade X D. nindii RS, Mo 9 100 D. Burana Mainil Wrap x D. Strip RS, Mo 11-14 100 P. amabilis Mo 14 100 P. violacea Mo 7 80 Nek 18 100 Klo R 60 (0 CyMV; 80 ORSV) Oncidium Golden Shower Klo, Nek 21 100 Cattleya Blc. Lucky Man x Blc. Lijinan Pearl Mo, RS 36 20 Jenis anggrek Denrobium Phalaenopsis Coelogyne pandurata Grammatophyllum scriptum 1) 2) Gejala : Klo (Klorosis), Klo R (Klorosis ringan), Nek (Nekrotik), RS (Ringspot), Mo (Mosaik), Cek (Cekungan), Tg (Tidak bergejala). Persentase tanaman anggrek yang terinfeksi virus setelah diverifikasi dengan ELISA. Berdasarkan keparahan gejala yang terlihat dan masa inkubasi pada tanaman anggrek, interaksi yang terjadi pada sebagian besar inokulasi campuran adalah interaksi sinergistik. Infeksi sinergistik umumnya terjadi bila kedua virus ini tidak memiliki hubungan kekerabatan, dan secara umum infeksi tersebut menyebabkan gejala yang lebih berat dibandingkan gejala akibat infeksi tunggal masing-masing virus (Hull 2002). Perbedaan tingkat keparahan gejala penyakit berkaitan dengan proses perkembangan dan penyebaran virus di dalam sel tanaman. Tingkat 33 keparahannya akan semakin tinggi dengan semakin cepatnya proses perkembangan virus dan penyebaran pada sel tanaman yang terinfeksi. Pada tanaman yang terinfeksi virus ganda terjadi interaksi antara kedua virus yang bersifat meningkatkan kemampuan salah satu atau kedua virus dalam proses perkembangan dan penyebaranya di dalam sel tanaman yang terinfeksi. Virus bergerak ke jaringan tanaman melalui pembuluh floem dan akan tersebar ke seluruh bagian tanaman bersamaan dengan peredaran hasil fotosintat (Hull 2002; Martin et al. 2004). CyMV dan ORSV mengganggu fungsi fiologis tanaman dengan memanfaatkan asam amino yang ada untuk proses replikasinya. Gangguan fisiologis ini menyebabkan timbulnya gejala sistemik yang muncul pada daun muda. Jadi, semakin cepat proses perkembangan dan penyebaran kedua virus di dalam sel-sel tanaman, maka gejala sistemik muncul semakin cepat dan tingkat keparahannya semakin tinggi seperti yang terjadi pada tanaman anggrek yang terinfeksi virus ganda pada penelitian ini. Berbeda dengan jenis anggrek lainya pada inokulasi virus campuran, anggrek G. scriptum menunjukkan gejala penyakit yang tidak separah bila hanya ada satu virus pada tanaman. Dari lima tanaman uji yang diinokulasi virus campuran, tiga tanaman menunjukan gejala klorosis ringan dan dua tanaman lainya tidak menunjukkan gejala. Setelah dideteksi melalui ELISA tidak ada satupun tanaman yang terinfeksi virus CyMV dan ORSV secara bersamaan, akan tetapi ORSV mampu menginfeksi tanaman dengan persentase 80%, dan infeksi CyMV tidak terjadi pada tanaman anggrek G. scriptum. Pada anggrek G. scriptum yang diinokulasi virus campuran diduga terjadi interaksi yang bersifat interferensi. Selain itu diduga tanaman anggrek G. scriptum memiliki ketahanan terhadap infeksi virus. Sehingga virus tidak dapat menimbulkan kerusakan yang cukup berarti. Menurut Walkey (1991) faktor-faktor yang dapat mempengaruhi perkembangan dan keparahan gejala penyakit adalah komposisi genetik tanaman inang dan virus, umur tanaman, dan kondisi lingkungan sebelum infeksi dan setelah infeksi. Ketika virus masuk ke dalam sel tanaman, elisitor pada virus akan berhubungan dengan reseptor pada sel tanaman untuk menentukan hubungan infeksi selanjutnya. Bila terjadi inkompatibel maka seluruh bagian tumbuhan akan 34 memberikan reaksi ketahanan yang bersifat sistemik bila diinfeksi virus, sehingga virus tidak dapat melakukan multiplikasi dan menimbulkan gejala. Apabila interaksinya kompatibel, maka virus dapat menginfeksi tumbuhan inang. Deteksi Virus pada Jaringan Tanaman Anggrek Deteksi virus berhasil dilakukan melalui uji serologi DAS-ELISA dan deteksi molekuler dengan metode RT-PCR. Reaksi positif antara antigen dan antibodi ditandai dengan perubahan warna cairan kompleks antigen dan antibodi yang terkonjugasi menjadi kuning, yang menandakan sampel yang di uji mengandung virus. Sedangkan deteksi molekuler melalui RT-PCR dari hasil visualisasi elektroforesis terlihat pita DNA CyMV berukuran 700 bp, dan pita DNA ORSV berukuran 500 bp tampak pada gel agarose setelah proses amplifikasi dengan PCR menggunakan pasangan primer reverse dan forward (Gambar 5). Hasil amplifikasi PCR ORSV ini berukuran mirip dengan hasil PCR yang dilaporkan oleh Ajjikuttira et al. (2005) yaitu berukuran 521bp. Dengan menggunakan primer yang sama, deteksi CyMV dengan PCR juga berhasil dilakukan oleh Khalimi (2008) yang menghasilkan amplikon berukuran lebih kecil daripada hasil amplifikasi PCR pada penelitian ini yaitu berukuran 672 bp. Hasil deteksi molekuler melalui RT-PCR dan deteksi serologi melalui DASELISA pada penelitian ini, memperkuat bukti bahwa metode tersebut dapat digunakan untuk mendeteksi CyMV dan ORSV yang menyebabkan tanaman anggrek bergejala mosaik, klorosis, nekrotik pada tanaman yang terinfeksi CyMV dan gejala ringspot, klorosis dan nekrotik pada tanaman yang terinfeksi ORSV. 35 M 1 2 700bp 500bp Gambar 8 Hasil amplifikasi DNA isolat CyMV dan ORSV dengan RT-PCR. M= 1 Kb DNA marker, 1= isolat ORSV, 2= isolat CyMV. KESIMPULAN Tanaman anggrek terinfeksi CyMV menunjukkan gejala klorotik membentuk cekungan dan mosaik pada bagian daun dengan pola bervariasi antar spesies tanaman anggrek. Sedangkan anggrek terinfeksi ORSV menunjukkan gejala ringspot, klorosis dan nekrotik yang timbul pada bagian daun tanaman anggrek. Kemampuan ORSV dalam menginfeksi tanaman anggrek lebih cepat dibandingkan CyMV. Anggrek C. pandurata merupakan tanaman anggrek yang mendekati imun terhadap infeksi CyMV akan tetapi rentan terhadap ORSV. Oncidium Golden Shower, dan Cattleya Blc. Lucky Man x Blc. Lijinan Pearl toleran terhadap infeksi CyMV akan tetapi rentan terhadap ORSV; D. Woxin dan G. scriptum agak resisten terhadap infeksi CyMV dan ORSV; P. violacea dan D. stratiotes merupakan tanaman anggrek yang rentan terhadap CyMV akan tetapi toleran terhadap ORSV; D. Burana Jade x D. nindii dan D. Burana Mainil Wrap x D. Strip merupakan tanaman anggrek yang agak resisten terhadap ORSV akan tetapi rentan terhadap CyMV; dan D. nindii, D. liniae, D. lasiantera, D. schulleri, D. discolor, D. Kyosimori P. amabilis merupakan jenis anggrek yang rentan terhadap infeksi CyMV dan ORSV. Sebagian besar tanaman anggrek yang diinokulasi virus campuran menimbulkan interaksi yang bersifat sinergistik pada kedua virus, kecuali pada anggrek G. scriptum yang menunjukkan interaksi yang bersifat interferensi. DAFTAR PUSTAKA Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Academic Press. Ajjikuttira P, Loh CS, Wong SM. 2005. Reciprocal function of movement proteins and complementation of long-distance movement of Cymbidium mosaic virus RNA by Odontoglossum ringspot virus coat protein. J of General Virology 86:1543–155. Akin HM. 2006. Virologi Tumbuhan. Penerbit Kanisius: Yogyakarta. [BPTP] Balai Pengkajian Teknologi Pertanian. 2005. Prospek dan arah pengembangan agribisnis anggrek. Jakarta: Departemen Pertanian. Bawden, F. C. 1964. Plant Viruses and Virus Diseases. New York: Ronald Press. Burnett H C.1974. Orchid Diseasea. Florida Departement of Agriculture and Consumer Service. Bulletin. Crowther JR 1996. Method in Molecular Biology: ELISA Theory and Practice. Vol 42. Otowa: Humana Press Darmono W. 2002. Menghasilkan Anggrek Silangan. Penebar Swadaya: Jakarta Dijkstra J, De Jagger. 1998. Practical Plant Virology: Protocol and Exercise. Boston: Springer. Falk BW, Duffus JE. 1981. Epidemiology of helper-dependent persistent aphid transmitted virus complexes. Di dalam: Marasmorosch K, Harris KF, editor. Plant Diseases and Vectors: Ecology and Epidemiology. New York: APS. Frowd JA, Tremaine JH. 1977. Cymbidium mosaic virus genomic RNA. Phytopatholog 67:43 Gibbs, AJ & B Harrison. 1976. Plant virology. London: Edward Arnold Pulb. Hadley G. Arditti M. & Arditti J. 1987. Orchid diseases a compendium. Di dalam: J. Arditti, editor. Orchid Biology, Reviews and Perspedlie. Ithaca: Cornell University Press. hlm 263-322. Hu JS, Ferreira S, Wang M, Xu MQ. 1993. Detection of Cymbidium mosaic virus, Odontoglosum ringspot virus, Tomato spotted wilt virus, and Potyviruses infecting orchid in Hawaii. Plant disease 77: 464-468. Hu JS, Ferreira S, Wang M, Xu MQ, Lu M, Iha M, Pflum E. 1994. Transmission, movement, and inactivation of Cymbidium mosaic and Odontoglosum ringspot virus . Plant disease 78: 633-636. Hull R. 2002. Matthews Plant Virology. Ed ke-4. San Diego: Academic Press. 38 Inouye N, Gara IW. 1996. Detection and identificationof virus of orchid in Indonesia. Bull, Res, Inst. Bioresour: Okayama Univ 4: 109-118. Jensen D D & A H Gold. 1951. A Virus Ringspot of Odontoglosum Orchid, Symptoms, Transmission and Electron Microscopy. In Lawson & Shfqaat Ali. The Handbook on Orchid Pest and Disease. American Orchid Soc. 4: 62-100. Khalimi K. 2008. Deteksi dan karakteristik Cymbidium Mosaic Virus (CymMV) isolat Anggrek. [tesis]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Khentry Y, Paradormuwat A, Tantiwitat S, Phansiri S, Thaveechai N. 2006. Incidence of Cymbidium mosaic virus and Odontoglossum ringspot virus in Dendrobium spp. In Thailand. Crop Protection 25: 925-932. Kondo H, Maeda T, Shirako Y, Tamada T. 2006. Orchid pleck virus is a rhabdovirus with an anual bipartite genom. Journal of General Virology . 87: 2413-2421. Kosaka Y, Fukunishi T.1997. Multiple inoculation with three attenuated viruses for the control of cucumber virus disease. Plant Dis. 81:733-738 Lawson RH, Branningam M. 1986. Handbook of Orchid Pest and Diseases. American Orchid Society: West Palm Beach. Lawson RH, Hsu HT,1995. Orchid. Di dalam: Loebenstein G, Lawson RH, Brunt AA,editor. Virus and Virus-like Diseases of Bulb and Flower Crops. Chichester, UK: John Wiley & Sons. 409-420. Lee CS, Chang CY. 2006. Multiplex RT-PCR detection of orchid viruses with an internal control of plant nad5 mRNA. Plant Pathology Bulletin 15:187-196 Martin EM et al. 2004. Novel cytopathological structures induced by mixed infection of unrelated plant viruses. Phytopathology 94:111-119. Matthews REF. 1991. Plant Virology. Ed ke-3. London: Academic Press. Matthews REF. 1992. Plant Fundamental of Plant Virology. California: Academic Press Inc. Murphy JF, Kyle MM.1995. Alleviation of restricted systemic spread pf pepper mottle potyvirus in Capsicum annum cv. avelar by coinfection with a cucumovirus. Phytopathol. 85: 561-566. Navalinskiene M, Raugalas J, Samuitiene M. 2005. Viral diseases of flower plants 16. Identification of virus affecting orchids Cymbidium Sw. Biologija 2: 2934. Noordam D. 1973. Identification of plant viruses. Methods & experiments. Wageningen: Center for Agric. Publish. And Documentation.. 39 Oku H.1994. Plant Pathogenesis and Disease Control. Boca Raton: Lewis Publishers. Sakai F, Dawson JRO. 1983. Interference in infection of tobacco protoplasts with two bromoviruses. J Gen Virol 64: 1347-1354. Setiawan H. 2005. Usaha Pembesaran Anggrek. Penebar Swadaya: Jakarta Smith, K M. 1972. A Textbook pf Plant Virus Diseases. London: Longman. Suseno H R. 1976. Virus Mosaik Cymbidium pada Cattleya spp. Di dalam Indonesia. Kongres Nasional PFI ke IV, Gambung; Bandung, 20-21 Desember. Sutarni M. 2002. Merawat Anggrek. Kanisius: Yogyakarta. Wahyuni WS. 2005. Dasar-dasar Virologi Tumbuhan. Gajah Mada University Press: Yogyakarta. Walkey DSA.1991. Applied Plant Virology. Ed ke-2. London: Chapman and Hall.s Wheeler H. 1975. Plant Pathogenesis. Berlin: Springer-Verlag Withner, C. L.1959. The Orchid. A Scientific Studies. New York: Brooklyn. Yuwono T.2006. Teori dan Aplikasi Polymerase Chain Reaction. Yogyakarta: Andi Offset. Zettler FW, Ko NJ, Wisler GC, Elliott MS, and Wong SM. 1990. Viruses of orchid and their control. Plant Dis. 74:621-626. Zhang XX, Holt J, Colvin J. 2001. Sinergism between plant viruses. A mathehatical analysis of the epidemiological implications. Plant Pathol. 50: 735-746. Zheng YX, Chen CC, Jan FJ.2008. Identification and characterization of three new Phalaenopsis orchid infecting virus. Di dalam: Program: The 1212 International Symposium on Virus Diseases of ornamental Plant ; Haarlem, 20-21 April 2008. Netherlands: 28-29.