BAB II TINJAUAN PUSTAKA A. PNEUMONIA Udara yang terhirup
advertisement

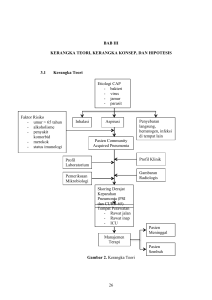
BAB II TINJAUAN PUSTAKA A. PNEUMONIA Udara yang terhirup dari lingkungan dapat terkontaminasi gas beracun, partikel dan mikroorganisme. Udara yang terkontaminasi oleh mikroorganisme membuat parenkim paru berisiko terinfeksi. Mikroorganisme masuk ke saluran napas bawah terutama lewat droplet yang terkontaminasi dan terinhalasi. Interaksi yang komplek antara virulensi dari mikroorganisme yang terinhalasi, pertahanan saluran napas, dan status imunitas dari penjamu menentukan terjadinya pneumonia (Sigh, 2012). Definisi pneumonia adalah suatu peradangan akut parenkim paru yang disebabkan oleh mikroorganisme (bakteri, virus, jamur, parasit), dan tidak termasuk pneumonia yang disebabkan oleh Mycobacterium tuberculosis. Peradangan paru selain karena mikroorganisme disebut pneumonitis (Perhimpunan Dokter Paru Indonesia, 2014). Pembagian pneumonia berdasar klinis dan epidemiologis dibedakan menjadi community acquired pneumonia (CAP), hospital acquired pneumonia (HAP), health care associated pneumonia (HCAP) dan ventilator acquired pneumonia (VAP) yang disebabkan pemasangan ventilator (Mandell et al., 2007). 1. Pertahanan Sistem Pernapasan Pertahanan sistem pernapasan garis pertama adalah bentuk fisik yang kompleks dari saluran napas atas dan bawah yang menyebabkan turbulensi aliran udara. Perjalanan aliran udara dari hidung sampai alveoli paru melewati beberapa struktur yang berkelok sehingga memungkinkan turbulensi partikel terjadi. Turbulensi udara mengakibatkan impaksi, sedimentasi dan deposisi partikel beserta mikroorganisme yang akhirnya menempel mukosa, kemudian dikeluarkan melalui lapisan mukosilier atau dikeluarkan dari saluran napas dengan bersin, batuk atau ditelan (Lambrect et al., 2011). Partikel berukuran > 10 µm tertangkap di rongga hidung, sedangkan berukuran 5-10 µm masuk ke bronkus dan percabangannya. Ukuran partikel < 3 µm masuk ke alveoli. Partikel yang terbawa dapat membawa kuman patogen dan menyebabkan infeksi paru. Pertahanan pernapasan mulai dari laring sampai bronkiolus terminalis yaitu silia dan mukus (mucociliary clearance). Pergerakan silia dan mukus yang lengket membantu pengeluaran partikel. Aktivitas dan jumlah silia dipengaruhi oleh asap rokok dan toksin (Ward et al., 2007; Lambrect et al., 2011). 2. Sistem Imun Sistem imun secara umum dibagi menjadi dua, yaitu sistem imun alamiah (bawaan) dan sistem imun adaptif. Setiap sistem imun memiliki peran dan fungsi yang berbeda dalam menjaga dan mempertahankan host dari agen-agen infeksius. Respons imun alamiah maupun adaptif mempunyai bagian humoral dan selular (Lambrect et al., 2011). Sistem Imun Alamiah Respons imun alamiah atau bawaan bertugas sebagai pertahanan pertama yang bersifat nonspesifik dalam mengiliminasi patogen yang masuk kedalam tubuh. Sistem imun alamiah mengembangkan berbagai reseptor disebut pattern recognition receptors (PRRs) yang mempunyai kemampuan mengenali secara spesifik bentuk molekuler dari patogen berupa protein mikroba atau lektin yang disebut pathogen associated molecular patterns (PAMPs). Peran PAMPs adalah membantu sistem imun alamiah bisa membedakan struktur dari tubuh sendiri (self) atau bukan (nonself) (Lambrect et al., 2011). Cluster of differentiation 14 (CD14) dan toll like receptor (TLR) termasuk PRRs sistem imun alamiah. Toll like receptor yang teridentifikasi sekitar 11 dan beberapa TLR mengenali produk bakteri yang berbeda. Toll like receptor 2 (TLR2) mengenali komponen spesifik dari Mycobacterium spp. (lipoarabinomannan), fungi (zymosan), dan bakteria gram positif (asam lipoteichoic, lipoprotein). Toll like receptor 4 (TLR4) mengenali lipopolisakarida (LPS) dari bakteri gram negatif. Respons imun alamiah membutuhkan TLR4 dalam melawan H. influenzae dan K. pneumonia. Penelitian melaporkan bahwa gangguan sinyal TLR4 meningkatkan mortalitas, mengganggu fagositosis bakterial dan penundaan ekspresi sitokin inflamasi (Craig et al., 2009). Pengenalan PAMPs oleh PRRs mengaktivasi kaskade intraselular dengan ekspresi efektor antara lain sitokin, kemokin dan molekul adhesi yang terlibat proses inflamasi. Inflamasi pada gram negatif sebagai respons TLR4 (sebagai PRRs) terhadap LPS (sebagai PAMPs) maka terjadi ekspresi sejumlah sitokin proinflamasi (TNF-α, IL-1β, IFN-γ) karena aktivasi nuclear factor-κβ (NFκβ) dalam makrofag, proses terjadi pula pada TLR2 terhadap asam teichoic organisme bakteri gram positif (antara lain Staphylococcus aureus dan Streptococcus pneumoniae) (Craig et al., 2009). Mekanisme humoral sistem imun alamiah Mekanisme respons imun alamiah humoral diperankan oleh laktoferin, lizozim, defensin, komplemen, kathelisidin dan kolektin, yang diproduksi oleh sel struktur jalan napas atau sel respons imun alamiah yang direkrut seperti netrofil dan makrofag (Lambrect et al., 2011). Aktivitas peptida antimikroba dimulai dengan: (1) masuknya mikroba; (a) interaksi elektrostatik antara dinding bakteri yang bermuatan negatif dengan peptida yang bermuatan positif; (b) kemudian dinding bakteri dan peptida berhubungan lubang insersi atau membentuk formasi carpet-like structure yang membuat distabilitas membran bakteri. (2,3) Peptida antimikroba berasal dari sel epitelial dan sel inflamasi. Defensin dan LL-37 melakukan peran sebagai mediator umpan balik kepada sel epitelial dan sel inflamasi, kemudian mengakibatkan lepasnya mediator-mediator dan proses selular (proliferasi dan kemoatraktan) yang dijelaskan pada gambar satu (Robert, 2000). Lizozim mendegradasi dinding bakteri gram negatif. Defensin diproduksi oleh netrofil (α-defensin) dan sel epitelial (β-defensin), defensin berperan membuat kebocoran di dinding bakteri, sebagai peptida antibakterial, menetralkan virus, dan merekrut sel dendritik melalui aktivasi reseptor kemokin CCR6. Peran defensin bergantung pada konsentrasi garam pada cairan di permukaan jalan napas (Lambrect et al., 2011). Gambar 1. Mekanisme aktivitas peptida antimikroba Keterangan: hBD=human β-defendin; HNP=human neutrophil peptide; SLPI= secretory leukocyte protease inhibitor; GSH=Growth Stimulating Hormone; LL-37= cathelicidin. Dikutip dari (Robert, 2000) Mekanisme selular sistem imun alamiah Respons imun alamiah selular paru terutama diperankan makrofag alveolar dan neutrofil. Mikroorganisme yang terdeposisi akan difagositosis oleh sel makrofag dan sel polimorfonuklear (PMN) yang bertugas dalam pertahanan tubuh. Sel makrofag dalam paru disebut makrofag alveolar. Sel makrofag adalah perkembangan dari sel monosit (circulating monocyte) yang diproduksi sumsum tulang.23 Sel makrofag mampu mengeluarkan substansi antigenik. Mekanisme fagositik sel makrofag terjadi karena didalam sitoplasma makrofag berisi berbagai enzim, produk metabolik dan sitokin untuk mencerna mikroorganisme dan pertahanan ruang alveolar, tetapi juga berpotensi merusak membran alveokapiler. Patogen yang masuk ke dalam paru memicu sel epithelial, makrofag, dan sel dendritik. Sel epitelial memproduksi kemokin yang merangsang netrofil untuk membantu fagositosis mikroba patogen (Toews, 2007; Lambrect et al., 2011). Proses fagositosis diawali dengan menempelnya mikroorganisme pada dinding makrofag yang berupa membran dengan bantuan suatu protein yang disebut opsonin, kemudian membran makrofag melakukan invaginasi dan membentuk cekungan untuk menelan mikroorganisme tersebut. Partikel atau mikroorganisme difagositosis melalui pembentukan fagosom sitoplasmik. Sel leukosit PMN (netrofil) berperan melawan mikroorganisme bila makrofag gagal dalam memfagositosis partikel atau mikroorganisme terutama yang berada di bagian distal paru (Djojodibroto, 2009). Gambar 2. Proses infeksi bakteri di paru dan peran netrofil. Keterangan: RBC= red blood cell. Dikutip dari (Craig et al., 2009) Netrofil mempunyai kemampuan mengenali bakteri atau komponennya, kemudian netrofil bermigrasi melewati epitel mengikuti gradien kemotaktik. Peran netrofil dalam mekanisme pertahanan paru sebagai antibakteria membutuhkan tahapan yang kompleks. Tahap awal (1) saat bakteri masuk dan berinteraksi dengan sel-sel epitelial dan makrofag, (2) memicu sekresi sitokin dan netrofil chemoattractants, (3) sitokin-sitokin dengan umpan balik positif untuk ekspresi molekul adhesi pada endotel kapiler, (4) mediasi proses migrasi netrofil ke ruang alveolar, (5) migrasi netrofil menghasilkan protease, reactive oxygen species (ROS) dan reactive nitrogen species (RNS) (6) induksi kematian sel pada sel-sel yang terinfeksi dan bila berlanjut terjadi lung injury yang luas. Proses inflamasi di paru dijelaskan pada gambar dua (Craig et al., 2009). Sistem Imun Adaptif Sistem pertahanan spesifik atau adaptif adalah respons imun terhadap antigen spesifik yang telah dikenali sebelumnya melalui sel antigen presenting cell (APC) yaitu sel dendritik. Terdapat dua macam komponen respons imun adaptif yaitu mekanisme respons imun humoral yang melibatkan limfosit B dan mekanisme respons imun selular yang melibatkan limfosit T. Limfosit B dan limfosit T mempunyai ketergantungan satu dengan yang lain dalam bekerja (Djojodibroto, 2009). Mekanisme humoral sistem imun adaptif Mekanisme respons imun humoral memerlukan aktivitas limfosit B dan antibodi yang diproduksi oleh sel plasma. Mekanisme imun humoral didalam sistem pernapasan terdapat dalam dua bentuk antibodi berupa imunoglobulin A (IgA) dan immunoglobulin B (IgB). Antibodi IgA penting dalam pertahanan tubuh terutama di nasofaring dan saluran napas bagian atas. Jumlah antibody IgA lebih banyak pada sistem pernapasan daripada dalam sirkulasi darah. Imunoglobulin G terdapat di bagian distal paru dalam jumlah sedikit dan sebagian lainnya berasal dari serum. Imunoglobulin G berperan dalam menggumpalkan partikel, menetralkan toksin yang diproduksi virus dan bakteria, mengaktifkan komplemen dan melisiskan bakteri gram negatif (Djojodibroto, 2009). Mekanisme selular sistem imun adaptif Mekanisme imun selular oleh sel T terjadi karena sensitisasi terhadap limfosit T yang menghasilkan berbagai mediator antara lain limfokin, yaitu zat yang dapat menarik dan mengaktifkan sel-sel pertahanan tubuh terutama makrofag. Limfosit T berinteraksi dengan limfosit B dalam memodifikasi produksi antibodi. Limfosit T dibedakan menjadi limfosit CD4+ (sel T Helper) dan limfosit CD8+ (sel supresor dan sel T sitotoksik). Sel T yang belum berdiferensiasi dikenal sebagai sel T naive (sel Th0) kemudian teraktivasi menjadi sel Th1 dan sel Th2. Sel Th1 mensekresi IL-2, tumor necrosis factor–β (TNF-β), dan interferon γ (IFN-γ) yang mengaktifkan fungsi fagositosis makrofag alveolar dan sel T sitotoksik . Sel Th2 mensekresi IL-4, IL-5 membantu mengaktifkan sel limfosit B memproduksi antibodi. Sel Th2 juga mensekresi IL-5 dan IL-9 yang mengaktifkan eosinofil dan sel mast. Respons imun melalui sel limfosit T disebut sistem imun selular (Baratawidjaja, 2006; Lambrect et al., 2011). B. PNEUMONIA KOMUNITAS Pneumonia komunitas atau CAP didefinisikan sebagai infeksi akut pada parenkim paru yang didapat dari komunitas. Pneumonia komunitas seringkali didapatkan dari infeksi bakteri dan berhubungan dengan klinis serta gambaran radiologis konsolidasi di satu atau kedua sisi paru. Pneumonia komunitas menjadi salah satu penyakit infeksi serius di seluruh dunia karena jumlah rawat inap dan insiden yang tinggi serta komplikasi berat yang menyertainya (Steel et al., 2013). 1. Epidemiologi Pneumonia komunitas menjadi kasus yang paling sering terjadi di negara industri dan menjadi masalah yang harus diperhatikan karena membutuhkan pembiayaan yang tinggi dalam penanganannya. Insidens pneumonia komunitas di Eropa sekitar 1,2 sampai 11,6 kasus per 1000 populasi per tahun (Viasus et al., 2013). Data di Asia menunjukkan pneumonia komunitas menyebabkan kematian sekitar 1 juta orang per tahun (Leon et al., 2014). Proporsi kasus di Indonesia 53,95% laki-laki dan 46,05% perempuan, dengan crude fatality rate (CFR) 7,6% (Perhimpunan Dokter Paru Indonesia, 2014). 2. Etiologi Etiologi pneumonia komunitas dapat disebabkan oleh berbagai mikroorganisme. Penelitian di berbagai negara melaporkan bahwa penyebab utama pneumonia komunitas adalah bakteri gram positif (Mandell et al., 2007). Lobus paru bagian bawah menjadi bagian dengan ventilasi paling baik dan menjadi tempat deposit mikroorganisme terinhalasi. Mikroorganisme patogen penyebab pneumonia komunitas secara umum diklasifikasikan menjadi tipikal dan atipikal. Penyebab tipikal tersering adalah Streptococcus pneumoniae dan penyebab atipikal adalah Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella species dan virus (Watkins et al., 2011). Data di Indonesia pada tahun 2012 menunjukkan bahwa penyebab utama pneumonia komunitas di beberapa rumah sakit adalah kuman gram negatif Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aueruginosa (Perhimpunan Dokter Paru Indonesia, 2014). 3. Patogenesis Pertahanan respirasi dari berbagai tahapan bekerja secara efektif untuk menjaga agar paru terbebas dari infeksi bakteri. Kegagalan dari mekanisme pertahanan saluran napas dan adanya faktor predisposisi pada penderita meningkatkan risiko terjadi pneumonia, kondisi dibawah ini perlu diperhatikan dalam proses pneumonia: 1. Perubahan dari flora normal orofaring. Imunoglobulin lokal terutama imunoglobulin A, komplemen dan flora normal mencegah kolonisasi orofaring dari mikroorganisme yang virulen. Malnutrisi, diabetes, alkoholisme, dan penyakit sistemik kronis lainnya menyebabkan penurunan fibronektin dan peningkatan basil gram negatif. Pemberian antibiotik berhubungan dengan supresi flora normal oral dan memfasilitasi kolonisasi bakteri gram negatif yang lebih resisten. 2. Penekanan reflek batuk dan reflek glotis. Menyebabkan aspirasi isi lambung terutama pada pasien tua, pasien dengan PPOK, penderita yang menjalani pembedahan torakoabdominal atau penyakit neuromuskular. 3. Penurunan kesadaran Kesadaran menurun meningkatkan aspirasi sekret orofaring. Penderita dengan koma, kejang, gangguan serebrovaskular dan alkoholisme sering terjadi aspirasi. 4. Gangguan mekanisme mukosilier Bersihan mukosilier yang efektif bergantung pada gerakan silier dan bentuk fisik dari mukus. Kelenjar submukosa dan sel globet di permukaan epitel memproduksi cairan dipermukaan saluran napas. Lapisan atas dari cairan ini terdiri dari gel seperti mucin dan bagian bawah terdiri dari cairan non gel. Gerakan silier membantu mukus di saluran napas bergerak ke arah mulut. Proteksi terutama oleh mukus yang melapisi epitel bersilia dari laring sampai bronkialis terminal yang terpengaruh oleh kondisi kronik seperti asap rokok, infeksi saluran napas dan udara/gas beracun. 5. Disfungsi makrofag alveolar. Monosit dalam sirkulasi darah cepat berdiferensiasi menjadi makrofag bila inflamasi terjadi dan membantu aktivitas serta fungsi makrofag alveolar. Makrofag alveolar mempunyai kemampuan sebagai sel fagosit. Sebagian besar mikroorganisme mati karena sistem lisosom makrofag alveolar. Kemampuan bakterisidal makrofag penting lainnya yaitu peran toll like receptor protein, pembentukan reactive oxygen species (ROS) dan nitric oxyde (NO). 6. Disfungsi imun. Respon imun mempunyai peran utama melawan infeksi mikroorganisme patogen. Respons imun bergantung pada pengenalan spesifik antigen oleh limfosit T dan B serta respons imun non spesifik oleh sel dendritik, makrofag, netrofil, eosinofil, dan sel mast. Kelainan granulosit, limfosit, imuno defisiensi kongenital/dapatan, terapi imunosupresan menjadi predisposisi pneumonia (Singh, 2012). 4. Patologi Perubahan patologis pada pneumonia secara umum dibagi menjadi 4 tahap, yaitu: a. Tahap kongesti Tahap kongesti terjadi permulaan respons awal dari inflamasi akut. Lobus paru yang terinfeksi akan menjadi merah karena kongesti vaskular. Netrofil dan bakteri akan terlihat dalam jumlah besar di alveoli. Tahap kongesti akan berlangsung pada 1 sampai 2 hari awal infeksi. b. Tahap hepatisasi merah. Lobus terinfeksi akan menjadi merah dan konsistensi menyerupai liver. Cairan protein berubah menjadi untaian fibrin disertai pembentukan eksudasi selular oleh netrofil. Tahap kongesti merah berlangsung 2 sampai 4 hari. c. Tahap hepatisasi abu-abu. Lobus yang terinfeksi menjadi kering dan berwarna biru karena lisis sel. Eksudasi sel netrofil berkurang seiring penurunan aktifitas sel-sel inflamasi dan makrofag tidak terlihat. Jumlah mikroorganisme berkurang. Tahap hepatisasi abu-abu berlangsung 4 sampai 7 hari. d. Tahap resolusi Berlangsungnya aktivitas enzimatik dan terbentuk lapisan fibrin. Makrofag menjadi sel utama di alveoli, terjadi reduksi cairan dan sel-sel eksudat dari alveoli dengan ekspektorasi dan drainase limfatik. Perbaikan parenkim paru selama lebih dari 3 minggu (Singh, 2012). 5. Diagnosis Anamnesis yang didapatkan pada penderita pneumonia adalah keluhan batuk dengan produksi sputum mukopurulen yang meningkat, demam, batuk, menggigil, nyeri dada pleuritik. Demam yang tinggi (>40oC), laki-laki, keterlibatan lebih dari satu lobus, gangguan neurologis atau gangguan gastrointestinal berhubungan dengan infeksi Legionella. Gambaran klinis penderita usia tua jarang terdapat gejala-gejala klasik pneumonia dan lebih pada gambaran kelemahan dan perubahan status fungsional dan mental. Kelainan dari faktor penjamu dan kemungkinan paparan patogen tertentu harus diperhatikan, seperti paparan dari pekerjaan, hewan sekitar, dan riwayat seksual (Watkins et al., 2007). Pemeriksaan fisik didapatkan demam, dullness dalam perkusi, egofoni, takikardia, dan takipnea. Suara napas asimetris, perubahan suara napas dari bronkovesikuler sampai bronkial, suara napas tambahan yaitu ronki basah halus hingga ronki basah kasar, pleural rub dan peningkatan fremitus raba meningkatkan kecurigaan pneumonia. Hasil pemeriksaan fisik pneumonia bergantung dengan luasnya parenkim yang terlibat. Takipnea sering ditemukan pada penderita pneumonia usia tua (Watkins et al., 2007). Gambaran konsolidasi berupa infiltrat pada pemeriksaan radiologis rontgen toraks posteroanterior dan lateral dibutuhkan dalam penegakan diagnosis pneumonia komunitas. Keterlibatan parenkim paru yang difus pada gambaran rontgen toraks berhubungan dengan penyebab dari infeksi Legionella dan virus (Watkins et al., 2007). Diagnosis pneumonia komunitas menurut Perhimpunan Dokter Paru Indonesia (2014) bila didapatkan infiltat baru atau penambahan infiltrat dari foto toraks ditambah 2 atau lebih gejala, yaitu: 6. - Batuk bertambah - Perubahan karakteristik dahak/purulen - Suhu tubuh ≥ 38oC atau riwayat demam - Pemeriksaan fisik ditemukan tanda konsolidasi, suara napas bronkial dan ronki - Leukosit ≥ 10.000 atau < 4.500. Penilaian Tingkat Keparahan Pneumonia Komunitas Penderajatan tingkat keparahan pada awal pasien datang di pelayanan kesehatan penderita pneumonia komunitas sangat penting untuk penatalaksanaan berikutnya. Perhitungan skor keparahan menurut Perhimpunan Dokter Paru Indonesia (2014) pada awal pemeriksaan digunakan untuk mengidentifikasi pasien pneumonia komunitas yang membutuhkan rawat jalan, rawat inap ataupun perawatan intensif. Sistem skor Pneumonia Severity Indexs (PSI) direkomendasikan oleh American thoracic society (ATS), Infectious diseases society of America (IDSA), dan British Thoracic Society (BTS). Sistem skor PSI yang dibuat oleh Pneumonia Patient Outcome Research Team (PORT) dijelaskan pada tabel satu (Mandell et al., 2007; British Thoracic Society, 2009; Perhimpunan Dokter Paru Indonesia, 2014). Tabel 1. Sistem skor PSI Karakteristik Pasien Skor Faktor demografi Umur: Laki-laki Perempuan Perawatan di rumah Umur (tahun) Umur (tahun) dikurangi 10 Umur (tahun) ditambah 10 Penyakit penyerta Keganasan Penyakit hati Gagal jantung kongestif Penyakit serebrovaskular Penyakit ginjal 30 20 10 10 10 Temuan pemeriksaan fisik Perubahan status mental Frekuensi napas ≥30/menit Tekanan darah sistolik ≤90 mmHg Suhu tubuh <35oC atau ≥40oC Denyut nadi >125/menit 20 20 20 15 10 Temuan laboratorium dan radiologi pH darah arteri <7,35 Blood urea nitrogen>30 mg/dl Sodium <130 mmol/L Glukosa >250mg/dl Hematokrit <30% Tekanan parsial oksigen arteri ≤60 mmHg Efusi pleura 30 20 20 10 10 10 10 Dikutip dari (Mandell et al., 2007) Tingkat keparahan pneumonia sesuai PSI memperhitungkanfaktor demografi, penyakit penyerta, temuan pemeriksaan fisik, laboratorium dan radiologi. Skor PSI kemudian dimasukkan dalam klasifikasi risiko mortalitas dan klasifikasi perawatan ke rawat jalan atau rawat inap, dijelaskan pada tabel dua (Mandell et al., 2007). Tabel 2. Klasifikasi risiko mortalitas dan perawatan berdasarkan PSI Kelas risiko Jumlah poin I ..(Ringan) II (Ringan) III (Ringan) (usia < 50 tahun, tidak ada penyakit penyerta dan abnormalitas tanda vital) ≤ 70 71-90 IV (Sedang) V (Berat) 91-130 > 130 Mortalitas 30 hari (%) 0,1 Perawatan Rawat jalan 0,6 2,8 Rawat jalan Rawat jalan atau rawat inap 8,2 Rawat inap 29,2 Rawat inap Dikutip dari (Mandell et al., 2007) Menurut pedoman diagnosis dan tatalaksana pneumonia komunitas Perhimpunan Dokter Paru Indonesia (2014) maka kriteria untuk indikasi rawat inap adalah : 1. Skor PORT lebih dari 70 2. Skor PORT ≤ 70 tetap memerlukan rawat inap bila memenuhi salah satu dibawah : - Frekuensi napas > 30 x/menit - PaO2/FiO2 < 250 mmHg - Foto toraks menunjukkan kelainan bilateral - Foto toraks melibatkan > 2 lobus - Tekanan sistolik < 90 mmHg - Tekanan diastolik < 60 mmHg Menurut IDSA/ATS (2007) kriteria diagnosis pneumonia berat bila didapatkan salah satu atau lebih kriteria dibawah ini : Kriteria minor: Frekuensi napas ≥ 30 kali/menit PaO2/FiO2 ≤ 250 mmHg Foto toraks melibatkan infiltrat multilobus Kesadaran menurun/disorientasi Uremia (BUN≥ 20 mg/dl) Leukopenia (leukosit < 4000 sel/mm3) Trombositopenia ( trombosit <100.000 sel/mm3) Hipotermia (suhu <36oC) Hipotensi yang memerlukan resusitasi cairan agresif. Kriteria mayor: Membutuhkan ventilasi mekanis Syok septik yang memerlukan vasopresor Pasien yang memerlukan ruang rawat intensif (ICU) adalah: Pasien syok septik yang membutuhkan vasopresor atau mengalami acut respiratory distress syndrome yang membutuhkan intubasi dan ventilasi mekanis Pasien dengan 3 gejala minor pneumonia berat. C. ZINK Peran penting zink untuk manusia diketahui sekitar 50 tahun lalu. World Health Organization (WHO) memperkirakan hampir 2 milyar orang terutama di negara berkembang mengalami defisiensi zink. Manifestasi klinis defisiensi zink antara lain gangguan pertumbuhan, disfungsi imun, peningkatan oksidatif stres dan peningkatan sitokin proinflamasi. Zink adalah zat gizi esensial yang berperan penting dalam regulasi respons imun terhadap berbagai penyakit infeksi (Prasad et al., 2004; Prasad, 2014). Sumber dan Bioavaibiliti Zink Sumber utama dari diet yang mengandung zink tinggi antara lain daging merah, makanan dari hasil laut, buah, sayuran segar dan produk dari pengolahan susu. Zink dapat ditemukan di berbagai makanan lainnya antara lain biji-bijian, kacang-kacangan, dan padipadian. Zink didistribusikan secara luas ke seluruh tubuh dalam bentuk ion intraselular dalam jumlah kecil dan dijumpai di dalam darah. Zink diabsorpsi terutama di duodenum dan yeyunum proksimal. Zink dieksresikan terutama melalui feses dan dalam jumlah kecil melalui keringat, urin, kulit yang deskuamasi (Arisman, 2010). Bahan makanan yang dapat membantu penyerapan zink antara lain asam askorbat, asam sitrat (pepaya, jambu, pisang mangga, semangka, pir), asam malak dan tartrat (kentang, wortel, labu, tomat), bahan makanan dari fermentasi (kecap, acar). Makanan yang dapat menghambat penyerapan antara lain polifenol (teh, kopi, bayam), kalsium dan fosfat (susu, keju) (National Institutes of Health, 2013). Bioaviabiliti zink dipengaruhi oleh kebutuhan sistemik. Pengaturan diet yang adekuat harus tersedia agar kebutuhan zink untuk berbagai proses metabolisme tubuh terpenuhi. Diet yang tidak adekuat akan menyebabkan tubuh mengubah zink endogen. Zink dapat menghambat penyerapan beberapa antibiotik antara lain penisiilamin, tetrasiklin dan kuinolon. Penyerapan zink dihambat suplemen yang mengandung besi dan fitat yang ditemukan dalam biji-bijian dan kacang-kacangan, sehingga pemberian zink harus dipisahkan minimal 2 jam (Hidayat, 1999). Kebutuhan Zink Kebutuhan zink yang direkomendasikan menurut Food And Nutrition Board dari USA National Academy of Science menetapkan diet zink adalah 15 mg/hari untuk laki-laki dewasa dan 12 mg/hari untuk wanita dewasa. Batas atas penggunaan zink menurut Food and Nutrition (2001) pada orang dewasa baik laki-laki maupun perempuan adalah 40 mg. Kebutuhan zink di Indonesia menurut Angka Kecukupan Gizi (AKG) sesuai rekomendasi Widya Karya Nasional Pangan dan Gizi XI Tahun 2012 adalah laki-laki dewasa adalah 13 mg/hari dan wanita dewasa 10 mg/hari (Kementrian Kesehatan Republik Indonesia, 2015). Efek Samping dan Toksisitas Zink Efek samping yang pernah dilaporkan pada pemberian zink lebih dari 40 mg antara lain nausea, muntah, diare, metallic taste, rasa tidak nyaman di lambung dan pada beberapa kasus dapat mengurangi absorbsi zat besi sehingga terjadi anemia (Maret et al., 2006). Tanda keracunan zink yang telah dilaporkan dengan dosis 150 mg hingga 450 mg/hari yang menyebabkan gejala mual, muntah, demam, diare dan kram perut (Lewis et al., 1998). Suplemen terapi zink dapat berbentuk zink asetat, zink glutamat, sitrat dan zink karbonat. Zink sulfat paling banyak digunakan oleh peneliti dan hasil penelitian menunjukkan tidak ada hubungan antara jenis suplemen dengan pertumbuhan (Maret et al., 2006). Peran Zink Zink berpotensi sebagai suplemen terapi dalam penatalaksanaan pneumonia komunitas karena perannya sebagai anti inflamasi dan respons anti mikrobial. Defisiensi zink dalam beberapa penelitian disebutkan menjadi faktor risiko terjadinya penyakit infeksi seperti pneumonia dan suplementasi zink berpotensi dengan menurunkan derajat keparahan sebagai tambahan pemberian antibiotik konvensional (terapeutik) menurunkan morbiditas dan mortalitas pneumonia komunitas (Stafford et al., 2013). 1. Peran zink pada fungsi imun dan pertahanan tubuh Sistem imun membutuhkan mikronutrien esensial seperti zat besi, zink, selenium dan copper agar fungsinya optimal. Defisiensi elemen mikronutrien mengakibatkan supresi pada aktivitas sel pada sistem imun bawaan dan adaptif dengan mempengaruhi fungsi atau penurunan jumlah sel imun yang kemudian berpengaruh pada peningkatan morbiditas dan mortalitas pada infeksi virus, bakteri dan parasit (Stafford et al., 2013). Zink sangat dibutuhkan dalam pertumbuhan dan perkembangan sebagian besar organisme. Defisiensi zink pertama kali dilaporkan sekitar 50 tahun lalu pada sebuah kasus klinis seorang pasien laki-laki dengan anemia berat dan gangguan pertumbuhan di Iran (Timur Tengah), selain itu pasien juga mengalami defisiensi sistem imun yang mengakibatkan infeksi dan kematian pasien. Penelitian Beck dkk menyatakan bahwa defisiensi zink pada manusia mengakibatkan ketidakseimbangan sel T helper1 (Th1) dan T helper2 (Th2) ditandai dengan penurunan sel Th1, tetapi defisiensi zink tidak berpengaruh pada Th2. Penurunan Th1 mengakibatkan penurunan produksi interferon γ (IFN γ), interleukin-2 (IL-2), dan sekresi TNF-α (Stafford et al., 2013). 2. Zink sebagai antiinflamasi Respons imun terhadap inflamasi diperlukan suatu sinyal molekuler. Peran utama dalam faktor trankripsi respons imun pada sitokin inflamasi yang melibatkan sinyal molekuler oleh nuclear factor-κβ (NFκβ). Zink mempunyai peran penting dalam regulasi aktivasi NFκβ (Prasad, 2004). Zink diperlukan oleh ikatan deoxyribose nucleid acid (DNA) dengan NFκβ murni atau NFκβ rekombinan protein p50 dalam lapisan sel T helper (Th) (Prasad et al., 2001). Zink menghambat aktivasi NFκβ melalui protein A20 yang diperantarai jalur TNFreceptor associated factor (TRAF) kemudian menghambat NFκβ inducible kinase (NIK). Zink yang menghambat aktivasi NFκβ melalui A20 akan menurunkan regulasi pembentukan IL-1β dan TNF-α di sel endothelial. Zink mempunyai jalur lain dalam menghambat aktivasi NFκβ yaitu melalui reseptor nukleus yaitu peroxisome proliferator activated receptor-α (PPAR-α), yang berperan sebagai mediator metabolisme lipoprotein dan inflamasi (Bao et al., 2010) Reactive oxygen spesies (ROS) terinduksi oleh banyak stimulus oleh LDL yang teroksidasi (oxLDL) di makrofag dan sel vaskular sel endothelial. ROS dan oxLDL dapat mengaktivasi apoptosis sel melalui jalur aktivasi enzim proapoptosis dan jalur NFκβ inducible kinase (NIK). Zink mempunyai peran atheroprotective dengan melalui beberapa mekanisme, pertama melalui inhibisi pembentukan ROS melalui jalur metallothionein (MT), superoxide dismutase (SOD) dan nicotinamide adenine dinucleotide phosphate (NADPH); mekanisme kedua adalah regulasi umpan balik negatif pada sitokin atau molekul pembentuk aterosklerosis antara lain sitokin proinflamasi (IL-1β, IL-6, IL-8, TNF-α, MCP-1), molekul adhesi (VCAM-1), enzim (iNOS, COX2), fibrinogen dan tissue factor (TF) melalui inhibisi aktivasi NFκβ oleh sinyal A20-mediating tumor necrosis factor (TNF)-receptor associated factor (TRAF) dan melalui sinyal crosstalk peroxisome proliferator activated receptor-α (PPAR-α). Berbagai peran zink dijelaskan pada gambar tiga (Prasad et al., 2008). Gambar 3. Jalur zink dalam mencegah aterosklerosis dan inflamasi di makrofag dan vaskular sel endothelial. Keterangan: TNF-α= Tumor necrosis factor-α; PPAR-α= peroxisome proliferator activated receptor-α; ROS=reactive oxygen spesies; oxLDL=oxidixed low density lipoprotein; NIK= NFκβ inducible kinase;CRP= C-reactive protein; IKK= I-κβ kinase; IL= interleukin; MCP-1=macrophage chemoattractant protein 1; ICAM-1= intercell adhesion molecule 1; VCAM-1= vascular cell adhesion molecule 1; TRAF= TNF-receptor associated factor; TF= tissue factor; iNOS= inducible nitric oxide synthase; NFκβ= nuclear factor κβ; MT= metallothionein; SOD= superoxide dismutase; NADPH= nicotinamide adenine dinucleotide phosphate. Dikutip dari (Prasad et al., 2008) 3. Zink meningkatkan respons antimikroba Efek defisiensi zink atau suplementasi zink di beberapa penelitian penyakit infeksi dilaporkan mempengaruhi jumlah atau fungsi dari makrofag. Pemberian suplementasi zink pada penelitian dengan infeksi T. Cruzi ,E.coli dan Staphylococcus aureus menghasilkan peningkatan aktivitas fagositosis makrofag peritoneal. Penelitian lain melaporkan makrofag mengaktivasi sitokin TNF-α dan IFN-γ untuk mendorong akumulasi zink di fagolisosom makrofag sehingga meningkatkan respons antimikrobial pada infeksi Mycobacterium avium (Prasad et al., 2008). Gambar 4. Perjalanan zink, sinyal inflamasi dan respons antimikrobial pada makrofag Keterangan: Zn2+ = zinc; TLR = toll like receptor; MAPK = mitogen activated protein kinase; NFκβ=nuclear transcription factor-κβ;Nrf2=nuclear factor erythroid 2 related factor 2; MT=metallothionein. Dikutip dari (Andreini et al., 2006) Sinyal toll like receptor 4 (TLR4) memacu akumulasi zink bebas secara cepat bersamaan dengan makrofag yang merupakan efek importir zink yaitu SLC39a8 dan redistribusi zink yang tersimpan di intraselular. Zink dibutuhkan oleh banyak respons sinyal TLR dan aktivasi pannexin-1 dependent inflammasome. Zink pada level yang tinggi dapat menghambat jalur sinyal inflamasi pada makrofag antara lain menghambat IKκβ, promosi aktivasi Nrf2 dan protein A20. Sinyal TLR memodulasi ekspresi beberapa gen zink transport dan memobilisasi penyimpanan zink intraselular. TLR-induced SLC30A mendorong efluk zink kemudian mengantarkan zink ke fagosom dan vesikel intraselular lainnya untuk aktivasi respons antimikrobial. Transport zink, sinyal inflamasi dan respons antimikrobial pada makrofag dijelaskan pada gambar empat (Andreini et al., 2006). Peran Zink Pada Pneumonia Potensi zink dalam penatalaksanaan pneumonia komunitas antara lain berperan sebagai antiinflamasi dan respons antimikrobial. Suplementasi zink berpotensi dengan menurunkan derajat keparahan sebagai tambahan pemberian antibiotik konvensional (terapeutik) menurunkan morbiditas dan mortalitas pneumonia komunitas (Stafford et al., 2013). Zink merupakan mikro mineral penting karena efek sitoprotektif antara lain antiinflamasi, dan antioksidan pada sel-sel pernapasan. Defisiensi zink dihubungkan dengan atrofi timus, limfopenia dan penurunan respons imun termediasi sel dan antibodi (Field et al., 2002). Zink berperan penting dalam regulasi respons imun terhadap berbagai penyakit infeksi (Prasad, 2014). Penelitian lainnya yang pernah meneliti tentang terapi tambahan zink pada pneumonia antara lain penelitian Brooks et al (2003) di Bangladesh terhadap 270 anak usia 2-23 bulan dengan pneumonia berat yang mendapat suplementasi zink 20 mg/hari selama 5 hari perawatan di rumah sakit, hasil penelitian menyatakan bahwa zink dapat mempercepat masa penyembuhan pneumonia (dinilai dari durasi retraksi dada, laju napas >50x/menit, dan hipoksia) sebesar 0,7 (95% CI 0,51-0,98) disertai perbaikan konsentrasi zink serum dari 10,1 μmol/L menjadi 14,5 μmol/L (p <0,0001) (Ngom et al., 2011). Suplementasi zink elemental 45 mg/hari dalam bentuk glukonat selama 12 bulan pada sejumlah kecil lansia (usia 55-87 tahun) secara signifikan menurunkan insidens semua infeksi, termasuk infeksi saluran napas (Prasad et al., 2008). Penelitian Srivasan et al tahun 2012 pada anak dengan pneumonia berat menyatakan pemberian terapi tambahan zink dapat mengurangi case fatality (Prasad, 2014). Penulis dalam penelitian menggunakan dosis 15 mg/hari berdasarkan rekomendasi kebutuhan zink di Indonesia menurut Angka Kecukupan Gizi (AKG) oleh Widya Karya Nasional Pangan dan Gizi XI Tahun 2012 (laki-laki dewasa adalah 13 mg/hari dan wanita dewasa 10 mg/hari) dan rekomendasi menurut Food And Nutrition Board dari USA National Academy of Science (diet zink 15 mg/hari untuk laki-laki dewasa dan 12 mg/hari untuk wanita dewasa). Batas atas penggunaan zink menurut Food and Nutrition tahun 2001 pada orang dewasa baik laki-laki maupun perempuan adalah 40 mg. Pemberian terapi zink dalam penelitian ini diberikan selama 5 hari untuk melihat pengaruhnya pada perbaikan klinis dan kadar biomarker yaitu endothelin-1 dan TNF-α penderita pneumonia. Hasil penelitian yang menjadi pembanding adalah penelitian Brooks et al (2003) selama 5 hari perawatan di rumah sakit yang menyatakan bahwa zink dapat mempercepat masa penyembuhan pneumonia. Pengambilan sampel dilakukan pada hari pertama dan hari ke-5, yang menjadi pembanding adalah hasil penelitian sebelumnya oleh Antunes et al (2002) dan Calbo et al (2008) yang menyatakan bahwa kadar TNF-α penderita pneumonia mengalami perubahan yang signifikan sesuai keparahan penyakit pada hari 5 setelah perawatan. D. TUMOR NECROSIS FACTOR –α (TNF-α) Tumor necrosis factor (TNF) diidentifikasi pertama kali pada tahun 1975 sebagai endotoxin induced glycoprotein yang menyebabkan nekrosis hemoragik pada sarkoma yang telah ditranplantasikan di tikus coba. Tumor necrosis factor diketahui mempunyai implikasi yang luas pada proses inflamasi, infeksi dan malignansi. Tumor necrosis factor (TNF) terdiri dari dua jenis, yaitu TNF-α dan TNF-β. Tumor necrosis factor alfa ditemukan sekitar tahun 1990 oleh William Coley. Limfosit Th1 menghasilkan TNF-β yang kurang berperan dalam proses inflamasi (Bradley, 2008). Tumor necrosis factor-α adalah sitokin yang berperan dalam proses keradangan dan sepsis, TNF-α dikendalikan oleh kromosom nomer 6 yang terdapat pada komplek gen MHC atau HLA. Tumor necrosis factor alfa adalah penanda (biomarker) yang baik adanya respons endotoksin dan meningkat setelah 90 menit dari rangsangan tersebut. Konsentrasi normal TNF-α dalam serum adalah < 35 pg/ml dan menjadi > 240 pg/ml dalam keadaan sepsis (Hermawan, 2008). Tumor necrosis factor-α dapat memproduksi panas secara langsung dengan aksi hipotalamik melibatkan pelepasan prostaglandin E2. Tumor necrosis factor alfa menyebabkan efek langsung pada sel endotel antara lain IL-1 dan mempunyai efek antiviral yang bekerja sinergis dengan interferon (Baratawidjaja, 2006). Jalur sinyal tranduksi TNF-α sangat komplek dan belum diketahui sepenuhnya. Regulasi trankripsi dari NFκβ adalah komponen kunci sinyal tranduksi TNF-α. Aktivitas biologis TNF-α terutama dihasilkan oleh sel makrofag dan sel-sel jenis lainnya dengan berbagai aktivitas biologi pada sel-sel sasaran yang termasuk sistem imun maupun bukan (Bradley, 2008). Sitokin dapat dimanfaatkan sebagai penanda (biomarker) untuk memprediksi suatu keadaan klinis bila diinterpretasikan bersama data klinis dan sistem skor seperti keparahan pneumonia dari pneumonia severity index (PSI). Hubungan antara peningkatan level sitokin pada infeksi dan gambaran klinisnya belum diketahui sepenuhnya. Bacci et al (2015) melaporkan level TNF-α berkorelasi dengan inteleukin-6 (IL-6) pada hasil penatalaksanaan penderita pneumonia komunitas. Level yang tinggi TNF-α dan IL-6 pada saat pasien pneumonia komunitas mulai masuk rumah sakit dapat menjadi prediktor outcome yang buruk (mortalitas) (Bacci et al., 2015). . Mikroorganisme Bakteri Gram + Bakteri Gram - LTA, eksotoksin LPS, endotoksin Gram positif TLR-2 TLR-4 APC Makrofag CD 14 OxLDL NFKβ ROS MHC II IFN-γ IL-4 CD4+ Th Th O IL-10 TNF-α IL-8 IL-6 IL-5 Th IL-6 IL-1β ` netrofil Sel Sel T sitotoksik Sel Endotel ICAM-1 NO elastase Endothelin-1 Pneumonia IgG PGE-2 Sel NK Opsonisasi fagositosis sel NK Gambar 7. Kerangka teori yang menjelaskan proses infeksi pneumonia komunitas. Keterangan: = variabel yang diteliti. = proses Singkatan :LPS= lipopolysaccharide, LTA=lipotheichoic acid, TRAF= TNF-receptor associated factor, APC=antigen presenting cell, MHC= major histocompatibility complex, CD=cluster of differentiation, TLR= toll like receptor, Mo= mikrobiologi, Gr= gram, KR= kultur resistensi. PGE2= prostaglandin E2, NK= natural killer, NO=nitric oxide, ICAM-1=intercellulare adhesions molecule-1 E. KERANGKA KONSEPTUAL Pneumonia komunitas disebabkan karena mikroorganisme terutama berupa bakteri gram negatif atau bakteri gram positif. Antigen bakteri gram negatif berupa lipopolysaccharide binding protein (LPS), sedangkan antigen bakteri gram positif berupa lipoteichoic acid (LTA). Toll like receptor 2 (TLR2) mengenali komponen spesifik dari bakteri gram positif yaitu LTA, kemudian LTA berperan sebagai superantigen kemudian difagosit oleh makrofag yang berperan sebagai APC. Antigen tersebut membawa muatan polipeptida spesifik yang berasal dari MHC II, kemudian berikatan dengan CD4+ melalui reseptor limfosit T / T cell receptor (TCR). Sel T yang teraktivasi akan mengekpresikan sitokin dari Th1 yaitu IFN-γ dan IL-2. T helper 2 akan mengekspresikan IL-4, IL-5, IL-6 dan IL-10.Interferon-γ merangsang makrofag mengeluarkan IL-1β, TNF-α, IL-6, IL-8, dan IFN-γ. Toll like receptor 4 (TLR4) mengenali LPS dari bakteri gram negatif terjadi kemudian ditransfer ke CD14. Inflamasi pada gram negatif sebagai respons TLR4 (sebagai PRRs) terhadap LPS (sebagai PAMPs) maka terjadi ekspresi sejumlah sitokin proinflamasi (TNF-α, IL-1β, IFN-γ) karena aktivasi nuclear transcription factor-κβ (NFκβ) dalam makrofag, proses terjadi pula pada TLR2 terhadap asam teichoic organisme bakteri gram positif. Endothelin-1 adalah peptida vasokonstriktor yang disekresi di paru dari sel endotelial vaskular, epitel saluran napas, otot polos vaskular dan berbagai sel lain.Pengaturan sekresi ET-1 pada tingkat transkripsi dipengaruhi oleh stimulus seperti hipoksia, sitokin (IL-2, IL1β, TNF-α, IFN-β), lipopolisakarida dan beberapa faktor pertumbuhan (transforming growth factor-β, platelet derived growth factor, epidermal growth factor) yang menginduksi transkripsi ET-1 oleh messenger ribo nucleid acid (mRNA) dan sekresi protein. Peran penting endothelin-1 dalam proses infeksi yaitu sebagai proinflamasi. Endothelin-1 menarik netrofil, mengaktifkan sel mast dan menstimulasi monosit untuk memproduksi berbagai sitokin proinflamasi. Ekspresi ET-1 sebagai mitogen regulator potensial dalam merangsang otot polos dan mediator proinflamasi yang mempunyai peran pada proses infeksi pneumonia komunitas. Interleukin-1β berperan sebagai mayor imunomodulator pada endotel untuk merangsang prostaglandin-E2(PGE2), plasminogen activator inhibitor-1 (PAI-1), dan merangsang ekspresi intercellular adhesion molecule-1 (ICAM-1) yang menyebabkan netrofil yang telah tersensitasi akan mudah mengadakan adhesi. Netrofil yang beradhesi dengan endotel akan mengeluarkan lisozim yang menyebabkan endotel lisis dan menyebabkan permeabilitas vaskuler meningkat, sehingga terjadi edema cairan kaya protein ke dalam paru. Endotel vaskuler mempunyai peranan yang sangat penting dalam pertahanan tubuh terhadap invasi mikroba dan juga dalam terjadinya sepsis. Aktivasi endotel tidak hanya meyebabkan terjadinya adhesi dan migrasi sel imun yang teraktivasi, tetapi juga menyebabkan kebocoran molekul-molekul besar, sehingga menghasilkan oedema jaringan. Stimulasi endotel menyebabkan produksi NO dan endothelin-1. Zink merupakan zat gizi esensial yang memegang peran penting dalam berbagai fungsi tubuh, termasuk regulasi respons imun terhadap berbagai penyakit infeksi. Zink berpotensi sebagai suplemen terapi dalam penatalaksanaan pneumonia komunitas karena perannya sebagai antiinflamasi dan respons antimikrobial. Peran utama dalam faktor trankripsi respons imun pada sitokin inflamasi yang melibatkan sinyal molekuler oleh nuclear transcription factor-κβ (NFκβ). Peran zink sebagai antiinflamasi terletak pada regulasi aktivasi NFκβ. Zink diperlukan oleh ikatan deoxyribose nucleid acid (DNA) dengan NFκβ murni atau NFκβ rekombinan protein p50 dalam lapisan sel T helper (Th). Messenger ribo nucleid acid (mRNA) dan TNF-α menginduksi ikatan NFκβ dengan DNA di dalam selsel mononuklear darah tepi. Regulator NFκβ yaitu protein A20 sebagai inhibitor aktivasi. Zink menginduksi ekspresi umpan balik positif protein A20. Zink menghambat aktivasi NFκβ melalui A20 yang akhirnya akan menurunkan regulasi pembentukan IL-1β dan TNFα di sel endothelial. Inhibisi aktivasi NFκβ oleh sinyal A20-mediating tumor necrosis factor (TNF)-receptor associated factor (TRAF) dan melalui sinyal crosstalk peroxisome proliferator activated receptor-α (PPAR-α). Umpan balik negatif aktivasi NFκβ oleh zink melalui jalur sinyal A20-PPAR-α menghasilkan penurunan pembentukan sitokin proinflamasi di sel endothelial, termasuk menurunkan kadar endothelin-1 dan kadar TNF-α dalam plasma. Zink mempunyai peran antioksidan melalui beberapa mekanisme, yang pertama melalui inhibisi pembentukan ROS melalui jalur metallothionein (MT), superoxide dismutase (SOD) dan nicotinamide adenine dinucleotide phosphate (NADPH). Peran zink pada aktivasi respons antimikrobial yaitu pemberian zink mempengaruhi sinyal TLR memodulasi ekspresi beberapa gen zink transport dan memobilisasi penyimpanan zink intraselular. TLR-induced SLC30A mendorong efluk zink kemudian mengantarkan zink ke fagosom dan vesikel intraselular lainnya untuk aktivasi respons antimikrobial, yaitu peningkatan fagositosis mikroba. Kadar TNF-α plasma akan menurun karena kematian mikroba dan penghambatan aktivasi NFκβ karena pemberian terapi tambahan zink. Perbaikan klinis penderita dinilai berdasarkan kriteria kondisi klinis stabil. Kondisi klinik stabil adalah tanda vital stabil, oksigenasi adekuat dalam udara ruangan, dapat mempertahankan oral intake, dan kondisi mental kembali pada keadaan normal. Kerangka konseptual secara ringkas terlihat pada gambar 8 dibawah ini. Mikroorganisme Bakteri Gram + Bakteri Gram Zin k LPS, endotoksin PPAR α Cross talk NADPH SOD,MT LTA, eksotoksin TLR-2 Gram positif TLR-4 APC A20 Jalur TRAF Makrofag CD 14 oxLDL ROS ` MHC II CD4+ IFN-γ NFKβ Th1 Th2 IL-8 TNF-α A R E A P E N E L I T I A N Netrofil Elastase epitel saluran napas otot polos vaskular otot polos saluran napas Kriteria Klinis Stabil Gambar 8. Kerangka konseptual yang menjelaskan hubungan antara pemberian zink pada kadar TNF-α plasma dan perbaikan klinis pada penderita pneumonia komunitas. Keterangan: = variabel yang diteliti. = proses = menurun = menghambat Singkatan : LPS= lipopolysaccharide, LTA=lipotheichoic acid, TRAF= TNF-receptor associated factor, APC=antigen presenting cell, MHC= major histocompatibility complex, CD=cluster of differentiation, TLR= toll like receptor, Mo= mikrobiologi, Gr= gram, KR= kultur resistensi. F. HIPOTESIS. 1. Pemberian zink selama 5 hari berpengaruh menurunkan kadar TNF-α serum penderita pneumonia. 2. Pemberian zink selama 5 hari berpengaruh pada perbaikan klinis penderita pneumonia. 3. Terdapat korelasi negatif antara perbaikan klinis dengan kadar TNF-α serum setelah pemberian zink selama 5 hari penderita pneumonia.