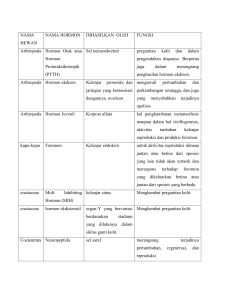
BETINA UNTUK MERANGSANG PEMIJAHAN
advertisement

PERAN IKAN MAS (Cyprinus carpio L.) BETINA UNTUK MERANGSANG PEMIJAHAN IKAN TAWES (Barbonymus gonionotus B.) DALAM METODE CANGKRINGAN LITA MASITHA SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2013 PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA* 1 Dengan ini saya menyatakan bahwa tesis “Peran Ikan Mas (Cyprinus carpio L.) Betina untuk Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dalam Metode Cangkringan” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor. Bogor, Januari 2013 Lita Masitha NIM 100211 * Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait. RINGKASAN LITA MASITHA. Peran ikan mas (Cyprinus carpio L.) betina untuk merangsang pemijahan ikan tawes (Barbonymus gonionotus B.) dalam metode Cangkringan. Dibimbing oleh MUHAMMAD ZAIRIN JUNIOR, MUHAMMAD AGUS SUPRAYUDI dan RUDHY GUSTIANO Pemijahan ikan secara alami lebih banyak memberikan keuntungan dibanding dengan kawin suntik. Metode Cangkringan merupakan salah satu cara pemijahan ikan secara alami. Metode ini dilakukan dengan memijahkan ikan mas di dalam hapa dan ikan tawes di luar hapa, dimana ikan tawes akan memijah setelah ikan mas memijah. Pada metode di atas terjadi stimulasi dari ikan mas ke ikan tawes. Stimulasi yang bekerja kemungkinan besar diakibatkan oleh semacam feromon yang dilepas oleh ikan mas. Penggunaan feromon pada pemijahan ikan, memiliki nilai praktis yang sangat tinggi karena dapat diterapkan tanpa menangani ikan sehingga meniadakan stres, dan merangsang proses endogenus normal sehingga mengeliminir kegagalan dalam pembuahan dan hanya bekerja pada induk yang benar-benar matang. Stimulasi pemijahan dengan feromon sangat potensial untuk dikembangkan pada ikan yang biasa memijah secara masal. Keterlibatan feromon pada pemijahan ikan mas dengan metode Cangkringan, dapat menimbulkan respon primer dan atau respon pelepas pada ikan tawes, yang selanjutnya menyebabkan pemijahan pada ikan tawes. Metode ini bersifat alami, lebih efektif dan lebih aman dibandingkan dengan metode kawin suntik. Pada metode kawin suntik, baik dengan teknik hipofisasi maupun dengan menggunakan hormon gonadotropin lain memiliki beberapa kelemahan. Kelemahan pada teknik hipofisasi antara lain hilangnya ikan donor karena diambil hipofisisnya, standarisasi kandungan ekstrak kelenjar hipofisis ikan sukar dilakukan karena terlalu banyak hormon yang terlibat, ada kekhawatiran akan terjadi interaksi antar hormon-hormon yang ada, dan penyakit dapat menular dengan mudah dari ikan donor ke ikan resipien. Pemijahan dengan metode Cangkringan juga memiliki beberapa kelebihan antara lain induk tidak mengalami stres karena penanganan sehingga resiko mortalitas kecil, induk ikan mas dapat digunakan sebagai perangsang untuk beberapa kali pemijahan, dan metode Cangkringan memberikan alternatif untuk pengembangan feromon sebagai perangsang. Namun, sampai saat ini belum diketahui peran ikan mas betina dalam merangsang pemijahan ikan tawes dengan metode Cangkringan. Metode ini perlu dikembangkan untuk menemukan feromon yang dapat dijadikan sebagai perangsang pada pemijahan ikan. Penelitian ini bertujuan untuk mengevaluasi peran ikan mas betina dalam merangsang pemijahan ikan tawes dalam metode cangkringan. Setiap pasang induk ikan tawes ditempatkan dalam wadah yang sama dengan 3 ekor ikan mas baik disuntik atau tidak disuntik ovaprim sebagai pengimbas dengan komposisi ♂♂♀ tidak disuntik (A), ♂♂♀ disuntik (B), ♂♂ tidak disuntik dan ♀ disuntik (C), ♀♀♀ disuntik (D) dan ♀♀♀ tidak disuntik (E). Pengambilan contoh telur dilakukan sebelum penyuntikan pertama dengan teknik kanulasi. Hasil pengamatan menunjukkan bahwa rata-rata diameter telur ikan mas berkisar 0.99– 1.96 mm, sedangkan rata-rata diameter telur ikan tawes berkisar 0.67–0.75 mm. Hasil penelitian ini menunjukkan bahwa yang bertindak sebagai pengimbas pada pemijahan ikan dengan metode cangkringan ini adalah ikan mas karena ikan tawes mijah jika ada ikan mas yang mijah. Ikan tawes tidak memijah mendahului ikan mas. Pengaruh pemijahan ikan mas pada ikan tawes dapat disebabkan baik oleh pasangan ikan mas heteroseks ♂♂♀) ( yang berovulasi maupun pasangan monoseks betina ♀♀♀) ( yang berovulasi . Pencapaian interval waktu imbas tercepat pada pemijahan ikan tawes secara alami karena pengaruh pemijahan ikan mas secara berturut-turut ditunjukkan oleh perlakuan B3 yaitu 6 jam 55 menit, E3 yaitu 6 jam 58 menit, dan C3 yaitu 8 jam 5 menit. Derajat pemijahan ikan tawes tertinggi diperoleh pada perlakuan B yaitu sebesar 100% kemudian perlakuan D, E, C dan A masing-masing sebesar 66.7%, 66.7%, 33.3% dan 0%. Hasil analisis hormon testosteron dan estradiol menunjukkan bahwa konsentrasi testosteron ikan mas jantan dan konsentrasi estradiol ikan mas betina pada akhir pemijahan sangat menentukan status pemijahan ikan tawes. Konsentrasi testosteron 2.2–10.19 ng mL-1 dapat memberikan pengaruh pemijahan baik secara stripping maupun secara alami pada ikan tawes (perlakuan B1, A1, B3 dan C3). Terjadinya pemijahan ikan tawes pada keempat perlakuan di atas juga didukung oleh rendahnya konsentrasi estradiol yaitu berkisar antara 0.62–1.46 ng mL-1. Konsentrasi testosteron yang terlalu rendah (kurang dari 1 ng mL-1 : perlakuan A2 dan C2) atau terlalu tinggi (12.83 ng mL-1 pada ikan mas jantan dan >16.8 ng mL-1 pada ikan mas betina : perlakuan A3) tidak memberikan pengaruh pemijahan pada ikan tawes. Keseluruhan dari hasil penelitian ini dapat disimpulkan bahwa ovulasi pada ikan mas betina yang disuntik atau tidak disuntik ovaprim dapat memberikan pengaruh imbas pada pemijahan ikan tawes. Namun, pengaruh imbas tersebut akan semakin kuat jika terdapat ikan mas jantan sebagai pengimbas. Kata kunci: metode Cangkringan, ikan mas, ikan tawes, ovulasi, imbas pemijahan SUMMARY LITA MASITHA. The Role of Female Common Carp (Cyprinus carpio) to Induce Spawning of Java Carp (Barbonymus gonionotus) Using Cangkringan Method. Supervised by MUHAMMAD ZAIRIN JUNIOR, MUHAMMAD AGUS SUPRAYUDI and RUDHY GUSTIANO Natural spawning in fish is more preferable than induce breeding. Cangkringan method offer an alternative that very close to natural spawning, since this method using spawning common carp to stimulate java carp to spawn. The stimulation most likely caused by pheromone which released from common carp. The use of pheromones in fish spawning has a highly practical because it can be applied without handling fish too much thus eliminating stress, and stimulate the endogenous normal processes of mature brood stock that eliminating failures in fertilization. Stimulation of spawning by pheromones potential to be developed further on mass spawner fish. The evidence of pheromones of common carp spawning in Cangkringan method may cause primary responses or releaser responses in Java carp to spawn, which in turn cause spawning of Java carp. In induce breeding, either by using hypophyzation technique or other gonadotropin hormone has several disadvantage. For using pituitary gland, the weakness are the loss of donor fish because it was taken their hypophysis, standardized pituitary gland extract is difficult to do because there are too many hormones involved, there are fears of an interaction among the hormones, and disease transmition. Spawning fish using Cangkringan method have several advantages such as reducing stress and avoid mortality risk, repeating inducer for spawning several times, and providing alternative to develop pheromones as an inducer. However, it is not clear until now the control of female common carp to induce spawning of Java carp in Cangkringan method. Therefore it is important to find the responsible pheromone in future. This study aimed to evaluate control of female common carp to induce spawning of Java carp in Cangkringan method. Each pair of Java carp was placed in the same tank with three common carp (♂♂♀ or ♀♀♀) injected or not injected with ovaprim. Between common carp and Java carp, they were separated by net. This study consist of three treatments, and two controls with three replications. The composition of this treatment were♂ ♂ ♀ not injected (A), ♂ ♂ ♀ injected (B), ♂ ♂ not injected and ♀ injected ( C), ♀ ♀♀ injected (D) and ♀ ♀♀ not injected (E). Sampling for egg was conducted before the first injection by cannulation tecniques. Observation indicated that egg diameter ranged from 0.99 to 1.96 mm for common carp eggs, while the diameter of Java carp eggs ranged from 0.67 to 0.75 mm. Results of this study showed that fish which act as inducer spawning in Cangkringan method is common carp because Java carp would spawn only if common carp was spawn. The Java carp never spawn precedes before common carp. These results indicated that inducing of common carp on spawning of Java carp enabled due to ovulating heterosexual couple carp ♂♂ ( ♀) or ovulating couples monosex (♀♀♀). The fastest interval time induction of common carp on natural spawning of Java carp indicated by B3 treatment is 6 hours 55 minutes, then E3 is 6 hours 58 minutes, and C3 is 8 hours 5 minutes. Application of ovaprim injection in ♂♂♀ common carp (treatment B) gave 100% spawning rate of Java carp, while treatment D, E, C and A gave 66.7%, 66.7%, 33.3% and 0%, respectively. Analysis of testosterone and estradiol showed that testosterone concentration of male common carp and estradiol concentration of female common carp at the end of spawning determine the spawning status of Java carp. Testosterone concentrations 2.26 to 10.19 ng mL-1 could affect both stripping and natural spawning in Java carp (treatment B1, A1, B3 and C3). The occurrence of spawning of Java carp in the four treatments is also supported by the low estradiol concentrations ranged between 0.62–1.46 ng mL-1. Testosterone concentrations those were too low (less than 1 ng mL-1: treatment A2 and C2) or too high (12.83 ng mL-1 in male carp and > 16.8 ng mL-1 in female one: A3 treatment) did not impact on spawning of Java carp. Overall result of this study showed that both ovulating female common carp injected or not injected with ovaprim was able to influence the spawning of Java carp. The influence was stronger when male common carp was present. Keywords: Cangkringan method, common carp, Java carp, induce spawning, ovulation © Hak Cipta milik IPB, tahun 2013 Hak Cipta Dilindungi Undang-Undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB. PERAN IKAN MAS (Cyprinus carpio L.) BETINA UNTUK MERANGSANG PEMIJAHAN IKAN TAWES (Barbonymus gonionotus B.) DALAM METODE CANGKRINGAN LITA MASITHA Tesis Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Akuakultur SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2013 Penguji Luar Komisi pada Ujian Tesis : Dr. Ir. Dinar Tri Soelistyowati, DEA Judul Tesis : Peran ikan mas (Cyprinus carpio L.) betina untuk merangsang pemijahan ikan tawes (Barbonymus gonionotus B.) dalam metode Cangkringan Nama : Lita Masitha NIM : C151100211 Disetujui Komisi Pembimbing Prof Dr Ir Muhammad Zairin Junior, MSc Ketua Dr Ir Muhammad Agus Suprayudi, MSi Anggota Dr Ir Rudhy Gustiano, MSc Anggota Diketahui Ketua Program Studi Ilmu Akuakultur Dekan Sekolah Pascasarjana Prof Dr Ir Enang Harris, MS Dr Ir Dahrul Syah, MScAgr Tanggal Ujian: 29 Januari 2013 Tanggal Lulus: PRAKATA Alhamdulillah, puji dan syukur hanyalah kepada Allah SWT, yang telah melimpahkan rahmat, karunia, dan hidayah-Nya, sehingga penelitian yang berjudul ”Peran Ikan Mas (Cyprinus carpio L.) Betina untuk Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dalam Metode Cangkringan” ini dapat terlaksana dengan baik. Dalam proses penelitian hingga terangkumnya tesis ini, cukup banyak hambatan yang dijumpai, sehingga disadari karya ini tidak dapat tersusun tanpa adanya bantuan dari berbagai pihak. Terima kasih kepada Bapak Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc., Bapak Dr. Ir. Muhammad Agus Suprayudi, M.Si dan Bapak Dr. Ir. Rudhy Gustiano, M.Sc yang telah memberi bimbingan dan ilmu yang sangat berharga kepada penulis, kepada Ibu Dr. Ir. Dinar Tri Soelistyowati, DEA atas kesediaannya menjadi penguji luar komisi, juga kepada Ibu Dr. Ir Widanarni, M.Si dan Bapak Prof. Dr. Ir. Enang Harris, M.S atas saran dan bimbingannya. Teristimewa penulis ucapkan terima kasih kepada suamiku tercinta Lukmanul Hakim dan putriku tersayang Fathimah atas limpahan kasih sayang, doa, pengorbanan, dukungan moril dan materi serta kesabarannya telah menyertai penulis untuk melanjutkan pendidikan. Penghargaan dan terima kasih yang tulus juga penulis sampaikan kepada orang tua tercinta, Ayahanda Mashud Ade Basu, S.Pd, Ibunda Mahadiah (Alm) dan Ibunda Samriati atas kasih sayang, doa restu, pengorbanan, serta dukungan moril dan materi yang diberikan kepada penulis. Penghargaan dan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi atas program Beasiswa BPPS, serta kepada Rektor Unidayan Baubau Bapak La Ode Muhammad Arsal S.Sos., M.Si atas rekomendasi yang diberikan, Bapak Ir. Tamar Mustari, M.S dan Bapak Ir. Musrif, M.P atas segala dorongan sehingga penulis dapat melanjutkan pendidikan pada Mayor Ilmu Akuakultur IPB. Terima kasih kepada para dosen dalam lingkup Mayor Ilmu Akuakultur IPB, atas ilmu berharga yang telah penulis peroleh; seluruh sahabat di Akuakultur angkatan 2010, atas kebersamaan, semangat, dan kenangan indah selama menempuh pendidikan bersama; rekanku Lysa Simanjuntak, S.Pi., M.Si atas dukungan dan kebersamaannya. Kepada Bapak Gholib S.Pt, M.Si terimakasih atas bantuannya dalam analisis hormon dan kepada para peneliti dan teknisi di Instalasi Penelitian Plasma Nutfah Budidaya Air Tawar Cijeruk Bogor, terima kasih telah berbagi ilmu dan bantuan yang diberikan selama penelitian. Kepada kakak-kakakku tercinta, Nur Kamariah, S.E; La Ode Herdin; Hardono Manan, S.Pi; Suparmi, S.Sos; adik-adikku tersayang Asad Hamzah, A.Ma.Pd; Noni Baali, A.Ma.Pd; Masriati; Masriadi; Siti Maryam dan Siti Fathimah Az-zahra, kepada Abi Ust. Syamsi bin La Onda dan Ummi Wa Ode Ahi beserta seluruh keluarga besarku, terima kasih atas doa, dukungan dan kasih sayangnya. Terima kasih untuk keluargaku di Pondok Edelweis’88 serta para sahabat seperantauan di Pondok Al-Lulu, atas kebersamaan dan semangat dari kalian. Kepada semua pihak yang tidak dapat disebutkan satu persatu, terima kasih atas bantuan, dukungan, serta doanya. Semoga tesis ini dapat memberikan faedah bagi semua pihak. Bogor, Januari 2013 Lita Masitha DAFTAR ISI DAFTAR ISI xi DAFTAR GAMBAR xiii DAFTAR TABEL xiv DAFTAR LAMPIRAN xiv 1 PENDAHULUAN Latar Belakang Rumusan Masalah Tujuan Penelitian Manfaat Penelitian 1 2 2 3 2 TINJAUAN PUSTAKA Ikan Mas Ikan Tawes Proses Pematangan Gonad Vitellogenesis dan Proses Pematangan Oosit Tahap Akhir Ovulasi dan Pemijahan Metode Cangkringan Feromon Hormon Testosteron dan Estradiol 3 3 4 6 7 9 9 11 3 METODOLOGI PENELITIAN Materi Uji dan Rancangan Penelitian Metode Penelitian Persiapan Induk Persiapan Wadah Pemberokan Induk Pengambilan Sampel Telur Pengambilan Sampel Darah Penyuntikan Induk Pemijahan dengan Sistem Imbas Parameter Penelitian Tingkat Kematangan Gonad Tingkah Laku Reproduksi Ikan Diameter Telur Waktu Induk Mencapai Ovulasi Derajat Pemijahan (DP) Ikan Tawes Jumlah Telur yang Diovulasikan (TO) Pada Ikan tawes Derajat Pembuahan (Fertilization Rate, FR) Telur Ikan Tawes Derajat Penetasan (Hatching Rate, HR) Ikan Tawes Konsentrasi Hormon Testosteron dan Estradiol Ikan Mas Parameter Kualitas Air Analisis Data 12 12 12 13 13 13 14 14 14 15 15 15 15 15 15 15 16 16 16 16 16 4 HASIL DAN PEMBAHASAN Tingkat Kematangan Gonad Diameter Telur Posisi Inti Telur Tingkah Laku Pemijahan Imbas Pemijahan Ikan Mas Terhadap Ikan Tawes Fekunditas, Derajat Pembuahan (FR) dan Derajat Penetasan Telur (HR) Profil Hormon Testosteron (T) dan Estradiol (E 2 ) Ikan Mas Kualitas Air 16 17 18 19 21 22 23 25 5 SIMPULAN DAN SARAN Simpulan Saran 25 25 DAFTAR PUSTAKA 26 LAMPIRAN 30 RIWAYAT HIDUP 38 DAFTAR GAMBAR 1 2 3 4 5 6 7 8 9 Oosit dengan lapisan folikel pada ikan cod (Gadus morhua), A : bagian dari keseluruhan oosit dengan kuning telur (Y), B : Zr menunjukkan zona radiata dan sel-sel folikel (teka, T, dan granulosa, G) ditandai dengan panah Perubahan morfologi pada oosit matang Black Porgy (Acanthopagrus schlegeli). A: Butiran kuning telur terlihat lebih besar dan kurang padat dalam sitoplasma. B: Secara perlahan inti bergeser dari pusat telur. C: Ooplasma transparan. D: Inti telur bergerak ke bagian peripheral. E: Oosit matang dengan satu butiran minyak. F: inti telur melebur. g = germinal vesicle (inti telur), o = butiran minyak Skema kontrol hormon dalam reproduksi ikan Proses perkembangan sel telur Rantai endokrin, poros hipothalamus-pituitari-gonad (HPG) pada ikan betina selama pematangan oosit dan ovulasi Induk ikan mas (A) dan induk ikan tawes (B) Wadah perlakuan yang digunakan selama penelitian; hapa sebagai pemisah antara ikan mas dan ikan tawes (panah) Pengambilan telur dengan metode kanulasi (A); pengambilan sampel darah dari vena ekor (B); penyuntikan induk dilakukan secara intramuscular (C) Posisi inti telur ikan tawes, inti telur pada fase istrahat (panah putih); inti telur bergerak ke tepi : GVM (panah hitam) 4 5 6 7 8 12 13 14 18 DAFTAR TABEL 1 Desain perlakuan pemijahan ikan mas dalam merangsang pemijahan ikan tawes dalam metode Cangkringan 2 Ukuran diameter (mm) telur ikan mas 3 Ukuran diameter (mm) telur ikan tawes 4 Jumlah ikan mas dan tawes yang mijah, waktu ikan mas mencapai ovulasi (WOM), waktu ikan tawes mencapai ovulasi (WOT), dan derajat pemijahan (DP) ikan tawes 5 Bobot tubuh, fekunditas, derajat pembuahan (FR) dan derajat penetasan (HR) ikan tawes 6 Konsentrasi hormon testosteron (T) dan estradiol (E 2 ) ikan mas 7 Nilai parameter kualitas air selama penelitian 12 17 17 20 23 24 25 DAFTAR LAMPIRAN 1 2 3 4 5 6 Desain percobaan Diameter telur ikan mas dan ikan tawes pada ulangan 1,2,3 Posisi inti telur (panah) ikan mas pada ulangan 1,2,3 Waktu suntik, waktu ovulasi/pemijahan ikan mas, waktu ovulasi/ Pemijahan ikan tawes Fekunditas, derajat pembuahan (FR) dan derajan penetasan (HR) Ikan tawes Konsentrasi hormon testosteron (T) dan estradiol (E 2 ) pada setiap perlakuan 30 31 33 35 36 37 1 1 PENDAHULUAN Latar Belakang Upaya untuk menginduksi pemijahan ikan dapat dilakukan melalui beberapa cara, baik melalui manipulasi lingkungan, kawin suntik maupun dengan metode imbas. Sejak tahun 70-an, di Indonesia telah berkembang metode imbas untuk memijahkan ikan tawes yang dikenal dengan metode Cangkringan. Metode ini pertama kali ditemukan di Balai Benih Ikan Sentral (BBIS) Cangkringan, yang pada awalnya digunakan untuk memijahkan ikan tawes dengan rangsangan pemijahan ikan mas. Menurut Zairin (2003) pada metode di atas terjadi stimulasi dari ikan mas ke ikan tawes. Stimulasi yang bekerja kemungkinan besar diakibatkan oleh semacam feromon yang dilepas oleh ikan mas. Feromon didefinisikan sebagai bau atau campuran zat berbau, yang dikeluarkan oleh suatu individu (pengirim) dan membangkitkan respon khas pada individu lain sebagai penerima (Sorensen dan Stacey 2004). Terdapat tiga kategori feromon yang dibedakan berdasarkan fungsinya yaitu isyarat anti-predator, isyarat sosial, dan isyarat reproduksi. Masing-masing kategori terdiri dari feromon yang dapat menimbulkan respon primer berupa efek fisiologis atau perubahan endokrinologis yang terjadi lebih lambat atau respon pelepas yaitu perubahan perilaku yang kuat (Sorensen dan Stacey 2004; Appelt dan Sorensen 2007; Burnard et al. 2008; Little et al. 2011). Meskipun demikian, feromon tidak terbatas pada jenis kelamin tertentu dan spesies yang berbeda dapat memproduksi dan melepaskan feromon yang sama, namun respon induksinya bervariasi (Burnard et al. 2008). Lim dan Sorensen (2012) mengemukakan bahwa saat ovulasi, ikan betina dari berbagai spesies diketahui melepaskan F-prostaglandin, sebuah derivat feromon seks yang menarik ikan jantan sejenis. Feromon pada ikan mas diidentifikasi sebagai campuran prostaglandin F2α (PGF2α) dan metabolit tubuh lain yang tidak teridentifikasi, yang disebut sebagai feromon kompleks. Hasil penelitian pada ikan mas betina yang diimplan dengan PGF2α dapat menarik ikan jantan dewasa walaupun berjarak 20 m, tetapi tidak untuk ikan betina. Selanjutnya hasil penelitian Stacey et al. (2012) menjelaskan bahwa ikan Scardinius erythrophthalmus betina yang sudah mengalami ovulasi dapat menginduksi respon primer individu jantan sejenis yang disebabkan karena terjadi peningkatan konsentrasi 17α,20β-dihydroxy-4-pregnen-3-one (17α,20β-P) dan penurunan konsentrasi androstenedion. Zheng et al. (1997) mengemukakan bahwa respon terhadap feromon 17α,20β-P merupakan penentu utama kesuksesan reproduksi ikan mas koki jantan. Hasil penelitiannya menunjukkan bahwa pengaruh feromon 17α,20β-P menyebabkan peningkatan aktivitas pemijahan, volume dan cairan sperma, durasi motilitas sperma dan proporsi sperma motil. Namun, tampak bahwa perubahan dalam kualitas sperma adalah komponen utama dari pengaruh feromon tersebut. Hal ini dapat dilihat dalam persaingan pembuahan in vitro dimana sperma dari ikan mas koki jantan yang dipapar dengan feromon 17α,20β-P dapat membuahi telur lebih banyak daripada sperma pada ikan jantan kontrol. 2 Penggunaan feromon pada pemijahan ikan memiliki nilai praktis yang sangat tinggi karena dapat diterapkan tanpa menangani ikan sehingga meniadakan stress, merangsang proses endogenus normal sehingga mengeliminir kegagalan dalam pembuahan dan hanya bekerja pada induk yang benar-benar matang. Stimulasi pemijahan dengan feromon sangat potensial untuk dikembangkan pada ikan yang biasa memijah secara masal (Zairin 2003). Keterlibatan feromon pada pemijahan ikan mas dengan metode Cangkringan, mungkin menimbulkan respon primer dan atau respon pelepas pada ikan tawes, yang selanjutnya menyebabkan pemijahan pada ikan tawes. Metode ini merupakan cara alami yang lebih efektif dan lebih aman dibandingkan dengan metode kawin suntik. Pada metode kawin suntik, jika ikan yang disuntik tidak mijah maka peluang terjadinya mortalitas semakin tinggi karena nekrosis telur yang dapat menyebabkan keracunan internal (Woynarovich dan Horvath 1980). Dengan demikian, metode Cangkringan diharapkan menelurkan alternatif cara pemijahan ikan selain dengan metode kawin suntik dalam akuakultur. Namun, sampai saat ini belum diketahui peran ikan mas betina dalam merangsang pemijahan ikan tawes dalam metode Cangkringan. Metode ini perlu dikembangkan untuk menemukan feromon yang dapat dijadikan sebagai perangsang pada pemijahan ikan. Perumusan Masalah Tahapan penting dalam siklus reproduksi ikan adalah proses pemijahan. Dewasa ini pemijahan ikan lebih banyak dilakukan dengan cara kawin suntik, baik dengan teknik hipofisasi maupun dengan menggunakan hormon gonadotropin lain seperti ovaprim maupun HCG (Human chorionic gonadotropin). Namun teknik hipofisasi memiliki beberapa kelemahan antara lain hilangnya ikan donor karena diambil hipofisisnya, standarisasi kandungan ekstrak kelenjar hipofisis ikan sukar dilakukan (Woynarovich dan Horvath 1980), terlalu banyak hormon yang terlibat sehingga dikhawatirkan akan terjadi interaksi antar hormon-hormon tersebut, dan penyakit dapat menular dengan mudah dari ikan donor ke ikan resipien (Dorafshan et al. 2003). Disamping itu metode kawin suntik dengan menggunakan ovaprim dan HCG harganya relatif mahal sehingga tidak ekonomis, sukar diperoleh dan spesifisitasnya tinggi. Oleh karena itu metode Cangkringan dapat dijadikan metode alternatif pemijahan ikan. Beberapa keunggulan metode ini antara lain induk tidak mengalami stres karena penanganan sehingga resiko mortalitas kecil, induk ikan mas dapat digunakan sebagai perangsang untuk beberapa kali pemijahan, metode Cangkringan memberikan alternatif untuk pengembangan feromon sebagai perangsang. Tujuan Penelitian ini bertujuan untuk mengevaluasi peran ikan mas betina dalam merangsang pemijahan ikan tawes dengan metode Cangkringan. 3 Manfaat Penelitian Hasil penelitian ini diharapkan dapat menjadi dasar pengembangan feromon sebagai perangsang, sehingga menjadi solusi alternatif bagi pemijahan ikan secara alami. 2 TINJAUAN PUSTAKA Ikan Mas Ikan mas termasuk famili Cyprinidae merupakan jenis ikan konsumsi air tawar, dengan daerah penyebaran alami di wilayah Eropa ke Cina dan telah dibudidayakan di berbagai daerah di dunia. Ikan ini merupakan ikan omnivora, sebagian besar memiliki cara makan dengan memakan makanan di dasar perairan. Memijah dengan menempelkan telur pada tumbuhan yang terendam di air atau di kolam (Woynarovich dan Horvath 1980). Usia matang gonad ikan mas berhubungan dengan letak garis lintang daerah dan jenis kelamin. Biasanya ikan jantan matang gonad lebih awal dibanding ikan betina. Ikan yang ada di daerah garis lintang rendah akan matang lebih awal dibandingkan dengan yang berada di daerah dengan garis lintang lebih tinggi. Pada kolam budidaya di India, ikan jantan matang gonad pada usia 6 bulan dan ikan betina pada usia 8 bulan, sedangkan di Kanada, ikan jantan matang gonad pada usia 3–4 tahun dan betina pada usia 4–5 tahun. Periode pemijahan ikan mas pada suhu air berkisar antara 18–28 °C (Tempero et al. 2006) Pada pemijahan ikan dengan teknik hipofisasi, ikan mas sering digunakan sebagai donor. Ikan mas diketahui sebagai donor universal, artinya dapat digunakan secara efektif untuk banyak jenis ikan, baik yang dalam satu famili maupun di luar famili (Sumantadinata 1983). Selain itu, ikan mas juga dikenal sebagai ikan yang mudah memijah. Pada pemijahan ikan dengan sistem Cangkringan, ikan yang biasa digunakan sebagai ikan donor atau perangsang adalah induk ikan mas. Ikan Tawes Ikan tawes juga termasuk famili Cyprinidae. Hidup di perairan tawar dengan suhu tropis 22–28 °C dan pH 7. Ikan ini dapat ditemukan di sungai pada kedalaman hingga lebih dari 15 m, rawa banjiran dan waduk. Berkembangbiak dengan baik di daerah yang letaknya 50–800 m di atas permukaan laut. Di daerah dataran rendah yang jauh di bawah 50 m dari permukaan laut, pembiakan ikan tawes pada umumnya kurang baik (Sumantadinata 1983). Bentuk badan ikan tawes agak panjang dan pipih dengan punggung meninggi, kepala kecil, moncong meruncing, mulut kecil terletak pada ujung hidung, sungut sangat kecil atau rudimenter. Badan berwarna keperakan agak gelap di bagian punggung. Pada moncong terdapat tonjolan-tonjolan yang sangat kecil. Sirip punggung dan sirip ekor berwarna abu-abu atau kekuningan, sirip dada berwarna kuning dan sirip dubur berwarna oranye terang (Kottelat et al. 1993). 4 Ikan tawes dapat memijah dengan rangsangan alami lingkungan, suntikan hormon, dan rangsangan imbas (Sumantadinata 1983). Seperti ikan lainnya dalam famili Cyprinidae, kematangan gonad ikan tawes sangat dipengaruhi oleh suhu, pakan dan musim. Proses Pematangan Gonad Perkembangan gonad ikan secara garis besar dibagi atas dua tahap perkembangan utama, yaitu tahap pertumbuhan gonad sampai ikan mencapai tahap dewasa kelamin dan tahap pematangan produk seksual. Menurut Unal et al. (2005) selama perkembangan gonad, setiap folikel ovarium terdiri dari oosit yang berkembang yang dikelilingi oleh dua lapisan sel somatik, yaitu sel-sel granulosa dalam dan sel-sel teka luar (Gambar 1). Gambar 1 Oosit dengan lapisan folikel pada ikan cod (Gadus morhua), (A) bagian dari keseluruhan oosit dengan kuning telur, (B) zona radiata dan sel-sel folikel (Arukwe dan Goksoyr 2003). Akronim, Y – kuning telur, Zr – zona radiata, T – teka, G – granulosa Selama awal pertumbuhan oosit (stadia perinukleolar), oosit dikelilingi oleh lapisan sederhana sel-sel granulosa yang rata (skuamosa) dan munculnya lapisan sederhana sel teka luar. Dua tipe sel tersebut dipisahkan oleh membran dasar nonselular (Arukwe dan Goksoyr 2003; Srijunngam et al. 2005; Unal et al. 2005; Zaki et al. 2005). Hasil studi histologis dan histometrikal pada ovarium ikan mas yang dilakukan Shirali et al. (2012) menjelaskan bahwa terdapat tujuh jenis folikel yang berbeda dalam tahapan siklus reproduksi yaitu 1) folikel kromatin-nukleolus, beberapa nukleolus muncul dalam inti, tersusun teratur dan terletak pada posisi peri nuklear. Ooplasma tipis dan basofilik. Diameter folikel ini berukuran 35.96±4.52 μm. 2) folikel perinukleolus, nukleolus besar dan banyak berada di 5 pinggiran inti. Ooplasmanya mengandung organela-organela juxta nuklear kompleks (Balbiani body). Diameter rata-rata dari folikel ini 111.22±17.67 μm. 3) folikel kortical alveolus, kortikal alveoli muncul di berbagai kedalaman ooplasma. Ada juga butiran-butiran kecil lemak di sekitar inti. Zona radiata muncul seperti garis tipis. Balbiani body menjadi hilang. Diameter folikel ini adalah 200.46±22.57μm. Ketiga folikel di atas disebut sebagai folikel pra vitellogenik. 4) folikel vitelogenik primer, butiran-butiran kuning telur terletak diantara kortikal alveoli. Ooplasmanya kurang basofilik. Diameter inti mencapai diameter maksimum dalam tahap ini. Diameter folikel ini 413.10±27.53 μm. 5) folikel vitelogenik sekunder, butiran-butiran kuning telur bergerak ke tengah sedangkan kortikal alveoli dan butiran-butiran lemak bergerak ke bagian peripheral. Membran nukleus menjadi tidak beraturan. Zona radiata menebal dan diameter folikel-folikel mencapai ukuran maksimum pada tahap ini yaitu 769.50±44.41 μm. 6) folikel vitelogenik tersier, butiran-butiran kuning telur meningkat, bergabung bersama-sama dan mengisi keseluruhan ooplasma. Nukleoli secara bertahap bergerak menuju pusat nukleus. 7) Maturasi, secara bertahap nukleus bergerak ke kutub animalia. Selanjutnya membran nukleus menghilang. Folikel primer, sekunder, tersier dan maturasi dianggap sebagai folikel-folikel vitelogenik. Selanjutnya Kucharczyk et al. (2008) menjelaskan posisi inti telur untuk menentukan tahap kematangan telur dibagi dalam empat tahap (Gambar 2) yaitu : tahap 1: inti telur (GV) berada di tengah, tahap 2: awal migrasi inti (kurang dari setengah jari-jari telur), tahap 3: akhir migrasi inti (lebih dari stengah jari-jari telur), dan tahap 4: peleburan inti atau germinal vesicle breakdown (GVBD). Gambar 2 Perubahan morfologi pada oosit matang Black Porgy (Acanthopagrus schlegeli), (A) butiran kuning telur terlihat lebih besar dan kurang padat dalam sitoplasma, (B) secara perlahan inti bergeser dari pusat telur, (C) ooplasma transparan, (D) inti telur bergerak ke bagian peripheral, E oosit matang dengan satu butiran minyak, (F) inti telur melebur (Yueh dan Chang 2000). Akronim, g – germinal vesicle (inti telur), o – oil droplet (butiran minyak) 6 Vitelogenesis dan Proses Pematangan Oosit Tahap Akhir Prinsip umum yang terjadi pada semua ikan bahwa untuk memproduksi telur besar perlu pengisian kuning telur (large yolky eggs) yang diperoleh melalui perkembangan oosit. Pembentukan, perkembangan dan pematangan gamet betina dan sel telur (oogenesis) merupakan proses yang rumit yang membutuhkan koordinasi hormon (Gambar 3) (Arukwe dan Goksoyr 2003). Hormon-hormon tersebut berada di bawah kontrol poros hipothalamus-pituitari-gonad (HPG). Selama fase reproduksi vertebrata ovipar betina, hati mensistesis sebuah prekursor protein kuning telur yang disebut sebagai vitelogenin. Sintesis vitelogenin di dalam hati (vitelogenesis) di kontrol oleh aksi hormon estrogen (Matty 1985). Vitelogenesis merupakan rangkaian dari proses pematangan gonad. Pada proses pematangan gonad, sinyal lingkungan seperti hujan, perubahan suhu, substrat, petrichor dan lain-lain, diterima oleh sistem syaraf pusat dan diteruskan ke hipotalamus. Sebagai respon, hipotalamus akan melepaskan hormon GnRH (Gonadotropin Releasing Hormone) yang selanjutnya bekerja pada kelenjar hipofisis. Selanjutnya hipofisis akan melepaskan hormon FSH (Follicle Stimulating Hormon) yang bekerja pada lapisan teka pada oosit (Woynarovich dan Horvath 1980). Gambar 3 Skema kontrol hormon dalam reproduksi ikan (Nagahama 1994) 7 Akibat kerja FSH, lapisan teka akan mensintesis testosteron dan di lapisan granulosa, testosteron akan diubah menjadi estradiol-17β (E 2 ) oleh enzim aromatase. Selanjutnya E 2 akan merangsang hati mensintesis vitelogenin yang merupakan bakal kuning telur. Vitelogenin akan dibawa oleh aliran darah menuju gonad dan secara selektif akan diserap oleh lapisan folikel oosit (Nagahama et al. 1995). Akibat menyerap vitelogenin, oosit akan tumbuh membesar sampai kemudian berhenti apabila telah mencapai ukuran maksimum. Pada kondisi ini dikatakan bahwa telur telah berada pada fase dorman dan menunggu sinyal lingkungan untuk pemijahan (Zairin 2003). Dalam proses pematangan oosit, tidak semua oosit yang telah mengalami vitelogenesis dapat diovulasikan. Bila keadaan lingkungan tidak mendukung, oosit akan mengalami degradasi atau kegagalan ovulasi yang dikenal dengan proses atresia (Gambar 4). Proses ini terjadi karena penyerapan materi oosit oleh sel-sel granulosa yang mengalami hipertropi. Bila keadaan lingkungan mendukung, maka akan terjadi proses praovulasi dan ovulasi (Woynarovich dan Horvath 1980). Fase dorman ovulasi Bila hormon gonadotropin tidak ada, maka secara alami sel telur akan diserap kembali perbanyakan sel perkembangan folikel Gambar 4 Proses perkembangan sel telur (Woynarovich dan Horvath 1980) Ovulasi dan Pemijahan Ovulasi adalah proses terlepasnya oosit matang dari sel-sel follikel (Yueh dan Chang 2000) untuk dibuahi (Nagahama dan Yamashita 2008). Sama halnya dengan pematangan gonad, pada proses ovulasi dan pemijahan, sinyal lingkungan 8 diterima oleh sistem syaraf pusat dan diteruskan ke hipotalamus. Sebagai respon, hipotalamus akan melepaskan GnRH yang selanjutnya bekerja pada kelenjar hipofisis. Pada tahap ini hipofisis mensekresikan hormon LH (Luteinizing hormon) yang bekerja pada lapisan teka oosit. Akibat kerja LH, lapisan teka akan mensintesis hormon 17α-hidroksiprogesteron yang kemudian di lapisan granulosa akan diubah menjadi 17α,20β-dihidroksiprogesteron (maturation inducing steroid, MIS) oleh enzim 20β-hidroxysteroid dehidrogenase (Zairin 2003). Selain 17α,20β-dihidroxy progesteron sebagai MIS atau MIH (maturation-inducing hormone) yang umum pada ikan, pada sebagian ikan menggunakan 17α,20β,21trihidroxy-4-pregnen-3-one (20β-S) sebagai MIH (Nagahama dan Yamashita 2008). Sinyal MIH akan merangsang pembentukan faktor perangsang kematangan (maturation promoting factor, MPF) yang akan menyebabkan inti telur bermigrasi ke arah mikrofil kemudian melebur (Gambar 5). Setelah proses peleburan inti (GVBD), lapisan folikel akan pecah dan telur dikeluarkan menuju rongga ovari, sehingga terjadi proses ovulasi (Yaron 1995). Setelah proses ovulasi, telur dikatakan telah mencapai kematangan secara fisiologis dan siap dibuahi sperma. Gambar 5 Rantai endokrin, poros hipothalamus-pituitari-gonad (HPG) pada ikan betina selama pematangan oosit dan ovulasi (Yaron dan Levavi-Sivan 2011). Pemijahan memiliki mekanisme kontrol terpisah dari proses ovulasi. Beberapa ikan teleostei dapat memijah beberapa kali dalam satu musim pemijahan dimana telur-telur yang dikeluarkan dari tubuh berasal dari telur-telur yang diovulasikan pada waktu yang sama. Namun ada pula ikan yang memijah dengan mengeluarkan telurnya sekaligus dimana telur-telur yang diovulasikan 9 dikeluarkan sedikit demi sedikit ke rongga ovarium dan kemudian dikeluarkan sekaligus pada saat pemijahan. Terdapat dua faktor perangsang pemijahan yaitu faktor internal dan eksternal. Faktor internal yang utama adalah kematangan gonad ikan, kandungan testosteron dan estradiol; sedangkan faktor eksternal merupakan lingkungan termasuk faktor fisika (cahaya, suhu, arus), faktor kimia (pH, kelarutan oksigen, feromon), dan faktor biologis (adanya lawan jenis, dan hormon). Untuk mempercepat pemijahan dapat pula diberikan rangsangan buatan berupa manipulasi lingkungan, suntikan hormon dan imbas (Zairin et al. 2005). Metode Cangkringan Pada awalnya metode imbas atau metode Cangkringan muncul karena kenyataan di BBIS (Balai Benih Ikan Sentral) Cangkringan Daerah Istimewa Yogyakarta (DIY) menunjukkan bahwa tetua ikan tawes tidak mau memijah di dalam hapa bila tidak disuntik terlebih dahulu dengan ekstrak hipofisa, meskipun kolam pemijahan telah dipersiapkan sesuai dengan keperluan cara pemijahan tradisional. Secara kebetulan dicobalah memijahkan ikan tawes bersama dengan ikan mas dalam satu kolam pemijahan. Kemudian diketahui bahwa ikan tawes dapat memijah mengikuti pemijahan ikan mas (Soedarman 1979). Metode induksi ini dinamakan sebagai "metode Cangkringan" karena cara ini mulai dicoba dan ditemukan di BBIS Cangkringan DIY. Sejak itu pemijahan ikan tawes di BBIS Cangkringan dilakukan dengan cara induksi. Pada pelaksanaannya, pemijahan ikan mas yang juga berfungsi sebagai perangsang pemijahan ikan tawes dapat dilakukan di dalam dan di luar hapa. Umumnya pemijahan ikan tawes mengikuti pemijahan ikan mas dengan selang waktu antara 10 menit sampai dengan 1 jam 45 menit (Lestari 1998). Feromon Sorensen dan Stacey (2004) menjelaskan istilah feromon sebagai bau atau campuran zat berbau, yang dikeluarkan oleh suatu individu (pengirim) dan membangkitkan respon khas yang adaptif, spesifik, serta ekspresi yang tidak memerlukan pengalaman sebelumnya atau pembelajaran pada individu lain sebagai penerima. Selanjutnya Little et al. (2011), mengemukakan bahwa feromon adalah faktor kimia yang disekresikan atau dikeluarkan oleh spesies yang memicu respon sosial dalam anggota spesies yang sama. Sebagian besar spesies ikan mengandalkan feromon untuk memediasi perilaku sosial (Sorensen dan Stacey 2004). Feromon juga memediasi tingkah laku dan respon fisiologis yang beragam dan terjadi pada berbagai spesies ikan air tawar (Burnard et al. 2008). Terdapat tiga kategori feromon yang dibedakan berdasarkan fungsinya yaitu isyarat anti-predator, isyarat sosial, dan isyarat reproduksi. Masing-masing kategori terdiri dari feromon yang dapat menimbulkan respon primer yaitu efek fisiologis atau perubahan endokrinologis yang terjadi lebih lambat dan atau respon pelepas yaitu perubahan perilaku yang kuat (Sorensen dan Stacey 2004; Appelt dan Sorensen 2007; Burnard et al. 2008; Little et al. 2011). 10 Meskipun demikian, feromon tidak terbatas pada jenis kelamin tertentu dan spesies yang berbeda dapat memproduksi dan melepaskan feromon yang sama, namun respon induksinya bervariasi (Burnard et al. 2008). Misalnya konjugat (sulfat) 17α,20β-P menginduksi respon pelepas pada ikan Carassius auratus jantan (Kobayashi et al. 2002) dan pada hill trout (Barilius bendelisis Ham) menginduksi respon primer (Bhatt dan Sajwan 2001). Sinyal kimia memainkan peran sangat penting dalam koordinasi aktivitas reproduksi pada sebagian besar organisme, dan tidak terkecuali ikan (Stacey dan Sorensen 2006). Yambe et al. (2006) mengemukakan bahwa selama 20 tahun terakhir, steroid dan prostaglandin telah diidentifikasi sebagai feromon seks yang dilepaskan ikan dalam urinnya. Hasil penelitian Appelt dan Sorensen (2007) menunjukkan bahwa ikan mas koki mengontrol pelepasan feromon prostaglandin pada urin untuk mempromosikan lokasi dan status reproduksi sebagai tahap awal sistem komunikasi kimia mereka. Selanjutnya dijelaskan bahwa frekuensi pelepasan urin ikan mas koki betina yang diinjeksi prostaglandin F2α (PGF2α) yang ditempatkan bersama-sama dengan jantan aktif lebih tinggi dibanding betina tanpa jantan aktif. Ikan mas koki jantan dewasa melepaskan sejumlah besar androstenedione (AD), yaitu suatu steroid androgenik kuat yang pada jantan maupun betina dapat merasakan sensitivitas yang sangat kuat dan merangsang interaksi agresif diantara jantan, walaupun tanpa isyarat steroid lainnya (Stacey dan Sorensen 2006). Secara bersamaan, betina dewasa melepaskan produk hormon lainnya dalam berbagai campuran, tiga diantaranya ditemukan dalam urin mereka. Interaksi yang sama diduga terjadi pula pada ikan mas karena ikan mas memiliki perilaku, fisiologis dan juga feromon yang hampir identik dengan ikan mas koki (Sorensen dan Stacey 2004). Pada saat ovulasi, betina menjadi aktif secara seksual dan meresponnya dengan mensintesis PGF2α di dalam saluran telur. PGF2α dan metabolitnya yang dirilis sebagai postovulatory feromon yang menyebabkan perilaku pemijahan pada jantan yang selanjutnya akan meningkatkan produksi LH dan sperma jantan (Kobayashi et al. 2002). Pada ikan mas, feromon ini diidentifikasi sebagai campuran PGF2α dan metabolit tubuh lain yang tidak teridentifikasi, yang disebut sebagai feromon kompleks (Lim dan Sorensen 2012). Stacey et al. (2012), mengemukakan bahwa ikan S. erythrophthalmus betina yang sudah mengalami ovulasi dapat menginduksi respon primer individu jantan sejenis yang mencakup perubahan dalam sirkulasi steroid dan peningkatan volume sperma. Respon primer individu jantan tersebut dimediasi oleh peningkatan serum LH jantan yang disebabkan karena terjadi peningkatan konsentrasi 17α,20β-P dan penurunan konsentrasi androstenedion. Namun S. erythrophthalmus dan ikan silver bream (Blicca bjoerkna) betina yang sudah mengalami ovulasi yang ditempatkan dalam satu wadah dengan Carassius carassius jantan tidak menyebabkan peningkatan volume sperma pada C. carassius. Begitu pula pada ikan mas betina yang di implan dengan PGF2α dapat menarik ikan mas jantan dewasa walaupun berjarak 20 m, tetapi tidak demikian untuk ikan betina (Lim dan Sorensen 2012). Berbagai macam bahan kimia telah diupayakan agar memiliki fungsi yang sama seperti feromon. Namun hanya steroid gonad, prostaglandin, dan asam empedu yang diketahui dapat dideteksi organ penciuman dan menimbulkan respon biologis (Sorensen dan Stacey 2004). 11 Hormon Testosteron dan Estradiol Spesies yang bereproduksi secara seksual harus menyinkronkan kematangan gamet dengan perilakunya, baik dengan sesama jenis maupun antar lawan jenis. Ikan teleostei mengatasi tantangan ini dengan menggunakan hormon reproduksi baik sebagai sinyal endogen untuk menyinkronkan perilaku seksual dengan pematangan gamet maupun sebagai sinyal eksogen (feromon) untuk menyinkronkan interaksi pemijahan antara ikan (Kobayashi et al. 2002). Pertumbuhan gonad dan vitelogenesis pada betina dirangsang oleh E 2 (Ohga et al. 2012) juga membangkitkan pelepasan feromon (Kobayashi et al. 2002). Pada ikan rainbow trout betina, plasma E 2 meningkat dari 54 hari sebelum ovulasi dan terus meningkat mencapai puncaknya pada 18 hari sebelum ovulasi. Selanjutnya turun mencapai 15–17 ng mL-1 pada 12 hari sebelum ovulasi dan mencapai level basal (2–3 ng mL-1) pada 4 hari sebelum ovulasi, kemudian tetap rendah sampai 32 hari setelah ovulasi (Pavlidis et al. 1994). Kobayashi et al. (2002) menyatakan bahwa pada akhir proses vitelogenesis, plasma E 2 ovarium turun dan plasma testosteron meningkat, yang dapat meningkatkan sistem kepekaan LH betina terhadap lingkungan (suhu, substrat pemijahan, feromon). Isyarat ini akhirnya memicu lonjakan LH yang mengubah jalur steroidogenik untuk mendukung produksi progesteron termasuk 17α,20β-P. Plasma 17α,20β-P merangsang pematangan oosit tetapi juga dirilis ke air bersama dengan sulfat 17α,20β-P dan androstenedion sebagai feromon praovulasi. Feromon ini merangsang perilaku pemijahan yang selanjutnya meningkatkan pelepasan LH, dan produksi sperma pada jantan. Penelitian Hong et al. (2006) menunjukkan bahwa ekstrak ovari ikan Chinese black sleeper (B. sinensis) dapat menarik lebih banyak jantan dibanding betina, dan ekstrak testikular dan ekstrak vesikula seminalis dapat menarik lebih banyak betina daripada jantan. Persentase pemijahan tertinggi diperoleh pada tempat yang diberikan 17α,20β-P dan PGE 2 , sementara jumlah telur yang dikeluarkan dan pembuahan tertinggi diperoleh pada tempat yang diberikan PGE 2 . Hasil penelitian ini menjelaskan bahwa organ seks B. sinensis mengandung 17α-progesteron (17α-P), 17α,20β-P, PGE 2 dan PGF 2 α. Steroid-steroid tersebut dapat bertindak sebagai feromon seks pada spesies ini yang menarik jantan dan betina ke tempat pemijahan dan merangsang pemijahan. Steroid 17α,20β-P juga diketahui sebagai steroid yang berfungsi mempromosikan inisiasi meiosis sel germinal dan pematangan folikel serta ovulasi pada betina. Pada jantan steroid ini juga menginisiasi pembelahan meiosis spermatogonium dan mengendalikan pematangan spermatozoa serta spermiasi (Mylonas dan Zohar 2001; Yaron dan Levavi-Sivan 2011). Steroid 17α,20β-P dalam bentuk bebas dan konjugatnya berfungsi sebagai feromon (Yaron dan Levavi-Sivan 2011). 12 3 METODOLOGI PENELITIAN Penelitian ini dilaksanakan sejak bulan Maret sampai dengan bulan November 2012 di Instalasi Penelitian Plasma Nutfah Perikanan Air Tawar, Cijeruk, Bogor. Analisis hormon testosteron dan estradiol dilakukan di Laboratorium Hormon Unit Rehabilitasi dan Reproduksi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Materi Uji dan Rancangan Penelitian Hewan uji yang digunakan dalam penelitian ini adalah induk ikan mas dengan bobot ± 1.5 kg per ekor (betina) dan ± 0.5 kg per ekor (jantan), berasal dari Instalasi Penelitian Plasma Nutfah Perikanan Air Tawar Cijeruk Bogor (Gambar 6A). Induk ikan tawes (jantan dan betina) dengan bobot sekitar 0.5 kg per ekor, berasal dari petani ikan di Desa Petir Kecamatan Darmaga Bogor (Gambar 6B). (A) (B) Gambar 6 Induk ikan mas (A) dan induk ikan tawes (B) Rancangan percobaan yang digunakan adalah rancangan satu faktor dalam RAL dengan 5 perlakuan dan 3 kali ulangan (Tabel 1 dan Lampiran 1). Tabel 1 Desain perlakuan pemijahan ikan mas dalam merangsang pemijahan ikan tawes dalam metode Cangkringan Perlakuan A B C D E Keterangan Ikan Mas (♂♂♀ tidak disuntik) dan ikan tawes (♂♀) Ikan Mas (♂♂♀ disuntik) dan ikan tawes (♂♀) Ikan Mas (♂♂ tidak disuntik, ♀ disuntik) dan ikan tawes (♂♀) Ikan Mas (♀♀♀disuntik) dan ikan tawes (♂♀) Ikan Mas (♀♀♀ tidak disuntik) dan ikan tawes (♂♀) Metode Penelitian Persiapan Induk Induk telah siap digunakan sebagai organisme uji ketika telah matang gonad. Kematangan gonad pada ikan mas betina ditandai dengan perut yang membesar, gerakan lamban, lubang genital agak terbuka dan memerah. Pada ikan 13 tawes betina, kematangan gonad ditandai dengan perut yang membuncit pula ke arah anus dan bila diraba terasa lunak. Tanda lain adalah terlihatnya pembuluh darah pada sirip dada, sirip perut dan sirip ekor lebih jelas daripada biasanya dan berwarna kemerah-merahan. Kematangan induk jantan ditunjukkan oleh keluarnya cairan putih dengan mudah jika perutnya diurut dari bagian perut ke arah anus. Persiapan wadah Wadah yang digunakan berupa bak fiber berbentuk bulat dengan volume 2.25 ton sebanyak 15 unit yang masing-masing di dalamnya ditempatkan hapa sebagai pemisah antara ikan mas dan ikan tawes (Gambar 7). Kakaban ditempatkan dalam bak untuk tempat penempelan telur ikan mas. Air dialirkan ke bak pemijahan hingga tinggi air kira-kira 75 cm setelah pemasangan hapa selesai kemudian diaerasi. Temperatur berkisar antara 25–27 oC. Pada setiap wadah ditempatkan kamera perekam dengan jarak 50 cm dari atas permukaan air untuk pengamatan tingkah laku ikan sebelum, selama dan setelah pemijahan. Gambar 7 Wadah perlakuan yang digunakan selama penelitian; hapa sebagai pemisah antara ikan mas dan ikan tawes (panah) Pemberokan Induk Induk-induk ikan diberok terlebih dahulu sebelum dipijahkan, yaitu dengan memelihara induk jantan dan induk betina secara terpisah untuk menghindari pemijahan liar. Pemberokan juga bertujuan untuk membuang sisa pakan dan mengurangi lemak pada daerah ovarium induk betina sehingga tidak mengganggu kelancaran pelepasan telur. Pemberokan ikan mas dilakukan selama 2 hari dan ikan tawes selama 5 hari. Pengambilan Contoh Telur Pengambilan contoh telur dilakukan setelah pemberokan untuk keperluan pengukuran diameter dan melihat posisi inti telur. Pengambilan contoh telur 14 dilakukan dengan metode kanulasi pada semua induk ikan mas dan ikan tawes (Gambar 8A). Contoh telur diambil minimal sebanyak 30 butir per ekor (Taufek et al. 2009). Pengamatan posisi inti telur dilakukan dengan meneteskan secara merata larutan serra (alkohol 99% : formaldehida 40% : asam asetat 100% dengan perbandingan 6 : 3 : 1) pada sampel telur (Yueh dan Chang 2000; Zarski et al. 2011), kemudian diamati di bawah mikroskop. Diameter telur diukur dengan menggunakan mikroskop dengan pembesaran 40x yang dilengkapi dengan mikrometer okuler. Pengambilan Contoh Darah Contoh darah diambil untuk keperluan analisis hormon testosteron dan estradiol. Pengambilan contoh darah dilakukan hanya pada induk ikan mas, sebanyak dua kali, yaitu sebelum penyuntikan pertama dan setelah pemijahan. Ikan dianestesi terlebih dahulu sebelum pengambilan contoh darah dengan cara direndam ke dalam larutan 2-fenoksi etanol (0.3 mL L-1 air media). Ikan kemudian di beri tanda dan contoh darahnya diambil sebanyak 1.5 mL dari vena ekor (MUAWC 2008) dengan menggunakan spuit 23G (UNZEN) yang telah diisi larutan antikoagulan (Natrium citrat hydrat 3.8%) 0.1 mL (Gambar 8B), kemudian disentrifus selama 15 menit dengan kecepatan 3000 rpm pada suhu 4 oC. Supernatan berupa plasma diambil kemudian dimasukkan ke dalam tabung polietilen dan disimpan pada suhu -20 oC sampai saat analisis hormon dilakukan. Ikan uji kemudian dimasukkan ke dalam bak fiber untuk pemulihan selama 2 jam sebelum penyuntikan dilakukan. Penyuntikan Induk Induk ditimbang terlebih dahulu sebelum penyuntikan dilakukan untuk menentukan banyaknya hormon yang disuntikkan. Induk disuntik dengan ovaprim pada dosis 0.6 mL kg-1 bobot tubuh secara intramuskular (Gambar 8C) untuk merangsang ovulasi. Penyuntikan hanya dilakukan pada ikan mas. Penyuntikan dilakukan sebanyak 2 kali untuk ikan betina (dosis 30 : 70) dengan interval penyuntikan masing-masing selama 6 jam dan 1 kali untuk ikan jantan. Pada perlakuan K(-) atau perlakuan A tidak dilakukan penyuntikan. (A) (B) (C) Gambar 8 Pengambilan telur dengan metode kanulasi (A); pengambilan sampel darah dari vena ekor (B); penyuntikan induk dilakukan secara intramuscular (C) Pemijahan dengan sistem imbas Sesaat setelah penyuntikan, induk-induk ikan kemudian dimasukkan kedalam wadah penelitian. Padat penebaran pada masing-masing bak adalah 15 3 ekor ikan mas (jenis kelamin sesuai perlakuan) dan 2 ekor ikan tawes (1 jantan + 1 betina). Setelah penyuntikan kedua pada ikan mas, dilakukan pengamatan terhadap respon ikan tawes selama 12 jam. Jika induk-induk ikan tawes belum mijah, maka pengamatan dilanjutkan sampai 36 jam kemudian, dengan interval pemeriksaan setiap 3 jam. Parameter Penelitian Tingkat Kematangan Gonad Tingkat kematangan gonad pada induk ikan mas dan ikan tawes dapat dilihat dari diameter dan posisi inti telurnya. Telur yang telah matang memiliki ukuran diameter maksimum dan inti telur yang tampak jelas, lebih kecil dan berada di tengah (fase dorman) atau sudah mulai bergerak ke tepi (germinal vesicle migration, GVM) (Rottmann et al. 1991; Yueh dan Chang 2000). Tingkah Laku Reproduksi Ikan Tingkah laku reproduksi ikan dapat dibagi menjadi tiga yaitu tingkah laku pada fase prapemijahan, pemijahan dan pasca pemijahan. Pengamatan dilakukan pada ikan mas dan ikan tawes pada ketiga fase tersebut. Diameter Telur Pengukuran diameter telur dipengaruhi oleh perbesaran lensa objektif. Penghitungan pengukuran diameter telur menggunakan rumus : A = B/C x 0.01 mm A = ukuran sebenarnya dalam mm, B = nilai yang diperoleh dari pengamatan mikrometer, C = pembesaran lensa dibagi 100. Waktu Induk Mencapai Ovulasi Setelah penyuntikan kedua, dilakukan pencatatan terhadap lama waktu masing-masing ikan memijah. Waktu ikan mas mencapai ovulasi (WOM) dihitung sebagai waktu yang diperlukan ikan mas dari mulai penyuntikan kedua hingga mijah. Waktu ikan tawes mencapai ovulasi (WOT) dihitung sebagai waktu yang diperlukan ikan tawes mulai dari ikan mas mijah hingga ikan tawes mijah. Derajat Pemijahan (DP) Ikan Tawes Persentase induk yang berovulasi ditentukan dari jumlah induk yang mengalami ovulasi pada setiap perlakuan dibagi dengan total induk pada perlakuan tersebut dan dinyatakan dalam persen, yaitu dapat dihitung dihitung dengan menggunakan rumus : Jumlah induk yang mengalami ovulasi DP = x 100 % Jumlah seluruh induk Jumlah Telur yang Diovulasikan (TO) pada Ikan Tawes Jumlah telur yang diovulasikan dapat dihitung dengan menggunakan rumus : TO = (Bg/Bs) x N 16 TO = jumlah telur yang diovulasikan, Bg = bobot gonad (g), Bs = bobot sub sampel gonad (g), N = jumlah telur dalam sub sampel gonad (butir). Derajat Pembuahan (Fertilization Rate, FR) Telur Ikan Tawes Derajat pembuahan telur merupakan persentase telur yang dibuahi dari sejumlah telur yang dipijahkan. Telur yang dibuahi akan tampak berwarna bening transparan, sedangkan telur yang tidak dibuahi akan berwarna putih keruh. Derajat pembuahan telur dapat dihitung dengan rumus : Jumlah telur yang dibuahi FR = x 100 % Jumlah Telur yang dipijahkan Derajat Penetasan (Hatching Rate, HR) Ikan Tawes Derajat penetasan pada ikan tawes ditentukan dari jumlah telur yang menetas dibagi dengan total telur yang dibuahi dan dinyatakan dalam persen. Derajat penetasan dapat dihitung dengan menggunakan rumus sebagai berikut : Jumlah telur yang menetas HR = x 100 % Jumlah Telur yang dibuahi Konsentrasi Hormon Testosteron dan Estradiol Ikan Mas Hormon testosteron dan estradiol dianalisis dengan Enzyme Linked Immuno Absorbent Assay (ELISA). Parameter Kualitas Air Pada penelitian ini dilakukan pengamatan terhadap beberapa parameter kualitas air sebagai data penunjang seperti suhu, DO dan pH. Analisis Data Data dianalisis secara deskriptif dan ditampilkan dalam bentuk tabel dan gambar. 4 HASIL DAN PEMBAHASAN Tingkat Kematangan Gonad Induk-induk ikan yang siap dipijahkan telah matang gonad. Hal ini dapat dilihat secara visual dengan mengamati ukuran diameter telur dan posisi intinya. Berdasarkan hasil pengamatan diameter dan posisi inti (germinal vesicle) telur pada penelitian ini, tampak bahwa induk-induk ikan yang digunakan baik ikan mas maupun ikan tawes telah matang gonad. Kematangan telur tersebut juga dapat dilihat dari penampilan telur yang bulat dan seragam ukurannya. 17 Diameter Telur Ukuran diameter telur pada masing-masing induk ikan mas dan ikan tawes yang digunakan dapat dilihat pada Tabel 2, Tabel 3 dan Lampiran 2. Tabel 2 Ukuran diameter (mm) telur ikan mas A B Perlakuan C 1 1.5±0.12 1.5±0.07 1.6±0.08 2 1.5±0.14 1.4±0.07 1.4±0.10 3 1.4±0.05 1.5±0.06 1.5±0.09 Ulangan D 1.3±0.18 1.2±0.13 1.8±0.16 1.2±0.04 1.5±0.06 1.7±0.11 1.5±0.05 1.6±0.09 1.6±0.10 E 1.1±0.11 1.6±0.14 1.4±0.17 1.5±0.10 1.5±0.10 1.3±0.10 1.6±0.08 1.5±0.09 1.4±0.10 D 0.7±0.04 0.7±0.05 0.7±0.03 E 0.7±0.05 0.7±0.03 0.7±0.04 n = 30, rerata±simpangan baku Tabel 3 Ukuran diameter (mm) telur ikan tawes Perlakuan Ulangan 1 2 3 A 0.7±0.03 0.7±0.03 0.7±0.03 B 0.7±0.04 0.7±0.05 0.7±0.04 C 0.7±0.04 0.7±0.05 0.7±0.04 n = 30, rerata±simpangan baku Semakin berkembang tingkat kematangan gonad, diameter telur yang ada dalam gonad akan menjadi semakin besar sampai mencapai ukuran maksimum. Secara umum, ukuran diameter telur ikan termasuk ikan mas dan ikan tawes sangat dipengaruhi oleh umur, lingkungan, genetik, nutrisi dan siklus reproduksi. Kematangan seksual pada ikan dicirikan oleh perkembangan diameter rata-rata telur dan melalui distribusi penyebaran ukuran telurnya (Effendie 2002). Telur yang matang pada ikan zebra (Brachydanio rerio) berbentuk bulat, transparan, dan tidak terikat satu sama lain, sedangkan telur yang belum matang berwarna buram, bentuk dan ukurannya tidak teratur dan saling menempel satu sama lain (Chen dan Martinich 1975). Berdasarkan kedua tabel di atas terlihat bahwa rata-rata diameter telur ikan mas berkisar antara 0.99–1.96 mm, sedangkan ikan tawes berkisar antara 0.67– 0.75 mm. Hasil pengukuran diameter oosit matang untuk ikan mas oleh Rottmann et al. (1991) berkisar antara 0.9–1.2 mm dan Linhart et al. (1995) berkisar antara 1.24–l .42 mm. Hasil penelitian Tempero et al. (2006) menunjukkan bahwa ratarata diameter oosit ikan mas berkisar antara 0.30 dan 1.85 mm dengan rata-rata diameter oosit matang adalah 1.16 mm. Sementara ukuran diameter oosit matang pada ikan tawes berkisar antara 0.68 dan 0.78 mm dengan rata-rata 0.70 mm (Bhuiyan et al. 2006). 18 Posisi Inti Telur Keberhasilan metode Cangkringan ditandai dengan memijahnya ikan tawes karena pengaruh pemijahan ikan mas. Keberhasilan tersebut sangat ditentukan oleh kematangan induk ikan mas dan ikan tawes. Meskipun ukuran diameter telur beragam, tetapi jika dilihat dari kematangan secara fisiologis, yaitu dari posisi inti telur semua induk ikan tawes dan ikan mas yang digunakan pada setiap perlakuan sudah berada pada kondisi siap mijah (Gambar 9 dan Lampiran 3). (A) 1 (B) 1 (C) 1 (D) 1 (E) 1 (E) 2 (A) 2 (B) 2 (C) 2 (D) 2 (E)2 (A) 3 (B) 3 (C) 3 (D) 3 (E) 3 Gambar 9 Posisi inti telur ikan tawes, inti telur pada fase istrahat (panah putih); inti telur bergerak ke tepi : GVM (panah hitam) Pengamatan terhadap posisi inti telur merupakan metode yang baik untuk menentukan perkembangan dan tingkat kematangan telur. Rottmann et al. (1991) menyatakan bahwa diameter, penampilan dan posisi inti telur adalah indikator visual perkembangan telur. Menurut Kucharczyk et al. (2008) posisi inti telur sebagai tanda kematangan telur, ditentukan dalam empat tahap kematangan yaitu tahap 1 : inti telur (GV) berada di tengah, tahap 2 : awal migrasi inti (kurang dari setengah jari-jari telur), tahap 3 : akhir migrasi inti (lebih dari setengah jari-jari telur), tahap 4 : inti periferal atau germinal vesicle breakdown (GVBD). Inti telur yang terlihat lebih kecil dari ooplasma dan terletak di tengah berada pada fase istrahat/dorman, menunggu sinyal pemijahan. Gerakan inti dari pusat telur ke tepi (germinal vesicle migration) merupakan langkah awal untuk ovulasi (Woynarovich dan Horvath 1980; Rottmann et al. 1991). Inti telur yang berada pada posisi lebih dekat ke pusat dibanding ke pertengahan jari-jari telur diklasifikasikan telah mencapai keadaan matang tahap II (Zarski et al. 2011). Selanjutnya Yueh dan Chang (2000) menjelaskan bahwa telur yang matang ditandai dengan ooplasma yang transparan dan inti yang bergerak menuju ke bagian peripheral. 19 Tingkah Laku Pemijahan Tingkah laku induk-induk ikan pada semua perlakuan hampir sama sesaat setelah dimasukkan ke dalam bak pemijahan. Pada perlakuan A, B dan C (♂♂♀), induk-induk ikan mas baik jantan maupun betina berenang secara perlahan mengelilingi bak pemijahan dengan arah berbeda satu sama lain. Induk ikan akan membelokkan badannya ketika bertemu dengan ikan mas lainnya. Demikian pula pada perlakuan D dan E (♀♀♀), induk-induk ikan berenang perlahan, beriringan, terkadang berlawanan arah kemudian berbelok, sesekali kepalanya menyundul kakaban atau diam bergerombol di dasar memperhatikan ikan tawes. Hal yang sama terjadi pula pada ikan tawes, dimana induk-induk ikan tawes (♂♀) pada semua perlakuan berenang perlahan sesaat setelah dimasukkan ke dalam bak pemijahan. Kadang terlihat berenang di bawah kucuran air, terkadang berenang perlahan mengitari pinggiran sekat hapa kemudian diam memperhatikan ikan mas. Pada perlakuan B dan C, aktifitas induk-induk ikan mas mulai terlihat aktif setelah penyuntikan kedua. Ketika mereka aktif secara seksual, ikan mas jantan mengejar dan menyentuh bagian urogenital ikan mas betina. Terkadang berenang disamping ikan betina, menempelkan badannya dan mendorong ikan betina sambil mengitari bak pemijahan. Kadang-kadang ikan akan berenang ke atas kakaban, untuk mengevaluasi manfaatnya dalam oviposisi (Kobayashi et al. 2002). Selanjutnya pemijahan terjadi, ditandai dengan ikan jantan semakin agresif mengejar ikan betina, memastikan dirinya selalu berada di samping ikan betina. Kadang-kadang ikan tersebut menyembulkan kepalanya ke permukaan air. Gerakan-gerakan ini semakin agresif sehingga menimbulkan percikan-percikan air ke permukaan. Ikan betina terlihat membalikkan badannya tepat di bawah kakaban untuk oviposisi. Pada saat itulah ikan jantan berenang cepat melepaskan sperma untuk membuahi telur. Selama masa pemijahan ikan jantan dan betina secara langsung menyamakan tingkah lakunya untuk mencapai pelepasan gamet yang serempak (terkoordinasi) seperti oviposisi dan pelepasan sperma (Liley dan Stacey 1983). Setelah terjadi pemijahan, air terlihat seperti berminyak, berbusa dan berbau amis. Hal yang sama juga terjadi pada ikan tawes. Ketika ikan mas terlihat agresif, ikan tawes juga mulai menunjukkan perilaku agresif. Ikan-ikan tawes jantan menempelkan badannya ke badan ikan tawes betina, berputar-putar dan berusaha untuk menggiring ikan tawes betina dari satu tempat ke tempat lain dengan gerakan yang cepat disertai suara gaduh berupa dengungan. Perilaku yang sama juga terjadi pada perlakuan D dan E. Jika waktu untuk memijah telah tiba, maka perilaku agresif dan kejar-kejaran juga terjadi walaupun tanpa ikan mas jantan. Namun yang terlihat beda dengan perlakuan lain adalah ikan tawes lebih dahulu menunjukkan perilaku agresif baru diikuti ikan-ikan mas betina. Meskipun demikian, ikan tawes tidak mendahului ikan mas untuk memijah. Ikan tawes memijah mengikuti pemijahan ikan mas dengan interval waktu antara 51 menit sampai 31 jam 19 menit, dimana pemijahan alami terjadi dengan interval waktu antara 6 jam 55 menit sampai 8 jam 5 menit (Tabel 4). Pascapemijahan, induk-iduk ikan mas berenang perlahan. Kadang terlihat memakan telur-telur yang menempel pada kakaban atau sekat hapa. Oleh karena itu, ketika kakaban terlihat sudah dipenuhi telur, perlu di pindahkan ke bak penetasan dan diganti dengan kakaban yang baru. 20 Imbas Pemijahan Ikan Mas Terhadap Ikan Tawes Hasil penelitian ini memperlihatkan bahwa ikan tawes dapat memijah secara alami atau melalui stripping karena rangsangan ikan mas yang memijah baik disuntik maupun tidak disuntik ovaprim (Tabel 4 dan Lampiran 4). Tabel 4 Jumlah ikan mas dan tawes yang mijah, waktu ikan mas mencapai ovulasi (WOM), waktu ikan tawes mencapai ovulasi (WOT), dan derajat pemijahan (DP) ikan tawes Perlakuan Ulangan A (♀♂♂ tidak disuntik) 1 2 3 1 2 3 1 2 3 B (♀♂♂ disuntik) C (♀ disuntik ♂♂ tidak disuntik) D1 (♀♀♀ disuntik) D2 (♀♀♀ disuntik) D3 (♀♀♀ disuntik) E1 (♀♀♀ tidak disuntik) E2 (♀♀♀ tidak disuntik) E3 (♀♀♀ tidak disuntik) Induk ke 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 Pemijahan ikan mas Ala Strip mi ping + + + + + + + - + + + + + + + + + + + + - + - Pemijahan ikan tawes Ala Strip mi ping + + + + + - - - - + - + - + - - + - WOM (jam) WOT (jam) td 6.15” 8.2” 5 * 18.24” 5.13 7.23” 51” 26.3” 6.55” 8.5” 8.33” 11.06” 2.57” 2.57” 18” 18” td td td td td td td - * Mijah sesaat sebelum penyuntikan kedua. ** Mijah alami tanpa penyuntikan, tidak dihitung sebagai kontrol negatif. td Perlakuan tanpa penyuntikan, waktu pencapaian ovulasi tidak terdeteksi. DP tawes (%) ** 0 100 33.33 - 31.19” 66.67 13.53” 12.2” - 6.58” 66.67 21 Pencapaian interval waktu imbas tercepat pada pemijahan ikan tawes secara alami karena pengaruh pemijahan ikan mas terjadi pada perlakuan B3 (K+), yaitu 6 jam 55 menit, kemudian perlakuan E3 yaitu 6 jam 58 menit, dan C3 yaitu 8 jam 5 menit. Begitu pula hasil pengamatan pada jumlah induk ikan tawes yang mijah karena pengaruh imbas ikan mas, hasil tertinggi diperoleh pada perlakuan B yaitu sebesar 100%, kemudian diikuti oleh perlakuan D dan E yang memberikan hasil yang sama yaitu 66.7%. Hasil terendah diperoleh pada perlakuan C sebesar 33.3% dan perlakuan A (K-) sebesar 0% (Tabel 4). Perlakuan B memberikan interval waktu imbas tercepat dan derajat pemijahan tertinggi, diduga karena penyuntikan ovaprim pada semua induk ikan mas baik jantan maupun betina pada perlakuan ini membantu meningkatkan konsentrasi LH. Akibat kerja LH, lapisan teka akan mensintesis hormon 17αhidroksiprogesteron yang kemudian di lapisan granulosa akan diubah oleh enzim 20β-hidroxysteroid dehidrogenase (20β-HSD) menjadi 17α,20β-P yang beraksi sebagai maturation inducing steroid (MIS) (Zairin 2003; Nagahama et al. 2005; Nagahama dan Yamashita 2008). Steroid ini akan mendorong inisiasi meiosis inti dan pematangan folikel serta ovulasi pada betina. Pada jantan steroid ini juga menginisiasi pembelahan meiosis spermatogonium dan mengendalikan pematangan spermatozoa serta spermiasi (Mylonas dan Zohar 2001; Yaron dan Levavi-Sivan 2011). Steroid 17α,20β-P dalam bentuk bebas dan konjugatnya berfungsi sebagai feromon (Yaron dan Levavi-Sivan 2011). Selama proses ovulasi dan spermiasi, terjadi perubahan tingkah laku ikan mas yang menjadi lebih agresif. Perubahan tingkah laku tersebut menyebabkan banyaknya urin yang dikeluarkan oleh ikan mas yang mengakibatkan banyaknya feromon yang dilepaskan ke air melalui urin tersebut (Appelt dan Sorensen 2007). Feromon yang dilepaskan ke air merupakan stimulasi dari ikan mas yang memicu terjadinya pemijahan pada ikan tawes. Isyarat-isyarat feromon ini pada ikan dapat masuk melalui organ penciuman (olfactory bulb), kemudian di teruskan ke sistem syaraf pusat, selanjutnya mengaktifkan poros hipothalamus-pituitari-gonad (Zielinski dan Hara 2007). Selanjutnya pada perlakuan D yang juga diinjeksi ovaprim terdapat dua pasang ikan tawes yang mijah, yaitu pada ulangan ke-2 dan ke-3 dengan jumlah ikan mas yang memijah masing-masing sebanyak 2 ekor, tetapi pada ulangan ke-1 tidak terjadi pemijahan pada ikan tawes. Hal ini diduga karena feromon yang dikeluarkan ikan mas betina pada ulangan ini tidak cukup untuk mengimbas tawes, karena ketiadaan ikan mas jantan. Selain itu hanya terdapat 1 ekor induk ikan mas yang memijah yang berperan sebagai pengimbas. Hasil yang sama ditunjukan pada perlakuan E dimana induk-induk ikan mas tidak diinjeksi ovaprim, namun karena terjadi pemijahan pada ikan mas sehingga terdapat 2 pasang ikan tawes yang mijah yaitu pada ulangan ke-1 dan ke-3. Namun demikian pada ulangan ke-2 tidak terjadi pemijahan pada ikan tawes walaupun semua ikan mas (3 ekor) mijah pada ulangan ini. Diduga telur ikan tawes pada perlakuan ini belum benar-benar matang. Dugaan lain adalah terdapat kelebihan metabolit dalam air yang dilepaskan ikan mas pada saat ovulasi yang menyebabkan ikan tawes tidak terangsang untuk melakukan pemijahan. Aksi feromon dan metabolitnya yang dikeluarkan pada saat ovulasi mungkin dapat mengaktifkan atau menonaktifkan poros hipothalamus-pituitari-gonad (Chen dan Martinich 1975). Sifat kimia dari metabolit penghambat pemijahan tersebut belum 22 diketahui, namun Greene (1966) menduga bahwa metabolit tersebut adalah amonia. Pada kedua perlakuan D dan E di atas, tidak terdapat ikan mas jantan namun ikan mas betina pun dapat mengimbas ikan tawes (DP = 66.7%). Hal ini disebabkan karena ikan betina juga melepaskan feromon pada saat ovulasi (Kobayashi et al. 2002; Lim dan Sorensen 2012). Pemijahan ikan mas yang terjadi pada perlakuan E yang tidak disuntik ovaprim dan tanpa kehadiran ikan jantan, diduga disebabkan oleh mekanisme stres. Mekanisme ini mengaktifkan poros hyphothalamus-hipofisis-ginjal-gonad. Gonadotropin tampaknya merangsang interrenal ginjal untuk memproduksi kortikosteroid yang pada gilirannya beraksi pada oosit sebagai MIS (Sundararaj dan Goswami 1977) yang membantu gonad membentuk maturation promoting factor (MPF) yang menyebabkan inti telur bermigrasi ke arah mikrofil kemudian melebur (Yaron 1995). Pada perlakuan A1 terjadi pemijahan pada induk ikan mas walaupun indukinduk ikan mas pada perlakuan ini tidak disuntik ovaprim. Hal ini dapat diduga bahwa gonad ikan betina sudah cukup matang dan didukung oleh kehadiran ikan jantan sebagai lawan jenis (Woynarovich dan Horvath) dapat merangsang ikan betina untuk ovulasi. Begitupula ikan jantan akan menunjukkan peningkatan aktivitas berenang bila terkena bau ikan betina yang matang gonad (Sorensen dan Stacey 2004). Peningkatan aktivitas berenang tersebut menyebabkan banyaknya urin yang dikeluarkan oleh ikan mas jantan yang mengakibatkan banyaknya feromon yang dilepaskan ke air melalui urin (Appelt dan Sorensen 2007). Pelepasan feromon oleh ikan mas jantan dapat menyebabkan ovulasi pada ikan mas betina yang selanjutnya memberikan pengaruh imbas pada pemijahan ikan tawes. Hasil penelitian ini membuktikan bahwa feromon dari ikan mas yang berovulasi dapat menyebabkan ikan tawes mijah dan metode Cangkringan berpotensi tinggi menjadi solusi alternatif pemijahan ikan menggantikan metode kawin suntik yang menggunakan ekstrak kelenjar hipofisa atau hormon gonadotropin lain yang selama ini biasa diterapkan dalam akuakultur. Fekunditas, Derajat Pembuahan (FR) dan Derajat Penetasan Telur (HR) Hasil perhitungan fekunditas ikan tawes menunjukkan bahwa ikan tawes yang mijah karena pengaruh imbas ikan mas yang disuntik (perlakuan B, C dan D) memberikan fekunditas yang tinggi dibanding dengan yang tidak disuntik (perlakuan A dan E) (Tabel 5 dan Lampiran 5). Fekunditas tertinggi diperoleh pada perlakuan B, C dan D yaitu masing-masing sebanyak 71 460, 35 730 dan 32 752 butir telur. Hal ini diduga bahwa pengaruh pemberian ovaprim mengakibatkan tingginya konsentrasi gonadotropin pada induk-induk ikan mas pada perlakuan ini sehingga feromon yang diberikan cukup kuat untuk merangsang ikan tawes mijah. Feromon sebagai hormon eksternal, membantu menaikkan konsentrasi gonadotropin internal ikan tawes sehingga peluang telur matang dalam gonad semakin tinggi untuk diovulasikan. 23 Tabel 5 Bobot tubuh, fekunditas, derajat pembuahan (FR) dan derajat penetasan (HR) ikan tawes Perlakuan A B C D E Bobot ikan betina (Kg) 0.25 0.56 0.31 0.49 0.42 Fekunditas rata-rata (butir) 11 910 71 460 35 730 32 752 20 247 FR (%) HR (%)* 0 79.3 81.3 0 81.7 0 96.7 93.4 0 94.7 * Dihitung dari jumlah telur yang terbuahi. Derajat pembuahan dan penetasan telur ikan tawes memberikan hasil yang tinggi dan hampir sama pada semua perlakuan hasil permijahan alami (perlakuan B, C dan E) masing-masing berkisar antara 79.3–81.7% dan 93.4–96.7% (Tabel 5). Nilai yang hampir sama yang ditunjukkan pada perlakuan-perlakuan tersebut diduga terjadi karena terdapat pasangan induk ikan tawes dalam jumlah yang sama pula baik jantan maupun betina pada setiap perlakuan. Namun pada perlakuan D dan A dimana ikan tawes memijah dengan cara distripping, tidak terdapat telur yang menetas karena tidak terbuahi. Derajat pembuahan sangat ditentukan oleh kualitas dan kuantitas sperma yang dipengaruhi oleh nutrisi, musim, temperatur, frekuensi pemakaian jantan dan hereditas. Banyaknya jumlah sperma yang dikeluarkan dari seekor ikan jantan bergantung pula kepada umur, ukuran dan frekuensi ejakulasi. Selain itu, tingkat pembuahan juga dipengaruhi oleh kondisi kematangan telur yang berkaitan dengan proses vitelogenesis sebelum telur diovulasikan (Zairin et al. 2005). Derajat penetasan dipengaruhi oleh faktor internal berupa kerja hormon dan volume kuning telur serta faktor eksternal berupa suhu, oksigen terlarut dan intensitas cahaya (Affandi dan Tang 2002). Rendahnya derajat pembuahan dan penetasan pada perlakuan yang memijah secara stripping diduga sangat dipengaruhi oleh kesalahan manusia. Telur ikan tawes yang terbuahi berwarna bening transparan dan embrio berbentuk huruf koma. Telur-telur tersebut umumnya akan menetas selama 2–3 hari setelah masa inkubasi. Larva yang hidup terlihat transparan, berukuran sangat kecil dan aktif berenang mencari makan, sedangkan larva yang mati berwarna putih keruh dan melayang di kolom air atau tenggelam di dasar kolam. Profil Hormon Testosteron (T) dan Estradiol (E 2 ) Ikan Mas Berdasarkan hasil analisis hormon testosteron dan estradiol pada plasma ikan mas, diperoleh hasil bahwa nilai T dan E 2 ikan mas berhubungan erat dengan status pemijahan ikan tawes (Tabel 6 dan Lampiran 6). 24 Tabel 6 Konsentrasi hormon testosteron (T) dan estradiol (E 2 ) ikan mas Status pemijahan Perlakuan ikan tawes Alami Alin/ Stripping Tidak mijah B3 C3 E3 A1 B1 B2 D2 D3 E1 A2 A3 C1 C2 Konsentrasi hormon pada betina E 2 (ng mL-1) Awal Akhir 0.22 0.89 0.13 0.62 0.39 0.86 1.40 1.46 1.45 1.35 0.37 0.28 0.51 0.40 1.06 1.13 0.46 1.01 0.72 0.72 0.48 3.55 2.70 0.96 0.11 3.23 T (ng mL-1) Awal Akhir 0.27 6.76 5.44 3.76 1.04 1.79 1.82 0.79 2.55 2.67 td td 2.46 0.69 td td 0.82 2.66 td td 2.95 >16.8 8.19 1.40 td td Konsentrasi hormon pada jantan T (ng mL-1) Awal Akhir 1.59 10.19 1.23 7.91 3.21 2.26 2.55 2.44 3.22 0.79 2.48 0.53 2.01 12.83 1.66 td 1.35 0.98 td tidak terdeteksi Konsentrasi T ikan mas jantan sebesar 2.26–10.19 ng mL-1 pada akhir pemijahan dapat memberikan pengaruh pemijahan baik secara stripping maupun secara alami pada ikan tawes (perlakuan B1, A1, B3 dan C3). Testosteron maupun steroid C19 lainnya diketahui dapat menginduksi peleburan inti pada konsentrasi yang tinggi (Nagahama dan Yamashita 2008) dan konjugat testosteron yang dilepaskan ke air bertindak sebagai feromon seks (Yaron dan Levavi-Sivan 2011). Konsentrasi E 2 ikan mas betina cenderung meningkat dari pemijahan alami ikan tawes ke tidak memijah. Pada pemijahan alami, terlihat konsentrasi berada di bawah 1 ng mL-1. Pada pemijahan alin konsentrasi meningkat di atas nilai 1 ng mL-1 pada 66.7% data yang dimiliki. Sedangkan pada ikan tawes yang tidak memijah, didapatkan informasi nilai konsentrasi meningkat hingga 3 ng mL-1 yang ditunjukkan oleh 50% data yang ada. Konsentrasi E 2 ikan mas betina yang rendah pada pemijahan alami menunjukkan bahwa konsentrasi steroid C21 terutama 17α,20β-P tinggi (Kobayashi et al. 2002) karena terjadi penurunan aktivitas enzim aromatase P450 sedangkan aktivitas enzim 20β-HSD meningkat (Nagahama dan Yamashita 2008). Steroid 17α,20β-P dalam bentuk bebas dan konjugatnya berfungsi sebagai feromon (Yaron dan Levavi-Sivan 2011). Konsentrasi T yang terlalu rendah (kurang dari 1 ng mL-1 ; perlakuan A2 dan C2) atau terlalu tinggi (12.83 ng mL-1 pada ikan mas jantan dan >16.8 ng mL-1 pada ikan mas betina ; perlakuan A3) tidak memberikan pengaruh pemijahan pada ikan tawes. Hasil yang sama dilaporkan Simanjuntak (2013) bahwa konsentrasi T yang tinggi (10.42–15.46 ng mL-1) pada ikan mas jantan pada akhir pemijahan tidak memberikan pengaruh pemijahan pada ikan tawes. 25 Kualitas air Dalam penelitian ini kualitas air yang diukur meliputi pH, oksigen terlarut dan suhu. Nilai pH, oksigen terlarut dan suhu air selama penelitian berada pada kisaran yang dapat ditoleransi oleh ikan mas dan ikan tawes, yaitu suhu 25–27 oC, oksigen terlarut 6.10–6.75 mg L-1 dan pH 6.5. Kondisi ini masih pada kisaran optimum bagi ikan mas dan ikan tawes (Tabel 7). Tabel 7 Nilai parameter kualitas air selama penelitian Parameter kualitas air Suhu (o C) Oksigen terlarut (mg L-1) pH Nilai pengukuran 25–27 6.10–6.75 6.5 Nilai optimum 25–30 >5 6.5–8.5 Pustaka SNI 1999 5 SIMPULAN DAN SARAN Simpulan Ikan mas betina yang berovulasi, baik secara alami maupun dengan suntikan ovaprim dapat memberikan pengaruh imbas pada pemijahan ikan tawes. Pengaruh tersebut dapat disebabkan baik berpasangan dengan jantan (heteroseks: ♂♂♀) maupun pasangan monoseks betina (♀♀♀) saja. Namun keberadaan ikan mas jantan memberikan pengaruh yang lebih kuat. Saran Perlu penelitian lebih lanjut untuk mengetahui organ yang berperan melepaskan feromon pada ikan mas dan organ yang menerima sinyal feromon pada ikan tawes. 26 DAFTAR PUSTAKA Affandi R, Tang UM. 2002. Fisiologi Hewan Air. Pekanbaru: UNRI Press. Appelt CW, Sorensen PW. 2007. Female golfish signal spawning readiness by altering when and where they release a urinary pheromone. Anim Behaviour 74:1329-1338. Arukwe A, Goksoyr A. 2003. Eggshell and egg yolk proteins in fish: hepatic proteins for the next generation: oogenetic, population, and evolutionary implications of endocrine disruption. Comp Hepatol 2:1-21. Bhatt JP, Sajwan MS. 2001. Ovarian steroid sulphate functions as priming pheromone in male Barilius bendelisis (Ham). J Biosci 26:253–263. Bhuiyan AS, Islam K, Zaman T. 2006. Fecqundity and ovarian characteristics of Puntius gonionotus (Bloch/Bleeker) (Cyprinidae: Cypriniformes). J Biosci 14:99-102. Burnard D, Gozlan RE, Griffiths SW. 2008. The role of pheromones in freshwater fishes. J Fish Biol 73:1-16. Chen L, Martinich RL. 1975. Pheromonal stimulation and metabolite inhibition of ovulation in the zebrafish, Brachydanio rerio. Fish Bull: 73:889894.Department of Zoology, San Diego State University. San Diego. Dorafshan S, Mostafavi H, Amiri BM. 2003. Induction of spawning in Common Carp (Cyprinus carpio) using pituitary extract and GnRH analogue in combination with Domperidone. Iranian J Biotechnol 1:213-217. Effendie MI. 2002. Biologi Perikanan. Yogyakarta: Yayasan Pustaka Nusatama. 163 hal. Greene GN. 1966. A reproduction control factor in the Cyprinids fish, Branchdanio rerio. FAO (Food Agricultural Organization). Fish Repr 44:86-92. Hong WS, Chen SX, Zhang QY, Zheng WY. 2006. Sex organ extract and artificial hormonal compounds as sex pheromones to atdract broodfish and to induce spawning of Chinese black sleeper (Bostrichthys sinensis Lacepede). Aquaculture Res 37:529-534. Kobayashi M, Sorensen PW, Stacey NE. 2002. Hormonal and pheromonal control of spawning behavior in the goldfish. Fish Physiol Biochem 26:71-84. Kottelat M, Whitden AJ, Kartikasari SN, Wiroatmodjo S. 1993. Freshwater fishes of Western Indonesia and Sulawesi. Periplus Edition (HK) Ltd. Jakarta. Kucharczyk D, Targonska K, Hliwa P, Gomułka P, Kwiatkowski M, Krejszeff S, Perkowski J. 2008. Reproductive parameters of common carp (Cyprinus carpio L) spawners during natural season and aout-of-season spawning. Repr Biol 8:285-289. 27 Lestari KL. 1998. Deskripsi mengenai pemijahan ikan tawes (Puntius javanicus Blkr) dengan cara induksi [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Liley NR, Stacey NE. 1983. Hormones, pheromones, and reproductive behaviour in fish. Di dalam: Hoar WS, Randall DJ, Donaldson EM, editor. Fish Physiol. Volume ke-9. New York: Academic Press Lim H, Sorensen PW. 2012. Common carp implanted with prostaglandin F 2α release a sex pheromone complex that atdracts conspecific males in both the laboratory and field. J Chem Ecol:Springer. 10 hlm Linhart O, Kudob S, Billard R, Slechtad V, Mikodina EV. 1995. Morphology, composition and fertilization of carp eggs: a review. Aquaculture 129:7593 Little E, Calfee R, Puglis H, Sorensen P, Gilligan D. 2011. Pheromones. U.S. Army Corps of Engineers Great Lakes and Mississippi River Interbasin Study. hlm 1-3 Matty AJ. 1985. Fish Endocrinology. Portland Oregon: Croom Helm London & Sidney Timber Press [MUAWC] Monash University Animal Welfare Committee. 2008. Blood collection guidelines. Monash University. hlm 1-10 Mylonas CC, Zohar Y. 2001. Endocrine regulation and artificial induction of oocyte maturation and spermiation in basses of the genus Morone. Aquaculture. 202:205-220 Nagahama Y.1994. Review, Endocrine regulation of gametogenesis in fish. Int J Dev Biol. 38: 217-229 Nagahama Y, Yoshikuni M, Yamashita M, Tanaka M. 1995. Regulation of oocyte maturation in fish. Di dalam: Hoar WS, Randall DJ, Donaldson EM, editor. Fish Physiol. Volume ke-13. New York: Academic Press Nagahama Y, Yamashita M. 2008. Review, Regulation of oocyte maturation in fish. Develop Growth Differ 50:S195–S219 Ohga H, Kaneko K, Shimizu A, Kitano H, Selvaraj S, Nyuji M, Adachi H, Yamaguchi A, Matsuyama M. 2012. Steroidogenic and maturationinducing potency of native gonadotropic hormones in female chub mackerel, Scomber japonicus. Repr Biol Endocrinol. BioMed Central. 20 hlm Pavlidis M, Dimitriou D, Dessypris A. 1994. Testosteron and 17β-estradiol plasma fluctuations throughout spawning period in male and female rainbow trout, Oncorhynchus mykiss (Walbaum), kept under several photoperiod regimes. Ann Zool Fennici 31:319-327 Rottmann RW, Shireman JV, Chapman FA. 1991. Determining sexual maturity of broodstock for induced spawning of fish. SRAC Publication No. 423. Southern Regional Aquaculture Center. Institute of Food and Agricultural Services, University of Florida. hlm 1-4 28 Shirali S, Majd NE, Mesbah M, Reza Seifi MR. 2012. Histological studies of Common Carp ovarian development during breeding season in Khouzestan Province, Iran. World J Fish Mar Sci 4:159-164 Simanjuntak L. 2013. Peran ikan mas (Cyprinus carpio) jantan dalam merangsang pemijahan ikan tawes (Barbonymus gonionotus) dengan metode Cangkringan [tesis]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. [SNI] Standar Nasional Indonesia. 1999. Produksi Benih Ikan Mas (Cyprinus carpio Linnaeus) Strain Majalaya Kelas Benih Sebar. (SNI 01-61331999). Jakarta: Badan Standarisasi Nasional Indonesia. Soedarman. 1979. Memijahkan ikan tawes (Puntius javanicus Blkr) dengan "sistim Cangkringan". Dinas Perikanan Daerah Istimewa Yogyakarta. 27 hlm Sorensen PW, Stacey NE. 2004. Brief review of fish pheromones and discussion of their possibe uses in the control of non-indigenous teleost fishes. NZ J Mar Freshwater Res 38:399-417 Srijunngam J, Kitana N, Callard IP, Watdanasirmkit K. 2005. Ultrastructural changes in the ovarian follicular wall during oocyte growth in the Nile Tilapia, Oreochromis niloticus Linn. The Nat History J Chulalongkorn Univ 5:21-30 Stacey NE, Sorensen PW. 2006. Reproductive pheromones. Di dalam: Sloman KA, Wilson RW, Balshine S, Farrel AP, Brauner CJ, editor. Behaviour and Physiology of Fish. Fish Physiol. Volume ke-24. USA: Elsevier Academic Press publication. hlm 359-400. Stacey NE, Van Der Kraak GJ, Olsen KH. 2012. Male primer endocrine responses to preovulatory female cyprinids under natural conditions in Sweden. J Fish Biol 80:147-165 Sundararaj BI, Goswami SV. 1977. Hormonal regulation of in vivo and in vitro oocyte maturation in the catfish, Heteropneustes fossilis (Bloch). General Comp Endocrinol 32:17-28 Sumantadinata K. 1983. Pengembangbiakan ikan-ikan peliharaan di Indonesia. Bogor: Sastra Hudaya Taufek N, Harmin SA, Christianus A. 2009. Effect of chicken gonadotropinreleasing hormone (cGnRH-II) on plasma steroid hormone, maturation and ovulation in African catfish, Clarias gariepinus (Burchell). African J Biotechnol 8:6700-6709 Tempero GW, Ling N, Hicks BJ, Osbome MW. 2006. Age composition, growth, and reproduction of Koi Carp (Cyprinus carpio) in the lower Waikato region, New Zealand. NZ J Mar Freshwater Res 40:571-583 Unal G, Karakisi H, Elp M. 2005. Ovarian follicle ultrastructure and changes in levels of ovarian steroids during oogenesis in Chalcalburnus tarichi Pallas. Turk J Vet Anim Sci 29:645-653 29 Woynarovich E, Horvath L. 1980. The artificial propagation of warm-water finfishes. A manual for extension. FAO Fisheries Technical Paper No. 201. Rome. Food and Agriculture Organization of the United Nation Yambe H, Kitamura S, Kamio M, Yamada M, Matsunaga M, Fusetani M, Yamazaki F. 2006. L-Kynurenine, an amino acid identified as a sex pheromone in the urine of ovulate female Masu Salmon. Proc Nat Acad Sci 103:15370-15374 Yaron Z. 1995. Endocrine control of gametogenesis and spawning induction in the Carp. Aquaculture 129:49-73 Yaron Z, Levavi-Sivan B. 2011. Endocrine regulation of fish reproduction. Di dalam: Farrell AP, editor. Encyclopedia of Fish Physiology: From Genome to Environment. Volume ke-2. San Diego: Academic Press. hlm 1500–1508. Yueh WS, Chang CF. 2000. Morphological changes and competence of maturing oocytes in the Protandrous Black Porgy, Acanthopagrus schlegeli. Zool Stud 39:114-122 Zairin Jr M. 2003. Endokrinologi dan peranannya bagi masa depan perikanan Indonesia. Orasi Ilmiah Guru Besar Tetap Ilmu Fisiologi Reproduksi dan Endokrinologi Hewan Air. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 70 hlm Zairin Jr M, Sari RK, Raswin M. 2005. Pemijahan ikan tawes dengan sistem imbas menggunakan ikan mas sebagai pemicu. J Akuakultur Indonesia 4:103–108 Zaki MI, Negm RK, El-Agamy A, Awad GS. 2005. Ovarian follicular ultrastructure of the oocytes of Boops boops with special reference to the vitelline envelope development and micropylar apparatus. Egyptian J Aquatic Res 31:326-356 Zarski D, Palinska K, Targonska K, Bokor Z, Kotrik L, Krejszeff S, Kupren K, Horvath A, Urbanyi B, Kucharczyk D. 2011. Oocyte quality indicators in Eurasian perch, Perca fluviatilis L., during reproduction under controlled conditions. Aquaculture 313:84–91 Zheng W, Strobeck C, Stacey N. 1997. The steroid pheromone 4-pregnen17α,20β-diol-3-one increases. J Experiment Biol 200: 2833–2840 Zielinski BS, Hara TJ. 2007. Olfaction. Fish Physiol: Sensory Systems Neurosci. Volume ke-25. Elsevier Inc. hlm 1-43 30 Lampiran 1 Desain percobaan 31 Lampiran 2 Diameter telur ikan mas dan ikan tawes pada ulangan 1, 2, dan 3 Descriptive Statistics: A, B, C, D1, D2, D3, E1, E2, E3 (Ikan mas ulangan 1) Variabel A B C D1 D2 D3 E1 E2 E3 Total Count 30 30 30 30 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 30 30 30 30 0 0 0 0 0 0 0 0 0 1.4725 1.5092 1.5700 1.2892 1.2308 1.7508 1.1317 1.6142 1.3992 0.1209 0.0699 0.0824 0.1767 0.1254 0.1619 0.1077 0.1374 0.1656 Descriptive Statistics: A, B, C, D, E (Ikan tawes ulangan 1) Variabel A B C D E Total Count 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 0 0 0 0 0 0.73417 0.66250 0.69500 0.65250 0.67750 0.02665 0.03520 0.03560 0.04012 0.04659 Descriptive Statistics: A, B, C, D1, D2, D3, E1, E2, E3 (Ikan mas ulangan 2) Variabel A B C D1 D2 D3 E1 E2 E3 Total Count 30 30 30 30 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 30 30 30 30 0 0 0 0 0 0 0 0 0 1.4500 1.4375 1.3875 1.1558 1.5392 1.6658 1.4650 1.5158 1.3317 0.1376 0.0739 0.1017 0.1017 0.0424 0.0615 0.1111 0.0990 0.1000 32 Descriptive Statistics: A, B, C, D, E (ikan tawes ulangan 2) Variabel A B C D E Total Count 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 0 0 0 0 0 0.71833 0.71500 0.70500 0.69833 0.68000 0.02780 0.04807 0.04707 0.04822 0.03243 Descriptive Statistics: A, B, C, D1, D2, D3, E1, E2, E3 (ikan mas ulangan 3) Variabel A B C D1 D2 D3 E1 E2 E3 Total Count 30 30 30 30 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 30 30 30 30 0 0 0 0 0 0 0 0 0 1.3917 1.5108 1.5333 1.4700 1.5600 1.5600 1.5625 1.4617 1.4258 0.0461 0.0649 0.0862 0.0506 0.0899 0.0964 0.0825 0.0880 0.0986 Descriptive Statistics: A, B, C, D, E (Ikan tawes ulangan 3) Variabel A B C D E Total Count 30 30 30 30 30 N N* Mean StDev 30 30 30 30 30 0 0 0 0 0 0.67667 0.69583 0.66917 0.70083 0.71667 0.02537 0.03601 0.03695 0.03314 0.03556 33 Lampiran 3 Posisi inti telur (panah) ikan mas pada ulangan I, II dan III (A)1 (B) 1 (C) 1 (D1) 1 (D2) 1 (D3) 1 (E1) 1 (E2) 1 (E3) 1 (A) 2 (D1) 2 (B) 2 (D2) 2 (C)2 (D3) 2 34 (E1) (A) 3 (D1) 3 (E1) 3 (E2) 2 (E3) 2 (B)3 (C)3 (D2) 3 (D3) 3 (E2) 3 (E3) 3 35 Lampiran 4 Waktu suntik, waktu ovulasi/pemijahan ovulasi/pemijahan ikan tawes Perlakuan A (♀♂♂ tidak disuntik) B (♀♂♂ disuntik) C (♀ disuntik ♂♂ tidak disuntik) Ulangan Tanggal 13/8/12 3/10/12 8/11/12 13/8/12 3/10/12 8/11/12 13/8/12 3/10/12 8/11/12 Ke1 2 3 1 2 3 1 2 3 Tanggal Induk ke D1 (♀♀♀ disuntik) 13/8/12 D2 (♀♀♀ disuntik) 3/10/12 D3 (♀♀♀ disuntik) 8/11/12 E1 (♀♀♀ tidak disuntik) E2 (♀♀♀ tidak disuntik) E3 (♀♀♀ tidak disuntik) 13/8/12 3/10/12 8/11/12 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 ikan Suntik I (WIB) 16.10 17.05 16.01 16.11 17.06 16.03 Suntik II (WIB) 22.10 23.10 22.00 23.12 22.03 Ovulasi / pemijahan mas Tanggal (WIB) 02.50 15/8/12 04.25 14/8/12 07.12 4/10/12 03.00 9/11/12 22.00 13/8/12 17.36 4/10/12 03.16 9/11/12 16.14 16.15 16.15 17.06 17.07 17.07 16.03 16.03 16.04 - 22.14 22.14 22.14 23.14 23.15 23.15 22.04 22.04 22.04 - 14/8/12 14/8/12 4/10/12 4/10/12 8/11/12 8/11/12 14/8/12 14/8/12 4/10/12 4/10/12 4/10/12 9/11/12 9/11/12 - 06.47 09.20 02.11 02.11 22.22 22.22 22.58 22.58 17.36 17.36 17.36 02.37 02.37 mas, waktu Ovulasi / pemijahan tawes Tanggal (WIB) 15/8/12 10.27 14/8/12 05.16 5/10/12 09.15 9/11/12 09.55 9/11/12 10.49 - - 5/10/12 09.30 9/11/12 11.15 15/8/12 11.00 - - 9/11/12 08.00 36 Lampiran 5 Fekunditas, derajat pembuahan (FR) dan derajat penetasan (HR) ikan tawes Perlakuan Ulangan A 1 2 3 Bobot tubuh (g) 250 610 330 1 2 3 300 620 760 1 2 3 160 830 310 1 2 3 200 750 220 1 2 3 600 500 240 Rata-rata B Rata-rata C Rata-rata D Rata-rata E Rata-rata Total Rata-rata * FR dan HR = 0 pada pemijahan secara stripping ** Dihitung dari jumlah telur yang terbuahi Fekunditas (butir) 11910 11910 83370 23820 107190 71460 35730 35730 35730 29775 32752.5 4764 35730 20247 160189.5 40047.38 FR (%) HR (%)** * - * - * * 79.33 * * 96.69 81.33 93.43 * * * * * 81.67 * 94.71 37 Lampiran 6 Konsentrasi hormon testosteron (T) dan estradiol (E 2 ) pada setiap perlakuan Perlakuan A1 A2 A3 B1 B2 B3 C1 C2 C3 D1 D2 D3 E1 E2 E3 Sex ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♂ ♂ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ ♀ Konsentrasi (ng/ml) T E2 Awal Akhir Awal Akhir 1.82 0.79 1.40 1.46 3.21 2.26 * * td td * * td td 0.72 0.72 2.63 td * * 2.32 0.53 * * 2.95 >16.8 0.48 3.55 1.53 16.21 * * 2.48 9.44 * * td 2.89 1.45 1.35 2.55 2.44 * * td td * * td td 0.37 0.28 4.67 0.79 * * 1.77 td * * 0.27 6.76 0.22 0.89 0.75 3.57 * * 2.42 >16.8 * * 8.19 1.40 2.70 0.96 1.66 td * * td td * * td td 0.11 3.23 0.76 1.04 * * 1.93 0.91 * * 5.44 3.76 0.13 0.62 1.30 5.96 * * 0.09 3.02 * * 2.11 3.06 0.63 2.79 td 0.89 td 0.89 td td td 1.40 td td 0.55 6.20 2.46 0.69 0.64 0.58 td td 0.38 0.21 td td 0.58 1.44 td td 0.44 0.60 td td 1.53 0.81 0.82 5.07 0.46 1.50 td 0.24 td 0.33 td td td 0.92 td td 0.26 td td td 0.10 0.22 td td 0.29 0.47 1.43 2.84 0.42 0.86 0.65 0.73 0.35 td 3.21 >16.8 0.74 3.74 Pemijahan ikan mas Alami Alin Pemijahan ikan tawes Alami Alin + - - + - - - - - - - - + - - + + - - + + - + - + - - - + - - - + - + - + + + + + + + + + + + + + - + - - - - + - + - + - - + - * Tidak dilakukan analisis estradiol pada ikan jantan; td Tidak terdeteksi 38 RIWAYAT HIDUP Penulis dilahirkan di Waha Tomia, Sulawesi Tenggara, pada tanggal 12 Mei 1983, sebagai putri kedua dari tujuh bersaudara, dari pasangan Bapak Mashud Ade Basu, S.Pd dan Ibu Mahadiah (Alm). Tahun 2000, penulis lulus dari SMA Negeri 1 Tomia Kabupaten Wakatobi, dan pada tahun yang sama diterima sebagai mahasiswa Jurusan Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Dayanu Ikhsanuddin Baubau Sulawesi Tenggara. Penulis menikah dengan Lukmanul Hakim dan telah dikaruniai seorang putri Fathimah (21 bulan). Sejak tahun 2006 penulis bekerja sebagai staf pengajar pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Universitas Dayanu Ikhsanuddin Baubau dan melanjutkan studi strata dua (S2) pada Agustus 2010 dengan bantuan dana dari Kementerian Pendidikan Nasional Direktorat Jenderal Pendidikan Tinggi, melalui Beasiswa Program Pascasarjana (BPPS) pada Mayor Ilmu Akuakultur Sekolah Pascasarjana IPB.