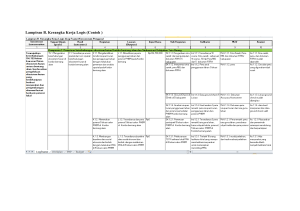
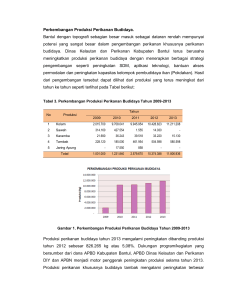
Transplantation of giant goramy testicular cells in Nile tilapia (PDF
advertisement

TRANSPLANTASI SEL TESTIKULAR IKAN GURAME PADA IKAN NILA DARMAWAN SETIA BUDI SKRIPSI DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2011 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi yang berjudul: TRANSPLANTASI SEL TESTIKULAR IKAN GURAME PADA IKAN NILA adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Bogor, Februari 2011 DARMAWAN SETIA BUDI C.14063519 ii ABSTRAK DARMAWAN SETIA BUDI. Transplantasi sel testikular ikan gurame pada ikan nila. Dibimbing oleh Alimuddin dan Odang Carman. Salah satu kendala dalam membudidayakan ikan gurame adalah kurangnya ketersediaan benih, sehingga diperlukan pengembangan teknologi rekayasa produksi benih untuk mengatasi permasalahan ini. Teknologi rekayasa produksi benih ikan melalui induk semang yang dihasilkan menggunakan teknik transplantasi sel testikular telah dikembangkan pada ikan salmonid. Teknologi transplantasi sel testikular membutuhkan ikan resipien yang cocok dan dapat menerima serta mendukung perkembangan sel spermatogonia ikan donor. Penelitian ini menguji potensi ikan nila sebagai resipien dengan mengamati kolonisasi sel donor dari ikan gurame pada gonad ikan nila. Ikan donor yang digunakan dalam penelitian ini berukuran 598,82 gram dengan Gonado Somatic Index (GSI) sebesar 0,013% dan persentase sel spermatogonia sebesar 28,22%. Sel testikular diinjeksikan pada larva ikan nila yang berumur sekitar 4 hari setelah menetas dengan dosis sebesar 20.000 sel/0,5 µl PBS. Analisis keberhasilan transplantasi dan kolonisasi sel donor dilakukan menggunakan metode PCR, masing-masing dengan cetakan DNA yang diekstraksi dari larva ikan nila umur 1 hari setelah injeksi dan gonad ikan nila umur sekitar 2 bulan. PCR dilakukan menggunakan primer spesifik bagi gen penyandi hormon pertumbuhan ikan gurame dan β-aktin ikan nila sebagai kontrol internal loading DNA. Hasil PCR menunjukkan bahwa ikan nila hasil transplantasi mempunyai pita DNA dengan ukuran yang sama pada ikan gurame, dan tidak ada pada ikan nila kontrol bukan hasil transplantasi. Persentase keberhasilan transplantasi pada larva adalah sebesar 100% (5/5) dan persentase individu resipien yang mengandung sel donor dalam gonadnya adalah 60% (3/5). Hal ini menunjukkan bahwa sel donor dari ikan gurame berhasil diinjeksikan dan dapat terkolonisasi dalam gonad ikan nila, sehingga ikan nila berpotensi digunakan sebagai resipien dalam transplantasi sel testikular ikan gurame. Analisis lebih lanjut perlu dilakukan untuk melihat kemampuan sel spermatogonia berkembang menjadi sperma dan telur dalam gonad ikan nila resipien. Kata kunci: ikan gurame, ikan nila, sel testikular, transplantasi, kolonisasi iii ABSTRACT DARMAWAN SETIA BUDI. Transplantation of giant gouramy testicular cells in Nile tilapia. Supervised by Alimuddin and Odang Carman. One of the constraints in the cultivation of giant gouramy is the lack of fry availability, necessitating the development of fry production engineering technology to address these issues. Engineering technology of fry production through the surrogate broodstock generated by testicular cells transplantation technique has been developed in salmonid. Testicular cells transplantation technology requires a suitable recipient that can accept and support the development of spermatogonia donor cell. This study examined the potential of Nile tilapia as a recipient for donor giant gouramy cells by observing its colonization in the gonads of Nile tilapia. Fish donor of 598,82 grams body weight with Gonado Somatic Index (GSI) of 0,013% and spermatogonial cells percentage of 28,22% was used. Testicular cells in amount of 20.000 cells/0,5 µl PBS were injected into peritoneal cavity of 4-day-old tilapia larvae. The success of transplantation and donor cell colonization were analyzed using PCR method with DNA template that have been extracted from tilapia larvae of 1 day post injection and the gonad of 2 months old fish. PCR was performed using a set of specific primer for the giant gouramy growth hormone gene and tilapia β-actin as an internal control of DNA loading. PCR results showed that the transplanted tilapia has a DNA band in the same size with giant gouramy, and not in untransplanted control. The success rate of transplantation in larvae was 100% (5/5) and the percentage of individual recipients containing donor cells in their gonad was 60% (3/5). This indicates that donor cells from giant gouramy was successfully injected and can be colonized in the gonads of Nile tilapia, so the Nile tilapia potentially be used as recipient for giant gouramy testicular cells transplantation. Further analysis needs to be conducted to observe the ability of spermatogonial cells develop into sperm and eggs in the gonad of tilapia recipient. Key words: giant gouramy, Nile tilapia, testicular cells, transplantation, colonization iv TRANSPLANTASI SEL TESTIKULAR IKAN GURAME PADA IKAN NILA DARMAWAN SETIA BUDI SKRIPSI sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2011 v Judul Skripsi : Transplantasi sel testikular ikan gurame pada ikan nila Nama : Darmawan Setia Budi NRP : C.14063519 Menyetujui, Pembimbing I Pembimbing II Dr. Alimuddin, S.Pi, M.Sc NIP. 19700103 199512 1 001 Dr. Ir. Odang Carman, M.Sc NIP. 19591222 198601 1 001 Mengetahui, Ketua Departemen Budidaya Perairan Dr. Ir. Odang Carman, M. Sc. NIP. 19591222 198601 1 001 Tanggal Pengesahan : ……………… vi KATA PENGANTAR Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga skripsi yang berjudul ”Transplantasi Sel Testikular Ikan Gurame pada Ikan Nila” ini berhasil diselesaikan. Skripsi ini bersumber pada hasil penelitian yang dilaksanakan sejak bulan Maret 2010 sampai Agustus 2010 bertempat di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis menyadari bahwa selesainya skripsi ini tidak lepas dari segala bantuan dan dukungan berbagai pihak, baik ide, pemikiran, tenaga, moril maupun materil. Oleh karena itu penulis menyampaikan rasa terima kasih yang mendalam kepada: 1. Dr. Alimuddin dan Dr. Odang Carman selaku dosen pembimbing skripsi; 2. Dr. Mia Setiawati selaku dosen pembimbing akademik dan Dr. Munti Yuhana sebagai dosen penguji tamu; 3. Mama, Bapak, mbak Nia, dan dek Ajeng atas do’a, kasih sayang, dukungan moril, maupun materil selama ini; 4. Anna Octavera, S.Pi., yang banyak membantu dalam penelitian dan penyusunan serta penulisan skripsi ini; 5. Rekan-rekan kerja dan sebimbingan (Jasmadi, Yuli, Gilang, Thami, Sekar, ka Fuad, ka Ade, bu Irma Wati, bu Yulintin, bu Helen, mas Demin, dan bang Indra) dan teman-teman kosan (Age, Dwi, Misbah, Tajuddin, dan Faris), serta rekan-rekan BDP angkatan 43, 44, dan 45 yang sabar membantu dan memberikan nasehat serta motivasi dalam penyelesaian skripsi ini; 6. Serta berbagai pihak yang tidak dapat penulis sebutkan satu persatu atas segala bantuan yang diberikan selama ini. Akhir kata, semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan umumnya dan perikanan khususnya. Bogor, Januari 2011 Darmawan Setia Budi i DAFTAR RIWAYAT HIDUP Penulis dilahirkan di Lumajang tanggal 18 September 1988 dari ayah Sudarmasto dan ibu Titin Sukowati. Penulis merupakan anak kedua dari 3 bersaudara. Pendidikan formal yang pernah dilalui penulis adalah SDN 1 Rogotrunan IV (lulus tahun 2000), SMPN 1 Lumajang (lulus tahun 2003), dan SMAN 1 Lumajang (lulus tahun 2006). Penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) 2006. Setelah satu tahun melalui program Tingkat Persiapan Bersama (TPB), penulis masuk program studi Teknologi dan Manajemen Perikanan Budidaya pada Fakultas Perikanan dan Ilmu Kelautan. Selama kuliah di IPB, penulis aktif pada organisasi kemahasiswaan, di antaranya adalah Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai staf divisi kewirausahaan pada periode 2008 dan Forum Keluarga Muslim FPIK (FKM-C) sebagai kepala divisi coorporation pada periode 2009. Penulis juga aktif menjadi asisten praktikum beberapa mata kuliah, di antaranya Dasar-dasar Akuakultur (2008/2009), Fisiologi Hewan Air (2008/2009 dan 2009/2010), Manajemen Kualitas Air (2009/2010), serta Dasar-dasar Genetika Ikan (2009/2010). Penulis pernah mendapatkan pendanaan DIKTI pada Program Kreativitas Mahasiswa bidang Penelitian (PKM-P) pada tahun 2009. Pada tahun 2010, penulis menjadi salah satu delegasi IPB pada Pekan Ilmiah Nasional (PIMNAS) XXIII yang dilaksanakan di Universitas Mahasaraswati Denpasar Bali, melalui Program Kreativitas Mahasiswa bidang Gagasan Tertulis (PKM-GT) dengan judul artikel ”Pengembangan Manipulasi Fish Germ Cells: Peningkatan Produksi dan Pelestarian Diversitas Sumberdaya Ikan di Indonesia”, dan berhasil meraih penghargaan setara perak. Pada tahun 2009, penulis melaksanakan praktek kerja lapang (PKL) dengan judul laporan “Pembenihan Abalon Haliotis asinina di Balai Besar Riset Pengembangan Budidaya Laut Gondol, Buleleng, Bali”. Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi yang berjudul “Transplantasi Sel Testikular Ikan Gurame pada Ikan Nila”. ii DAFTAR ISI Halaman DAFTAR TABEL ............................................................................................... iv DAFTAR GAMBAR ........................................................................................... v DAFTAR LAMPIRAN ....................................................................................... vi I. PENDAHULUAN ........................................................................................ 1 II. BAHAN DAN METODE ............................................................................ 3 2.1. Produksi Ikan Resipien ........................................................................... 3 2.1.1. Pemeliharaan Induk Ikan Nila ...................................................... 3 2.1.2. Pemijahan Semi Buatan ................................................................ 3 2.1.3. Inkubasi Telur ............................................................................... 4 2.2. Persiapan Sel Donor ................................................................................ 4 2.2.1. Pemilihan Ikan Donor ................................................................... 4 2.2.2. Disosiasi Sel Donor....................................................................... 5 2.3. Transplantasi Sel Donor .......................................................................... 5 2.3.1. Persiapan Mikroinjeksi dan Loading Sel Donor ........................... 5 2.3.2. Pelaksanaan Transplantasi Sel Donor ........................................... 6 2.4. Pemeliharaan Ikan Resipien .................................................................... 6 2.5. Analisis Keberhasilan Transplantasi dan Deteksi Kolonisasi Sel Donor ................................................................................................ 6 2.5.1. Ekstraksi DNA .............................................................................. 7 2.5.2. Amplifikasi DNA dengan PCR ..................................................... 8 III. HASIL DAN PEMBAHASAN .................................................................... 9 3.1. Hasil ....................................................................................................... 9 3.1.1. Sel Testikular Donor ..................................................................... 9 3.1.2. Konfirmasi Keberhasilan Transplantasi ........................................ 9 3.1.3. Deteksi Kolonisasi Sel Donor pada Gonad Resipien .................... 10 3.2. Pembahasan ............................................................................................ 12 IV. KESIMPULAN DAN SARAN .................................................................... 17 4.1. Kesimpulan ............................................................................................. 17 4.2. Saran ....................................................................................................... 17 DAFTAR PUSTAKA .......................................................................................... 18 LAMPIRAN ......................................................................................................... 20 iii DAFTAR TABEL Halaman 1. Program PCR (Polymerase Chain Reaction) yang digunakan (Achmad, 2009) ..................................................................... 8 2. Donor yang digunakan pada kegiatan transplantasi ......................................... 9 3. Kuantifikasi DNA hasil ekstraksi gonad ikan nila resipien ............................. 11 iv DAFTAR GAMBAR Halaman 1. Sel testikular ikan gurame hasil disosiasi ......................................................... 9 2. Deteksi keberhasilan injeksi sel donor dalam rongga peritonial larva ikan nila umur 1 hari setelah penyuntikan dengan menggunakan metode PCR .............................................................................. 10 3. Visualisasi DNA genom ikan nila resipien umur 2 bulan ................................ 10 4. Deteksi kolonisasi sel donor ikan gurame pada gonad ikan nila resipien umur 2 bulan ........................................................................ 11 v DAFTAR LAMPIRAN Halaman 1. Proses penyiapan larva ikan nila resipien......................................................... 21 2. Penyiapan ikan donor gurame .......................................................................... 22 3. Prosedur disosiasi testis ikan gurame (Mauluddin, 2009) ................................ 23 4. Contoh perhitungan dan penentuan dosis sel donor ......................................... 24 5. Transplantasi sel donor ..................................................................................... 25 6. Perbandingan variabel kerja reproduksi ikan gurame dan ikan nila ................ 26 vi I. PENDAHULUAN Ikan gurame (Osphronemus gouramy) merupakan salah satu komoditas yang menjadi target Kementerian Kelautan dan Perikanan untuk ditingkatkan produksinya hingga tahun 2014 (KKP, 2010). Salah satu kendala dalam membudidayakan ikan gurame adalah kurangnya ketersediaan benih. Sebagai gambaran terhadap permintaan benih ikan gurame, menurut BBI dan Dinas Peternakan Kabupaten Banyumas, permintaan telur ikan gurame di Kabupaten Banyumas untuk daerah Jawa Timur dan Yogyakarta mencapai 1 juta butir per minggu (BI, 2010). Ikan gurame membutuhkan waktu yang lama untuk mencapai matang kelamin (2-3 tahun) (Badan Standardisasi Nasional, 2000) dan siklus pemijahannya tergantung pada musim, akibatnya kontinyuitas benih kurang terjamin. Sementara itu, teknologi pemijahan buatan ikan gurame sampai saat ini belum dapat dikuasai dengan sempurna, sehingga produksi benihnya masih sangat tergantung pada musim pemijahan tersebut. Dengan demikian, teknologi rekayasa produksi benih ikan gurame perlu dikembangkan untuk mengatasi permasalahan ini. Teknologi rekayasa produksi benih ikan melalui teknik transplantasi sel gonad telah banyak dikembangkan. Okutsu et al. (2006a), melalui transplantasi sel testikular telah berhasil memproduksi benih ikan rainbow trout (Oncorhynchus mykiss) melalui induk “semang” (surrogate broodstock) ikan salmon masu (Oncorhynchus masou). Sel testikular (yang mengandung sel stem spermatogonia) ikan target yang ditransplantasikan pada ikan resipien memiliki kemampuan memperbanyak diri (self-renewal) dan dapat berkembang menjadi sperma dan telur ikan target (Okutsu et al., 2006a). Transplantasi sel spermatogonia juga telah dilakukan pada tikus (Brinster & Zimmermann, 1994). Transplantasi sel hidup, jaringan, ataupun organ dari satu spesies ke spesies lain disebut xenotransplantasi (Wikipedia, 2010). Sejak tahun 1960-an teknologi xenotransplantasi telah diterapkan meliputi transplantasi sel, jaringan, dan organ pada beberapa spesies vertebrata tingkat tinggi seperti babi, sapi, simpanse, kera dan babon (Nicolle, 1999). Pengembangan dan penerapan teknologi xenotransplantasi sel testikular diharapkan dapat menjadi solusi terhadap masalah perbenihan ikan gurame. 1 Teknologi transplantasi sel testikular membutuhkan ikan resipien yang cocok dan dapat menerima serta mendukung perkembangan sel spermatogonia ikan donor. Ikan resipien harus memiliki keunggulan seperti kemampuan untuk tumbuh dan matang gonad yang relatif cepat dan teknologi pemijahannya pun relatif lebih mudah. Salah satu kandidat ikan resipien yang dapat digunakan sebagai induk semang ikan gurame adalah ikan nila (Oreochromis niloticus). Ikan nila memiliki karakteristik morfologi telur yang mirip dengan ikan gurame, sehingga diduga dapat mendukung perkembangan sel gonad ikan gurame di dalam tubuhnya. Ikan nila memiliki waktu matang gonad relatif cepat dan dapat dipijahkan dengan mudah di dalam wadah yang terkontrol, sehingga akan mendukung kegiatan rekayasa genetik di masa mendatang (Alimuddin et al., 2009). Transplantasi sel gonad (intraspesies) yang menggunakan ikan nila sebagai model telah dilakukan oleh Lacerda et al. (2006, 2008, 2010). Potensi ikan nila sebagai induk semang (surrogate broodstock) dari ikan gurame dapat diketahui dengan mengamati perkembangan sel testikular ikan gurame pada ikan nila. Penelitian ini bertujuan untuk menguji bahwa ikan nila berpotensi digunakan sebagai resipien dengan mengamati kolonisasi sel donor dari ikan gurame pada gonad ikan nila. 2 II. BAHAN DAN METODE 2.1. Produksi Ikan Resipien Ikan resipien yang digunakan dalam penelitian ini adalah larva ikan nila (Oreochromis niloticus) yang berumur sekitar 4 hari setelah menetas. Tahapan penyiapan larva ikan nila resipien meliputi pemeliharaan induk nila, pemijahan semi buatan dan inkubasi telur (Lampiran 1). 2.1.1. Pemeliharaan Induk Ikan Nila Penelitian ini menggunakan 5 pasang induk ikan nila (jantan dan betina) dengan ciri-ciri induk jantan memiliki 2 lubang pengeluaran (anus dan urogenital) dan induk betina memiliki 3 lubang pengeluaran (anus, urinary, dan oviduct). Induk yang digunakan berukuran sekitar 400-500 g/ekor. Induk dipelihara secara terpisah pada 10 buah akuarium berukuran 60x60x60 cm yang dilengkapi dengan aerasi untuk menjaga ketersediaan oksigen terlarut. Induk diberi pakan 3 kali sehari (pagi, siang, dan sore) secara at satiation (pemberian pakan sampai kenyang). Pakan yang diberikan adalah pakan komersil dengan kadar protein ±42% dengan tujuan mengoptimalkan pematangan gonad induk. Setiap hari dilakukan penyifonan dan pergantian air sebanyak ±60% untuk menjaga kualitas media pemeliharaan. 2.1.2. Pemijahan Semi Buatan Pemijahan semi buatan yaitu dengan melakukan fertilisasi buatan antara telur dan sperma yang dikeluarkan tanpa melalui rangsangan hormonal sebelumnya. Ikan yang siap memijah ditandai dengan lubang genital yang menonjol dan berwarna merah. Induk jantan dan betina yang siap memijah disatukan dalam akuarium berukuran 60x60x60 cm yang dilengkapi dengan aerasi. Induk ikan nila yang akan memijah ditandai dengan kedua induk membersihkan dasar akuarium menggunakan mulut (Lampiran 1a). Apabila hal ini tidak terjadi dan kedua induk saling menyerang, maka induk jantan yang digunakan tidak cocok dengan induk betina sehingga harus diganti dengan pejantan lain yang cocok. 3 Setelah induk betina mengeluarkan telur 1-2 kali, kedua induk ikan nila diambil dari akuarium dan dimasukkan ke wadah terpisah. Stripping (pengurutan) dilakukan dengan mengurut bagian perut ke arah lubang genital untuk mengeluarkan telur dan sperma. Telur yang keluar ditampung dalam mangkok yang berisi larutan fisiologis (NaCl 0,9%), sedangkan sperma yang keluar disedot menggunakan syringe (Lampiran 1b). Telur dan sperma dicampur dalam mangkuk/cawan petri dan dihomogenkan menggunakan bulu ayam (Lampiran 1c). Pada cawan petri tersebut ditambahkan air secukupnya untuk mengaktifkan sperma agar dapat bergerak membuahi telur. Air pada cawan petri dibuang setelah 2-3 menit dan telur yang telah dibuahi diletakkan di atas saringan santan dalam media air bersuhu 28oC. 2.1.3. Inkubasi Telur Telur yang telah dibuahi diinkubasi dalam saringan santan (berdiameter 20 cm) di permukaan air dalam akuarium berukuran 60x60x60 cm dengan suhu air 28oC yang distabilkan menggunakan termostat. Pencegahan serangan jamur pada telur dilakukan dengan pemberian methylene blue pada media inkubasi. Aerasi kuat diberikan untuk menjaga agar telur teraduk pelan dan menjaga ketersediaan oksigen terlarut pada media inkubasi (Lampiran 1d). Inkubasi dilakukan hingga telur menetas sampai larva siap digunakan untuk transplantasi, yaitu sekitar 7 hari setelah pembuahan (Lampiran 1e). 2.2. Persiapan Sel Donor 2.2.1. Pemilihan Ikan Donor Ikan donor yang digunakan adalah ikan gurame (Osphronemus gouramy) jantan berukuran sekitar 600 g/ekor. Ciri-ciri ikan gurame jantan adalah melengkung jika diangkat dan pangkal sirip dada berwarna putih, sedangkan gurame betina tidak melengkung jika diangkat dan pangkal sirip dada berwarna hitam. Sebelum dibedah ikan donor ditimbang terlebih dahulu, testis ikan donor juga ditimbang sebelum didisosiasi (Lampiran 2). Ikan donor gurame diperoleh dari pengumpul di daerah Kayu Manis, Bogor. 4 2.2.2. Disosiasi Sel Donor Prosedur disosiasi testis menggunakan larutan 0,5% tripsin dalam PBS sesuai dengan Mauluddin (2009) (Lampiran 3). Sel yang telah didisosiasi diamati untuk mengetahui komposisi sel testikular (spermatogonia, spermatosit, dan spermatid) donor dan jumlah dihitung menggunakan haemocytometer untuk menentukan konsentrasi suspensi sel sehingga sesuai dengan dosis yang digunakan (Lampiran 4). Pengamatan dan penghitungan sel testikular dilakukan di bawah mikroskop Olympus BH2-RFCA. Sel testikular disuspensikan pada larutan PBS dan dapat disimpan dalam jangka waktu 1-2 jam pada suhu 4oC sebelum digunakan. 2.3. Transplantasi Sel Donor 2.3.1. Persiapan Mikroinjeksi dan Loading Sel Donor Alat mikroinjeksi didukung dengan mikroskop 3 dimensi (Stemi DV4, Zeiss) (Lampiran 5a). Proses loading sel (Lampiran 5b) atau memasukkan sel ke dalam jarum mikroinjeksi merupakan salah satu bagian penting, sehingga diperlukan kehati-hatian dan keterampilan khusus. Suspensi sel donor dalam larutan PBS terdiri dari sel spermatogonia, spermatosit, spermatid, dan sel somatik lainnya. Suspensi sel sebanyak 0,5 µl (berdasarkan dosis 0,5 µl suspensi sel per resipien) diambil menggunakan mikropipet dan diteteskan pada kertas parafilm. Suspensi sel disedot ke dalam jarum mikroinjeksi hingga tidak tersisa dengan memutar mikroinjektor ke arah dalam. Jarum mikroinjeksi terpasang pada needle holder yang dipegang dengan tangan kiri, sementara tangan kanan memutar mikroinjektor. Selanjutnya transplantasi siap dilakukan setelah needle holder kembali dipasang pada mikromanipulator. Ukuran lubang jarum mikroinjeksi sebesar 30 µm disesuaikan dengan ukuran sel spermatogonia donor ikan gurame yang berukuran 5-15 µm (Mauluddin, 2009) Modifikasi dapat dilakukan dengan memasukkan lebih dari 0,5 µl suspensi sel hingga 2 µl untuk ditransplantasikan pada 4 ekor larva resipien (0,5 µl/ekor). Modifikasi sangat bergantung pada keahlian dan keterampilan pada saat melakukan transplantasi. Ikan resipien ditransplantasi dengan dosis sekitar 20.000 5 sel donor/0,5µl/ekor, modifikasi dari Okutsu et al. (2006a) yang mentransplantasikan sekitar 10.000 sel testikular pada larva ikan rainbow trout. 2.3.2. Pelaksanaan Transplantasi Sel Donor Larva resipien diletakkan berjajar pada cekungan gel agarosa dalam cawan petri plastik (Lampiran 5c) dan selanjutnya diletakkan di bawah mikroskop. Sel diinjeksikan pada rongga peritonial (peritoneal cavity) larva di antara kuning telur dan tulang belakang menggunakan jarum mikroinjeksi (Lampiran 5d) yang digerakkan secara manual dengan mikromanipulator. Ikan nila hasil transplantasi dipelihara dalam akuarium hingga berumur 2 bulan setelah transplantasi. 2.4. Pemeliharaan Ikan Resipien Ikan resipien hasil transplantasi dipelihara dalam akuarium berukuran 15x15x25 cm dan diberi makan cacing sutera secara ad libitum (pakan selalu tersedia) hingga berumur 2 minggu setelah transplantasi. Selanjutnya ikan resipien dipindahkan pada akuarium berukuran 60x60x60 cm dan diberi pakan pellet terapung dengan kadar protein ±38% secara at satiation (pemberian pakan sekenyangnya), 3 kali sehari (pagi, siang, dan sore) hingga berumur 2 bulan untuk kemudian dianalisis. Media pemeliharaan dijaga kualitasnya dengan melakukan penyifonan 1 kali sehari pada pagi hari. 2.5. Analisis Keberhasilan Transplantasi dan Deteksi Kolonisasi Sel Donor Analisis keberhasilan transplantasi dan deteksi kolonisasi sel donor dilakukan dengan menggunakan metode PCR (Polymerase Chain Reaction) seperti yang telah dikembangkan oleh Achmad (2009). Analisis keberhasilan transplantasi dilakukan sehari setelah pelaksanaan transplantasi sel donor, dengan tujuan untuk memastikan bahwa sel donor benar-benar masuk ke dalam rongga peritonial larva resipien. Deteksi kolonisasi sel donor dalam gonad resipien ikan nila dilakukan 2 bulan setelah transplantasi. Tahapan prosedur analisis keberhasilan transplantasi dan deteksi kolonisasi sel donor meliputi ekstraksi DNA, amplifikasi DNA menggunakan PCR, dan visualisasi produk PCR melalui elektroforesis. 6 2.5.1. Ekstraksi DNA DNA diekstraksi dari larva resipien umur 1 hari dan dari gonad resipien umur 2 bulan setelah transplantasi. Ekstraksi DNA yang dilakukan meliputi 3 tahapan yaitu cell lysis, RNase treatment, protein precipitation, dan DNA precipitation. Pada tahap cell lysis, jaringan (5-20 mg) dilisis menggunakan 200 μl Cell Lysis Solution (Gentra, Minneapolis, USA) dan 1,5 μl Proteinase K (20 mg/ml) dalam Eppendorf 1,5 ml. Inkubasi dilakukan pada suhu 55°C selama semalam atau hingga sel terlisis sempurna. RNase treatment dilakukan setelah sel terlisis sempurna. Setelah inkubasi sampel didiamkan hingga suhu ruang dan kemudian ditambahkan 1,5 μl RNase (4 mg/ml). Larutan sampel diaduk dengan cara membolak-balik (inverting) Eppendorf sebanyak 30 kali. Selanjutnya sampel diinkubasi pada suhu 37oC selama 60 menit. Setelah inkubasi sampel didiamkan kembali hingga suhu ruang. Tahap protein precipitation. Ke dalam tabung sampel ditambahkan 50 μl Protein Precipitation Solution (Gentra, Minneapolis, USA) dan di-vortex kencang 30 detik untuk mencampur larutan dalam Eppendorf. Sampel kemudian diinkubasi pada es (ice bath) selama 10-15 menit. Setelah itu, sampel disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit. Tahap DNA precipitation. Supernatan dipindahkan ke dalam Eppendorf yang telah diisi 300 μl isopropanol, sampel dibolak-balik 50 kali. Selanjutnya disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit. Supernatan dibuang, kemudian ditambahkan 300 μl etanol 70% dingin (stok disimpan dalam lemari es -20oC) ke dalam Eppendorf berisi pellet DNA, sampel dibolak-balik beberapa kali untuk mencuci pellet DNA. Sampel disentrifugasi kembali dengan kecepatan 12.000 rpm selama 10 menit. Supernatan dibuang, pellet DNA dikeringudarakan dan ditambahkan 30 μl IEW (Ion Exchange Water). Larutan DNA disimpan dalam freezer suhu -20oC hingga akan digunakan. Analisis kemurnian dan kandungan DNA dilakukan melalui dua cara yaitu secara kuantitatif dengan spektrofotometer GeneQuant dan kualitatif menggunakan elektroforesis. 7 2.5.2. Amplifikasi DNA dengan PCR Amplifikasi DNA hasil ekstraksi dilakukan dengan PCR (Polymerase Chain Reaction) menggunakan primer F1GH (5’-TGTTCTCTGACGGCGTGGTT-3’) dan R1GH (5’-GCAACAAAAAACCACCAGAA-AGAG-3’) (Achmad, 2009). Total volume untuk pereaksi PCR yaitu 10 µl; mengandung 1 µl primer F1GH; 1 µl primer R1GH 1 µl; 1 µl dNTPs mix; 1 µl MgCl2; 1 µl La Taq buffer; dan 0,05 µl Ex Taq polimerase (Takara Bio, Shiga, Japan); 1 µl DNA template; sisanya adalah IEW. Kontrol internal loading DNA dilakukan menggunakan primer forward β-aktin nila (5'-GTGCCCATCTACGAGGGTTA-3') dan reverse (5'TTTGATGTCACGCACGATTT-3'). Program PCR yang digunakan dapat dilihat pada Tabel 1. Jumlah siklus PCR yang digunakan adalah 45 siklus untuk pasangan primer GH ikan gurame dan 35 siklus untuk pasangan primer β-aktin nila. Visualisasi hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 1% dengan tegangan 150 Volt dan kuat arus 70 mA. Tabel 1. Program PCR (Polymerase Chain Reaction) yang digunakan (Achmad, 2009). Pre Denaturasi Denaturasi Annealing Extention Final Extention Primer Suhu (oC) Waktu (detik) Suhu (oC) Waktu (detik) Suhu (oC) Waktu (detik) Suhu (oC) Waktu (detik) Suhu (oC) Waktu (detik) GH 94 180 94 30 58 45 72 45 72 180 β-aktin 94 180 94 30 61 30 72 30 72 180 8 III. HASIL DAN PEMBAHASAN 3.1. Hasil 3.1.1 Sel Testikular Donor Hasil disosiasi sel testikular gonad yang digunakan dalam penelitian ini dapat dilihat pada Tabel 2. Donor yang digunakan memiliki GSI (Gonado Somatic Index) sebesar 0,0132% dengan persentase sel spermatogonia sebesar 28,22%. Seperti ditunjukkan pada Gambar 1, sel spermatogonia memiliki ukuran paling besar (5-15 µm), diikuti spermatosit (3-5 µm), serta spermatid dan sel somatik (1,5-2,5 µm). Tabel 2. Donor yang digunakan pada kegiatan transplantasi. Bobot Tubuh (g) 598,82 Bobot Gonad (g) 0,0791 GSI (%) 0,0132 ∑ Sel Testikular 65.200.000 ∑ Spermatogonia 18.400.000 % Spermatogonia 28,22 Keterangan: tanda panah menunjukkan sel spermatogonia Gambar 1. Sel testikular ikan gurame hasil disosiasi. 3.1.2. Konfirmasi Keberhasilan Transplantasi DNA yang diekstraksi dari ikan resipien yang berumur 1 hari setelah penyuntikan dan kemudian dianalisis menggunakan metode PCR memiliki produk PCR dengan ukuran pita yang sama dengan kontrol positif DNA ikan gurame dan tidak ditemukan pada sampel ikan nila bukan transplantasi (Gambar 2, ditunjukkan dengan tanda panah). Hal ini menunjukkan bahwa sel yang diinjeksikan berhasil masuk ke dalam larva ikan nila resipien. Dari lima sampel 9 yang dianalisis, semuanya menunjukkan pita yang sama dengan kontrol positif. Artinya bahwa keberhasilan injeksi sebesar 100% dari kelima sampel yang dianalisa. Keterangan: M = marker; 1-5 = produk PCR DNA larva resipien; C+ = produk PCR DNA ikan gurame; N = produk PCR DNA ikan nila non transplan; C- = kontrol reagen. Gambar 2. Deteksi keberhasilan injeksi sel donor dalam rongga peritonial larva ikan nila umur 1 hari setelah penyuntikan dengan menggunakan metode PCR. 3.1.3. Deteksi Kolonisasi Sel Donor pada Gonad Resipien DNA dari gonad ikan nila resipien yang telah berumur sekitar 2 bulan setelah transplantasi berhasil diekstraksi. Hasil visualisasi pada gel elektroforesis diperoleh DNA genom berukuran lebih besar dari 10 kb (Gambar 3, ditunjukkan dengan panah). Kuantifikasi DNA hasil ekstraksi dapat dilihat pada Tabel 3. Keterangan: M = marker; 1-5 = DNA gonad ikan nila resipien. Gambar 3. Visualisasi DNA genom gonad ikan nila resipien umur 2 bulan. 10 Tabel 3. Kuantifikasi DNA hasil ekstraksi gonad ikan nila resipien. Sampel DNA Rasio (absorbansi 260/280 nm) DNA (ng/μl) 1 1,829 1788 2 1,861 156 3 1,871 300 4 1,830 548 5 1,794 1532 Berdasarkan Tabel 3, konsentrasi DNA tertinggi dari gonad ikan nila resipien sebesar 1788 ng/µl sedangkan yang terendah sebesar 156 ng/µl. Nilai rasio yang didapat berkisar antara 1,784-1,871. Brown (2010) menyebutkan rasio absorbansi 260 nm dan 280 nm yang kurang dari 1,8 menunjukkan bahwa hasil ekstraksi telah terkontaminasi oleh protein atau fenol. Visualisasi produk PCR dari DNA gonad ikan nila resipien tersebut menunjukkan ukuran pita DNA yang sama dengan DNA ikan gurame (Gambar 4, ditunjukkan dengan tanda panah). Hal tersebut menunjukkan bahwa sel donor terkolonisasi pada gonad ikan resipien yang berumur 2 bulan setelah transplantasi. Produk PCR menggunakan primer β-aktin nila menunjukkan bahwa DNA gonad ikan nila juga teramplifikasi. Hasil yang diperoleh, sel donor terkolonisasi pada 3 dari 5 sampel ikan resipien yang diperiksa (sampel 2, 3, dan 4) dengan tingkat keberhasilan kolonisasi 60% dari total resipien yang diperiksa. Keterangan: M = marker; 1-5 = produk PCR DNA gonad resipien; C+ = produk PCR DNA gurame; N = produk PCR DNA nila non transplan; C- = kontrol reagen. Gambar 4. Deteksi kolonisasi sel donor ikan gurame pada gonad ikan nila resipien umur 2 bulan. 11 Ketebalan pita DNA hasil amplifikasi PCR berbeda pada masing-masing sampel. Pada sampel 4, pita DNA yang muncul sangat tipis dan tidak terlihat jelas. Sedangkan pada sampel 2 dan 3, pita DNA produk PCR yang muncul terlihat cukup jelas. Jika dibandingkan dengan produk PCR β-aktin nila, maka tingkat ketebalan pita produk PCR GH gurame menunjukkan jumlah DNA sel donor yang terdeteksi pada DNA gonad ikan nila resipien. Semakin tipis pita DNA yang muncul, maka semakin sedikit DNA sel donor yang terdeteksi dalam gonad ikan nila. 3.2. Pembahasan Transplantasi sel germinal pada ikan pertama kali dilakukan menggunakan sel bakal gonad (Primordial Germ Cell/PGC) (Takeuchi et al., 2003). Jumlah PGC terbatas (rata-rata 90 PGC per larva ikan rainbow trout yang baru menetas) dan hanya ada pada larva sebelum terjadinya diferensiasi seksual. Hal ini menyebabkan PGC sulit diperoleh sehingga kemudian digunakan sel stem spermatogonia yang belum terdiferensiasi dalam transplantasi sel germinal pada ikan (Okutsu et al., 2006b). PGC merupakan sel yang belum terdiferensiasi menjadi spermatogonia ataupun oogonia. Spermatogonia digolongkan menjadi dua jenis, yaitu sel stem spermatogonia yang belum terdiferensiasi dan sel spermatogonia terdiferensiasi. Sel stem spermatogonia yang belum terdiferensiasi memiliki kemampuan memperbarui diri (self-renewal) sepanjang hidup organisme tersebut dan menghasilkan sel spermatogonia terdiferensiasi yang akan mengalami proliferasi (pembelahan) mitosis dan meiosis hingga menjadi spermatozoa. Transplantasi sel testikular yang mengandung sel stem spermatogonia telah dilakukan, berhasil terkolonisasi pada gonad ikan resipien, serta dapat berkembang menjadi telur dan sperma yang fungsional (Okutsu et al., 2006a). Studi mengenai morfologi dan komposisi sel testikular ikan gurame telah dilakukan. Proporsi sel spermatogonia tertinggi terdapat pada kelas ikan muda (800-1000 g), daripada kelas ikan dewasa (1100-1300 g) dan ikan matang gonad (2250-3200 g) (Mauluddin, 2009). Pada penelitian ini digunakan ikan gurame berukuran sekitar 600 g, di bawah kelas ikan muda dengan tujuan memperoleh 12 jumlah sel spermatogonia yang lebih banyak untuk optimalisasi proses transplantasi. Hasil disosiasi sel gonad ikan donor gurame, menunjukkan jumlah sel testikular sebesar 65.200.000 sel/gonad dengan persentase sel spermatogonia sebesar 28,22% (Tabel 1). Jika dibandingkan dengan hasil penelitian Mauluddin (2009), jumlah sel testikular yang diperoleh adalah sangat besar namun persentase sel spermatogonia pada penelitian ini sangat kecil. Mauluddin (2009) memperoleh jumlah sel testikular sebesar 432.000 sel/gonad dengan persentase spermatogonia sebesar 80,56% dari hasil disosiasi sel testikular gonad ikan gurame muda menggunakan larutan tripsin 0,5% dalam PBS (Phosphate Buffer Saline). Perbedaan ini terjadi karena bobot ikan gurame yang digunakan pada penelitian ini lebih kecil (598,82 g) dengan bobot gonad yang lebih besar yaitu 0,0791 g, sedangkan Mauluddin (2009) menggunakan gurame berbobot 800 g dengan berat gonad rata-rata sebesar 0,06895 g. Hal ini kemungkinan disebabkan umur ikan gurame dan status kematangan gonad yang berbeda. Takeuchi et al. (2009), memperoleh jumlah spermatogonia yang lebih besar pada ikan nibe croaker (Nibea mitsukurii) muda umur 3 bulan, daripada ikan nibe berumur 6 bulan dan 16 bulan. Ukuran sel spermatogonia ikan gurame hasil disosiasi berkisar 5-15 µm, spermatosit 3-5 µm, dan spermatid serta sel somatik lebih kecil dari 2,5 µm (Gambar 1), sesuai dengan Mauluddin (2009). Transplantasi sel germinal ikan dilakukan dengan injeksi sel donor pada rongga peritonial (peritoneal cavity) larva ikan salmon masu (Takeuchi et al., 2003), larva ikan nibe croaker (Takeuchi et al., 2009), dan larva ikan chub mackerel (Yazawa et al., 2010) yang baru menetas. Dosis sel testikular donor ikan gurame yang diinjeksikan sekitar 20.000 sel testikular per larva resipien ikan nila. Hermawan (2010) menyatakan bahwa dosis injeksi sel testikular gurame sekitar 1.250-80.000 sel per larva dapat terdeteksi sehari setelah injeksi menggunakan mikroskop fluoresen. Okutsu et al. (2006b) menginjeksikan sekitar 10.000 sel testikular pada larva resipien. Volume suspensi sel yang diinjeksikan pada rongga peritonial larva resipien ikan nila sebesar 0,5 µl. Volume suspensi sel yang diinjeksikan bergantung pada ukuran larva resipien, 20-30 nl suspensi sel diinjeksikan pada transplantasi sel germinal larva ikan rainbow trout (Yoshizaki, 13 2010a), sedangkan 15 nl suspensi sel diinjeksikan pada transplantasi sel germinal larva ikan chub mackerel (Yazawa et al, 2010) yang ukuran larvanya lebih kecil dari pada larva ikan rainbow trout. Kombinasi dosis dan suspensi sel dalam penelitian ini masih perlu dioptimalkan lagi untuk meningkatkan efisiensi, efektivitas, serta keberhasilan transplantasi. Umur resipien berpengaruh pada tingkat kolonisasi sel donor terkait dengan kondisi lingkungan (microenvironments) dalam tubuh resipien yang dapat mendukung migrasi sel donor ke daerah genital (genital ridges) (Takeuchi et al., 2003). Keberadaan sistem imunorejeksi dan kemoatraktan sangat berpengaruh pada keberhasilan kolonisasi sel donor (Takeuchi et al., 2003; Okutsu et al., 2006b). Untuk mengatasi imunorejeksi, maka digunakan larva yang baru menetas sebagai resipien yang sistem imunorejeksinya relatif belum berkembang (immature) di mana pada stadia ini jenis kelamin larva belum terdiferensiasi (Okutsu et al., 2006b). Molekul atraktan yang dapat mendukung migrasi sel donor juga ditemukan dalam genital ridges pada larva yang baru menetas, molekul ini akan berkurang seiring dengan perkembangan gonad (Takeuchi et al., 2003). Pada penelitian ini digunakan larva ikan nila yang baru menetas (4 hari setelah menetas) sebagai resipien. Resipien yang digunakan pada penelitian ini perlu dioptimalkan lebih lanjut dengan mengobservasi umur terbaik yang dapat mendukung kolonisasi sel donor. Keberhasilan proses transplantasi ditunjukkan dengan adanya sel donor yang masuk dan berada pada rongga peritonial resipien. Metode deteksi keberadaan sel donor gurame dalam rongga peritonial larva nila resipien menggunakan metode PCR marka molekuler deteksi gen GH/Growth Hormone ikan gurame dan pewarnaan sel donor (PKH-26) telah dikembangkan (Achmad, 2009; Hermawan, 2009). Konfirmasi keberhasilan proses transplantasi pada penelitian ini menggunakan metode PCR. Hasil yang didapat 100% (5/5) sel donor yang diinjeksikan berhasil masuk dan berada pada larva resipien (Gambar 3). Sel testikular donor ikan gurame (sekitar 20.000 sel/0,5µl) berhasil masuk dan dapat dideteksi menggunakan metode PCR dengan marka molekuler gen GH ikan gurame, berbeda dengan Hermawan (2010) dimana dosis yang berhasil masuk dan dapat dideteksi sebesar 40.000 dan 80.000 sel per larva resipien dari perlakuan 14 dosis 1.250-80.000 sel per larva resipien. Perbedaan ini terjadi karena jumlah siklus yang digunakan dalam program PCR berbeda yaitu 35 siklus, sedangkan dalam penelitian ini jumlah siklus PCR yang digunakan adalah 45 siklus. Keberhasilan transplantasi sel testikular juga sangat dipengaruhi oleh proses dan teknis penyuntikan sel donor pada rongga peritonial larva sehingga dibutuhkan keterampilan khusus, proses yang salah dapat menyebabkan sel yang ditransplantasikan kembali keluar atau bahkan tidak masuk sama sekali sehingga tidak terdeteksi menggunakan PCR. Achmad (2009), menggunakan primer GH gurame untuk mendeteksi DNA gurame dengan metode PCR dalam pengembangan marka molekuler untuk deteksi kolonisasi sel donor ikan gurame dalam gonad resipien ikan nila. Primer yang digunakan dapat mendeteksi 1 sel gurame di dalam 104 sel nila. DNA gurame yang didapat berukuran sekitar 340 pasang basa. Distribusi sel donor pada rongga peritonial ikan resipien setelah transplantasi telah diketahui. Sebelum terinkorporasi dengan daerah genital (genital ridges) resipien, sel donor tersebar pada rongga peritonial dan kemudian menempel pada dinding peritonial resipien (Takeuchi et al., 2003). Sel donor menggunakan pseudopodia untuk bergerak ke arah genital ridges. Setelah terinkorporasi/terkolonisasi dalam genital ridges, selanjutnya sel donor akan berproliferasi dan berdiferensiasi hingga menjadi telur atau spermatozoa (Takeuchi et al., 2003; Okutsu et al., 2006a; Yoshizaki et al., 2010b). Deteksi kolonisasi pada penelitian ini dilakukan 2 bulan setelah transplantasi, di mana gonad ikan nila resipien telah berkembang dan lebih mudah diambil. DNA genom dari gonad ikan nila resipien berhasil didapat melalui prosedur ekstraksi DNA (Gambar 4 dan Tabel 3). Deteksi kolonisasi menggunakan PCR menunjukkan bahwa sel donor terkolonisasi pada 3 dari 5 sampel ikan resipien yang diperiksa dengan tingkat keberhasilan kolonisasi 60% dari total resipien yang diperiksa (Gambar 5). Hasil deteksi yang diperoleh menunjukkan bahwa ikan nila berpotensi digunakan sebagai resipien dalam transplantasi sel testikular ikan gurame. Apabila ikan nila dapat digunakan sebagai induk semang dalam produksi benih ikan gurame, maka efisiensi produksi benih ikan gurame akan dapat ditingkatkan. Efisiensi ini meliputi produksi induk yang 15 lebih cepat, wadah pemeliharaan induk yang tidak terlalu besar, fekunditas yang lebih tinggi, serta siklus pemijahan yang lebih sering (Lampiran 6). Sehingga, kebutuhan terhadap benih gurame akan terpenuhi dengan peningkatan kontinyuitas ketersediaan benih gurame. 16 IV. KESIMPULAN DAN SARAN 4.1. Kesimpulan Sel spermatogonia ikan gurame dapat terkolonisasi pada gonad ikan nila yang berumur 2 bulan. 4.2. Saran Penelitian lanjutan mengenai karakterisasi perkembangan gonad ikan nila resipien yang positif membawa sel donor perlu dilakukan untuk mengetahui bahwa sel donor dapat berproliferasi dan berdiferensiasi dalam gonad resipien sehingga memungkinkan ikan nila dapat digunakan sebagai induk semang untuk menghasilkan ikan gurame. 17 DAFTAR PUSTAKA Achmad, M., 2009. Pengembangan marka molekuler DNA dalam identifikasi sel gonad ikan gurame Osphronemus gouramy dan ikan nila Oreochromis niloticus menggunakan PCR. [Tesis]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor Alimuddin, Junior, M.Z., Arfah, H., 2009. Teknologi transplantasi sel testikular dalam rekayasa produksi benih ikan gurame (Osphronemus gouramy). Direktorat Jenderal Pendidikan Tinggi. 32 p. Badan Standardisasi Nasional, 2000. Induk ikan gurame (Osphronemus gouramy, Lac) kelas induk pokok (Parent Stock). SNI : 01-6485.1-2000. BI, 2010. Sistem informasi pola pembiayaan lending model usaha kecil. http://www.bi.go.id/sipuk/id/?id=4&no=40201&idrb=43601 [7 Oktober 2010]. Brinster, R.L., Zimmermann, J.W., 1994. Spermatogenesis following male germ cell transplantation. Proc Nat Acad Sci USA 91, 11298-11302. Brown, T.A., 2010. Gene cloning and DNA analysis: an introduction, sixth ed. Willey-Balckwell, UK. Hermawan, A., 2009. Deteksi sel donor ikan gurame Osphronemus gouramy pada larva ikan nila Oreochromis niloticus. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor. KKP, 2010. Rencana strategis kementrian perikanan dan kelautan 2010-2014. Kementrian Kelautan dan Perikanan, Jakarta. Lacerda, S.M.S.N., Batlouni, S.R., Silva, S.B.G., Homem, C.S.P., Franca L.R., 2006. Germ cells transplantation in fish: the Nile-tilapia model. Anim Reprod 146-159. Lacerda, S.M.S.N., Batlouni, S.R., Assis, L.H., Resende, F.M., Campos-Silva, S.M., Campos-Silva, R., Segatelli, T.M., Franca, L.R., 2008. Germ cell transplantation in tilapia (Oreochromis niloticus). Cybium 32(2), 115-118. Lacerda, S.M.S.N., Batlouni, S.R,, Costa G.M.J., Segatelli T.M., Bruno R., 2010. A new and fast technique to generate offspring after germ cells transplantation in adult fish: the Nile tilapia (Oreochromis niloticus) model. PLoS ONE 5(5), e10740. Majhi, S.K., Hattori, R.S., Yokota, M., Watanabe, S., Stru¨ssmann, C.A., 2009. Germ cell transplantation using sexually competent fish: an approach for rapid propagation of endangered and valuable germline. PLoS ONE 4(7), e6132. Mauluddin, 2009. Studi mengenai morfologi dan komposisi sel testikular ikan gurame Osphronemus gouramy Lac. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor. 18 Nicolle, L.E., 1999. Xenotransplantation: an animal future?. Canadian Medical Association. NOV 161 (10). Okutsu, T., Suzuki, K., Takeuchi, Y., Takeuchi, T., Yoshizaki, G., 2006a. Testicular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional egg in fish. Proc Natl Acad Sci USA 103, 2725-2729. Okutsu, T., Yano, A., Nagasawa, K., Shikina, S., Kobayashi, T., Takeuchi, K., Yoshizaki, G., 2006b. Manipulation of fish germ cells: visualization, cryopreservation and transplantation. J Reprod Dev 52, 685. Takeuchi, Y., Yoshizaki, G., Takeuchi, T., 2003. Generation of live fry from intraperitonially transplantation primordial germ cells in rainbow trout. Biol Reprod 6, 1142-1149. Takeuchi, Y., Yoshizaki, G., Takeuchi, T., 2004. Surrogate broodstock produces salmonids. Nature 430, 629-630. Takeuchi, Y., Higuchi, K., Yatabe, T., Miwa, M., Yoshizaki, G., 2009. Development of spermatogonial cell transplantation in nibe croaker, Nibea mitsukurii (Perciformes, Sciaenidae). BOR Papers in Press DOI:10.1095/biolreprod.109.077701. Wikipedia, 2010. Xenotransplantation. Available http://www.wikipedia.com/xenotransplantation.html. [2 Mei 2010]. at Yazawa, R., Takeuchi, Y., Higuchi, K., Yatabe, T., Kabeya, N., Yoshizaki, G., 2010. Chub mackerel gonads support colonization, survival, and proliferation of intraperitoneally transplanted xenogenic germ cells. BOR Papers in Press DOI:10.1095/biolreprod.109.081281. Yoshizaki, G., Ichikawa, M., Hayashi, M., Iwasaki, Y., Miwa, M., Shikina, S., Okutsu, T., 2010a. Sexual plasticity of ovarian germ cells in rainbow trout. Development 137, 1227-1230. Yoshizaki, G., Okutsu, T., Ichikawa, M., Hayashi, M., Takeuchi, Y., 2010b. Sexual plasticity of rainbow trout germ cells. Anim Reprod 187-196. 19 20 Lampiran 1. Proses penyiapan larva nila resipien a. Tingkah laku pemijahan induk nila (mating) b. Pengurutan (stripping) induk nila betina dan jantan c. Fertilisasi buatan d. Inkubasi telur e. Larva ikan nila siap ditransplantasi 21 Lampiran 2. Penyiapan ikan donor gurame a. Ikan donor gurame jantan b. Penimbangan ikan donor c. Pembedahan ikan donor d. Gonad ikan donor 22 Lampiran 3. Prosedur disosiasi testis ikan gurame (Mauluddin, 2009) Ikan donor ditimbang Ikan dibedah dan testis diambil Testis ditimbang Testis dicacah 1.5 mL larutan tripsin 0,5% dalam PBS dicampurkan pada cacahan testis Testis dicacah kembali Dipipet (pipetting) 3-5 menit sampai berbuih Disaring menggunakan saringan sel ke dalam tabung Eppendorf 1,5 ml Disentrifugasi 10 menit, 1200 rpm Supernatan dibuang, endapan disuspensi kembali dengan PBS Suspensi sel diamati dan dihitung menggunakan haemacytometer di bawah mikroskop Sel testikular donor siap ditransplantasikan 23 Lampiran 4. Contoh perhitungan dan penentuan dosis sel donor Perhitungan sel testikular ikan donor dengan haemocytometer menggunakan rumus sebagai berikut : Misalkan volume suspensi sel awal (larutan induk) adalah 200 µl, dilakukan pengenceran 20 kali (10 µl biang dalam 200 µl suspensi baru) agar sel tidak terlalu padat untuk diamati. A, B, C, D, dan E merupakan titik pengambilan/penghitungan sel testikular. Di titik A terhitung sebanyak 20 sel testikular, B = 23 sel, C = 26 sel, D = 24 sel, dan E = 25 sel. Jadi jumlah sel/µl dapat dihitung sebagai berikut : (dalam haemocytometer) ∑ sel = 5900 sel/µl x 200 µl = 1.180.000 sel (dalam pengenceran 20x) ∑ sel = 1.180.000 sel/µl x 20 = 23.600.000 sel (dalam larutan induk 200 µl) Jadi konsentrasi sel testikular dalam larutan induk adalah: ∑ sel = 23.600.000 sel/200 µl = 118.000 sel/µl Penentuan dosis dan pengenceran : Dosis yang digunakan adalah 20.000 sel/0,5µl/ekor resipien = 40.000 sel/µl/ekor resipien. Maka pengenceran yang perlu dilakukan adalah 118.000/40.000 = 2,95 kali. Misalkan volume total suspensi sel dengan konsentrasi 40.000 sel/µl (M2) yang akan digunakan adalah 200 µl (V2), maka volume larutan induk dengan konsentrasi 118.000 sel/µl (M1) yang diambil (V1) adalah : V1 x M1 = V2 x M2 Jadi dilakukan pengenceran dengan pengambilan larutan induk sebanyak 67,8 µl ditambahkan PBS hingga 200 µl yang dapat digunakan untuk transplantasi 400 ekor larva resipien. 24 Lampiran 5. Transplantasi sel donor a. Set alat mikroinjeksi b. Proses loading sel c. Larva resipien pada cekungan gel agarosa d. Proses transplantasi sel 25 Lampiran 6. Perbandingan variabel kinerja reproduksi ikan gurame dan ikan nila Variabel (satuan) Ikan Gurame Ikan Nila Keterangan Produksi induk (bulan) 24-36 6-14 Produksi induk nila 3-4 kali lebih cepat Bobot induk (kg/ekor) 1,5-2,5 0,3-0,6 Wadah pemeliharaan induk nila 4-5 kali lebih efisien 3.000-12.500 1.000-2.000 750-1.000 3.333 Produksi benih nila 3 kali lebih banyak 8-12 2-3 Frekuensi produksi benih nila 4 kali lebih sering Fekunditas (butir/ekor) Fekunditas (butir/kg) Siklus pemijahan (minggu) Asumsi: Tidak ada perubahan sifat reproduksi ikan nila resipien Sifat reproduksi ikan gurame berdasarkan SNI: 01-6485.1-2000 dan sifat reproduksi ikan nila berdasarkan SNI: 01-6138-1999. 26