Asam Amino dan Protein
advertisement
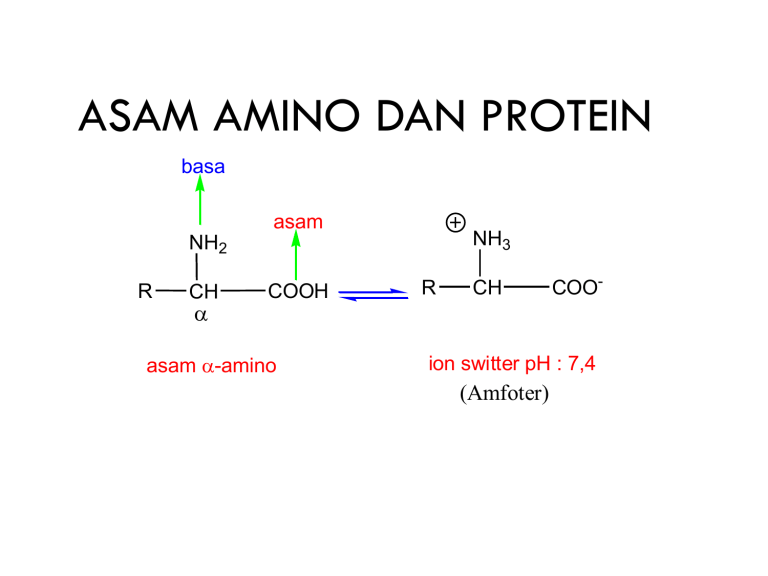
ASAM AMINO DAN PROTEIN basa asam NH3 NH2 R CH COOH asam -amino R CH COO- ion switter pH : 7,4 (Amfoter) ASAM AMINO DAN PROTEIN Asam amino adalah senyawa penyusun protein. Asam amino mempunyai satu gugus karboksil dan satu gugus amino. Pada umumnya gugus amino terikat pada posisi dari gugus karboksil. basa asam NH3 NH2 R R H, C - : kiral CH COOH asam -amino R CH COO- ion switter pH : 7,4 (Amfoter) Asam Amino Amfoter Asam amino dapat berperan sebagai asam (mendonorkan proton pada basa kuat) dan dapat berperan sebagai basa (menerima proton dari asam kuat) Bentuk kesetimbangan : HO RCHCOOH NH3+ pH rendah H RCHCOO HO H RCHCOO NH3+ NH2 pH netral pH tinggi Protein Molekul yg sangat vital untuk organisme terdapt di semua sel Polimer disusun oleh 20 mcm asam amino standar Rantai asam amino dihubungkan dg iktn kovalen yg spesifik Struktur & fungsi ditentukan oleh kombinasi, jumlah dan urutan asam amino Sifat fisik dan kimiawi dipengaruhi oleh asam amino penyusunnya Fungsi Protein Reaksi kimia enzymes Immune system antibodies Mechanical structure tendons Generation of force muscles Nerve conduction ion channels Vision eye lens . . . and much more! Asam Amino merupakan unit penyusun protein Struktur: satu atom C sentral yang mengikat secara kovalent: gugus amino, gugus karboksil, satu atom H dan rantai samping (gugus R) • Gugus R rantai samping yang berbeda-beda pada setiap jenis asam amino • Gugus R yang berbeda-beda tersebut menentukan: -. Struktur -. Ukuran -. Muatan elektrik -. Sifat kelarutan di dalam air Asam amino standar Asam amino yang menyusun protein organisme ada 20 macam disebut sebagai asam amino standar Diketahui asam amino ke 21 disebut selenosistein (jarang ditemukan) Terdapat di beberapa enzim seperti gluthatione peroxidase. Klasifikasi Asam amino Diklasifikasikan berdasar gugus R (rantai samping) Biasanya sifat-sifat seperti: hidrofobik/hidrofilik, polar/non polar, ada/tidaknya gugus terionisasi AROMATIK NON POLAR Asam amino BASIC (+) ACIDIC (-) POLAR Asam amino non polar Memiliki gugus R alifatik Glisin, alanin, valin, leusin, isoleusin dan prolin Bersifat hidrofobik. Umum terdapat pada protein yang berinteraksi dengan lipid Asam amino polar Memiliki gugus R yang tidak bermuatan Serin , threonin, sistein, metionin, asparagin, glutamin Bersifat hidrofilik mudah larut dalam air Cenderung terdapat di bagian luar protein Sistein berbeda dgn yg lain, karena gUgUs R terionisasi pada pH tinggi (pH = 8.3) sehingga dapat mengalami oksidasi dengan sistein membentuk ikatan disulfide Asam amino dengan gugus R aromatik Fenilalanin, tirosin dan triptofan Bersifat relatif non polar hidrofobik Fenilalanin bersama dgn V, L & I a.a plg hidrofobik Tirosin gugus hidroksil , triptofan cincin indol Sehingga mampu membentuk ikatan hidrogen penting untuk menentukan struktur enZim Asam amino aromatik mampu menyerap sinar UV λ 280 nm sering digunakan utk menentukan kadar protein Asam amino dengan gugus R bermuatan positif Lisin, arginin, dan histidin Mempunyai gugus yg bsft basa pd rantai sampingnya Bersifat polar terletak di permukaan protein dapat mengikat air. Histidin mempunyai muatan mendekati netral (pd gugus imidazol) dibanding lisin gugus amino arginin gugus guanidino Asam amino dengan gugus R bermuatan negatif Aspartat dan glutamat Mempunyai gugus karboksil pada rantai sampingnya bermuatan (-) / acid Asam amino non standar Merupakan asam amino diluar 20 mcm as. Amino standar Terjadi karena modifikasi yang terjadi setelah suatu asam amino standar menjadi protein. Kurang lebih 300 asam amino non standar dijumpai pada sel modifikasi serin yang mengalami fosforilasi oleh protein kinase • modifikasi prolin dlm proses modifikasi posttranslasi, oleh prokolagen prolin hidroksilase. • Ditemukan pada kolagen untuk menstabilkan struktur • Dari modifikasi Glu oleh vit K. • karboksi glutamat mampu mengikat Ca penting utk penjendalan darah. • Ditemukan pd protein protombin •Modifikasi lisin. Terdapat di kolagen dan miosin (protein kontraksi pd otot) dan berperan untuk sisi terikatnya polisakarida •Beberapa ditemukan asam amino nonstandar yang tidak menyusun protein merupakan senyawa antara metabolisme (biosintesis arginin dan urea) STRUKTUR PROTEIN Struktur primer - sifat kovalen pada ikatan peptida stabil, tidak dipengaruhi oleh : pH, pelarut. - Atom-atom C, H, N terletak pada satu bidang datar - R diproyeksikan pada arah tertentu pada bidang Struktur sekunder - Terbentuk karena ikatan hidrogen - Bentuk spiral (α helix) - Gugus karbonil dari setiap asam amino membentuk ikatan hidrogen dengan gugus amino dari asam amino ke tiga di sepanjang rantai polipeptida Struktur tertier - Dibentuk oleh interaksi antara gugus samping (R) dari asam – asam amino. - Hasil interaksi : pelipatan α – helix, gugus R yang hidrofobik disembunyikan di dalam lipatan protein menjadi sangat larut dlm air. - Contoh : insulin, hemoglobin dan albumin telur - Ditemukan : ikatan disulfida, jembatan garam, ikatan hidrogen, atraksi hidrofobik. HIDROLISIS PATI Perlakuan Waktu Hidrolisis 3 Menit 6 Menit 5ml amilum + HCl + Pemanasan 9 Menit 12 Menit 15 Menit 18 Menit 21 Menit Hasil Uji Iodium Ungu Kehitaman Ungu Kehitaman Ungu Kehitaman Merah kecoklatan coklat coklat pucat kuning Keterangan amilosa amilopektin amilopektin eritrodekstrin akrodekstrin maltosa Glukosa amilodekstrin ERITRODEKSTRIN akrodekstrin









