1410-0029 Agrin Vol. 15, No. 1, April 2011 76 ISOLASI DAN UJI
advertisement

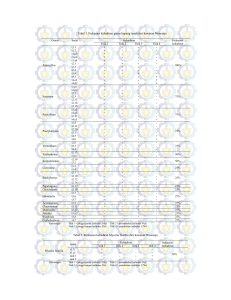
ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 ISOLASI DAN UJI EFEKTIFITAS IN VITRO MIKROBA PELARUT FOSFAT ISOLAT AJIBARANG Isolation and in Vitro Effectivity Test of Ajibarang Phosphate Solubilizing Microorganisms Isolate Oleh: Tamad dan Joko Maryanto Fakultas Pertanian Universitas Jenderal Soedirman, Purwokerto Alamat korespondensi: Tamad ([email protected]) ABSTRAK Kelarutan P yang rendah dalam tanah dapat ditingkatkan antara lain dengan memanfaatkan mikroba pelarut fosfat (MPF). MPF menghasilkan sejumlah asam organik (sitrat, oksalat, glukonat, laktat dan fumarat) yang mampu melarutkan P. Penelitian ini bertujuan untuk mendapatkan isolat MPF lokal yang unggul dalam melarutkan P dari Batuan Fosfat (BF) deposit Ajibarang. Penelitian ini merupakan percobaan faktor tunggal, yaitu MPF dengan 10 isolat bakteri dan 10 isolat fungi. Rancangan yang digunakan ialah Rancangan Acak Lengkap dengan tiga ulangan. Berdasarkan karakteristik kemampuan mengasamkan media tumbuh, laju tumbuh dan daya melarutkan P (zone bening dan P terlarut) maka: a) isolat dari sumber akar tanaman lebih unggul dibanding asal tanah sekitar perakaran, b) isolat dari tanaman padi dan jagung lebih unggul dibanding dari tanaman lainnya dan c) isolat kelompok bakteri lebih unggul dibanding kelompok fungi. MPF dengan daya larut P dari BF tertinggi ialah isolat bakteri dari akar padi dan jagung dengan daya larut 1,2 sampai 1,3 ppm P/hari. Kata kunci: mikroba pelarut fosfat, batuan fosfat, isolat Ajibarang ABSTRACT The low solubility of P in soil could be enhance by using microorganisms. This due to the organic acids (citrate, oxalate, gluconate, lactate and fumarate) produce by soil microorganisms could increase the solublity of P. The organic acid could form chelate with Al, Fe and Ca, result in the release of P. The research aimed is to get Phosphate Solubilizing Microorganisms (PSM) isolat well on solubilizing P of Ajibarang Rock Phosphate (RP). The single factor of this research is PSM (ten bactery and ten fungy). The research was arranged in Complete Randomized Design with three repeated. The base of acidity capability, rate of growth and solubilizing of P, so isolate PSM: a) from rhizoplane is better than isolate from rhizosphere, b) from paddy and corn better than anather plant and c) bactery isolate better than fungy isolate. Isolate PSM with highest solubilizing of P from RP is bactery isolate from paddy and corn root. Phosphorus soluble from RP by that isolate is between 1.2 to 1.3 ppm P/day. Key words: phosphate solubilizing microorganisms, rock phosphate, Ajibarang isolate agen penjerap P yang mempengaruhi PENDAHULUAN Persoalan yang umum dihadapi oleh ketersediaan P. fosfor (P) adalah tidak semua P dalam pengelolaan tanah tanah segera tersedia bagi tanaman, sangat berpengaruh terhadap tergantung pada sifat dan ciri tanah serta adalah jenis sumber P yang ditambahkan pengelolaan tanah itu sendiri. ke dalam tanah (Havlin et al., 2005). Diantara Sedangkan yang faktor sangat ketersediaan P sifat dan ciri tanah yang penting ialah pH Sumber utama P dalam tanah berasal tanah yang terkait erat dengan keberadaan dari kerak bumi yang mengandung sekitar 76 ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 0,12% P berupa batuan beku dan batuan sedimen (Barber, 1995). Berkaitan dengan permasalahan Selain itu, tersebut di atas, penelitian ini bertujuan sumber P bagi tanah juga dapat berasal untuk mendapatkan isolat MPF lokal yang dari penambahan unsur P ke dalam tanah mampu berupa pupuk fosfat. Sebagian besar Ajibarang dan mengetahui efektifitas isolat bahan dasar pembuatan pupuk fosfat lebih MPF lokal dalam melarutkan P dari BF dari 90% berasal dari impor. Kebutuhan asal Ajibarang, sehingga didapatkan isolat impor MPF lokal yang unggul dalam melarutkan fosfat Indonesia tahun 2000 diperkirakan sekitar 3 juta ton, tentunya melarutkan P dari BF asal P dari BF. kenyataan ini membutuhkan devisa yang sangat besar (Sudradjat, 1997). Oleh karena itu perlu segera dicarikan alternatif sumber pupuk P lain. METODE PENELITIAN Penelitian Laboratorium ini Tanah dilaksanakan Faperta di Unsoed Salah satu sumber pupuk P adalah dengan sumber dana Dosen Muda tahun yang potensinya cukup besar dan 2007. Penelitian dilaksanakan mulai April tersedia di beberapa daerah di Indonesia. sampai dengan september 2007. Penelitian Namun kendala pemanfaatan BF sebagai ini merupakan percobaan faktor tunggal sumber P ialah kelarutannya yang rendah. yaitu jenis isolat mikroba pelarut fosfat { Kelarutan BF yang rendah dapat diatasi = 20 jenis isolat MPF (10 isolat bakteri dan antara lain dengan memanfaatkan MPF. 10 isolat fungi)}, dengan tiga ulangan, Subba-Rao (1999) menyatakan bahwa, dengan rancangan dasar Rancangan Acak MPF menghasilkan Lengkap. organik (sitrat, oksalat, glukonat, laktat Pengamatan dilakukan terhadap pH dan fumarat) yang mampu melarutkan P. media tumbuh, laju tumbuh dan jumlah P Mekanismenya, organik yang terlarut dari BFA pada medium tersebut dapat melakukan pengkelatan Pikovskaya padat dan cair (pewarna biru terhadap Al, Fe, dan Ca sehingga P akan klormolibdat) oleh MPF. bebas dan tersedia untuk tanaman. Akan tersebut tetapi pelarutan fosfat tersebut bersifat menggunakan Uji Fisher (F) dan untuk spesifik, sehingga satu membandingkan antar jenis isolat MPF BF sejumlah asam-asam asam spesies MPF dilakukan Terhadap data analisis varian efektif dalam melarutkan BF asal suatu dilakukan tempat menggunakan Uji Jarak Ganda Duncan belum tentu efektif melarutkan BF asal tempat lain. dalam analisis nilai tengah dengan tingkat kepercayaan 95%. 77 ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 Isolasi MPF dilakukan secara steril 3500 putaran per menit selama 15 menit, dari perakaran (rizoplan) dan tanah sekitar kemudian disaring. Penetapan P dilakukan perakaran panjang, dengan metode pewarnaan chlormolibdat jagung, padi, ketela pohon dan umbi yang dibaca dengan spektrofotometer pada ganyong/ irut yang digunakan sebagai panjang sumber isolat. (Hidayat, 1978). (rizosfir) kacang Isolasi dilakukan dengan gelombang 660 milimikron menggunakan metode pengenceran pada media agar Pikovskaya (Subba -Rao, 1999) HASIL DAN PEMBAHASAN dengan mengganti sumber P berasal dari MPF yang diisolasi dari dua sumber tepung BF. Isolat MPF ditumbuhkan dalam (akar dan tanah sekitar perakaran) dan lima medium pikovskaya pada inkubator selama jenis seminggu. panjang, ketela pohon dan sagu/ irut) merupakan Zone biru sekitar koloni pertanda mikoba tersebut tanaman (padi, jagung, kacang memiliki kenampakan morfologis yang mampu melarutkan P dari BF yang hampir digunakan bagi berlendir dan berbentuk bundar untuk perkembangannya bakteri, sedangkan fungi berwarna putih, (Anas, 1989). Mikroba yang mampu berbulu dan berbentuk bundar. Isolat MPF melarutkan P dari dilakukan yang ditumbuhkan pada media Pikovskaya pemurnian dan dengan dengan pewarna chlormolibdat terlihat agar bahwa isolat MPF yang berasal dari akar Pikovskaya secara berulang sebanyak tiga tanaman umumnya memiliki zona biru kali. isolat yang terlihat lebih jelas dibandingkan digunakan ciri morfologis koloni yaitu: dengan isolat yang berasal dari tanah di warna, transparansi, lendir, bentuk, dan sekitar perakaran. ukuran. biru lebih jelas terlihat pada isolat bakteri sebagai pertumbuhan dan membiakannya BFA P perbanyakan dalam Pembedaan Uji sumber medium antar efektifitas jenis MPF dalam melarutkan P dari BFA dilakukan dengan menumbuhkan isolat tersebut dalam sama, yakni berwarna hijau, Demikian juga zone dibanding jamur dan isolat asal padi dibanding sumber tanaman lainnya. pH media akhir inkubasi, laju medium Pikovskaya cair (tanpa agar) pada tumbuh dan P terlarut dari BF pada media tabung reaksi (20 ml) dengan sumber P tumbuh Pikovskaya terlihat berbeda antara dari tepung BFA selama seminggu. Hasil isolat bakteri dan jamur. pelarutan P dipisahkan dari mikrobanya berasal dari sumber tanaman yang berbeda dengan dengan mempunyai kemampuan menurunkan pH, pemusing (centrifuge) pada kecepatan laju tumbuh, dan melarutkan P yang 78 melakukan dekantasi MPF yang ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 berbeda (Tabel Berdasarkan di sekitar perakaran. Demikian juga, isolat karakteristik kemampuan melarutkan P yang berasal dari padi lebih mengasamkan (zone biru), laju tumbuh, kemampuan pH media, mempunyai laju tumbuh dan P mengasamkan media tumbuh dan daya terlarut dari BF pada media tumbuh melarutkan media Pikovskaya lebih tinggi disbanding sumber Pikovskaya terlihat bahwa isolat dari akar tanaman lainnya. Isolat bakteri lebih lebih unggul dibanding dari tanah (Tabel mengasamkan pH media, mempunyai laju 2). Isolat yang berasal dari akar memiliki tumbuh dan P terlarut dari BF pada media pH media yang lebih rendah dibandingkan tumbuh Pikovskaya lebih tinggi dibanding dengan isolat yang berasal dari tanah isolat jamur. Kemampuan isolat bakteri sekitar tersebut MPF dalam melarutkan P dari BF hampir menunjukkan bahwa isolat yang diisolasi seragam, yaitu antara 1,0 sampai 1,5 ppm dari P 1). dari perakaran. akar tanaman mengeluarkan asam BF pada Hal lebih banyak P/hari. Sedangkan daya larut P dari BF organik sehingga oleh isolat jamur bervariasi antara 0,2 mampu menurunkan pH lebih tinggi sampai 1,5 ppm P/hari. dibandingkan isolat yang berasal dari tanah Tabel 1. pH media, laju tumbuh dan P terlarut media Pikovskaya-BF yang diinokulasi MPF selama 4x24 jam Kode pH Laju Tumbuh P terlarut P terlarut (%) 7 Isolat Media (UPK/ml/hari) (x10 ) (ppm) (x 10-4) Bakteri: AP 5,48 14,51 1,40 1,40 TP 6,24 11,96 0,80 0,80 AJ 6,35 13,53 1,14 1,14 TJ 6,07 14,15 1,00 1,00 Akp 6,42 16,07 0,88 0,88 TKp 6,37 14,08 0,92 0,92 AKh 5,94 13,23 1,23 1,23 TKh 6,42 14,15 0,96 0,96 AS 6,30 14,70 1,10 1,10 TS 6,78 15,45 1,15 1,15 Jamur: AP 6,45 1,62 1,49 1,49 TP 6,58 1,09 1,08 1,08 AJ 6,41 1,72 1,93 1,93 TJ 6,58 1,14 1,20 1,20 AKp 6,42 1,21 1,16 1,16 TKp 6,95 1,02 0,42 0,42 AKh 6,56 1,51 1,11 1,11 TKh 6,60 1,16 0,36 0,36 AS 6,69 1,26 0,56 0,56 TS 7,13 1,36 0,21 0,21 Keterangan: A (Akar), T (Tanah perakaran), J (jagung), Kh (Ketela pohon), Kp (Kacang panjang), P (Padi) dan S (Sagu/ Irut) 79 ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 Tabel 2. Pengaruh sumber isolat terhadap diameter zone biru, laju tumbuh, pH media dan P terlarut media Pikovskaya-BF yang diinokulasi MPF selama 4 x 24 jam Sumber Ф Zona biru Laju Tumbuh pH P terlarut 7 Isolat (mm) (SPK/ml/hari) (x10 ) Media (ppm) Akar 5,35 b 7,94 b 6,30 a 1,20 b Tanah 4,73 a 7,56 a 6,57 b 0,81 a Padi 6,01 c 7,30 a 6,19 a 1,19 bc Jagung 4,22 a 7,64 ab 6,35 b 1,32 c Kacang panjang 5,14 b 8,10 b 6,54 bc 0,85 ab Ketela Pohon 5,86 bc 7,51 ab 6,38 b 0,92 ab Sagu/Irut 4,00 a 8,12 b 6,73 c 0,76 a Bakteri 7,65 b 14,18 b 6,24 a 1,06 b Jamur 2,43 a 1,31 a 6,64 b 0,95 a Keterangan: Angka dalam kolom dan sumber isolat sama yang diikuti oleh huruf sama tidak berbeda uji DMRT pada taraf 5%. Penurunan pH biakan menjadi masing-masing kelompok dan sifat media kurang dari 7,00 dikarenakan MPF tersebut tumbuh yang digunakan. mengeluarkan asam organik dari proses media Pikovskaya yang digunakan sebagai metabolismenya 1999; media tumbuh dijadikan pH 7,00, hal ini Pradhan dan Sukla, 2006). Mikroba hidup yang menjadi penyebab mengapa fungi melakukan metabolisme sel yang mampu tumbuh lebih lambat. menghasilkan asam organik. lebih menyukai lingkungan yang agak (Subba-Rao, Keaktifan mikroba dalam melakukan metabolisme sel untuk menghasilkan asam organik tidak Dalam hal ini Fungi umumnya masam (Subba-Rao, 1999). Subba-Rao (1999) menyebutkan, selalu sama antar jenis yang sama, apalagi bahwa yang menjadi tolok ukur suatu dari jenis yang berbeda (Hadijati, 1993; isolat tersebut dikatakan unggul tidak Sperber, Kemampuan hanya kemampuannya yang tinggi dalam menghasilkan asam organik dari MPF melarutkan fosfat tak larut saja, akan tetapi bergantung pada keaktifan mikroba itu juga dilihat dari kecepatan tumbuhnya, sendiri tingkat kekeruhannya dalam media cair, 2004). dalam melakukan proses metabolisme sel (Paul and Clark, 1989). Laju tumbuh (UPK/ml/hari) isolat dan luasan zona biru. Perbedaan lain, isolat asal padi dan jagung relatif lebih unggul fungi sepuluh kali lebih lambat dibanding dibanding asal tanaman lainnya. bakteri. Sedangkan laju tumbuh antar kelompok bakteri mempunyai sifat terkait isolat masing-masing kelompok (bakteri dengan kemampuan melarutkan P lebih atau unggul dibanding kelompok fungi (Turan fungi) menunjukkan pola yang seragam. Laju tumbuh kelompok mikroba sangat 80 ditentukan oleh sifat genetis et al., 2006). Isolat ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 Menurut Jang dan Suh (2002), terdapat korelasi negatif antara pH dengan pelarutan P, dimana penurunan pH sejalan dengan penaikan pelarutan P. Hubungan antara pH dengan P terlarut dimana pelarutan P tergantung dari banyaknya dan jenis asam organik yang dikeluarkan oleh isolat MPF tersebut yang ditandai dengan penurunan pH. KESIMPULAN Hasil isolasi didapatkan dua kelompok MPF yaitu bakteri dan jamur dengan masing-masing sepuluh isolat. Antar jenis morfologi isolat yang Berdasarkan tidak mempunyai jauh karakteristik ciri berbeda. kemampuan mengasamkan media tumbuh, laju tumbuh dan daya melarutkan P (zone biru dan P terlarut) isolat dari sumber akar, isolat dari tanaman padi dan jagung dan isolat kelompok bakteri lebih unggul. Isolat MPF dengan daya larut P dari BF tertinggi ialah isolat bakteri dari akar tanaman padi dan jagung dengan daya larut 1,2 sampai 1,3 ppm P/hari. DAFTAR PUSTAKA Anas, I. 1989. Biologi tanah dalam praktek. Petunjuk Laboratorium. PAU Bioteknologi IPB. Bogor. Barber, S.A. 1995. Soil nutrient bioavailability a mechanistis approach. John Wiley and Sons, Inc. New York. Havlin, J.L, J.D. Beaton, S.L. Tisdale and W.L. Nelson. 2005. Soil fertility and fertilizers, an introduction to nutrient management. 7th ed. Pearson Education, Inc., New Jersey, 515p. Hadijati, T. 1993. Efektivitas bakteri pelarut fosfat dalam melarutkan fosfat secara in vitro. Majalah Ilmiah UNSOED, 3(19): 10-16. Hidayat, A. 1978. Methods of soil chemical analysis. JICA-JJFCRR. Bogor. Jang, J, dan S. Suh. 2002. Aplication of va mychorrhizae and phosphate solubilizer as biofertilizers in Korea. National Institute of Agricultural Science and Technology RDA, pp. 17. Paul, E.A, and F.E. Clark. 1989. Soil microbiology and biochemistry. Academic Press, Inc. San Diego, California. Pradhan, N, and L.B. Sukla. 2006. Solubilization of inorganic phosphate by fungi isolated from agriculture soil. African Journal of Biotechnology, 5(10): 850-854. Sperber, J. L. 2004. The incidence of apatite-solubilizing organisms in the rizhosphere and soil. (On-line), Australian Journal of Agriculture Research, 9(6): 778-781. Subba Rao, N.S. 1999. Soil microbiology (Fourth edition of soil microorganisms and plant growth). Science Publisher, Inc. New Hampshire, USA. Sudradjat, A. 1997. Fosfat. pp. 13-166. Dalam S. Suhala, dan M. Arifin, (eds) Bahan galian industri. Puslitbang Teknologi Mineral. Bandung. Turan, M, N. Ataoglu, and F. Sahin. 2006. Evaluation of the capacity of phosphate solubilizing bacteria and 81 ISSN: 1410-0029 Agrin Vol. 15, No. 1, April 2011 fungi on phosphorus 82 different form of in liquid culture. Journal of Sustainable Agriculture, 28(3): 99-108.