karakterisasi fisiologi dan identifikasi molekuler isolat-isolat
advertisement

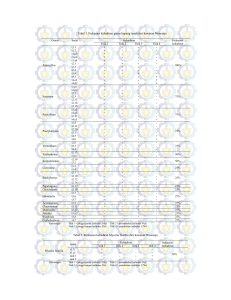
KARAKTERISASI FISIOLOGI DAN IDENTIFIKASI MOLEKULER ISOLAT-ISOLAT BAKTERI METANOTROF ASAL SAWAH WILAYAH BOGOR DAN SUKABUMI DINA DWI ASTUTI DEPARTEMEN BIOLOGI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR BOGOR 2009 ABSTRAK DINA DWI ATUTI. Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof Asal Sawah Wilayah Bogor dan Sukabumi. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA. Metan (CH4) merupakan salah satu gas rumah kaca utama yang dapat menyerap radiasi inframerah sehingga berkontribusi terhadap pemanasan global. Methanotrof merupakan bakteri yang hidup menggunakan metan sebagai sumber karbon dan energi. Bakteri metanotrof memiliki peran utama dalam mereduksi metan yang lepas ke atmosfer dari lingkungan. Isolat-isolat bakteri metanotrof (BGM 1, BGM 2, BGM 3, BGM 9, dan SKM 14) yang diisolasi dari sawah wilayah Bogor dan Sukabumi diketahui memiliki oksidasi metan yang tinggi. Dalam penelitian ini dilakukan uji fisiologi dengan menggunakan API 20 NE dan analisis sekuen gen 16S rRNA dari kelima isolat tersebut. Kelima isolat menunjukkan hasil positif terhadap uji gelatin, enzim β-galactosidase, asimilasi glukosa, asimilasi manitol, asimilasi N-asetil-glukosamin, asimilasi maltosa, dan asimilasi asam malat. Analisis 16S rRNA menunjukkan isolat BGM 1 dan BGM 3 memiliki kemiripan 74% dan 70% dengan Methylocystis rosea, BGM 2 dan BGM 9 memiliki kemiripan 83% dan 85% dengan Methylococcus capsulatus, dan SKM 14 memiliki kemiripan 65% dengan Methylobacter sp. Pohon filogenetik menunjukkan isolat BGM 1 dan BGM 3 berada satu kelompok dengan Methylocystis rosea strain SV97T, Methylobacterium extorquens, dan Methylosinus trichosporium, namun memiliki kekerabatan terdekat dengan Methylocystis rosea strain SV97T. Isolat BGM 2, BGM 9, dan SKM 14 berada satu kelompok dengan Methylococcus capsulatus strain texas, Methylomicrobium buryatense, dan Methylobacter sp. namun isolat BGM 2 dan BGM 9 memiliki kekerabatan terdekat dengan Methylococcus capsulatus strain texas. Sedangkan isolat SKM 14 memiliki kekerabatan terdekat dengan Methylobacter sp. ABSTRACT DINA DWI ASTUTI. Physiological Characterization and Molecular Identification of Methanotrophic Bacteria isolated from Ricefields in Bogor and Sukabumi. Under supervision of IMAN RUSMANA and ALINA AKHDIYA. Methane (CH4) is one of the main greenhouse gasses that could absorb infra-red radiation so it contribute to global warming. Methanotrophs are bacteria that are able to grow using methane as their only source of carbon and energy. They play a major role in the reduction of the release of methane into the atmosphere from environments. Methanotrophic bacteria isolated from Ricefields in Bogor and Sukabumi (BGM 1, BGM 2, BGM 3, BGM 9, and SKM 14) had a high methane oxidation. Activity physiologycal assay using API 20 NE and molecular identification using 16S rRNA gene sequence analysis were conducted in this research. Five isolates showed a positive reaction of physiological assays for gelatine, β-galactosidase enzyme, glucose assimilation, mannitol assimilation, N-asetil-glukosamin assimilation, maltose assimilation, and malic acid assimilation. BGM 1 and BGM 3 16S rRNA sequence showed that they had similarity to Methylocystis rosea into 74% and 70% respectively, while BGM 2 and BGM 9 had similarity to Methylococcus capsulatu into 83% and 85% respectively, and SKM 14 had 65% similarity with Methylobacter sp. Phylogenetic tree showed that BGM 1 and BGM 3 isolates were in the same group with Methylocystis rosea strain SV97T, Methylobacterium extorquens, and Methylosinus trichosporium, nevertheless they were very close related to Methylocystis rosea strain SV97T. BGM 2, BGM 9, and SKM 14 isolates were in the same group with Methylococcus capsulatus strain texas, Methylomicrobium buryatense, and Methylobacter sp. nevertheless BGM 2 and BGM 9 isolates were very close related to Methylococcus capsulatus strain texas. While SKM 14 was very close related with Methylobacter sp. KARAKTERISASI FISIOLOGI DAN IDENTIFIKASI MOLEKULER ISOLAT-ISOLAT BAKTERI METANOTROF ASAL SAWAH WILAYAH BOGOR DAN SUKABUMI DINA DWI ASTUTI Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada Departemen Biologi DEPARTEMEN BIOLOGI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR BOGOR 2009 Judul Skripsi : Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof Asal Sawah Wilayah Bogor dan Sukabumi Nama NIM : Dina Dwi Astuti : G34051506 Menyetujui : Pembimbing I, Pembimbing II, (Dr. Ir. Iman Rusmana M.Si) NIP 196507201991031002 (Alina Akhdiya M.Si) NIP 080130418 Mengetahui : Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor Dr. Drh. Hasim, DEA NIP 19610328 198601 1 002 Tanggal Lulus PRAKATA Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Penyayang atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari hingga Mei 2009 ini ialah Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof Asal Sawah Wilayah Bogor dan Sukabumi. Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Iman Rumana, M.Si. dan Ibu Alina Akhdiya, M.Si. atas bimbingan dan pengarahan yang diberikan selama penelitian dan penyusunan skripsi ini. Terima kasih kepada Dr. Utut Widyastuti, M.Si atas saran dan masukan yang diberikan sehingga tulisan ini menjadi lebih baik. Di samping itu, penulis sampaikan terima kasih dan syukur kepada Mba Ema, Mba Ary, Mba Rika, dan teman-teman yang melakukan penelitian di laboratorium Mikrobiologi, Nina Sari An-Nisa, Zainati Fakhrina, Qatrunnada, Tiara Kirana Gita, Nur Azifah Cakra Dewi, serta seluruh teman-teman Biologi 42 atas dukungannya dalam pelaksanaan penelitian ini. Serta pihak-pihak yang secara tidak langsung telah membantu dalam pengumpulan data karya ilmiah ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, kakak, dan Mohammad Irfan atas segala doa dan kasih sayangnya. Semoga karya ilmiah ini bermanfaat. Bogor, Juli 2009 Dina Dwi Astuti RIWAYAT HIDUP Penulis dilahirkan di Jakarta pada tanggal 25 April 1987 dari ayah Widodo dan ibu Sri Endang Kartini. Penulis merupakan anak kedua dari dua bersaudara. Tahun 2005 penulis lulus dari SMA Negeri 14 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui Seleksi Pemilihan Mahasiswa Baru. Penulis memilih Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama mengikuti perkuliahan, penulis aktif menjadi anggota KPH (Komisi Pengawas Himpunan Mahasiswa Biologi) pada tahun 2005-2007. Penulis menjadi asisten praktikum mata kuliah Biologi Tingkat Persiapan Bersama pada tahun ajaran 2008/2009, mata kuliah Ilmu Lingkungan pada tahun ajaran 2008/2009. Pada saat mengikuti perkuliahan, penulis melakukan studi lapang di Kawasan wana Wisata Cangkuang Sukabumi, dengan judul makalah “Kemungkinan Tumbuhan Liar Menjadi Tanaman Hias”. Penulis juga melakukan praktik lapangan di PT. Frisian Flag Indonesia pada bulan Juli hingga Agustus 2008, dengan judul makalah “Uji Mikrobiologis Pada Produk Susu Kental Manis Di PT Frisian Flag Indonesia”. DAFTAR ISI Halaman DAFTAR TABEL ........................................................................................................................ vi DAFTAR GAMBAR ................................................................................................................... vi DAFTAR LAMPIRAN ............................................................................................................. ... vi PENDAHULUAN Latar Belakang ................................................................................................................... Tujuan Penelitian ............................................................................................................... BAHAN DAN METODE Waktu dan Tempat ............................................................................................................. Bahan dan Alat ................................................................................................................... Metode Penelitian............................................................................................................... Pemurnian dan Peremajaan Isolat ................................................................................. Pewarnaan Gram dan Uji Fisiologi ............................................................................... Isolasi, Amplifikasi, dan Visualisasi DNA Genom ...................................................... Sekuensing DNA .......................................................................................................... Analisis Filogenetik ...................................................................................................... 1 1 1 1 1 1 1 1 2 2 HASIL Karakteristik Koloni Sel Isolat Bakteri Metanotrof ........................................................... Isolasi, Amplifikasi, dan Visualisasi DNA Genom ............................................................ Sekuensing DNA ................................................................................................................ Analisis Filogenetik ........................................................................................................... 2 3 3 4 PEMBAHASAN ......................................................................................................................... 5 SIMPULAN ................................................................................................................................ 6 SARAN ....................................................................................................................................... 6 DAFTAR PUSTAKA ................................................................................................................. 6 LAMPIRAN ................................................................................................................................ 8 DAFTAR TABEL Halaman 1 Karakteristik morfologi sel dan pewarnaan Gram isolat-isolat bakteri metanotrof ................ 2 Ciri-ciri fisiologi isolat-isolat bakteri metanotrof..................................................................... 3 Hasil analisis sekuen gen 16S rRNA dengan menggunakan program BLAST-N ................... 2 3 4 DAFTAR GAMBAR Halaman 1 Hasil elektroforesis dari amplifikasi gen 16S rRNA menunjukkan pita DNA berukuran ~1.3 kb ............................................................................................................................. ......... 2 Pohon filogenetik berdasarkan sekuen gen 16S rRNA dari isolat-isolat bakteri metanotrof yang dibandingkan dengan sekuen gen 16S rRNA dari beberapa spesies bakteri metanotrof lainnya ..................................................................................................................................... 3 4 DAFTAR LAMPIRAN Halaman 1 Hasil pewarnaan Gram isolat-isolat bakteri metanotrof ......................................................... 9 2 Hasil sekuen gen 16S rRNA dan BLAST-N isolat-isolat bakteri metanotrof .......................... 11 3 Hasil analisis bioinformatika menggunakan program BLAST-N pada situs NCBI.................. 20 PENDAHULUAN Latar Belakang Pengukuran emisi CH4 di lahan sawah mengindikasikan bahwa metan yang diproduksi pada bagian anaerob sebagian dioksidasi pada lapisan permukaan sedimen sawah (Conrad & Rothfus 1991). Bakteri pengoksidasi metan atau methanotroph adalah organisme aerobik yang dapat tumbuh dan berkembang dengan metan sebagai satu-satunya sumber energi. Oleh karena itu, oksidasi metan dapat terjadi pada lingkungan mikro yang bersifat aerobik pada zona perakaran dan pada bagian yang bersifat toksik pada lapisan permukaan tanah. Proses oksidasi metan tersebut diinisiasi oleh enzim metan monooksigenase yang berperan dalam konversi metan menjadi metanol (Oremland dan Capone 1988). Enzim MMO juga berperan dalam degradasi berbagai senyawa polutan seperti trikloroetilen, isomer-isomer dari dikloroetilen, vinil klorida, dan kloroform (Graham et al. 1992). Oksidasi CH4 oleh bakteri metanotrof di lahan sawah dapat mencapai 80 % dari CH4 yang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Hal ini menunjukkan bahwa aktivitas oksidasi CH4 selain dipengaruhi oleh faktor lingkungan juga dipengaruhi oleh dominansi jenis bakteri metanotrof dari komunitas mikroba di lahan sawah. Menurut Hanson & Hanson (1996), upaya mereduksi emisi metan akan 20-60 kali lebih efektif dalam mengurangi kemungkinan pemanasan atmosfer bumi pada abad mendatang daripada mengurangi emisi CO2. Informasi tentang aspek mikrobiologi komunitas bakteri baik jenis, aktivitas dan dominasi bakteri metanotrof yang berperan penting dalam menurunkan emisi gas rumah kaca CH4 pada lahan sawah di Indonesia masih sangat jarang. Oleh karena itu kajian ilmiah tentang komunitas bakteri baik jenis/spesies, aktivitas dan dominansi mikroba bakteri metanotrof penting dilakukan, sehingga hasil dan informasinya dapat mendukung dan dimanfaatkan untuk mewujudkan lahan sawah yang ramah lingkungan. Aplikasi bakteri metanotrof sebagai pengoksidasi metan dapat menjadi salah satu solusi untuk mengurangi emisi metan dari sawah. Sebanyak 40 isolat bakteri metanotrof berhasil diisolasi dari sedimen sawah di Bogor dan Sukabumi. Oksidasi metan tertinggi dihasilkan oleh isolat BGM 1, BGM 2, BGM 3, BGM 9, dan SKM 14 (Hapsary 2008). Oleh karena itu perlu dilakukan karakterisasi fisiologi dan analisis molekular terhadap isolat-isolat bakteri metanotrof tersebut untuk identifikasi hingga tingkat spesies. Tujuan Penelitian Penelitian ini bertujuan untuk mengkarakterisasi secara fisiologi dan mengidentifikasi secara molekular isolatisolat bakteri metanotrof asal sawah wilayah Bogor dan Sukabumi. BAHAN DAN METODE Waktu dan Tempat Penelitian ini dilaksanakan bulan Februari 2009 sampai dengan bulan Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Bahan dan Alat Bahan-bahan yang digunakan, yaitu 5 isolat bakteri metanotrof BGM 1, BGM 2, BGM 3, BGM 9, dan SKM 14 asal sawah wilayah Bogor dan Sukabumi. Peralatan yang digunakan, yaitu PCR (Perkin Elmer Biosystem, USA), Laminar Air Flow, autoklaf, sentrifuse, elektroforesis mini-gel (BioRad Mini-Sub Cell GT, CA, USA), UV Transluminator (Hoefer Scientific Instruments, San Fransisco, USA), dan peralatan lainnya yang biasanya digunakan di laboratorium mikrobiologi. Metode Pemurnian dan peremajaan isolat. Isolat-isolat bakteri metanotrof dimurnikan dan diremajakan pada media agar NMS (Nitrate Mineral Salts) dan diinkubasi pada suhu ruang (27°C) selama 3-14 hari. Pewarnaan Gram dan Uji Fisiologi. Isolat-isolat bakteri metanotrof yang telah dimurnikan dan diremajakan dilakukan pewarnaan Gram. Selanjutnya dilakukan karakterisasi secara fisiologi dan biokimia dengan menggunakan API-Kit (API 20NE). Isolasi, Amplifikasi, dan Visualisasi DNA Genom. Isolasi DNA genom menggunakan metode Lazo (Lazo et al 1987). DNA genom hasil isolasi digunakan untuk amplifikasi gen 16S- rRNA menggunakan Polymerase Chain Reaction (PCR). Amplifikasi gen 16S-rRNA dilakukan dengan memakai DNA template 2 yang diamplifikasi dengan kit Ready To Go PCR Beads (Pharmacia-Biothec) dengan menggunakan universal primer spesifik prokaryot (Marchesi et al. 1998), yaitu 63f (5’-CAGGCCTAACACATGCAAGTC-3’) dan 1387r (5’GGGCGGWGTGTACAAGGC-3’). Kondisi PCR yang digunakan adalah Pre-PCR pada suhu 94oC selama 2 menit, denaturasi pada suhu 92oC selama 30 detik, Annealing primer pada suhu 55oC selama 30 detik, Elongation atau perpanjangan primer pada suhu 75oC selama 1 menit, dan Post PCR pada suhu 75oC selama 5 menit, dengan jumlah siklus sebanyak 30 kali. Pemisahan DNA produk PCR dilakukan pada Elektroforesis mini-gel dengan menggunakan agarose 2 % (b/v) pada tegangan listrik 50 volt selama 45 menit (Sambrook et al. 1989). Visualisasi menggunakan Ethidium Bromida dan dilihat di bawah UV Transluminator. Sekuensing DNA. DNA hasil amplifikasi lalu disekuensing di PT. CHAROEN PHOKPHAND INDONESIAJakarta, untuk mengetahui urutan basa DNA-nya. Hasil sekuen kemudian dijajarkan dengan data GenBank menggunakan program BLAST-N (Basic Local Alignment Search Tool-Nucleotida) dari situs NCBI (National Center for Biotechnology Information) untuk mengetahui kemiripan spesies dari isolat yang diuji. Analisis Filogenetik. Konstruksi pohon filogenik dilakukan dengan menggunakan program MEGA 4.0 (Kumar et al. 2004), metode Neighbor Joining (NJ) dengan bootstrap 1000x. HASIL Karakteristik Koloni Sel Isolat Bakteri Metanotrof Isolat BGM 1, BGM 3, dan SKM 14 memiliki sel berbentuk batang dengan penataan rantai sedangkan isolat BGM 2dan BGM 9 memiliki sel berbentuk bulat dengan penataan rantai. Kelima bakteri metanotrof merupakan bakteri gram negatif, tidak membentuk spora, dan non-motil (Tabel 1). Hasil uji fisiologi menggunakan API 20 NE menunjukkan bahwa kelima isolat bakteri metanotrof dapat mereduksi nitrat menjadi nitrit (kecuali BGM 9), tidak dapat mereduksi nitrat menjadi nitrogen (kecuali BGM 9), menghasilkan urease (kecuali BGM 1), menghidrolisis βglukosidase (kecuali BGM 9), menghidrolisis protease, menghasilkan βgalaktosidase. Kelima bakteri metanotrof juga melakukan asimilasi glukosa, arabinosa (kecuali BGM 3), manosa (kecuali BGM 1), manitol, N-asetil-glukosamin, maltosa, potasium glukonat (kecuali BGM 2), asam malat, dan trisodium sitrat (kecuali BGM 2). Selain itu bakteri metanotrof dapat melakukan fermentasi glukosa pada isolat BGM 3, menghasilkan arginin pada BGM 3 dan BGM 9, melakukan asimilasi asam capric pada isolat BGM 1, BGM 3, dan BGM 9, asimilasi asam adipic pada isolat BGM 9, dan asimilasi asam penilasetik pada BGM 1, BGM 3, dan BGM 9 (Tabel 2). Tabel 1 Karakteristik morfologi sel dan pewarnaan Gram isolat-isolat bakteri metanotrof Isolat Bentuk dan Pewarnaan penataan sel Gram BGM 1 batang, rantai - BGM 2 bulat, rantai - BGM 3 batang, rantai - BGM 9 bulat, rantai - SKM 14 batang, rantai - 23 Tabel 2 Ciri-ciri fisiologi isolat bakteri metanotrof Isolat Bakteri Metanotrof 1 2 3 4 BGM 1 +/- - - BGM 2 +/- - - BGM 3 +/- - BGM 9 -/+ SKM 14 +/- 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 - - + + + + - + + + + + + - + + + + + - + + + + + + + + - - - + - + + + + + + - + - + + + + + + - + + + - - + + - + - - - + + + + + + + + + + + + + + + + + + + + + + + + - - + + - Ket : 1.Nitrat (NO2/N2) 2. Triptofan 3. Glukosa 4. Arginin 5. Urea 6. Esculin ferric sitrat 7. Gelatin 8. 4-nitrophenil-βD-galaktopiranosida 9. Glukosa 10. Arabinosa 11. Manosa 12. Manitol 13. N-asetil-glukosamin 14. Maltosa 15. Potasium glukonat 16. Asam capric 17. Asam adipic 18. Asam malat 19. Trisodium sitrat 20. Asam penilasetik Isolasi, amplifikasi, dan Visualisasi DNA Genom Isolasi DNA genom isolat-isolat bakteri metanotrof dilakukan dengan menggunakan metode Lazo, yang dibuktikan dengan terbentuknya satu pita untuk tiap DNA genom isolat-isolat bakteri metanotrof setelah dielektroforesis dan diamati di atas UV transluminator. Amplifikasi gen 16S rRNA dari kelima isolat bakteri metanotrof menggunakan Primer universal 63 f dan 1387r yang spesifik untuk prokariot. Hasil amplifikasi pada gel elektroforesis yang diamati di atas UV transluminator memperlihatkan adanya pita DNA penyandi gen 16S rRNA dengan ukuran ~1.3 kb setelah dibandingkan dengan DNA marker (1 kb DNA ladder) (Gambar 1) Sekuensing DNA Hasil sekuen gen 16S rRNA tiap isolat dianalisis similaritasnya dengan data di GenBank menggunakan program BLAST-N (Basic Local Alignment Search Tool-Nucleotida) (Lampiran 2). Berdasarkan analisis program BLAST-N diketahui homologi spesies dari isolat yang diuji (Lampiran 3). Isolat BGM 1 memiliki kemiripan 74% dengan Methylocystis rosea strain SV97T, isolat BGM 2 memiliki kemiripan 83% dengan Methylococcus capsulatus strain texas, isolat BGM 3 memiliki kemiripan 69% dengan Methylocystis parvus strain 57, isolat BGM 9 memiliki kemiripan 85% dengan Methylococcus capsulatus strain texas, dan 1 2 3 4 5 M 10.0 kb 1.5 kb 1.0 kb M: marker 1 kb DNA ladder Sumur 1: BGM 1 Sumur 2: BGM 2 Sumur 3: BGM 3 Gambar Sumur 4: BGM 9 Sumur 5: SKM 14 1 Hasil elektroforesis dari amplifikasi gen 16S rRNA menunjukkan pita DNA berukuran ~1.3 kb. isolat SKM 14 memiliki kemiripan 63% dengan Methylobacter sp. clone GASPOKA-565-E11 (Tabel 3). Hasil sekuen isolat BGM 1 dan BGM 3 termasuk ke dalam kingdom: Bacteria, filum: Proteobacteria, kelas: Alphaproteobacteria, ordo: Rhizobiales, dan famili Methylocystaceae. Sedangkan isolat BGM 2, BGM 9, dan SKM 14 termasuk ke dalam kingdom: Bacteria, filum: Proteobacteria, kelas: Gammaproteobacteria, ordo: Methylococcales, dan famili: Methylococcaceae. 24 Analisis Filogenetik Data sekuen gen 16S rRNA dari kelima isolat kemudian dibandingkan dengan beberapa data sekuen gen 16S rRNA dari beberapa spesies bakteri metanotrof seperti Methylococcus capsulatus strain texas, Methylococcus capsulatus (ACM 1292), Methylococcus capsulatus (ACM 3302), Methylocystis parvus strain 57, Methylocystis parvus strain 81, Methylocystis parvus, Methylocystis rosea strain SV97T, Methylobacter sp. clone GASP-OKA-565-E11, Methylobacter sp. clone DFR2W1u37, dan Methylobacter sp. clone BSP4Q1u04. Hasil perbandingan sekuen ini kemudian divisualisasikan dalam bentuk pohon filogenetik yang dapat menunjukkan kekerabatan (Gambar 2). Isolat bakteri metanotrof BGM 1 dan BGM 3 berada satu kelompok dengan Methylocystis parvus strain 57, Methylocystis parvus strain 81, Methylocystis parvus, dan Methylocystis rosea strain SV97T. Sedangkan isolat bakteri metanotrof BGM 2, BGM 9, dan SKM 14 berada satu kaleompok dengan Methylococcus capsulatus strain texas, Methylococcus capsulatus (ACM 1292), Methylococcus capsulatus (ACM 3302), Methylobacter sp. clone GASP-OKA-565E11, Methylobacter sp. clone DFR2W1u37, dan Methylobacter sp. clone BSP4Q1u04. Skala 0.02 menunjukkan jarak evolusi pada panjang cabang, sedangkan angka pada cabang menunjukkan nilai bootstrap. Tabel 3 Hasil analisis sekuen gen 16S rRNA dengan menggunakan program BLAST-N Isolat BGM 1 BGM 2 BGM 3 BGM 9 SKM 14 Spesies Bakteri Metanotrof homolog Methylocystis rosea strain SV97T Methylococcus capsulatus strain texas Methylocystis parvus strain 57 Methylococcus capsulatus strain texas Methylobacter sp. clone GASP-OKA-565-E11 % identitas 74% 83% 69% 85% 65% No.akses AJ414656.1 AJ563935.1 AJ458508.1 AJ563935.1 EU043582.1 Methylococcus capsulatus (ACM 1292) Methylococcus capsulatus strain texas Methylococcus capsulatus (ACM 3302) Uncultured Methylobacter sp. clone GA... Uncultured Methylobacter sp. clone DF... Uncultured Methylobacter sp. clone BS... BGM 9 SKM 14 BGM 2 BGM 3 BGM 1 Methylocystis rosea strain SV97T Methylocystis parvus strain 81 Methylocystis parvus strain 57 Methylocystis parvus Gambar 2 Pohon filogenetik berdasarkan sekuen gen 16S rRNA dari isolat-isolat bakteri metanotrof yang dibandingkan dengan sekuen gen 16S rRNA dari beberapa spesies bakteri metanotrof lainnya 5 PEMBAHASAN Uji fisiologi kelima isolat bakteri metanotrof menunjukkan nilai positif pada uji gelatin, uji PNPG (Para-NitroPhenyl-βDGalactopyranosidase), uji asimilasi glukosa, uji asimilasi manitol, uji asimilasi N-asetilglukosamin, uji asimilasi maltosa, dan uji asimilasi asam malat. Uji gelatin positif menunjukkan bahwa isolat dapat menghidrolisis gelatin yang merupakan protein berukuran besar menjadi polipeptida dan kemudian menjadi asam amino dengan menggunakan enzim protease. Uji PNPG dilakukan untuk mengetahui kemampuan isolat dalam memproduksi enzim ß-galaktosidase yang dapat menghidrolisis atau menguraikan laktosa menjadi glukosa dan galaktosa, hasil positif akan mengubah warna media yang tidak berwarna menjadi kuning. Menurut Tryland & Fiskdal (1997), ß-galaktosidase dapat dihasilkan oleh bakteri gram negatif (Enterobacteriaceae, Vibrinoceae, Pseudomonadaceae, dan Neisseriaceae), bakteri gram positif (Lactobacteriaceae, Streptococcaceae), yeast, dan fungi. Kelima isolat bakteri metanotrof mampu menggunakan dengan baik beberapa sumber karbon untuk proses asimilasinya, yaitu glukosa, manitol, N-asetil-glukosamin, maltose, dan asam malat. Pada hasil sekuensing DNA (Lampiran 2), terdapat komposisi basa DNA G+C yang lebih banyak dibandingkan komposisi basa DNA A+T. Komposisi basa DNA G+C pada pada genus Meyhylobacter sebesar 49%60%, pada genus Methylococcus sebesar 59%-66%, sedangkan pada genus Methylocystis sebesar 62%-67% (Hanson & Hanson 1996). Semakin tinggi nilai kandungan G+C maka semakin sukar molekul untai-ganda DNA tersebut dipisahkan (Yuwono 2008). Analisis sekuen gen 16S rRNA menunjukkan bahwa dari kelima isolat bakteri metanotrof, isolat BGM 1 memiliki kemiripan terdekat dengan Methylocystis rosea strain SV97T pada data GenBank, isolat BGM 3 memiliki kemiripan terdekat dengan Methylocystis parvus strain 57 pada data GenBank, isolat BGM 2 dan BGM 9 memiliki kemiripan terdekat dengan Methylococcus capsulatus strain texas pada data GenBank, dan isolat SKM 14 memiliki kemiripan dengan Methylobacter sp. clone GASP-OKA-565-E11 pada data GenBank (Lampiran 3). Sedangkan berdasarkan analisis pohon filogenetik terlihat bahwa isolat BGM 1 memiliki kemiripan terdekat dengan Methylocystis rosea, isolat BGM 3 memiliki kemiripan terdekat dengan Methylocystis parvus, isolat BGM 2 dan BGM 9 memiliki kemiripan terdekat dengan Methylococcus capsulatus, dan isolat SKM 14 memiliki kemiripan terdekat dengan Methylobacter sp. Hal ini dapat membuktikan bahwa isolat BGM 1 dapat digolongkan ke dalam spesies Methylocystis rosea, isolat BGM 3 dapat digolongkan ke dalam spesies Methylocystis parvus, isolat BGM 2 dan BGM 9 dapat digolongkan ke dalam spesies Methylococcus capsulatus, dan isolat SKM 14 dapat digolongkan ke dalam spesies Methylobacter sp. Pada pohon filogeni dapat dilihat bahwa isolat BGM 1 dan BGM 3 berada satu kelompok dengan Methylocystis parvus strain 57, Methylocystis parvus strain 81, Methylocystis parvus, dan Methylocystis rosea strain SV97T, namun isolat BGM 1 memiliki kekerabatan terdekat dengan Methylocystis rosea strain SV97T dan isolat BGM 3 memiliki kekerabatan terdekat dengan Methylocystis parvus strain 57. Isolat BGM 2, BGM 9, dan SKM 14 berada satu kaleompok dengan Methylococcus capsulatus strain texas, Methylococcus capsulatus (ACM 1292), Methylococcus capsulatus (ACM 3302), Methylobacter sp. clone GASP-OKA-565-E11, Methylobacter sp. clone DFR2W1u37, dan Methylobacter sp. clone BSP4Q1u04, namun isolat BGM 2 dan BGM 9 memiliki kekeraban terdekat dengan Methylococcus capsulatus strain texas. Sedangkan isolat SKM 14 memiliki kekerabatan terdekat dengan Methylobacter sp. clone GASP-OKA-565-E11. 16S rRNA dapat digunakan sebagai penanda molekuler karena molekul ini ada pada setiap organisme dengan fungsi yang identik pada seluruh organisme. Analisis gen penyandi 16S rRNA praktis untuk definisi spesies, karena molekul ini ada pada setiap organisme , sehingga dapat dirancang suatu primer yang universal untuk seluruh kelompok (Pangastuti 2006). Data urutan basa gen penyandi 16S rRNA memungkinkan digunakan untuk mengkonstruksi pohon filogenetik yang dapat menunjukkan nenek moyang dan hubungan kekerabatan organisme (Ward 1998). Menurut Hanson & Hanson (1996), genus Methylobacter memiliki sel berbentuk bulat, bulat panjang, atau batang dengan 6 motilitas bervariasi, tidak dapat memfiksasi nitrogen, tidak tumbuh pada suhu 45°C, dan memiliki pigmentasi sel berwarna coklat atau kuning. Genus Methylococcus memiliki sel berbentuk bulat atau bulat panjang dengan motilitas bervariasi, dapat melakukan fiksasi nitrogen, dapat tumbuh pada suhu 45°C, dan memiliki pigmentasi sel berwarna coklat atau kuning. Sedangkan genus Methylocystis memiliki sel berbentuk bulat, batang, atau bulat panjang. Methylocystis rosea merupakan bakteri gram negatif, berbentuk batang dengan lebar 0.81.1µm dan panjang 1.1-2.5µm, non-motil, tidak membentuk spora, dengan penataan tunggal atau rantai. (Wartiainen et al 2006). Methylocystis parvus. merupakan bakteri metilotrof obligat yang menggunakan metanol sebagai satu-satunya sumber karbon. Bakteri ini tumbuh pada pH optimum antara 7 dan 9 dan temperatur optimum antara 30-37°C. Selain itu bakteri ini memiliki komponen utama polisakarida berupa D-glucose (82%) dan L-rhamnose (14%) (Hou et al 1979). Methylococcus capsulatus merupakan bakteri metilotrofik gram negatif yang memiliki bentuk bulat dan merupakan mikroba termofilik yang dapat hidup secara optimal pada suhu 45°C. Bakteri Metanotrof ini dapat merubah gas rumah kaca dan metan menjadi sumber energi untuk hidupnya dan juga berperan menurunkan tingkat gas metan di atmosfer bumi (Brock 2002). Methylobacter memiliki bentuk morfologi bulat panjang-batang dengan lebar 0.8-1.5µm dan panjang 1.23.0µm dengan penataan tunggal atau rantai, motil pada kultur muda, dan non motil pada kultur tua. Methylobacter sp. merupakan bakteri metanotrof obligat yang menggunakan metan dan methanol sebagai sumber karbon dan energi. Beberapa bakteri ini juga menggunakan methylamine sebagai sumber karbon dan energi (Dworkin et al 2006). Bakteri metanotrof memiliki sistem enzim yang spesifik yaitu methane monooksigenase (MMO) yang juga dapat mendegradasi senyawa organoklorin seperti trikloroetilen, isomer-isomer dari dikloroetilen, vinil klorida, dan kloroform (Graham et al. 1992). Metanotrof mempunyai dua tipe MMO yaitu soluble MMO (sMMO) dan particulate MMO (pMMO). Methylobacter dan Methylococcus termasuk metanotrof tipe I yang dapat mengespresikan enzim pMMO sedangkan Methylocsytis termasuk metanotrof tipe II yang dapat mengespresikan sMMO (Hanson & Hanson 1996). SIMPULAN Kelima isolat bakteri metanotrof hasil isolasi menunjukkan hasil positif terhadap uji gelatin, enzim β-galactosidase, asimilasi glukosa, asimilasi manitol, asimilasi N-asetil-glukosamin, asimilasi maltosa, dan asimilasi asam malat Isolat BGM 1 memiliki kemiripan terdekat dengan Methylocystis rosea strain SV97T (74%) isolat BGM 3 memiliki kemiripan terdekat dengan Methylocystis parvus strain 57 (69%), sedangkan isolat BGM 2 dan BGM 9 memiliki kemiripan terdekat dengan Methylococcus capsulatus strain texas (83% dan 85%), isolat SKM 14 memiliki kemiripan dengan Methylobacter sp. clone GASP-OKA-565-E11 (65%). SARAN Percobaan bakteri metanotrof di tanaman padi perlu dilakukan untuk mengetahui efektivitasnya dalam menurunkan emisi gas metan di sawah DAFTAR PUSTAKA Brock TD. 2002. Methylococcus capsulatus is a methane-oxidising bacterium that has great potential in bioremediation Vol. 5 pp.9-33. Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. Biol. Fertil. Soil 12:2832. Dworkin M, Falklow S, E Rosenberg, KH Scleifer, Stackebrandt. 2006. The Prokaryotes: Proteobacteria: alpha and beta subclasses Ed: 3. Springer Graham DW, Korich DG, Leblanc RP, Sinclair NA, Arnold RG. 1992. Applications of a Colorimetric Plate Assay for Soluble Methane Monooxygenase Activity. Appl Environ Microbiol 58(7): 2231-2236. Hanson R, Hanson TE. 1996. Methanotrophic Bacteria. Journal of Microbiol Reviews 60(2): 439471. Hapsary W. 2008. Isolasi dan karakterisasi bakteri metanotrof asal sawah di 7 Bogor dan Sukabumi [skripsi]. Bogor : Institut Pertanian Bogor. Hou CT, Laskin AI, Patel RN. 1979. Growth and Polysaccharide Production by Methylocystis parvus OBBP on Methanol. Appl Environ Microbiol 37(5) Kumar S, Tamura K, Jakobsen IB, Nei M. 2001. MEGA2: molecular evolutionary genetics analysis software. Bioinformatics 17:1244– 1245 Lazo GR, Roffey R, Gabriel DW. 1987. Conservation of plasmid DNA sequences and pathovar identification of strain Xanthomonas campestris. Pytopathology 77: 1461-1467. Marchesi JR et al. 1998. Design and evaluation of useful bacterium specific PCR primer that amplify genes coding for bacterial 16SrRNA. Appl Environ Microbiol 64:795-799. Oremland RS, Capone DG. 1988. Use of “specific” inhibitors in biogeochemistry and microbial ecology. Adv. Microbiol. Ecol. 10:285-383. Pangastuti A. 2006. Definisi Spesies Prokaryota Berdasarkan Urutan Basa Gen Penyandi 16s rRNA dan Gen Penyandi Protein. Biodiversitas 7(3) : 292-296. Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular Cloning: a Laboratory Manual. Ed ke-2. New York: Cold Spring Harbor Laboratory. Tryland I, Fiksdal L. 1997. Enzyme characteristics of β-D-galactosidase and β-D-glucuronidase positive bacteria and their interference in rapid methods for detection of waterborne coliforms and Escherichia coli. J Appl Environ Microbiol 64 : 1018-1023 Ward, D.M. 1998. A natural species concepts for procaryotes. Current Opinion in Microbiol 1: 271-277. Wartiainen I, Hestness AG, McDonald IR, MM Svenning. 2006. Methylocystis rosea sp. nov., a novel methanotrophic bacterium from Arctic wetland soil, Svalbard, Norway (78°C). Norway: Department of Biology, Faculty of Science, University of Tromsø Yuwono T. 2008. Biologi Molekular. Jakarta : Erlangga. LAMPIRAN 9 Lampiran 1 Hasil pewarnaan Gram isolat-isolat bakteri metanotrof BGM 1 (perbesaran 100x10) BGM 3 (perbesaran 100x10) SKM 14 (perbesaran 100x10) BGM 2 (perbesaran 100x10) BGM 9 (perbesaran 100x10) 10 Kontrol Pewarnaan Gram Bakteri Gram Positif Staphylococcus aureus Bakteri Gram Negatif Escherichia coli 11 Lampiran 2 Hasil sekuen gen 16S rRNA parsial dan BLAST-N isolat-isolat bakteri metanotrof A) Urutan nukleotida hasil sekuen gen 16S rRNA isolat BGM 1 GGCGGACGNGTGAGTAACNCGCTGNGAATCNACCGCNACCCTNCTNCAATAACGCCTGGAGA ACNTGTTGCTACTACCACNATACTCCCTCCTNNGGAAANATTNTTCGTCGGNATGATGAGCCC GCCGTTGNCATTATTCTNTTTGGNGGGGTNAAGGCCTNCCCCGGCGACAATCCNTATCTGGNC TNAGAGGATGATCNCCCACATTGNGACTGAGACACGGCCCNCACTCCNATACGAGGCNCCAC TGGGGAATATTGTNCAATGGGCGCAAGCCTGATCCACCCNTGCCCCGTGAGTGATGAAAGCC CTATGGTTGTNAAGCTCTTTCTCCNNTGAAAATAATGACGGTNTTCCNAGAAGAAACCCCNGN TATNTTNTNGCCNNCAGCCNCGGTAATACTAAANGGGGCTATCGTTGTTCTCAATTACTGNGC GTAAAGCGCNCGTANGCGNATATTTATTTCANGGGAGAAATCCCCCAGCTCATCTCTGGAACT GCCTTTGATACTGGGTATCTCTAGTATGGAAAAGGAGAGTGTAATTCCCAGTGTGTAGGTGAA ATTCTTCATATATTCTTCAGGAACACCNCTGGTGGAAGGCGCNTCACTGGGCCCTTACTGACA CTGAAGATGCTAAAACGNGGGGAGCAAACACGATTATATACCCTGGTGNNTCCCCNCCCCNA AACAATNAATGTTGATCCGTCGGGCAGCTTGCTGTTCGNNTGGCNCACCTANACATTNAACAT NCNCCCTGGGGAGTACCGCNCCCCNAATAAAACTCTCAGAANTNTCGNGGGNCCCCCCAACG GNGGAACATGTGNTTTNTTNTAAAAACNCGCAAAACNTTCACCTCTTTAATNNGCGGANGCNC ANAAAAAATTTTCTNCTTTCGNTGGNCCAAAANGGGGTNNNGGTTCCCCCCNCTGGGGGNAN GTGGGTTATCCCCCACANCCCCCCCCCCNTNTTCCCCATTTTTGGGCCNTAGGNAGGCGG B) Hasil BLAST-N sekuen gen 16S rRNA parsial dengan data GenBank isolat BGM 1 12 13 Lampiran 2 (Lanjutan) A) Urutan nukleotida hasil sekuen gen 16S rRNA isolat BGM 2 TGCTCCTTGATTCANCGGCGGACGGGTGANTANTGCCTAGGAATCTGCCTGGTAGTGGGGGAC AACGTTTCNAAAGGAACGCTAATACCGCATACGTCCTACGGGAGAAAGCAGGGGACCTTCGG GCCTTGCGCTATCAGATGAGCCTAGGTCGGATTAGCTAGTTGGTGAGGTAATGGCTCACCAAG GCNACGATCCGTAACTGGTCTGAGAGGATGATCAGTCACACTGGAACTGAGACACGGTCCAN ACTCCTACGGGGAGGCAGCAGTGGGGAATATTGGACAATGGGCGAAAGCCTGATCCAGCCAT GCCGCGTGTGTGAAGAAGGTCTTCNGATTGTAAAGCACTTTAAGTTGGGAGGAAGGGCAGTA AGTTAATACCTTGCTGTTTTGACGTTACCGACANAATAAGCACCGGCTAACTCTGTGCCAGCA GCCGCGGTAATACAGAGGGTGCAAGCGTTAATCGGAATTACTGGGCGTAAAGCGCGCGTAGG TGGTTCGTTAAGTTGGATGTGAAAGCCCCGGGCTCAACCTGGGAACTGCATCCAAAACTGGCG AGCTATAGTACGGTAGAGGGTGGTGGAATTTCCTGTGTAGCGGTGAAATGCNTAAATATAGN AAGGAACACCAGTGGCGAAGGCGACCACCTGGACTGATACTGACACTGAGGTGCGAAAGCGT GGGNAGCAAACAGGATTAAATACCCTGGTAGTCCNCNCCGTAAACNATGTCACTANCNGTTG GAATCCTTGAAATTTANTGGCNCAGCTAACGCATTAGTTNACCCCTGGGAGTACGGCCCCANG TTAAACTCAATGATTGACGGGGCCCCCNAACCGTGGACAGTGTTTATTCNAACACCNAAAACT TACAGCCTGACTGCAAAANTTCCAAAATGATGGNCCTNGGANNCNACNNGGCTCAGGTGCCC CCTTTNCNGAATNTNGNTANTCCTACANCCNCCTNN B) Hasil BLAST-N sekuen gen 16S rRNA parsial dengan data GenBank isolat BGM 2 14 15 Lampiran 2 (Lanjutan) A) Urutan nukleotida hasil sekuen gen 16S rRNA isolat BGM 3 GTGGCCGACGGGNGAATACNCGTGGNNCNCTACCTTTCTNNTTCGNAATNCTTCNGGGNNNCT TGTTACTACTACCGTGATNCCCCCTTCGGGNGAAATTATTTCTCCCCTGATATATCNCGCCCGC CNTCNGATTNTCTNTNTGGNGAGGTAANGGCTCACCAGNGACGACTCATCANTATNTGGTCTG AGGANGATGATCACCCACTTTGNNTCTGANACACGNCCCACTCTCCTACGGGGGGCANCNGN GGNNTAATATTGCACTNTGGGCGCGCCNCTGATCCACCCATGCCGCGNGTGNGATNAANNCC TTAGGNTTGNAANNCTCTTTTGTCCGNNGAANATAATGACTGTNCCGNAANAATANCCCCCGN NTANNTTCGTGCCANCACCCGCNNATATACAAAGGGGNCTAGCNTTGCTCAATAATCTCTGGG CNTAAAGGGCGCGTANGCANCACTCTTAAGTCGGGNGNGAAAGCCCAGGNCTCATCCCTNGA NTTGCCTTCNATACTGGATAGTCTTGTNCTTCGNAAGATGTTGGTNNCACCTGCGAGTGTAGA GNTGANNTTCGTAAATATTCACAACACCACCNGTGGNAGAAGGCGNCCNNGGTGNNCCTAAT ACNGACTCNGANGCGCAAAAGCGTGGAGCAGCAAACGANTATTATANCCCNTGNTACNCCNC NCCNTAAACGATNAATGCCNCCNGNTGGGNATTTTNCTCTTCAGNGGCGCATCTAACNCTTNA ATCCTCCCCCNGGGGAACACCNNCCCAANATNANACTCAAANGATTTGACGGGGCCCCCCAC AGCGGNGNANNNTGTNTTTNTTTAAAACACNCGNAAATCTNNCCCNTTTTNAATGGCGGANTT TCGNAAAAATTNTTNTNCNTNGNCTGCCCAANNNGGGTNGGTGGTTNCCCCCTCNGGGNGAA TGGNGAATACCCNAAAGACCCCCTCCCCTNTTNCTTTTNGGG B) Hasil BLAST-N sekuen gen 16S rRNA parsial dengan data GenBank isolat BGM 3 16 17 Lampiran 2 (Lanjutan) A) Urutan nukleotida hasil sekuen gen 16S rRNA isolat BGM 9 TGCTCCATGAATTCAGCGGCGGACGGGTGAGTAATGCCTAGGAATCTGCCTGGTAGTGGGGG ACAACGTTTCGAAAGGAACGCTAATACCGCATACGTCCTACGGGAACAAAGCAGGGGACCTT CGGGCCTTGCGCTATCAGATGAGCCTAGGTCGGATTAGCTAGTTGGTGGGGTAAAGGCCTACC AAGGCGACGATCCGTAACTGGTCTGAGAGGATGATCAGTCACACTGGAACTGAGACACGGTC CAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGGCGAAAGCCTGATCCAGCC ATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTTTAAGTTGGGAGGAAGGGCAG TAAGTTAATACCTTGCTGTTTTGACGTTACCAACAGAATAAGCACCGGCTAACTTCGTGCCAG CAGCCGCGGTAATACGAAGGGTGCAAGCGTTAATCGGAATTACTGGGCGTAAAGCGCGCGTA GGTGGTTTGGTAAGATGGATGTGAAATCCCCGGGCTCAACCTGGGAACTGCATCCATAACTGC CTGACTAGAGTACGGTAGAGGGTGGTGGAATTTCCTGTGTAGCGGTGAAATGCGTAGATATA GGAAGGAACACCAGTGGCGAAGGCGACCACCTGGACTGATACTGACACTGAGGTGCGAAAGC GTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCNCNCCGTAAACGATGTCNACTANCCG TTGGGATCCTTGAAATCTTAGTGGCNCANCTANCNCGATAAGTCNACCCCTGGGGAGTACGGC CCCAGGTTAAACTCAATGANTGACGGGGCCCCCCCAACGGNGGACATGTGNTTTATNCNAAC ACNCAAAANCTTNCTGGCTTGACTNTCCGNACNTNCAAA B) Hasil BLAST-N sekuen gen 16S rRNA parsial dengan data GenBank isolat BGM 9 18 19 Lampiran 2 (Lanjutan) A) Urutan nukleotida hasil sekuen gen 16S rRNA isolat SKM 14 GCTCCTTGNTTCGACNGCGCACTGGTNACTACNGCCTNTCTANTCTGCCTGGCAGGGNGGCTA CNACCTTTNACNNGGNACGCNCTTACCGCNTACATNTCTTACTCGGGAGAAAGNATGNGCAC CTTCTNGCCTTGCGCTATCGGANGAGCCNAGGNCNNCATTAGGCTAACTTATCCGANGNNGTG GCTGCACNAGANCATACAATCCGATTGCTGNCTCTNAACACGATGCATCAACTCACTCTGGGA ACTGAGCACACGGGTCNATANTCCNCCNNGGAGGCCGCGCCNGATCAATATTGTGNCAATGT GACGTAAATCCTGATCCTAGCCATNCCACGTGTCTTTAACAAGGTCTTCATGATTGNANAGCA CCTTTAAAATTNNGCNCNAAGGTACNTTCAGTTNCATACCTTGCTGTTTTGACGATTGCCGGA CTAGAATNNGCNCCGNNTNACTNTGTGCCAACNGCCCCNNTAATACAANTNNNGNNAGNGTT NATCTCCAATTACTNNNNCTCAGGNNCTGCCTATTGTNNANTCGTTACCTTGGATGTGAAAGC NCCNGNCTCAACNTNCGAANTGCATCCTNAACTGNCTAGNTATTCTANGGAACANCGGTGGT GNAATTTCCTNTNTNGCGCCTTNACTGCCTNTATATATGCAAAGACCACNAGTNGCAANNGGA ATCACNTGCCCTGATACTCACCCTGAAGTGCNAAAACGTGNGCNGCCAACAGGATTACATAN CCTGGNAGNCCCTNCGTANAAANGTCNCTCCCGGTNAACCNTNGAAATTTAANGNCCAGTAA TGCTNAGTCCCCCCTGGGGNAACNNCGNNTTTNNANTCAATGANTAACGTGCCCCCTGCGGG GACANGGATTAATCAANNTCCTNAAACTTCGAGCCTGAAN B) Hasil BLAST-N sekuen gen 16S rRNA parsial dengan data GenBank isolat SKM 14 20 Lampiran 3 Hasil analisis bioinformatika menggunakan program BLAST-N pada situs NCBI A) Hasil BLAST-N isolat BGM 1 B) Hasil BLAST-N isolat BGM 2 C) Hasil BLAST-N isolat BGM 3 D) Hasil BLAST-N isolat BGM 9 21 E) Hasil BLAST-N isolat SKM 14 22 23 24