1h nmr spectroscopy - Direktori File UPI
advertisement

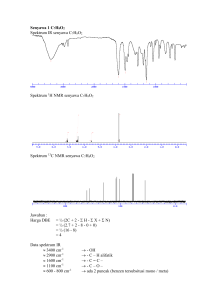
NMR 1H NMR SPECTROSCOPY NMR Informasi dari spektrum H NMR integral 4 Br OCH2CH3 2 3 multiplisitas konstanta kopling standar TMS geseran kimia kel. H = jumlah jenis proton ppm NMR Jumlah sinyal proton O CH2 C CH3 •Setiap tipe proton yang berbeda akan muncul pada tempat berbeda •Anda dapat menentukan ada berapa tipe H dalam molekul •Tipe proton = proton dengan lingkungan kimianya NMR Integrasi Puncak Integrasi = proses yang menunjukkan jumlah relatif H Menghitung luas area dibawah puncak METHOD 1 integral line integral line 55 : 22 : 33 = 5:2:3 perbandingan sederhana dari tinggi garis integral Integrasi Puncak NMR Actually : 58.117 / 11.3 = 5.14 5 2 21.215 / 11.3 = 1.90 3 33.929 / 11.3 = 3.00 O CH 2 O C CH 3 METHOD 2 digital integration asumsi : CH3 33.929 / 3 = 11.3 NMR GESERAN KIMIA NMR Geseran Kimia (δ, ppm) Bagaimana proton dapat muncul di tempat (geseran kimia, δ) yang berbeda? Lingkungan kimia proton yang berbeda CH3 O CH3 C C O C H 2C H 2 O C C H 3 CH3 CH3 + O C H 3C H 2C H 2 N O- C l C H 2C H 2C H 2 C l O O C H 3C H 2 O C C H 2C H 2 C O C H 2C H 3 NMR Diamagnetic Anisotropy Perlindungan oleh elektron valensi garis medan magnet Medan magnet yang di aplikasikan (Bo) menginduksi sirkulasi elektron valensi Menghasilkan medan magnet yang melawan medan magnet yang diaplikasikan Bo applied B induced (opposes Bo) fields subtract at nucleus elektron valensi melindungi (shielding/ memerisai) inti dari efek bidang magnet yang diaplikasikan NMR Efek Perisai Pada Proton Jumlah efek perisai dari elektron valensi berbeda pada setiap tipe proton dalam molekul Proton muncul pada tempat yang berbeda dalam spektrum (dapat diprediksi) DOWNFIELD Kurang terperisai H muncul disini SPECTRUM UPFIELD Sangat terperisai H muncul disini Membutuhkan medan magnet yang lebih tinggi utk resonansi NMR Puncak diukur relatif terhadap TMS Puncak diukur tidak berdasarkan posisi resonansi, tetapi diukur seberapa jauh bergeser dari TMS. Senyawa referensi tetramethylsilane “TMS” CH3 CH3 Si CH3 CH3 Memiliki proton yang sangat terlindungi (muncul pada daerah upfield) TMS shift in Hz downfield n 0 Pada awalnya ahli kimia berfikir tidak ada senyawa yang akan muncul pada area lebih tinggi dari TMS NMR Kuat Medan Magnet Alat Kuat medan frekuensi γ hν = B 2π o konstanta ν = ( K) Bo Medan magnet yang kuat (Bo) menyebabkan instrumen harus beroperasi pada frekuensi yang lebih tinggi (ν) NMR Field Strength 1H Operating Frequency 60 Mhz 1.41 T 2.35 T 100 MHz 7.05 T 300 MHz NMR Pengaruh Frekuensi Alat •Frekuensi yang lebih tinggi memberikan geseran yang lebih besar •Geseran proton tergantung pada frekuensi alat yang digunakan (muncul perbedaan geseran untuk proton yang sama tetapi diukur pada alat yang berbeda) Frekuensi lebih besar = geseran lebih besar (Hz). TMS shift in Hz downfield n 0 NMR Pengaruh Frekuensi Alat Menyesuaikan geseran pada nilai yang tidak tergantung pada alat geseran kimia parts per million chemical shift = δ = shift in Hz spectrometer frequency in MHz = ppm Setiap proton tertentu dalam molekul akan selalu muncul pada geseran kimia yang sama (nilai konstan) NMR Apakah yang direpresentasikan ppm? Operating Frequency 60 Mhz 100 Hz 300 MHz 300 Hz 6 5 4 3 1 ( 106 ) n MHz 60 Hz 100 MHz 7 1 part per million of n MHz is n Hz Hz Equivalent of 1 ppm 1H 2 1 0 = n Hz ppm Each ppm unit represents either a 1 ppm change in Bo (magnetic field strength, Tesla) or a 1 ppm change in the precessional frequency (MHz). NMR NMR Correlation Chart -OH -NH DOWNFIELD DESHIELDED UPFIELD SHIELDED CHCl3 , H TMS 12 RCOOH 11 10 9 RCHO 8 7 6 H C=C 5 4 CH2F CH2Cl CH2Br CH2I CH2O CH2NO2 3 2 1 0 CH2Ar C-CH-C CH2NR2 C CH2S C-CH2-C C C-H C=C-CH2 C-CH3 CH2-CO δ (ppm) NMR Prediksi Geseran Kimia R-CH3 R-CH2-R R3CH 0.7 - 1.3 1.2 - 1.4 1.4 - 1.7 R-C=C-C-H O 1.6 - 2.6 R-C-C-H O 2.1 - 2.4 RO-C-C-H O 2.1 - 2.5 HO-C-C-H 2.1 - 2.5 N C-C-H 2.1 - 3.0 R-C C-C-H 2.1 - 3.0 C-H R-C C-H R-N-C-H 2.2 - 2.9 R-S-C-H 2.0 - 3.0 I-C-H 2.0 - 4.0 Br-C-H 2.7 - 4.1 Cl-C-H 3.1 - 4.1 RO-C-H 3.2 - 3.8 HO-C-H 3.2 - 3.8 O R-C-O-C-H 3.5 - 4.8 O2N-C-H 4.1 - 4.3 F-C-H 4.2 - 4.8 R-C=C-H 4.5 - 6.5 H 6.5 - 8.0 O R-C-N-H 5.0 - 9.0 O R-C-H 9.0 - 10.0 O R-C-O-H 11.0 - 12.0 2.3 - 2.7 R-N-H 0.5 - 4.0 Ar-N-H 3.0 - 5.0 R-S-H 1.7 - 2.7 R-O-H 0.5 - 5.0 Ar-O-H 4.0 - 7.0 1.0 - 4.0 Prediksi Geseran Kimia NMR Tidak perlu menghafal secara detail geseran masing-masing tipe proton asam COOH aldehid CHO benzen CH alkena =C-H C-H dimana C terikat pada atom elektronegatif X-C-H 12 10 9 7 6 4 CH dimana C sebelah aliphatik ikatan C-H pi bonds X=C-C-H 3 2 0 NMR FAKTOR-FAKTOR YANG MEMPENGARUHI GESERAN KIMIA NMR Faktor yang mempengaruhi δ Tiga faktor utama yang menjelaskan kebanyakan posisi resonansi proton (dalam skala ppm) : 1. Deshielding oleh unsur elektronegatif 2. Bidang anisotropi pada molekul dengan elektron ikatan pi 3. Deshielding karena ikatan hidrogen NMR Deshielding oleh unsur elektronegatif δ- Cl δ+ C H δ- δ+ Unsur elektronegatif •Klor menarik kerapatan elektron menjauh dari karbon yang juga mengimbas kerapatan elektron disekitar proton. •Unsur klor menyebabkan proton tidak terperisai ( “deshields”) NMR CHART Proton yang tidak terperisai(deshielding) protons muncul pada low field semakin deshielding Proton yang terperisai (shielding)akan muncul pada high field NMR Deshielding oleh unsur elektronegatif Ketergantungan geseran kimia CH3X pada unsur X Senyawa CH3X CH3F CH3OH CH3Cl Unsur X F Keelektronegatifan X Geseran Kimia δ Paling tidak terperisai CH3Br CH3I CH4 (CH3)4Si O Cl Br I H Si 4.0 3.5 3.1 2.8 2.5 2.1 1.8 4.26 3.40 3.05 2.68 2.16 0.23 0 TMS deshielding meningkat sejalan dengan peningkatan keelektronegatifan atom X NMR Deshielding oleh unsur elektronegatif Pengaruh “deshielding” bertambah dengan meningkatnya jumlah atom elektronegatif most deshielded CHCl3 CH2Cl2 CH3Cl 7.27 5.30 3.05 ppm Pengaruh “deshielding” berkurang dengan bertambahnya jarak proton terhadap atom elektronegatif most deshielded -CH2-Br 3.30 -CH2-CH2Br 1.69 -CH2-CH2CH2Br 1.25 ppm Bidang Anisotropic NMR •Bidang anisotropic timbul karena kehadiran ikatan pi •Kehadiran ikatan pi (ikatan rangkap) atau sistem pi akan mempengaruhi geseran kimia dari proton yang dekat. •Efek ini dapat terjadi pada alkena, alkuna, dan paling besar pada cincin benzen. asam COOH aldehid CHO benzen CH alkena =C-H C-H dimana C terikat pada atom elektronegatif X-C-H 12 10 9 7 6 4 CH dimana C sebelah aliphatik ikatan C-H pi bonds X=C-C-H 3 2 0 Bidang Anisotropic NMR Contoh : pada cincin benzen Circulating π electrons H Bo H Deshielded fields add together Secondary magnetic field generated by circulating π electrons deshields aromatic protons NMR Bidang Anisotropic •Contoh : pada senyawa alkena protons are deshielded Deshielded H fields add H digeser ke downfield C=C H Bo H secondary magnetic (anisotropic) field lines NMR Bidang Anisotropic Contoh : pada senyawa alkuna H C C H Bo Shielded fields subtract hydrogens are shielded secondary magnetic (anisotropic) field NMR Ikatan Hidrogen R O H H O R H O R Geseran kimia tergantung pada berapa banyak ikatan hidrogen yang dapat terjadi Alkohol memiliki geseran kimia yang sangat bervariasi mulai dari 0.5 ppm (free OH) sampai 5.0 ppm (banyak ikatan hidrogen). Ukuran panjang ikatan hidrogen mereduksi kerapatan elektron disekitar proton (lebih deshielding) NMR Ikatan Hidrogen O H O C R R C O H O Asam karboksilat membentuk ikatan hidrogen yang kuat – mereka membentuk dimer Proton dari –O-H akan muncul pada geseran kimia antara 10 and 12 ppm. H3C O O H O Dalam metil salisilat, yang memiliki iakatan hidrogen internal, proton –O-H akan muncul pada daerah sekitar 14 ppm, NMR PEMECAHAN PUNCAK SPEKTRUM (SPLITTING) NMR SPIN-SPIN SPLITTING •Sering kali puncak spektrum sekelompok atom hidrogen akan muncul sebagai multiplet dibandingkan singlet. •Pemecahan puncak spektrum (spin-spin splitting) atom H terjadi karena interaksi dengan atom hidrogen tetangga (coupling). Singlet Doublet Triplet Quartet Quintet Septet Octet Nonet NMR Contoh spektrum integral = 2 Cl H H C C Cl integral = 1 triplet Cl H doublet Pemecahan puncak spektrum dapat diprediksi NMR PREDIKSI PEMECAHAN SPEKTRUM Puncak hidrogen ini di split oleh dua atom H tetangga Puncak hidrogen ini di split oleh satu atom H tetangga H H H H C C C C H triplet H doublet NMR ATURAN N+1 H H H H C C C C H 2 atom H tetangga n+1 = 3 triplet H 1 atom tetangga n+1 = 2 doublet MULTIPLETS singlet doublet triplet quartet quintet sextet septet NMR 1) PENGECUALIAN ATURAN N+1 Proton yang ekivalen karena efek simetris biasanya tidak saling spliting satu sama lain X CH2 CH2 Y X CH CH Y no splitting if x=y 2) no splitting if x=y Proton dalam grup yang sama (terikat pada C yang sama) biasanya tidak saling splitting satu sama lain H C H H H or C H NMR 3) PENGECUALIAN ATURAN N+1 Aturan N+1 diaplikasikan terhadap proton dalam rantai alifatik (jenuh) atau siklik jenuh. CH2CH2CH2CH2CH3 or CH3 H YES YES Tetapi tidak diaplikasikan pada proton senyawa ikatan rangkap atau benzen. H CH3 H H CH3 NO NO NMR Beberapa pola splitting umum X CH CH Y CH3 CH (x=y) CH2 CH X CH2 CH2 Y (x=y) CH3 CH2 CH3 CH CH3 NMR CONTOH SPLITTING Br CH2CH3 NMR CONTOH SPLITTING H CH3 C CH3 + N O O- NMR CONTOH SPLITTING O CH3 C offset = 2.0 ppm H NMR KONSTANTA KOPLING J H H C C H J J H H J J J Konstanta kopling merupakan jarak antar puncak dalam multiplet (J diukur dalam Hz). J diukur dari jumlah interaksi antara dua set hidrogen yang menghasilkan multiplet. NMR KONSTANTA KOPLING 200 Hz Konstanta kopling bernilai konstan, tidak berubah karena perbedaan frekuensi alat 6 200 MHz 5 Pemisahan lebih besar Geseran tergantung pada kekuatan medan magnet 3 100 Hz 100 MHz 7.5 Hz J = 7.5 Hz 4 3 400 Hz 2 1 200 Hz 7.5 Hz J = 7.5 Hz 2 1 ppm NMR 50 MHz J = 7.5 Hz Why buy a higher field instrument? 3 Spectra are simplified! Overlapping multiplets are separated. 2 1 2 1 2 1 100 MHz J = 7.5 Hz 3 200 MHz Second-order effects are minimized. J = 7.5 Hz 3 NMR NOTASI KONSTANTA KOPLING 1. Tipe kopling yang paling banyak ditemukan adalah antara hidrogen pada atom C bersebelahan. 3J H H C C Disebut sebagai kopling vicinal . Dilambangkan 3J, karena antara dua atom H terpisah oleh 3 ikatan. 2. Tipe lain dapat terjadi pada kasus khusus. H C H 2J 2J 0) kopling geminal (kebanyakan berharga Kopling geminal tidak terjadi ketika dua atom H ekuivalen karena adanya rotasi ikatan (ikatan sigma). NMR NOTASI KONSTANTA KOPLING 3. Terdapat kopling yang lebih jauh dari 2J or 3J, tetapi hanya terjadi pada kasus khusus. 4J H C C C H , sebagai contoh, terutama ketika hidrogen dipaksa untuk mempunyai bentuk konformasi “W”(biasanya dalam senyawa bisiklik) Kopling yang lebih jauh dari 3J (e.g., 4J, 5J, etc) biasanya disebut “long-range coupling.” NMR HARGA KONSTANTA KOPLING H H vicinal C C H C C trans H H cis H C C H C geminal H 3 ikatan 11 to 18 Hz 3 ikatan 6 to 15 Hz 3 ikatan 0 to 5 Hz 2 ikatan 3J 3J 3J 2J Ha,Ha = 8 to 14 Hax Heq Heq 6 to 8 Hz Hax Ha,He = 0 to 7 He,He = 0 to 5 3 ikatan 3J NMR HARGA KONSTANTA KOPLING H H cis 6 to 12 Hz trans 4 to 8 Hz H C C H H C C 3 ikatan 4 to 10 Hz 3 ikatan 0 to 3 Hz 4 ikatan 0 to 3 Hz 4 ikatan 3J 3J 4J C H H C C C 4J H long-range couplings biasanya kecil (<3 Hz) dan lebih sering tidak terjadi (0 Hz). NMR CINCIN BENZEN NMR HIDROGEN PADA CINCIN BENZEN Kehadiran cincin menyebabkan proton yang terikat pada cincin muncul pada geseran kimia 7-8 ppm. Circulating π electrons H Bo H Deshielded Secondary magnetic field generated by circulating π electrons deshields aromatic protons NMR CINCIN BENZEN : Monosubtitusi 1.Subtituen alkil (-R) R R = alkil (only) •Seluruh atom H akan muncul pada tempat yang sama pada spektrum NMR •Arus cincin menyetarakan kerapatan elektron pada seluruh C dan H dari cincin NMR CINCIN BENZEN : Monosubtitusi 5 CH3 3 NMR CINCIN BENZEN : Monosubtitusi 2. Subtituen dengan keberadaan PEB .. X unshared pair .. .. X = .. OH, .. OR, NH2, NR2, .... .. -O(CO)CH .. 3 ester Subtituen dgn kehadiran unsur elektronegatif yg memiliki PEB (gugus pendorong elektron) memerisai H (shielding) pada posisi –o atau –p karena efek resonansi dan memisahkan H kedalam dua group. .. :O R + :O R + :O :- + :O R : .. - R NMR CINCIN BENZEN : Monosubtitusi Anisole (400 MHz) O CH3 Compare: CH3 The ring protons in toluene come at about 7.2 ppm at the red line. 2 shielded 3 NMR CINCIN BENZEN : Monosubtitusi 3. Subtituen Karbonil O H C R R H H C O H •Keberadaan gugus karbonil menyebabkan H pada posisi –o atau -p pada cincin benzen tidak terperisai oleh bidang anisotropik dari ikatan pi pada C=O. •Posisi –o mendapat pengaruh paling besar. •Efek yang sama terkadang dapat terjadi pada ikatan C=C NMR CINCIN BENZEN : Monosubtitusi Acetophenone (90 MHz) O C H CH3 H 3 Compare: CH3 The ring protons in toluene come at about 7.2 ppm at the red line. 2 deshielded 3 NMR CINCIN BENZEN : Disubtitusi X X X Y Y Y •Keberadaan dua subtituen akan mempengaruhi jumlah sinyal, geseran kimia, pola spillting, dan konstanta kopling. •Waspadai adanya efek simetris dari subtituen NMR CINCIN BENZEN : Disubtitusi para X Y 1,4-disubtitusi benzen akan memperlihatkan sepasang doublet (jika X = Y, X sangat berbeda dengan Y) NMR CINCIN BENZEN : Disubtitusi para 3 OCH3 I CHCl3 impurity 2 2 NMR CINCIN BENZEN : Disubtitusi para Br OCH2CH3 4 2 3 NMR CINCIN BENZEN : Disubtitusi para Untuk kasus dua subtituen yang mendekati sama Seluruh puncak bergerak mendekat Puncak lebih luar akan mengecil …………………..… dan akhirnya menghilang. Puncak lebih dalam memanjang …………………………. dan akhirnya bergabung X X Y X' X=Y X ~ X’ X X seluruh H ekuivalen X=X gugus sama NMR CINCIN BENZEN : Disubtitusi para 4 H2N OCH2CH3 2 2 3 NMR CINCIN BENZEN : Disubtitusi para 6 CH3 4 CH3 NMR PROTON HIDROKSIL DAN AMINO R O H R N H H R C O O H •Proton hidroksil dan amino dapat muncul hampir disemua geseran dalam spektrum (ikatan hidrogen). •Absorpsinya biasanya melebar dibandingkan puncak proton yang lain dan sering kali dapat diedentifikasi karena fakta ini. •Proton dari asam karboksilat secara umum muncul pada medan rendah sekitar 11-12 ppm. NMR PROTON HIDROKSIL DAN AMINO CH3CH2 OH 3 2 1 NMR PROTON HIDROKSIL DAN AMINO Penghilangan kopling spin melalui pertukaran C O H H •Dalam alkohol antara hidrogen -O-H hydrogen dan H yang terikat pada C tetangganya biasanya tidak terlihat. •Hal ini terjadi karena perubahan cepat dari hidrogen –OH antara berbagai molekul alkohol dalam larutan. •Dalam alkohol yang sangat murni terkadang kopling ini dapat terlihat R-O-Ha + R’-O-Hb R-O-Hb + R’-O-Ha Pertukaran terjadi sangat cepat sehingga gugus –C-H “sees” dengan banyak hidrogen –OH selama spektrum diukur (rata-rata spin = 0). NMR PROTON HIDROKSIL DAN AMINO COOH 1 O CH3 CH C OH Cl ~12 ppm offset = 4.00 ppm 1 3
![NMR H [Compatibility Mode]](http://s1.studylibid.com/store/data/000907036_1-9c75f1555d3843b7e71c8eeb3e83f039-300x300.png)